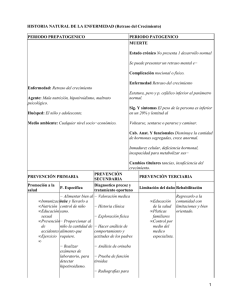
ENFERMEDAD DE LESCH-NYHAN: Clínica de la deficiencia de
Anuncio

ENFERMEDAD DE LESCH-NYHAN: Clínica de la deficiencia de HPRT en una serie de 42 pacientes 1. INTRODUCCIÓN 1.1. Hipoxantina-Guanina Fosforribosil-Transferasa Las purinas son compuestos esenciales para la síntesis de ácidos nucleicos. Las bases purínicas adenina y guanina se unen a una pentosa y forman un nucleósido que, tras la adición de un residuo fosfórico, origina un nucleótido1. En el metabolismo de las purinas están implicadas múltiples enzimas, entre las que se encuentra la hipoxantina-guanina fosforribosil-transferasa (HPRT), que tiene un papel fundamental en la regulación de la síntesis de ácido úrico. La reacción que la HPRT cataliza tiene como objetivo la síntesis de nucleótidos purínicos (inosina monofosfato y guanosina monofosfato) mediante la reutilización de las bases purínicas hipoxantina y guanina. En este proceso se utiliza el fosforribosilpirofosfato (PRPP) como un cosustrato y fuente de energía2. Esta reutilización de las bases purínicas ahorra mucha energía en el proceso de síntesis de nucleótidos ya que utiliza sólo un mol de adenosina trifosfato (ATP) por mol de nucleótido en comparación con los seis moles necesarios para la síntesis de novo de los nucleótidos. 1.2. Síndrome de Lesch-Nyhan En 1964, M. Lesch y W. Nyhan describieron los casos de dos hermanos con un cuadro clínico peculiar. Este síndrome estaba caracterizado por hiperuricemia, hiperuricosuria y disfunciones neurológicas severas tales como coreoatetosis, retraso mental y comportamiento automutilante3. Posteriormente, en 1967, JE. Seegmiller y cols establecieron que la causa del ya mencionado síndrome era el déficit completo de la actividad de la enzima HPRT4. Prevalencia La prevalencia del síndrome de Lesch-Nyhan se estima en torno al 1 por cada 280 000 recién nacidos vivos (RNV) en Canadá. En España, la prevalencia del déficit de HPRT se estima en 1 de cada 235 000 RNV. En Reino Unido, la prevalencia está en 1 de cada 2 millones con una tasa de incidencia de 0,18 por cada 100 000 RNV5. Variantes No todos los pacientes con deficiencia de HPRT presentan con la misma intensidad los síntomas neurológicos, y algunos sólo sufren los síntomas correspondientes a la sobreproducción de ácido úrico, nefrolitiasis y gota6. Estos fenómenos de atenuación fenotípica (que se han denominado “variantes atenuadas de Lesch-Nyhan”)6, se producen debido al menor grado de deficiencia enzimática (deficiencia parcial), aunque pueden aparecer con actividad enzimática HPRT indetectable por los métodos convencionales7. Base Genética La HPRT humana está codificada en un único gen (HPRT1) que abarca cerca de 45kb del brazo largo del cromosoma X en la región Xq26. Está integrado por nueve exones con una secuencia codificante de 654pb. Su deficiencia tiene una herencia de carácter recesivo ligada al cromosoma X, de tal forma que normalmente los afectados son varones mientras que las mujeres son portadoras asintomáticas (a pesar de que se hayan descrito cinco mujeres con el síndrome de Lesch-Nyhan)5. Las mutaciones del gen HPRT1 responsables del síndrome son muy heterogéneas en cuanto al tipo de mutación y localización. De entre las más de 600 mutaciones relacionadas con la patología se han descrito desde delecciones e inserciones, hasta duplicaciones y mutaciones puntuales8. Sin embargo, estas últimas se han relacionado con más frecuencia con el déficit parcial de HPRT, mientras que las mutaciones que provocan el síndrome de Lesch-Nyhan clásico suelen ser mutaciones que dan lugar a la ausencia completa de la actividad enzimática. Se han descrito algunos casos con región codificante del gen HPRT1 normal y una expresión reducida del ARNm, por causas aún desconocidas9. Objetivo Desde el año 1984, se han diagnosticado en la Unidad Metabólico Vascular (UMV) del Hospital Universitario La Paz 42 pacientes con deficiencia de HPRT. Esta serie es la más numerosa de enfermos con deficiencia de HPRT diagnosticados en un único centro hospitalario. El propósito de este estudio es ofrecer las características clínicas, bioquímicas, enzimáticas y moleculares de estos pacientes para conocer el espectro clínico de la deficiencia de HPRT. 2. PACIENTES Y MÉTODOS 2.1. Pacientes Se han estudiado, en el Hospital Universitario La Paz (Madrid, España), un total de 42 pacientes pertenecientes a 35 familias distintas con deficiencia total o parcial del enzima HPRT. Todos los pacientes eran varones, y el rango de edad en la primera visita a la consulta oscilaba entre 16 días hasta 35 años. 2.2. Criterios Diagnóstico El déficit de HPRT se sospechó ante la presencia de síntomas y signos característicos del síndrome, así como resultados bioquímicos indicativos de una sobreproducción de purinas. El diagnóstico se alcanzó mediante la detección de reducción de la actividad de HPRT en hemolisados, con un incremento simultáneo en la actividad de la adenina fosforribosiltransferasa (APRT). 2.3. Determinaciones bioquímicas: metabolismo de purinas El metabolismo de las purinas fue examinado mediante la determinación de las concentraciones en plasma de ácido úrico, xantina e hipoxantina, y con su excreción en orina de 24 horas, en los casos en que fue posible su obtención, o mediante la determinación del cociente úrico/creatinina en una muestra aleatoria de orina. Los niveles en plasma y orina de xantina e hipoxantina se determinaron mediante cromatografía de alto rendimiento (HPLC). En aquellos casos en que fue posible, el metabolismo de las purinas fue examinado una vez fueron suspendidos todos los fármacos que pudiesen influenciar sobre él. Se pautó colchicina (0.5mg al día) como profilaxis de la artritis aguda en aquellos pacientes con antecedentes de gota. Antes de las pruebas, los pacientes siguieron durante 7 días una dieta isocalórica de mantenimiento con restricción de purinas (menos de 75mg al día) y con un contenido de proteínas del 10-15%. 2.4. Determinaciones enzimáticas La actividad de las enzimas HPRT y APRT en hemolisado se determinó con HPLC. Para evaluar la posibilidad de cierta actividad residual, se determinó la actividad HPRT en eritrocito intacto. Para ello, los eritrocitos obtenidos de sangre venosa se incubaron durante 40 minutos, y a 37°C, en 10mM HEPES, 125 mM NaCl, 2,6 mM KCl, 5,5mM glucosa, 1mM CaCl2, 50mM MgCl2, 18mM NaH2PO4 y 10 μM [14C] hipoxantina. Tras el tiempo de incubación, el IMP radiactivo se separó de la hipoxantina por HPLC, y se midió la radioactividad en el pico de IMP. Además, la actividad de HPRT se expresó como el porcentaje de [14C] hipoxantina transformada en [14C] IMP (valores normales: 98-100%) para caracterizar mejor el déficit enzimático. 2.5. Análisis Molecular El diagnóstico molecular del déficit de HPRT es importante porque permite un diagnóstico prenatal más rápido y preciso, así como determinar la condición de portadora en las mujeres de la familia. Este diagnóstico requiere el análisis en cada paciente de la región codificante del gen HPRT1 a partir del ARN del paciente y mediante RT-PCR, o, en los casos en que el gen HPRT1 no se expresa o no es posible obtener ARN mensajero (ARNm), la amplificación y secuenciación de los nueve exones del gen HPRT1 con las secuencias intrónicas flanqueantes para encontrar la mutación. En algunos casos, la región codificante de HPRT1 es normal y, sin embargo, los pacientes presentan niveles reducidos de ARNm de HPRT1 con disminución o ausencia de actividad enzimática de origen desconocido. En nuestra experiencia, alrededor de un 80% de las madres son portadoras, con lo que sólo un 20% de los pacientes tienen una mutación de novo. 3. RESULTADOS 3.1. Características Clínicas Generalidades Los pacientes fueron clasificados en dos categorías según la clínica que presentaron: 1) “Enfermedad de Lesch-Nyhan clásico” y 2) “Variantes atenuadas de Lesch-Nyhan”. La clínica de los pacientes con el síndrome clásico quedó definida por distonía severa generalizada, conducta autolesiva (siendo característica la automutilante), movimientos involuntarios como balismo o coreoatetosis, y alteraciones cognitivas (Figura 1). Los pacientes con alguna de las variantes, o bien no tenían clínica neurológica, o bien ésta era moderada-severa (sin presentar conducta automutilante). Además, algunos de estos pacientes podían llevar a cabo actividades cotidianas vitales que los enfermos con la enfermedad de Lesch-Nyhan no podían. En aquellos pacientes que por su temprana edad no presentaban la clínica típica de la enfermedad de LeschNyhan pero cuya mutación del gen HPRT1 era sugestiva del diagnóstico, fueron diagnosticados de enfermedad de Lesch-Nyhan. Figura 1. Manifestaciones clínicas y repercusiones de la Enfermedad de Lesch-Nyhan (grado 4). Las variantes atenuadas se clasificaron, según la clínica, en tres grados: 1) clínica de sobreproducción y sobreexcreción de purinas (hiperuricemia e hiperuricosuria), con exploración neurológica aparentemente normal, 2) distonía aparente sin privación de la realización de actividades básicas de la vida diaria, y 3) clínica neurológica severa, muy similar a la de la enfermedad de Lesch-Nyhan (con la excepción de ausencia de conducta autolesiva). La enfermedad de Lesch-Nyhan se consideró como grado 4 (Tabla 1). CLÍNICA Enfermedad de Lesch-Nyhan Distonía severa generalizada, autolesión, movimientos involuntarios, alteraciones cognitivas. Variantes Atenuadas de Lesch-Nyhan Distonía severa generalizada, movimientos involuntarios, alteraciones cognitivas. Distonía aparente, capacidad para realizar actividades básicas de la vida Hiperuricemia, hiperuricosuria, exploración neurológica aparentemente normal Tabla 1. Categorías establecidas según la clínica de los pacientes con deficiencia de HPRT. GRADO 4 3 2 1 Enfermedad de Lesch-Nyhan Un total de 27 pacientes, cuyas edades al diagnóstico oscilaban entre 16 días y los 31 años, fueron incluidos dentro de la categoría de Enfermedad de Lesch-Nyhan clásico. Debido a la gran diferencia de edad entre los sujetos, la clínica que presentaron en su primera visita a la consulta fue muy variable. En su primera consulta, un total de 10 pacientes (todos mayores de 3 años) ya presentaban las características típicas de la enfermedad de Lesch-Nyhan, incluyendo conducta automutilante (Pacientes 1,3,4,5,6,7,8,12,15,20). Estos pacientes eran extremadamente dependientes para realizar las actividades básicas de la vida diaria y eran incapaces de andar. Aquellos pacientes menores de tres años de edad, presentaron como manifestación neurológica más precoz, un retraso en el desarrollo psicomotor e hipotonía. En algunos casos habían sido diagnosticados de parálisis cerebral distónica o tetraparesia distónica. A uno de los pacientes (Tabla 2, Paciente 11) inicialmente diagnosticado de enfermedad de Lesch-Nyhan finalmente se le clasificó como grado 3 de variante atenuada debido a que en su evolución no presentó conducta autolesiva. El resto de pacientes permanecieron en la clasificación inicial debido al desarrollo de dicha conducta. Variantes Atenuadas A quince pacientes inicialmente se les atribuyó como diagnóstico alguna de las variantes atenuadas del síndrome. El diagnóstico tan solo se modificó en uno de los pacientes (Tabla 3, Paciente 34) al que inicialmente se le había atribuido un grado 2 que, finalmente, progresó a 3 debido al desarrollo de distonía severa generalizada y coreatetosis (ausentes en su primera consulta). Por ausencia de comportamiento autolesivo, se incluyó en la categoría 3 de variables atenuadas del síndrome a un paciente inicialmente diagnosticado de enfermedad de LeschNyhan. 3.2. Características Bioquímicas En todos los pacientes con déficit de HPRT se detectó una sobreproducción de purinas. En comparación a individuos control, tanto los pacientes con Síndrome de Lesch-Nyhan clásico como los que padecen alguna de sus variantes, mostraron tener unas concentraciones significativamente elevadas en plasma de urato, hipoxantina y xantina. Consecuente con este hallazgo, la excreción urinaria de ácido úrico, hipoxantina y xantina también estaba elevada en todos los individuos enfermos, sin diferencias destacables entre los que padecen el síndrome clásico o alguna de sus variantes. 3.3. Estudio Enzimático Todos los pacientes estudiados mostraron niveles indetectables o disminuidos de la actividad de la HPRT en los hemolisados. Fenotipo Lesch-Nyhan Ninguno de los pacientes con el síndrome de Lesch-Nyhan clásico (déficit total de HPRT) mostró niveles detectables de HPRT en los hemolisados (HPRT <0.01nmol/h/mg hemoglobina). La actividad media de la APRT en hemolisados fue significativamente mayor en comparación a los pacientes control. Variantes Atenuadas La gran mayoría de pacientes con variantes atenuadas del síndrome mostró niveles indetectables de HPRT en hemolisados. La actividad media de la APRT en hemolisados fue significativamente mayor en comparación a los pacientes control. 3.4. Estudios Moleculares Se encontraron un total de 27 mutaciones distintas en las 35 familias analizadas. No se pudo obtener información de cinco de las familias a estudio. Fenotipo Lesch-Nyhan En los pacientes con enfermedad de Lesch-Nyhan las mutaciones encontradas incluyeron 7 mutaciones puntuales (2 missense, 1 nonsense y 3 de splicing), 5 delecciones de una o dos bases, 6 delecciones de más de dos bases y 4 duplicaciones de 1 o 2 bases. Variantes Atenuadas En los pacientes con variantes atenuadas se encontraron 9 mutaciones puntuales (8 missense y 1 de splicing). 4. DISCUSIÓN Podría concluirse que la deficiencia de HPRT tiene un amplio espectro de potenciales manifestaciones clínicas de distintos grados de severidad. A pesar de esta gran variedad de síntomas, todos los enfermos – sea cual sea el déficit de la actividad de HPRT – presentan sobreproducción de ácido úrico con las consecuentes manifestaciones clínicas. Estas manifestaciones son la hiperuricemia, hiperuricosuria y la litiasis de ácido úrico, que normalmente son los motivos de la primera consulta en el caso de los pacientes con alguna de las variantes atenuadas más leves de la enfermedad. La artritis gotosa suele darse en casos más evolucionados con un mal control de la hiperuricemia. Debido a esta homogeneidad en la sobreproducción de ácido úrico presentada en todos los sujetos, se podría concluir que la severidad clínica del déficit de HPRT está determinada por las manifestaciones neurológicas de la enfermedad. Con experiencias clínicas como las de este estudio se comprueba cómo las manifestaciones neurológicas de la enfermedad, además de que difieren entre pacientes diagnosticados de “Síndrome de Lesch-Nyhan clásico” y de “variantes atenuadas del síndrome” (siendo, por lo general, más leves en estos últimos), van apareciendo de forma progresiva. En el caso de los diagnósticos tempranos del síndrome de Lesch-Nyhan clásico, la manifestación neurológica más precoz fue el retraso en el desarrollo motor. Este retraso psicomotor se suele reconocer entre los primeros 3-9 meses de vida1 y se evidencia, entre otras cosas, por hipotonía e incapacidad del sujeto a mantener alzada la cabeza. Todos los pacientes diagnosticados en este estudio de Síndrome de Lesch-Nyhan presentaron una dependencia absoluta para llevar a cabo actividades básicas de la vida diaria y debían hacer uso de la silla de ruedas. Una de las manifestaciones neurológicas más dramáticas de la enfermedad de Lesch-Nyhan es la conducta autolesiva, concretamente la automutilación. La conducta automutilante suele aparecer en torno a los tres años de edad y, a pesar de ser característica, no es patognomónica ni está presente en todos los casos en el momento del diagnóstico en los pacientes de Síndrome de Lesch-Nyhan clásico1. En los casos observados en la UMV del Hospital Universitario La Paz, el sujeto más joven que presentó esta manifestación en su primera consulta fue de 3 años de edad. Muchos pacientes, inicialmente diagnosticados de enfermedad de Lesch-Nyhan por antecedentes familiares o severidad de la mutación del gen HPRT1, al diagnóstico no mostraron conductas autolesivas, pero, posteriormente, terminaron desarrollándola. Esta conducta automutilante suele dirigirse más hacia los labios, carrillos, lengua y dedos del sujeto (Figura 1), aunque en algunas ocasiones se manifiesta como comportamiento agresivo dirigido hacia la familia o amigos. Se agrava ante situaciones de estrés, y en la literatura se ha relacionado con un trastorno del comportamiento de tipo obsesivo-compulsivo10. A pesar de la dificultad del control de esta manifestación, las familias de los sujetos a estudio sostienen que se puede modular con distintos factores, entre los que la educación es probablemente el de mayor importancia. A pesar de ello, la conducta automutilante - ni la autolesiva en general - ha desaparecido por completo en ninguno de los pacientes que la ha desarrollado. Una de las grandes dificultades que plantea la enfermedad de Lesch-Nyhan y sus variantes atenuadas es que la gran variabilidad clínica en muchas ocasiones supone la superposición de fenotipos entre individuos con grados de déficits enzimáticos similares. Por lo tanto, es una enfermedad de difícil categorización que debe ir evaluándose progresivamente puesto que, por ejemplo, la clínica autolesiva puede no estar presente en el momento del diagnóstico pero sí aparecer con posterioridad. A pesar de que en la literatura figura que podría haber una buena correlación entre la severidad del defecto molecular y el fenotipo clínico11, la experiencia en la UMV del Hospital Universitario La Paz sugiere que esta afirmación debería acotarse. Los pacientes 2 y 3 (Tabla 2, Figura 2), que presentaban la misma mutación por ser hermanos, en el momento del diagnóstico mostraron una evidente diferencia en la expresión fenotípica de la enfermedad: así como uno se encontraba en silla de ruedas aunque no presentaba conducta automutilante, el otro podía caminar sin ayuda. Con el tiempo, ambos quedaron incapacitados en una silla de ruedas. Sin embargo, es de destacar el caso del paciente 10 (Tabla 2), un joven de 21 años con una mutación severa (ausencia de todo el exón 4 del gen HPRT1) y diagnóstico de enfermedad de LeschNyhan que, pese a estar limitado en una silla de ruedas, goza de una habilidad manual destacable, no ha presentado conducta automutilante y su clínica neurológica no es tan severa como la de pacientes con mutaciones igual de severas. Figura 2. Imagen de los pacientes 2 y 3, evidenciándose la inicial variación fenotípica. Por lo tanto, se plantea la posibilidad de que la severidad clínica no sólo esté debida al defecto molecular, sino a otros factores aún desconocidos que deberían fomentar la futura progresión en la investigación de la enfermedad de Lesch-Nyhan. 5. TABLAS Tabla 2. Características de los pacientes inicialmente diagnosticados con la Enfermedad de Lesch-Nyhan. ENFERMEDAD DE LESCH-NYHAN Paciente Familia Edad* Grado* Clínica Actual 1 LN1 2 LN2 3 LN3 4 LN4 5 LN5 6 LN6 7 LN7 8 LN8 9 LN9 10 LN10 11 LN11 12 LN12 13 LN13 14 LN14 15 LN15 16 LN16 17 LN17 18 LN18 19 LN19 20 LN20 21 LN21 22 LN22 23 LN23 24 LN24 25 LN25 26 V F1 V F1 V F1 LP F2 B F3 A F4 M F5 R F6 PP F7 AnD F8 H F9 C F10 C F10 Z2 F11 C2 F12 A3 F13 S3 F14 M2 F15 F16 F17 F18 F19 F20 F21 F22 F23 31 años 6 años 5 años 28 años 4 años 3 años 6 años 19 años 19 meses 11 meses 5 meses 27 años 18 meses 3 años 8 años 19 meses 9 meses 11 meses 2 años 4 años 16 meses 11 meses 16 días 6 meses 9 meses 6 4 4 4 4 4 4 4 4 4 4 4 4 4 4 4 4 4 4 4 4 4 4 4 4 4 3 Distonia severa generalizada, coreatetosis, retraso mental, automutilación Distonia severa generalizada, coreatetosis, retraso mental, autolesión Distonia severa generalizada, coreatetosis, retraso mental, automutilación Distonia severa generalizada, coreatetosis, retraso mental, automutilación Distonia severa generalizada, coreatetosis, retraso mental moderado, automutilación Distonía severa generalizada, coreatetosis, automutilación, retraso mental. Distonía severa generalizada, coreatetosis, automutilación, retraso mental. Distonía severa generalizada, coreatetosis, automutilación, retraso mental. Distonia severa generalizada, coreatetosis, leve retraso mental, automutilación. Anemia severa Distonia severa generalizada, coreatetosis, autolesión Distonia severa generalizada, coreatetosis, leve retraso mental Distonia severa generalizada, coreatetosis, retraso mental, automutilación Distonia severa generalizada, coreatetosis, leve retraso mental, automutilación Distonia severa generalizada, coreatetosis, moderado retraso mental, automutilación Distonía severa generalizada, coreatetosis, automutilación, retraso mental. Distonia severa generalizada, coreatetosis, leve retraso mental, automutilación Distonia severa generalizada, coreatetosis, leve retraso mental, automutilación Distonia severa generalizada, coreatetosis, leve retraso mental, automutilación Distonia severa generalizada, coreatetosis, leve retraso mental, automutilación Distonia severa generalizada, coreatetosis, leve retraso mental, automutilación Distonia severa generalizada, coreatetosis, leve retraso mental, automutilación Distonia severa generalizada, coreatetosis, automutilación Distonia severa generalizada, coreatetosis, leve retraso mental, automutilación Distonia severa generalizada, coreatetosis, leve retraso mental, automutilación Distonia severa generalizada, coreatetosis, leve retraso mental, automutilación Distonia severa generalizada, coreatetosis, severo Grado Actual 4 4 4 4 4 4 4 4 4 4 3 LNDV16 4 4 4 4 4 4 4 4 4 4 4 4 4 4 4 LN26 27 LN27 F24 meses 18 meses retraso mental, automutilación Distonia severa generalizada, coreatetosis, automutilación 4 4 *Datos de la primera visita a la Unidad Metabólico Vascular del Hospital Universitario La Paz Tabla 3. Características de los pacientes inicialmente diagnosticados con variantes atenuadas del Síndrome de Lesch-Nyhan. VARIANTES ATENUADAS DE LESCH-NYHAN Paciente Familia Edad* Grado* Clínica Actual (años) 28 G 13 2 Retraso mental moderado, marcha distónica, disartria LNDV1 F25 años 29 SA 35 2 Retraso mental moderado, marcha distónica, disartria, LNDV2 F26 años fracaso renal con traspalnte renal 30 LNDV3 31 LNDV4 32 LNDV5 33 LNDV6 34 LNDV7 35 LNDV8 36 LNDV9 37 LNDV10 38 LNDV11 39 LNDV1 40 LNDV13 41 LNDV14 42 LNDV15 11 LN11 SA F26 S2 F27 S F28 F29 F29 F30 F31 F32 F33 Z F34 A4 F34 A4 F34 A4 F35 A5 H F9 33 años 14 años 7 meses 14 meses 12 meses 16 años 16 años 30 años 5 meses 15 años 12 años 10 años 17 años 5 meses Grado Actual 2 2 2 Retraso mental moderado, marcha distónica, disartria 2 3 3 3 Distonia severa generalizada, coreatetosis, leve retraso mental Distonia severa generalizada, coreatetosis 3 Distonia severa generalizada, coreatetosis 3 2 Distonia severa generalizada, coreatetosis 3 3 Distonia severa generalizada, coreatetosis 3 2 Retraso mental leve, marcha distónica, disartria 2 1 Hiperuricemia (en tratamiento) 1 1 Déficit de atención. Hiperuricemia (en tratamiento) 1 1 Hiperuricemia (en tratamiento) 1 1 1 1 Distonía con ejercicio extenuante. Hiperuricemia (en tratamiento) Hiperuricemia (en tratamiento) 1 Hiperuricemia (en tratamiento) 1 4 Distonía severa generalizada, coreatetosis, retraso mental *Datos de la primera visita a la Unidad Metabólico Vascular del Hospital Universitario La Paz 3 1 3 LNDV16 BIBLIOGRAFÍA 1. García Puig J, Torres Jiménez R. Trastornos del metabolismo de las purinas. En: Sanjurjo Crespo P, y Baldellou Vázquez A, eds. Diagnóstico y Tratamiento de las Enfermedades Metabólicas Hereditarias. Ergon, S.A. Madrid, 2014 (en prensa). 2. Seegmiller JE. Diseases of purine and pyrimidine metabolism. In: Bondy PK, Rosenberg LE, eds. Metabolic control and disease. Philadelphia: WB Saunders, pp777-937, 1980. 3. Lesch M, Nyhan WL: A familial disorder of uric acid metabolism and central nervous system function. Am J Med 1964, 36:561-570. 4. Seegmiller JE, Rosenbloom FM, Kelley WN: Enzyme defect associated with a sex-linked human neurological disorder and excessive purine synthesis. Science. Mar 1967, 155 (3770):1682-1684. 5. Torres RJ. Lesch-Nyhan Syndrome. En: Maloy S, y Hughes K, eds. Brenner’s Encyclopedia of Genetics (Second Edition). Elsevier Inc, 219-222, 2013. 6. Torres RJ, Puig JG, Jinnah HA. Update on the Phenotypic Spectrum of Lesch-Nyhan Disease and its Attenuated Variants. Curr Rheumatol Rep. 2012 Apr; 14(2): 189-94. 7. Jinnah HA, Ceballos-Picot I, Torres RJ, et al. Attenuated variants of Lesch-Nyhan disease. Brain. 2010; 133: 671-89. 8. Official website of the Lesch-Nyhan disease international study group. www.lesch-nyhan.org. 9. García MG, Torres RJ, Prior C, Puig JG. Normal HPRT coding region in complete and partial HPRT deficiency. Mol Genet Metab. 2008; 94: 167-72. 10. Torres RJ, Puig JG. Lesh-Nyhan Syndrome. Drugs of the Future. 2010; 35(6). 11. Wilson JM, Stout JT, Palella TD, Davidson BL, Kelley WN, Caskey CT. A molecular survey of hypoxanthine-guanine phosphoribosyltransferase deficiency in man. J Clin Invest. 1986, 77: 188-195. Autor: Nicolás M. González Senac Universidad Autónoma de Madrid