Universidad Central del Ecuador - q
Anuncio

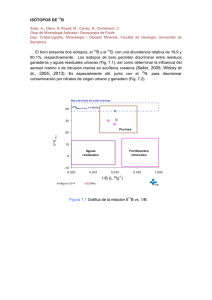
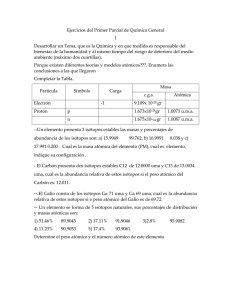
Universidad Central del Ecuador Facultad de Ciencias Químicas Fundamentos Espectroscópicos Trabajo 4: Isótopos, Cationes, Aniones y Radicales Libres TEMA 1. Cationes y Aniones 1.1 Definición y características de cationes y aniones Anión Un anión es un ion con carga eléctrica negativa, es decir, que ha ganado electrones; los aniones se describen con un estado de oxidación negativo. Hay dos tipos de aniones: monoatómicos y poliatómicos: - Los aniones monoatómicos suelen corresponder a no metales que han ganado electrones completos en su capa de valencia. - Los aniones poliatómicos se pueden considerar como procedentes de una molécula que ha perdido electrones. Los aniones ácidos proceden de un ácido poliprótico que ha perdido parte de sus electrones. Clasificación Clase (A).- desprenden gases con el ácido clorhídrico o sulfúrico diluido, carbonato, bicarbonato, sulfito, tiosulfato, sulfuro, nitrito, hipoclorito, cianuro y cianato. Están incluidos los del (I) con el agregado de los siguientes: floruro, cloruro, bromuro, yoduro, nitrato, clorato, perclorato, bromato y yodato, borato, ferrocianuro, ferricianuro, tiocianato, formiato, acetato, oxalato , tartrato y citrato. Clase (B).- reacciones de precipitación, sulfato, persulfato, fosfato, fosfito, hipofosfito, arseniato, arsenito, silicato, flousilicato, salicilato, benzoato y succinato. Reacciones de oxidación y reducción en solución, manganato, permanganato de potasio, cromato y dicromato. Cationes Un catión es un ion con carga eléctrica positiva, es decir, ha perdido electrones; los cationes se describen con un estado de oxidación positivo. Las sales típicamente están formadas por cationes y aniones (aunque el enlace nunca es puramente iónico, siempre hay una contribución covalente). También los cationes están presentes en el organismo en elementos tales como el sodio (Na) y el potasio (K). 1.2 Métodos para obtener cationes y aniones de carbono Métodos para obtener carbocationes: Los carbocationes pueden generarse de diferentes maneras ya sea mediante la ionización de halogenuros de alquilo, reacciones de sustitución electrofílica aromática y en la adición electrofílica de alquenos. Jaguaco Mónica | Toapanta Paola Universidad Central del Ecuador Facultad de Ciencias Químicas Fundamentos Espectroscópicos La manera más simple de formar un carbocation es la ionización de un átomo o grupo de átomos unido al carbono que se separa con sus electrones de enlace para formar un par iónico. En todos los casos, el empleo de un disolvente altamente polar es indispensable, pues la solvatación hace que el catión sea estable. Métodos para obtener carbaniones: La formación del carbanion se ve favorecida por la presencia de grupos atractores de electrones capaces de estabilizar la carga negativa por resonancia. La desprotonación de un carbono con una base de Brönsted es el procedimiento más directo para generar un carbanion; se generan además en la reacción de Michael, en reacciones que se utilice el reactivo de Grignard, entre otras. 1.3 Estabilidad de los cationes. Factores que influyen en la estabilidad Estabilidad de los Carbocationes Los carbocationes se presentan como intermediarios en varios tipos de reacción pero es difícil mantenerlos por mucho tiempo. Los más estables se han preparado en solución y, en algunos casos, aun en estado sólido. En solución el carbocation puede estar libre, lo que es más probable en disolventes polares en los que el catión estará solvatado, o puede existir como un par iónico, lo que significa que está estrechamente asociado con un ion negativo llamado contraion. Los pares iónicos se forman fácilmente en disolventes no polares. Para los alquil carbocationes simples el orden de estabilidad es terciario > secundario > primario. Los factores que determinan la estabilidad de los carbocationes son: - Efectos electrónicos.- los carbocationes son especies deficientes en electrones, por lo tanto, cualquier cambio estructural que incremente la densidad electrónica en el centro positivo estabilizara al carbocation; así la presencia de un átomo o grupo atrayente de electrones cercano al carbono positivo desestabilizará al catión mientras que un grupo donador le conferirá estabilidad. - Hiperconjugación.- el orden de estabilidad puede explicarse por hiperconjugación y por efecto de campo. En la hiperconjugación un enlace vecino al carbono con carga positiva, comparte los electrones con el orbital vacío del carbocation estabilizándolo de esta manera. - Transposición.- otra forma de estabilizar una carga positiva es mediante una transposición, que consiste en que un átomo o grupo de átomos vecinos al carbocation, se transfiera al carbocation junto con sus electrones de enlace, para dejar una carga positiva más estable. - Efecto de los disolventes.- sólo en muy pocos casos los carbocationes son lo suficientemente estables para ser aislados; el papel del disolvente en las reacciones de generación de carbocationes es de fundamental importancia, es más, muy pocas proceden en ausencia de disolvente; obviamente el disolvente juega un papel importante en facilitar el proceso de ionización. Este papel se debe en gran parte al Jaguaco Mónica | Toapanta Paola Universidad Central del Ecuador Facultad de Ciencias Químicas Fundamentos Espectroscópicos carácter dipolar de algunos disolventes y su consecuente habilidad para estabilizar iones. - Resonancia.- cuando la carga positiva de un carbocation se distribuye entre varios átomos debido a la presencia de un doble enlace, un átomo que tenga pares de electrones no compartidos o un anillo aromático vecinos, la carga se estabiliza. Este efecto se denomina efecto de resonancia, y es común en compuestos aromáticos, éteres o carbocationes alílicos. 1.4 Posibles usos. o o o o o o o Los iones son esenciales para la vida, por ejemplo el ion Sodio es el más importante catión (Na+) extracelular participa en: la regulación de la presión osmótica celular, etc. El catión potasio (K+) intracelular participa en: transmisión del impulso nervioso, contracción muscular, activación enzimática (cofactor enzimático), entre otros. El calcio con su catión extracelular (Ca2+) participa en la constitución del tejido óseo, dientes y sistema nervioso, coagulación sanguínea, etc. El cloro (Cl), su más importante anión (Cl-) extracelular participa en la regulación osmótica celular y síntesis del ácido clorhídrico estomacal. El magnesio como catión (Mg2+) interviene en la activación enzimática, desarrollo óseo, contracción muscular Los aniones más importantes del fósforo son los aniones intracelulares H2PO4-, HPO42-, PO43- participan en el desarrollo óseo y de los dientes, las reacciones de transferencia de energía (ATPfosfocreatina) y constitución de nucleótidos, fosfolípidos y otras sustancias. Los cationes son usados como la parte positiva en un compuesto formando un enlace iónico y estos participan en reacciones en su mayoría de intercambio iónico que tienen aplicaciones en la medicinas como las resinas de intercambio catiónico TEMA 2. Isótopos 2.1 Definición y características de isotopos. Isótopo Se denominan isótopos a los átomos de un mismo elemento, cuyos núcleos tienen cantidad diferente de neutrones, y por lo tanto, difieren en masa. La mayoría de los elementos químicos poseen más de un isótopo; solamente 21 elementos, por ejemplo el berilio y sodio; poseen un solo isótopo natural; mientras que el estaño es el elemento con más isótopos estables. Otros elementos tienen isótopos naturales, pero inestables, como el Uranio, cuyos isótopos están constantemente en decaimiento, lo que los hace radiactivos. Los isótopos inestables son útiles para estimar la edad de variedad de muestras naturales, como rocas y materia orgánica. Esto es posible, siempre y cuando, se conozca Jaguaco Mónica | Toapanta Paola Universidad Central del Ecuador Facultad de Ciencias Químicas Fundamentos Espectroscópicos el ritmo promedio de desintegración de determinado isótopo, en relación a los que ya han decaído. Gracias a este método de datación, conocemos la edad de la tierra. Los rayos cósmicos hacen inestables a isótopos estables de Carbono que posteriormente se adhieren a material biológico, permitiendo así estimar la edad aproximada de huesos, telas, maderas, cabello, etc. Se obtiene la edad de la muestra, no la del propio isótopo, ya que se tienen en cuenta también los isótopos que ya han desintegrado en la misma muestra. Se sabe el número de isótopos desintegrados con bastante precisión, ya que no pudieron haber sido parte del sistema biológico a menos que hubieran sido aún estables cuando fueron absorbidos. 2.2 Principales isótopos de C, H, O, N, S y X Isotopos del Carbono En la naturaleza, podemos encontrar varios isótopos de carbono; los más frecuentes son el carbono 12, el carbono 13 y el carbono 14. Estos números indican el número másico para cada isótopo; el número atómico es siempre el mismo, ya que todos estos isótopos tienen 6 protones, y lo que varía entonces en cada uno de ellos es la cantidad de neutrones presentes en el núcleo: seis, siete y ocho, respectivamente. Las propiedades químicas de cada uno de estos isótopos de carbono son similares, casi la totalidad del dióxido de carbono presente en la atmósfera, está formado por 12C; sin embargo, una pequeña fracción de estas moléculas está formada con 13C, y una porción aún menor tiene como componente un átomo de 14C. El isótopo de 14C es radiactivo e inestable, y sus propiedades se han aplicado en la determinación de la edad de algunos fósiles. Isótopos del Hidrógeno El hidrógeno natural tiene tres isótopos, conocidos como: protio o hidrógeno común, el cual no contiene neutrones y posee una abundancia de un 99.985 %; deuterio, el cual posee un neutrón y una abundancia de 0.015%; y el tritio, radiactivo y de dos neutrones, con una abundancia de 10-15 %. Estos isótopos son tan especiales, que son el único grupo de isótopos que posee símbolos especiales, y estos son: H para el protio, D en el caso del deuterio, y T para el isótopo tritio. Isótopos del Oxigeno El oxígeno tiene tres isótopos estables y diez radioactivos; todos sus isótopos radioactivos tienen un periodo de semidesintegración de menos de tres minutos. Isotopos del Nitrógeno Existen dos isótopos estables del nitrógeno, 14N y 15N, siendo el primero el que se produce en el ciclo carbono-nitrógeno de las estrellas, el más común sin lugar a dudas (99,634%). Jaguaco Mónica | Toapanta Paola Universidad Central del Ecuador Facultad de Ciencias Químicas Fundamentos Espectroscópicos De los diez isótopos que se han sintetizado, el 13N tiene un periodo de semidesintegración de nueve minutos, y el resto de segundos o menos. Las reacciones biológicas de nitrificación y desnitrificación influyen de manera determinante en la dinámica del nitrógeno en el suelo, casi siempre produciendo un enriquecimiento en 15N del sustrato. Isótopos del Azufre Se conocen 18 isótopos del azufre, cuatro de los cuales son estables: 32S (95,02%), 33S (0,75%), 34S (4,21%) y 36S (0,02%). Aparte del 35S, formado al incidir la radiación cósmica sobre el argón-40 atmosférico y que tiene un periodo de semidesintegración de 87 días, los demás isótopos radiactivos son de vida corta. Isótopos del Cloro En la naturaleza se encuentran dos isótopos estables de cloro; uno de masa 35uma, y el otro de 37uma, con unas proporciones relativas de 3:1 respectivamente, lo que da un peso atómico para el cloro de 35,5uma. El cloro tiene 9 isótopos con masas desde 32uma hasta 40uma; sólo tres de éstos se encuentran en la naturaleza: el 35Cl, estable y con una abundancia del 75,77%, el 37Cl, también estable y con una abundancia del 24,23%, y el isótopo radiactivo 36Cl. La relación de 36Cl con el Cl estable en el ambiente es de aproximadamente 700×10–15:1. El 36Cl se produce en la atmósfera a partir del 36Ar por interacciones con protones de rayos cósmicos; en el subsuelo se genera 36Cl principalmente mediante procesos de captura de neutrones del 35Cl, o por captura de muones del 40Ca. El 36Cl decae a 36S y a 36Ar, con un periodo de semidesintegración combinado de 308000 años. 2.3 Métodos para obtener isótopos y abundancia relativa La abundancia relativa de un isótopo es un valor expresado en porcentaje (%); se calcula dividiendo el número de átomos de un isótopo entre el número total de átomos del elemento al que pertenece, todo ello multiplicado por 100. En un elemento natural, la abundancia relativa de sus isótopos en la naturaleza recibe el nombre de abundancia isotópica natural. La denominada masa atómica de un elemento es una media de las masas de sus isótopos naturales ponderada de acuerdo a su abundancia relativa. A = masa atómica del elemento natural Ai = masa atómica de cada isótopo xi = porcentaje de cada isótopo en la mezcla 2.4 Estabilidad de los isótopos. Factores que influyen en la estabilidad. Jaguaco Mónica | Toapanta Paola Universidad Central del Ecuador Facultad de Ciencias Químicas Fundamentos Espectroscópicos Un elemento químico que tiene uno o varios isótopos, de los cuales todos, algunos, o ninguno, pueden ser isótopos estables. Los isótopos que no son estables, a diferencia de los estables, se desintegran para dar lugar a otros núclidos emitiendo partículas o radiación electromagnética. Se conocen unos 2500 núclidos, de los cuales son estables menos de 300. La representación del número de neutrones (N) frente al número de protones (número atómico, Z) indicándose los isótopos estables se denomina carta de Segrè. La región de estabilidad definida por esta gráfica es estrecha, cumpliéndose que para números de masa (A) pequeños el número de protones y de neutrones es similar, mientras que conforme aumenta A, la relación N/Z también aumenta (hasta un valor de aproximadamente 1,6). Los núclidos que están a la derecha de esta franja de estabilidad son núclidos con demasiados protones para los neutrones que tiene, y los núcleos se rompen por repulsión. Los núclidos que están a la izquierda son núclidos con demasiados neutrones para los protones que tienen, y se produce un proceso de decaimiento convirtiendo neutrones en protones. Se encuentra que para Z = 43, Z = 61 o Z > 83 no hay ningún núclido estable. La fuerza nuclear fuerte es la encargada de mantener unido el núcleo atómico, a pesar de que la fuerza electromagnética haga que los elementos con el mismo signo de carga eléctrica (los protones, que tienen todos una carga positiva) se repelan; sin embargo, la fuerza nuclear fuerte tiene un radio de acción muy pequeño, lo que explica que no se encuentren núcleos estables para Z > 83, ya que, al aumentar el número de protones, aumenta el tamaño del núcleo, por lo que la fuerza nuclear fuerte se ve sobrepasada por la fuerza electromagnética, que logra llegar a expulsar algún protón. 2.5 Posibles usos. o o o o o En el marcaje isotópico, se usan isótopos inusuales como marcadores de reacciones químicas. Los isótopos añadidos reaccionan químicamente igual que los que están presentes en la reacción, pero después se pueden identificar por espectrometría de masas o espectroscopia infrarroja. Si se usan radioisótopos, se pueden detectar también gracias a las radiaciones que emiten y la técnica se llama marcaje radiactivo. La datación radioactiva es una técnica similar, pero en la que se compara la proporción de ciertos isótopos de una muestra, con la proporción en que se encuentran en la naturaleza. La sustitución isotópica, se puede usar para determinar el mecanismo de una reacción gracias al efecto cinético isotópico. Diferentes variedades de espectroscopia se basan en las propiedades únicas de nucleidos específicos. Por ejemplo, la espectroscopia por resonancia magnética nuclear (RMN), permite estudiar sólo isótopos con un spin distinto de cero, y los nucleidos más usados son 1H, 2H, 13C y 31P. La espectroscopia Mössbauer también se basa en las transiciones nucleares de nucleidos específicos, como el 57Fe. Jaguaco Mónica | Toapanta Paola Universidad Central del Ecuador Facultad de Ciencias Químicas Fundamentos Espectroscópicos o Los radionucleidos, también tienen aplicaciones importantes, las centrales nucleares y armas nucleares requieren cantidades elevadas de ciertos nucleidos. Los procesos de separación isotópica o enriquecimiento isotópico representan un desafío tecnológico importante. TEMA 3. Radicales Libres 3.1 Definición y Características de los Radicales Libres. Radicales Libres Los radicales libres son átomos o grupos de átomos que tienen un electrón (e-) desapareado en capacidad de aparearse, por lo que son muy reactivos; estos radicales recorren nuestro organismo intentando robar un electrón de las moléculas estables, con el fin de alcanzar su estabilidad electroquímica. Una vez que el radical libre ha conseguido robar el electrón que necesita para aparear su electrón libre, la molécula estable que se lo cede se convierte a su vez en un radical libre, por quedar con un electrón desapareado, iniciándose así una verdadera reacción en cadena que destruye nuestras células. La vida biológica media del radical libre es de microsegundos; pero tiene la capacidad de reaccionar con todo lo que esté a su alrededor provocando un gran daño a las moléculas y a las membranas celulares. Los radicales libres no son intrínsecamente malos; de hecho, nuestro propio cuerpo los fabrica en cantidades moderadas para luchar contra bacterias y virus. 3.2 Método para la obtención de radicales libres Los procesos normales del organismo producen radicales libres como el metabolismo de los alimentos, la respiración y el ejercicio. También estamos expuestos a elementos del medio ambiente que crean radicales libres como la polución industrial, tabaco, radiación, medicamentos, aditivos químicos en los alimentos procesados y pesticidas. Las reacciones que afectan a los radicales libres son: - Reacciones de iniciación.- son las reacciones que producen un aumento en el número de radicales libres; pueden afectar a la formación de radicales libres a partir de especies estables o pueden producir reacciones de radicales libres con especies estables para formar más radicales libres. - Reacciones de propagación.- son reacciones en las que el número de radicales libres total es el mismo que el de partida. - Reacciones de terminación.- son las reacciones en las que se produce una disminución neta del número de radicales libres; dos radicales libres se combinan para formar una especie química más estable. La ruptura de los enlaces puede también generar radicales libre; así en la Ruptura Homolítica la generación de radicales libres es evidente y la Ruptura Heterolítica da lugar a los carbocationes y carbaniones. Jaguaco Mónica | Toapanta Paola Universidad Central del Ecuador Facultad de Ciencias Químicas Fundamentos Espectroscópicos 3.3 Estabilidad de los radicales libres Para conseguir la estabilidad modifican a moléculas de su alrededor provocando la aparición de nuevos radicales, por lo que se crea una reacción en cadena que dañará a muchas células y puede ser indefinida si los antioxidantes no intervienen. Los radicales libres son muy inestables y reaccionan rápidamente con otros compuestos, intentando capturar el electrón necesario para ganar estabilidad. En general, los radicales libres atacan la molécula estable más cercana y le “roban” su electrón. Cuando la molécula ataca pierde su electrón y se convierte en un radical libre comenzando una reacción en cadena. 3.4 Posibles usos. Reacciones adversas de los radicales libres Los radicales libres producen daño a diferentes niveles en la célula: o Atacan a los lípidos y proteínas de la membrana celular por lo que la célula no puede realizar sus funciones vitales (transporte de nutrientes, eliminación de deshechos, división celular, etc.). o El radical superóxido, O2, que se encuentra normalmente en el metabolismo provoca una reacción en cadena de la lipoperoxidación de los ácidos grasos de los fosfolípidos de la membrana celular. o Atacan al DNA impidiendo que tenga lugar la replicación celular y contribuyendo al envejecimiento celular. o Los radicales libres producidos por el cuerpo para llevar a cabo determinadas funciones son neutralizados fácilmente por nuestro propio sistema, con este fin, nuestro cuerpo produce unas enzimas (como la catalasa o la dismutasa) que son las encargadas de neutralizarlos. Estas enzimas tienen la capacidad de desarmar los radicales libres sin desestabilizar su propio estado. o Los radicales libres en nuestro organismo aceleran la rapidez de envejecimiento y degeneración de las células de nuestro cuerpo por lo que el consumo de antioxidantes es esencial. BIBLIOGRAFÍA: 1. http://www.federacioncafe.com/Documentos/CafeYSalud/CafeYAntioxidantes/Radicales%20libres.pdf/20 11-07-16/22:00 2. http://micocinavegetariana.com/los-radicales-libres-y-su-salud/2011-07-16/22:00 3. http://es.wikipedia.org/wiki/Is%C3%B3topo_estable/2011-07-16/22:10 4. http://es.wikipedia.org/wiki/Azufre#Isotop.C3.ADa/2011-07-16/22:20 5. http://quimica.laguia2000.com/general/isotopos-del-hidrogeno/2011-07-16/22:30 6. http://quimica.laguia2000.com/elementos-quimicos/isotopos-de-carbono/2011-07-16/22:30 7. http://es.wikipedia.org/wiki/Complejo_%28qu%C3%ADmica%29/2011-07/18/11:30 8. http://www.eis.uva.es/~qgintro/atom/tutorial-05.html/2011/07/18/11:37 9. http://quimicayciencias.cjb.net/2011/07/19/11:45 10. CHANG, Raymond, “Química General”, Editorial Mc Graw Hill, pág. 843,844. 11. ttp://www.scribd.com/doc/6869194/RADICALES-LIBRES Jaguaco Mónica | Toapanta Paola