Diagnóstico Virológico PCR y pruebas rápidas: Gripe A.
Anuncio

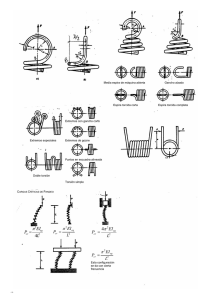
Diagnóstico Virológico PCR y pruebas rápidas: Gripe A. Carlos Artaza Alvarez MIR 4 Hospital Universitario Fundación Alcorcón Reacción en Cadena de la Polimerasa (RCP) INTRODUCCION: Década de los 70: Grandes avances en Biología Molecular: • • • • Enzimas de restricción Clonación de genes en plásmidos y fagos Técnicas de hibridación en filtro para ADN y ARN Técnicas de secuenciación química y enzimática ADN INTRODUCCION 1983: Kary Mullis desarrollo una nueva técnica que hizo posible la síntesis de grandes cantidades de un fragmento de ADN sin necesidad de clonarlo: PCR (polymerase chain reaction). Consiguió copiar millones de veces, en un par de horas, una secuencia predeterminada dentro de una mezcla de ADN. PCR: Definición Síntesis "in vitro" de secuencias específicas de ADN. La técnica se basa en la repetición de ciclos de síntesis de DNA dirigida por oligonucleótidos para realizar la replicación en forma exponencial de secuencias diana de ácidos nucleicos (Amplificación del DNA). AMPLIFICACION EXPONENCIAL DNA PCR: Definición Es una técnica: Altamente especifica Muy sensible: en principio, para practicarla bastaría una sola molécula (genoma humano) ~6 picogramos. Robusta, utiliza como sustrato al ADN de muestras sin necesidad de ser purificada de su fuente natural (tejidos embebidos en parafina, lavados bronquiales, exudados de mucosas, etc) PCR: Componentes de la Reacción 1. - - - - Enzima (DNA polimerasa): Capaces de sintetizar DNA o RNA “in Vitro”. Requieren un molde y sintetizan una molécula complementaria al molde. Capaces de actuar a altas temperaturas empleadas en la reacción. Inicialmente: DNA polimerasa de E. Coli inestabilidad térmica (necesario agregar en cada ciclo) PCR: Componentes de la Reacción Actualmente Enzimas termoestables: Taq (Thermus acuaticus) y la Vent (Thermococcus litoralis) °T optimas: 72°C. Taq: • Proteína de una sola cadena polipeptídica. • Peso molecular de 95 kDa. • Fidelidad de replicación depende de la [Mg+2] y de los dNTPs y del balance de estos. • Tasa de incorporación de nucleótidos: 150 nucleótidos /seg. PCR: Componentes de la Reacción 2. DNA molde: - La concentración de DNA molde depende de la fuente utilizada. - Idealmente: 20 nanogramos a 1 microgramo de DNA genómico de células eucariotas. - No es necesario purificar el DNA molde. - Eliminar los inhibidores de la polimerasa. - Para muestras clínicas: extracción con fenolcloroformo y posterior precipitación de Ácidos nucleicos con etanol o isopropanol. PCR: Componentes de la Reacción 3. Cebadores o iniciadores (Primers): -Oligonucleótidos sintéticos -Componente mas sensible que determina el éxito de la PCR. -Se deben seleccionar dos iniciadores que estén localizados en los extremos de la región de interés. - Longitud: 18 a 30 nucleótidos (↓ < especificidad). - Contenido: G+C entre 40-75%. - Concentración: 0.1 a 0,5 uM. - Deben carecer de estructura secundaria. PCR: Componentes de la Reacción - No deben ser complementarios entre si. - Existen programas informáticos para el diseño de cebadores. - El extremo 3’ del nucleótido iniciador se fija a un soporte sólido (gel de sílice) y un sintetizador de DNA añade paso a paso cada nucleótido en una serie de etapas. “Maquina de genes”: Construye cadenas de oligonucleótidos utilizados durante la PCR. (Oligo 1000M DNA Synthesizer) PCR: Componentes de la Reacción 4. Dexosirribonucleósidos trifosfatados (dNTPs): - Son los ladrillos con los que se construye las nuevas cadenas de DNA. - Cuatro: dATP, dTTP, dCTP y dGTP. - Concentración equimolar de los 4 dNTPs - Concentración óptima: 20 y 200 uM. - Bajas concentraciones: < índice de incorporación. - Altas concentraciónes: < especificidad PCR: Componentes de la Reacción 5. Otros componentes: - Solución amortiguadora: • Incluye: HCl, KCl, gelatina y MgCl2. • Mantiene el pH óptimo para que la enzima actúe. - Agua: • • • • Solvente del resto de componentes Al menos destilada, purificada por UV y ozono Libre de DNAsas y RNAsas Desionizada - Magnesio: Función critica: Los iones de magnesio estimulan a la enzima Taq Polimerasa para que incorpore los dNTPs. • Bajas concentraciones: Bajo rendimiento • Exceso Mg: amplificaciones inespecificas RCP: Etapas. 1. Desnaturalización DNA – – – – Incubación DNA molde (92-98ºC, de 30-90 seg) Separación de cadenas complementarias por ruptura de los puentes de hidrógeno. Cadenas DNA blanco accesibles al apareamiento. Etapa crítica, importante DNA molde se desnaturalice completamente Desnaturalización del DNA °T: 92-98°C 30-90 seg RCP: Etapas. 2. Alineamiento – – – Enfriamiento de la reacción Hibridación de cadenas desnaturalizadas con cebadores o iniciadores (Primer: DNA sintético de hebras sencilla) Temperatura optima (°T de fusión) depende de los cebadores (generalmente 50 a 60 °C) Alineamiento ºT: 50-60ºC RCP: Etapas. 3. Reacción de extensión: – – – Se efectúa a una temperatura intermedia: 72°C Actúa la DNA polimerasa extendiendo la longitud de los cebadores. Incorpora los nucleótidos libres en dirección 5’ 3’ complementando la cadena que actúa como molde. Reacción de extensión °T: 72 °C RCP: Etapas. Estas tres etapas constituyen un ciclo térmico y se realizan en forma automatizada en un TERMOCICLADOR RCP: Etapas. Protocolo típico 30 a 50 ciclos Al completar ciclo Fragmentos recientes sirven de molde. En pocos ciclos Fragmento sintetizado producto predominante (amplificación). Longitud del fragmento DNA distancia entre los cebadores. RCP: Etapas. Evitar un número alto de ciclos : dan lugar a la amplificación de productos originados por hibridaciones inespecíficas. La enzima sufre el efecto meseta: exponencial Aritmética estacionaria. Cuando el efecto meseta se presenta la cantidad de DNA sintetizada es suficiente para su utilización. Tasa de producción de DNA por PCR Contaminación en PCR: La Reacción en Cadena de la Polimerasa es una técnica muy sensible, por lo que es de gran importancia evitar contaminaciones Existen una serie de normas que ayudan a evitar las contaminaciones: • • • • • Lugar físico exclusivo para realizar la PCR Uso de instrumental exclusivo para la PCR Utilización de reactivos y tubos estériles Uso de guantes Controles blanco Análisis del producto de una RCP: Después de la amplificación: • DNA puede colocarse en gel de agarosa • Realizar el corrimiento electroforético, • Teñirlo y observar en luz ultravioleta el producto de la RCP. Análisis del producto de una RCP: El análisis mas fino y la caracterización metodologías adecuadas: • Análisis electroforético en geles poliacrilamida. • Digestiones con enzimas de restricciones • Hibridación con detectores específicos (genes clonados) • Secuenciación nucleotídica. PCR:DESVENTAJAS La PCR supuso un gran avance y permitió introducir la biología molecular de forma generalizada en los laboratorios asistenciales. El hecho que complica y alarga extraordinariamente el proceso es la visualización del producto una vez amplificado, que debe hacerse por hibridación en solución o en fase sólida (southern blot). PCR:DESVENTAJAS De esta manera se tarda entre 2 a 4 días en poder informar un resultado. Se necesita disponer de personal altamente especializado. Espacio suficiente para poder separar varias áreas de trabajo con la finalidad de evitar la temible contaminación por ADN sintetizado con anterioridad. PCR A TIEMPO REAL (PCR-RT) La mayoría de los inconvenientes se han solucionado con la introducción de la PCR realizada en tiempo real (PCR-RT). Elimina cualquier proceso post-PCR puesto que monitoriza la progresión de la amplificación en el momento en que ocurre. PCR A TIEMPO REAL (PCR-RT) A diferencia de la PCR convencional que mide la acumulación ADN al final de un número predeterminado de ciclos, con PCRRT esto se hace durante el proceso de amplificación usando fluorescencia. El aumento de la fluorescencia es proporcional a la cantidad de ADN formada. PCR A TIEMPO REAL (PCR-RT) El proceso se puede automatizar fácilmente usando un sistema que realice la amplificación (termociclador) y que a su vez sea capaz de leer fluorescencia. Dado que la amplificación y la detección ocurren al mismo tiempo, el análisis es más rápido que en la PCR en punto final. PCR A TIEMPO REAL (PCR-RT) La incorporación de fluorescencia al proceso de PCR se puede hacer de muy diversas maneras, pero las más utilizadas son: Colorantes intercalados Sondas marcadas. PCR A TIEMPO REAL (PCR-RT) Las sondas marcadas: son secuencias de oligonucleótidos que reaccionan por complementariedad de bases con un pequeño fragmento de la secuencia a amplificar. Estas sondas están marcadas con moléculas que emiten fluorescencia (fluoróforos) cuando se produce la amplificación específica. PCR A TIEMPO REAL (PCR-RT) Las sondas se colocan en la reacción de PCR junto con los otros reactivos y solamente se detecta fluorescencia, si la secuencia de interés está presente en la muestra y hay amplificación. PCR A TIEMPO REAL (PCR-RT) Las sondas fluorescentes más usadas son de tres tipos: sondas con actividad 5’ nucleasa (TaqMan) molecular beacons y Sondas FRET. Las tres se pueden aplicar en microbiología clínica, aunque las sondas FRET son las más complejas. Sondas Taqman PCR A TIEMPO REAL (PCR-RT) Agentes intercalantes de ADN: otro formato ampliamente utilizado. El mas empleado es el SYBR Green. El SYBR Green no emite fluorescencia cuando se encuentra en solución. En presencia de ADN doble cadena, el SYBR Green se intercala entre las cadenas de ADN emitiendo así una señal fluorescente. PCR A TIEMPO REAL (PCR-RT) Este fluorocromo se agrega a la reacción de PCR junto con los otros reactivos. Si en la reacción de PCR hay amplificación, el SYBR Green se une al ADN de doble cadena recién sintetizado en cada ciclo y va generando un aumento en la señal de fluorescencia que es proporcional a la cantidad de producto generado durante la amplificación. Aplicaciones de la PCR a tiempo real en la microbiología clínica No difieren de las de la PCR convencional. 1 . Diagnóstico etiológico. 2 . Control del tratamiento con antimicrobianos. 3 . Caracterización genética de agentes infecciosos. Genotipificación; identificación de mutaciones determinantes de resistencias a fármacos o de virulencia; epidemiología molecular Aplicaciones de la PCR a tiempo real en la microbiología clínica No obstante, gracias a sus indudables ventajas y a la sencillez de su empleo, la PCR a tiempo real ha ido reemplazando la PCR clásica Su aplicación se extiende a un número cada vez mayor de agentes infecciosos, implementándose progresivamente en la rutina asistencial. PCR:DIAGNOSTICO DE LA GRIPE A El virus de la gripe A(H1N1) deriva de diferentes linajes que han circulado en cerdos en el último tercio del siglo XX. Se trataría de un ejemplo más del papel que se sabe que desempeña este mamífero como mediador en el reagrupamiento genético del virus de la gripe A que posteriormente acaba afectando a humanos. PCR:DIAGNOSTICO DE LA GRIPE A El análisis filogenético de los diferentes fragmentos genómicos del virus A(H1N1) muestra un cuádruple origen. En una fase final parece haberse producido una modificación del virus porcino AH1N1 (linaje clásico porcino norteamericano, linaje aviar norteamericano y linaje humanoH3N2). Obtención, conservación y transporte de las muestras 1. Tipos de muestras: Con mejor rendimiento diagnóstico: • frotis de nasofaringe • lavado o aspirado nasofaríngeo Menor rendimiento diagnóstico • frotis nasal • frotis faríngeo Muestras inadecuadas • moco • saliva Obtención, conservación y transporte de las muestras 2. Conservación y transporte Períodos no superiores a 48-72 horas: refrigeradas a 4º C. El transporte también será refrigerado (acumuladores de frío). Períodos superiores: congeladas, preferiblemente a -70º C. Se recomienda mantener la congelación durante el transporte. Obtención, conservación y transporte de las muestras 3. Condiciones de bioseguridad Para el transporte y la manipulación de las muestras, se deben seguir las recomendaciones específicas de un nivel de bioseguridad 2. PCR-TR : GRIPE A Componente del virus que detecta: Ácidos nucleicos, utiliza cebadores y sondas específicos para detectar un fragmento del gen de la hemaglutinina y de la proteína M2 de A(H1N1)v. Tipo de ensayo: PCR a tiempo real. Tiempo de realización: 3-4 horas. Amplificación de un RNA mediante transcripción inversa del RNA a cDNA y posterior PCR con la DNA polimerasa de Thermus thermophilus. PCR-TR : GRIPE A Sensibilidad de la prueba: No está suficientemente evaluada, y depende de varios factores: a) Del sistema de extracción del material genético del virus a partir de la muestra b) de la propia técnica: no todas las técnicas de PCR son equivalentes c) de la experiencia de cada laboratorio. d) de la muestra a evaluar: tipo de paciente, situación epidémica, etc. PCR-TR : GRIPE A Especificidad de la prueba: Igualmente, no está evaluada adecuadamente. Depende del tipo de muestra y de la experiencia de cada laboratorio. En la actual situación epidémica, y en un laboratorio de Microbiología experimentado, puede asumirse que supera el 98%. PCR-TR : GRIPE A Ventajas: a) b) Sensible y específica. Rápida, aunque esta dependerá: a)Disponibilidad de equipos humanos organizados y bien entrenados, y b)Volumen de muestras a procesar. c) Algunas variantes técnicas permitirían la cuantificación de la carga vírica. PCR-TR : GRIPE A Inconvenientes: a) b) c) Requiere equipamiento específico. Requiere de la existencia y disponibilidad de microbiólogos bien entrenados. Detecta genoma viral, pero no informa si exista viabilidad del virus, por lo que no se recomienda para monitorizar tratamientos, ni evaluar la respuesta clínica. PRUEBAS RAPIDAS:DETECCION VIRUS RESPIRATORIOS Detección de antígenos virales: Permite una rápida obtención de resultados, generalmente en unas pocas horas después de la recepción de la muestra. Resultados a menudo son difíciles de interpretar. La especificidad dependerá de la experiencia del personal que los realice. La sensibilidad suele ser baja. PRUEBAS RAPIDAS:DETECCION VIRUS RESPIRATORIOS Métodos utilizados para la detección de los antígenos virales directamente en la muestra clínica: • Inmunofluorescencia • enzimoinmunoanálisis (EIA) Antígenos virales utilizados: moléculas que se sitúan en la superficie del virus, • la hemaglutinina y • la neuraminidasa, PRUEBAS RAPIDAS:DETECCION VIRUS RESPIRATORIOS También pueden encontrarse en la superficie de las células infectadas. Es posible emplear otras proteínas menos accesibles del virus como las nucleoproteínas, que son menos variables. PRUEBAS RAPIDAS:DETECCION VIRUS RESPIRATORIOS Se han comercializado técnicas: Inmuno-cromatografía capilar y Enzimoinmunoanálisis de membrana Posibilitan detectar virus gripales o sus antígenos en pocos minutos y su lectura es visual. PRUEBAS RAPIDAS:DETECCION VIRUS RESPIRATORIOS Amplia implantación en la asistencia urgente y en el ámbito pediátrico No obstante, su utilidad se ve limitada debido a su coste y bajas sensibilidad y especificidad. Diferentes Pruebas de detección rápida de antígenos disponibles para virus gripales GRACIAS