Técnica Histológica de Rutina
Anuncio
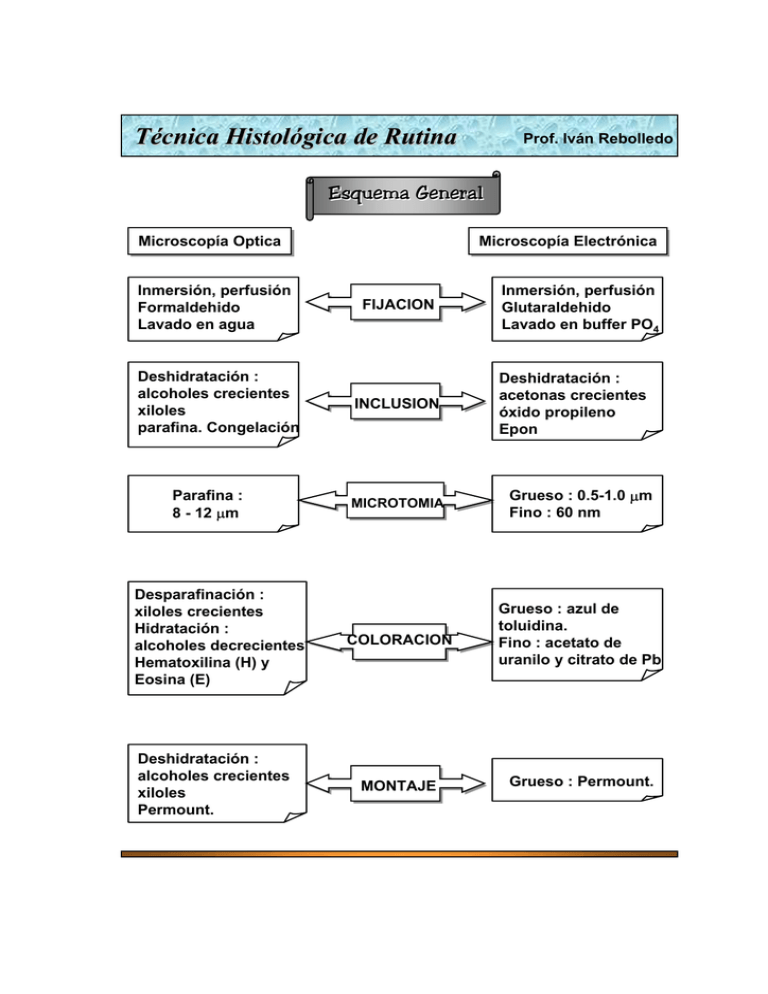
Técnica Histológica de Rutina Prof. Iván Rebolledo Esquema General Microscopía Microscopía Optica Optica Inmersión, perfusión Formaldehido Lavado en agua Deshidratación : alcoholes crecientes xiloles parafina. Congelación Parafina : 8 - 12 µm Desparafinación : xiloles crecientes Hidratación : alcoholes decrecientes Hematoxilina (H) y Eosina (E) Deshidratación : alcoholes crecientes xiloles Permount. Microscopía Microscopía Electrónica Electrónica FIJACION INCLUSION Inmersión, perfusión Glutaraldehido Lavado en buffer PO4 Deshidratación : acetonas crecientes óxido propileno Epon MICROTOMIA Grueso : 0.5-1.0 µm Fino : 60 nm COLORACION Grueso : azul de toluidina. Fino : acetato de uranilo y citrato de Pb MONTAJE Grueso : Permount. Técnica histológica Técnica histológica Las células deben prepararse adecuadamente para ser analizadas estructural y químicamente con instrumentos ópticos o electrónicos. La serie de procesos que incluyen la técnica histológica corriente son : fijación, inclusión, corte, tinción y montaje. 1. Fijación 1. 1. Propósito de la fijación : Es el procedimiento destinado a preservar la estructura y composición química de la célula, lo más cercano a su estado vivo; en otras palabras, se trata de utilizar soluciones químicas que minimicen las alteraciones estructurales y químicas que normalmente se producen como consecuencia de la muerte celular. Además, la fijación tiene como finalidad proteger las estructuras celulares contra daños en los procedimientos posteriores (inclusión, corte y tinción). 1. 2. Mecanismo de acción de la fijación : La mayoría de los fijadores son soluciones que actúan sobre las porciones proteicas de la célula. El buen fijador debe ser aquel que precipite las proteínas lo más fino posible, para que el aspecto celular no se modifique. Por ejemplo, el fijador más comúnmente usado en MO es el formol o formalina. La formalina tiene como fórmula H-CHO, la cual es capaz de reaccionar con los grupos amino y carboxilo de las proteínas, produciendo uniones metilénicos con otras moléculas proteicas, así, las proteínas precipitan formando mallas. La desventaja de este mecanismo de acción molecular es que puede extraer sustancias químicas vitales para estudios histoquímicos, por ejemplo, el glucógeno de las células hepáticas; esto se obvia eligiendo otra solución fijadora. En conclusión, la elección del fijador debe estar de acuerdo con el propósito de la experimentación. 1.3. Características de un fijador : 1.3.1. El fijador penetra en el trozo del tejido por difusión, de manera que se produce una gradiente de concentración del fijador, que depende de varios factores : h capacidad de penetración del fijador (tamaño molecular) h grosor del tejido (óptimo para MO es de 0.5 cm; para ME es de 0.5 mm). h proporción volumétrica fijador versus tejido (óptimo es 20:1) 1.3.2. El pH del fijador es una de las constantes que la célula debe mantener dentro de un rango muy estrecho, ya que de él depende que Técnica histológica Se efectúen las funciones vitales (respiración, metabolismo, etc.) en forma normal. Para obtener una solución fijadora con un pH deseado, se utiliza una solución llamada Buffer o tampón, que tiene la propiedad de mantener un pH determinado. Un buffer puede ser orgánico (acetato o cacodilato de sodio) o inorgánico (fosfato de sodio) En la práctica se utiliza un instrumento llamado pHímetro para medir el pH de la solución buffer. 1.3.3. La solución fijadora debe tener una osmolaridad adecuada al tejido que se estudiará, es decir, la solución fijadora debe tener una concentración muy similar a los líquidos que bañan las células o tejidos. Esto es muy importante puesto que así se evitan desplazamientos de líquidos de mayor a menor concentración, que puedan provocar deformaciones de la célula. En la práctica se utiliza un instrumento llamado osmómetro, para medir esta variable. Si una solución fijadora está muy concentrada puede agregarse agua destilada o si está muy diluida puede agregarse sacarosa o glucosa. 1.3.4. Al elegir un fijador se debe tener en cuenta el costo, la estabilidad en el tiempo y la facilidad de manejo. 1.4. Forma de aplicar un fijador : en la práctica se utilizan dos métodos para aplicar un fijador a un tejido : inmersión o perfusión. 1.4.1. Inmersión : es la forma más común de fijar un tejido, consiste en extraer el tejido, cortarlo en trozos pequeños y sumergirlo en la solución fijadora, por un tiempo determinado, de acuerdo a las características del fijador y del tejido. 1.4.2. Perfusión : consiste en hacer circular la solución fijadora por los vasos sanguíneos de un animal anestesiado, con los medios operatorios adecuados. De esta manera, el fijador puede llegar en corto tiempo a la intimidad del tejido elegido. Es un procedimiento que fija in situ. Se utiliza con frecuencia en la fijación del encéfalo, cuando aún se encuentra dentro del cráneo. 1.5. Algunos fijadores utilizados: 1.5.1. En MO : Ú formaldehido Ú alcohol etílico Ú ácido acético Ú ácido pícrico Ú cloruro de mercurio 1.5.2. En ME : ª glutaraldehido ª tetróxido de osmio ª paraformaldehido ª permanganato de potasio Técnica histológica 2.2. Medios de inclusión : 2. Inclusión Los tejidos biológicos requieren técnicas especiales para ser seccionados en cortes finos, previo a su observación con el MO (± 10 µm de grosor) o con el ME (± 60 nm de grosor). Para esto, los tejidos deben adquirir una consistencia adecuada, que se logra congelando los tejidos o incluirlos en una sustancia que reemplace el agua que contiene. Así, la inclusión es el procedimiento mediante el cual se introducen tejidos previamente fijados y deshidratados en medios líquidos o semifluídos que, al solidificarse, proporcionan al tejido una consistencia tal que permita ser cortado en láminas finas. Además, la inclusión permite que los tejidos puedan ser manipulados con facilidad y almacenarse por tiempo indeterminado. 2.1. Deshidratación : Previo a la inclusión en un medio determinado, que generalmente es insoluble en agua, los tejidos deben ser deshidratados. Para esto se introducen en una serie (batería) de alcoholes (MO) o acetonas (ME) crecientes, como lo siguiente : H2O 50 70 80 Para MO se utiliza con frecuencia la parafina, que es una mezcla de hidrocarburos sólidos extraídos de la destilación del petróleo. Se caracteriza por tener un punto de fusión entre 35 y 65 ºC. Es insoluble en agua y alcohol, de aquí la necesidad que los tejidos sean tratados previamente con xiloles. Terminado este proceso, se hacen los bloques que serán llevados al micrótomo, utilizando moldes especiales y orientando el tejido de acuerdo a la forma conveniente para su observación. Se deja enfriar la parafina para que se forme el bloque, se recortan los excesos y se monta en una platina especial o en un taco de madera, para instalarlo en el micrótomo. Para ME se utiliza con frecuencia la inclusión a EPON. El medio de inclusión está compuesto por una resina, un endurecedor y un acelerador. La dureza del bloque de Epon se logra variando las cantidades de los endurecedores, a fin de obtener una dureza que esté de acuerdo con el propósito de la investigación. 95 100 X P Técnica histológica Los tejidos ya deshidratados con la batería de acetonas crecientes, se pasan a mezclas crecientes de Epon acetona y se introducen en unos pequeños recipientes cilíndricos de plástico llamados cápsulas de BEEM, llenos de resina. Se dejan en una estufa a 60 ºC por 1-3 días. Se extrae el bloque de la cápsula para tallarlo y obtener los cortes gruesos y finos. Cuchilla de vidrio Baño de plástico Pegamento Baño de metal Diamante 2.3. Método de congelación : Se utiliza en histoquímica, en la cual deben conservarse las enzimas celulares sin ser alteradas o extraídas por los líquidos fijadores o deshidratadores. Consiste en enfriar los tejidos frescos hasta su congelación, sumergiéndolos en una sustancia refrigerante, como el nitrógeno líquido. Es muy útil en los diagnósticos urgentes durante una intervención quirúrgica. 3. Microtomía Los tejidos fijados e incluídos (y los congelados) deben someterse al proceso de corte, con el fin de obtener láminas delgadas que puedan ser observadas por transparencia con el MO ó el ME. 3.1. Cuchillas : Para MO se utilizan cuchillas de acero y para ME las de vidrio y diamante. Cuchilla de diamante 3.2. Micrótomos : Este es el nombre que reciben los instrumentos destinados a obtener cortes delgados del tejido. En MO es frecuente el uso del micrótomo rotatorio, el cual mediante una rueda con acción manual o automática, puede moverse el bloque contra la cuchilla o a la inversa. Otro micrótomo usado en MO es el micrótomo de deslizamiento, en el cual se desliza la cuchilla sobre unos rieles rebanando finamente un bloque fijo en el centro del instrumento. Los cortes de congelación se obtienen en un micrótomo que mantiene temperaturas bajas : es el crióstato. Técnica histológica En ME es frecuente el uso del ultramicrótomo, cuyo avance puede ser mecánico o térmico. Los cortes se reciben sobre un baño de agua. 4. Tinción La finalidad de la tinción o coloración es aumentar el contraste de las estructuras celulares mediante la adición de compuestos coloreados que tiene propiedades selectivas por determinadas zonas del tejido. Generalmente son compuestos orgánicos (azul de toluidina) o inorgánicos (ferrocianuro de potasio) y en cuanto al origen pueden ser naturales (hematoxilina) o sintéticos (eosina). 4.1. Mecanismo de acción de los colorantes : Cuando las propiedades de tinción de un colorante se localizan en un radical básico de su molécula, se dice que el colorante es básico y las estructuras que lo captan se llaman basófilas, en este caso, dichas estructuras poseen radicales ácidos. Ejemplo : El núcleo de una célula contiene ADN cuya naturaleza química es ácida. Los ribosomas del citoplasma contienen ARN cuya naturaleza química es ácida. El colorante utilizado para teñir el núcleo y los ribosomas posee el color en su radical básico. Al añadir el colorante al tejido, el radical básico del colorante se une al radical ácido del ADN y ARN. Así el radical ácido del ADN y ARN atraen el radical básico del colorante, por esto se dice que estas estructuras son basófilas Cuando las propiedades de tinción de un colorante se localizan en un radical ácido de su molécula, se dice que el colorante es ácido y las estructuras que lo captan se llaman acidófilas, en este caso, dichas estructuras poseen radicales básicos. Colorante Estructura Colorante Estructura Color en su radical básico Estructura con radicales ácidos Color en su radical ácido Estructura con radicales básicos Colorante básico Estructura basófila Colorante ácido Estructura acidófila Técnica histológica Ejemplo : Ejemplo : El citoplasma de une célula del estómago llamada parietal se tiñe de rojo con colorantes ácidos. La baturaleza química del citoplasma es básica. El colorante utilizado para teñirlo es la eosina que posee el color en su radical ácido. Así, los radicales básicos del citoplasma atraen los radicales ácidos del colorante, se dice que la estructura es acidófila. El azul de toluidina se tiñe de púrpura en contacto con gránulos azurófilos de los macrófagos, lo que indica que poseen grandes cantidades de heparina (un mucopolisacárido sulfatado). Los colorantes aparecen coloreados debido a que pueden absorber un cierto rango de longitud de onda del espectro de la luz visible (400-650 nm). Por ejemplo, el ácido pícrico que tiñe estructuras de color amarillo, es capaz de absorber todos los colores excepto el amarillo, que se transmite por el tubo ocular del microscopio hasta llegar a la retina del observador. Hay ocasiones en que un colorante puro puede absorber una longitud de onda diferente dependiendo de su concentración. Es el caso del azul de toluidina que transmite en el color azul a bajas concentraciones y transmite en color púrpura al encontrarse en altas concentraciones. Este fenómeno se llama metacromasia. Cuando el colorante se concentra es que hay un exceso de materiales químicos en un lugar determinado. 4.2. Hematoxilina : Es el colorante más utilizado en las técnicas histológicas de rutina. Su popularidad viene de su capacidad de teñir diferentes estructuras tisulares, su amplia aplicabilidad a diferentes tejidos y la facilidad de preparación. Es extraída de la corteza de un árbol llamado Palo de Campeche, originario del estado Campeche en México. La hematoxilina per se no tiñe, sino que es su producto de oxidación llamado hemateína la que tiñe. La oxidación o maduración puede producirse en forma natural exponiéndola al aire y luz, o en forma química usando yodato sódico La oxidación natural puede requerir días o meses, en cambio, la química es instantánea. Para que la hemateína pueda teñir fuertemente, se requiere de un mordiente, una sustancia química que facilite la fijación del colorante sobre las estructuras celulares. Técnica histológica 4.3. Eosina : Es el colorante ácido más ampliamente usado, debido a que con una diferenciación adecuada, puede teñir citoplasmas de diferentes tipos de células y teñir diferentes tipos de fibras del tejido conectivo. Hay varios tipos de eosinas, todas ellas son xantenos y de ellas la más común es la Eosina Y ó simplemente eosina, que es soluble en agua y alcohol. Se usa en bajas concentraciones : 0.5 a 1.0 % en agua destilada. La tinción con Eosina ocurre en el frasco respectivo y en los siguientes frascos con alcohol ocurre una leve diferenciación (extracción del exceso de colorante). 4.4. Método de coloración en MO : La mayoría de los colorantes se disuelven en agua, de aquí que los cortes de parafina deben someterse previamente a una desparafinación pasándolos por varios xiloles y luego deshidratándolos, pasándolos por varios alcoholes decrecientes (100º, 95º, 80º, 70º, y 50º) y luego agua. X X 100 95 Luego, se introducen los portaobjetos que contienen los cortes adheridos, al frasco que contiene la Hematoxilina, posterior-mente se lavan para extraer el exceso de colorante y a continuación se introducen en el frasco que contiene la Eosina. 4.5. Método de coloración en ME : Para ME los cortes gruesos (0.5 a 1.0 µm) de Epon pueden ser teñidos directamente con Azul de Toluidina (colorante básico) para obtener una orientación general del tejido objetivo de estudio. El mismo bloque debe ser retallado para dejar el mínimo de sector de tejido que se estudiará al ME. Los cortes finos (±60nm) se recogen sobre grillas de cobre (3 mm Ø) y se tiñen con acetato de uranilo y citrato de plomo. El propósito de añadir estos metales pesados es que puedan depositarse sobre las estructuras y desvíen los rayos electrónicos, dando así un contraste al tejido. 80 70 50 H2O Técnica histológica Grilla o rejilla 5. Montaje Los cortes de parafina ya se encuentran montados sobre una lámina de vidrio (portaobjetos). Para un examen al MO debe cubrirse con otra lámina de vidrio más delgada que la anterior (cubreobjetos). Se utiliza una sustancia llamada Permount que permite pegar en forma permanente ambas láminas de vidrio. Como esta sustancia es insoluble en agua, los tejidos deben ser deshidratados, pasando por una batería de alcoholes crecientes (50º, 70º, 80º, 95º y 100º). Por último, se pasan por xiloles y depositando una gota de Permount sobre el tejido,se coloca un cubreobjetos aplastándola suavemente. H2O 50 70 80 95 100 X X






