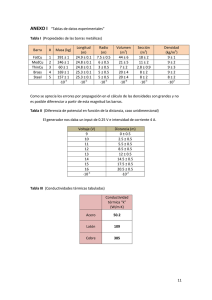
Reloj de yodo. Análisis de la velocidad de reacción
Anuncio

Reloj de yodo. Análisis de la velocidad de reacción Félix García Rodriguez ÍNDICE • • • • • • • • • • INTRODUCCIÓN DESCUBRIMIENTO REACCIÓN REDOX Y ECUACIONES DE VELOCIDAD FASES DE LA REACCIÓN OBJETIVOS MATERIALES EMPLEADOS PREPARACION DE LAS DISOLUCIONES LA REACCIÓN ANAÁLISIS DE DATOS GRÁFICAS Introducción • La reacción del reloj de yodo es una reacción redox en la un cambio de color súbito marca el final. • El tiempo que tarda en producirse este depende de varios factores, entre los que se encuentran la temperatura y la concentración • Para estudiar como varían estas se realizaran tablas y gráficas en Excel para interpretar los resultados obtenidos en el laboratorio Descubrimiento • Esta reacción fue descubierta en 1866 por el prestigioso científico Hans Heinrich Landolt • Lo que ocurre en la reacción del reloj de yodo es lo siguiente: A + B C Reacción redox y ecuaciones de velocidad • Una reacción redox es una reacción química en la que se da una transferencia de electrones entre las especies químicas. • A+1eA• B B+ • La velocidad de reacción es una medida de la cantidad de reactivos que se transforman en la unidad de tiempo. • Como se supone que esta cinética es de primer orden se tiene que cumplir que: • Tras integrar y despejar obtenemos la expresión con la que más tarde traajaremos en excel. • Para estudiar como varía la reacción en función de la temperatura y calcular la energía de activación podemos usar la ecuación de Arrhenius Fases de la reacción • Etapa primera: los iones hidrogenosulfito (HSO3-) reducen los iones yodato (IO3-) a iones yoduro (Iˉ) según la reacción : IO3-(aq) + 3HSO3-(aq) → I-(aq) +3SO4 2-(aq) + 3H+(aq) • Etapa segunda: los iones yoduro producidos en la etapa primera reaccionan con los iones yodato en exceso produciendo yodo (I2) • 5I- (aq) + IO3-(aq) + 6H+(aq) → 3I2(aq) + 3H2O(l) Objetivos • Demostrar que la reacción posee una cinética de primer orden • Observar la rapidez con la que se produce la reacción en función de la temperatura de los reactivos Materiales y reactivos empleados • • • • • • • • • • • • • • Yodato de potasio (KIO3) Hidrogenosulfito de sodio (NaHSO3) Almidón Frasco lavador con agua destilada Placa calefactora Balanza de laboratorio Matraces aforados de 250 ml. Vasos de precipitados Pipeta Probeta Vaso de precipitados Varilla de vidrio Espátula Embudo de vidrio Preparación de las disoluciones • Disolución 1: yodato de potasio (KIO3) 0,03 M. Se pesan con una balanza 1,6g de KIO3 y se disuelve añadiendo agua destilada con el frasco lavador hasta llegar al enrase de un matraz aforado de 250 ml • Disolución 2: hidrogeno sulfito de sodio (NaHSO3) 0,03M con almidón. Se coge con una pipeta 2ml de una disolución de NaHSO3 al 40% peso/volumen y se pesan 0,2g de almidón y se disuelve añadiendo agua destilada con el frasco lavador hasta llegar al enrase de un matraz aforado de 250ml. El almidón es preferible añadirlo aparte calentando agua destilada para que se disuelva mejor y evitar el exceso de turbidez. • A continuación se extraen 10ml de cada una de las disoluciones con dos pipetas diferentes. Es necesario que las pipetas sean diferentes para que los reactivos no se contaminen. Estos se depositan en dos pipetas diferentes, se vierten en un vaso y se agitan con una varilla. La reacción Análisis de datos • Respecto a la concentración, se deja siempre la misma disolución de NaHSO3 y se diluye el KIO3 reduciendo cada vez 1ml de la disolución 1 y echando agua en su lugar. • Respecto al tiempo se cogerán intervalos similares de incremento de la temperatura y se estudiará su variación. De esta no se realizará la ecuación de Arrhenius, pues faltan valores de la constante de velocidad a diferentes temperaturas Gráficas Variación de la concentración de IO3- a 19ºC 0,00 0 5 10 15 20 25 30 -0,50 log [IO3-] -1,00 -1,50 y = -0,0177x - 1,6346 -k/2,303 -2,00 -2,50 -3,00 tiempo (s) [IO3-] 0,015 0,0135 0,012 0,0105 9*10-3 log[io3-] -1,82 -1,87 -1,92 -1,98 -2,05 11 14 16 18 24 tiempo(S) Variación de la concentración de IO3- a 19ºC 0,00 0 50 100 -k/2,303 -0,50 log [IO3-] y = -0,0037x - 1,7309 -1,00 -1,50 -2,00 -2,50 tiempo (s) [IO3-] 0,015 0,0135 0,012 0,0105 9*10-3 7,5*10-3 6*10-3 log[io3-] -1,82 -1,87 -1,92 -1,98 -2,05 -2,12 -2,22 tiempo(S) 25,2 46,19 58,41 64,2 77,03 98,28 142,29 Variación de la concentración de IO3- a 21ºC 0,00 0 5 10 15 20 25 30 35 40 45 50 55 60 65 70 -0,50 log [IO3-] -1,00 -k/2,303 -1,50 y = -0,0105x - 1,6878 -2,00 -2,50 -3,00 tiempo (s) [IO3-] log[IO3-] tiempo(S ) 0,015 -1,82 0,0135 -1,87 0,012 -1,92 0,0105 -1,98 17,5 19,53 22,31 30,1 9*10-3 7,5*10-3 -2,05 -2,12 6*10-3 4,5*10-3 -2,22 -2,35 32,35 42,25 36,14 68,31 Variación del tiempo con la temperatura 50 45 temperatura (Cº) 40 35 30 25 20 tiempo (s) temperatur a 15 10 5 40 21 13 11 18 28 36 47 0 0 5 10 15 20 25 30 35 40 45 tiempo (s) temperatura (Cº) Variación del tiempo con temperatura tiempo temperatur a 37 28 25 21 21 25 27 30 50 45 40 35 30 25 20 15 10 5 0 0 5 10 15 20 tiempo (s) 25 30 35 40 Conclusiones • Según la ecuación ajustada log[A]0 = -1,68, sin embargo sabemos que es -1,82. El error es del 7%. • Se obtiene el valor de las constantes a 19 y 21 grados ( 0,0055 y 0,046 respecttivamente) • Al aumentar la temperatura aumenta la rapidez de la reacción Bibliografía consultada 5.1-LBROS ANDRÉS CABRERIZO, Dulce María; ANTÓN BOZAL, Juan Luis y BARRIO PÉREZ, Javier. (19??). Química 2º Bachillerato. España: Editex. 5.2-REVISTAS DURÁN TORRES, Carlos y AGUILAR MUÑÓZ, Mª Luisa. (2011). Eureka sobre Enseñanza y Divulgación de las Ciencias 8. 105-110. REGUERA ALONSO, Celia y GARCÍA GARCÍA, Mª Ángeles. (2011). Ciencia Recreativa Para Enseñanza Secundaria, 3. 2-6. FARRÁN MORALES, Mª Ángeles, GARCÍA FERNÁNDEZ, Mª Ángeles y PÉREZ TORRALBA, Marta. (2011). 100cias@uned, 4. 153-156 5.3-REFERENCIAS QUIMITUBE (2014). Experiencias de laboratorio: El reloj de yodo. Noviembre de 2014. Disponible en: http://www.quimitube.com/reacciones-oscilantes-reloj-de-yodo ALONSO FELIPE, José Vicente. (2013). Taller de química espectacular. Dis ponible en: http://quim.iqi.etsii.upm.es/vidacotidiana/Tallerquimicaespectacular.pdf CLUBENSAYOS. Arcoíris químico (2014, agosto). Disponible en: