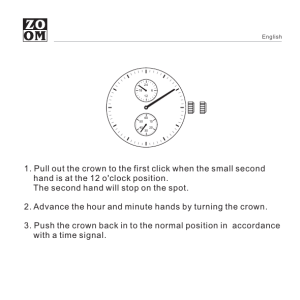
HIT-Ab((PF4-H)) 0009802032
Anuncio

HemosIL® AcuStar HIT-Ab(PF4-H) - 0009802032 ENGLISH - Insert revision 08/2013 Intended use Fully automated chemiluminescent immunoassay for the detection of IgG, IgA and IgM antibodies in human citrated plasma and serum that react with Platelet Factor 4 (PF4) when complexed to heparin on the ACL AcuStar™. Heparin-associated antibodies are commonly found in patients with heparin induced thrombocytopenia or thrombosis (HIT). • With the cartridge still on a solid surface, press the two tabs placed on the sides of the piercing cap (grey part) and apply pressure to the top portion of the cartridge until it snaps into a lock position. Once in the locked position the tabs should not be visible. Do not invert the open cartridge. • Once the cartridge is placed on the instrument, additional periodic mixing is performed on board. Summary and principle Heparin-induced thrombocytopenia (HIT) is an immune complex mediated disorder that can cause morbidity and mortality in patients receiving heparin therapy1. HIT is considered a paradoxical disease in that anticoagulant is administered to prevent thrombosis; however the major clinical event in HIT is an increased risk for venous and/or arterial thrombosis2. HIT is suspected when patients treated with unfractionated heparin (UFH) or low molecular weight heparin (LMWH) show a decrease of platelet counts greater than 50% from baseline, typically between day 5 and 10 from the initiation of the anticoagulant treatment3. Cases of early-onset HIT and delayed-onset HIT have also been reported2. Prompt diagnosis is very important because heparin treatment must be suspended and alternative anticoagulants used in case of confirmed HIT. Type II HIT, the immunoallergic type, is caused by the development of platelet-activating antibodies, mostly directed against Platelet Factor 4 when complexed with Heparin (PF4/H)4. These antibodies are the primary cause for inducing thrombosis both venous and arterial. The current working hypothesis is that early exposure to PF4 complexes, perhaps induced by endogenous non-heparin factors, leads to PF4 clustering and a T-cell-dependent antibody class switch of B-cells. Later in life, these B-cells become again transiently activated when PF4 clusters are induced by heparin treatment2. Development of pathology is mainly associated with heparin-dependent antibodies of the IgG isotype1. However, the presence of only IgM and/or IgA was observed in some patients, including cases showing a thrombotic complication5. PF4/H antibody testing combined with an appropriate clinical assessment has been proven to be very useful as an aid in the management of HIT suspected patients. Particularly, a negative result for a PF4/H antibody test can support the clinical decision to exclude the presence of HIT, and therefore continue heparin treatment2. A weak positivity for PF4/H antibodies may indicate that the antibodies are nonplatelet activating, while a strong positivity may indicate a higher risk of HIT. In both cases, confirmation with a functional test is recommended. A clinical reassessment supported by laboratory data should be performed before confirmation or exclusion of the diagnosis2. The HemosIL AcuStar HIT-Ab(PF4-H) assay is a chemiluminescent two-step immunoassay consisting of magnetic particles coated with PF4 complexed to polyvinyl sulfonate (PVS) which capture, if present, the PF4/Heparin antibodies from the sample. After incubation, magnetic separation, and a wash step, a tracer consisting of a mixture of 3 isoluminol-labeled monoclonal antibodies (anti-human IgG, anti-human IgA and anti-human IgM) is added and may bind with the captured PF4/Heparin IgG, IgA and/or IgM isotypes on the particles. After a second incubation, magnetic separation, and a wash step, reagents that trigger the luminescent reaction are added, and the emitted light is measured as relative light units (RLUs) by the ACL AcuStar optical system. The RLUs are directly proportional to the PF4/Heparin antibodies concentration in the sample. The ACL AcuStar HIT-Ab(PF4-H) assay utilizes a 4 Parameter Logistic Curve fit (4PLC) data reduction method to generate a Master Curve. The Master Curve is predefined and lot dependent and it is stored in the instrument through the cartridge barcode. With the measurement of calibrators, the predefined Master Curve is transformed to a new, instrument specific 4PLC Working Curve. The concentration values of the calibrators are included in the calibrator tube barcodes. Composition The AcuStar HIT-Ab(PF4-H) kit consists of: R HIT-Ab(PF4-H) Cartridge for 25 determinations (Cat. No. 0009802033): 1 cartridge containing 1 vial of magnetic particle suspension coated with PF4/PVS complex, 1 vial of assay buffer, 1 vial of tracer consisting of mAb anti-human IgG, IgM and IgA antibodies labeled with isoluminol, and 1 vial of sample diluent used for the regular predilution of the sample. The reagents are in a phosphate or Tris buffer containing bovine serum albumin, bovine fetal serum, PF4/PVS complex, mouse monoclonal IgG, stabilizers, and preservative. C1 HIT-Ab(PF4-H) Calibrator 1 (Cat. No.0009802034): 1 x 1 mL barcoded tube of a solution with humanized mAb anti-PF4-Heparin in Tris buffer containing bovine serum albumin, stabilizers and preservative. C2 HIT-Ab(PF4-H) Calibrator 2 (Cat. No. 0009802035): 1 x 1 mL barcoded tube of a solution with humanized mAb anti-PF4-Heparin in Tris buffer containing bovine serum albumin, stabilizers, and preservative. The calibrators are lot specific and they can not be used with other lots of reagents. PRECAUTIONS AND WARNINGS: The human derived material in this product was tested by FDA approved methods and found nonreactive for Hepatitis B Surface Antigen (HBsAg), Anti-HCV and HIV 1/2 antibodies. Handle as if potentially infectious6. All reagents contain less than 0.1% sodium azide that may form explosive azides in metal plumbing. Use proper disposal procedures. Hazard class: None Risk phrases: None Safety phrases: None This product is For in vitro Diagnostic Use. Preparation HIT-Ab(PF4-H) Cartridge: Microparticles settle during shipment and storage and require mixing to resuspend. • The first time that the cartridge is used, gently invert the cartridge 30 times avoiding the formation of foam. • Check for the complete resuspension of the microparticles. If the microparticles are not totally resuspended continue to invert the cartridge until the microparticles have been completely resuspended. • If the microparticles do not resuspend, DO NOT USE CARTRIDGE. • Once the microparticles have been resuspended, place the cartridge on a solid surface and gently remove the Red Secure Shipping Tab from the cartridge. HIT-Ab (PF4-H) Verwendung In a cross-reactivity study, 46 samples of the following conditions were tested with the AcuStar HITAb(PF4-H) assay: containing paraproteins IgG or IgM, with elevated levels of IgG or IgM, positive for Rheumatoid Factor (RF), and from pregnant women (at least 10% multiparous). Sample group N N (Positive) % Positive HIT-Ab(PF4-H) Rheumatoid Factor 10 0 0% Elevated IgG and IgM 20 0 0% Paraprotein IgG and IgM 6 0 0% Pregnant women 10 0 0% Expected values HIT-Ab(PF4-H) Calibrator 1 & 2: Are liquid and must be mixed by gentle inversion several times before use to assure homogeneity of the calibrator. Avoid foam formation. Please Note: Do not use the reagent if you observe any change in appearance of components included in the kit or if you observe any damage in the packaging materials. Reagent storage and stability Unopened reagents and calibrators are stable until the expiration date shown on the cartridge and tube labels when stored at 2-8°C. HIT-Ab(PF4-H) Cartridge - Stability after opening on board the ACL AcuStar System is 12 weeks. HIT-Ab(PF4-H) Calibrator 1 & 2 - Stability after opening on board the ACL AcuStar System is 4 hours. For optimal stability remove calibrators from the system and store them at 2-8°C capped in the original vial. Instrument/test procedures Refer to the ACL AcuStar Operator’s Manual for the complete assay procedure instructions. Specimen collection and preparation Plasma: Nine parts of freshly drawn venous blood are collected into one part trisodium citrate. Refer to CLSI Document H21-A5 for further instructions on specimen collection, handling, and storage7. Thaw frozen samples rapidly at 37°C. After thawing the assay must be performed within 2 hours. Serum: Following collection, the serum should be separated from the clot. Follow CLSI Document H18-A3 recommendations for storage conditions for samples8. Centrifuge specimens containing visible particulate matter before testing. Additional reagents and control plasmas The following are not supplied with the kit and must be purchased separately. AcuStar HIT Controls Cat. No. 0009802122 Quality control Two levels of control are recommended for a complete quality control program . HemosIL AcuStar HIT Controls Low and High are designed for this program. Each laboratory should establish its own mean and standard deviation, and should establish a quality control program to monitor laboratory testing. Controls should be analyzed at least once every 8 hour shift when testing is taking place, in accordance with good laboratory practice. Refer to the instrument’s Operator’s Manual for additional information. Refer to Westgard et al for identification and resolution of out-of-control situations10. 9 Traceability of calibrators and control materials The reported values were determined over multiple runs on the ACL AcuStar System using specific lots of reagents and against an internal House Standard. Sample matrix 41 paired citrated-plasma/serum samples were analyzed with the AcuStar HIT-Ab(PF4-H) assay. The concentration values were compared by Passing and Bablok regression using the plasma sample values as reference (X-axis), and the correlation coefficient calculated with Pearson correlation. The slope and intercept were respectively 1.01 and 0.03 and the correlation coefficient (r) 0.993. Please Note: The ACL AcuStar automatically accounts for the differences in dilution between plasma and serum samples. Reported serum sample values do not need to be corrected by a factor. Refer to the ACL AcuStar Operator’s Manual for additional information. Results HemosIL AcuStar HIT-Ab(PF4-H) results are reported in U/mL (HemosIL AcuStar HIT-Ab(PF4-H) Arbitrary Units). Test Range: System ACL AcuStar 0.00 – 128.00 U/mL Please Note: For samples >128.00 U/mL results will be reported as >128.00 U/mL and flagged as >Norm. Although a positive reaction obtained using this assay may indicate the presence of a heparin-associated antibody, the detection of antibodies, however, DOES NOT CONFIRM the diagnosis of heparin-induced thrombocytopenia (HIT). Some patients may have naturally occurring antibodies to PF4. The presence of PF4/H antibodies in a normal population is not expected. A set of studies was performed to assess the optimal cut-off of HemosIL AcuStar HIT-Ab(PF4-H) on the ACL AcuStar systems as described below. 150 plasma samples from apparently healthy individuals (blood bank donors) were tested. The 95% reference interval was 0.07 -1.01 U/mL. In addition, a population of 91 samples (61 citrated plasma and 30 sera) from heparin-exposed patients (UFH and LMWH) with no clinical suspicion of HIT were tested. The 95% reference interval was 0.04 – 2.27 U/mL. Finally, a method comparison with the Serotonin Release Assay (SRA) on 201 plasma samples from HIT suspected patients (14 SRA positive and 187 SRA negative) indicated that the optimal cut-off determined by ROC analysis was 1.00 U/mL (83.1% Agreement, 95% CI = 77.2% - 88.0%). Based on these studies it has been determined that on heparin treated patient samples, HemosIL AcuStar HIT-Ab(PF4-H) results equal or higher than 1.00 U/mL may indicate the presence of HIT antibodies. The assay results should be used with other information, including the clinical context, in forming a diagnosis. Performance characteristics Precision: Within run and total (run to run and day to day) precision was assessed over multiple runs. ACL AcuStar Mean (U/mL) %CV (Within run) %CV (Total) Low HIT-Ab(PF4-H) Control 0.53 4.2 6.4 High HIT-Ab(PF4-H) Control 2.72 3.0 6.0 HIT-Ab(PF4-H) plasma sample 1.70 5.7 6.2 Method Comparison: An in-house method comparison was performed with both plasma and serum samples using two commercially available FDA cleared ELISA assays. The results summarized below are based on a cut-off of 1.00 U/mL for the AcuStar. Overall % Agreement for plasma and serum were: ELISA 1 Assay ELISA 2 Assay Plasma Samples Serum Samples + - + AcuStar HIT-Ab(PF4-H) results + 81 18 + 45 1 - 11 156 - 4 75 Predicate Device N % Co-Positivity (95% CI) Co-Negativity (95% CI) % Agreement (95% CI) ELISA 1 Assay Plasma 266 88.0% (79.6% - 93.9%) 89.7% (84.1% - 93.8%) 89.1% (84.7% - 92.6%) ELISA 2 Assay Serum 125 91.8% (80.4% - 97.7%) 98.7% (92.9% - 100.0%) 96.0% (90.9% - 98.7%) Clinical performance: A multicenter study was performed at three hospitals on 610 samples (409 citrated plasma and 201 sera) using two commercially available FDA cleared ELISA assays. One hospital used only sera samples, the other two hospitals used only plasma samples and these results were combined. The samples were from patients exposed to heparin who showed HIT related symptoms and hence were suspected to suffer from HIT. The results summarized below are based on a cut-off of 1.00 U/mL for the AcuStar: ELISA 1 Assay ELISA 2 Assay Plasma Samples Serum Samples + - + AcuStar HIT-Ab(PF4-H) results + 16 23 + 37 9 - 11 359 - 14 141 Predicate Device N % Co-Positivity (95% CI) Co-Negativity (95% CI) % Agreement (95% CI) ELISA 1 Assay Plasma 409 59.3% (38.8% - 77.6%) 94.0% (91.1% - 96.1%) 91.7% (88.6% - 94.2%) ELISA 2 Assay Serum 201 72.5% (58.3% - 84.1%) 94.0% (88.9% - 97.2%) 88.6% (83.3% - 92.6%) The precision, method comparison, and clinical study results were obtained using specific lots of reagents and controls. Limitations/interfering substances HIT-Ab(PF4-H) results on the ACL AcuStar are not affected by hemoglobin up to 500 mg/dL, bilirubin up to 18 mg/dL, triglycerides up to 1250 mg/dL, heparin (Low Molecular Weight and Unfractionated) up to 1 IU/ mL, and Rheumatoid Factor up to 800 IU/mL. The assay is not affected by prozone effect. The assay protocol has a washing step after the sample incubation that precludes the prozone effect. Please Note: Positive Rheumatoid Factor samples may increase the value of an already positive HIT sample. Twenty six samples diagnosed with Antiphospholipid Syndrome (APS) were tested with the HemosIL AcuStar HIT-Ab(PF4-H). All 26 samples reported negative with HemosIL AcuStar HIT-Ab(PF4-H) demonstrating that the assay is not affected by APS antibodies. - 0009802032 Vollautomatischer Chemilumineszenz-Immunoassay zur Bestimmung von IgG, IgA und IgM Antikörpern in menschlichem Citratplasma und Serum, die mit Plättchenfaktor 4 (PF4) reagieren, welcher mit Heparin komplexiert ist. Zur Verwendung auf ACL AcuStar™ Analysensystemen. Heparin assoziierte Antikörper werden üblicherweise bei Patienten mit Heparin induzierter Thrombozytopenie oder Thrombose (HIT) gefunden. Testprinzip und Zusammenfassung Die Heparin-induzierte Thrombozytopenie (HIT) ist eine durch Immunkomplexe vermittelte Störung, die zu Morbidität und Mortalität bei Patienten unter Heparintherapie führen kann1. HIT wird als paradoxe Erkrankung angesehen, bei der Antikoagulantien zur Verhinderung einer Thrombose eingesetzt werden, jedoch das klinische Ereignis der HIT ein erhöhtes Risiko für venöse und/oder arterielle Thrombosen ist2. Ein Verdacht auf eine HIT liegt vor, wenn Patienten, die mit unfraktioniertem Heparin (UFH) oder niedermolekularem Heparin (LMWH) behandelt werden, einen Abfall der Thrombozytenzahl um mehr als 50% vom Ausgangswert zwischen dem 5. und 10. Tag nach Beginn der Antikoagulation zeigen3. Fälle von früherem oder späterem Auftreten einer HIT wurden ebenfalls berichtet2. Die unverzügliche Diagnose ist von entscheidender Bedeutung, da die Heparinbehandlung eingestellt und in bestätigten Fällen einer HIT durch alternative Antikoagulantien ersetzt werden muss. Die HIT Typ II, der immun-allergische Typ, wird durch die Entstehung von Plättchen-aktivierenden Antikörpern verursacht, die hauptsächlich gegen den Komplex aus Plättchenfaktor 4 und Heparin (PF4/H) gerichtet sind4. Diese Antikörper sind der Hauptgrund für die Entwicklung einer Thrombose, sowohl venös als auch arteriell. Die derzeitige Hypothese lautet, dass eine frühere Exposition mit PF4/H-Komplexen (eventuell ausgelöst durch endogene Faktoren) zu einer weiteren PF4/H-Komplexierung, sowie zu einer T-Zell abhängigen Veränderung der Antikörper-Klasse der B-Zellen führt. Zu einem späteren Zeitpunkt werden diese B-Zellen wieder transient aktiviert, falls es zu PF4/H-Komplexierung durch die Behandlung mit Heparin kommt2. Die Entwicklung der pathologischen Symptomatik ist hauptsächlich verbunden mit Heparin-abhängigen Antikörpern vom IgG Isotyp1. Jedoch wurde bei einigen Patienten nur die Anwesenheit von IgM und/oder IgA beobachtet. Dabei traten Fälle mit thrombotischen Komplikationen auf5. Die Testung auf PF4/H Antikörper, kombiniert mit einer entsprechenden klinischen Einschätzung, zeigt sich als sinnvoll zur Unterstützung des Managements von Patienten mit Verdacht auf HIT. Besonders ein negatives Ergebnis eines PF4/H Antikörper Tests kann die klinische Entscheidung für den Ausschluss einer HIT und damit die Fortführung der Heparin-Behandlung unterstützen2. Ein schwach positives Ergebnis für PF4/H Antikörper kann dafür sprechen, dass die Antikörper nicht Plättchen-aktivierend sind. Ein stark positives Ergebnis dagegen kann für ein höheres Risiko einer HIT sprechen. In beiden Fällen wird die Bestätigung durch einen funktionellen Test empfohlen. Eine klinische Neubewertung, unterstützt durch die Laborergebnisse, sollte vor der Bestätigung oder dem Ausschluss der Diagnose stehen2. Der HemosIL AcuStar HIT-Ab(PF4-H) Test ist ein Zweistufen-Chemilumineszenz-Immunoassay. Er besteht aus Magnetpartikeln die mit PF4, welches mit Polyvinylsulfonat (PVS) komplexiert ist, beschichtet sind. Dieser Komplex erfasst, falls vorhanden, die PF4/Heparin Antikörper der Probe. Nach Inkubation, magnetischer Separation und einem Waschvorgang, wird ein Tracer hinzugefügt, der aus einer Mischung von 3-Isoluminol markierten monoklonalen Antikörpern (anti-human IgG, anti-human IgA and anti-human IgM) besteht. Dieser Tracer kann an die eingefangenen PF4/Heparin IgG, IgA und/oder IgM Isotypen binden. Nach einer zweiten Inkubation, magnetischen Separation und einem Wasch-Schritt werden die Reagenzien, welche die Lumineszenz-Reaktion auslösen, zugegeben. Das emittierte Licht wird in Form von relativen Licht Einheiten (RLUs) vom optischen System des ACL AcuStar Analysensystems erfasst. Die RLUs sind direkt proportional zur Konzentration der PF4/Heparin Antikörper in der Probe. Der ACL AcuStar HIT-Ab(PF4-H) Test verwendet zur Datenreduktion eine logistische Kurvenanpassung mit 4 Parametern (4PLC) zur Erstellung einer Masterkurve. Die chargenabhängige Masterkurve ist vordefiniert und wird im Gerät über den Barcode der Kartusche gespeichert. Durch Messung des Kalibrators wird die vordefinierte Masterkurve in eine neue gerätespezifische 4PLC Arbeitskurve umgesetzt. Die Konzentrationsangaben des Kalibrators sind im Barcode des Kalibratorröhrchens enthalten. Inhalt Die AcuStar HIT-Ab(PF4-H) Packung enthält: R HIT-Ab(PF4-H) Cartridge für 25 Bestimmungen (Art. Nr. 0009802033): 1 Kartusche enthält 1 Flasche einer Suspension aus Magnetpartikeln, die mit einem PF4/PVS Komplex beschichtet sind; 1 Flasche Pufferlösung; 1 Flasche Tracer, bestehend aus monoklonalen anti-human IgG, IgM und IgA Antikörpern, die mit Isoluminol markiert sind; und eine Flasche Probendiluent, das für die automatische Vorverdünnung der Probe verwendet wird. Die Reagenzien sind in einem Phosphatoder TRIS-Puffer gelöst, der bovines Serum-Albumin, bovines fetales Serum, PF4/PVS Komplexe, monoklonale Maus IgG, Stabilisatoren und Konservierungsmittel enthält. C1 HIT-Ab(PF4-H) Calibrator 1 (Art. Nr. 0009802034): 1 barcodiertes Röhrchen x 1 mL einer Lösung von humanem mAb anti-PF4-Heparin gelöst in Tris Puffer, mit bovinem Serum-Albumin, Stabilisatoren und Konservierungsmitteln. C2 HIT-Ab(PF4-H) Calibrator 2 (Art. Nr. 0009802035): 1 barcodiertes Röhrchen x 1 mL einer Lösung von humanem mAb anti-PF4-Heparin gelöst in Tris Puffer, mit bovinem Serum-Albumin, Stabilisatoren und Konservierungsmitteln. Die Kalibratoren sind chargenspezifisch und können nicht mit anderen Reagenzchargen kombiniert werden. Warnung: Das verwendete Humanmaterial wurde mit FDA anerkannten Methoden als nicht reaktiv für Hepatitis-BAntigen (HBsAg), Anti-HCV und HIV 1/2-Antiköper getestet. Als potentiell infektiöses Material behandeln6. Alle Reagenzien enthalten weniger als 0,1% Natriumazid (Natriumazid kann in metallenen Abflussrohren potenziell explosive Azide bilden). Bitte die entsprechenden Abfallbeseitigungsvorschriften beachten. Gefahrenklasse: keine Risikoeinstufung: keine Sicherheitseinstufung: keine Dieses Produkt ist nur für die in vitro Diagnostik geeignet. Herstellung HIT-Ab(PF4-H) Cartridge: Mikropartikel setzen sich während des Transports und der Lagerung ab, so dass Mischen zur Resuspendierung notwendig ist. • Vor der ersten Verwendung der Kartusche muss diese etwa 30 Mal vorsichtig umgeschwenkt werden; Schaumbildung vermeiden. • Vergewissern Sie sich, dass die Flasche mit den Mikropartikeln vollständig resuspendiert ist. Falls die Mikropartikel noch nicht vollständig resuspendiert sind, mischen Sie die Kartusche erneut durch vorsichtiges Umschwenken. Lagerung und Haltbarkeit Die ungeöffneten Reagenzien und Kalibratoren sind bei Lagerung zwischen 2-8°C bis zu dem auf dem Etikett angegebenen Verfallsdatum haltbar. HIT-Ab(PF4-H) Cartridge - Haltbarkeit im ACL AcuStar System nach Öffnen: 12 Wochen HIT-Ab(PF4-H) Calibrator 1 & 2 - Haltbarkeit im ACL AcuStar System nach Öffnen: 4 Stunden Für eine optimale Haltbarkeit sollten die Kalibratoren aus dem Gerät entnommen und im Kühlschrank bei 2-8°C im verschlossenen Originalgefäß aufbewahrt werden. Bestimmungsansatz Die ausführliche Beschreibung des Bestimmungsansatzes ist dem ACL AcuStar GeräteBedienerhandbuch zu entnehmen. Probenmaterial- und Gewinnung Plasma: 9 Teile frisches venöses Blut und 1 Teil Trinatriumcitrat-Lösung werden sorgfältig in einem silikonisierten Glasröhrchen gemischt. Hinweise zur Aufbereitung des Blutes sind den Empfehlungen des Deutschen Instituts für Normung – DIN 58 95 – oder dem CLSI Dokument H21-A5 zu entnehmen7. Eingefrorene Proben rasch bei 37°C auftauen und anschließend zentrifugieren. Aufgetaute Proben müssen innerhalb von 2 Stunden analysiert werden. Serum: Nach der Abnahme sollte das Serum vom Blutkuchen getrennt werden. Folgen Sie den Empfehlungen zu Lagerungsbedingungen von Proben gemäß des CLSI Dokuments H18-A38. Proben, die sichtbare Schwebstoffe enthalten, vor der Analyse zentrifugieren. Zusätzliche Reagenzien und Kontrollmaterialien Die folgenden Kontrollen sind nicht in der Packung enthalten und müssen zusätzlich bestellt werden: AcuStar HIT Kontrollen Art. Nr. 0009802122 Qualitätskontrolle Es werden zwei Kontroll-Level für ein umfangreiches Qualitätskontroll-Programm empfohlen9. Die Kontrollen HemosIL AcuStar HIT Low (niedriger Bereich) und High (hoher Bereich) stehen dafür zur Verfügung. Jedes Labor sollte für das Qualitätskontroll-Programm seinen eigenen Mittelwert und Standardabweichung ermitteln. An Tagen, an denen Messungen durchgeführt werden, sollte spätestens nach jeweils 8 Stunden eine Qualitätskontrolle gemessen werden. Weitere Informationen sind dem Geräte-Bedienerhandbuch zu entnehmen. Algorithmen zur Beurteilung der Qualitätskontrollergebnisse siehe z.B. Westgard et al.10. Siehe auch „Richtlinien der Bundesärztekammer zur Qualitätssicherung laboratoriumsmedizinischer Untersuchungen“ in der jeweils gültigen Fassung. Standardisierung des Kalibrators und der Kontrollmaterialien Die angegebenen Referenzwerte wurden bei mehreren Läufen am ACL AcuStar System mit spezifischen Reagenzchargen und gegen einen internen “Haus-Standard” ermittelt. Probenmatrix 41 gepaarte Citratplasma/Serum Proben wurden mit dem AcuStar HIT-Ab(PF4-H) Test analysiert. Die Konzentrationswerte wurden mittels einer Passing Bablok Regressionsanalyse verglichen. Dabei wurde der Plasmaprobenwert als Referenz (X-Achse) eingesetzt und der Korrelationskoeffizient mit der Pearson Korrelation berechnet. Slope und Intercept lagen bei 1,01 beziehungsweise 0,03, die Korrelation (r) ergab einen Wert von 0,993. Hinweis: Der ACL AcuStar berücksichtigt automatisch die Unterschiede in der Verdünnung bei Plasmabzw. Serumproben. Ergebnisse von Serumproben müssen nicht durch einen Umrechnungsfaktor korrigiert werden. Weitere Informationen sind dem im ACL AcuStar Geräte-Bedienerhandbuch zu entnehmen. Ergebnisse HemosIL AcuStar HIT-Ab(PF4-H) Ergebnisse werden in U/mL (frei gewählte Units) angegeben. Test Bereich: System ACL AcuStar 0,00 – 128,00 U/mL Hinweis: Für Proben mit mehr als 128,00 U/mL werden die Ergebnisse mit >128,00 U/mL angegeben und als > Norm markiert. Obwohl ein positives Ergebnis mit diesem Test die Anwesenheit von Heparin assoziierten Antikörpern anzeigen kann, bestätigt ein positives Ergebnis nicht die Diagnose einer HIT. Bei einigen Patienten können natürlicherweise Antikörper gegen PF4 auftreten. Einschränkungen HIT-Ab(PF4-H) Ergebnisse auf dem ACL AcuStar werden durch Konzentrationen an Hämoglobin bis zu 500 mg/dL, Bilirubin bis zu 18 mg/dL, Triglyceriden bis zu 1250 mg/dL, Heparin (LMW und unfraktioniert) bis zu 1 IU/mL und Rheumafaktor bis zu 800 IU/mL nicht beeinflusst. Der Test zeigt keinen Prozone-Effekt. Das Testprotokoll beinhaltet nach der Inkubation einen WaschSchritt, der den Prozone-Effekt verhindert. Instrumentation Laboratory Company - Bedford, MA 01730-2443 (USA) Instrumentation Laboratory SpA - V.le Monza 338 - 20128 Milano (Italy) Inmunoensayo quimioluminiscente totalmente automatizado para la detección de anticuerpos IgG, IgA e IgM que reaccionan con Factor Plaquetario 4 (FP4) cuando éste forma un complejo con la heparina, en el sistema ACL AcuStar™. Los anticuerpos asociados a la heparina se encuentran comúnmente en pacientes con trombocitopenia inducida por heparina o trombosis (TIH). Sumario y principio La trombocitopenia inducida por heparina (TIH) es una enfermedad provocada por un inmunocomplejo, que puede causar elevada morbilidad y mortalidad en pacientes que reciben terapia con heparina1. La TIH es una enfermedad paradójica ya que la administración de un anticoagulante para la prevención de trombosis, puede provocar un riesgo muy elevado de complicaciones trombóticas venosas y/o arteriales2. Se sospecha la existencia de TIH cuando los pacientes tratados con heparina no fraccionada (HNF) o con heparina de bajo peso molecular (HBPM) muestran un descenso del recuento de plaquetas superior al 50% del nivel basal, habitualmente entre el quinto y el décimo día del inicio del tratamiento3. También se han descrito casos con un inicio más temprano o más tardío2. El diagnóstico rápido es muy importante porque de confirmarse un cuadro de TIH, el tratamiento con heparina debe suspenderse y usarse anticoagulantes alternativos. La enfermedad de TIH de tipo II, el tipo inmunoalérgico, está causada por la aparición de anticuerpos activadores de las plaquetas, dirigidos principalmente contra el factor plaquetario 4 (FP4), cuando éste se encuentra formando un complejo con la heparina (FP4/H)4. Estos anticuerpos son la causa primaria de la inducción de la trombosis venosa y arterial. La actual hipótesis de trabajo es que una exposición temprana del individuo a los complejos de FP4, quizás inducida por factores endógenos no relacionados con la heparina, causaría la agregación del FP4 y la activación de las células B mediante las células T. En otra época, más tardía, estas células B podrían activarse de nuevo, transitoriamente, en presencia de agregados de FP4 inducidos por el tratamiento con heparina2. La evolución de la patología está principalmente asociada con los anticuerpos dependientes de heparina del tipo IgG1. Sin embargo la presencia de anticuerpos únicamente del tipo IgM y/o IgA se ha observado en algunos pacientes, incluyendo casos con complicaciones trombóticas5. El análisis de anticuerpos anti-FP4/H combinado con una apropiada supervisión médica constituyen una gran ayuda en el manejo de los pacientes con sospecha de TIH. Particularmente, un resultado negativo de anticuerpos anti-FP4/H puede dar soporte a la decisión clínica de descartar la presencia de TIH y de continuar con el tratamiento de heparina2. Un resultado débilmente positivo de anticuerpos antiFP4/H puede indicar que los anticuerpos no llegarán a activar a las plaquetas, mientras que una fuerte positividad puede indicar un alto riesgo de TIH. En ambos casos, se recomienda la confirmación con un test funcional. Antes de proceder con la confirmación o exclusión del diagnóstico de TIH debe realizarse una nueva supervisión clínica teniendo en cuenta el resultado de las pruebas de laboratorio2. El ensayo HemosIL AcuStar HIT-Ab(PF4-H) es un inmunoensayo quimioluminiscente de dos pasos constituido por partículas magnéticas recubiertas con FP4 en complejo con polivinil sulfonato (PVS) que capturan los anticuerpos anti-FP4/heparina, si estos están presentes en la muestra. Tras una incubación, separación magnética y lavado, se añade un trazador que consiste en una mezcla de 3 anticuerpos monoclonales marcados con isoluminol (anti-IgG humana, anti-IgA humana y anti-IgM humana), que se pueden unir a las IgG, IgA y/o IgM anti-FP4/heparina capturadas en las partículas. Tras una segunda incubación, separación magnética y lavado, se añaden reactivos que inician la reacción luminiscente y la luz emitida se mide con el sistema óptico del ACL AcuStar en unidades relativas de luz (RLU). Las RLU son directamente proporcionales a la concentración de anticuerpos anti-FP4/heparina que contiene la muestra. El ensayo ACL AcuStar HIT-Ab(PF4-H) utiliza un método de reducción de datos con una curva logística de 4 parámetros (4PLC) para generar una Curva Maestra. La Curva Maestra se encuentra predefinida y depende del lote, y se almacena en el instrumento a través del código de barras del cartucho. Con la medición de los calibradores, la Curva Maestra predefinida se transforma en una nueva curva de 4PLC, la de Trabajo, específica para el instrumento. Los valores de concentración de los calibradores se incluyen en los códigos de barras de los tubos de los calibradores. Composición El kit AcuStar HIT-Ab(PF4-H) está formado por: R HIT-Ab(PF4-H) Cartridge para 25 determinaciones (Cat. No. 0009802033): 1 cartucho que contiene 1 vial de una suspensión de partículas magnéticas recubiertas con el complejo FP4/PVS, 1 vial de tampón de ensayo, 1 vial de trazador formado por anticuerpos monoclonales anti-IgG, anti-IgM y anti-IgA humanas marcados con isoluminol y 1 vial de diluyente de muestra que se utiliza para la pre-dilución regular de las muestras. Los reactivos están en una solución tampón fosfato o Tris que contiene albúmina de suero bovino, suero fetal bovino, complejo FP4/PVS, IgG monoclonal de ratón, estabilizadores y conservante. C1 HIT-Ab(PF4-H) Calibrator 1 (Cat. No.0009802034): 1 x 1 mL de una solución de anticuerpo monoclonal humanizado anti-FP4/heparina en tampón Tris que contiene albúmina de suero bovino, estabilizadores y conservante, en tubo con código de barras. C2 HIT-Ab(PF4-H) Calibrator 2 (Cat. No. 0009802035): 1 x 1 mL de una solución de anticuerpo monoclonal humanizado anti-FP4/heparina en tampón Tris que contiene albúmina de suero bovino, estabilizadores y conservante, en tubo con código de barras. Los calibradores son específicos del lote y no pueden usares con otros lotes de reactivos. PRECAUCIONES Y ADVERTENCIAS: El material de origen humano utilizado en este producto ha sido analizado por métodos aprobados por la FDA y se ha encontrado negativo para el antígeno de superficie de la hepatitis B (HBsAg) y para anticuerpos anti-HCV y anti-HIV 1/2. Manejarlo con precaución como si fuese potencialmente infeccioso6. Todos los reactivos contienen menos del 0,1% de azida sódica, que puede formar azidas explosivas en contacto con tuberías de metal. Utilizar procedimientos adecuados para su desecho. Indicaciones de peligro: Ninguna Frases de Riesgo: Ninguna Frases de Seguridad: Ninguna Este producto es sólo para el diagnóstico in vitro. Cartucho HIT-Ab(PF4-H): Las micropartículas sedimentan durante el envío y el almacenamiento, por lo que se deben mezclar para conseguir su resuspensión. • Cuando se utiliza el cartucho por primera vez, debe invertirse suavemente 30 veces, evitando que se forme espuma. Hinweis: Positive Rheumafaktor Proben können den Wert einer bereits positiven HIT Probe erhöhen. 26 Patientenproben mit diagnostiziertem Antiphospholipid Syndrom (APS) wurden mit HemosIL AcuStar HIT-Ab(PF4-H) getestet. Alle 26 Proben reagierten negativ mit HemosIL AcuStar HIT-Ab(PF4-H). Dies zeigt, dass der Test von APS-Antikörpern nicht beeinflusst wird. In einer Studie zur Bestimmung der Kreuzreaktivitäten wurden 46 Proben mit den folgenden Bedingungen mit dem AcuStar HIT-Ab(PF4-H) Test untersucht: Paraproteine IgG oder IgM, erhöhte Level von IgG oder IgM, Rheumafaktor (RF) positiv und von schwangeren Frauen (mindestens 10% multipar). Patientengruppe N N (Positiv) % Positiv HIT-Ab(PF4-H) Rheumafaktor 10 0 0% Erhöhte IgG und IgM 20 0 0% Paraprotein IgG und IgM 6 0 0% Schwanger 10 0 0% Referenzbereiche HIT-Ab(PF4-H) Calibrator 1 & 2: Flüssigstabil. Mischung durch mehrmaliges Umschwenken vor der Verwendung, um die Homogenität des Kalibrators sicherzustellen. Schaumbildung vermeiden. Hinweis: Verwenden Sie die Reagenzien nicht, falls Sie eine Veränderung in der Erscheinung der Komponenten des Testkits beobachten oder falls Sie eine Beschädigungen des Materials feststellen. Aplicación Preparación DEUTSCH - Packungsbeilage Version 08/2013 • Falls die Mikropartikel sich nicht vollständig resuspendieren lassen, verwenden Sie die Kartusche nicht. • Wenn die Mikropartikel resuspendiert sind, stellen Sie die Kartusche auf eine stabile Oberfläche und entfernen Sie vorsichtig die rote Transportsicherung von der Kartusche. • Anschließend drücken Sie die beiden seitlichen Klappen der Bohrungskappe (grauer Teil) und üben Sie Druck auf die Oberseite der Kartusche aus bis die Kappe einrastet. Befindet sich die Kartusche in der eingerasteten Position, sollten die seitlichen Klappen nicht mehr sichtbar sein. Drehen Sie die offene Kartusche nicht auf den Kopf. • Sobald die Kartusche im Instrument platziert ist, werden zusätzlich periodische Mischvorgänge im Gerät durchgeführt. HIT-Ab(PF4-H) - 0009802032 Die Anwesenheit von PF4/H Antikörpern in der Normalbevölkerung wird nicht erwartet. Folgende Studien wurden durchgeführt, um den optimalen Cut-off von HemosIL AcuStar HIT-Ab(PF4-H) auf dem ACL AcuStar Analysensystem zu ermitteln. 150 Plasmaproben von offensichtlich gesunden Probanden (Blutspendern) wurden getestet. Das 95% Referenzintervall lag bei 0,07 -1,01 U/mL. Zusätzlich wurde eine Population von 91 Patienten (61 Citratplasmaproben und 30 Serumproben) unter Heparintherapie (UFH und LMWH) ohne klinischen Verdacht auf eine HIT untersucht. Das 95% Referenzintervall lag bei 0,04 – 2,27 U/mL. Abschließend wurde ein Methodenvergleich mit einem Serotonin Release Assay (SRA) bei 201 Plasmaproben von Patienten unter HIT-Verdacht durchgeführt (14 SRA positiv und 187 SRA negativ). Auf Grund der ROC-Analyse wurde der optimale Cut-off mit 1,00 U/mL bestimmt (83,1% Übereinstimmung, 95% CI = 77,2 - 88,0%). Basierend auf diesen Studienergebnissen konnte gezeigt werden, dass bei Patienten unter Heparintherapie HemosIL AcuStar HIT-Ab(PF4-H) Ergebnisse gleich oder größer 1,00 U/mL die Anwesenheit von HIT Antikörpern anzeigen können. Die Testergebnisse sollten bei der Diagnosestellung immer im Zusammenhang mit weiteren Informationen, wie z.B. dem klinischen Kontext, herangezogen werden. Testcharakteristik Präzision: Die Präzision im Lauf und von Tag zu Tag wurde bei mehreren Läufen bestimmt. ACL AcuStar Mittelwert (U/mL) VK % (im Lauf) VK % (Summe) HIT-Ab(PF4-H) Kontrolle niedriger Bereich 0.53 4.2 6.4 HIT-Ab(PF4-H) Kontrolle hoher Bereich 2.72 3.0 6.0 HIT-Ab(PF4-H) Plasmaprobe 1.70 5.7 6.2 Methodenvergleich: Es wurde ein in-house Methodenvergleich mit Plasma- und Serumproben unter Verwendung von zwei kommerziell verfügbaren FDA zugelassenen ELISA Tests durchgeführt. Die unten aufgeführten Ergebnisse basieren auf einem Cut-off von 1,00 U/mL für den ACL AcuStar. Die Gesamtübereinstimmung für Plasma und Serum lag bei: ELISA 1 ELISA 2 Plasmaproben Serumproben + - + AcuStar HIT-Ab(PF4-H) Ergebnisse + 81 18 + 45 1 - 11 156 - 4 75 Vergleichsmethode N % Co-Positivität (95% CI) Co-Negativität (95% CI) % Übereinstimmung (95% CI) ELISA 1 (Plasma) 266 88.0% (79.6% - 93.9%) 89.7% (84.1% - 93.8%) 89.1% (84.7% - 92.6%) ELISA 2 (Serum) 125 91.8% (80.4% - 97.7%) 98.7% (92.9% - 100.0%) 96.0% (90.9% - 98.7%) Klinische Leistungsfähigkeit: Es wurde eine Multicenter-Studie an drei Krankenhäusern mit 610 Proben (409 Citratplasma und 201 Serum) im Vergleich zu zwei kommerziell verfügbaren FDA zugelassenen ELISA Tests durchgeführt. Eine Klinik verwendete nur Serumproben, in den anderen beiden kamen nur Plasmaproben zum Einsatz. Die Ergebnisse daraus wurden kombiniert. Die Proben waren von Patienten unter Heparinbehandlung, die HIT ähnliche Symptome zeigten und folglich unter Verdacht standen an einer HIT zu leiden. Die unten aufgeführten Ergebnisse basieren auf einem Cut-off von 1,0 U/ml für den ACL AcuStar: ELISA 1 ELISA 2 Plasmaproben Serumproben + - + AcuStar HIT-Ab(PF4-H) Ergebnisse + 16 23 + 37 9 - 11 359 - 14 141 Vergleichsmethode N % Co-Positivität (95% CI) Co-Negativität (95% CI) % Übereinstimmung (95% CI) ELISA 1 (Plasma) 409 59.3% (38.8% - 77.6%) 94.0% (91.1% - 96.1%) 91.7% (88.6% - 94.2%) ELISA 2 (Serum) 201 72.5% (58.3% - 84.1%) 94.0% (88.9% - 97.2%) 88.6% (83.3% - 92.6%) Die Ergebnisse der Präzision, des Methodenvergleichs und der klinischen Studien sind mit spezifischen Reagenzien- und Kontrollchargen ermittelt worden. ESPAÑOL - Revisión Prospecto 08/2013 • Comprobar que las micropartículas estén totalmente resuspendidas. Si no lo están, continuar invirtiendo el cartucho hasta que se resuspendan completamente. • Si las micropartículas no se resuspenden completamente, NO UTILIZAR EL CARTUCHO. • Una vez que las micropartículas se han resuspendido, colocar el cartucho sobre una superficie sólida y sacar con cuidado la lengüeta roja de seguridad del cartucho. • Manteniendo el cartucho sobre la superficie sólida, presionar las dos pestañas situadas en el lateral de la tapa perforadora (parte gris) y presionar la parte superior del cartucho hasta que quede en posición de bloqueo. Una vez en la posición de bloqueo, las pestañas no deben ser visibles. No invertir el cartucho abierto. • Una vez colocado en el instrumento, el cartucho es sometido a una agitación adicional periódica. Calibradores 1 y 2 HIT-Ab(PF4-H): Son líquidos y se deben mezclar suavemente por inversión varias veces antes de usar para asegurar su homogeneidad. Evitar la formación de espuma. Atención: No utilice el reactivo si observar cualquier alteración en el aspecto de los componentes del kit o cualquier daño en el material de embalaje. Conservación y estabilidad de los reactivos Los reactivos y calibradores que no hayan sido abiertos son estables hasta la fecha de caducidad indicada en las etiquetas del cartucho y de los tubos si se conservan a 2-8°C. HIT-Ab(PF4-H) Cartridge - Estabilidad tras apertura en el instrumento ACL AcuStar: 12 semanas. HIT-Ab(PF4-H) Calibrator 1 & 2 - Estabilidad tras apertura en el instrumento ACL AcuStar: 4 horas. Para una estabilidad óptima, retirar los calibradores del sistema y conservarlos a 2-8°C en el vial original con tapón. Instrumento/procedimiento Consultar el manual de usuario del ACL AcuStar, donde se encuentran todas las instrucciones del ensayo. Recolección y preparación de las muestras Plasma: Recoger nueve partes de sangre venosa recién extraída en una parte de anticoagulante citrato trisódico. Para obtener más información sobre recolección, manejo y conservación de muestras, consultar el documento H21-A5 del CLSI7. Las muestras congeladas se deben descongelar rápidamente a 37°C. El ensayo se debe llevar a cabo en un plazo de 2 horas tras la descongelación. Suero: El suero debe separarse del coágulo después de la recolección. Seguir las recomendaciones del documento H18-A3 del CLSI para las condiciones de almacenamiento de las muestras8. Centrifugar las muestras que contengan partículas visibles antes de realizar el ensayo. Reactivos adicionales y plasmas de control Los siguientes reactivos no se incluyen en el kit y deben adquirirse por separado. AcuStar HIT Controls Cat. No. 0009802122 Control de calidad Se recomiendan dos niveles de control para realizar un programa completo de control de calidad9. Los controles HemosIL AcuStar HIT bajo y alto se han elaborado para dicho programa. Cada laboratorio debería establecer su propio promedio y su desviación estándar, además de implantar un programa de control de calidad para monitorizar los ensayos del laboratorio. Los controles deben analizarse como mínimo una vez en cada turno de 8 horas de acuerdo con las buenas prácticas de laboratorio. Consultar el manual de usuario del instrumento si se desea más información. Consultar la publicación de Westgard et al. para la identificación y resolución de situaciones anormales del control de calidad10. Trazabilidad de los calibradores y controles Los valores indicados se establecieron mediante múltiples determinaciones con el sistema ACL AcuStar utilizando lotes específicos de reactivos frente a un estándar interno. Tipo de muestra Se analizaron con el ensayo AcuStar HIT-Ab(PF4-H) 41 muestras pareadas de plasma citratado y suero. Los valores de concentración se compararon por regresión de Passing & Bablock utilizando los valores de la muestra de plasma como referencia (eje X) y se calculó el coeficiente de correlación de Pearson. La pendiente y la intersección fueron 1,01 y 0,03 respectivamente, y el coeficiente de correlación (r) fue 0,993. Atención: El sistema ACL AcuStar tiene en cuenta automáticamente la diferencia de dilución entre muestras de suero y de plasma. Valores obtenidos para muestras de suero no tienen que ser corregidos por un factor. Consultar el manual de usuario del ACL AcuStar si se desea más información. Resultados Los resultados del ensayo HemosIL AcuStar HIT-Ab(PF4-H) se reportan en U/mL (Unidades Arbitrarias HemosIL AcuStar HIT-Ab(PF4-H)). Rango del ensayo: Sistema ACL AcuStar 0,00 - 128,00 U/mL Atención: Los resultados de las muestras superiores a 128,00 U/mL serán reportados como >128,00 U/mL y marcados como >Norm. Aunque una reacción positiva al utilizar este ensayo pueda indicar la presencia de anticuerpos asociados a la heparina, la detección de anticuerpos, sin embargo, NO CONFIRMA el diagnóstico de trombocitopenia inducida por heparina (TIH). Algunos pacientes pueden tener anticuerpos FP4 de origen natural. HIT-Ab(PF4-H) - 0009802032 Utilisation Le réactif HemosIL HIT- Ab(PF4-H) est un dosage immunologique automatisé en chimiluminescence pour la détection des anticorps IgG, IgA et IgM réagissant avec le Facteur Plaquettaire 4 (PF4) complexé à l’héparine dans le plasma humain citraté et le sérum sur l’analyseur ACL AcuStar™. Les anticorps associés à l’héparine se rencontrent le plus souvent chez les patients développant une thrombocytopénie ou une thrombose induite par l’héparine (TIH). Principe La thrombocytopénie induite par l’héparine (TIH) est un syndrome induit par la formation de complexes immuns qui peuvent entraîner morbidité et mortalité chez les patients traités par l’héparine1. La TIH est un syndrome que l’on peut considérer comme paradoxal dans le cadre duquel un anticoagulant est administré afin de prévenir la survenue de thrombose, mais pour lequel l’événement majeur est un accroissement du risque de thrombose veineuse et/ou artérielle2. Une TIH est suspectée chez un patient traité par une héparine non fractionnée (HNF) ou de bas poids moléculaire (HBPM), lorsque chez celui-ci l’on constate une baisse de 50% du nombre de plaquettes par rapport au taux basal, et ce, typiquement 5 et 10 jours après le début du traitement anticoagulant3. Des cas de TIH plus précoces ou plus tardifs ont été également rapportés2. Un diagnostic rapide est important car le traitement à l’héparine doit être suspendu et une anticoagulation alternative doit être mise en place en cas de TIH confirmée. La TIH de type II, type immunoallergique, est liée au développement d’anticorps activant les plaquettes, majoritairement dirigés contre le Facteur Plaquettaire 4 complexé à l’héparine (PF4/H)4. Ces anticorps sont la première cause induisant des thromboses veineuses et artérielles. L’hypothèse de travail actuelle repose sur une exposition précoce à des complexes PF4, peut-être induits par des facteurs endogènes non hépariniques, entraînant la formation d’amas de PF4 et une réponse immune cellules T dépendante puis cellules B dépendante. Au cours de la vie, ces cellules B peuvent être activées lors de la formation d’amas de PF4 induite par un traitement à l’héparine2. Le développement d’une pathologie est le plus souvent associée à des anticorps héparine dépendants de type IgG1. Cependant, la présence d’anticorps seulement de type IgM et/ou IgA a été également observée chez des patients, associée à des complications thrombotiques5. Il a été montré que la détermination des anticorps anti-PF4/H associée à une évaluation clinique appropriée est particulièrement utile comme aide à la conduite thérapeutique chez des patients suspectés de TIH. En particulier, une réponse négative au test de détermination des anticorps anti-PF4/H vient à l’appui d’une décision clinique d’exclusion de la présence d’une TIH et de poursuite du traitement à l’héparine2. Une réponse positive faible pour la présence d’anticorps anti-PF4/H peut indiquer que ces anticorps n’activent pas les plaquettes, par contre une réponse positive forte peut être l’indicateur d’un risque élevé de TIH. Dans chaque cas, la confirmation par un test fonctionnel est recommandée. Une réévaluation clinique associée aux données du laboratoire pourrait être réalisée avant un diagnostic de confirmation ou d’exclusion de TIH2. Le réactif HemosIL AcuStar HemosIL HIT- Ab(PF4-H) est un test immunlogique en 2 étapes utilisant une détection en chimiluminescence. Dans un premier temps, le PF4 complexé au polyvinyl sulfonate (PVS) adsorbé sur les particules magnétiques peut capturer, s’ils sont présents, les anticorps Anti- PF4/ Héparine de l’échantillon. Après incubation puis séparation des particules magnétiques et lavage, un traceur consistant en des anticorps monoclonaux (anti-IgG, anti-IgA et anti-IgM humaines) marqué à l’Isoluminol est ajouté, pouvant se fixer sur les Anti- PF4/Héparine IgG, IgA et IgM capturés sur les particules. Après une seconde incubation, séparation des particules magnétiques et lavage, 2 révélateurs sont ajoutés à ces particules. La réaction de chimiluminescence résultante est mesurée par le système optique d’ACL AcuStar et le résultat exprimé en unités de lumière relative (ULRs). Les ULRs sont directement proportionnelles à la concentration d’anticorps Anti- PF4/Héparine de l’échantillon. Le test ACL AcuStar HIT- Ab(PF4-H) utilise une courbe de calibration usine logarithmique 4 paramètres (4PLC) correspondant à un algorithme mathématique générant une courbe usine. Cette courbe de calibration usine est prédéfinie et spécifique du lot. Elle est mémorisée dans l’analyseur via le code barres de la cartouche. Après analyse des calibrateurs, la courbe usine prédéfinie est transformée en courbe de travail 4PLC spécifique de l’instrument. Les concentrations des calibrateurs sont indiquées dans les codes barres des tubes pour calibration. Composition La trousse AcuStar HIT Ab(PF4-H) contient: R Cartouche HIT Ab(PF4-H) pour 25 déterminations (Réf. 0009802033): 1 cartouche contient 1 flacon d’une suspension de particules magnétiques adsorbées avec du complexe PF4/PVS, 1 flacon de tampon, 1 flacon de traceur consistant en des anticorps anti-IgG, anti-IgA et anti-IgM humaines marqué à l’Isoluminol et un flacon de diluant utilisé pour la pré-dilution ou la dilution de l’échantillon lors des réanalyses. Les réactifs sont en tampon phosphate ou Tris contenant également de l’albumine bovine sérique, du sérum de veau fœtal, du complexe PF4/PVS, des IgG monoclonales de souris, des stabilisants et un conservateur. C1 HIT Ab(PF4-H) Calibrator 1 (Réf. 9802034): 1 tube code barré de 1 ml d’une solution d’Anticorps monoclonal humain anti-PF4-Heparin en tampon Tris, contenant également de l’albumine bovine sérique, des stabilisants et un conservateur. C2 HIT Ab(PF4-H) Calibrator 2 (Réf. 9802035): 1 tube code barré de 1 ml d’une solution d’Anticorps monoclonal humain anti-PF4-Heparin en tampon Tris, contenant également de l’albumine bovine sérique, des stabilisants et un conservateur. Les calibrateurs sont spécifiques du lot et ne peuvent pas être utilisés avec d’autres lots de réactifs. PRECAUTIONS: Ces réactifs contiennent des produits d’origine humaine. Ils ont été trouvés négatifs pour les anticorps anti VIH 1/2, anti VHC et l’antigène de surface de l’hépatite B (AgHBs), en utilisant des méthodes approuvées par la FDA. Ces réactifs sont à manipuler comme s’ils étaient potentiellement infectieux.6 Tous les réactifs du coffret contiennent moins de 0,1% d’azide de sodium comme conservateur. L’azide de sodium peut former des azides de plomb ou de cuivre avec les canalisations du laboratoire, susceptibles d’exploser par percussion. Pour cette raison, il est conseillé d’éliminer les réactifs suivant les procédures en vigueur localement. Classification risque: Aucune Phrases risque: Aucune Phrases sécurité: Aucune Ce produit est à usage diagnostique in vitro. Préparation Cartouche HIT Ab(PF4-H) : Les microparticules se déposent durant le transport et le stockage et nécessitent d’être remises en suspension. - Lors de la première utilisation, agiter doucement la cartouche en effectuant une trentaine d’inversions et en évitant la formation de mousse. - S’assurer de la complète remise en suspension des microparticules. Si tel n’est pas le cas, poursuivre l’agitation jusqu’à complète remise en suspension. Limitaciones/sustancias interferentes Los resultados de HIT-Ab(PF4-H) no son afectados por la hemoglobina hasta 500 mg/dL, por la bilirrubina hasta 18 mg/dL, por los triglicéridos hasta 1250 mg/dL, por la heparina (de bajo peso molecular y no fraccionada) hasta 1 UI/mL y por el factor reumatoide hasta 800 UI/mL. El ensayo no muestra efecto prozona. El protocolo de ensayo tiene un paso de lavado después de la incubación de la muestra que evita el efecto prozona. Atención: Muestras positivas de factor reumatoide pueden incrementar el valor de un resultado ya positivo de TIH. Se probaron con el ensayo HemosIL AcuStar HIT-Ab(PF4-H) veinte y seis muestras de pacientes diagnosticados con Síndrome Antifosfolípidos (SAF). Todas las 26 muestras reportaron negativo con HemosIL AcuStar HIT-Ab(PF4-H), lo que demuestra que el ensayo no es afectado por los anticuerpos SAF. En un estudio de reacciones cruzadas, se probaron 46 muestras de las siguientes condiciones con el ensayo AcuStar HIT-Ab(PF4-H): muestras con paraproteínas IgG o IgM, con altos niveles de IgG o IgM, positivas de factor reumatoide (RF) y de mujeres embarazadas (al menos 10% multíparas). Grupo de muestras Factor reumatoide IgG e IgM elevadas Paraproteinas IgG e IgM Embarazadas N 10 20 6 10 N (Positivas) % Positivas de HIT-Ab (PF4-H) 0 0% 0 0% 0 0% 0 0% Valores esperados En una población normal la presencia de anticuerpos FP4/H no es esperada. Se llevó a cabo una serie de estudios para comprobar el valor de corte óptimo de HemosIL AcuStar HIT-Ab(PF4-H) en el sistema ACL AcuStar como se describe abajo. Se probaron 150 muestras de plasma de individuos aparentemente sanos (donantes de sangre). El intervalo de referencia 95% fue de 0,07 - 1,01 U/mL. Además, se probó una población de 91 muestras (61 plasmas citratados y 30 sueros) de pacientes expuestos a la heparina (HNF y HBPM) sin sospecha clínica de TIH. El intervalo de referencia 95% fue de 0,04 - 2,27 U/mL. Finalmente, una comparación de métodos con el ensayo de Liberación de Serotonina (SRA) utilizando 201 muestras de plasma de pacientes con sospecha de TIH (14 de ellos SRA positivos y 187 SRA negativos) indicó que el valor de corte óptimo determinado por análisis ROC era 1,00 U/mL. (Concordancia de 83,1%, 95% IC= 77,2% - 88,0%). En base a estos estudios se ha determinado que en muestras de pacientes tratados con heparina, los resultados de HemosIL AcuStar HIT-Ab(PF4-H) iguales o superiores a 1,00 pueden indicar la presencia de anticuerpos TIH. Los resultados del ensayo se deben utilizar juntamente con otras informaciones, incluso el contexto clínico, para realizar un diagnóstico. Características técnicas Precisión: Se evaluó la precisión intraserie y la total (serie a serie y día a día) en múltiples series. ACL AcuStar Media (U/mL) CV% (Intraserie) CV% (Total) Control bajo HIT-Ab(PF4-H) 0,53 4,2 6,4 Control alto HIT-Ab(PF4-H) 2,72 3,0 6,0 Muestra de plasma HIT-Ab(PF4-H) 1,70 5,7 6,2 Comparación de métodos: Se realizó una comparación de métodos internamente, con muestras de plasma y suero, utilizando 2 ensayos de ELISA aprobados por la FDA disponibles comercialmente. Los resultados que se resumen a continuación están basados en un valor de corte de 1,00 U/mL para el AcuStar. La concordancia global para plasma y suero fue: ELISA 1 Muestras ELISA 2 Muestras de plasma de suero + - + AcuStar HIT-Ab(PF4-H) resultados + 81 18 + 45 1 - 11 156 - 4 75 Referencia N % Co-Positividad (95% IC) % Co-Negatividad (95% IC) % Concordancia (95% IC) ELISA 1 Plasma 266 88,0% (79,6% - 93,9%) 89,7% (84,1% - 93,8%) 89,1% (84,7% - 92,6%) ELISA 2 Suero 125 91,8% (80,4% - 97,7%) 98,7% (92,9% - 100,0%) 96,0% (90,9% - 98,7%) Comportamiento clínico: Se realizó un estudio multicéntrico en 3 hospitales con 610 muestras (409 plasmas citratados y 201 sueros) usando 2 ensayos de ELISA aprobados por la FDA disponibles comercialmente. Un hospital utilizó sólo muestras de suero mientras que los otros dos hospitales utilizaron sólo plasmas y los resultados se combinaron. Las muestras eran de pacientes expuestos a la heparina que presentaron síntomas relacionados a la TIH y, por tanto, con sospecha de TIH. Los resultados que se resumen a continuación están basados en un valor de corte de 1,00 U/mL para el AcuStar. ELISA 1 Muestras ELISA 2 Muestras de plasma de suero + - + AcuStar HIT-Ab(PF4-H) resultados + 16 23 + 37 9 - 11 359 - 14 141 Referencia N % Co-Positividad (95% IC) % Co-Negatividad (95% IC) % Concordancia (95% IC) ELISA 1 Plasma 409 59,3% (38,8% - 77,6%) 94,0% (91,1% - 96,1%) 91,7% (88,6% - 94,2%) ELISA 2 Suero 201 72,5% (58,3% - 84,1%) 94,0% (88,9% - 97,2%) 88,6% (83,3% - 92,6%) Los resultados de precisión, comparación de métodos y comportamiento clínico se obtuvieron utilizando lotes concretos de reactivos y controles. FRANÇAIS - Révision de la notice 08/2013 - Si les microparticules n’arrivent pas être remises en suspension, NE PAS UTILISER LA CARTOUCHE. - Une fois les microparticules remises en suspension, placer la cartouche sur une surface stable, retirer doucement la patte de sécurité rouge de la cartouche. - La cartouche en place sur une surface stable, presser sur les deux pattes situées latéralement par rapport à la fermeture (partie grise) et appliquer une pression au sommet de la cartouche afin que celle-ci se mette en position de verrouillage. Une fois en position de verrouillage les pattes ne sont plus visibles. Ne pas inverser la cartouche après ouverture. - Une fois la cartouche mise en place dans l’instrument, des agitations périodiques sont réalisées à bord. HIT Ab(PF4-H) calibrator 1 & 2: les calibrateurs sont sous forme liquide prête à l’emploi et doivent être mélangés doucement par plusieurs inversions afin de s’assurer de leur homogénéité avant utilisation. Eviter la formation de mousse. Note: Ne pas utiliser les réactifs si vous constatez un changement dans l’apparence des composants contenus dans le coffret ou si l’emballage des matériels est endommagé. Conservation et stabilité des réactifs Conservés à 2-8°C, les réactifs et calibrateurs non ouverts sont stables jusqu’à la date de péremption indiquée sur les étiquettes de la cartouche et des tubes. Cartouche HIT Ab(PF4-H) - La stabilité sur l’analyseur ACL AcuStar après ouverture est de 12 semaines HIT Ab(PF4-H) Calibrator 1 & 2 - La stabilité sur l’analyseur ACL AcuStar après ouverture est de 4 heures. Pour une stabilité optimale, retirer les calibrateurs du système et les conserver hors de l’analyseur à 2-8°C dans le flacon d’origine bouché. Procédures de test/Instrument Se référer au mode d’emploi de ACL AcuStar pour des informations complètes sur les procédures de dosage. Recueil des spécimens et préparation Plasma : 9 parts de sang fraîchement prélevé sont collectées avec 1 part de citrate trisodique. Se référer au document CLSI H21-A5 ou au document GEHT (STV, numéro spécial, 1-40, 1998 et ses modifications parues sur le site du GEHT en 2007) pour plus d’informations sur le prélèvement des échantillons, leur manipulation et leur stockage.7 Les spécimens congelés doivent être décongelés rapidement à 37°C. Après décongélation le dosage doit être réalisé dans les 2 heures. Sérum : Après centrifugation, le sérum doit être séparé du caillot. Se référer au document CLSI H18-A3 pour plus d’informations sur le stockage des échantillons.8 Centrifuger les spécimens présentant des particules visibles avant dosage. Réactifs auxiliaires et plasmas de contrôle Non fournis avec la trousse, ils doivent faire l’objet d’une commande séparée. AcuStar HIT Controls Réf. 0009802122 Contrôle de qualité Deux niveaux de contrôle sont recommandés pour un programme de contrôle de qualité complet.9 Les contrôles HemosIL AcuStar HIT Controls Bas et Haut sont spécifiques à ce programme. Chaque laboratoire doit établir sa propre moyenne et déviation standard et son programme de contrôle de qualité afin de vérifier l’état de fonctionnement de son système analytique. A titre d’exemple, les contrôles pourraient être analysés une fois toutes les 8 heures en regard des bonnes pratiques de laboratoire. Se référer au mode d’emploi de l’instrument pour des informations complémentaires. Se reporter à Westgard et al pour l’identification et la résolution des contrôles hors limites.10 Traçabilité des valeurs des calibrateurs et contrôles Les valeurs reportées dans les notices sont déterminées à partir d’essais multiples réalisés sur le système ACL AcuStar, en utilisant des lots spécifiques de réactifs, et ce, par rapport à un Standard Interne. Matrice échantillon 41 paires d’échantillons de plasmas citratés / séra ont été analysées avec le réactif HemosIL AcuStar HIT Ab(PF4-H). Les valeurs obtenues ont été comparées par la méthode de régression Passing et Bablok en utilisant les valeurs obtenues sur plasma comme référence (axe des abscisses-X), et le coefficient de corrélation déterminé par la méthode de Pearson. La pente et l’ordonnée à l’origine sont 1,01 et 0,03 respectivement, le coefficient de corrélation (r) est de 0,993. Note: l’analyseur ACL AcuStar tient compte automatiquement des différences de dilutions entre échantillons de plasma et de sérum. Aussi, les résultats obtenus pour les échantillons de sérum n’ont pas besoin d’être corrigés par un facteur. Se référer au mode d’emploi de l’instrument ACL AcuStar pour des informations complémentaires. Résultats Les résultats HemosIL AcuStar HIT Ab(PF4-H) sont reportés en U/ml (HemosIL AcuStar HIT Ab(PF4-H) unités arbitraires). Domaine de mesure: Analyseur ACL AcuStar 0,00 – 128 000 U/ml Note : Pour les spécimens > 128 000 U/ml les résultats sont rapportés comme > 128 000 U/ml et indiqués comme > Norm. Une réaction positive obtenue avec ce test peut indiquer la présence d’anticorps associés à l’héparine. Cependant, la détection des anticorps NE CONFIRME PAS le diagnostic de Thrombocytopénie induite par l’Héparine (TIH). Certains patients peuvent avoir naturellement des anticorps anti- PF4. Limites de la méthode et substances interférant avec celle-ci Les résultats HIT Ab(PF4-H) sur l’analyseur ACL AcuStar ne sont pas affectés par l’hémoglobine jusqu’à 500 mg/dl, par la bilirubine jusqu’à 18 mg/dl (180 mg/l), par les triglycérides jusqu’à 1 250 mg/ dl (12,5 g/l), l’héparine (Bas Poids Moléculaire et Non Fractionnée) jusqu’à 1 UI/ml et par les facteurs rhumatoïdes jusqu’à 800 UI/ml. Aucun effet de zone n’a été constaté. Le protocole du test comporte une étape de lavage après l’incubation ce qui permet de prévenir tout effet de zone. Note : des échantillons positifs en facteurs rhumatoïdes peuvent avoir une valeur HIT déjà positive, augmentée. Vingt six échantillons diagnostiqués comme ayant un Syndrome des Antiphospholipides (SAPL) ont été testés avec le réactif HemosIL AcuStar HIT Ab(PF4-H). Ces 26 échantillons ont été trouvés négatifs avec le réactif HemosIL AcuStar HIT Ab(PF4-H) montrant ainsi que le test n’est pas affecté par les anticorps SAPL. Lors d’une étude de réactivités croisées, 46 échantillons comme indiqué ci-dessous, ont été testés avec le réactif HIT Ab(PF4-H) : contenant des paraprotéines IgG ou IgM, avec des taux élevés d’IgG ou IgM, positifs pour les facteurs rhumatoïdes, ou issus de femmes enceintes (au moins 10%) multipares. Groupes de patients N N (Positifs) % Positifs HIT Ab(PF4-H) Facteurs rhumatoïdes 10 0 0,0% IgG et IgM élevées 20 0 0,0% Paraprotéines IgG et IgM 6 0 0,0% Femmes enceintes 10 0 0,0% Valeurs attendues La présence d’anticorps anti PF4/Héparine n’est pas rencontrée. Une série d’études a été réalisée afin de déterminer le cut-off optimal pour le réactif HemosIL AcuStar HIT Ab(PF4-H).sur l’analyseur ACL AcuStar, comme décrit ci-dessous. 150 échantillons de plasma issus de donneurs apparemment sains (donneurs de banques du sang) ont été testés. L’intervalle de référence 95% était 0,07 – 1,01 U/ml. De plus, une population 91 échantillons (61 plasmas citratés et 30 sera) provenant de patients exposés à l’héparine (Héparine non fractionnée et de bas poids moléculaire) sans suspicion clinique de TIH ont été également testés. L’intervalle de référence 95% était 0,04 – 2,27 U/ml. Finalement une comparaison de méthodes contre le Serotonin Release Assay (SRA) portant sur 201 échantillons de plasma issus de patients suspectés de TIH (14 SRA positifs et 187 SRA négatifs) indique que le cut-off optimal déterminé par la méthode ROC, était de 1,00 U/ml (Agrément 83.1%, IC 95% = 77,2% - 88,0%). En relation avec ces études, il a été déterminé que sur des échantillons de patients traités à l’héparine, les résultats obtenus avec le réactif HemosIL AcuStar HIT Ab(PF4-H) supérieurs ou égaux à 1,00 U/ ml peuvent indiqués la présence d’anticorps en relation avec une TIH. Les résultats du test peuvent être utilisés avec d’autres informations, incluant le contexte clinique, pour poser un diagnostic. Caractéristiques et performances Fidélité: La répétabilité (CV% intra séries) et la reproductibilité (CV% inter séries et de jour à jour) ont été évaluées au cours d’essais multiples. ACL AcuStar Moyenne (U/mL) CV%(intra séries) CV%(Total) Low HIT-Ab(PF4-H) Control 0,53 4.2 6,4 High HIT-Ab(PF4-H) Control 2,72 3.0 6,0 HIT-Ab(PF4-H) plasma 1,70 5.7 6,2 Comparaison de méthodes: Une comparaison de méthodes interne a été réalisée avec des échantillons de plasma et de sérum en utilisant des trousses commerciales ELISA agréées par la FDA. Les résultats sont résumés ci-dessous, considérant un cut-off de 1,00 U/ml pour AcuStar. L’agrément global (%) pour plasma et sérum était : Test ELISA 1 Test ELISA 2 Echantillons de plasma Echantillons de sérum + - + Résultats AcuStar HIT-Ab(PF4-H) + 81 18 + 45 1 - 11 156 - 4 75 Méthode N % Co-Positivité Co-Négativité % Agrément (95% CI) (95% CI) (95% CI) Test ELISA 1 Plasma 266 88.0% (79.6% - 93.9%) 89.7% (84.1% - 93.8%) 89.1% (84.7% - 92.6%) Test ELISA 2 Sérum 125 91.8% (80.4% - 97.7%) 98.7% (92.9% - 100.0%) 96.0% (90.9% - 98.7%) Performances Cliniques : Une étude multicentrique a été réalisée dans 3 hôpitaux et a porté sur 610 échantillons (409 plasmas citratés et 201 sera) en utilisant 2 trousses commerciales ELISA agréées par la FDA. Un hôpital n’a utilisé que des sera, les deux autres ont uniquement utilisés des échantillons de plasma et les résultats ont été combinés. Les échantillons provenaient de 3 groupes différents de patients exposés à l’héparine, montrant des symptômes en relation avec la TIH et suspectés de TIH. Les résultats sont résumés ci-dessous et sont basés sur un cut-off de 1,00 U/ml pour AcuStar. Test ELISA 1 Test ELISA 2 Echantillons de plasma Echantillons de sérum + - + Résultats AcuStar HIT-Ab(PF4-H) + 16 23 + 37 9 - 11 359 - 14 141 Méthode N % Co-Positivité Co-Négativité % Agrément de comparaison (95% CI) (95% CI) (95% CI) Test ELISA 1 Plasma 409 59.3% (38.8% - 77.6%) 94.0% (91.1% - 96.1%) 91.7% (88.6% - 94.2%) Test ELISA 2 Sérum 201 72.5% (58.3% - 84.1%) 94.0% (88.9% - 97.2%) 88.6% (83.3% - 92.6%) Les résultats de la fidélité, la comparaison de méthodes et l’étude clinique ont été obtenus en utilisant des lots spécifiques de réactifs et de contrôles. T3800-4117 R1 08/2013 HemosIL® AcuStar HIT-Ab(PF4-H) - 0009802032 ITALIANO - Revisione dell'inserto 08/2013 Utilizzo Test immunologico in chemiluminescenza completamente automatico per la determinazione quantitativa degli anticorpi IgG, IgA e IgM anti-PF4/Eparina sull’analizzatore ACL AcuStar™. Anticorpi associati all’eparina si possono riscontrare in pazienti con Trombocitopenia Indotta da Eparina (HIT) o con Trombosi. Principio del metodo La Trombocitopenia Indotta da Eparina (HIT) è una malattia autoimmune che può portare alla morte pazienti in terapia eparinica1. La HIT viene considerata una “malattia paradosso” in quanto un anticoagulante somministrato per prevenire un evento trombotico in realtà provoca una trombosi. La HIT comporta un incremento del rischio di trombosi venosa e/o arteriosa2. La HIT si manifesta in pazienti trattati con eparine non frazionate (ENF) o con eparine a basso peso molecolare (EBPM) con una riduzione della conta piastrinica superiore al 50 % rispetto ai valori basali, tipicamente fra il 5° e il 10° giorno dall’inizio del trattamento3. Casi di insorgenza precoce o ritardata di HIT sono stati comunque evidenziati2. Diagnosticare la HIT è molto importante poiché in casi di pazienti positivi alla HIT deve essere sospeso il trattamento in corso ed avviato un trattamento con un anticoagulante differente. La HIT di tipo 1 è una trombocitopenia precoce, transitoria, che si risolve spontaneamente senza che sia necessario sospendere il farmaco. Questa è la forma più comune e si riscontra nel 10-20% dei pazienti trattati con eparina. Non ha una base immunologica e raramente si associa a trombosi periferica. La HIT di tipo 2 è una forma di trombocitopenia su base immunologica il cui meccanismo è mediato da anticorpi IgG eparina-dipendenti diretti contro il complesso PF4/eparina (PF4/E)4. Questi anticorpi sono la causa primaria dell’insorgenza di una trombosi venosa o arteriosa. L’ipotesi attuale è che una precoce esposizione ai complessi con PF4, forse indotta da fattori endogeni e non da eparina, porti ad un clustering del PF4 e ad una modifica delle cellule B a cellule T. In seguito, le cellule B tornano ad essere transitoriamente attivate quando i cluster di PF4 sono dovuti a trattamento con Eparina2. Lo sviluppo della patologia è legata soprattutto ad anticorpi IgG eparina-dipendenti1. Tuttavia anche la sola presenza di anticorpi IgM e/o IgA, osservata in alcuni pazienti, può essere associata a complicazioni trombotiche5. Il test per la rilevazione di anticorpi anti-PF4/E associato ad una adeguata valutazione clinica, ha dimostrato di essere molto utile come aiuto nella gestione dei pazienti con sospetta HIT. In particolare, un risultato negativo può essere d’aiuto alla decisione clinica di escludere la presenza di HIT e quindi continuare con la terapia eparinica2. Una debole positività del test può indicare che gli anticorpi non sono in grado di attivare le piastrine, mentre una forte positività può indicare un elevato rischio di HIT. In entrambi i casi si raccomanda la conferma della positività con un test funzionale. La conferma o meno della diagnosi dovrebbe essere supportata da una valutazione clinica accompagnata da dati di laboratorio2. Il kit HemosIL AcuStar HIT-Ab(PF4-H) è un test immunologico a due fasi in chemiluminescenza totalmente automatizzato che utilizza delle particelle magnetiche adese con PF4 legato al polivinil-sulfonato (PVS) per la ricerca di anticorpi diretti contro l’eparina in pazienti con sospetta HIT. Dopo una fase di incubazione, separazione magnetica e di lavaggio, viene aggiunto un tracciante costituito da una miscela di tre anticorpi (umano anti-IgG, umano anti-IgM e umano anti-IgA) che cattura, se presenti, gli anticorpi anti-PF4/E isotipo IgG, IgA e/o IgM del campione. Dopo una seconda fase di incubazione, separazione magnetica e lavaggio, sono aggiunti i reagenti (trigger) che danno l’avvio alla reazione di luminescenza e la luce emessa è misurata come unità relative luminose (RLUs) dal sistema ottico dell’ACL AcuStar. Le RLUs sono direttamente proporzionali alla concentrazione di anticorpi anti-PF4/E nel campione. Il metodo ACL AcuStar HIT-Ab(PF4-H) utilizza, per l’elaborazione dei dati, una curva di calibrazione a 4 Parametri (4PLC) per generare la Curva di Riferimento. La Curva di Riferimento è lotto dipendente ed è memorizzata nello strumento attraverso il codice a barre della cartuccia. Con la determinazione dei calibratori, la Curva di Riferimento predefinita è trasformata in una nuova Curva di Lavoro 4PLC, specifica per lo strumento. I valori di concentrazione dei calibratori sono presenti nei codici a barre posti sulle provette di plastica dei calibratori. Composizione Il kit AcuStar HIT-Ab(PF4-H) è composto da: R HIT-Ab(PF4-H) Cartridge per 25 determinazioni (Cat. No. 0009802033): 1 cartuccia contiene 1 flacone di una sospensione di particelle magnetiche adese con il complesso PF4/PVS, 1 flacone di tampone, 1 flacone di tracciante costituito da una miscela di anticorpi umani anti- IgG, IgA e IgM marcati con isoluminolo, e 1 flacone di diluente campione per la prediluizione del campione. I reagenti sono in tampone fosfato o borato e contengono una soluzione di albumina bovina serica, siero fetale bovino, complesso PF4/PVS, IgG monoclonale di topo, stabilizzanti e conservanti. C1 HIT-Ab(PF4-H) Calibrator 1 (Cat. No.0009802034): 1 provetta di plastica con barcode da 1 mL di una soluzione con di anticorpi anti-PF4/E di origine umana in soluzione salina con siero fetale bovino, stabilizzanti e conservanti. C2 HIT-Ab(PF4-H) Calibrator 2 (Cat. No. 0009802035): 1 provetta di plastica con barcode da 1 mL di una soluzione con di anticorpi anti-PF4/E di origine umana in soluzione salina con siero fetale bovino, stabilizzanti e conservanti. I calibratori sono lotto dipendenti e non possono essere utilizzati con altri lotti di reagenti. ATTENZIONE: Il materiale di origine umana contenuto nel kit è stato verificato all’origine, con metodi raccomandati dalla FDA, l’assenza dell’antigene di superficie dell’epatite B (HBsAg) e degli anticorpi anti-HCV e anti-HIV 1/2. Trattare come potenzialmente infetto6. Tutti i reagenti contengono meno dello 0,1% di sodio azide che potrebbe formare azidi esplosive a contatto con tubature metalliche. Prendere le dovute precauzioni per lo smaltimento. Simbolo di pericolo: nessuno Frasi di rischio: nessuno Consigli di prudenza: nessuno Per uso diagnostico in vitro. Preparazione HIT-Ab(PF4-H) Cartridge: Le microparticelle contenute nel kit devono essere risospese, in quanto durante la spedizione e lo stoccaggio, possono essersi depositate sul fondo della confezione. • Prendere la cartuccia da utilizzare e capovolgere gentilmente per 30 volte, evitando la formazione di schiuma. • Assicurarsi della completa risospensione delle microparticelle. Se le microparticelle non sono completamente risospese, continuare a capovolgere nuovamente la cartuccia per inversione fino a verificare la totale risospensione delle particelle. • Se le microparticelle non si risospendono, NON USARE LA CARTUCCIA. • Una volta che le microparticelle sono state risospese, posizionare la cartuccia su una superficie solida e rimuovere delicatamente la linguetta rossa di sicurezza. • Mantenere la cartuccia su una superficie solida, premere le due scanalature sui lati del tappo foratore (parte grigia) e spingere sulla parte superiore della cartuccia fino al blocco. Una volta in posizione, le due scanalature non devono essere visibili. Non invertire la cartuccia aperta. • Quando la cartuccia è collocata sullo strumento, viene eseguita periodicamente una miscelazione. Antifosfolipidi confermata e nessuno di essi è risultato positivo, dimostrando così che il kit HemosIL AcuStar HIT-Ab(PF4-H) non è influenzato da questa patologia. In uno studio di cross-reattività sono stati analizzati 46 campioni con il test AcuStar HIT-Ab(PF4-H): contenenti paraproteine IgG o IgM, con elevati valori di IgG o IgM, positivi al Fattore Reumatoide (FR) e da donne in gravidanza (almeno il 10% di esse hanno avuto più di una gravidanza). Gruppo N N (Positivi) % Positivi con HIT-Ab (PF4-H) Fattore Reumatoide 10 0 0% IgG e IgM elevati 20 0 0% Paraproteine IgG e IgM 6 0 0% Donne in gravidanza 10 0 0% Valori attesi HIT-Ab(PF4-H) Calibrator 1 & 2: I calibratori sono in forma liquida e devono essere miscelati per inversione alcune volte, assicurandosi della omogeneità prima dell’uso. Evitare la formazione di schiuma. Nota: Non utilizzare il reagente se si osserva una differenza rispetto agli atri reagenti o se la cartuccia risulta danneggiata. Conservazione e stabilità dei reagenti I reagenti e i calibratori sigillati sono stabili a 2-8°C fino alla data di scadenza stampata sull’etichetta. HIT-Ab(PF4-H) Cartridge - Stabilità a bordo dei sistemi ACL AcuStar dopo l’apertura 12 settimane. HIT-Ab(PF4-H) Calibrator 1 & 2 - Stabilità a bordo dei sistemi ACL AcuStar dopo l’apertura 4 ore. Rimuove i calibratori dal sistema e conservarle a 2-8°C nelle provette di plastica chiuse con il tappo per una migliore stabilità. Metodo Per le metodiche e le procedure di lavoro consultare il Manuale dell’Operatore ACL AcuStar. Preparazione dei campioni Plasma: Aggiungere a nove parti di sangue fresco venoso una parte di trisodio citrato. Per informazioni aggiuntive sulla preparazione, il trattamento e la conservazione dei campioni, fare riferimento al documento CLSI H21-A57. Scongelare rapidamente a 37°C i campioni congelati. Analizzare i campioni entro 2 ore dallo scongelamento. Siero: Dopo la raccolta, il siero deve essere separato dalla parte coagulata. Seguire le raccomandazioni del documento CLSI H18-A3 sulle condizioni di conservazione dei campioni8. I campioni che mostrano visibilmente la presenza di particelle, devono essere centrifugati prima di essere analizzati. Reagenti ausiliari e plasmi di controllo I seguenti reattivi non sono forniti insieme al kit e devono essere ordinati separatamente. AcuStar HIT Controls Cat. No. 0009802122 Controllo di qualità Per un completo programma di controllo di qualità si raccomanda l’uso di due livelli di controllo9. I controlli AcuStar HIT Low e High sono indicati per questo programma. Ogni laboratorio deve definire i valori medi e le deviazioni standard per i controlli utilizzati nel proprio programma di controllo di qualità. I controlli dovrebbero essere analizzati almeno una volta ogni 8 ore nel corso delle sedute di analisi, secondo la consueta attività di laboratorio. Riferirsi al Manuale dell’Operatore per ulteriori informazioni. Per i casi particolari consultare all’articolo di Westgard et al10. Calibratori e materiale di controllo I valori indicati sono stati assegnati eseguendo repliche successive sui sistemi ACL AcuStar con l’impiego di un lotto specifico di reagente rispetto a uno Standard Interno. Tipo di campioni 41 coppie di campioni plasma-citrato/siero sono stati analizzati con il kit AcuStar HIT-Ab(PF4-H). I valori di concentrazione sono stati confrontati con la regressione di Passing e Bablock, disponendo i valori dei campioni di plasma sull’asse di riferimento (asse-X), e calcolando il coefficiente di correlazione con il metodo Pearson. La pendenza e l’intercetta ottenute sono state rispettivamente di 1,01 e 0,03 con una correlazione(r) di 0,993. Nota: L’analizzatore ACL AcuStar gestisce automaticamente le differenze di diluizione fra i campioni di plasma e siero. I risultati derivanti dall’analisi di campioni di siero non devono essere corretti da un fattore. Riferirsi al Manuale dell’Operatore ACL AcuStar per ulteriori informazioni. Risultati I risultati del test AcuStar HIT-Ab(PF4-H) sono espressi in U/mL (HemosIL AcuStar HIT-Ab(PF4-H) Unità Arbitrarie). Linearità: Sistema ACL AcuStar 0.00 – 128.00 U/mL NOTA: Per campioni >128.00 U/mL i risultati verranno riportati come >128.00 U/mL ed indicati con >Norm. Nonostante un risultato positivo di questo test indichi la presenza di anticorpi anti-PF4/E, un risultato positivo NON CONFERMA la diagnosi di HIT. Alcuni pazienti possono avere questi anticorpi senza avere HIT. Non è prevista la presenza di anticorpi anti-PF4/E nella popolazione normale. Sono stati eseguiti una serie di studi per determinare il valore di cut-off da utilizzare su ACL AcuStar. Sono stati analizzati 150 campioni di plasma da donatori sani. Il 95% dei risultati rientra nell’intervallo compreso fra 0.07 e 1.01 U/mL. Sono stati analizzati inoltre 91 campioni (61 plamsa citrato e 30 siero) di pazienti sottoposti a trattamento eparinico (ENF e EBPM) non sospetti di HIT. Il 95% dei risultati rientra nell’intervallo compreso fra 0.04 e 2.27 U/mL. È stato poi effettuato uno studio comparativo con il metodo SRA (Serotonin Release Assay) su 201 plasmi di pazienti con sospetta HIT (14 positivi al test SRA e 187 negativi al test SRA). Da questo studio risulta che il cut-off ottimale è pari a 1.0 U/mL. Tale cut-off è stato determinato tramite un analisi ROC (83.1% Agreement, 95% CI = 77.2% - 88.0%). Basandosi su questi studi è stato definito che risultati del test maggiori o uguali a 1 U/mL indicano la presenza di anticorpi associabili alla HIT. Il risultato del test dovrebbe essere utilizzato insieme ad altre informazioni di carattere clinico per formulare la diagnosi. Prestazioni Bibliography / Literatur / Bibliografía / Bibliographie / Bibliografia /Bibliografia 1. Warkentin TE et al. Heparin-induced thrombocytopenia in patients treated with low-molecular-weightheparin or unfractionated heparin. N Eng J Med. 1995;332(1):1330-1335 2. Greinacher A. Heparin-Induced Thrombocytopenia. J Thromb Haemost. 2009;7 (suppl. 1):9-12 3. Arepally GM, Ortel TL. Clinical practice. Heparin-induced thrombocytopenia. N Engl J Med 2006;355:809-817 4. Greinacher A et al. Heparin-associated thrombocytopenia: isolation of the antibody and characterization of a molecular PF4-heparin complex as the major antigen. Thromb Haemost. 1994;71(2):247-251 5. Amiral J et al. Pathogenicity of IgA and/or IgM antibodies to heparin-PF4 complexes in patients with heparin-induced thrombocytopenia. Br J Haematol. 1996;92(4):954-959 6. Richmond JY, McKinney RW eds. Biosafety in Microbiological and Biomedical Laboratories. 4th Edition. U.S. Dept. of Health and Human Services, Public Health Service;1999 7. Clinical and Laboratory Standards Institute/CLSI. Collection, Transport, and Processing of Blood Specimens for Testing Plasma-Based Coagulation and Molecular Hemostasis Assays; Approved Guideline - Fifth Edition, CLSI Document H21-A5; Vol. 28 No. 5 8. Clinical and Laboratory Standards Institute/CLSI. Procedures for the Handling and Processing of Blood Specimens: Third Edition, CLSI Document H18-A3; Vol. 24 No. 38 9. Zucker S, Cathey MH, West B. Preparation of Quality Control Specimens for Coagulation. Am. J. Clin. Pathol. 1970;53:924-927 10. Westgard JO and Barry PL. Cost-Effective Quality Control: Managing the Quality and Productivity of Analytical Process. AACC Press;1986 ACL and AcuStar are trademarks of Instrumentation Laboratory. © 2011 Instrumentation Laboratory. Precisione: La precisione, nella serie e totale (tra ciclo e ciclo e tra giorno e giorno), è stata verificata eseguendo numerosi test. ACL AcuStar Media (U/mL) %CV (nella serie) %CV (Totale) Low HIT-Ab(PF4-H) Control 0.53 4.2 6.4 High HIT-Ab(PF4-H) Control 2.72 3.0 6.0 Campioni di plasma HIT-Ab(PF4-H) 1.70 5.7 6.2 Metodo di Confronto: I campioni sono stati analizzati in uno studio di correlazione con due metodi ELISA disponibili in commercio riconosciuti dalla FDA. Per il test HemosIL AcuStar HIT-Ab(PF4-H) è stato utilizzato un cut-off pari a 1.0 U/mL. I risultati sono riportati qui di seguito. Test ELISA 1 su Test ELISA 2 su campioni di plasma campioni di siero + - + AcuStar HIT-Ab(PF4-H) + 81 18 + 45 1 - 11 156 - 4 75 Metodo di riferimento N % Co-Positivity (95% CI) Co-Negativity (95% CI) % Agreement (95% CI) Test ELISA 1 Plasma 266 88.0% (79.6% - 93.9%) 89.7% (84.1% - 93.8%) 89.1% (84.7% - 92.6%) Test ELISA 2 Siero 125 91.8% (80.4% - 97.7%) 98.7% (92.9% - 100.0%) 96.0% (90.9% - 98.7%) Studi clinici: É stato effettuato uno studio clinico multicentrico (tre differenti ospedali) nel corso del quale sono stati analizzati 610 pazienti (409 campioni di plasma citrato e 201 campioni di siero) usando 2 metodi ELISA riconosciuti dalla FDA disponibili in commercio. Un ospedale ha analizzato solo campioni di siero mentre gli altri due ospedali hanno analizzato solo plasma. Sono stati raccolti campioni di pazienti sottoposti a terapia eparinica che hanno mostrato sintomi di HIT. Per il test HemosIL AcuStar HIT-Ab(PF4-H) è stato utilizzato un cut-off pari a 1.0 U/mL. I risultati sono riportati qui di seguito. Test ELISA 1 su Test ELISA 2 su campioni di plasma campioni di siero + - + AcuStar HIT-Ab(PF4-H) + 16 23 + 37 9 - 11 359 - 14 141 Calibrator Reference Value ACL AcuStar C1 HIT-Ab(PF4-H) Calibrator 1 U/mL C2 HIT-Ab(PF4-H) Calibrator 2 U/mL Metodo di riferimento N % Co-Positivity (95% CI) Co-Negativity (95% CI) % Agreement (95% CI) Test ELISA 1 Plasma 409 59.3% (38.8% - 77.6%) 94.0% (91.1% - 96.1%) 91.7% (88.6% - 94.2%) Test ELISA 2 Siero 201 72.5% (58.3% - 84.1%) 94.0% (88.9% - 97.2%) 88.6% (83.3% - 92.6%) I risultati di precisione, correlazione e studio clinico sono stati ottenuti utilizzando lotti specifici di reagenti e controlli. Limitazioni/Sostanze interferenti I risultati del test HIT-Ab(PF4-H) su ACL AcuStar non sono influenzati in presenza di livelli di emoglobina fino a 500 mg/dL, bilirubina fino a 18 mg/dL, trigliceridi fino a 1250 mg/dL, eparina (ENF o EBPM) fino a 1 IU/ mL e fattore reumatoide fino a 800 IU/mL. Il test non presenta l’effetto prozona. Il metodo prevede una fase di lavaggio dopo l’incubazione del campione che impedisce l’effetto prozona. Nota: La presenza di Fattore Reumatoide potrebbe alzare il titolo di campioni già positive alla HIT. Sono stati analizzati con il kit HemosIL AcuStar HIT-Ab(PF4-H) ventisei campioni con Sindrome da Anticorpi HIT-Ab(PF4-H) - 0009802032 PORTUGUÊS - Revisão do folheto 08/2013 Utilização prevista Imunoensaio quimioluminescente completamente automatizado para a detecção de anticorpos IgG, IgA e IgM em plasma humano citratado e em soro que reage com o Factor plaquetário 4 (PF4) quando complexado com a heparina no ACL AcuStar™. Os anticorpos associados à heparina estão normalmente presentes em doentes com trombocitopenia induzida pela heparina ou com trombose (HIT). • Com o cartucho ainda numa superfície sólida, pressione as 2 abas colocadas lateralmente na tampa de perfuração (parte cinzenta) e aplique pressão na parte de cima do cartucho até ficar na posição de trancado. Nessa posição as abas não devem ser visíveis. Não inverta o cartucho aberto. • Depois do cartucho estar colocado no instrumento, realiza-se uma mistura periódica adicional. Resumo e príncipio A trombocitopenia induzida por heparina (HIT) é uma doença mediada por imunomplexos, causadora de morbilidade e mortalidade em doentes com terapêutica por heparina1. A HIT é considerada uma doença paradoxal, na qual o anticoagulante é administrado para prevenir trombose; contudo o acontecimento clínico mais importante na HIT é um risco aumentado para trombose venosa e/ou arterial2. Suspeitase da HIT quando os doentes tratados com heparina não fraccionada (HNF) ou heparina de baixo peso molecular (HBPM) mostra um decréscimo das contagens de plaquetas superior a 50% da linha de base, tipicamente entre o dia 5 e 10 a partir do início do tratamento com anticoagulante3. Também foram notificados casos de HIT precoce e retardada2. O diagnóstico rápido é muito importante, porque o tratamento com heparina tem de ser suspenso e têm de ser utilizados anticoagulantes alternativos, no caso de uma HIT confirmada. A HIT tipo II, o tipo imunoalérgico, é causado pelo desenvolvimento de anticorpos activadores de plaquetas, na sua maioria dirigidos contra o factor plaquetário 4 quando complexados com heparina (PF4/H)4. Estes anticorpos são a causa primária de indução de tromboses, tanto venosa como arterial. A hipótese actual, é de que a exposição precoce aos complexos PF4, talvez induzido pelos factores endógenos não-heparínicos, leva à formação de clusters de PF4 e a um switch da classe de anticorpos das células B, dependente das células T. Num período posterior da vida, estas células B ficam nova e transitoriamente activadas quando os clusters PF4 são induzidos pelo tratamento com heparina2. O desenvolvimento da patologia está maioritariamente associado aos anticorpos dependentes da heparina do isotipo IgG1. Contudo, a presença de apenas IgM e/ou IgA foi observado em alguns doentes, incluindo casos com complicações trombóticas5. Os testes aos anticorpos PF4/H combinados com uma avaliação clínica adequada, demonstrou ser muito útil como auxiliar na gestão de doentes com suspeita de HIT. Em particular, um resultado negativo no teste do anticorpo PF4/H pode suportar a decisão clínica de exclusão da presença de HIT, e portanto continuar com o tratamento com heparina2. A positividade fraca para os anticorpos PF4/H pode indicar que os anticorpos são activadores não-plaquetários, enquanto uma positividade forte pode indicar um risco mais elevado de HIT. Em ambos os casos, é recomendada a confirmação com um teste funcional. Uma reavaliação clínica suportada por dados de laboratório, deve ser realizada antes da confirmação ou exclusão do diagnóstico2. O ensaio HemosIL AcuStar HIT-Ab(PF4-H) é um ensaio quimioluminescente em 2 passos consistindo em partículas revestidas com PF4 complexado com sulfato de polivinilo (PVS) que captura, se estiver presente, os anticorpos PF4/Heparin da amostra. Após incubação, separação magnética e um passo de lavagem, o marcador consistindo numa mistura de 3 anticorpos monoclonais marcados com isoluminol (IgG anti-humano, IgA anti-humana e IgM anti-humana) é adicionada e pode ligar-se com os isotipos PF4/Heparina IgG, IgA e/ou IgM capturados nas partículas. Após a segunda incubação, separação magnética e um passo de lavagem, os reagentes que despoletam a reacção luminescente são adicionados, e a luz emitida é medida em unidades relativas de luz (URLs) pelo sistema óptico ACL AcuStar. As URLs são directamente proporcionais à concentração de anticorpos PF4/Heparina na amostra. O ensaio ACL AcuStar HIT-Ab(PF4-H) utiliza o método de redução de dados pelo ajustamento da curva de 4 parâmetros logísticos (4PLC) para gerar a curva padrão. Esta é pré-definida e dependente do lote e é guardada no instrumento através do código de barras do cartucho com a medição dos calibradores, a curva padrão pré-definida é transformada numa nova curva de trabalho 4PLC específica do instrumento. Os valores de concentração dos calibradores estão incluídos nos códigos de barras do tubo. Composição O kit AcuStar HIT-Ab(PF4-H) consiste em: R HIT-Ab(PF4-H) Cartridge for 25 determinations (Cat. No. 0009802033): 1 cartucho com 1 frasco de suspensão de partículas magnéticas revestidas com complexo PF4/PVS, 1 frasco de tampão de ensaio, 1 frasco de marcador com anticorpo monoclonal anti-humano IgG, anticorpos IgM e IgA marcados com isoluminol e 1 frasco de diluente da amostra utilizado para a pré-diluição da amostra. Os reagentes estão num tampão fosfato ou Tris com albumina sérica bovina, soro bovino fetal, complexo PF4/PVS, anticorpo monoclonal IgG de ratinho, estabilizantes e conservante. C1 HIT-Ab(PF4-H) Calibrator 1 (Cat. No.0009802034): 1 tubo com código de barras x 1 mL de solução com anticorpos monoclonais anti-PF4-Heparina em tampão Tris com albumina sérica bovina, estabilizantes e conservante. C2 HIT-Ab(PF4-H) Calibrator 2 (Cat. No. 0009802035): 1 tubo com código de barras x 1 mL de solução com anticorpos monoclonais anti-PF4-Heparina em tampão Tris com albumina sérica bovina, estabilizantes e conservante. Os calibradores são específicos de lote e não podem ser utilizados com outros lotes de reagente. PRECAUÇÕES E AVISOS: O material de origem humana neste produto foi testado com métodos aprovados pela FDA sendo nãoreactivos para o antigénio de superfície da Hepatite B (HBsAg), Anti-HCV e anticorpos HIV 1/2. Manipule como potencialmente infeccioso6. Ambos os controlos contêm menos do que 0.1% de azida sódica, com potencial para formação de azidas explosivas nas canalizações. Utilize os procedimentos de eliminação adequados. Classe de risco: nenhuma Frases de risco: nenhuma Frases de segurança: nenhuma Este produto destina-se a uso em diagnóstico in vitro. Preparação HIT-Ab(PF4-H) Cartridge: As micropartículas assentam durante o transporte e armazenagem e é necessário misturar para ressuspender. • A primeira vez que se utiliza o cartucho, inverta-o suavemente 30 vezes evitando a formação de espuma. • Verifique a ressuspensão completa das micropartículas. Se as micropartículas não estão totalmente ressuspensas continue a inverter o cartucho até as micropartículas terem sido completamente ressuspensas. • Se as micropartículas não estão totalmente ressuspensas, NÃO UTILIZE O CARTUCHO. • Depois das micropartículas estarem ressuspensas, coloque o cartucho numa superfície sólida e retire suavemente o separador vermelho de segurança de transporte do cartucho. AcuStar HIT-Ab(PF4-H) demonstrando que o ensaio não é afectado por anticorpos APS. Num estudo de reactividade cruzada, foram analisadas 46 amostras das seguintes situações, com o ensaio AcuStar HIT-Ab(PF4-H) : com paraproteínas IgG ou IgM, com níveis elevados de IgG ou IgM, positivo para o Factor reumatóide (RF), e de mulheres grávidas (pelo menos 10% multíparas). Grupo de amostras N N (Positiva) % HIT-Ab (PF4-H) Positiva Factor reumatóide 10 0 0% IgG e IgM Elevada 20 0 0% Paraproteína IgG ae IgM 6 0 0% Grávidas 10 0 0% Symbols used / Verwendete Symbole / Símbolos utilizados / Symboles utilisés / Simboli impiegati / Símbolos utilizados CALIBRATOR REFERENCE VALUE Calibrator / Kalibrator / Calibrador / Calibrateur / Calibrante / Calibrador Reference value / Referenzwerte / Valor de referencia / Valeur de référence / Valore di riferimento / Valor de referência Valores esperados HIT-Ab(PF4-H) Calibrator 1 & 2: São líquidos e têm de ser misturados por inversão suave várias vezes antes de usar, para assegurar homogeneidade do calibrador. Evite a formação de espuma. Por favor note: Não use o reagente se observar alguma alteração na aparência dos componentes incluídos no kit ou se observar algum dano nos materiais de embalagem. Conservação do reagente e estabilidade Os reagentes e calibradores fechados e selados são estáveis até ao fim do prazo de validade impresso no cartucho e nos rótulos dos tubos quando conservados entre 2-8°C. HIT-Ab(PF4-H) Cartridge – Estabilidade pós-abertura colocado no ACL AcuStar System é de 12 semanas. HIT-Ab(PF4-H) Calibrator 1 & 2 - Estabilidade pós-abertura colocado no ACL AcuStar System é de 4 horas. Para uma estabilidade óptima retire os calibradores do sistema e conserve-os entre 2-8°C no recipiente original e com tampa. Instrumento/Procedimentos do teste Consulte o manual do operador ACL AcuStar para obter instruções completas acerca dos procedimentos do ensaio. Colheita da amostra e preparação Plasma: nove partes de sangue venoso fresco colhidas numa parte de citrato trissódico. Consulte o CLSI Document H21-A5 para obter instruções acerca da colheita de amostras, manipulação e conservação7. Descongele amostras congeladas rapidamente a 37°C. Depois de descongelar, o ensaio tem de ser realizado no período de 2 horas. Sero: A seguir à colheita, o soro deve ser separado do coágulo. Siga as recomendações do CLSI Document H18-A3 de condições de conservação das amostras8. Centrifugue as amostras com partículas visíveis, antes de analisar. Reagentes adicionais e plasmas controlo Os seguintes não são fornecidos com o kit e têm de ser adquiridos em separado. AcuStar HIT Controls Cat. No. 0009802122 Controlo de qualidade Recomenda-se a utilização de dois níveis de controlo para um programa de qualidade9. Os HemosIL AcuStar HIT Controls Low e High foram concebidos para este programa. Cada laboratório deve estabelecer a sua média e desvio padrão, e deve estabelecer um programa de controlo de qualidade para monitorizar os testes do laboratório. Os controlos devem ser analisados pelo menos uma vez, em cada turno de 8 horas quando a análise estiver a decorrer, de acordo com as boas práticas de laboratório. Consulte o manual do operador para obter informação adicional. Consulte Westgard et al para identificação e resolução de situações fora de controlo10. Rastreabilidade dos calibradores e materiais de controlo Os valores notificados foram determinados ao longo de múltiplas análises no ACL AcuStar System com lotes específicos de reagentes e contra um controlo interno. Matriz da amostra Foram analisadas 41 amostras emparelhadas de plasma citratado/soro com o ensaio AcuStar HITAb(PF4-H). Os valores de concentração foram comparados por regressão de Passing e Bablok utilizando os valores de amostras de plasma como referência (eixo do X), e o coeficiente de correlação calculado com a correlação de Pearson. O declive e a intercepção foram respectivamente 1.01 e 0.03 e o coeficiente de correlação (r) 0.993. Por favor note: O ACL AcuStar corrije automaticamente as diferenças de diluição entre as amostras de plasma e soro. Os valores notificados das amostras de soro não precisam de ser corrigidas por um factor. Consulte o manual do operador ACL AcuStar para obter mais informação. Resultados Os resultados do HemosIL AcuStar HIT-Ab(PF4-H) são notificados em U/mL (HemosIL AcuStar HIT-Ab(PF4-H) Unidades arbitrárias). Intervalo do teste: Sistema ACL AcuStar 0.00 – 128.00 U/mL Por favor note: Para amostras com resultados >128.00 U/mL serão notificados como >128.00 U/mL e sinalizados com >Norm. Embora a obtenção de uma reacção positiva com este ensaio possa indicar a presença de um anticorpo associado à heparina, a detecção de anticorpos, contudo, NÃO CONFIRMA o diagnóstico de trombocitopenia induzida pela heparina (HIT). Alguns doentes podem ter anticorpos anti-PF4 que ocorrem naturalmente. A presença de anticorpos PF4/H na população normal não é esperado. Foi realizado um conjunto de estudos para avaliar o cut-off óptimo do HemosIL AcuStar HIT-Ab(PF4-H) nos sistemas ACL AcuStar conforme descrito a seguir: Foram analisadas 150 amostras de plasma de indivíduos aparentemente saudáveis (dadores de banco de sangue). O intervalo de referência a 95% foi de 0.07 -1.01 U/mL. Adicionalmente, foi analisada uma população de 91 amostras (61 de plasma citratado e 30 soros) de doentes expostos a heparina (HNF e HBPM) sem suspeita clínica de HIT. O intervalo de referência a 95% foi de 0.04 – 2.27 U/mL. Finalmente, uma comparação de método com o ensaio de libertação de serotonina (SRA) em 201 amostras de de doentes com suspeita de HIT (14 SRA positivos e187 SRA negativos) indicou que o cut-off óptimo determinado por análise ROC foi de 1.00 U/mL (concordância de 83.1% , IC 95% = 77.2% - 88.0%). Baseado nestes estudos foi determinado que, nas amostras de doentes tratados com heparina, os resultados HemosIL AcuStar HIT-Ab(PF4-H) iguais ou mais elevados do que 1.00 U/mL podem indicar a presença de anticorpos HIT. Os resultados do ensaio devem ser utilizados com outra informação, incluindo o contexto clínico, na formação de um diagnóstico. In vitro diagnostic medical device In-vitro Diagnostikum De uso diagnóstico in vitro Dispositif mèdical de diagnostic in vitro Per uso diagnostico in vitro Dispositivo médico para utilização em diagnóstico in vitro Batch code Chargen-Bezeichnung Identificación número de lote Désignation du lot Numero del lotto Número de lote Use by Verwendbar bis Caducidad Utilisable jusqu’à Da utilizzare prima del Data límite de utilização Temperature limitation Festgelegte Temperatur Temperatura de Almacenamiento Températures limites de conservation Limiti di temperatura Límite de temperatura Consult instructions for use Beilage beachten Consultar la metódica Lire le mode d’emploi Vedere istruzioni per l’uso Consultar as instruções de utilização Control Kontrollen Control Contrôle Controllo Controlo Biological risks Biologisches Risiko Riesgo biológico Risque biologique Rischio biologico Risco biológico Manufacturer Hergestellt von Fabricado por Fabricant Prodotto da Fabricado por Authorised representative Bevollmächtigter Representante autorizado Mandataire Rappresentanza autorizzata Representante autorizado Características de desempenho Precisão: A precisão intra-análise e total (análise a análise e dia a dia) foi avaliada ao longo de múltiplas análises. ACL AcuStar Média (U/mL) %CV (intra-análise) %CV (Total) Low HIT-Ab(PF4-H) Control 0.53 4.2 6.4 High HIT-Ab(PF4-H) Control 2.72 3.0 6.0 Amostra de plasmaHIT-Ab(PF4-H) 1.70 5.7 6.2 Comparação do método: Foi efectuada uma comparação interna do método com amostras de plasma e de soro utilizando 2 ensaios ELISA comercializados e aprovados pela FDA. Os resultados resumidos a seguir baseiam-se num cut-off de 1.00 U/mL para o AcuStar. A concordância total em % para o plasma e soro foram: Amostras de plasma Amostras de soro ensaio ELISA 1 ensaio ELISA 2 + - + Resultados AcuStar HIT-Ab(PF4-H) + 81 18 + 45 1 - 11 156 - 4 75 Dispositivo Predicado N %Co-Positividade(95% IC) Co-Negatividade (95% IC) % Concordância (95% IC%) Plasma ensaio ELISA 1 266 88.0% (79.6% - 93.9%) 89.7% (84.1% - 93.8%) 89.1% (84.7% - 92.6%) Soro ensaio ELISA 2 125 91.8% (80.4% - 97.7%) 98.7% (92.9% - 100.0%) 96.0% (90.9% - 98.7%) Desempenho clínico: Realizou-se um estudo multicêntrico em 3 hospitais com 610 amostras (409 plasmas citratados e 201 soros) com 2 ensaios ELISA comercializados e aprovados pela FDA. Um hospital utilizou apenas amostras de soro, os outros 2 hospitais utilizaram apenas amostras de plasma e estes resultados foram combinados. As amostras foram de doentes expostos à heparina que apresentaram sintomas relacionados com HIT e por isso com suspeita de HIT. Os resultados resumidos a seguir basearam-se num cut-off de 1.00 U/mL para o AcuStar: Amostras de plasma Amostras de soro ensaio ELISA 1 ensaio ELISA 2 + - + Resultados AcuStar HIT-Ab(PF4-H) + 16 23 + 37 9 - 11 359 - 14 141 Dispositivo Predicado N %Co-Positividade(95% IC) Co-Negatividade (95% IC) % Concordância (95% IC%) Plasma do ensaio ELISA 1409 59.3% (38.8% - 77.6%) 94.0% (91.1% - 96.1%) 91.7% (88.6% - 94.2%) Soro do ensaio ELISA 2 201 72.5% (58.3% - 84.1%) 94.0% (88.9% - 97.2%) 88.6% (83.3% - 92.6%) A precisão, comparação de métodos e resultados dos estudos clínicos foram obtidos utilizando lotes específicos de reagentes e controlos. Limitações/Substâncias interferentes Os resultados HIT-Ab(PF4-H) no ACL AcuStar não são afectados pela hemoglobina até 500 mg/dL, bilirrubina até 18 mg/dL, trigliceridos até 1250 mg/dL, heparina (HNF e HBPM) até 1 IU/mL, e Factor reumatóide até 800 IU/mL. O ensaio não é afectado pelo efeito de prozona. O protocolo do ensaio tem um passo de lavagem depois da incubação que evita o efeito prozona. Por favor note: As amostras com Factor reumatóide positivo podem aumentar o valor da amostra já positiva para HIT. Vinte e seis amostras diagnosticadas com o Síndrome Antifosfolípidico (APS) foram testadas com o HemosIL AcuStar HIT-Ab(PF4-H). Todas as 26 amostras foram notificadas como negativas com o HemosIL Instrumentation Laboratory Company - Bedford, MA 01730-2443 (USA) Instrumentation Laboratory SpA - V.le Monza 338 - 20128 Milano (Italy) T3800-4117 R1 08/2013 HIT-Ab((PF4-H)) Printed Insert Sheet: Revision: Issued: C.O.: ENGLISH DEUTSCH ESPAÑOL FRANÇAIS ITALIAN PORTUGUESE 0009802032 T3800-4117 R1 08/2013 437437 LANGUAGES TECHNICAL SPEC'S PAPER: SIZE: PRINT: PRINT COLOR: White paper, 50-60 g/m2 weight. 594 x 420 mm (DIN A2). Front/Back. Front - Top Band Green Pantone 382, all remaining type in black. Back - All type in black. Instrumentation Laboratory Company - Bedford, MA 01730-2443 (USA) Instrumentation Laboratory SpA - V.le Monza 338 - 20128 Milano (Italy) T3800-4117 R1 08/2013