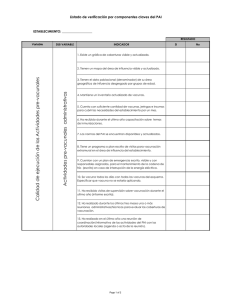
Vacunas Farmacia
Anuncio

100mm 90mm 80mm 60mm 10mm GUÍA DE VACUNAS EN LA OFICINA DE FARMACIA Coordinador Ángel Gil de Miguel Doctor en Medicina. Catedrático de Medicina Preventiva y Salud Pública. Facultad de Medicina. Universidad Rey Juan Carlos. Colaboradores José Luis del Barrio Doctor en Biología. Profesor titular interino de Medicina Preventiva y Salud Pública. Facultad de Ciencias de la Salud. Universidad Rey Juan Carlos. Pilar Carrasco Garrido Doctora en Farmacia. Profesora titular de Medicina Preventiva y Salud Pública. Facultad de Ciencias de la Salud. Universidad Rey Juan Carlos. Ruth Gil Prieto Doctora en Bioquímica. Profesora titular interina de Medicina Preventiva y Salud Pública. Facultad de Ciencias de la Salud. Universidad Rey Juan Carlos. Rodrigo Jiménez García Doctor en Medicina. Profesor titular de Medicina Preventiva y Salud Pública. Facultad de Ciencias de la Salud. Universidad Rey Juan Carlos. Ana Isabel López de Andrés Doctora en Farmacia. Profesora Contratada Doctor de Medicina Preventiva y Salud Pública. Facultad de Ciencias de la Salud. Universidad Rey Juan Carlos. Jesús San Román Montero Doctor en Medicina. Profesor Contratado Doctor de Medicina. Facultad de Ciencias de la Salud. Universidad Rey Juan Carlos. GUÍA DE VACUNAS EN LA OFICINA DE FARMACIA ÍNDICE GUÍA DE VACUNAS EN LA OFICINA DE FARMACIA ÍndiCe Tema 1. epidemiología y control de las enfermedades transmisibles 1.1. Definición de enfermedad transmisible 1.2. Fases de las enfermedades transmisibles 1.3. Agente causal 1.3.1. Definición 1.3.2. Características 1.4. Cadena epidemiológica 1.4.1. Reservorio 1.4.2. Fuente 1.4.3. Portador 1.4.4. Mecanismos de transmisión 1.4.5. Huésped susceptible Tema 2. Concepto y clasificación de las vacunas 2.1. Concepto de vacunación 2.2. Clasificación de las vacunas 2.2.1. Clasificación microbiológica 2.2.2. Clasificación según el método de fabricación 2.2.3. Clasificación según su composición 2.2.4. Clasificación según su uso sanitario 2.3. Normas generales sobre el uso de las vacunas 2.3.1. Técnicas de administración de vacunas 2.4. Mecanismo de actuación de las vacunas 2.5. Calendario vacunal Tema 3. Vacuna contra la poliomielitis 3.1. Aspectos generales de la poliomielitis 3.2. Características del agente etiológico 3.3. Cadena epidemiológica de la poliomielitis 3.4. Epidemiología de la poliomielitis 3.5. Composición de la vacuna frente a la poliomielitis 3.6. Indicaciones de la vacuna de la poliomielitis 3.6.1. Indicaciones de la VPO (vacuna Sabin) 3.6.2. Indicaciones de la VPI (vacuna Salk) 3.6.3. Criterios para la introducción de polio inactivada en los países que utilizan polio oral 3.7. Pautas de vacunación 3.7.1. Pauta de vacunación en la edad infantil con VPO 3.7.2. Pauta de vacunación en la edad infantil con VPIa 3.7.3. Pauta de administración secuencial con VPIa y VPO 3.7.4. Pauta de administración en la edad adulta 3.8. Vía de administración 3.9. Contraindicaciones y precauciones 3.10. Reacciones adversas 3.11. Conservación y transporte 3.12. Vacunas antipoliomielíticas comercializadas 4 13 14 14 15 15 15 16 16 16 16 16 17 19 20 20 20 20 22 22 23 23 24 25 27 28 28 28 28 30 30 30 30 31 31 31 31 31 31 32 32 32 32 33 Índice Tema 4. Vacuna frente a difteria, tétanos y tos ferina 4.1. Difteria 4.1.1. Aspectos generales de la difteria 4.1.2. Características del agente etiológico 4.1.3. Cadena epidemiológica de la difteria 4.1.4. Signos y síntomas diftéricos 4.1.5. Epidemiología de la difteria 4.2. Vacuna contra la difteria 4.2.1. Indicaciones 4.2.2. Contraindicaciones 4.2.3. Reacciones adversas 4.3. Tétanos 4.3.1. Características del agente etiológico 4.3.2. Cadena epidemiológica del tétanos 4.3.3. Signos y síntomas del tétanos 4.3.4. Epidemiología del tétanos 4.4. Inmunización pasiva contra el tétanos 4.5. Vacuna contra el tétanos 4.5.1. Indicaciones 4.5.2. Contraindicaciones 4.5.3. Reacciones adversas 4.6. Tos ferina 4.6.1. Características del agente etiológico 4.6.2. Cadena epidemiológica de la tos ferina 4.6.3. Signos y síntomas de la tos ferina 4.6.4. Epidemiología de la tos ferina 4.7. Vacuna contra la tos ferina 4.7.1. Vacuna de células enteras (Pe) 4.7.2. Vacuna acelular (Pa) 4.8. Vacunas combinadas frente a difteria, tétanos y tos ferina 4.8.1. Tipos de vacunas combinadas DTP. 4.8.2. Características de las vacunas DTP 4.8.3. Vacunas antidiftéricas, antitetánicas y/o antipertúsicas comercializadas en España 4.8.4. Pautas posológicas Tema 5. Vacuna triple vírica (sarampión, rubeola, paperas) 5.1. Sarampión 5.1.1. Características del agente etiológico 5.1.2. Cadena epidemiológica del sarampión 5.1.3. Epidemiología del sarampión 5.2. Vacuna contra el sarampión 5.2.1. Indicaciones, pautas y vías de administración 5.2.2. Contraindicaciones y precauciones 5.2.3. Reacciones adversas 5.2.4. Vacunas contra el sarampión comercializadas 5.3. Rubeola 35 36 36 36 36 36 37 37 37 38 38 38 38 38 39 39 40 40 40 41 41 41 42 42 42 43 43 44 44 45 45 45 45 47 49 50 50 50 50 51 51 51 52 52 52 5 GUÍA DE VACUNAS EN LA OFICINA DE FARMACIA 5.3.1. Características del agente etiológico 5.3.2. Cadena epidemiológica de la rubeola 5.3.3. Epidemiología de la rubeola 5.4. Vacuna contra la rubeola 5.4.1. Indicaciones, pautas y vías de administración 5.4.2. Contraindicaciones y precauciones 5.4.3. Reacciones adversas 5.4.4. Vacunas contra la rubeola comercializadas 5.5. Parotiditis 5.5.1. Características del agente etiológico 5.5.2. Cadena epidemiológica de la parotiditis 5.5.3. Epidemiología de la parotiditis 5.6. Vacuna contra la parotiditis 5.6.1. Indicaciones, pautas y vías de administración 5.6.2. Contraindicaciones y precauciones 5.6.3. Reacciones adversas 5.7. Vacuna triple vírica 5.7.1. Características generales 5.7.2. Composición de la vacuna 5.7.3. Inmunogenicidad y eficacia 5.7.4. Indicaciones, pautas y vías de administración 5.7.5. Contraindicaciones y precauciones 5.7.6. Reacciones adversas 5.7.7. Conservación 5.7.8. Vacunas triple víricas comercializadas Tema 6. Vacuna frente a Haemophilus influenzae tipo b 6.1. Características del agente etiológico 6.2. Cadena epidemiológica del Haemophilus influenzae 6.3. Factores de riesgo 6.4. Clínica del Haemophilus influenzae 6.5. Epidemiología de la infección por Haemophilus influenzae 6.6. Control de la enfermedad invasiva causada por Hib. Actuación en casos especiales 6.6.1. Quimioprofilaxis 6.6.2. Definición de contacto íntimo 6.6.3. Pautas de actuación ante los contactos de un caso de meningitis 6.7. Vacuna anti-Hib 6.7.1. Vacuna polisacárida 6.7.2. Vacuna conjugada frente a Hib 6.7.3. Composición de la vacuna conjugada 6.7.4. Inmunogenicidad y eficacia 6.7.5. Fallos vacunales y vacunaciones incompletas 6.7.6. Indicaciones, pautas y vías de administración 6.7.7. Contraindicaciones y precauciones 6.7.8. Reacciones adversas 6.7.9. Vacunas combinadas 6 52 52 53 53 53 54 54 54 54 54 55 55 55 56 56 56 57 57 57 57 57 57 58 58 58 59 60 60 60 61 62 63 63 63 63 64 64 64 64 64 65 65 66 66 66 ÍndiCe 6.7.10. Vacunas anti-Hib comercializadas en España Tema 7. Vacuna frente a la enfermedad meningocócica 7.1. Características del agente etiológico 7.2. Cadena epidemiológica de la infección meningocócica 7.2.1. Factores de riesgo de la infección meningocócica 7.2.2. Estado de portador 7.3. Signos y síntomas de la infección meningocócica 7.4. Epidemiología de la infección meningocócica 7.5. Control de la enfermedad meningocócica. Actuación en casos especiales 7.5.1. Quimioprofilaxis 7.6. Vacunas antimeningocócicas 7.6.1. Tipos de vacunas antimeningocócicas 7.6.2. Indicaciones, pautas y vías de administración 7.6.3. Contraindicaciones y precauciones 7.6.4. Reacciones adversas 7.6.5. Vacunas antimeningocócicas comercializadas Tema 8. Vacuna frente a la hepatitis b 8.1. Características del agente etiológico 8.2. Cadena epidemiológica de la hepatitis B 8.2.1. Reservorio 8.2.2. Mecanismos de transmisión de la hepatitis B 8.3. Manifestaciones clínicas de la hepatitis B 8.4. Epidemiología de la hepatitis B 8.5. Métodos de control de la hepatitis B 8.5.1. Inmunoprofilaxis pasiva 8.5.2. Inmunoprofilaxis activa 8.6. Vacunas frente a la hepatitis B 8.6.1. Eficacia vacunal 8.6.2. Indicaciones, pautas y vías de administración 8.6.3. Reacciones adversas 8.6.4. Vacunas frente a hepatitis B comercializadas 8.7. Estrategias de control Tema 9. Vacuna frente al virus de la varicela zóster 9.1. Características del agente etiológico 9.2. Cadena epidemiológica de la varicela zóster 9.2.1. Reservorio 9.2.2. Mecanismos de transmisión 9.3. Signos y síntomas de la infección por VVZ 9.4. Epidemiología de la varicela zóster 9.5. Prevención de la varicela 9.5.1. Profilaxis de exposición 9.5.2. Inmunoprofilaxis pasiva 9.5.3. Inmunoprofilaxis activa 9.6. Vacunas anti-varicela 9.6.1. Eficacia vacunal 67 69 70 70 71 72 73 74 75 75 76 76 78 79 79 79 81 82 82 82 83 85 85 86 88 88 88 89 89 90 90 91 93 94 95 95 95 96 97 98 98 98 99 99 99 7 GUÍA DE VACUNAS EN LA OFICINA DE FARMACIA 9.6.2. Indicaciones, pautas y vías de administración 9.6.3. Contraindicaciones y precauciones 9.6.4. Reacciones adversas 9.6.5. Vacunas anti-varicela comercializadas en España 9.7. Estrategias de vacunación 9.8. Vacunas contra el herpes zóster 9.9. Tratamiento de la varicela zóster Tema 10. Vacuna frente al neumococo 10.1. Características del agente etiológico 10.2. Cadena epidemiológica del neumococo 10.3. Signos y síntomas de la infección neumocócica 10.4. Epidemiología de la infección neumocócica 10.5. Métodos de control de la infección neumocócica 10.5.1. Quimioprofilaxis 10.5.2. Inmunoprofilaxis 10.6. Vacunas frente al neumococo 10.6.1. Tipos de vacunas antineumocócicas 10.6.2. Inmunogenicidad, eficacia y efectividad 10.6.3. Indicaciones, pautas y vías de administración 10.6.4. Contraindicaciones y precauciones 10.6.5. Reacciones adversas 10.6.6. Vacunas antineumocócicas comercializadas 10.7. Futuras líneas de investigación Tema 11. Vacuna frente a la gripe 11.1. Características del agente etiológico 11.2. Cadena epidemiológica de la gripe 11.3. Signos y síntomas de la gripe 11.4. Epidemiología de la gripe 11.5. Métodos de control de la gripe 11.5.1. Vigilancia epidemiológica 11.5.2. Tratamiento de la gripe 11.5.3. Prevención individual de la gripe 11.6. Vacuna antigripal 11.6.1. Respuesta inmunitaria 11.6.2. Indicaciones, pautas y vías de administración 11.6.3. Contraindicaciones y precauciones 11.6.4. Reacciones adversas 11.6.5. Vacunas antigripales comercializadas 11.6.6. Vacunas atenuadas frente a la gripe Tema 12. Vacuna frente a la hepatitis a 12.1. Características del agente etiológico 12.2. Cadena epidemiológica de la hepatitis A 12.3. Signos y síntomas de la hepatitis A 12.4. Epidemiología de la hepatitis A 12.5. Estrategias de control de la hepatitis A 8 99 100 101 101 101 102 103 105 106 106 107 107 109 109 109 109 109 110 111 112 112 113 113 115 116 116 117 118 120 120 120 121 121 122 122 124 124 125 125 127 128 128 129 130 132 ÍndiCe 12.6. Vacunas frente a la hepatitis A 12.6.1. Inmunogenicidad, eficacia y efectividad 12.6.2. Indicaciones, pautas y vías de administración 12.6.3. Indicaciones futuras 12.6.4. Contraindicaciones y precauciones 12.6.5. Reacciones adversas 12.6.6. Vacunas frente a hepatitis A comercializadas 12.6.7. Vacunas en estudio Tema 13. Vacuna frente al rotavirus 13.1. Características del agente etiológico 13.2. Cadena epidemiológica de la infección por rotavirus 13.3. Signos y síntomas de la infección por rotavirus 13.3.1. Infección asintomática 13.3.2. Infección nosocomial 13.4. Respuesta inmunitaria frente al rotavirus 13.5. Epidemiología de la infección por rotavirus 13.6. Prevención de la infección por rotavirus 13.7. Vacuna frente al rotavirus 13.7.1. Inmunogenicidad y eficacia 13.7.2. Indicaciones, pautas y vías de administración 13.7.3. Contraindicaciones y precauciones 13.7.4. Reacciones adversas 13.7.5. Vacunas frente a rotavirus comercializadas 13.8. Tratamiento de la infección por rotavirus Tema 14. Vacuna frente al papilomavirus humano 14.1. Características del agente etiológico 14.2. Cadena epidemiológica de la infección por papilomavirus 14.3. Signos y síntomas de la infección por papilomavirus 14.4. Tratamiento de las infecciones por papilomavirus 14.4.1. Tratamiento del cáncer cervicouterino 14.4.2. Tratamiento de las verrugas genitales 14.5. Epidemiología de la infección por papilomavirus 14.6. Prevención de la infección por papilomavirus 14.7. Vacuna frente al papilomavirus 14.7.1. Inmunogenicidad y eficacia 14.7.2. Indicaciones, pautas y vías de administración 14.7.3. Contraindicaciones y precauciones 14.7.4. Reacciones adversas 14.7.5. Vacunas frente a papilomavirus comercializadas Tema 15. Vacunación en situaciones de post-accidente o exposiciones inevitables 15.1. Vacunación antitetánica 15.2. Vacunación antirrábica 15.3. Profilaxis post-exposición de picaduras de arañas y serpientes Tema 16. Vacunación en viajeros 16.1. Epidemiología 133 133 133 135 135 135 136 136 137 138 139 140 140 140 141 141 142 142 143 144 144 145 145 146 147 148 149 149 152 152 152 153 153 154 154 154 155 155 155 157 158 160 162 163 164 9 GUÍA DE VACUNAS EN LA OFICINA DE FARMACIA 16.2. Consejos sanitarios a viajeros 16.3. Enfermedades prevenibles con vacunas 16.3.1. Vacunas de uso selectivo 16.3.2. Vacunas de uso obligatorio 16.4. Grupos de vacunación especiales 16.5. Quimioprofilaxis 16.6. El Reglamento Sanitario Internacional 16.7. Centros de vacunación provinciales Tema 17. Calendarios vacunales infantiles: cambios estratégicos 17.1. Cambios en el calendario de vacunación de una Comunidad Autónoma: Madrid 17.2. Calendarios de vacunación 17.2.1. Calendario del Consejo Interterritorial del Sistema Nacional de Salud 17.2.2. Calendario vacunal de Andalucía 17.2.3. Calendario vacunal de Aragón 17.2.4. Calendario vacunal de Asturias 17.2.5. Calendario vacunal de Baleares 17.2.6. Calendario vacunal de Canarias 17.2.7. Calendario vacunal de Cantabria 17.2.8. Calendario vacunal de Castilla La Mancha 17.2.9. Calendario vacunal de Castilla León 17.2.10. Calendario vacunal de Cataluña 17.2.11. Calendario vacunal de Ceuta 17.2.12. Calendario vacunal de Comunidad Valenciana 17.2.13. Calendario vacunal de Extremadura 17.2.14. Calendario vacunal de Galicia 17.2.15. Calendario vacunal de La Rioja 17.2.16. Calendario vacunal de Madrid 17.2.17. Calendario vacunal de Melilla 17.2.18. Calendario vacunal de Murcia 17.2.19. Calendario vacunal de Navarra 17.2.20. Calendario vacunal de País Vasco Tema 18. estrategias de vacunación en la población adulta 18.1. Vacuna frente a difteria, tétanos y tos ferina 18.2. Vacuna frente a la gripe 18.3. Vacuna frente al neumococo 18.4. Vacuna frente a la hepatitis 18.4.1. Vacuna frente a la hepatitis A 18.4.2. Vacuna frente a la hepatitis B 18.4.3. Vacunas combinadas frente a hepatitis A y B 18.5. Vacuna frente al sarampión, rubeola y parotiditis 18.6. Calendario vacunal de adultos Tema 19. Conservación y almacenamiento de vacunas 19.1. La cadena del frío 19.1.1. Definición de la cadena del frío 19.1.2. Fases de la cadena del frío 10 165 167 168 168 168 169 171 171 173 174 176 177 178 179 180 181 182 183 184 185 186 187 188 189 190 191 192 193 194 195 196 197 198 200 201 202 202 203 204 204 205 207 208 208 208 ÍndiCe 19.1.3. Elementos de la cadena del frío 19.2. Distribución de las vacunas 19.2.1. Controles de calidad de la distribución 19.3. Almacenamiento de las vacunas 19.3.1. Elementos que intervienen en el almacenamiento de las vacunas 19.3.2. Actividades en el almacenaje de vacunas 19.4. Administración de vacunas 19.4.1. Elementos que intervienen en la administración de las vacunas 19.4.2. Actividades en la administración de vacunas 19.4.3. Mantenimiento del equipamiento 19.4.4. Control en la dispensación de vacunas Tema 20. Farmacovigilancia y seguridad vacunal 20.1. Farmacovigilancia 20.1.1. Objetivos de la Farmacovigilancia 20.2. Concepto de reacción adversa 20.2.1. Clasificación de las reacciones adversas 20.3. Seguridad vacunal: acontecimientos adversos después de la vacunación (AADV) 20.3.1. Clasificación de AADV 20.4. AADV y su relación con las principales vacunas 20.5. Notificación de reacciones adversas: sistema de Tarjeta Amarilla anexo i. Centros provinciales de vacunación internacional anexo ii. Glosario anexo iii. Páginas web de interés bibliografía Cuestionario de evaluación 208 209 210 211 211 211 212 213 213 213 214 215 216 217 217 217 218 218 219 220 223 231 237 239 243 11 GUÍA DE VACUNAS EN LA OFICINA DE FARMACIA TEMA 1 Epidemiología y control de las enfermedades transmisibles GUÍA DE VACUNAS EN LA OFICINA DE FARMACIA 1.1. definición de enfermedad transmisible Enfermedad transmisible es aquella que precisa la existencia de un agente causal infeccioso que desencadena una respuesta orgánica, y ese agente es comunicable. No equivale a enfermedad infecciosa, ya que hay procesos transmisibles que no son infecciosos (sarna, pediculosis) y hay agentes transmisibles que no desencadenan enfermedad (Streptococcus beta haemolyticus). El término de enfermedad infecciosa se usa cuando la interacción con un microorganismo causa daño al huésped, y el daño asociado a la fisiología alterada origina signos clínicos y síntomas de enfermedad. La característica básica de las enfermedades transmisibles es que hay un agente necesario, en general único, exógeno y capaz de reproducirse o multiplicarse. Su epidemiología consiste en el estudio de los factores que ponen en relación al agente causal con el huésped susceptible. La mayoría de las enfermedades transmisibles han ido disminuyendo tanto en su incidencia como en su mortalidad. La disminución de la incidencia se debe a: a) mejoría de las condiciones higiénicas generales, vivienda, higiene personal; b) mejor nutrición; c) métodos de desinfección, desinsectación y desratización; d) vacunas y antibióticos; e) disminución de la patogenia de los microorganismos debido al proceso de adaptación al huésped. 1.2. Fases de las enfermedades transmisibles a) Periodo de incubación. Intervalo comprendido entre la entrada del microorganismo y la aparición de los primeros síntomas. En este periodo el agente se multiplica y adapta al huésped sin que llegue a provocar una respuesta perceptible. Cada enfermedad tiene un periodo de incubación característico. Este periodo de incubación depende de los siguientes factores: • Número de microorganismos que penetraron. • Tasa de replicación de los microorganismos. • Lugar de multiplicación de los microorganismos. • Respuesta inmunitaria. b) Periodo prodrómico. Aparecen signos generales inespecíficos. Patogénicamente se corresponde a una situación en la que el agente o sus toxinas no actúan aún en sus órganos diana, pero en cambio, sí hay afectación de la puerta de entrada o generalizada. c) Periodo clínico. Aparecen los síntomas o signos que definen a la enfermedad y que con los datos analíticos nos permiten hacer el diagnóstico. 14 T.1 EPIDEMIOLOGÍA y CONTROL DE LAS ENFERMEDADES TRANSMISIBLES 1.3. agente causal 1.3.1. Definición Los postulados de Koch tratan de los principios que rigen la etiología de las enfermedades infecciosas. Para que un microorganismo sea considerado agente causal de una enfermedad infecciosa debe cumplir los siguientes requisitos: a) El microorganismo debe encontrarse en todos los casos de la enfermedad. b) Debe poder aislarse y obtenerse en cultivo puro a partir de las lesiones. c) Debe reproducirse la enfermedad al inocular un cultivo puro a un animal susceptible. d) Debe aislarse el mismo microorganismo de las lesiones producidas en los organismos inoculados. e) El microorganismo ha de inducir una respuesta inmune objetivable. 1.3.2. Características a) Contagiosidad. Es la capacidad que tiene el agente infeccioso de propagarse dentro del sujeto sano susceptible. Se expresa por dos índices: • Tasa de contagiosidad o tasa de ataque: Número de casos de enfermedad en un brote Población expuesta • Tasa de ataque secundario. Mide mejor la contagiosidad que la tasa de ataque global. Número total de casos secundarios Total de susceptibles – casos primarios Entendiendo por casos primarios o casos índice los primeros que se producen en un espacio o lugar determinado y secundarios aquellos cuya fuente de contagio ha sido un caso primario. b) Infectividad. Es la capacidad de instalarse y multiplicarse en los tejidos produciendo o no la enfermedad. La dosis infectante mínima es el número mínimo de microorganismos necesarios para producir la infección. Para que se produzca un infección es necesario la entrada de un número determinado de microorganismos, bien para que por la acción sumatoria local venzan a las defensas orgánicas o tal vez para aumentar las probabilidades de que al menos uno de ellos entre, o más probablemente por la combinación de ambos mecanismos. c) Patogenicidad. Es la capacidad para producir enfermedad en los infectados. Se define por la tasa de patogenicidad: Numero de infectados que enferman Numero total de infectados 15 GUÍA DE VACUNAS EN LA OFICINA DE FARMACIA d) Virulencia. Es una medida cuantitativa de la patogenicidad o de la probabilidad de producir enfermedad. O dicho de otra forma la capacidad de un microorganismo para ocasionar un daño al huésped. Es el grado de patogenicidad del agente causal. Podemos cuantificar la virulencia con la tasa de letalidad: Numero de infectados que fallecen Numero total de infectados 1.4. Cadena epidemiológica Son los pasos que conducen a la aparición de una enfermedad transmisible. Los eslabones de la cadena epidemiológica son: reservorio, fuente, portador, mecanismo de transmisión y huésped susceptible. 1.4.1. Reservorio Es el ser animado o inanimado en el que el agente etiológico se reproduce y perpetúa durante un periodo relativamente largo en un ambiente natural. Cuando se trata del suelo, se llama reservorio adicional o depósito. Cuando el agente pasa desde el reservorio al hombre susceptible actúa como fuente. 1.4.2. Fuente Se define como el ser animado o inanimado desde donde pasa el agente etiológico al huésped o punto de origen del agente infeccioso hasta el huésped susceptible. La fuente puede ser por tanto también reservorio. El hombre es la fuente de infección más importante para los seres humanos. La vía de eliminación depende de la puerta de entrada y de la localización del microorganismo durante la evolución de la enfermedad. 1.4.3. Portador Es la persona que sin padecer los síntomas o signos de la enfermedad transmite microorganismos. Supone un estado de equilibrio y tolerancia entre el agente y el huésped por la presencia en éste de mecanismos de competencia o de inmunidad. 1.4.4. Mecanismo de transmisión Constituyen el conjunto de medios y sistemas que facilitan el contacto del agente infeccioso con el sujeto receptor. Hay enfermedades que tienen un mecanismo único y otras que tienen varios. Los mecanismos de transmisión dependen de la vía de liberación, la resistencia del agente etiológico en el medio externo, la puerta de entrada y el número de gérmenes necesarios para producir infección. a) Transmisión directa. Es el auténtico contagio o paso de una enfermedad transmisible de la fuente de infección al sujeto sano susceptible por una relación inmediata sin interferencias de ningún tipo. Suele darse en microorganismos con poca resistencia al medio exterior (luz y desecación), o cuando se requiere un contacto prolongado para producir la infección. Los mecanismos directos más importantes son: • Contacto directo. Incluye: 1) Vía sexual. Por ejemplo sífilis, gonorrea. 16 T.1 EPIDEMIOLOGÍA y CONTROL DE LAS ENFERMEDADES TRANSMISIBLES 2) Contacto de mucosas. Por ejemplo mononucleosis infecciosa. 3) Transmisión intrapartum. Por ejemplo gonorrea. 4) Transplacentaria. Por ejemplo rubeola, toxoplasmosis. 5) Transmisión holodáctila. De Holos (todo) dactilos (dedo), es decir a través de las manos. Por ejemplo la salmonelosis. • Por medio del aire. Aunque en realidad hay un intermediario y no se debería hablar de contacto directo debido a la proximidad física que es necesaria, se suele incluir en este grupo. Es la vía de diseminación más frecuente. • Mordeduras. Por ejemplo rabia. • Arañazo. Por ejemplo linforreticulosis benigna. b) Transmisión indirecta. Se considera como tal cuando hay separación en el tiempo y en la distancia entre la fuente de infección y el sujeto susceptible; existe entre seres animados (animales o artrópodos) o inanimados (alimentos, agua, o fómites). El agente se puede reproducir en el vehículo de transmisión, y se denomina entonces mecanismo propagativo, o no, actuando de modo mecánico. 1.4.5. Huésped susceptible Entendemos por huésped aquella persona o animal que sirve de nicho ecológico para que un microorganismo pueda multiplicarse, pudiendo dar lugar a una infección e incluso a una enfermedad. Se habla de huésped susceptible cuando se da la condición necesaria para que el hombre se convierta en huésped y sea afectado por un agente causal. Es lo opuesto a la resistencia o inmunidad. Los factores que influyen sobre la susceptibilidad o vulnerabilidad del huésped son: a) Edad, que influye sobre el sistema inmunológico (los recién nacidos tienen anticuerpos de la madre) y sobre las posibilidades de exposición (el neonato está aislado de la comunidad). b) Lugar de trabajo. Los médicos tienen más riesgo de infecciones que otras profesiones. c) Estado inmunitario y patología de base. 17 GUÍA DE VACUNAS EN LA OFICINA DE FARMACIA TEMA 2 Concepto y clasificación de las vacunas GUÍA DE VACUNAS EN LA OFICINA DE FARMACIA 2.1. Concepto de vacunación La vacunación consiste en la inducción y producción de una respuesta inmunitaria específica protectora, es decir, la producción de anticuerpos mediada por células, y que es realizada por un individuo sano susceptible como consecuencia de la administración de un producto biológico, o mejor dicho inmunobiológico. La intención es producir una respuesta similar a la inmunidad natural, pero sin que se produzca ninguna manifestación ni síntoma de la enfermedad. Las vacunas están formadas por antígenos inmunizantes capaces de generar la producción de anticuerpos pero no la enfermedad. Su mecanismo de acción se basa en la respuesta del sistema inmune a cualquier agente extraño o antígeno y en la memoria inmunológica. La vacunación es por tanto, el eje clave para la prevención de las enfermedades infecciosas. Constituye uno de los pilares fundamentales de la salud pública, siendo esencial en dicha prevención los programas de vacunación, que cada día se van actualizando y que han pasado desde su comienzo, a inicio de los años 60, hasta nuestros días por un cambio sustancial que obliga a hacer una revisión exhaustiva de su clasificación y usos. Hay dos conceptos que tenemos que definir en este momento ya que van a ser empleados en este tema y a lo largo del resto. Son la inmunogenicidad y la reactogenicidad de las vacunas. El primero hace referencia a la propiedad de la vacunas para inducir una respuesta inmunitaria detectable, es decir alcanzar el nivel de anticuerpos suficientes para estar protegidos frente a la enfermedad para la cual nos hemos vacunado. y el segundo a la seguridad de las vacunas y se mide en función de las reacciones adversas locales o sistémicas que la vacuna puede producir tras su administración. 2.2. Clasificación de las vacunas 2.2.1. Clasificación microbiológica Según el integrante antigénico: Vacunas bacterianas o víricas (Véase tabla 1). 2.2.2 Clasificación según el método de fabricación a) Atenuadas (Véase tabla 2). Obtenidas a partir de microorganismos que han perdido su virulencia como resultado de inoculaciones o siembras repetidas en medios de cultivo, pero que conservan su capacidad antigénica ya que son microorganismos vivos. Su inmunogenicidad suele ser de larga duración y muy intensa, parecida a la enfermedad natural, ya que inducen inmunidad celular y humoral. Por lo general suelen requerir dosis bajas de antígenos o incluso se podría reducir la cantidad de antígeno a administrar en dosis sucesivas, si bien en muchos casos suele ser suficiente con una sola dosis, salvo en el caso de la polio oral en la que son necesarias al menos tres dosis. Otro aspecto a tener en cuenta en este tipo de vacunas es que con frecuencia pueden ser contagiosas para el entorno favoreciendo la infección por el microorganismo atenuado en lugar del microorganismo salvaje, lo que sucede con la vacuna oral de polio, lo que obliga a ser prudentes a la hora de la vacunación a inmunodeprimidos o su entorno. 20 T.2 CONCEPTO y CLASIFICACIóN DE LAS VACUNAS Vivas / Atenuadas Muertas / Inactivadas Bacterianas Enteras Tuberculosis (vacuna BCG) Cólera oral Fiebre tifoidea oral Cólera i.m. Tos ferina Fiebre tifoidea parenteral Subunidades/toxoides Tétanos Difteria Polisacáridos capsulares Meningococo A, C, Y, W135* Neumococo 23 valente Conjugadas Meningococo C Neumococo 7 valente Haemophilus influenzae b Componentes acelulares Tos ferina acelular Víricas Enteras Varicela Fiebre amarilla Polio oral Polio oral Sarampión Rubeola Paperas Rotavirus Herpes zóster Subunidades Rabia Gripe Polio inyectable Hepatitis A Encefalitis japonesa* Encefalitis Centroeuropea* Hepatitis B Gripe Papilomavirus * Solo disponibles a través de Sanidad Exterior y los Centros de Vacunación a Viajeros autorizados. Tabla 1. Clasificación microbiológica y según método de fabricación de las vacunas (Salleras Ll, 1998 modificado). b) Inactivadas. Obtenidas a partir de microorganismos muertos mediante procedimientos físicos o químicos, es decir por calor, con formol, etc. Éstas pueden ser a su vez de cuatro tipos: vacunas de microorganismos totales o enteros, con antígenos purificados, fracciones víricas o bacterianas, o con antitoxinas (toxoides o anatoxinas). En general su respuesta es menos intensa, menos duradera en el tiempo, es de tipo humoral, suele requerir varias dosis para la primovacunación y para mantener un nivel de anticuerpos óptimo. Como ventajas diremos que son más estables, suelen llevar adyuvantes, lo que facilita y potencia su respuesta, y no es posible la difusión de la infección en los no vacunados. 21 GUÍA DE VACUNAS EN LA OFICINA DE FARMACIA Vacunas atenuadas Atenuación mediante pases en cultivos celulares o en medios bacteriológicos. Suelen requerir una sola dosis. Necesitan un número menor de microorganismos. Suelen ser menos estables. No requieren adyuvantes. Inducen respuesta humoral y celular. Hay la posibilidad de difusión de la infección entre no vacunados. Vacunas inactivadas Pueden elaborarse a partir de microorganismos completamente virulentos. Requieren múltiples dosis. Necesitan gran número de microorganismos. Son más estables. Requieren adyuvantes. Inducen solo la producción de anticuerpos. No es posible la difusión de la infección a los no vacunados. Por lo general se administran por vía parenteral. Tabla 2. Características generales de las vacunas atenuadas e inactivadas (Salleras Ll, 1998 modificado). c) Recombinantes. Se elaboran a partir de la clonación de genes que codifican proteínas antigénicas específicas en una célula huésped. En cuanto a la inmunogenicidad y reactogenicidad se comportan como las vacunas inactivadas. d) Sintéticas. Fabricadas a partir de polipéptidos que copian la secuencia primaria de aminoácidos de los determinantes antigénicos del microorganismo. Al igual que en el caso anterior, los comentarios sobre inmunogenicidad y reactogenicidad son los mismos que en las vacunas inactivadas. 2.2.3. Clasificación según su composición a) Vacunas monovalentes. Contienen un solo componente antigénico. b) Vacunas polivalentes. Contienen distintos tipos antigénicos de una misma especie, sin inmunidad cruzada entre ellos. c) Vacunas combinadas. Contienen una asociación de varios elementos antigénicos de distintas especies o microorganismos. 2.2.4. Clasificación según su uso sanitario b) Vacunas sistemáticas (Véase tabla 3). Vacunas que tienen un interés sanitario de tipo comunitario y que se aplican por tanto a la totalidad de la población, formando parte de los programas de vacunación de los distintos países. Dentro de este grupo tenemos todas aquellas vacunas que de forma general se emplean en la infancia y que forman parte del calendario vacunal. Entre ellas están las vacunas contra la poliomielitis, difteria, tétanos, tos ferina, hepatitis B, meningitis por Haemophilus influenzae y meningococo C, rubeola, sarampión y paperas, todas ellas vacunas eficaces frente a enfermedades frecuentes en la infancia. Estas vacunas han permitido grandes logros para el control y eliminación de enfermedades de gran impacto en la población. Algunas de ellas como la vacuna oral de polio y la del sarampión están permitiendo en la actualidad incluso la erradicación de estas dos enfermedades. b) Vacunas no sistemáticas. Vacunas que no tienen un interés comunitario sino individual, estando indicadas en función de factores de riesgo, personales o ambientales de cada individuo, o ante la aparición de brotes epidémicos. Dentro de estas vacunas tenemos todas aquellas que se aplican fuera del calendario vacunal y que con más frecuencia se emplean en adultos. Otro aspecto importante a considerar en la edad adulta y que cada vez juega un papel más importante en nuestro medio, es la vacunación del viajero. Estos aspectos se tratarán en el tema 16. El uso de las 22 T.2 CONCEPTO y CLASIFICACIóN DE LAS VACUNAS vacunas en viajeros tiene especial relevancia ya que los riesgos de contraer enfermedades infecciosas aumentan de forma considerable en este colectivo. Si bien según los diferentes estudios realizados las enfermedades más frecuentes son la diarrea y las enfermedades de la piel, no están exentos de otras que podemos evitar y que por su gravedad merece la pena que lo hagamos. Entre otras podríamos hablar de la fiebre amarilla, la hepatitis A o el tétanos, enfermedades que podemos prevenir claramente con la administración de sus respectivas vacunas todas ellas eficaces, efectivas y seguras. Vacunas sistemáticas Vacunas no sistemáticas DTPa VPI (vacuna de polio inactivada) Triple vírica VHB (vacuna de hepatitis B) Hib (vacuna de Haemophilus influenzae tipo b) Antimeningocócica C Papilomavirus Varicela1 Antineumocócica conjugada1 Fiebre tifoidea BCG (vacuna contra la tuberculosis) Antineumocócica Cólera Gripe Rabia Fiebre amarilla Varicela VHA Encefalitis japonesa Rotavirus Antimeningocócica tetravalente (A+C+Y+W135) 1. Sólo en algunas Comunidades Autónomas Tabla 3. Clasificación sanitaria de las vacunas. 2.3. normas generales sobre el uso de las vacunas La administración de las vacunas o de cualquier producto inmunobiológico requiere de una sistemática sencilla que vamos a detallar a continuación de una forma breve y concisa. 2.3.1. Técnicas de administración de vacunas Es necesaria la desinfección de la zona de punción. Se debe esperar a que ésta se seque antes de administrar las vacunas, no recomendándose el uso de alcohol en ningún caso en general y de forma particular en el caso de vacunas atenuadas. Ahora bien, en cuanto a la vía de administración por lo general se emplean tres, la oral, la intramuscular y la subcutánea o hipodérmica. Como es lógico el empleo de una vía u otra obedece a las indicaciones que las casas comerciales hacen en cada caso y que es conveniente seguir adecuadamente. Además de esas indicaciones merece la pena destacar que cada una de las vías de administración tienen sus peculiaridades y condicionan que las vacunas requieran a veces más de una dosis, como en el caso de la polio que se administra por vía oral, o que incluso en el caso de que se produzca un vómito en los 5-10 minutos siguientes a la vacunación, requiera una revacunación. En el caso de la administración intramuscular debemos recordar que si bien es una buena vía de administración, ésta no se debe emplear en el caso de diátesis hemorrágica. Los lugares más empleados por su seguridad y eficacia son el deltoides y el vasto externo (cara externa del muslo) en el caso de los niños menores de 18 meses. La vía hipodérmica o subcutánea es de absorción más lenta pero igual de eficaz y es la elegida en vacunas atenuadas como triple vírica o fiebre amarilla, aunque también se emplea en algunas inactivadas como polio inyectable, o incluso en vacunas de polisacáridos como la antimeningocócica y la antineumocócica. 23 GUÍA DE VACUNAS EN LA OFICINA DE FARMACIA Finalmente, y aunque no hemos dicho nada previamente se suele emplear la vía intradérmica, pero ésta sólo se usa en el caso de la vacuna contra la tuberculosis que hoy por hoy tiene un uso restringido a los recién nacidos en un seno familiar de alto riesgo de contraer la enfermedad, y en el caso de la vacuna contra la rabia que en nuestro medio se emplea como profilaxis post-exposición. 2.4. Mecanismo de actuación de las vacunas Hay tres respuestas secuenciales frente a la vacunación: a) Inducción de cascadas proteolíticas que tratan de aislar el cuerpo extraño (complemento, calicreína y sistema de coagulación). b) Reconocimiento y atrapamiento del microorganismo o el antígeno por las células fagocíticas. c) Inducción de una respuesta humoral por liberación de péptidos antimicrobianos. Existe un cierto grado de solapamiento entre el sistema inmunitario innato y adaptativo, que cubre el desfase temporal entre la respuesta inmediata y la aparición de anticuerpos. Algunos de los elementos de la inmunidad innata están preformados y preparados para actuar sin cambios (anticuerpos naturales, proteína C reactiva, vía alternativa del complemento), pero hay otros que tienen que ser activados por señales externas (macrófagos, células dendríticas, linfocitos T citolíticos, neutrófilos). En cuanto al sistema inmunitario adaptativo está constituido por células quiescentes, los linfocitos B y T que pueden responder ante un antígeno único y específico. Cuando se presenta o reconoce un antígeno estos linfocitos proliferan para originar una población clonal de células que elaboran una respuesta inmunitaria frente al antígeno extraño. Para que se genere una respuesta inmunitaria, los antígenos suelen necesitar de la interacción de los linfocitos B y T (dependiente de linfocitos T). La respuesta frente a las vacunas se valora midiendo la aparición y concentración de anticuerpos específicos en el suero. En el caso de algunas vacunas virales, como las de sarampión, rubeola y hepatitis B, la presencia de anticuerpos circulantes se correlaciona con la protección clínica. Aunque este indicador ha servido como signo de inmunidad, la seroconversión sólo mide la parte humoral de la respuesta inmunitaria. Se produce un fracaso secundario de la vacuna cuando un paciente con inmunidad previa adecuada pierde los anticuerpos identificables a lo largo del tiempo. Se ha empleado la valoración de la persistencia de anticuerpos para determinar la duración de la inmunidad producida por la vacuna. Sin embargo, la ausencia de anticuerpos identificables puedo no indicar falta de protección en el individuo. 24 T.2 CONCEPTO y CLASIFICACIóN DE LAS VACUNAS 2.5. Calendario vacunal Tras la incorporación de las nuevas vacunas, el calendario vacunal propuesto por el Consejo Interterritorial del Sistema Nacional de Salud para el 2008 queda como sigue: Edad Poliomielitis 2 4 VPI1 VPI2 Meses 6 12 15 VPI3 18 3 4 6 Años 10 11 13 14 16 VPI4 Difteria Tétanos DTPa1 DTPa2 DTPa3 DTPa4 Hib2 Hib4 DTPa5 o DT Td Pertussis Haemophilus influenzae B Hib1 Hib3 Sarampión, rubeola, parotiditis Hepatitis B TV1 TV2 (a) HB 3 dosis HB 3 dosis (b) 0, 1-2 y 6 meses Meningitis meningocócica C MenC1 MenC2 (c) MenC3 (d) Varicela Papilomavirus VVZ (e) VPH 3 dosis (f) Tabla 4. Calendario de vacunaciones recomendado por el Consejo Interterritorial del Sistema Nacional de Salud para el año 2007 (Aprobado el 10 de octubre de 2007). a) Niños no vacunados en este rango de edad, recibirán la segunda dosis entre los 11-13 años. b) Niños que no hayan recibido la primovacunación en la infancia. c) Se administrarán dos dosis de vacunas MenC entre los 2 y 6 meses de vida, separadas entre sí al menos dos meses. d) Se recomienda administrar una dosis de recuerdo a partir de los doce meses de vida. e) Personas que refieran no haber pasado la enfermedad ni haber sido vacunados con anterioridad, siguiendo indicaciones de la ficha técnica. f) Vacunar en una única cohorte a las niñas entre los 11-14 años de edad. 25 GUÍA DE VACUNAS EN LA OFICINA DE FARMACIA TEMA 3 Vacuna frente a poliomielitis GUÍA DE VACUNAS EN LA OFICINA DE FARMACIA 3.1. aspectos generales de la poliomielitis La poliomielitis es una enfermedad vírica que a menudo se identifica por la parálisis flácida de comienzo agudo. Se produce una afectación de vías digestivas (cuadro de gastroenteritis aguda) y posteriormente del sistema nervioso. Solo en el 1% de los casos aparece con parálisis asimétrica y fiebre desde el comienzo y en algunos casos meningitis. También hay una afectación de los miembros inferiores, deglución y músculos del sistema respiratorio. En la actualidad es una enfermedad en proceso de erradicación, pero en los países en vías de desarrollo continúa siendo una infección endémica. La poliomielitis paralítica puede considerase como un importante problema de Salud Pública. La erradicación de esta enfermedad, no solamente se traduce en la ausencia de casos, sino en la erradicación del virus que la causa. 3.2. Características del agente etiológico Los poliovirus pertenecen a la familia Picornaviridae, del género Enterovirus. El virión del poliovirus es de pequeñas dimensiones, con un diámetro entre 27 y 30 ηm. La cápside encierra un genoma de RNA lineal de cadena única. En la actualidad se conocen tres serotipos basados en pruebas de neutralización cruzada (tipo 1, tipo 2 y tipo 3). 3.3. Cadena epidemiológica de la poliomielitis a) Reservorio: Únicamente humano, constituido por individuos de infección inaparente. b) Mecanismo de transmisión: Contacto directo de los sujetos susceptibles con secreciones respiratorias y heces infectadas. También, pero menos, frecuentemente en fómites y aguas residuales. c) Periodo de transmisibilidad: En secreciones faríngeas se detectan los virus desde las 36 horas de la instauración de la infección hasta 1 ó 2 semanas después. En heces, 72 horas tras la exposición hasta 5 semanas. d) Período de incubación: 7-14 días, aunque puede variar entre 3 y 35 días. 3.4. epidemiología de la poliomielitis La poliomielitis prácticamente ha desaparecido en los países desarrollados, siendo en la actualidad una enfermedad en proceso de posible erradicación. 28 T.3 VACUNA FRENTE A POLIOMIELITIS Sin embargo, en muchos países en vías de desarrollo sigue siendo una enfermedad endémica, constituyendo un auténtico problema de Salud Pública. Esta enfermedad puede ser erradicada ya que solamente afecta a humanos y porque existe actualmente una vacuna eficaz, segura y barata, creando una inmunidad para toda la vida. Esta situación también se favorece porque no existen portadores a largo plazo ya que el virus solamente sobrevive en el ambiente durante un periodo corto de tiempo. El objetivo 5 de la Estrategia de Salud para Todos de la OMS para el año 2000, que señalaba la erradicación mundial de la poliomielitis para ese año, fue postergado hasta el año 2005. Pese a ello, los resultados son muy esperanzadores. No se ha encontrado el poliovirus salvaje de tipo 2 desde octubre de 1999, año en que fue detectado por última vez en el oeste de Uttar Pradesh (India). Al terminar el año 2000, menos de un tercio de la población del mundo vivía en países donde la poliomielitis todavía era endémica, en comparación con más de 80% en 1988. Las actividades o estrategias propuestas por la OMS para la obtención del certificado de erradicación de la polio son las siguientes: a) Programas de inmunización rutinaria. b) Establecimiento de los llamados Días Nacionales de Inmunización. c) Actividades de inmunización “de barrido”. d) Sistema de Vigilancia de la Parálisis Flácida Aguda (PFA). De manera complementaria pueden implantarse estrategias de vigilancia medioambiental, vigilancia de enterovirus o estudios de seroprevalencia. En España la vacunación antipoliomielítica se introduce en 1963, provocando un descenso brusco en la incidencia de la enfermedad, alcanzándose una reducción del 90% en el número de casos declarados de la enfermedad. Los últimos casos autóctonos se detectaron en Andalucía durante los años 1987 y 1988 afectando a población marginal no vacunada. En al año 1989 se detectan dos casos de poliomielitis. Uno de ellos era un caso importado de Mauritania mientras que el segundo era un caso compatible con polio asociado a vacunación. No podemos estimar datos sobre cobertura vacunal durante los primeros años en que se introdujo la vacuna, aunque se supone que las coberturas fueron altas llegando a alcanzarse los dos millones de dosis administradas en 1970. En la actualidad las coberturas obtenidas varían entre el 70% y el 90% según las distintas comunidades, pero se considera que estas coberturas están infraestimadas debido al método empleado en su estimación. El éxito en los países donde aún es endémica la poliomielitis dependerá cada vez más de que se resuelvan tres dificultades fundamentales: a) Lograr el acceso y vacunar al mayor número posible de niños, sobre todo en los países sumidos en conflictos. b) Mantener e intensificar el compromiso de los gobiernos y la participación multisectorial ante una enfermedad en vías de desaparición. c) Recabar el financiamiento externo necesario para llevar a término la tarea. 29 GUÍA DE VACUNAS EN LA OFICINA DE FARMACIA 3.5. Composición de la vacuna frente a la poliomielitis Existen tres tipos de vacunas contra la polio: a) Vacuna de polio inactivada (VPI) de virus inactivados o vacuna Salk. Se prepara con suspensiones de cepas de los tres serotipos inactivados con formol. Cada dosis contiene 1-3 x 107 DICT50 de cada uno de los tres serotipos. b) Vacuna de polio inactivada de potencia aumentada (VPIa) inactivada de potencia aumentada. Vacuna de elección en los países en los que no hay casos de polio. Cada dosis tiene 40 unidades antigénicas (UA) D del serotipo 1; 8 UA del 2 y 32 UA del serotipo 3. c) Vacuna de polio oral (VPO) vacuna oral con virus vivos atenuados o vacuna Sabin. Se prepara con suspensiones de cepas de neurovirulencia atenuada de los tres serotipos de poliovirus, obtenidas por pases sucesivos en cultivos celulares de células diploides. Cada dosis contiene 106 DICT50 del serotipo 1, 105 DICT50 del 2 y 105,5 DICT50 del serotipo 3. Todas las vacunas pueden contener neomicina, estreptomicina y/o polimixina B que contribuyen a la inactivación y a evitar la posible contaminación por bacterias. 3.6. indicaciones de la vacuna de la poliomielitis 3.6.1. Indicaciones de la VPO (vacuna Sabin) Se ha utilizado como vacunación sistemática en población infantil. Actualmente, tanto en nuestro país como en la mayoría de los países de la Unión Europea, ha sido sustituida por la VPI como vacunación sistemática de la población infantil, debido a la erradicación de la enfermedad del continente europeo. a) Indicada en niños no vacunados o vacunados de forma incompleta con riesgo inmediato de exposición al virus. b) Indicada en casos excepcionales en población adulta como en viajeros, epidemias, laboratorios, personas no vacunadas en contacto estrecho con enfermos e incluso con sujetos vacunados. 3.6.2. Indicaciones de la VPI (vacuna Salk) a) En la actualidad, desde marzo del 2004, se emplea en la vacunación sistemática en población infantil. b) En personas inmunodeprimidas que no han sido vacunadas. c) Enfermos infectados con VIH, sintomáticos o asintomáticos. d) Personas que conviven con inmunodeprimidos, incluidos los infectados por VIH. e) Personas ingresadas en hospitales que precisen ser vacunadas. f) Adultos no inmunizados o inmunizados de forma incompleta, que conviven con niños a los que se administra VPO. g) Adultos no inmunizados o parcialmente inmunizados, con riesgo futuro de exposición al virus. h) Individuos que no aceptan la VPO. 30 T.3 VACUNA FRENTE A POLIOMIELITIS 3.6.3. Criterios para la introducción de polio inactivada en los países que utilizan polio oral La Organización Mundial de la Salud recomienda que la VPI (exclusiva o secuencial) no se introduzca en los calendarios de vacunación en cualquiera de las siguientes circunstancias: a) En países tropicales en vías de desarrollo. b) En países hasta hace poco libres de polio, o que actualmente sean endémicos, o que tengan sustanciales contactos con un área endémica. c) En países que utilicen la pauta del Programa Ampliado de Inmunización (6, 10 y 14 semanas). d) Si se dispone de escasos recursos económicos. e) Si las coberturas de vacunación son inferiores al 90%. 3.7. Pautas de vacunación 3.7.1. Pauta de vacunación en la edad infantil con VPO a) A toda la población infantil a partir de los 2-3 meses de edad, en 3 dosis iniciales separadas por un intervalo de 4-8 semanas, seguidas de una 4ª dosis a los 15-18 meses, siendo necesario a veces la indicación de una quinta dosis entre los 6-14 años de edad. b) En niños en los que no se haya completado la pauta basta con completarla hasta administrar 3 dosis, aunque la ficha técnica indica 3 más una dosis de recuerdo. 3.7.2. Pauta de vacunación en la edad infantil con VPIa Con VPIa la pauta es igual que con VPO. 3.7.3. Pauta de administración secuencial con VPIa y VPO Consiste en la administración, en niños, de dos primeras dosis de VPIa, completando la pauta con VPO. El fundamento de esta pauta consiste en que las dos dosis de VPIa inducen inmunidad humoral suficiente para prevenir los casos raros de enfermedad paralítica en los vacunados, secundarios al uso de VPO. Las dosis de VPO nos darán la inmunidad local. Cuando termine la vacunación se conseguirá inmunidad humoral y local. 3.7.4. Pauta de administración en la edad adulta La vacuna de elección es la VPI debido al mayor riesgo de enfermedad paralítica al administrar VPO. Se administrarán tres dosis con la pauta 0-2-6 ó 12 meses. Si es necesario se acelerará la vacunación con pauta de 0-1-2 meses. En el caso de adultos en contacto con niños vacunados con VPO, la vacunación se hará previamente a la vacunación del niño. 31 GUÍA DE VACUNAS EN LA OFICINA DE FARMACIA En no inmunizados que viajes a zonas endémicas podría bastar con una sola dosis. En parcialmente inmunizados 1 dosis única de vacuna. 3.8. Vía de administración a) Vacuna VPO: vía oral. b) Vacunas VIP o VPIa: vía subcutánea o intramuscular. 3.9. Contraindicaciones y precauciones a) Hipersensibilidad a los componentes de preparado. b) Embarazo. No pueden administrase vacunas de virus vivos durante el embarazo. Se puede emplear VPIa si hay riesgo elevado de contagio. c) Inmunodeprimidos. Las vacunas de virus vivos están contraindicadas en casos de inmunosupresión, infección por VIH, convivientes con inmunodeprimidos, etc. d) Diarrea aguda. En caso de diarrea aguda aplazar la vacunación con VPO. Si se administró a un niño una dosis hay que repetirla lo antes posible, para reparar pérdidas de vacunación o bien interferencias con otros enterovirus. No es necesario interrumpir la lactancia. 3.10. reacciones adversas Generalmente son poco frecuentes. Se han descrito síntomas generales como vómitos o cefaleas tras la vacunación. En raras ocasiones se ha descrito una asociación temporal entre VPO y síntomas y signos de polio paralítica, generalmente tras la primera dosis. La frecuencia de esta circunstancia es 1 caso cada 2,5 millones de dosis administradas. 3.11. Conservación y transporte a) VPO: entre +2 ºC y +8 ºC, sin sobrepasar esa temperatura durante el transporte. b) VPI y VPIa: entre +2 ºC y +8 ºC sin sobrepasar los 22 ºC en su transporte, ni en ningún caso debe congelarse. 32 T.3 VACUNA FRENTE A POLIOMIELITIS 3.12. Vacunas antipoliomielíticas comercializadas Vacunas antipoliomielíticas VPO solas Código nacional 793794.4 Nombre Vacuna Polio Sabin Descripción 1 dosis vial Composición Virus de la poliomielitis atenuados, cepas Sabin tipo 1, tipo 2 y tipo 3. Puede contener trazas de sulfato de neomicina. Vacunas antipoliomielíticas VPI solas Código nacional 757344.9 Nombre Vacuna Poliomielítica Berna Descripción 1 ampolla 1 ml Composición Virus de la poliomielitis inactivados, cepas tipo 1, 2 y 3. Puede contener trazas de neomicina, estreptomicina y polimixina B. Vacunas antipoliomielíticas combinadas (VPI + DTPa + Hib) Código nacional Nombre Descripción Composición 841320.1 InfanrixIPV+HIB Vial liofilizado + 1 jeringa precargada 0,5 ml Virus de la poliomielitis inactivados, cepas tipo 1, 2 y 3. Acompañado de toxoide diftérico, toxoide tetánico, fracción antigénica de Bordetella pertussis (toxoide pertussis, hemaglutinina filamentosa y pertactina) y polisacárido capsular PRP de Haemophilus influenzae B. 651501.3 Pentavac Vial liofilizado + 1 jeringa precargada 0,5 ml Virus de la poliomielitis inactivados, cepas tipo 1, 2 y 3. Acompañado de toxoide diftérico, toxoide tetánico, fracción antigénica de Bordetella pertussis (toxoide pertussis y hemaglutinina filamentosa) y polisacárido capsular PRP de Haemophilus influenzae tipo b. Vacunas antipoliomielíticas combinadas (VPI+ DTPa + Hib + VHB) Código nacional 820068.9 657445.4 Nombre Infanrix Hexa Descripción Vial liofilizado + 1 jeringa precargada 0,5 ml sin aguja Vial liofilizado + 1 jeringa precargada 0,5 ml con aguja Composición Virus de la poliomielitis inactivados, cepas tipo 1, 2 y 3. Acompañado de toxoide diftérico, toxoide tetánico, fracción antigénica de Bordetella pertussis (toxoide pertussis, hemaglutinina filamentosa y pertactina), polisacárido capsular PRP de Haemophilus influenzae tipo b y antígeno de superficie (AgHBs) del virus de hepatitis B. Puede contener trazas de neomicina y polimixina B. Tabla 5. Vacunas antipoliomielíticas comercializadas en España. 33 GUÍA DE VACUNAS EN LA OFICINA DE FARMACIA TEMA 4 Vacuna frente a difteria, tétanos y tos ferina GUÍA DE VACUNAS EN LA OFICINA DE FARMACIA 4.1. difteria 4.1.1. Aspectos generales de la difteria La introducción en 1926 de la inmunización vacunal con toxoide diftérico, y sobre todo, a partir de 1949 cuando se inició su uso combinado con el toxoide tetánico y la vacuna antipertúsica, modificó drásticamente la epidemiología de la difteria. Su distribución es mundial, de presentación epidémica aproximadamente cada 10 años y predominante en los meses fríos del año. La enfermedad ya era conocida por Hipócrates en el siglo V a. de C. Pero no fue hasta 1826 cuando fue descrita por primera vez la enfermedad por Bretonneau, quien le otorgó el nombre que conocemos en la actualidad. En 1883, Klebs describió el bacilo diftérico asociándolo a la enfermedad. En 1901 Behring contribuyó a la prevención de dicha enfermedad gracias a la obtención del suero antidiftérico. 4.1.2. Características del agente etiológico El agente etiológico es el Corynebacterium diphtheriae. Es un bacilo Gram + inmóvil, no capsulado ni esporulado, siendo su único reservorio el hombre. La principal virulencia viene determinada por la acción de su potente exotoxina, que inhibe la síntesis proteica en las células de mamíferos, pero no en las bacterias. Es una toxina muy potente y letal. 4.1.3. Cadena epidemiológica de la difteria El único reservorio de C. diphtheriae es el hombre. Su mecanismo de transmisión es a través de inspiración de pequeñas gotitas respiratorias por vía aérea y/o por contacto directo con secreciones respiratorias o exudado de lesiones cutáneas infectadas. El periodo de incubación es entre 2 y 5 días. Generalmente la infección da lugar a estado de portador asintomático y sólo ocasionalmente aparece la enfermedad clínica, siendo el estado de portador muy importante en la transmisión de la enfermedad y en la adquisición de inmunidad frente a ella, pudiendo diseminar los gérmenes hasta 6 meses después. En condiciones endémicas hasta el 3-5% de los individuos pueden alojar al microorganismo en la faringe, pero en nuestro medio donde, la enfermedad es poco común, el aislamiento en individuos sanos es muy raro. 4.1.4. Signos y síntomas diftéricos Los bacilos se introducen por las vías respiratorias e invaden el epitelio de las mucosas de las amígdalas y de la faringe. Generalmente no pasan a la sangre. Sus manifestaciones clínicas más frecuentes según la localización anatómica de la enfermedad son: laringitis, faringitis y difteria cutánea. Ésta última se caracteriza por úlceras crónicas incurables con una membrana sucia y a menudo asociadas a infecciones por estafilococos y estreptococos. La recuperación frente a la enfermedad, sea cual sea su manifestación clínica, no indica inmunidad permanente. a) Difteria faringo-amigdalar: se presenta con fiebre elevada, disfagia, voz gangosa y reacción adenopática submaxilar uni o bilateral. Posteriormente se forman las típicas membranas blanco-nacaradas que se extienden más allá de las amígdalas y sangran con facilidad si se intenta desprenderlas. b) Difteria faríngea o nasal: manifestación clínica de la difteria que se caracteriza por rinorrea sanguinolenta, visualizándose las membranas en el tabique nasal. Las complicaciones propias de la difteria son alteraciones neurológicas como parálisis de las cuerdas vocales, miocarditis y neuritis. 36 T.4 VACUNA FRENTE A DIFTERIA, TÉTANOS y TOS FERINA 4.1.5. Epidemiología de la difteria Tiene una distribución mundial, causando epidemias cada 10 años, sin tener una explicación clara, y principalmente en los meses fríos, como sucede con la mayoría de las enfermedades cuya vía de transmisión es aérea. La incidencia y el patrón de la difteria en los países occidentales han cambiado notablemente en los últimos 50-70 años, pasando de los 147.991 casos notificados en EEUU en 1920 a 5 casos en 1980. La difteria afecta principalmente a los menores de 15 años, pero la inmunización iniciada en los años 40-50 en los países industrializados ha modificado este patrón hacia los adultos. En los países en vías de desarrollo la inmunización comenzó en los años 70. La cobertura vacunal ha sido del 46% en el año 1985, llegando al 79% en 1992. En los últimos años han surgido dos ondas epidémicas en Europa del Este: la primera entre 1982 y 1985 con 1917 casos, y la segunda y más reciente entre 1990 y 1994. Las tasas de ataque mayores se han producido en los lugares con densidad de población más alta, como Moscú y San Petersburgo, declarándose 39.703 casos en 1994. Todos los grupos etarios han sido afectados pero más del 70% de los casos han afectado a mayores de 14 años con una mortalidad del 5%. Diversos países están notificando casos de difteria importada, como Turquía (63 casos en 1993) y casos aislados en Alemania, Austria, Bulgaria, Finlandia, Noruega, Polonia, Italia y Reino Unido. En España la vacunación frente a difteria se introdujo con carácter obligatorio en 1945. Desde 1965 se vacuna de forma sistemática con la vacuna combinada con antipertussis y toxoide tetánico (DTP). Los últimos casos fueron declarados en 1986. La presencia de anticuerpos en menores de 10 años es del 96,7%. A partir de esta edad se detecta una disminución importante en los niveles de anticuerpos, siendo del 30,9% en el rango de 20-40 años y 22,8% en el rango de 18 a 44 años, por lo que el riesgo de epidemia se presenta fundamentalmente en la población adulta. 4.2. Vacuna contra la difteria La vacuna antidiftérica, constituida por toxoide diftérico, se comercializa combinada trivalente DTP (Difteria – Tétanos – Pertussis), DTPa (Difteria – Tétanos – Pertussis acelular) o bivalente (DT) para vacunación infantil, que puede ser empleada desde los dos meses de edad del niño si fuese necesario. También existen combinaciones bivalentes (Td y dTpa) para su uso en adultos. La denominación de la “d” o la “pa” se debe a que la cantidad de toxina diftérica o pertúsica. “d” es la décima parte que en la vacuna DTPa convencional, y en el caso de la “pa” es casi la mitad de la dosis de antígeno que en la vacuna DTPa Un 90-95% de los vacunados con cuatro dosis de DTP adquiere anticuerpos considerados protectores (>0,01 UI/ml). Esta inmunidad persiste durante 5 años, disminuyendo progresivamente hasta el décimo año (50% a los 6 años), por lo que es necesaria una dosis de refuerzo cada 10 años. 4.2.1. Indicaciones La vacuna está indicada para la inmunización universal a partir de los 2-3 meses de vida y en adultos que no hayan sido vacunados en la infancia o hayan transcurridos más de 10 años desde la última dosis. También se recomienda vacunar a mujeres en edad fértil no vacunadas o no revacunadas. En embarazadas se recomienda retrasar la vacunación hasta el segundo trimestre, aunque no hay indicios de teratogenicidad. La vacuna debe administrarse en personas que han pasado la enfermedad ya que ésta no confiere inmunidad permanente. 37 GUÍA DE VACUNAS EN LA OFICINA DE FARMACIA 4.2.2. Contraindicaciones La vacuna solo está contraindicada en casos de enfermedades febriles agudas, anafilaxia a alguno de los componentes o reacciones locales o generales graves en dosis previas. 4.2.3. Reacciones adversas Es una vacuna segura aunque a veces se presentan síntomas generales como fiebre (10%), cefalea, raramente urticaria, anafilaxia, neuropatía periférica, llanto inconsolable (en los lactantes), disnea. Son más frecuentes los efectos secundarios a nivel local como dolor y tumefacción (30%), prurito (25%) y enrojecimiento. 4.3. Tétanos El tétanos es una enfermedad infecciosa que afecta al hombre y a diversas especies animales. Se caracteriza por la afectación del sistema nervioso central lo que da lugar a espasmos tónicos persistentes e incontrolados, con exacerbaciones breves violentas. El espasmo casi siempre empieza en los músculos del cuello y la mandíbula, siempre es de comienzo agudo y una proporción elevada de los afectados mueren. Su virulencia se debe a dos toxinas la tetanoespasmina o toxina tetánica, y la tetanolisina. Es una enfermedad grave, que a pesar de los avances en los actuales tratamientos presenta una alta letalidad., pudiendo presentar aquellos que sobrevivan secuelas importantes, especialmente de tipo muscular. 4.3.1. Características del agente etiológico El agente etiológico es el Clostridium tetani. Es un bacilo Gram + móvil, anaerobio estricto y esporulado. Produce dos toxinas: tetanolisina y la tetanoespasmina (responsable de la enfermedad), siendo letal para el hombre en dosis de 2,5 ηg/l. La tetanolisina tiene una importancia desconocida en la patogenia del tétanos, atribuyéndose a la tetanoespasmina la virulencia del Clostridium tetani. La tetanoespasmina está codificada en un plásmido presente en todas las cepas toxigénicas. Entra en el sistema nervioso central principalmente por las terminaciones presinápticas de las motoneuronas inferiores, donde puede causar una alteración local de la transmisión neuromuscular. Después aprovecha el sistema de transporte axonal retrógrado y llega a los cuerpos neuronales en el tronco del encéfalo y la médula espinal donde expresa su acción patógena principal. 4.3.2. Cadena epidemiológica del tétanos Analizando la cadena epidemiológica podemos ver cómo el reservorio es el tracto gastrointestinal de animales herbívoros y omnívoros, incluido el hombre, siendo eliminados al exterior a través de las heces. La bacteria entra en el organismo a partir de heridas o lesiones contaminadas Las esporas del tétanos se introducen junto con tierra, polvo o heces en el organismo a través de soluciones de continuidad de los tejidos, sobre todo heridas cutáneas (incluso mínimas), traumáticas o quirúrgicas. Nunca se transmite de persona a persona. Las puertas de entrada más habituales del bacilo tetánico son las siguientes: a) Heridas de punción de cualquier tipo: inyecciones, tatuajes, piercing, heridas causadas por la inyección de drogas. b) Laceraciones. c) Mordiscos, arañazos de animales y heridas por asta de toro. 38 T.4 VACUNA FRENTE A DIFTERIA, TÉTANOS y TOS FERINA d) Traumatismos importantes (accidentes de circulación, heridas por explosión, por arma de fuego, quemaduras o heridas abiertas). e) Extracciones dentarias. f) Partos y abortos sépticos. g) Heridas o procesos de evolución crónica: úlceras por decúbito, gangrena, congelación, abscesos dentales, otitis media. h) Infección de la cicatriz del cordón umbilical en el tétanos neonatal. 4.3.3. Signos y síntomas del tétanos Clínicamente se distinguen tres tipos de tétanos: localizado, generalizado y cefálico. También es muy importante, por su incidencia y repercusión el tétanos neonatal. a) Tétanos localizado. Se caracteriza por la aparición de rigidez en la zona de la herida o lesión. Su evolución es benigna, aunque a veces aparece como la fase inicial del tétanos generalizado. b) Tétanos generalizado. Es la forma más común de la enfermedad (80%). Comienza como síntomas localizados en la zona de la herida, seguido de afectación de diversos grupos musculares. Es típica la afectación de los músculos encargados de la masticación y de la deglución. Un signo inicial muy importante es la dificultad para abrir la boca, el denominado “trismo” o la “risa sardónica” como consecuencia de la contracción de los músculos faciales. Su periodo de incubación puede oscilar entre 7 y 14 días. La evolución natural es en el 95% de los casos hacia muerte, pero con tratamiento adecuado la sintomatología cede paulatinamente. c) Tétanos cefálico. Se origina a partir de una herida en la cabeza o por penetración de las esporas a través de orificios naturales (otitis media crónica). Su periodo de incubación oscila entre 1-2 días y puede desarrollarse como tétanos localizado o evolucionar hacia tétanos generalizado. d) Tétanos neonatal. Excepcional en los países industrializados aunque muy común en los que están en vías de desarrollo. Se origina por la infección de la cicatriz del cordón umbilical y suele presentarse a los 6-14 días del nacimiento. Aparece como dificultad para succionar el pecho, llanto persistente, espasmos e hipertonía permanente. La desnutrición acompañada de la deshidratación y las infecciones añadidas incrementan la gravedad del tétanos neonatal, que presenta tasas de mortalidad muy elevadas. 4.3.4. Epidemiología del tétanos Desde el punto de vista epidemiológico se ha producido un descenso considerable de las tasas de tétanos desde los años 1940 con la introducción de la vacuna frente a toxoide tetánico. Pese a ello, todavía la OMS estima que produce más de 500.000 muertes al año, la mayoría en países en vías de desarrollo. En los países desarrollados se han reducido las tasas a valores de menos de 0,2 casos/100.000 habitantes/año, afectando casi exclusivamente a personas mayores de 50 años. Por el contrario en los países en vías de desarrollo, el 80% de los casos son de tétanos neonatal, alcanzado tasas de mortalidad de 2-60 casos/1.000 nacidos vivos. Es más frecuente en zonas rurales, húmedas y cálidas que favorecen la supervivencia prolongada de la espora, así como en zonas con deficiencias higiénico-sanitarias. En España la incidencia es de las más elevadas dentro de los países desarrollados, notificándose en los últimos años cerca de 50 casos anuales, la mayor parte en mayores de 60 años de edad y varones. El 66% no había sido vacunado nunca y un 30% desconocía sus antecedentes vacunales. 39 GUÍA DE VACUNAS EN LA OFICINA DE FARMACIA Las coberturas vacunales frente a tétanos son mayores del 94% para niños y adolescentes, y sólo del 50% en adultos. Esta tasa tan baja en adultos se debe principalmente a dos causas: la enfermedad no confiere inmunidad natural, y la inexistencia de revacunaciones periódicas durante la edad adulta. Los últimos estudios de prevalencia indican que ésta es inversamente proporcional a la edad y más reducida en el grupo de mujeres que en el de los varones en todos los grupos de edad. Esto podría justificarse por las vacunaciones durante el servicio militar y por el tipo de trabajos que tradicionalmente han hecho los hombres, muchos de ellos vacunados frente a tétanos a consecuencia de accidentes laborales. 4.4. inmunización pasiva contra el tétanos La inmunoglobulina antitetánica humana específica (IGT; Véase tabla 6) se indica en caso de heridas potencialmente tetanígenas en individuos no vacunados o en situación inmunitaria incierta así como en casos de contraindicaciones de la vacuna. También se indica en caso de tétanos manifiesto. Se administrará en dosis de 250 UI en una sola dosis intramuscular. Si han transcurrido más de 24 horas de la herida o lesión, cuando el riesgo de contaminación es más elevado, la dosis será de 500 UI. En el caso de tétanos manifiesto se administran 3000-6000 UI en dosis única. Si se administra en el mismo momento que la vacuna debe de hacerse con jeringuillas y agujas diferentes y en lugares anatómicos alejados para evitar reacciones adversas. La protección es inmediata pero de duración limitada a 4 semanas. Código nacional 655175.2 Nombre Gamma Anti-Tétanos Grifols Descripción 250 UI 1 vial liofilizado + ampolla 1 ml 929414.4 250 UI 1 jeringa precargada 1 ml 655183.7 500 UI 1 vial liofilizado + ampolla 2 ml 929505.9 500 UI 1 jeringa precargada 2 ml 663559.9 Tetagamma P 663542.1 250 UI 1 jeringa precargada 1 ml 500 UI 1 jeringa precargada 2 ml Tabla 6. Inmunoglobulinas específ icas contra tétanos comercializadas en España. 4.5. Vacuna contra el tétanos Aparte de las presentaciones como vacuna triple (DTP), o combinada con toxoide diftérico (DT y Td). Niveles >0,01 UI/ml se consideran protectores, alcanzando dichos niveles el 90% de los pacientes tras la administración de la primera dosis. La inmunogenicidad persiste durante 10-13 años, necesitando posteriormente dosis de refuerzo. 4.5.1. Indicaciones Las principales indicaciones son la aplicación sistemática a todos los niños mayores de 2 meses, en caso de heridas o lesiones tetanígenas siguiendo las pautas recomendadas, en adolescentes o adultos 40 T.4 VACUNA FRENTE A DIFTERIA, TÉTANOS y TOS FERINA insuficientemente vacunados, mal vacunados o no vacunados y en el embarazo y mujeres en edad fértil para prevenir el tétanos neonatal. También hay que vacunar cuando se produzca una herida o intervención que indique la necesidad de protección antitetánica. La conducta a tomar varía según las circunstancias (Véase tabla 7): a) Pacientes adecuadamente vacunados hace menos de 5 años: no precisa ningún tipo de inmunoprofilaxis con IGT, y tampoco necesita vacuna. b) Pacientes adecuadamente vacunados entre 5-10 años antes: • Heridas pequeñas y limpias: no precisa ningún tipo de inmunoprofilaxis con IGT, ni vacuna. • Heridas contaminadas, potencialmente tetanígenas: debe administrarse dosis de refuerzo de vacuna antitetánica. c) Pacientes no vacunados o en un estado inmunitario desconocido: se inyectará una dosis de vacuna, independientemente del tipo de herida, completando después la pauta inmunizante total. Si la herida es potencialmente tetanígena aconsejable administrar al mismo tiempo IGT. d) Pacientes con inmunodeficiencias: se indicará también IGT cuando la herida o la lesión se considere tetanígena, aunque se haya cumplido el calendario vacunal. Herida Limpia Herida Sucia No vacunado Vacunación dudosa Menos de 3 dosis Vacunación Vacunación IGT Vacunación completa Nada (pacientes vacunados hace menos de 10 años). Vacunación (pacientes vacunados hace más de 10 años). Nada (pacientes vacunados hace menos de 5 años). Vacunación (pacientes vacunados hace más de 5 años). Tabla 7. Actuación en caso de herida tetanígena. 4.5.2. Contraindicaciones La vacuna de tétanos está contraindicada cuando hay antecedentes de reacción neurológica previa o hipersensibilidad severa tras la administración de la primera dosis. En este caso sustituir por IGT en el caso de heridas tetanígenas. 4.5.3. Reacciones adversas Principalmente reacciones locales a las 4-8 horas de la inyección, que podrían incrementarse si no se espacian debidamente las dosis. Reacciones sistémicas: fiebre, cefaleas, mialgias, anorexia y vómitos. 4.6. Tos ferina La tos ferina es una enfermedad contagiosa causada por Bordetella pertussis, que evoluciona en dos fases. La primera es la infección o colonización del microorganismo en las células ciliadas del revestimiento epitelial del aparato respiratorio, donde se multiplica. La segunda fase es la enfermedad propiamente dicha, producida por la secreción de toxinas por parte de la bacteria. 41 GUÍA DE VACUNAS EN LA OFICINA DE FARMACIA 4.6.1. Características del agente etiológico El agente etiológico es un bacilo capsulado, no esporulado, inmóvil, aerobio y Gram –. Existen varios serotipos según su composición, siendo los más frecuentes los serotipos 1, 2 y 3. Es importante la identificación de los componentes de la bacteria, para conocer cuál es su carácter antigénico, especialmente dirigido hacia la elaboración de las vacunas frente a Bordetella pertussis. Sus principales componentes son: a) Toxina tosferinosa, también denominada tosferínica o pertúsica: es el factor de mayor virulencia y es la causante de varias actividades biológicas como la inducción de linfocitosis, la sensibilización a los efectos letales de la histamina, la intensificación de la secreción de insulina y la capacidad adyuvante. b) Hemaglutinina filamentosa (HAF): proteína de la pared celular. c) Pertactina (PER): proteína de la membrana exterior. d) Fimbrias y aglutinógenos (AGG). 4.6.2. Cadena epidemiológica de la tos ferina Es una enfermedad que se transmite por vía respiratoria de persona a persona y que es altamente contagiosa. El periodo de incubación varía entre 6 y 20 días, con una media de 7 días. Se ha demostrado que la infección natural no causa inmunidad de por vida (el porcentaje de anticuerpos es inversamente proporcional a la edad). También se ha demostrado una relación directa entre el tiempo transcurrido desde la vacunación y las tasas de ataque. 4.6.3. Signos y síntomas de la tos ferina La enfermedad se divide en tres periodos: catarral, paroxístico y de convalecencia. a) Periodo catarral: suele durar entre 1-2 semanas y se caracteriza por síntomas semejantes a cualquier infección del aparato respiratorio superior. La fiebre suele ser escasa o ausente y la tos aumenta hasta aparecer en forma de paroxismos. b) Periodo paroxístico: este segundo periodo dura entre 2-4 semanas, durante las cuales la tos es “convulsiva” y a veces va acompañada de mucosidades claras y adherentes e incluso vómitos. c) Periodo de convalecencia: dura entre 1-2 semanas. Los paroxismos de tos van disminuyendo progresivamente en frecuencia e intensidad, aunque la tos puede persistir durante algunos meses. La intensidad de las manifestaciones clínicas depende de la edad y del estado vacunal. Los lactantes menores de 6 meses son los más susceptibles, siendo a esta edad mayor la mortalidad. Entre las complicaciones de esta enfermedad, la más grave es la bronconeumonía, responsable de más del 90% de las muertes en niños menores de 3 años. Entre las complicaciones neurológicas destaca la encefalitis aguda, con una incidencia de 0,8/1.000 niños con tos ferina. El pronóstico de la encefalitis por tos ferina es variable. La mayoría de los estudios indica que una tercera parte de los casos fallece, una tercera parte sobrevive pero presenta lesiones cerebrales permanentes y el resto se recupera sin evidencia de secuelas neurológicas. También son frecuentes en los países en desarrollo los problemas nutricionales condicionados por los vómitos recurrentes que padecen los afectados por esta enfermedad. 42 T.4 VACUNA FRENTE A DIFTERIA, TÉTANOS y TOS FERINA 4.6.4. Epidemiología de la tos ferina La tos ferina sigue siendo un problema importante de salud, sobre todo en los países escasamente desarrollados, donde se producen la mayoría de los 60 millones de casos y medio millón de muertes anuales. La introducción en los años 40 de la vacuna de microorganismos enteros inactivados, redujo rápidamente su incidencia, pero se produjo un recrudecimiento en la década de 1970 en países como Gran Bretaña, Japón o Suecia, cuando se abandonó su empleo sistemático al habérsele atribuido a la vacuna de células enteras numerosos efectos adversos, sobre todo de tipo neurológico e incluso muertes. En los últimos años, el número de casos se incrementa anualmente, especialmente en adolescentes y adultos, constituyendo la principal fuente de contagio en las áreas industrializadas, con tasas de transmisión del 80 al 100% en población susceptible, siendo ésta fundamentalmente lactantes aún no vacunados (menores de dos meses) o con vacunación incompleta. Ocurre de forma endémica aunque se producen brotes cada 3 ó 4 años. En España existe un programa de vacunación desde 1965. La enfermedad es de declaración obligatoria desde 1982, en el que su incidencia estimada fue de 50.463 casos, es decir una incidencia de 133 casos/100.000 habitantes. A partir de 1989, debido a su inclusión como vacuna sistemática, la incidencia disminuyó considerablemente. En los últimos años ha empezado a producirse un aumento de los casos, con picos epidémicos cada tres años. En 1997 la tasa fue de 2,78 casos/100.000 habitantes (1095 casos), en 1998 de 0,8 por 100.000 habitantes (315 casos) y en 1999, 0,9 por 100.000 habitantes (406 casos). En cuanto a la edad de los casos, el 30,5% aparece en menores de 1 año, y el 83,5% en menores de 15 años, siendo casi el 50% menores de 5 años. De los casos hospitalizados en 1997, el 79,3% se produjo en menores de 1 año, siendo más del 80% en los primeros 4 meses de edad, casos que se consideran no prevenibles al no haber recibido la primovacunación con DTP. Con relación a la evolución de los casos, el 96,4% fue dado de alta y se registraron 6 defunciones (0,6%), una de ellas de un adulto y el resto en menores de 1 año. Un dato a tener en cuenta es el incremento de las tasas en adolescentes y adultos. Diferentes estudios como el de Nenning y cols., detectaron un 12,4% de infectados; Rossenthal y cols. y Suchmitt-Grohé obtuvieron incidencias del 26% y 32% respectivamente en adultos con tos persistente de más de una semana de duración. Se han realizado numerosos estudios de seroprevalencia entre 1993-1997, mostrando porcentajes bajos en niños entre 2 y 10 años de edad (30%) y adolescentes (58%) Estudios con personal sanitario indican que sólo el 56,6% tenía anticuerpos. El estudio de seroprevalencia más amplio y completo ha sido el realizado por García-Gobeira y cols. con población entre 5 y 59 años, donde se obtuvieron porcentajes desde el 35% entre 5 y 12 años, hasta el 52% en el grupo etario de 50 a 59 años para la toxina pertúsica, y desde el 64,6% al 79,8% respectivamente, para la hemaglutinina filamentosa, demostrando un aumento de la inmunidad en adolescentes y adultos explicable por el efecto booster natural, es decir un nuevo contacto con el germen que no produce enfermedad pero que estimula la producción de anticuerpos, lo que sugiere una amplia circulación de Bordetella pertussis en estos grupos de edad. 4.7. Vacuna contra la tos ferina No está comercializada ninguna vacuna antipertussis monovalente; sólo combinada como DTPe (Pertussis de células enteras) o DTPa (Pertussis acelular). 43 GUÍA DE VACUNAS EN LA OFICINA DE FARMACIA 4.7.1. Vacuna de células enteras (Pe) Se compone de suspensiones de Bordetella pertussis inactivada por calor, formaldehído o glutaraldehído y absorbidas en hidróxido o fosfato de aluminio. La inmunogenicidad varía entre el 50-85%, según diferentes estudios. La eficacia frente a la enfermedad clínica es del 70-90% durante 2-5 años. La inmunidad disminuye con el tiempo, no prolongándose más allá de 12 años tras la administración de la última dosis de vacuna. Las vacunas antipertussis de células enteras han sido consideradas las más reactógenas entre las vacunas sistemáticas de la infancia. Las reacciones adversas se clasifican en: a) Reacciones leves: aparecen a las 4-12 horas de la administración de la vacuna. • Locales: dolor, tumefacción, eritema e induración. Se presentan en el 50% de los vacunados. • Generales: son autolimitadas y entre las más frecuentes está la fiebre (50% de los vacunados), anorexia, vómitos, somnolencia, tos leve, irritabilidad y malestar general. b) Reacciones graves: son raras. Destaca la aparición de fiebre superior a 40 ºC, llanto persistente, convulsiones aisladas, episodio hipotónico-hiporreactivo (colapso o shock). Estas alteraciones no causan secuelas y no son contraindicaciones para la vacuna, aunque es aconsejable en estos casos la vacuna acelular. Se han realizado numerosos estudios que relacionan la vacuna frente a la tos ferina con secuelas en el SNC: a) Se ha demostrado un aumento de riesgo de enfermedad neurológica aguda en los tres primeros días tras la administración de la vacuna, con una frecuencia de 0,1-3 casos/100.000 vacunados. b) No se ha demostrado relación entre la vacuna y la muerte súbita del lactante, ni con la aparición de espasmos, encefalopatía crónica u otros retrasos psicomotores. c) Se ha demostrado una relación clara entre los efectos secundarios y la edad, por lo que no se recomienda en mayores de 7 años ni en adultos. d) En cualquier caso, los beneficios derivados de la vacunación superan sus riesgos. 4.7.2. Vacuna acelular (Pa) Estas vacunas se componen principalmente por TP, HAF, PER y fimbrias 2 y 3, purificadas e inactivadas. En junio de 1997 se introducen las vacunas acelulares en el calendario vacunal de la American Academy of Pediatrics para uso tanto en primovacunación como en dosis de recuerdo, y en ambos casos la DTPe se considera una alternativa. Las vacunas acelulares son altamente inmunógenas y su eficacia es en general muy satisfactoria. La mayoría de los estudios preparados con vacunas de dos a cinco componentes indican tasas de eficacia en lactantes a partir de 2 a 3 meses de vida del 85 al 96% tras la administración de 3 dosis. Una ventaja adicional de estas vacunas sobre las de células enteras es que cuando se aplican a lactantes, no resultan inhibidas por la presencia de anticuerpos maternos. La inmunidad disminuye con el tiempo, no prolongándose más allá de 12 años tras la administración de la última dosis de vacuna. Las reacciones adversas provocadas por esta vacuna acelular son inferiores a las producidas por la vacuna de células enteras. En relación a las reacciones locales (eritema, induración…) se reducen en dos tercios. Las reacciones sistémicas diminuyen en más de la mitad (fiebre moderada, irritabilidad, somnolencia…). Entre las generales graves o intensas, la fiebre >40 ºC se reduce a un tercio, las convulsiones a un cuarto, y los episodios de llanto superior a tres horas a un quinto. Las crisis de hipotonía son prácticamente inexistentes. 44 T.4 VACUNA FRENTE A DIFTERIA, TÉTANOS y TOS FERINA Son contraindicaciones absolutas de esta vacuna las reacciones anafilácticas agudas como la encefalopatía en los 7 días tras la administración de la vacuna (tanto la acelular como la de células enteras). En estos casos se deberá vacunar con DT. También son contraindicación la fiebre mayor de 40 ºC en las primeras 48 horas tras la vacunación, la hipotonía en las primeras 48 horas tras la vacunación o las convulsiones en los primeros tres días tras la vacunación. Esto sucede con la vacuna de tos ferina de células enteras, por lo que en estos casos se recomienda continuar la vacunación con vacuna acelular. En España actualmente, el calendario vacunal recomienda para la vacunación sistemática el uso de la vacuna DTPa. También está indicada en los siguientes casos: a) Inmunodeficiencias congénitas o adquiridas y tratamiento inmunosupresor concomitante, aunque pueda interferir en la respuesta inmunológica a la vacunación. b) Manifestaciones alérgicas respiratorias. c) Trastornos neurológicos estables (parálisis cerebral, etc…) aunque en estos casos es preferible inmunizar con la vacuna acelular. 4.8. Vacunas combinadas frente a difteria, tétanos y tos ferina 4.8.1. Tipos de vacunas combinadas DTP La vacuna combinada DTP es la primera empleada en niños de forma sistemática para la profilaxis de las tres enfermedades. En el momento actual se combinan con ella otros antígenos como el Hib, virus de la hepatitis B o el virus de la polio inactivada. 4.8.2. Características de las vacunas DTP Todas las combinaciones son inmunógenas, comprobándose tras la vacunación una eficacia protectora superior al 90% para cada uno de los componentes de la vacuna. Sus indicaciones son las mismas que las de cada una de las vacunas por separado. Las reacciones adversas más frecuentes se deben al componente pertussis en las vacunas combinadas con células enteras. Las reacciones que se presentan con los componentes de tétanos y difteria se suelen producir sobre todo a inmunizaciones repetidas o hiperinmunizaciones. 4.8.3. Vacunas antidiftéricas, antitetánicas y/o antipertúsicas comercializadas en España Existen numerosas combinaciones de la vacuna DTP ya comercializadas. Se deben conservar en frigorífico entre +2 y +8 ºC. Evitar la congelación en DTPa/e y VHB. En aquellas vacunas que tiene Hib y VHB, para reconstituir hay que agitar la suspensión coloidal, inyectarla en el liofilizado y agitar de nuevo antes de administrarla. La vía de administración es intramuscular; la subcutánea sólo en caso de riesgo de hemorragia, pudiendo producir mayor riesgo de reacciones adversas. Es necesario mantener los intervalos entre dosis para evitar una hiperreactividad. 45 GUÍA DE VACUNAS EN LA OFICINA DE FARMACIA Vacunas DTPa Código nacional Nombre Descripción Composición 731349.6 Boostrix 1 jeringa precargada 0,5 ml (adultos y niños > 4 años) Toxoide diftérico, toxoide tetánico y fracción antigénica de pertussis (toxoide pertúsico, hemaglutinina filamentosa y pertactina) adsorbidos en hidróxido y fosfato de aluminio. 664052.4 Infanrix 1 jeringa precargada 0,5 ml (niños de 2 meses a 7 años) Toxoide diftérico, toxoide tetánico y fracción antigénica de pertussis (toxoide pertúsico, hemaglutinina filamentosa y pertactina) adsorbidos en hidróxido de aluminio. Vacunas Td Código nacional Nombre Descripción Composición 656756.2 Diftavax 40/4 UI 1 jeringa precargada 0,5 ml Toxoide diftérico y toxoide tetánico adsorbidos en hidróxido de aluminio. 917641.9 Ditanrix 20/2 UI 1 jeringa precargada 0,5 ml Toxoide diftérico y toxoide tetánico adsorbidos en hidróxido de aluminio. Vacunas DTPa + VPI + Hib Código nacional Nombre Descripción Composición 841320.1 InfanrixIPV+HIB Vial liofilizado + 1 jeringa precargada 0,5 ml Toxoide diftérico, toxoide tetánico y fracción antigénica de pertussis (toxoide pertúsico, hemaglutinina filamentosa y pertactina). Acompañado de virus de la poliomielitis inactivados (cepas tipo 1, 2 y 3), y polisacárido capsular PRP de Haemophilus influenzae B. 651501.3 Pentavac Vial liofilizado + 1 jeringa precargada 0,5 ml Toxoide diftérico, toxoide tetánico y fracción antigénica de pertussis (toxoide pertúsico y hemaglutinina filamentosa). Acompañado de virus de la poliomielitis inactivados (cepas tipo 1, 2 y 3), y polisacárido capsular PRP de Haemophilus influenzae B. Vacunas DTPa + VPI + Hib + VHB Código nacional Nombre 820068.9 Infanrix Hexa 657445.4 Descripción Composición Vial liofilizado + 1 jeringa precargada 0,5 ml sin aguja Toxoide diftérico, toxoide tetánico y fracción antigénica de pertussis (toxoide pertúsico, hemaglutinina filamentosa y pertactina). Acompañado de virus de la poliomielitis inactivados (cepas tipo 1, 2 y 3), polisacárido capsular PRP de Haemophilus influenzae B y antígeno de superficie (proteína S) del virus de hepatitis B. Puede contener trazas de neomicina y polimixina B. Vial liofilizado + 1 jeringa precargada 0,5 ml con aguja Vacunas DTPe + VHB Código nacional Nombre 676122.9 Tritanrix HepB Descripción 1 vial 0,5 ml Composición Toxoide diftérico, toxoide tetánico y Bordetella pertussis inactivada. Acompañado de antígeno de superficie (AgHBs) del virus de hepatitis B. Puede contener trazas de tiomersal. Tabla 8. Vacunas antitetánicas, antidiftéricas y antipertúsicas comercializadas en España. 46 T.4 VACUNA FRENTE A DIFTERIA, TÉTANOS y TOS FERINA 4.8.4. Pautas posológicas El calendario de vacunación queda dispuesto como se indica a continuación (Véase tabla 9). A partir de 7 años de edad y en adultos la vacuna recomendada es Td. La pauta de vacunación en personas no vacunadas es de 1-2-6 ó 12 meses. Siempre hay que aplicar dosis de recuerdo a los 10 años. 2 meses Infantil DTPa 4 meses DTPa 6 meses DTPa Intervalo Adulto 1 2 dT 1 a 2 meses 15-18 meses DTPa 3-6 años Refuerzo cada 10 años DTPa dTpa 1,2 dT 2 Intervalo dT 6 a 12 meses dT Revacunación cada 10 años Posibles cambios futuros en el Calendario Vacunal Tabla 9. Pauta posológica de las vacunas antidiftéricas, antitetánicas y/o antipertúsicas. En el caso de vacunaciones incompletas frente a tétanos (Véase tabla 10), las pautas de actuación son las siguientes, vacunando con vacuna combinada Td (adulto). Dosis previas 3 dosis 2 dosis 1 dosis Supuestos Dosis a recibir No han transcurrido 10 años desde la última dosis Ninguna Han transcurrido más de 10 años desde la última dosis 1 dosis No han transcurrido 5 años desde la última dosis 1 dosis Han transcurrido más de 5 años desde la última dosis 2 dosis (0-1mes) No han transcurrido 5 años desde la última dosis 2 dosis (0-1 mes) Han transcurrido más de 5 años desde la última dosis 3 dosis (0-1-6 ó 12 meses) Tabla 10. Medidas a tomar en caso de vacunación incompleta de tétanos. Si es necesario vacunar frente a tétanos a mujeres embarazadas, deben recibir dos dosis separadas entre sí por 4 semanas y la segunda dosis 2 semanas antes del parto, con el fin de prevenir el tétanos neonatal (países en vías de desarrollo). 47 GUÍA DE VACUNAS EN LA OFICINA DE FARMACIA TEMA 5 Vacuna triple vírica (sarampión, rubeola, paperas) Guía De Vacunas en la oFicina De Farmacia 5.1. Sarampión el sarampión es una enfermedad exantemática aguda, extremadamente contagiosa, de duración limitada y erróneamente considerada como benigna, producida por un único paramyxovirus con rna que sólo causa la enfermedad a los humanos. se caracteriza por presentar fiebre elevada, cuadro catarral, conjuntivitis y la aparición de un exantema máculo-papuloso generalizado en la piel. aproximadamente en un 50-80% de los casos, aparecen lesiones de 1-2 mm en la cara interna de las mejillas, en forma de puntos blancos rodeados de un eritema, aceptadas como signo patognomónico, denominadas manchas de Koplik. Deja inmunidad permanente, no existiendo portadores salvo al final de la incubación y en el periodo de estado. las complicaciones de la patología pueden ser graves e incluso mortales (hemorragias, neumonía, enteritis). 5.1.1. Características del agente etiológico el virus del sarampión es un rna virus perteneciente a la familia paramyxoviridae, género Morbillivirus. el virión es de morfología esférica con un diámetro medio entre 125-250 ηm. contiene en su interior una molécula de rna monocatenario. presenta una envoltura formada por dos glicoproteínas y una proteína que forma la capa interna de la envoltura. pierde entre un 90 a un 99% de su infecciosidad si se suspenden en un medio exento de proteínas a temperatura ambiente o a 4 ºc. 5.1.2. Cadena epidemiológica del sarampión a) reservorio: únicamente el hombre. b) modo de transmisión: por secreciones nasofaríngeas de personas afectadas. c) periodo de transmisibilidad: de 2 a 4 días antes al inicio del exantema; hasta 4 días después de la aparición del mismo. d) periodo de incubación: aproximadamente unos 10 días de media. 5.1.3. Epidemiología del sarampión la cumbre mundial a Favor de la infancia, celebrada en el año 1990, se marcó como objetivo lograr dos metas en el año 1995 para conseguir una disminución en la incidencia del sarampión. una de ellas era conseguir reducir la mortalidad por esta enfermedad en un 95%; la otra era reducir la morbilidad en un 90%. en la misma línea, el programa ampliado de Vacunación (pai) propuso reducir la mortalidad por sarampión hasta alcanzar valores inferiores al 1% y conseguir la inmunización de al menos el 90% de la población infantil menor de 1 año de edad. en la actualidad, al menos tres regiones de la oms han fechado la obtención del certificado de eliminación del sarampión: a) región americana, es decir todo el continente americano. año 2000. b) región europea. año 2007. c) región este mediterráneo. se espera que se alcance para el año 2010. 50 T.5 Vacuna triple Vírica (sarampión, rubeola, paperas) 5.2. Vacuna contra el sarampión la vacuna es eficaz y segura y produce inmunidad humoral y celular, mediada por igG, igm e iga, siendo la tasa de seroconversión superior al 95% de los vacunados y su eficacia protectora está entre el 90-95%. 5.2.1. Indicaciones, pautas y vía de administración la vacuna está indicada para la vacunación sistemática de la población infantil, así como en aquellos casos de adultos susceptibles. las pautas de administración se reflejan seguidamente: a) 1ª dosis: 15 meses. b) 2ª dosis: 3-6 años (preferible 4). c) 3ª dosis: 11-12 años (niños no vacunados entre 3-6 años). es decir esta dosis no es necesaria si se administró la de los 3-6 años. es conveniente señalar que los niños vacunados antes de los 12 meses de edad se consideran no vacunados. Destacamos sin embargo algunas situaciones especiales como el caso de un brote epidémico de sarampión donde se recomienda una dosis de triple vírica a los doce meses. en caso de epidemia se recomienda una dosis monovalente o triple vírica entre los 6 y 11 meses de edad, considerándose ésta como la primera dosis del calendario vacunal, reiniciándose la pauta pasados los 12 meses. esta vacuna tiene una vía de administración subcutánea. cada dosis de vacuna contiene 0,5 ml de la vacuna reconstituida. 5.2.2. Contraindicaciones y precauciones a) embarazo. evitar el embarazo en los 3 meses siguientes a la vacunación monovalente o de la triple vírica. b) enfermedades febriles agudas. c) tuberculosis. puede enmascarar la prueba de tuberculina (hipo-anergia tuberculínica). d) antecedentes de reacción anafiláctica a la neomicina, gelatina u otro componente. e) anafilaxia a las proteínas del huevo: en este caso, recurrir a la vacuna habitual en el hospital bajo vigilancia especializada. f) inmunodeficiencias primarias o secundarias. g) transplante de médula ósea: realizar serología antisarampión previa y vacunar sólo a los seronegativos. h) infección por ViH o enfermos de siDa asintomáticos o sintomáticos que tengan inmunodepresión grave. i) trombocitopenia: las personas con antecedentes de trombopenia tienen mayor riesgo de trombocitopenia tras la vacunación. 51 Guía De Vacunas en la oFicina De Farmacia 5.2.3. Reacciones adversas a) reacciones sistémicas: • erupción y fiebre > 39 ºc (a los 5-12 días de la administración). son efectos autolimitados. incidencia: entre el 2-30% de los vacunados. • trombocitopenia. con manifestación clínica en 1/30-40.000 vacunados en las 2-3 semanas siguientes a la vacunación. normalmente son manifestaciones benignas y autolimitadas. mayor riesgo tras el padecimiento de la enfermedad natural b) reacciones locales: calor, enrojecimiento, tumefacción. son menos frecuentes. 5.2.4. Vacunas contra el sarampión comercializadas Código nacional 984963.4 Nombre Rimevax Descripción 1 vial 0,5 ml Composición Virus sarampión atenuados, cepa Schwarz. Puede contener trazas de sulfato de neomicina y sorbitol. Tabla 11. Vacunas antisarampión comercializadas en España. 5.3. Rubeola la rubeola es una enfermedad vírica contagiosa propia de la infancia, caracterizada por síntomas generales leves y un exantema semejante al del sarampión o la escarlatina. previo a la aparición del exantema aparece una adenopatía retroarticular, fiebre y malestar ligeros. por lo general, la erupción de la piel dura unos tres días pudiéndose acompañar de fiebre ligera. otros síntomas, tales como el dolor de cabeza o de garganta y la pérdida de apetito, son más comunes en los adolescentes y adultos que contraen la enfermedad que en el caso de los niños. la enfermedad en la infancia es generalmente leve. su importancia se debe a la posibilidad de producir malformaciones congénitas o abortos si la infección se adquiere en la edad adulta durante los tres primeros meses de embarazo. 5.3.1. Características del agente etiológico el virus de la rubeola es un rna virus perteneciente a la familia togaviridae, género Rubivirus. el virión es de morfología esférica con un diámetro medio de unos 60 ηm. contiene en su interior una molécula de rna monocatenario. presenta una envoltura formada por dos glicoproteínas y una proteína de la nucleocápside asociada al rna. el virión rna es infeccioso. se inactiva mediante éter, cloroformo y deoxicolato sódico. es relativamente lábil almacenado a 4ºc, y presenta cierta estabilidad de –60 ºc a –70 ºc. 5.3.2. Cadena epidemiológica de la rubeola a) reservorio: únicamente el hombre. b) modo de transmisión: por secreciones nasofaríngeas de personas afectadas y vía placentaria en los primeros meses de embarazo. 52 T.5 Vacuna triple Vírica (sarampión, rubeola, paperas) c) periodo de transmisibilidad: desde la semana anterior a la aparición del exantema, hasta 5-7 días después de la aparición del mismo. d) periodo de incubación: oscila entre 2 y 3 semanas. Destacar que el rash se desarrolla entre los 14 y 17 días de la exposición. 5.3.3. Epidemiología de la rubeola la rubeola era considerada una enfermedad endémica a escala mundial antes de la introducción de la vacuna. cursaba en ciclos epidémicos con una periodicidad entre 6 y 9 años. en un principio, la población infantil era la principal afectada, pero desde la aparición de la vacuna en 1969, la incidencia de la enfermedad comenzó a disminuir de tal manera que provocó un cambio en el patrón epidemiológico de la enfermedad. en la actualidad la mayoría de los casos se producen en adultos jóvenes no vacunados. en nuestro país la vacuna contra la rubeola se introduce en el año 1979. en un principio iba destinada a niñas de 11 años de edad con el fin de evitar la embriopatía rubeólica. con la introducción en 1981 de la triple vírica, se extiende la vacunación a toda la población infantil. Desde principios de los 90 hasta la actualidad, la rubeola presenta una tendencia descendente, con la excepción del pico del año 1996, manteniéndose su componente estacional, con una incidencia máxima de casos en la primavera. 5.4. Vacuna contra a la rubeola es una vacuna de virus vivos atenuados, tras diferentes pases del virus en células diploides humanas. cada dosis contiene al menos 1000 Dict50 (dosis infecciosa en cultivo de tejidos), acompañada de neomicina o kanamicina, usando como medio de liofilización sucrosa, sorbitol, aminoácidos y sales tampón. en españa solo está comercializada la cepa Wistar ra 27/3. se alcanzan niveles de seroconversión en el 95% de los vacunados. cabe destacar que confiere una eficacia protectora que oscila entre valores del 90-95%. la cepa ra 27/3 produce anticuerpos humorales del tipo igm e igG. también produce anticuerpos secretores del tipo iga en la nasofaringe. la protección conferida tras la administración de la vacuna tiene una duración al menos de 18 años, aunque probablemente sea para toda la vida. 5.4.1. Indicaciones, pautas y vía de administración la razón fundamental para administrar la vacuna de la rubeola es la prevención de la embriopatía rubeólica. por este motivo está indicada en población femenina, seronegativa y en edad fértil. actualmente se aplica como vacunación universal a la población infantil de ambos sexos, para evitar la aparición de epidemias que pudiesen afectar a embarazadas seronegativas. De acuerdo al calendario vacunal vigente se mantienen dos dosis de la vacuna triple vírica: a) 1ª dosis: a los 15 meses, aunque se puede emplear a partir de los 12 meses. b) 2ª dosis: entre los 3 y 6 años de edad. actualmente se está vacunando a la población infantil de 4 años de edad con el fin de minimizar el número de niños susceptibles al inicio del periodo escolar. c) 3ª dosis: se mantiene esta dosis para aquellos niños que no fueron vacunados entre los 3 y 6 años de edad. la pauta que debe aplicarse en mujeres en edad fértil se traduce en una única dosis del preparado monovalente frente a rubeola, aunque también se puede administrar la triple vírica. 53 Guía De Vacunas en la oFicina De Farmacia como precaución a seguir por esta población estaría el evitar el embarazo en los 3 meses posteriores a la vacunación. si nos encontramos con el caso de una mujer seronegativa embarazada, la administración de la vacuna se realizará inmediatamente después del parto. la vía de administración indicada, tanto para el preparado monovalente como para la vacuna triple vírica, es la subcutánea. recordar que cada dosis contiene 0,5 ml de la vacuna reconstituida. 5.4.2. Contraindicaciones y precauciones a) embarazo. las mujeres embarazadas no deben recibir la vacuna. como precaución, deberán evitar el embarazo en los tres meses siguiente a la administración de esta vacuna. Destacar que la vacunación accidental no es indicación de un aborto terapéutico. b) inmunodeficiencias congénitas o adquiridas. los niños ViH positivos sintomáticos, recibirán una dosis de la vacuna triple vírica. c) pacientes con tratamiento inmunosupresor (corticoides, radioterapia, etc.). d) trasplante de médula ósea. e) Hipersensibilidad de tipo anafiláctico a la neomicina. f) enfermedad febril grave. 5.4.3. Reacciones adversas incidir en que generalmente la vacuna contra la rubeola es bien tolerada. los efectos adversos que se han descrito más frecuentemente son fiebre, rash, linfadenopatías. en mujeres en edad fértil se ha descrito casos de artralgias. De modo infrecuente puede aparecer artritis y algún caso de trombopenia autolimitada. 5.4.4. Vacunas contra la rubeola comercializadas Código nacional 948851.2 Nombre Rubeaten Berna Descripción 1 vial liofilizado + ampolla disolvente 0,5 ml Composición Virus rubeola atenuados, cepa Wistar RA 27/3. Contiene sorbitol. Tabla 12. Vacunas antirrubeola comercializadas en España. 5.5. Parotiditis infección vírica generalizada de curso clínico benigno que frecuentemente ataca las glándulas salivares, particularmente la glándula parótida, determinando una tumefacción dolorosa de la misma. la enfermedad se manifiesta durante la infancia. cuando aparece en la adolescencia o en la edad adulta puede producir orquiepididimitis u ooforitis; también algunas complicaciones como meningoencefalitis o pancreatitis, en general exentas de gravedad. 5.5.1. Características del agente etiológico el virus de la parotiditis es un rna virus perteneciente a la familia paramyxoviridae, género Paramyxovirus. los viriones son partículas con envoltura aproximadamente esférica con un diámetro medio entre 125-250 ηm. 54 T.5 Vacuna triple Vírica (sarampión, rubeola, paperas) contiene en su interior una molécula de rna monocatenario. presenta una envoltura formada por dos glicoproteínas y una proteína que forma la capa interna de la envoltura. Virión inestable a temperatura ambiente o a 4ºc. Desde el punto de vista antigénico no se han detectado variables inmunológicas del mismo. 5.5.2. Cadena epidemiológica de la parotiditis a) reservorio: únicamente el hombre. b) modo de transmisión: diseminación de gotitas de secreciones por vía respiratoria. contacto directo con saliva de la persona infectada. c) periodo de transmisibilidad: se limita al día o dos días previos y los cinco días posteriores a la aparición de la tumefacción parotídea. podemos hablar de un periodo ventana que oscile entre siete días antes y nueve días después. d) periodo de incubación: oscila entre 2 y 3 semanas. 5.5.3. Epidemiología de la parotiditis se caracteriza por ser una enfermedad de distribución universal. aparece frecuentemente al final del invierno y durante la primavera. los casos aparecen en niños de edades comprendidas entre los 10 y 14 años de edad. Destacar que recientemente han surgido brotes epidémicos en poblaciones con elevadas tasas de vacunación, viéndose mayormente afectados los adolescentes y adultos jóvenes. Desde la introducción de la vacuna triple vírica en españa en 1981, la incidencia de la enfermedad ha disminuido notablemente, concretamente un 97% respecto al inicio de los 80. en los últimos años se está observando una pérdida del patrón estacional. es importante señalar que los casos recientemente declarados (almoradí y manacor, 1998) podrían estar relacionados con un fallo vacunal primario. Ya desde hacía algunos años se venía aconsejando la vigilancia de los casos o brotes de parotiditis, ya que algunos países estaban realizando estudios donde se cuestionaba la efectividad de la vacuna contra la parotiditis que contenía la cepa rubini. Del estudio de los brotes anteriormente mencionados, se tomó la decisión, por parte de las autoridades sanitarias de restringir el uso de dicha cepa en niños con alergia a alguno de los componentes de las otras vacunas. 5.6. Vacuna contra la parotiditis es una vacuna de virus vivos atenuados. actualmente existen más de 10 cepas vacunales en todo el mundo, aunque las más utilizadas han sido la Jeryl lynn, rubini y urabe. es una vacuna que produce seroconversión en un 97% de los vacunados. este valor oscila en adultos entre el 92% y el 95%. en cuanto a su eficacia protectora presenta un intervalo que oscila entre valores del 75% y el 91%. importante destacar que la cepa rubini infiere una menor protección de la esperada. a consecuencia de esto, se ha multiplicado la incidencia de la enfermedad en los últimos años. sin embargo la duración de la inmunidad se estima que podría mantenerse durante toda la vida de la persona vacunada. Destacar que la vacunación de susceptibles tras la exposición al virus salvaje, no confiere una protección clínica ni altera la severidad de la enfermedad. posiblemente la vacunación masiva ante la presencia de un brote epidémico detendría la enfermedad. 55 Guía De Vacunas en la oFicina De Farmacia 5.6.1. Indicaciones, pautas y vías de administración la vacuna está indicada para la vacunación universal a la población infantil. también se indica en adolescentes y adultos que no hayan padecido la enfermedad, ni hayan sido vacunados previamente. podemos establecer dos pautas de administración según la población: a) población infantil: 1ª dosis a los 15 meses (en forma de triple vírica), y 2ª dosis entre los 4 y 6 años o entre 11 y 12 años. b) población adulta: una única dosis de vacuna. se administra siempre como vacuna triple vírica ya que actualmente no está disponible como vacuna monovalente. 5.6.2. Contraindicaciones a) embarazo. las mujeres embarazadas no deben recibir la vacuna. De igual manera debe evitarse el embarazo en los tres meses siguientes a la vacunación. b) inmunodeficiencias primarias o secundarias. en niños ViH positivos asintomáticos o con escasa manifestación clínica, sea administrará la vacuna triple vírica. c) Hipersensibilidad conocida a la neomicina. d) enfermedad febril grave. e) extremar las precauciones en individuos con antecedentes de reacción anafiláctica al huevo. f) la vacuna interacciona con gammaglobulinas y hemoderivados. la vacunación debe posponerse al menos 2 semanas antes y varios meses después de la administración del tratamiento. 5.6.3. Reacciones adversas aunque son muy poco frecuentes, los más importantes se destacan a continuación: a) infección subclínica atenuada y no transmisible. b) Febrícula acompañada de tumefacción parotídea entre los 10 y los 14 días tras la vacunación. c) prurito, exantema y púrpura trombocitopénica. d) encefalitis. el riesgo estimado de encefalitis en el mes posterior a la vacunación es de 1 caso/ 2,5 x 106 dosis administradas. e) meningitis aséptica a los 2 o 3 semanas de la vacunación. en el caso de la cepa Jeryl lynn la frecuencia es de 1 caso/1-2 millones de dosis. si se ha empleado la cepa urabe la frecuencia es de 1 caso/1000-20.000 dosis de vacuna. f) en raras ocasiones pueden presentarse convulsiones febriles, orquitis, artritis, sordera neurosensorial. 56 T.5 Vacuna triple Vírica (sarampión, rubeola, paperas) 5.7. Vacuna triple vírica 5.7.1. Características generales en la actualidad es la segunda vacuna combinada más utilizada en la población infantil. se caracteriza por producir inmunidades duraderas aunque precisa de la administración de dosis de recuerdo. la vacuna triple vírica ha sido el resultado de una ardua labor de investigación. De su implantación sistemática en todo el mundo dependerá que estas tres patologías se reduzcan de manera significativa. esta disminución de casos se está consiguiendo sobre todo en europa y américa. 5.7.2. Composición de la vacuna Formada por un liofilizado de virus hiperatenuados de sarampión, rubeola y parotiditis. normalmente el virus del sarampión se atenúa en embrión de pollo. además contiene neomicina. pueden aparecer como excipientes substancias como lactosa y sacarosa. 5.7.3. Inmunogenicidad y eficacia se alcanzan dosis de seroconversión de un 98% tras la primovacunación. la administración de una segunda dosis asegura una eficacia del 100% ya que se paliarían los posibles fallos de la vacunación inicial. 5.7.4. Indicaciones, pautas y vías de administración la vacuna triple vírica está indicada en cualquier persona de edad superior o igual a 12 meses en la que no exista una certeza sobre la inmunidad a los componentes de la vacuna, aunque en la mayoría de los calendarios vacunales de nuestro país se administra a los 15 meses. indicar que la vacunación en personas que han padecido las tres patologías no entrañaría ningún riesgo. lo mismo ocurriría en los previamente vacunados. en cuanto a las pautas de administración de la vacuna podrían darse las siguientes circunstancias: a) Vacunación primaria: a los 15 meses de edad, aunque podría adelantarse. así, en caso de riesgo de contagio podría administrarse a los 9 meses de edad, repitiendo la dosis a los 12 meses. b) segunda dosis: entre los 4 y los 6 años para prevenir un fallo vacunal. c) niños no vacunados entre los 4 y 6 años: se les dará una segunda dosis a los 11 años. la vía de administración es subcutánea o intramuscular. Debe dejarse evaporar el desinfectante empleado en la piel ya que puede producirse la inactivación de los virus atenuados de la vacuna. no puede administrarse por vía intradérmica ya que se reduce la inmunogenicidad. precaución con la administración intravenosa ya que se produciría una reacción anafiláctica. 5.7.5. Contraindicaciones y precauciones a) embarazo. las mujeres embarazadas no deben recibir la vacuna. De igual manera debe evitarse el embarazo en los tres meses siguientes a la vacunación. 57 Guía De Vacunas en la oFicina De Farmacia b) anafilaxia a las proteínas del huevo. c) contraindicaciones derivadas de cada uno de los componentes. d) Valorar la relación riesgo/beneficio en su administración a inmunodeficientes. e) la vacuna interacciona con gammaglobulinas y hemoderivados. incluso administrados tres meses antes, pueden inactivar la vacuna. f) la terapia inmunosupresora puede afectar a la inmunización. puede simultanearse con cualquiera de las vacunas del calendario vacunal Dtp, Hib, hepatitis b, Vpo, Vpp; también con la vacuna de la varicela. 5.7.6. Reacciones adversas a) produce las reacciones locales y generales de las vacunas inyectables. b) Fiebre de intensidad variable (entre los 4 y 12 días tras la vacunación) debida a la replicación del virus del sarampión. c) pueden aparecer artralgias transitorias en jóvenes debidas al virus de la rubeola. d) tumefacción parotídea provocada por el virus de la parotiditis. e) las vacunas de virus atenuados provocan cierta depresión temporal de la inmunidad general. siempre habrá que valorar la relación riesgo/beneficio. 5.7.7. Conservación la hiperatenuación de los virus hace que sean muy lábiles a la luz y el calor. el vial liofilizado debe conservarse ente +2ºc y +8ºc y se recomienda no congelar. 5.7.8. Vacunas triple víricas comercializadas Código nacional 654487.7 Nombre M M Rvaxpro Descripción 1 vial liofilizado + 1 jeringa precargada 0,5 ml Composición Virus atenuados del sarampión (cepa EndersEdmonston), de la parotiditis (cepa Jeryl Lynn, nivel B) y de la rubeola (cepa Wistar RA 27/3). Puede contener trazas de neomicina y sorbitol. 708164.7 Priorix 708172.2 887760.7 1 vial liofilizado + 1 jeringa precargada disolvente 0,5 ml 10 viales liofilizado + 10 jeringas precargadas disolvente 0,5 ml Vacuna Triple MSD 1 vial liofilizado + 1 vial disolvente 0,5 ml Virus atenuados del sarampión (cepa Schwarz), de la parotiditis (cepa RIT 4385, derivada de Jeryl Lynn) y de la rubeola (cepa Wistar RA 27/3). Puede contener trazas de sulfato de neomicina y sorbitol. Virus atenuados del sarampión (cepa EndersEdmonston), de la parotiditis (cepa Jeryl Lynn, nivel B) y de la rubeola (cepa Wistar RA 27/3). Puede contener trazas de neomicina y sorbitol. Tabla 13. Vacunas triple víricas comercializadas en España. 58 GUÍA DE VACUNAS EN LA OFICINA DE FARMACIA TEMA 6 Vacuna frente a Haemophilus influenzae tipo b Guía De Vacunas en la oFicina De Farmacia previo al empleo sistemático de la vacuna conjugada, el Haemophilus influenzae tipo b era el principal causante de meningitis bacteriana y el responsable de gran número de infecciones como epiglotitis, neumonía, celulitis, bacteriemia y otitis media en menores de 5 años, con una mayor incidencia entre los 6 y los 12 meses. en eeuu se han llegado a notificar alrededor de 2000 casos al año de enfermedad invasora por Hib y 1000 fallecimientos al año. actualmente se dispone de una vacuna conjugada, de gran poder inmunogénico, que ha logrado disminuir de forma significativa la incidencia de la enfermedad en aquellos países donde se realiza la vacunación en forma sistemática. 6.1. Características del agente etiológico Haemophilus influenzae es una bacteria Gram –, pequeña, inmóvil, no esporulada, aerobia o anaerobia facultativa que coloniza las vías respiratorias superiores. su morfología es variable, presentándose habitualmente en forma de pequeños cocobacilos a largos filamentos. existen seis tipos capsulados antigénicamente diferentes (a, b, c, d, e, f) y otras cepas no tipificables ni encapsuladas. más del 95% de los casos de enfermedad invasiva causada por H. influenzae se deben al serotipo b. 6.2. Cadena epidemiológica del Haemophilus influenzae el hombre es el único huésped natural del H. influenzae. el microorganismo muere rápidamente fuera del huésped, no sobreviviendo en el medio ambiente o en objetos inanimados. se transmite de persona a persona, por contacto directo o a través de la inhalación de gotitas de las secreciones de las vías respiratorias, siendo el periodo de incubación entre 2 y 4 días. la transmisibilidad se mantiene mientras se encuentre el germen en la nasofaringe, dejando de transmitirse a las 24-48 horas de haberse iniciado el tratamiento con antibiótico. 6.3. Factores de riesgo la susceptibilidad es universal. los factores que determinan que la persona colonizada sea asintomática o desarrolle la enfermedad invasiva no se conocen bien. algunos de los factores de riesgo que pueden influir son: a) Edad: el recién nacido hasta los 2-3 meses se encuentra protegido por los anticuerpos transferidos a través de la placenta. es a partir de esa edad cuando la incidencia de la enfermedad aumenta hasta los 5 años, edad en la que se desarrolla la inmunidad natural contra el Hib como consecuencia de la adquisición de niveles protectores de forma natural. b) Asistencia a guarderías: diversos estudios realizados en eeuu han demostrado que los niños que acuden a guarderías tienen un riesgo superior de desarrollar una enfermedad invasiva por Hib que los que no acuden. c) Factores socioeconómicos: un nivel bajo de ingresos familiares o el bajo nivel de estudios aumentan la probabilidad de exposición al Hib así como incrementan el riesgo de enfermar. 60 T.6 Vacuna Frente a HaeMoPHilus influenzae tipo b d) Lactancia materna: se sabe que la lactancia es un factor protector de la enfermedad invasiva por Hib, al menos durante los primeros seis meses de vida. e) Antecedentes de infección respiratoria: los estudios epidemiológicos a este respecto no son concluyentes, aunque parecen indicar que infecciones respiratorias previas pueden incrementar la susceptibilidad del huésped a la enfermedad invasiva. 6.4. Clínica del Haemophilus influenzae las formas no capsuladas causan infecciones leves como otitis media, bronquitis y sinusitis, siendo raramente responsables de enfermedad invasiva. sin embargo, las formas capsuladas, frecuentemente el serotipo b, son las responsables de las diferentes formas de enfermedad invasiva, siendo la meningitis la más común y severa. las enfermedades invasivas se producen al diseminarse el microorganismo desde la nasofaringe a la sangre y a otros lugares del organismo. Dentro de dichas infecciones, las más comunes son meningitis, epiglotitis, neumonía, artritis y celulitis, afectando casi exclusivamente a niños menores de 5 años. ocasionalmente pueden afectar a personas inmunodeprimidas mayores de esta edad. a) Meningitis: es la manifestación aguda más grave causada por Hib. ocurre en el 50-65% de los casos y afecta principalmente a niños entre 6 y 18 meses (cuando los niños ya han perdido la protección generada por los anticuerpos transplacentarios). las características clínicas iniciales son fiebre, inapetencia y alteraciones del sistema nervioso central, existiendo en los lactantes síntomas poco relevantes: no se manifiesta ni rigidez de nuca, ni otros signos indicadores de alteración en el snc; por el contrario los vómitos casi nunca faltan. Generalmente después de estos síntomas iniciales se producen convulsiones y la evolución espontánea de la enfermedad es hacia el coma en pocos días u horas. con tratamiento antibiótico adecuado la tasa de mortalidad mundial es del 2-5%. las principales secuelas de una meningitis causada por Hib son sordera permanente (10%) y hasta un 20% puede presentar otro tipo de secuelas. b) Epiglotitis: es la segunda manifestación más común en europa y norteamérica. se caracteriza por una obstrucción de las vías respiratorias con una evolución muy rápida que puede provocar la muerte por asfixia. suele afectar a niños entre 2 y 7 años y también a adultos. el comienzo puede ser lento con dolores de garganta o fulminante con episodios de fiebre elevada, disnea, disfagia y babeo, inquietud e irritabilidad. c) Neumonía: la única característica diferencial de este tipo de neumonías y las producidas por otros microorganismos es que el comienzo es más insidioso, precedido de infección en las vías respiratorias altas y fiebre alta. la mayoría de las veces la neumonía causada por Hib acompaña a otras de las enfermedades invasivas. d) Celulitis: es frecuente en los niños más pequeños. suele presentarse como fiebre, hinchazón y color azulado en la zona afectada (mejilla y la boca o cuello). e) Artritis: afecta principalmente a niños pequeños, caracterizándose por dolor en una articulación mayor (aquella que soporta el peso corporal) y dolor al realizar movimientos, e inflamación. f) Otras enfermedades: pericarditis (infección de la membrana que recubre el corazón), empiema (presencia de pus en la cavidad pleural) y osteomielitis (infección del tejido óseo). 61 Guía De Vacunas en la oFicina De Farmacia el fármaco de elección es el cloranfenicol o cefalosporinas de tercera generación, debiendo comenzar el tratamiento de forma inmediata. la duración del tratamiento oscila entre 10 y 14 días. en la actualidad entre un 30-50% de las cepas de Hib son resistentes a la ampicilina en españa y un elevado número de éstas son a su vez resistentes al cloranfenicol. 6.5. Epidemiología de la infección por Haemophilus influenzae la enfermedad invasiva por Hib tiene una distribución universal y suele presentarse con carácter endémico. la mayoría de los casos que se producen son primarios, es decir, se producen por contacto con un portador asintomático. no se han conocido grandes epidemias causadas por este microorganismo. en estados unidos, canadá, australia, países nórdicos e israel, Hib es la causa más importante de meningitis en niños jóvenes y una de las más importantes causas de enfermedad invasiva bacteriana. el número de casos antes de la implantación de la vacuna era de 20.000/100.000 niños menores de 5 años, con tasas de incidencia entre el 45-69/100.000 niños menores de 5 años. la incidencia en eeuu ha disminuido a consecuencia de la vacunación con vacuna conjugada (1988) pasando a tasas de 3,7 casos/100.000 en niños menores de 5 años. en europa todos los países que han introducido la vacuna han sufrido descensos en sus tasas de incidencia. así inglaterra y Gales presentaban tasas de 26-28/100.000; Francia 23/100.000; Finlandia 52/100.000; Dinamarca 40/100.000 niños menores de 5 años. Datos de australia estimaban la incidencia prevacunal en un 58,5/100.000 niños menores de 5 años de edad. en américa latina y caribe, antes de introducir la vacunación de forma sistemática, la incidencia global de enfermedad invasiva por Hib era de 60/100.000 niños menores de 5 años de edad. en los países en vías de desarrollo la incidencia de la enfermedad por Hib es mucho mayor que en los países industrializados, afectando principalmente a los niños más pequeños, la mayoría de ellos antes de los 12 meses y aproximadamente la mitad antes de los 6 meses de vida. también la clínica es diferente, siendo más predominante la neumonía que la meningitis. en el África subsahariana, el 20-40% de los niños ingresados fallece a causa de la enfermedad. en españa, debido a la existencia de estudios parciales acerca de la incidencia de esta enfermedad en la población infantil y al uso de diferentes metodologías para ello, se llevó a cabo un proyecto a nivel nacional que recogió datos de 12 ccaa en los años 1993 y 1994. en total se localizaron 302 casos por Hib, de los cuales 192 (63,6%) fueron diagnosticados como meningitis. la incidencia para la enfermedad invasiva total de 12,4/100.000 niños menores de 5 años de edad y para meningitis de 8/100.000 niños menores de 5 años. se detectó asimismo una importante variabilidad geográfica, obteniéndose tasas elevadas de 25,2 en baleares, 25,1 en la rioja, 16,3 en castilla león y 13,8 en castilla la mancha, a cifras muy bajas como las de extremadura, de 1,6, o cantabria de 4,5. el 77,8% de los casos declarados ocurrieron en niños menores de 2 años y el 42,7% en niños menores de 1 año. también se pudo observar un claro patrón estacional coincidiendo con los meses fríos del año, principalmente entre los meses de octubre y enero. se observaron un 24,3% de complicaciones y/o secuelas, ocasionadas principalmente por meningitis y epiglotitis, y se produjeron un 4,7% de muertes, el 71,4% en niños menores de 1 año. 62 T.6 Vacuna Frente a HaeMoPHilus influenzae tipo b estudios comparativos de las tasas de incidencia en otros países europeos donde la vacuna ya había sido introducida de forma sistemática con los datos obtenidos de este estudio evidenció la necesidad de incluir la vacuna conjugada frente a Hib como vacuna sistemática, introduciéndose en el calendario vacunal en 1998. 6.6. Control de la enfermedad invasiva causada por Hib. Actuación en casos especiales 6.6.1. Quimioprofilaxis con la quimioprofilaxis se pretende eliminar todos los posibles portadores entre los contactos de un niño que es susceptible y evitar así la transmisión del microorganismo. algunos fármacos utilizados en el tratamiento de la enfermedad no llegan a actuar a nivel de la nasofaringe por lo es recomendable administrar quimioprofilaxis a pacientes ya tratados y curados al darles el alta. 6.6.2. Definición de contacto íntimo se define como contacto íntimo a aquellas personas que en los 10 días previos al diagnóstico de un caso cumplen alguna de las siguientes características: a) convive en el domicilio del enfermo o duerme en la misma habitación. b) está expuesto a las secreciones orales de un caso (respiración boca a boca, besos, intubación traqueal…). c) comparten utensilios de higiene bucal, cubertería o alimentos. d) en escuelas infantiles se extiende este concepto a todos los niños, siempre que compartan alguna actividad en el centro. e) personas que aun no viviendo en el mismo domicilio tengan contactos próximos y repetidos con el enfermo (en general, durante más de cuatro horas al día). la definición de contacto íntimo se aplicará independientemente de la edad de la persona, aunque en el caso de los niños pequeños hay que tener en cuenta que éstos tienen mayor riesgo. 6.6.3. Pautas de actuación ante los contactos de un caso de meningitis se debe administrar quimioprofilaxis en las siguientes circunstancias: a) todos los miembros de una familia (niños y adultos) si conviven con un niño no vacunado menor de 5 años. b) todos los miembros de una familia (niños y adultos) donde haya aparecido un caso, cuando entre ellos haya algún niño inmunodeprimido, independiente de su edad y de su estado vacunal. c) a todos los contactos íntimos de un caso (compañeros de guardería, colegio, personal…) menores de 5 años, no vacunados o vacunados de forma incompleta. el antibiótico de elección es la rifampicina, que ha demostrado eliminar Hib en el 95% de los portadores. 63 Guía De Vacunas en la oFicina De Farmacia 6.7. Vacuna anti-Hib la historia de las inmunizaciones frente a Hib se inicia en Finlandia y eeuu en el año 1973 con dos ensayos clínicos con una vacuna polisacárida que resultaba ser poco inmunogénica en niños menores de 18 meses (grupo de mayor riesgo). Fue autorizada en eeuu en el año 1985 para vacunar a niños mayores de 18 meses. la segunda generación de vacunas han sido las vacunas conjugadas, autorizadas en 1987 para su uso en lactantes desde los 2 meses de edad y comercializadas en eeuu en 1990. la tercera generación de vacunas son las combinadas con la vacuna conjugada. en 1998 fueron comercializadas en españa algunas como la Dtpa/e-Hib. 6.7.1. Vacuna polisacárida Fue la primera vacuna disponible para la prevención de las enfermedades causadas por Hib, autorizada en 1985, pero no se utiliza en la actualidad. 6.7.2. Vacuna conjugada frente a Hib con el fin de superar los problemas de la vacuna polisacárida se procedió a unir (conjugar) el polisacárido capsular purificado polirribosil-ribitol-fosfato (prp) con una proteína transportadora que posibilitara transformar la polisacárida en timo-dependiente, lo que permite obtener una respuesta de inmunidad de memoria en los niños menores de 18 meses, consiguiendo de esta forma una elevada respuesta inmunológica a partir de los 2 meses de edad y memoria inmunológica. 6.7.3. Composición de la vacuna conjugada se disponen de cuatro tipos de vacunas: a) prp-t: vacuna conjugada del prp con toxoide tetánico a razón de 0,4:1 (toxoide/polisacárido). b) prp-D: Vacuna conjugada del prp con toxoide diftérico a razón de 1,2:1 (toxoide/polisacárido), no disponible en españa. c) Hboc: Vacuna conjugada de un oligosacárido capsular con una mutante no tóxica de la proteína del toxoide diftérico obtenida por ingeniería genética, denominada crm 197, en proporción 0,16-0,2:1. contiene cloruro sódico como disolvente. no disponible en españa. d) prp-omp: vacuna conjugada del prp con un complejo proteico de la membrana externa de neisseria meningitidis serogrupo b. no disponible en españa. 6.7.4. Inmunogenicidad y eficacia las vacunas frente a Hib son eficaces para la prevención de la enfermedad invasora por este microorganismo, pero no lo son para la profilaxis de enfermedades invasoras originadas por otros serotipos de cepas capsuladas, ni infecciones (otitis, conjuntivitis…) causadas por cepas no capsuladas. reducen el número de portadores nasofaríngeos. una concentración de anticuerpos de 0,15 µg/ml se consideran protectores (valor de protección natural o concentración mínima de protección inmediata) y una de 1 µg/ml proporciona protección a largo plazo (valor de 64 T.6 Vacuna Frente a HaeMoPHilus influenzae tipo b protección vacunal o concentración mínima protectora a largo plazo), manteniéndose esta concentración con la administración de la dosis de refuerzo. la persistencia de los anticuerpos en los niños durante las edades en que están sometidos a más riesgo se alcanza con la administración de dosis de refuerzo a los 12-15 meses de edad en niños que recibieron la primovacunación cuando eran menores de 12 meses. la gran eficacia de estas vacunas ha sido ampliamente demostrada tras numerosos estudios y especialmente por la drástica disminución de casos en los países donde se ha vacunado de forma sistemática. a) un estudio llevado a cabo en eeuu (1988-1990) con la vacuna Hboc, administrada a los 2, 4 y 6 meses de edad, demostró una eficacia del 100% después de la segunda y tercera dosis (siendo la eficacia solamente del 26% tras la primera dosis). b) también un estudio llevado a cabo en Finlandia (1987-1989) con la vacuna Hboc, administrada a los 4, 6 y 18 meses de edad, demostró eficacia del 89%, 95% y el 100% después de la primera, segunda y tercera dosis respectivamente. c) estudios similares con la vacuna prp-t han demostrado eficacia entre el 95-100%. 6.7.5. Fallos vacunales y vacunaciones incompletas la vacuna es muy inmunógena y eficaz cuando se usan las tres dosis recomendadas en lactantes y una dosis de refuerzo entre los 12 y 18 meses de edad. una dosis de vacuna es muy inmunógena en niños a partir de 15 meses de edad. en niños pequeños, la inmunogenicidad depende de la edad de la dosis inicial: la primera dosis a los 2 ó 3 meses de edad no induce una respuesta importante de anticuerpos, pero después de una segunda dosis, a los 4 ó 5 meses de vida se produce una respuesta significativa que alcanza títulos de anticuerpos entre 15 y 22 veces más elevados, y tras la tercera dosis, a los 6 ó 7 meses, se logran altas concentraciones de anticuerpos en casi todos los niños. la eficacia de la vacuna se inicia entre 1 y 2 semanas después de su administración, es decir, cuando ya se han empezado a producir anticuerpos. los fallos vacunales que pueden aparecer con las vacunas conjugadas frente a Hib son infrecuentes. Valdheim en un estudio realizado en los Ángeles, obtuvo 16 casos de infecciones por Hib después de una única dosis de vacuna, 6 casos tras dos dosis y 3 después de las tres primeras dosis. estos fallos pueden deberse a una respuesta inmunitaria deficiente al no haberse administrado todas las dosis requeridas o la revacunación, por una deficiencia inmunitaria del niño vacunado (déficit de igG2), por una hiporreactividad al prp o por la presencia de anticuerpos maternos elevados. en caso de no poder administrar alguna dosis, no es necesario la primovacunación, basta con completar la dosis ausente tan pronto como sea posible. 6.7.6. Indicaciones, pautas y vías de administración a) lactantes a partir de 2 meses de edad. b) menores de 5 años no vacunados. c) embarazadas (tercer trimestre) o mujeres en edad fértil (en caso de no haber contraído la enfermedad de forma natural). d) niños menores de 24 meses con enfermedad invasora por Hib, se deben vacunar un mes después del comienzo de la enfermedad, siguiendo la pauta de vacunación de acuerdo a su edad. los niños mayores de 24 meses con Hib no necesitan vacunación (inmunidad natural). 65 Guía De Vacunas en la oFicina De Farmacia e) contactos menores de 5 años de un enfermo por enfermedad invasora con Haemophilus influenzae tipo b. Quimioprofilaxis y vacuna si no están vacunados o lo están de forma incompleta. no se recomienda en niños mayores de 5 años de edad y adultos no vacunados salvo en caso de riesgo de presentar una enfermedad invasora por Hib (asplenia, ViH, inmunodeficiencias…), así como aquellos que estén siendo tratados con quimioterapia o que hayan recibido un transplante de médula ósea. se administra (Véase tabla 14) por vía subcutánea o intramuscular en la cara anterolateral el muslo en niños menores de un año; en niños mayores se aplica en la región deltoidea. Vacu na PRP - T Inicio (meses) Dosis Intervalo (semanas) Refuerzo (meses) 2–6 3 4-8 15 – 18 6 – 12 2 4–8 15 – 18 > 12 1 — No Tabla 14. Pautas de vacunación con la vacuna anti-Haemophilus los niños mayores de 12 meses con riesgo de padecer enfermedad invasiva por Hib y los niños mayores de 5 años en los que esté indicada la vacuna recibirán una dosis de recuerdo dos meses después de ésta. Vacunar antes de la 6ª semana de vida puede inducir tolerancia a Hib. el intervalo mínimo entre dosis debe ser de 4 semanas y el óptimo 2 meses. 6.7.7. Contraindicaciones y precauciones a) Hipersensibilidad a cualquier componente de la vacuna, para lo cual hay que tener en cuenta la proteína con que se ha conjugado y los conservantes, ya que éstos son diferentes en cada tipo de vacuna conjugada frente a Hib. b) embarazo. no se recomienda vacunar a embarazadas durante el primer trimestre de embarazo. en relación a las interacciones, la vacuna frente a Hib puede ser administrada a la vez que otras vacunas pero siempre en diferente lugar y con jeringas diferentes. 6.7.8. Reacciones adversas la vacuna frente a Hib no ha originado ningún efecto secundario grave ni secuelas, por lo que se la considera una vacuna segura. las reacciones adversas son poco frecuentes, leves y transitorias. su incidencia varía entre el 5% y el 25%, y se trata principalmente de reacciones locales como dolor, eritema, tumefacción o induración en el lugar de la inyección. otras reacciones a nivel general suelen ser fiebre o irritabilidad. son poco frecuentes y desaparecen en las 24 horas posteriores a la vacunación. 6.7.9. Vacunas combinadas las vacunas frente a Haemophilus influenzae se encuentran comercializadas en diferentes países formando parte de algunas vacunas combinadas, asociadas con otras (difteria, tétanos, tos ferina acelular o de células enteras, poliomielitis y hepatitis b). la inmunogenicidad y las reacciones adversas son similares a las observadas cuando se administran las vacunas por separado. 66 T.6 Vacuna Frente a HaeMoPHilus influenzae tipo b 6.7.10. Vacunas anti-Hib comercializadas en España Vacunas anti-Hib solas Código nacional 664730.1 Nombre Hiberix Descripción Vial liofilizado + 1 jeringa precargada 0,5 ml Composición Polisacárido capsular PRP purificado de H. influenzae tipo b, conjugado con toxoide tetánico. Vacunas anti-Hib combinadas (Hib + VPI + DTPa) Código nacional Nombre Descripción Composición 841320.1 InfanrixIPV+HIB Vial liofilizado + 1 jeringa precargada 0,5 ml Polisacárido capsular PRP purificado de H. influenzae tipo b, conjugado con toxoide tetánico. Acompañado de virus de la poliomielitis inactivados (cepas tipo 1, 2 y 3), toxoide diftérico, toxoide tetánico y fracción antigénica de Bordetella pertussis (toxoide pertussis y hemaglutinina filamentosa). 651501.3 Pentavac Vial liofilizado + 1 jeringa precargada 0,5 ml Polisacárido capsular PRP purificado de H. influenzae tipo b, conjugado con toxoide tetánico. Acompañado de virus de la poliomielitis inactivados (cepas tipo 1, 2 y 3), toxoide diftérico, toxoide tetánico y fracción antigénica de Bordetella pertussis (toxoide pertussis y hemaglutinina filamentosa). Vacunas anti-Hib combinadas (Hib + VPI+ DTPa + VHB) Código nacional 820068.9 657445.4 Nombre Infanrix Hexa Descripción Vial liofilizado + 1 jeringa precargada 0,5 ml sin aguja Vial liofilizado + 1 jeringa precargada 0,5 ml con aguja Composición Polisacárido capsular PRP purificado de H. influenzae tipo b, conjugado con toxoide tetánico. Acompañado de virus de la poliomielitis inactivados (cepas tipo 1, 2 y 3), toxoide diftérico, toxoide tetánico, fracción antigénica de Bordetella pertussis (toxoide pertussis, hemaglutinina filamentosa y pertactina), y antígeno de superficie (proteína S) del virus de hepatitis B. Puede contener trazas de neomicina y polimixina B. Tabla 15. Vacunas anti-Hib comercializadas en España. se deben almacenar en viales a una temperatura entre +2º-8ºc y no deben congelarse porque se inactivan. 67 GUÍA DE VACUNAS EN LA OFICINA DE FARMACIA TEMA 7 Vacuna frente a la enfermedad meningocócica Guía De Vacunas en la oFicina De Farmacia la enfermedad meningocócica es una de las principales causas de meningitis y sepsis en el mundo, manifestándose inicialmente con un cuadro clínico inespecífico asociado habitualmente a fiebre, cefaleas, malestar general y diversos síntomas. afecta principalmente a niños menores de 5 años aunque puede aparecer a cualquier edad. 7.1. Características del agente etiológico neisseria meningitidis es un diplococo Gram negativo, no móvil, aerobio estricto, citocromo oxidasa y catalasa positivo. su estructura consiste en una membrana externa cuyas proteínas (omp) permiten definir 20 serotipos conocidos, una cápsula o envoltura cuyos componentes permiten distribuirlos en 13 serogrupos conocidos (a, b, c, D, X, Y, Z, 29e, W135, H, i, K y l), y unas fimbrias o pili donde se encuentra la endotoxina responsable de la patogenia de la enfermedad, y que definen 12 inmunotipos. esta clasificación, desde el punto de vista epidemiológico, tiene especial relevancia para la caracterización de brotes y el seguimiento de la difusión de la enfermedad en la población. los serogrupos a, b y c son los responsables del 80-90% de los casos de enfermedad, siendo el serogrupo c el causante de brotes y ocasionalmente epidemias. a) serogrupo a: responsable del conocido “cinturón africano” y también presente en el este de europa. responsable de brotes epidémicos con elevada morbilidad y mortalidad. b) serogrupo b: capaz de producir ondas epidémicas. es generalmente, el responsable de las situaciones de endemicidad de los países desarrollados. c) serogrupo c: Generalmente responsable de brotes epidémicos y ondas cortas pero ha sido especialmente importante en países europeos, estados unidos y canadá en los últimos años. Últimamente comienza a tener importancia, en determinadas zonas geográficas, serogrupos como el W135 y el Y. De hecho, el serogrupo W135 (W135: 2a: p1.2,5) se ha asociado a un brote epidémico en peregrinos de la meca del año 2000 (99 casos). 7.2. Cadena epidemiológica de la infección meningocócica el único huésped natural del meningococo es el hombre y el microorganismo muere rápidamente fuera del huésped. la forma de transmisión de neisseria meningitidis es a través de aerosoles o por contacto con secreciones respiratorias, favoreciendo dicha transmisión la tos, los estornudos y la proximidad física. los meningococos colonizan la nasofaringe y posteriormente pueden expandirse al sistema circulatorio. el período de incubación puede variar entre 2 y 10 días, aunque habitualmente es de 3 a 4 días. el periodo de transmisibilidad se mantiene mientras los meningococos estén en las secreciones nasofaríngeas. por lo general desaparecen a las 24 horas de haber iniciado tratamiento antibiótico. la susceptibilidad a la enfermedad es baja, con elevada proporción de portadores en relación con el número de casos. son las personas con colonizaciones recientes las que presentan mayor riesgo de padecer la enfermedad, ya que después de 7 días dichas personas ya presentan niveles de anticuerpos que resultan protectores. 70 T.7 Vacuna Frente a la enFermeDaD meninGocócica la resistencia del huésped al meningococo depende de la capacidad funcional de la mucosa rinofaríngea y sobre todo, de la presencia del complemento y de anticuerpos bactericidas en la sangre. la enfermedad meningocócica puede afectar a cualquier grupo de edad, aunque es más frecuente en niños y jóvenes. la susceptibilidad de los niños está relacionada con la presencia de anticuerpos bactericidas en el suero. el 50% de los lactantes tienen títulos de anticuerpos bactericidas debido a la transferencia materna; posteriormente estos niveles disminuyen y alcanzan su punto más bajo entre los 6 y los 24 meses de vida. Después de esta edad se produce un aumento lineal en el título de anticuerpos hasta los 12 años. 7.2.1. Factores de riesgo de la infección meningocócica a) individuos con riesgo elevado: • anemia drepanocítica. • asplenia funcional o anatómica. • Deficiencia de la properdina o de la vía terminal del complemento (c5 a c8). • Hacinamiento. • malas condiciones de vida • tabaquismo. • contactos íntimos de los casos de meningitis. por el contrario, diversos estudios no han puesto de manifiesto que exista un riesgo aumentado para presentar la enfermedad en personas con enfermedades asociadas a inmunosupresión, incluyendo la infección por ViH. b) infecciones respiratorias previas: el haber padecido infecciones respiratorias causadas por Mycoplasma o por virus respiratorios como el de la gripe a, pueden influir en la patogénesis de la enfermedad invasora, posiblemente por aumentar la eficiencia de la transmisión de neisseria meningitidis de persona a persona por secreciones o por disminución transitoria de la inmunidad causada por una infección viral, que podría actuar disminuyendo la capacidad del huésped para controlar la invasión. c) edad y sexo: puede presentarse en todas las edades, pero son los niños menores de 5 años los que tienen las tasas de incidencia más elevadas, probablemente debido a la falta de anticuerpos circulantes y a la ausencia de estímulos antigénicos previos. también existe una relación entre la edad y el serogrupo. el serogrupo b afecta más a niños pequeños que los serogrupos a y c que tienden a desplazarse hacia los grupos de mayor edad. la enfermedad meningocócica es más frecuente en hombres que mujeres oscilando la razón entre 1,2 y 1,5. sin embargo, la letalidad acostumbra a ser superior en mujeres. d) ocupación y medio escolar: no se ha podido establecer relación causal entre la ocupación y el padecer la enfermedad. tan sólo dos tipos de ocupaciones como son los profesionales sanitarios y los militares podrían considerarse de riesgo en determinadas circunstancias. el personal sanitario tiene un riesgo incrementado en el caso de practicar reanimación a un enfermo o al inocularse accidentalmente con material contaminado, ya que fuera de estas situaciones tiene el mismo riesgo que la población general. 71 Guía De Vacunas en la oFicina De Farmacia en el caso de los militares el riesgo podría reducirse a épocas de hacinamiento o a situaciones de estrés o cansancio siendo estos factores posibles factores que favorecen la aparición de la enfermedad. el medio escolar, considerado durante mucho tiempo como factor que predisponía a la enfermedad meningocócica, no está actualmente considerado como tal, siendo la edad el factor que realmente predispone para la aparición de la misma. la mayoría de los casos secundarios aparecen entre los contactos que conviven en el mismo domicilio que el caso índice y no entre los compañeros de escuela o clase. e) ambientales: las estaciones se han relacionado con la enfermedad meningocócica. en muchos países tropicales, la mayoría de los casos ocurren durante la época de sequía, por ejemplo en el “cinturón de la meningitis” del África subsahariana (Véase imagen 1). en los climas templados, gran parte de los brotes ocurren a final de invierno. f) Factores socioeconómicos: la pobreza emparejada al hacinamiento son factores predisponentes para la aparición de la enfermedad meningocócica, especialmente en los países en desarrollo. en los países en vías de desarrollo, la desnutrición, los déficit de vitamina a y el paludismo, todas ellas unidas al nivel socioeconómico, influirían no sólo en la aparición de le enfermedad sino en la escasa respuesta inmunitaria a la vacunación. Cinturón de Meningitis Países que reportan más de 15 casos por 100.000 personas y una epidemia de enfermedad meningocócica de enero de 1995 a octubre de 1999 Imagen 1. Cinturón de la meningitis africana. 7.2.2. Estado de portador Desde 1896 se conoce el estado de portador para neisseria meningitidis en población sana. Diversos estudios han observado una estrecha relación entre la prevalencia del estado de portador en una población y el inicio, desarrollo y descenso de una epidemia. sin embargo estudios posteriores no han apoyado esta información, 72 T.7 Vacuna Frente a la enFermeDaD meninGocócica demostrándose que el porcentaje de portadores en la comunidad no se puede asociar con los casos de enfermedad meningocócica. Tanto la adquisición del estado de portador como el haber padecido de forma natural la enfermedad, tanto en su forma clínica como subclínica, confieren inmunidad, de duración limitada. unas semanas después de haberse iniciado la colonización, se detectan incrementos en los títulos de anticuerpos igG, igm e iga. la inmunidad natural puede no requerir la infección por el microorganismo o colonización por cada serogrupo, ni siquiera por neisseria meningitidis puesto que pueden producirse anticuerpos en respuesta a antígenos de reacción cruzada presentes en otras especies de neisseria o incluso en otros géneros. los portadores nasofaríngeos de meningococo son comunes en la población, observándose que las tasas varían en función de la edad. son altas en la adolescencia y adultos jóvenes y bajas en la infancia. también se relaciona un incremento del número de portadores con las condiciones de vida, aumentando éstos en casos de hacinamiento. estudios realizados en inglaterra han obtenido tasas de portadores del 2% en niños menores de 5 años y del 24% en personas entre 15 y 19 años. tasas elevadas de portadores se observaban en fumadores, en personas que viven hacinadas y en reclutas. en Francia se han obtenido tasas del 10% en menores de 14 años y del 30% en el grupo de 15 a 20 años. un estudio realizado en españa entre 1991 y 1992 encontró tasas de portadores en la población escolar entre 6 y 14 años del 2,3%. los enfermos constituyen una fuente de infección mientras tienen meningococos en la nasofaringe. a pesar de ello, son los portadores los que causan mayoritariamente la infección al haberse estimado que por cada caso hay más de 1.000 portadores sanos. 7.3. Signos y síntomas de la infección meningocócica el periodo de incubación de la enfermedad puede variar entre 2 y 10 días aunque lo habitual es entre 3 y 4 días. la enfermedad se puede presentar como: bacteriemia inaparente benigna, sepsis grave con o sin meningitis, meningitis con o sin sepsis, meningoencefalitis. a) meningitis. neisseria meningitidis es la primera causa de meningitis bacteriana en el niño y la segunda en el adulto. se manifiesta inicialmente por un cuadro de cefalea y fiebre, apareciendo posteriormente alteraciones del nivel de la consciencia, vómitos, convulsiones, y en algunos casos rigidez de nuca. b) sepsis meningocócica. se puede presentar un cuadro séptico en el que puede haber o no meningitis. se caracteriza por fiebre, hipotermia, hipotensión, shock, y petequias o lesiones purpúricas. las petequias son lesiones entre 1-2 mm de diámetro, más frecuentes en el tronco y en las extremidades inferiores, que a veces pueden convertirse en lesiones necróticas y alcanzar la piel e incluso órganos más profundos (la ausencia de éstas no excluye la presencia de la enfermedad). una de las señales de alerta para los padres es que las petequias no desaparecen al hacer presión sobre ellas. otras manifestaciones de la enfermedad meningocócica menos frecuentes pueden ser: miocarditis, insuficiencia renal aguda, artritis, neumonía, vasculitis, conjuntivitis, endocarditis, periocarditis y uretritis. las secuelas neurológicas de la meningitis, que aparecen en el 5-20% de los casos, consisten en sordera neurosensorial, trastornos motores y de la coordinación, y retraso mental. en las formas sépticas las secuelas suelen ser necrosis cutáneas, subcutáneas y óseas que excepcionalmente pueden llevar a la pérdida de las extremidades. la letalidad de la enfermedad es variable; en las meningitis suele ser inferior al 15% y en las sepsis entre el 20 y 50%. 73 Guía De Vacunas en la oFicina De Farmacia la penicilina (bencilpenicilina) es el fármaco de elección en el tratamiento de la enfermedad meningocócica, siendo la única contraindicación reacciones anafilácticas previas a la penicilina. en estos casos se recomienda cloranfenicol y cefalosporinas. 7.4. Epidemiología de la infección meningocócica la enfermedad meningocócica tiene una distribución universal, aunque con una elevada frecuencia en climas templados y tropicales, tanto en zonas rurales como urbanas. se producen ondas epidémicas (10-500 casos por 100.000 habitantes) cada 10 años. puede manifestarse esporádicamente en brotes (serogrupos b y c) con un incremento de las tasas de incidencia cada 7-12 años, o en grandes epidemias como en el África subsahariana llamado el “cinturón de la meningitis” (serogrupo a). según datos de la oms en la actualidad, la enfermedad meningocócica causa entre 500.000 y 600.000 muertes al año, afectando de forma especial a lactantes y niños menores de 5 años y disminuyendo el riesgo con la edad. aunque su incidencia global es muy variable, en algunos países en vías de desarrollo puede alcanzar valores entre 100-500 casos/100.000 habitantes (países del cinturón de la meningitis africana). en eeuu las tasas son bajas, 1 por 100.000 habitantes. en europa oscilan entre 0,5 y 4 casos por 100.000, siendo los países nórdicos los que presentan tasas más elevadas. los serogrupos a, b y c son los responsables del 80-90% de los casos de enfermedad, siendo los serogrupos Y y W-135 los causantes del 10-15% restante. la situación epidemiológica en los países desarrollados ha experimentado un gran cambio al inicio de la década de los noventa se produce un aumento paulatino de la incidencia de la enfermedad meningocócica asociada a la circulación de una nueva cepa del serogrupo c, alcanzando las mayores tasas entre los años 1996 y 1997. españa presenta una tasa de incidencia relativamente baja al compararla con otros países europeos, aproximadamente 0,4 casos por 100.000 habitantes, presentándose en ondas multianuales. el serogrupo predominante ha sido el serogrupo b, siendo el causante de las epidemias de 1970-71 y en 1977/1979 (donde se alcanzaron tasas de 179/100.000 habitantes). pero ha sido a partir de 1995 cuando se ha observado un incremento del número de cepas del serogrupo c especialmente entre 1996-97 causando el último brote que se ha producido en españa (Véase imagen 2). en esta última década se había pasado de una situación en que el serogrupo b representaba entre un 60%-70% de todos los casos y el c entre un 25-30% a deberse al serogrupo b un 27% de los casos y al c un 73% (1996). este incremento fue debido a la circulación de una nueva cepa de neisseria meningitidis c:2b:p1.2,5 (serogrupo c, serotipo 2b, subserotipo p1.2,5), una cepa frente a la que la población general no presentaba inmunidad natural y que presentaba un importante grado de virulencia, provocando la ya mencionada onda epidémica causada por serogrupo c. Durante esta última oleada la incidencia de la enfermedad meningocócica fue muy desigual en las diferentes ccaa. Galicia fue la que mayor tasa de incidencia presentó, con 13 casos confirmados por cultivo, seguida de cantabria con una tasa de 12,2, la rioja con 6,1 y castilla león con 4. esta situación desembocó en una campaña de vacunación masiva en las 14 de las 17 ccaa a la población entre 18 meses y 19 años como método de control de la enfermedad meningocócica. 74 T.7 Vacuna Frente a la enFermeDaD meninGocócica 35 Nº de casos Total conf. 30 Serog. C Serog. B 25 20 15 10 5 0 ct 95 O 96 ct O ct 97 O 98 ct O 99 ct O Imagen 2. Prevalencia de meningitis en la Comunidad de Madrid (1995-2000) Desde octubre del año 1999 a junio del 2000 se ha observado un aumento de la incidencia de la enfermedad meningocócica por serogrupo c en niños menores de 5 años. esta situación unida a la creación de una nueva vacuna frente a este serogrupo que había demostrado ser eficaz y segura concretamente en niños menores de 2 años, llevó a la introducción de la nueva vacuna conjugada frente a meningococo serogrupo c en el calendario vacunal español en el año 2001, y en muchas comunidades autónomas, entre ellas madrid, a realizar una campaña de vacunación masiva a niños entre 2 meses y 5 años. 7.5. Control de la enfermedad meningocócica. Actuación en casos especiales en casos esporádicos y en brotes se recomienda el aislamiento del paciente hasta pasadas 24 horas de iniciado el tratamiento antibiótico. asimismo, una vez conocido el serogrupo se deberá comunicar con la mayor rapidez con el fin de establecer pautas de vacunación. Valorar los contactos íntimos con el fin de aplicar quimioprofilaxis, y vacunar si el brote está causando por un serogrupo presente en la vacuna. 7.5.1. Quimioprofilaxis indicaciones de profilaxis antimeningocócica: a) personas que viven en el domicilio del caso índice. b) personas que hayan pernoctado en la misma habitación del caso índice los 10 días precedentes a su hospitalización. c) personas que no viven en el mismo domicilio que el caso índice pero que han tenido contactos próximos y repetidos en los últimos días, durante más de 4 horas consecutivas al día. 75 Guía De Vacunas en la oFicina De Farmacia d) personas que han tenido contacto directo con las secreciones nasofaríngeas del enfermo los 10 días precedentes a su hospitalización y hasta 24 horas después de iniciado el tratamiento antibiótico. e) en guarderías y centros de preescolar (hasta 5 años de edad). • un caso en un aula: todos los niños y personal del aula (valorar otros posible contactos). • Dos casos en aulas distintas: todos los niños y personal de la guardería o centro preescolar. f) otros centros escolares (eso y enseñanza media). • un caso en un aula: todos los alumnos del aula (valorar otros posible contactos). • Dos casos en aulas distintas: todos los alumnos de ambas aulas. • tres o más casos en el plazo de un mes, en al menos 2 aulas: todos los alumnos y personal del centro. el antibiótico de elección es la rifampicina, que ha demostrado ser eficaz para reducir las tasas de portadores entre un 72-90%, recomendándose su administración tan pronto sea posible (normalmente a las 24 horas de haber aparecido el caso). otros antibióticos alternativos serían ciprofloxacina o ceftriaxona (Véase tabla 16). Antibiótico Pauta posológica Vía de administración Rifampicina Niños < 1 mes: 5 mg/kg/12 horas, durante 2 días Niños 1 mes – 12 años: 10 mg/kg/12 horas, durante 2 días Adultos: 600 mg/12 horas, durante 2 días Oral Ceftriaxona Niños < 12 años: 125 mg Adultos y niños mayores de 12 años: 250 mg Intramuscular Ciprofloxacina Adultos: 500 mg (monodosis) Oral Tabla 16. Quimioprofilaxis de infección meningocócica 7.6. Vacunas antimeningocócicas 7.6.1. Tipos de vacunas antimeningocócicas a) Vacuna antimeningocócica A. la eficacia de esta vacuna está en relación a la edad; en niños mayores de 18 meses la eficacia está por encima del 80-90% manteniéndose la respuesta durante un año o más. en niños menores de 12 meses es poco inmunogénica, siendo sólo aconsejable vacunar en caso de epidemia o viajes a zonas endémicas y siendo necesarias dos dosis de vacuna. la duración de la protección también está relacionada con la edad de la primovacunación. en niños que son vacunados antes de los 4 años de edad, la protección es considerablemente menor que si son vacunados después de esa edad. la vacuna produce efecto booster por lo que es posible la revacunación siempre que el riesgo de infección continúe. esta vacuna no está comercializada en nuestro país. 76 T.7 Vacuna Frente a la enFermeDaD meninGocócica b) Vacuna antimeningocócica B. el polisacárido capsular del meningococo del serogrupo b es escasamente inmunógeno y semejante a las moléculas de adhesión intercelular de las neuronas del hombre. esta característica le hace poco favorable para la inmunización por la posibilidad de tolerancia o autoinmunidad. actualmente se plantean diferentes líneas de investigación, como la modificación por conjugación del polisacárido capsular mediante conjugación o las vacunas basadas en proteínas principales de la membrana externa (omp) de la pared celular. Hasta el momento, dos vacunas han sido ensayadas. una vacuna bivalente basada en las proteína de la membrana externa de la cepa b:4:p1.15, junto con el polisacárido capsular del serogrupo c. Ha sido probada con cierta eficacia en adultos y adolescentes pero la eficacia y la inmunogenicidad es baja en menores de 4 años. la vacuna del national institute of public Health de oslo contiene un complejo de proteína de membrana externa (clases 1, 3 y 5) y lipopolisacáridos del serogrupo b. también se trabaja en la línea de vacunas basadas en proteínas fijadoras de hierro o con vacuna con lipooligosacáridos derivados de los lipopolisacáridos sin embargo, el estudio bioinformática del genoma de la neisseria meningitidis ofrece en el futuro un perspectiva prometedora en la buscada de nuevos antígenos susceptibles de ser usados paras la inmunización. Vacuna aún no disponible en la mayoría de los países, incluida españa. c) Vacuna antimeningocócica C. esta vacuna es muy eficaz para prevenir la meningitis por meningococo c pero la duración de la inmunidad es corta (3 años), una dosis de recuerdo no induce efecto booster y su eficacia está muy reducida en niños menores de 18 meses. la eficacia varía en función de la edad al comportarse el polisacárido capsular c como antígeno timo independiente. en adultos y niños mayores de 5 años la eficacia de esta vacuna ese del 85%; en niños menores de 5 años del 70%; en niños entre 2 y 3 años del 55% y niños menores de 2 años no es eficaz. asimismo la duración del efecto protector decrece con la edad: la proporción de niños con niveles protectores al año de haber sido vacunados es bajo. la respuesta de los anticuerpos tras la vacunación no genera memoria inmunológica por lo que una dosis de refuerzo no puede diferenciarse de una primovacunación. la vacunación no afecta al estado de portador y por tanto no interrumpe la cadena de transmisión por lo que no afecta a las recomendaciones de quimioprofilaxis. actualmente no se emplea ya que ha sido sustituida por la vacuna conjugada antimeningocócica c. d) Vacuna conjugada antimeningocócica C. esta vacuna se ha elaborado conjugando neisseria meningitidis serogrupo c a una proteína transportadora no tóxica del toxoide diftérico (crm197), pasando de esta manera a ser un antígeno timo dependiente capaz de inducir memoria inmunológica especialmente en niños menores de 18 meses superando así el principal problema de la vacuna polisacárida. tras diferentes ensayos clínicos realizados en el reino unido y haberse comercializado en ese país en el año 1999 ha sido en el año 2001 cuando se ha introducido en el calendario vacunal español. cada dosis de vacuna contiene oligosacárido o polisacárido de la cápsula de neisseria meningitidis (10 μg) unido covalentemente entre 10-25 μg de una proteína transportadora de Corynebacterium diphtheriae (crm197). e) Vacuna polisacarídica A + C (Véase tabla 17). es una vacuna bivalente, inactivada y polisacárida. actualmente tiene una serie de inconvenientes al ser timo independiente (poco inmunógenas en niños pequeños, no genera memoria inmunológica y produce protección de corta duración). por este motivo nunca han sido introducidas como vacunas sistemáticas en los calendarios vacunales. 77 Guía De Vacunas en la oFicina De Farmacia consta de 50 μg de cada uno de los polisacáridos capsulares purificados de neisseria meningitidis de los serogrupos a y c. Conjugada C Polisacárida A+C Inmunogénica en niños < 18 meses Existencia de memoria inmunológica (linfocitos T con memoria). Existencia de efecto “booster” ante nuevas exposiciones al Ag. Elevados niveles de AB (anticuerpos bactericidas) y AT (anticuerpos totales). No inmunogénica en niños < 18 meses. Ausencia de memoria inmunológica (linfocitos T con memoria). Ausencia de efecto “booster” ante nuevas exposiciones al Ag. Mediocre formación de anticuerpos IgG. Tabla 17. Características diferenciales de las vacunas antimeningocócicas. 7.6.2. Indicaciones, pautas y vías de administración a) Vacuna conjugada antimeningocócica c. actualmente se encuentra incluida en el calendario vacunal para la vacunación sistemática infantil de niños entre 2 meses y 18 meses. igualmente se indica en los grupos de riesgo en los que sea preferible una respuesta timo dependiente, aunque debe valorarse completar otros serogrupos con vacunas polisacáridas: • Vacunación en caso de epidemia y a contactos de casos debidos a meningococo serogrupo c. • pacientes con déficit de properdina y fracciones terminales del complemento (c5-c9). • asplenia anatómica y/o funcional. • enfermedad de Hodgkin y otras neoplasias hematológicas. • inmunodeficiencias primarias de tipo humoral o combinadas. Posología Dosis de recuerdo Niños de 2-12 meses 2 dosis administradas en intervalo de al menos dos meses Se administrará una tercera dosis en el 2º año de vida entre los 12 y los 18 meses. Niños mayores de 12 meses y adultos Dosis única No se ha establecido la necesidad. Tabla 18. Posología de las vacunas conjugadas polisacarídicas C. la vacuna se administrará por vía intramuscular, y nunca por vía intravenosa, subcutánea o intradérmica. b) Vacuna polisacárida a + c. en gran medida, ha sido desplazada por la vacuna conjugada frente al meningococo c en lo que se refiere a la respuesta frente al polisacárido c. sin embargo, sigue indicada en niños mayores de 18 meses de edad y adultos. con el polisacárido a puede obtenerse una respuesta inmune de corta duración a partir de los tres meses de edad. está indicada en: • contactos íntimos de un caso de enfermedad por serogrupo a y también por serogrupo c, pero teniendo en cuenta que en menores de 4 años no siempre alcanza niveles protectores. 78 T.7 Vacuna Frente a la enFermeDaD meninGocócica • en caso de epidemia por alguno de los serogrupos contenidos en la vacuna. para niños mayores de 24 meses y adultos de grupos de riesgo y viajes a zonas especialmente endémicas se prefiere la vacuna tetravalente a+c+Y+W135, vacuna solo disponible en nuestro país a través de medicamentos extranjeros. • inmunodeprimidos de elevado riesgo como enfermedad de Hodgkin, asplenia funcional o anatómica, neoplasias hematológicas, déficit de complemento (c5-c9), etc. • personal de laboratorio que manipule meningococo en condiciones de aerosol. • Viajeros y/o residentes en países o áreas con enfermedad epidémica o hiperendémica reconocida. se incluye en este apartado todos los países del “cinturón africano” como son benin, camerún, chad, costa de marfil, este de etiopía, Gambia, Guinea, Kenia, liberia, mali, níger, nigeria, república centroafricana, el sur de senegal, sierra leona (en su parte norte), sudan, togo, uganda. también burundi, tanzania y Zambia. se administrará una única dosis por vía subcutánea profunda. 7.6.3. Contraindicaciones y precauciones sus contraindicaciones son las generales para todas las vacunas: enfermedad febril aguda, anafilaxia, reacción grave a una dosis previa de vacuna. en pacientes inmunodeprimidos la respuesta puede ser menor aunque no está contraindicada la vacuna. la vacuna a + c no está contraindicada en embarazadas pudiendo usarse cuando el riesgo de infección es alto. en 1974 durante un brote epidémico en brasil se vacunó a mujeres embarazadas, no encontrándose efectos adversos y obteniéndose niveles adecuados de anticuerpos en la sangre materna y del cordón umbilical. la inmunización posterior de los niños no fue afectada por la vacunación de las madres. la vacuna tampoco está contraindicada durante el periodo de lactancia. la vacuna conjugada c no está recomendada en embarazadas a no ser que exista riesgo, evaluándose en este caso la relación riesgo-beneficio. se puede administrar de forma simultánea con otras vacunas, siempre que se apliquen en diferentes lugares anatómicos y con diferentes agujas. 7.6.4. Reacciones adversas las vacunas antimeningocócicas son seguras y bien toleradas. las reacciones adversas que se han descrito son reacciones locales leves y transitorias como dolor, eritema e induración a las 24-48 horas de la administración en el 2,5% de los casos. en relación a las reacciones sistémicas éstas son moderadas, como escalofríos e irritabilidad produciéndose en el 10-30% de los vacunados, con aparición de fiebre sólo en el 1-2%. es excepcional la aparición de reacciones anafilácticas. 7.6.5. Vacunas antimeningocócicas comercializadas todas deben conservarse en frigorífico a una temperatura entre +2ºc y +8ºc, evitando la congelación. 79 Guía De Vacunas en la oFicina De Farmacia Vacunas antimeningocócicas oligosacarídicas solas Código nacional 659966.2 Nombre Meningitec Descripción 1 jeringa precargada 0,5 ml con aguja 892125.6 1 vial monodosis 0,5 ml 602687.8 10 jeringas precargadas 0,5 ml con aguja (EC) 623553.9 10 viales monodosis 0,5 ml (EC) 650785.8 Menjugate Vial liofilizado + jeringa disolvente 0,5 ml Composición Oligosacárido de Neisseria meningitidis serogrupo C, cepa C11, conjugado con proteína CRM197 de Corynebacterium diphtheriae, adsorbido en fosfato de aluminio. Oligosacárido de Neisseria meningitidis serogrupo C, cepa C11, conjugado con proteína CRM197 de Corynebacterium diphtheriae, adsorbido en hidróxido de aluminio. Vacunas antimeningocócicas polisacarídicas solas Código nacional 933788.9 Nombre Neisvac C 632141.6 Descripción 1 jeringa precargada 0,5 ml 10 jeringas precargadas 0,5 ml (EC) Composición Polisacárido de Neisseria meningitidis serogrupo C, conjugado con toxoide tetánico y adsorbido en hidróxido de aluminio hidratado. Vacunas antimeningocócicas polisacarídicas combinadas (A+C) Código nacional 674416.1 Nombre Mencevax AC Descripción 1 vial liofilizado + ampolla disolvente 0,5 ml Composición Polisacárido purificado de Neisseria meningitidis serogrupos A y C Tabla 19. Vacunas antimeningocócicas comercializadas en España. 80 GUÍA DE VACUNAS EN LA OFICINA DE FARMACIA TEMA 8 Vacuna frente a la hepatitis B Guía De Vacunas en la oFicina De Farmacia la hepatitis b (Hb) continúa siendo un grave problema de salud pública en todo el mundo ya que su coste económico y social es muy importante por lo que son necesarias diferentes estrategias para su prevención y control. entre éstas, destaca la inmunización activa en el conjunto de la población. según datos de la organización mundial de la salud (oms), más de mil millones de personas están infectadas en el mundo. De ellas, más del 40% de las personas infectadas que alcanzan la edad adulta mueren a consecuencia de la enfermedad. la mayoría de las infecciones agudas se resuelven, pero un porcentaje importante se cronifican, con mayor porcentaje en los niños. este motivo explica la existencia de más de 300 millones de portadores crónicos en el mundo, que constituyen la principal fuente de diseminación. este gran grupo de portadores crónicos supone un importante problema socio-sanitario añadido por las numerosas y graves secuelas que padecen (p.e.: cirrosis y carcinoma hepatocelular). 8.1. Características del agente etiológico el virus de la hepatitis b (VHb), fue el primer virus hepático descubierto. en 1963 blumberg investiga el polimorfismo de las proteínas del suero de enfermos y descubre el entonces denominado antígeno australia, siendo en 1967 cuando descubre finalmente el VHb. en 1970, Dane lo visualiza en el microscopio electrónico. el VHb pertenece a la familia Hepadnaviridae. tiene forma esférica y un diámetro aproximado de 42 ηm. consta de una cubierta externa de glicoproteínas y una nucleocápside icosaédrica proteica. su material genético está constituido por una doble cadena de aDn de diferente longitud. la cubierta está formada por una glicoproteína mayoritaria llamada gp27 o proteína s, que contiene el determinante antigénico agHbs, y otras dos glicoproteínas más grandes gp36 (proteína m) y gp42 (proteína l) que poseen la secuencia del agHbs más otros fragmentos de distinto tamaño. la nucleocápside está integrada por 180 unidades proteicas idénticas, llamadas p22 o proteína del core (agHbc), que envuelven al aDn genómico y a la transcriptasa viral. la célula infectada produce además envueltas virales vacías en forma de agregados en gran cantidad, así como una proteína no agregada que contiene una secuencia del core (agHbc) y una secuencia aminoterminal adicional (agHbe). la célula diana del VHb es el hepatocito humano, en el que se integra y replica durante la infección. el grado de respuesta inmune, fundamentalmente citotóxica por células t, frente a los antígenos virales expresados por el hepatocito infectado condiciona las manifestaciones clínicas y la evolución de la enfermedad. cuando el virus infecta a las células hepáticas, habitualmente los determinantes antigénicos dan lugar a la aparición sucesiva de anticuerpos específicos (anti-Hbc, anti-Hbe y anti-Hbs). en cambio, la ausencia de respuesta de anticuerpos en la infección VHb junto con niveles elevados de agHbe y aDn viral en suero durante largo tiempo, es el reflejo de fenómenos de inmunotolerancia extrema que se pueden observar en huéspedes inmunológicamente inmaduros o en individuos inmunocomprometidos. 8.2. Cadena epidemiológica de la hepatitis B 8.2.1. Reservorio los seres humanos. los chimpancés presentan susceptibilidad. no se ha identificado ningún reservorio animal en libertad. en ánades, marmotas y otros animales se han detectado hepadnavirus similares, pero no causan infección en humanos. 82 T.8 Vacuna Frente a la Hepatitis b 8.2.2. Mecanismos de transmisión de la hepatitis B la transmisión del VHb se realiza a partir de los enfermos agudos y los portadores crónicos (asintomáticos o con hepatitis crónica). además de en sangre, donde el virus es altamente infectivo, se han hallado virus en otros fluidos y secreciones humanas como saliva, semen, secreciones vaginales, orina, líquido cefalorraquídeo, moco, lágrimas y leche materna. sin embargo, existen dudas de la eficacia de la transmisión por alguno de ellos cuando no están contaminados con sangre. en general, se describen dos patrones principales de transmisión: la vía vertical (transmisión perinatal) y la vía horizontal (transmisión sexual, transmisión parenteral por contacto con sangre o secreciones de enfermos, o por contacto con objetos contaminados). sin embargo, en un 30% de enfermos no es posible identificar ningún mecanismo de transmisión o fuente de contagio. el VHb es detectado por métodos de biología molecular en secreciones como la saliva, el semen o el sangrado de pequeñas heridas de la piel, aunque en una cantidad aproximadamente 100 veces menor que en el suero de los mismos pacientes portadores crónicos de los que proceden las secreciones. en este sentido, existe variabilidad en la cantidad de virus infectante de las secreciones mencionadas, en función del estado serológico (mayor en pacientes agHbe positivos) y el nivel replicación viral. por esta razón, la capacidad de contagio no es homogénea para distintos portadores. la puerta de entrada del virus es discutida. la vía percutánea a través de mordeduras o heridas ha sido sugerida. sin embargo, la cavidad oral, a pesar de ser un ambiente poco propicio para el VHb, es la vía de entrada más defendida, ya que la presencia de pequeñas heridas o ulceraciones facilita la penetración del virus. a) transmisión vertical o perinatal. la transmisión vertical o perinatal se produce desde una mujer embarazada a su hijo. ocurre en gestantes que adquieren la infección aguda durante el embarazo o más frecuentemente en portadoras crónicas del VHb (agHbe y/o agHbs positivas). en ambos casos existe una importante relación entre la transmisión, el estado serológico, y el grado de replicación viral de la madre. la infección intraútero es rara (5-10%) ya que el VHb no es capaz de atravesar la placenta. por tanto, el recién nacido adquiere la infección fundamentalmente a través del canal del parto. la baja frecuencia de transmisión en las infecciones maternas durante el primer y segundo trimestre, que ocurre cuando la madre evoluciona a la cronicidad, junto al hecho de que la infección y los marcadores serológicos en el recién nacido se desarrollen entre el segundo y cuarto mes de vida, confirman este modo de transmisión. se ha encontrado un riesgo de transmisión menor cuando se realiza cesárea. el paso de sangre desde la madre al feto durante el desprendimiento de placenta en el parto y la inoculación e ingestión de secreciones del canal del parto contaminadas con VHb por el recién nacido son los principales mecanismos postulados. en embarazadas portadoras crónicas de VHb la probabilidad de transmisión depende de la positividad del agHbe, de su título, y del nivel de replicación viral. Globalmente las madres agHbe positivas transmiten la infección en un 70-90% (mayor con los títulos de agHbe más altos), en comparación con el 10-20% de las madres agHbs positivas y anti-Hbe positivas. esto es debido a que la positividad del agHbe significa una mayor actividad replicativa del virus y por tanto una mayor cantidad de virus infectante en sangre. en la embarazada con infección aguda por VHb la transmisión aumenta según avanza el embarazo y disminuye si se produce la seroconversión materna anti-Hbe y anti-Hbs. no obstante, durante un primer momento de la seroconversión (con títulos bajos) la transmisión existe debido a que todavía hay aDn viral presente en sangre materna. el 60-70% de los recién nacidos de madres con hepatitis b aguda durante el tercer trimestre desarrollarán la infección. sin embargo esto solo ocurrirá en un 7-25% de los niños cuando la infección materna es durante el primer y segundo trimestre, ya que la mayoría de las madres evolucionan hacia la curación. el recién nacido infectado por el VHb es asintomático al nacer. entre el segundo y el cuarto mes presentará una hepatitis aguda, asintomática en la mayoría de casos, con el perfil serológico habitual de los adultos. un pequeño porcentaje de niños desarrollaran una hepatitis aguda fulminante. sin embargo, el hecho más importante de la hepatitis b en el recién nacido y el lactante es la evolución de un 90% de los casos a portadores crónicos (agHbs positivos), lo que supone aproximadamente un 20% de todos los portadores crónicos en españa. esta mayor tendencia a la cronicidad, si se compara con el 5% que ocurre en el adulto, parece ser debida, entre otros factores, a una inmadurez del sistema inmunológico que conduce a una 83 Guía De Vacunas en la oFicina De Farmacia tolerancia de la infección viral que favorece su cronicidad. por otra parte, el estado serológico materno parece influir en el curso de la infección del recién nacido. los niños nacidos de madres portadoras crónicas agHbs y antiHbe positivas evolucionan frecuentemente como hepatitis agudas sintomáticas mientras que aquellos niños de madres portadoras crónicas agHbe positivas o con infección aguda en el tercer trimestre del embarazo desarrollan una hepatitis crónica asintomática. más aún, se ha visto que la posibilidad de inactividad de la replicación viral en el niño es baja (20%) si la madre es portadora crónica, y alta si la madre cursa con una hepatitis aguda. en españa, la prevalencia de portadoras crónicas agHbs positivas encontrada en diversos estudios es del 1,3-1,6%, con un 6-7% de positividad para el agHbe en portadoras crónicas. en la etnia gitana la prevalencia de embarazadas portadoras crónicas es mucho mayor, con un 8,2-11,8% de agHbs positivo en diferentes estudios. estos datos justifican el cribaje de portadoras en embarazadas, ya que como se verá más adelante, las medidas de profilaxis en el recién nacido pueden evitar la enfermedad y sus secuelas. b) transmisión horizontal. la transmisión horizontal ocurre en el sujeto susceptible que entra en contacto con secreciones y líquidos corporales contaminados (sangre, saliva, lágrimas, semen, etc.) o con utensilios compartidos (útiles de aseo, de cocina, etc.) contaminados con estas secreciones procedentes de sujetos infectados. Desde el punto de vista epidemiológico, es la principal vía de transmisión en los países de baja endemicidad de europa, afectando a adultos jóvenes, adolescentes y grupos de riesgo, y adquiriendo en españa una importancia creciente. los mecanismos de transmisión horizontal son diversos y difíciles de estudiar. la transmisión sexual es una de las principales vías de diseminación de la enfermedad en la edad adulta-joven y en la adolescencia, con una mayor contagio en grupos de promiscuidad sexual u homosexuales, grupo este último en el que se detectan tasas más altas de seroprevalencia (agHbs 2,5-9%, anti-Hbs 46-86% en adultos) que en la población general. como ya se ha comentado previamente, en la pubertad y adolescencia se observa un aumento significativo en las tasas de seroprevalencia en nuestro país, implicándose la transmisión horizontal fundamentalmente por transmisión sexual. el contagio intrafamiliar ha sido objeto de análisis de numerosos estudios. se ha encontrado una mayor prevalencia de marcadores de Hb en familiares convivientes con uno o más portadores crónicos de Hb que en la población general. sin embargo, en la enfermedad aguda la transmisión intrafamiliar es muy baja y fundamentalmente limitada a la pareja sexual. este hecho puede deberse a que la transmisión horizontal intrafamiliar es menos eficiente y requiere una mayor exposición que en las relaciones sexuales. la relación de parentesco de mayor riesgo es la de madre-hijo, aunque en los estudios de corte transversal es difícil distinguir el papel de la transmisión vertical de la horizontal. un mayor contacto diario entre madre e hijo favorecería la segunda. también se ha relacionado el hacinamiento con una mayor contagiosidad intrafamiliar. en cambio, no se encuentran claras diferencias respecto a actitudes higiénicas en la familia, probablemente debido a la dificultad de su estudio y diferenciación. De la anterior, y del hecho de que la mayoría de las infecciones por VHb son asintomáticas, se desprende la necesidad de cribaje de hepatitis b entre los familiares de portadores crónicos conocidos, para aplicar medidas preventivas como la vacunación. en el colegio, la transmisión del VHb a partir de niños portadores crónicos en el mismo aula es baja, siendo mayor en guarderías e internados por el mayor tiempo de convivencia de los niños. los discapacitados psíquicos en instituciones cerradas son un grupo de elevado riesgo de transmisión del VHb encontrándose tasas entre el 5,8 y el 23% de prevalencia de agHbs. los principales factores implicados en esta alta prevalencia en discapacitados psíquicos son los déficits inmunológicos que presentan algunos de ellos (síndrome de Down), la mayor exposición relacionada con sus características de comportamiento y el ingreso en instituciones cerradas. la transmisión al recién nacido a través de la lactancia materna ha sido un tema muy discutido en los últimos años. a pesar de que es posible detectar VHb en la leche materna, no se ha podido demostrar que la supresión de la lactancia materna disminuya la incidencia de la enfermedad postnatal, razón por la cual actualmente no se contraindica. otros mecanismos de transmisión son infrecuentes en la edad infantil. la vía parenteral por inoculación directa de sangre o hemoderivados en las hepatitis postransfusionales, los pacientes adolescentes adictos 84 T.8 Vacuna Frente a la Hepatitis b a drogas parenterales, o los pinchazos accidentales infantiles con jeringuillas contaminadas son poco frecuentes pero en ocasiones se presentan en niños y adolescencia. 8.3. Manifestaciones clínicas de la hepatitis B la infección por el VHb cursa con diferentes formas bien caracterizadas clínica y serológicamente. un gran porcentaje de casos (75-90%), especialmente en la infancia, son formas asintomáticas u oligoasintomáticas que pasan inadvertidas siendo a veces diagnosticadas por análisis bioquímicos y serológicos, hecho este que dificulta el diagnostico y favorece la diseminación del virus en la comunidad. en el resto de los pacientes (20-25%), tras un periodo de incubación de 3 meses (30-180 días), la infección se manifiesta como una hepatitis ictérica o colestásica aguda caracterizada en una primera fase preictérica por la presencia de aDn viral en sangre, agHbs y agHbe en la serología. 8.4. Epidemiología de la hepatitis B la distribución del VHb es universal, pero no homogénea. por ello, se distinguen tres áreas geográficas mundiales, las cuales no sólo se diferencian por la prevalencia existente en cada una de ellas, sino también por el mecanismo principal de transmisión y por la edad a la que incide la máxima frecuencia de infección. a) Áreas de baja prevalencia (0,2-0,5 % de portadores crónicos). la infección ocurre fundamentalmente en la edad adulta en los denominados grupos de riesgo y la transmisión sexual tiene una marcada importancia. b) Áreas de prevalencia media (2-7% de portadores crónicos). la infección ocurre preferentemente en niños y lactantes mediante un mecanismo de transmisión horizontal precoz (niño-niño), y en menor cuantía a través de la transmisión vertical (madre-hijo). c) Áreas de elevada prevalencia (8-20% de portadores crónicos). la infección incide sobre todo en lactantes y niños por transmisión vertical en el momento del nacimiento y poco tiempo después por transmisión horizontal precoz. por otro lado, en europa se distinguen 3 zonas de distinta prevalencia y transmisión: a) endemicidad elevada: europa central y europa del este, con una incidencia comunicada de infección aguda de VHb entre 27-400 por 100.000 habitantes. el porcentaje de portadores de agHbs en esta zona es superior al 4%. b) endemicidad moderada o intermedia: sur de europa. la incidencia comunicada de infección aguda de VHb en esta zona es de 6 casos por 100.000 habitantes y el porcentaje de portadores de agHbs varía entre el 1 y el 4%. c) endemicidad baja: Dividida a su vez en dos áreas: • europa occidental, con un porcentaje de portadores de agHbs entre 0,2-1% y con una incidencia comunicada de infección aguda de VHb de 4 casos por 100.000 habitantes. • irlanda, Gran bretaña y escandinavia, con una incidencia comunicada de infección aguda de VHb de 1 caso por 100.000 habitantes y con un porcentaje de portadores de agHbs menor del 0,2%. en españa, la prevalencia se estima a partir de grupos específicos de población en distintas comunidades autónomas (donantes voluntarios de sangre, escolares, sanitarios, etc.), encontrándose una tasa de portadores 85 Guía De Vacunas en la oFicina De Farmacia crónicos (agHbs +) entre el 0,6-1,3% (1,5-2% de nuevos donantes en andalucía), mientras que son anti-Hbs entre el 15,5-17% de la población. esto sitúa a españa en el grupo de países europeos de endemicidad intermedia (entre baja y media). por otra parte, existen diferencias importantes regionales, étnicas y sociales dentro de españa siendo más frecuente en áreas urbanas que en áreas rurales, y en algunas etnias y grupos marginales de población. la infección por VHb en españa y por lo tanto el máximo riesgo de transmisión, incide preferentemente en la edad adolescente y en el adulto joven, donde la transmisión sexual es probablemente la de mayor importancia. en la imagen 3 se muestra el porcentaje de positivos a marcadores de infección de hepatitis b (anti-Hbc) por grupos de edad en población española de 1996. estudios de seroprevalencia realizados en las comunidades de madrid, cataluña y Valencia en población infantil encuentran tasas bajas de anti-Hbs (1,5-1,7% y de agHbs (0,20,8%) en comparación con el aumento que se observa en los adolescentes y adultos jóvenes (9,3-16,7% antiHbs y 1,2-2,4% agHbs), que prácticamente alcanza la prevalencia de anti-Hbs de adultos y ancianos (19,9% y 23,2% respectivamente) según los datos de la encuesta de cataluña. coincidiendo con estos datos, durante 1990 el 60% de las declaraciones de hepatitis b correspondían al grupo de edad de 15-34 años y solo el 9% eran menores de 15 años. la incidencia declarada de hepatitis b (eDo) durante el año 2002 se muestra en la tabla 20. 12% 10% 8% 6% 4% 2% 0% 6-9 años 10-14 años 15-19 años 20-24 años 25-29 años 30-39 años Imagen 3. Población con marcadores de infección de hepatitis B (anti-HBc) por grupos de edad. Población española 1996. Fuente: Encuesta de Seroprevalencia Española, 1996. aunque la transmisión perinatal en españa es poco frecuente, representa entre un tercio y un quinto de los portadores crónicos, lo cual tiene un papel importante en la difusión de la enfermedad en la población general. en cambio la transmisión horizontal en la edad infantil es menos frecuente, está producida por contagio intrafamiliar o niño-niño y tiene menor importancia epidemiológica. 8.5. Métodos de control de la hepatitis B su objetivo es evitar la diseminación del VHb mediante su aislamiento y destrucción. esto puede conseguirse en el ámbito familiar y en el sanitario con actuaciones como: a) manejar con máxima precaución sangre u otras secreciones corporales como si estuvieran contaminadas. b) utilizar métodos de barrera que impidan el contacto del material o secreciones contaminadas con la piel y mucosas (uso de guantes, preservativos, etc.). 86 T.8 Vacuna Frente a la Hepatitis b c) evitar compartir objetos de uso personal (maquinillas de afeitar, cepillos de dientes, peines, toallas, etc.). d) emplear material sanitario desechable, así como proceder a una correcta esterilización del instrumental médico. en cuanto a la hepatitis postransfusional, se ha reducido mucho su incidencia gracias al cribaje de donantes de sangre excluyendo a los positivos para agHbs y/o anti-Hbc, así como a la disminución del número de transfusiones al ajustar sus indicaciones en los pacientes que pudieran necesitarlas. por último, se debe realizar estudio serológico de todos los miembros de la familia ante la presencia de un caso de hepatitis, sea ésta aguda o crónica, y aplicar medidas de protección a las personas susceptibles. el beneficio de estas medidas ha quedado claramente reconocido y por ello han de tenerse muy en cuenta a pesar de disponer de otras medidas de prevención más eficientes. por eso, para que este tipo de medidas sean ejercitadas es muy importante una adecuada educación sanitaria de la población. Comunidad Autónoma Número de casos Tasa por 100.000 habitantes Andalucía 163 2,23 Aragón 46 3,95 Asturias 20 1,93 Baleares 24 3,19 Canarias 50 3,04 Cantabria 12 2,28 Castilla-La Mancha 44 2,54 Castilla-León 48 1,95 Cataluña 58 0,96 1 1,34 Comunidad Valenciana 70 1,76 Extremadura 29 2,66 Galicia 62 2,30 La Rioja 5 1,94 Madrid 111 2,20 Melilla 18 26,80 Murcia 14 1,25 Navarra 12 2,25 País Vasco 31 1,53 818 2,07 Ceuta Total Estatal Tabla 20. Número de casos de incidencia declarada (EDO) de hepatitis B por Comunidades y Ciudades Autónomas en 2002. Fuente: Instituto de Salud Carlos III. Centro Nacional de Epidemiología. Declaración EDO. 87 Guía De Vacunas en la oFicina De Farmacia 8.5.1. Inmunoprofilaxis pasiva se realiza mediante el empleo de gammaglobulina específica (Véase tabla 21) inmediatamente tras la exposición a materiales o secreciones contaminadas con VHb. la gammaglobulina específica es elaborada a partir de donantes con título elevado de anti-Hbs. existe una gammaglobulina estándar que contiene anticuerpos contra el agHbs con títulos de al menos 1:1000. sin embargo, la gammaglobulina inmune preparada con plasma preseleccionado contiene un alto título de anti-Hbs mayor de 1:100.000, por lo que se convierte en el preparado de elección. la dificultad de su obtención encarece el producto, motivo por el que su utilización queda limitada a la profilaxis postexposición incluyendo a sujetos susceptibles con exposición accidental y recién nacidos de mujeres portadoras crónicas. se administra de forma intramuscular y la dosis recomendada es 0,2 ml/kg de peso (40 ui/ml) en recién nacidos y de 0,06 a 0,1 ml/kg (12-20 ui/kg) en adultos. es capaz de prevenir hasta un 75% de las infecciones postexposición siendo más eficaz si se administra dentro de las primeras 12 horas después del contacto en el caso de los recién nacidos y dentro de las 24 horas postexposición en el caso de los adultos. cuando se asocia a la vacuna su eficacia asciende al 92-100% según diferentes estudios. por esta razón y por el corto periodo de duración de su efecto protector, es necesaria la administración adicional de la vacuna, que se inyectará vía intramuscular y con distinta jeringuilla simultáneamente en un lugar diferente del organismo. en una cohorte de hijos de madre portadoras tratadas con inmunoglobulina anti-Hb (iGHb) y vacunación seguidos hasta los 8 años se observó que los fracasos de protección (5,1% de infecciones por VHb) se debían principalmente a infecciones prenatales, al retraso del inicio de la vacunación y a la falta de respuesta inicial a la vacuna, más que a una caída de la inmunidad. Código nacional 738088.7 Nombre Gamma Anti-hepatitis B Grifols Descripción 100 UI 1 ampolla 0,5 ml 709238.4 600 UI 1 ampolla 3 ml 708958.2 1000 UI 1 ampolla 5 ml 663567.4 Gammaglobulina Antihepatitis-B P Behring 663534.6 200 UI 1 jeringa precargada 1ml 1000 UI 1 jeringa precargada 5 ml Tabla 21. Inmunoglobulinas específicas contra hepatitis B comercializadas en España. 8.5.2. Inmunoprofilaxis activa Dada la dificultad en el aislamiento del VHb en cultivos celulares, las primeras vacunas contra la hepatitis b, denominadas vacunas plasmáticas, se consiguieron mediante la inactivación del VHb obtenido a partir del plasma de portadores del agHbs. Varios factores como el miedo a la transmisión de virus desconocidos con las vacunas plasmáticas y su coste elevado, llevó a la investigación y desarrollo de nuevas vacunas mediante técnicas de recombinación genética, denominadas vacunas recombinantes genéticas. 8.6. Vacunas frente a la hepatitis B las vacunas disponibles en españa son engerix b®, Hbvaxpro® y Fendrix®. existen diferentes presentaciones ya que la dosis a administrar varía en función del grupo vacunado. están elaboradas por recombinación genética, producidas en células de levaduras saccharomyces cerevisae a las que se inserta el gen responsable de la síntesis del agHbs. 88 T.8 Vacuna Frente a la Hepatitis b 8.6.1. Eficacia vacunal la eficacia vacunal ha sido demostrada en varios estudios constatando la ausencia de enfermedad en los vacunados que seroconvirtieron, no habiéndose detectado casos en cohortes previamente vacunadas. la inmunogenicidad de las vacunas recombinantes genéticas y las derivadas de plasma puede considerarse similar. mediante tres dosis de vacuna se induce una respuesta protectora de anticuerpos en el 95-98% de los individuos vacunados. los títulos protectores (iguales o mayores de 10 mui/ml de anti-Hbs) se consiguen a las dos semanas de la segunda dosis. la respuesta es mayor en niños y adolescentes que en adultos mayores de 40 años. además, en los niños se ha visto un efecto dosis dependiente en la respuesta inmune desarrollada. 8.6.2. Indicaciones, pautas y vías de administración la vacuna de hepatitis b puede aplicarse en el calendario vacunal infantil a todos los niños mediante la aplicación de 3 dosis antes de cumplir los 15-18 meses de edad. la primera dosis puede aplicarse al nacimiento y antes de abandonar el hospital. en los recién nacidos con peso >2000 gr. de madre seronegativa se aplicará la segunda dosis a los 1 ó 2 meses de edad y la tercera dosis a los 6 ó 7 meses (esquemas: 0-2-6 ; 0-1-6; 0-17), pudiéndose administrar a la vez que el resto de vacunas del calendario (Dtp, polio oral o intramuscular, Haemophilus influenzae tipo b, triple vírica, etc.). en los niños prematuros se iniciara la vacunación cuando alcancen 2000 gramos, con el mismo esquema descrito. no se precisa serología postvacunal. para los recién nacidos de madre agHbs (+), cualquiera que sea su peso, la primera dosis de vacuna se aplica antes del segundo día de vida, debiendo además administrarse igHb antes de las primeras 12 horas según ficha técnica; la segunda dosis será al mes y la tercera a los seis meses (0, 1, 6). en estos casos sí debe realizarse un estudio serológico postvacunación, confirmando la seroconversión con anti-Hbs y la negativización del agHbs. en adolescentes no vacunados previamente, según la recomendación dictada por el consejo interterritorial del ministerio de sanidad se debe administrar la vacuna entre los 10-13 años, con tres dosis (esquema 0, 1, 6) sin tener que realizar marcadores serológicos pre ni postvacunales. no hay criterios fijos respecto a la necesidad o no de dosis de recuerdo. se estima que el 95% de los vacunados a pesar de descender el título de anti-Hbs con el tiempo tendrían clones de linfocitos b capaces de desencadenar una respuesta inmune secundaria ante el VHb. sólo en personas con un alto riesgo de exposición se recomiendan dosis adicionales de recuerdo a los 7-10 años de la primovacunación. otras indicaciones de vacunación son también los siguientes casos especiales: a) niños y adolescentes no vacunados antes, cualquiera que sea su edad si: • son atendidos en centros de atención a discapacitados psíquicos. • se encuentran en programas de transplante, hemodiálisis, o atención por hemofilia o diabetes juvenil. • son viajeros a países endémicos y la estancia se estima mayor de 6 meses. • son contactos familiares convivientes con portadores crónicos de agHbs o con enfermos agudos por VHb. • son pertenecientes a ciertos grupos étnicos o emigrantes procedentes de países de elevada endemicidad. b) niños inmunocomprometidos: se recomienda aplicar doble dosis de antígeno, en función de la edad. c) en accidentes. como inoculación percutánea con agujas con contenido hemático de fuente positiva o desconocida respecto al agHbs. en caso de fuente conocida positiva se administrará además, en un punto de inyección distinto a la vacuna, inmunoglobulina anti-Hb. el esquema de vacunación será 0, 1, 2 meses y por ser una pauta rápida requiere una dosis de recuerdo a los 12 meses. 89 Guía De Vacunas en la oFicina De Farmacia la vacuna se administra por vía intramuscular (la administración intradérmica es ineficaz) en la región anterolateral del muslo en niños recién nacidos y lactantes. en niños mayores y adolescentes se inyecta en deltoides, y no en la región glútea ya que se ha observado menor respuesta en las personas vacunadas en esa zona. la dosis y pautas de vacunación varían según la edad y el tipo comercial de vacuna. la hepatitis b es un problema importante de salud pública que genera una gran morbi-mortalidad y un considerable gasto social y sanitario a la sociedad. la disponibilidad actual de una vacuna con una alta efectividad y seguridad, y la implementación de programas de control y prevención, hacen que en un futuro no muy lejano pueda erradicarse la enfermedad producida por el VHb. 8.6.3. Reacciones adversas las reacciones locales son de escasa duración, generalmente como dolor, eritema e induración. afectan a un 25% de los vacunados. con una incidencia muy baja se presentan reacciones de tipo general como cansancio tipo gripal, fiebre, náuseas, vómitos, mialgias, artralgias, vómito, dolor abdominal, remitiendo en la gran mayoría de los casos espontáneamente. 8.6.4. Vacunas frente a hepatitis B comercializadas Vacunas VHB solas Código nacional 997569.2 Nombre Engerix B Descripción 10 μg 1 vial 0,5 ml 877514.9 10 μg 1 jeringa precargada 0,5 ml 686709.9 20 μg 1 jeringa precargada 1 ml 650862.6 Fendrix 650863.3 904813.6 20 μg 1 jeringa precargada 0,5 ml 20 μg 10 jeringas precargadas 0,5 ml HBvaxpro 5 μg 1 vial 0,5 ml 652093.2 5 μg 1 jeringa precargada 0,5 ml 652094.9 10 μg 1 jeringa precargada 1 ml 906826.4 40 μg 1 vial 1 ml Composición Antígeno de superficie (AgHBs) del virus de la hepatitis B, producido por células recombinantes de Saccharomyces cerevisae, adsorbido en hidróxido de aluminio. Antígeno de superficie (AgHBs) del virus de la hepatitis B, producido por células recombinantes de Saccharomyces cerevisae, coadyuvado por 3-O-desacil4’-monofosforil lípido A, adsorbido en fosfato de aluminio. Antígeno de superficie (AgHBs) del virus de la hepatitis B, producido por células recombinantes de Saccharomyces cerevisae, adsorbido en sulfato hidroxifosfato de aluminio amorfo. Vacunas VHB + VHA Código nacional 857946.4 803767.4 90 Nombre Twinrix Descripción “Adultos” 1 jeringa precargada 1 ml “Pediátrica” 1 jeringa precargada 0,5 ml Composición Antígeno de superficie (AgHBs) del virus de la hepatitis B, producido por células recombinantes de Saccharomyces cerevisae, adsorbido en fosfato de aluminio. Acompañado de virus de hepatitis A inactivados producidos por células diploides humanas (MRC-5) adsorbidos en hidróxido de aluminio hidratado. T.8 Vacuna Frente a la Hepatitis b Vacunas VHB + DTPe Código nacional 676122.9 Nombre Tritanrix HepB Descripción 1 vial 0,5 ml Composición Antígeno de superficie (AgHBs) del virus de la hepatitis B, producido por células recombinantes de Saccharomyces cerevisae, adsorbido en fosfato de aluminio. Acompañado de toxoide diftérico, toxoide tetánico y Bordetella pertussis inactivada. Puede contener trazas de tiomersal. Vacunas VHB + DTPa + VPI + Hib Código nacional 820068.9 Nombre Infanrix Hexa 657445.4 Descripción 1 jeringa precargada 0,5 ml 1 jeringa precargada 0,5 ml con aguja Composición Antígeno de superficie (AgHBs) del virus de la hepatitis B, producido por células recombinantes de Saccharomyces cerevisae, adsorbido en fosfato de aluminio. Acompañado de toxoide diftérico, toxoide tetánico y fracción antigénica de Bordetella pertussis (toxoide pertussis, hemaglutinina filamentosa y pertactina), virus de la poliomielitis inactivados (cepas tipo 1, 2 y 3) y polisacárido capsular PRP de Haemophilus influenzae B. El liofilizado contiene lactosa. Tabla 22. Vacunas anti-hepatitis B comercializadas en España. 8.7. Estrategias de control el objetivo ideal de un programa de control de la hepatitis b debe ser conseguir inmunidad universal en toda la población. basándonos en los análisis de coste-beneficio publicados, no hay dudas sobre la conveniencia de los programas encaminados a la vacunación universal. en general, cualquier estrategia de vacunación tiene una mejor relación coste-beneficio que no hacer nada, considerando la gran morbi-mortalidad y el coste socioeconómico que produce la hepatitis b. sin embargo existen discrepancias en definir cuál es la mejor forma de implementar un programa de vacunación. en los países con alta e intermedia endemia de Hb, la vacunación universal de todos los recién nacidos es probablemente la mejor de las alternativas teóricas, ya que la alta prevalencia de hepatitis condiciona tasas elevadas de transmisión vertical y horizontal precoz en la infancia. el bajo presupuesto de sanidad de la mayoría de estos países es el principal obstáculo a la ejecución de estos programas. en cambio, en los países más desarrollados, con baja endemicidad, se pueden considerar estrategias más complejas para mejorar la eficiencia, al identificar y vacunar principalmente a los individuos y grupos de mayor riesgo (adolescentes y recién nacidos de madres portadoras crónicas). no obstante, el grado de eficiencia de los distintos programas y estrategias están influenciados por varios aspectos todavía no claramente definidos como la duración de la protección de la vacuna, el grado de cumplimiento de los distintos programas, el coste de las vacunas, el coste de los nuevos tratamientos, etc. por ejemplo, si se demostrara la duración indefinida de la protección de la vacuna (pauta de 3 dosis) como apunta algún trabajo de seguimiento de recién nacidos vacunados, la estrategia de vacunación universal en recién nacido sería la más adecuada. mientras tanto, considerando que la inmunidad puede caer entre los 7-10 años de la vacunación, la estrategia con mejor 91 Guía De Vacunas en la oFicina De Farmacia relación coste-beneficio en diversos estudios, es combinar la vacunación en pre-adolescentes hacia los 10 años de edad y la inmunización de recién nacidos de madres portadoras crónicas de Hb identificados mediante cribaje con serologías prenatales en todas las embarazadas. la adecuación y simplificación de los calendarios vacunales y la obligatoriedad de aportar la cartilla de vacunación al comenzar la enseñanza secundaria pueden ser medidas útiles para mejorar el cumplimiento y la cobertura de las campañas de vacunación. el control de la hepatitis b en las embarazadas y la detección de portadoras crónicas en el último trimestre de gestación es un punto de especial importancia a tener en cuenta en los programas de prevención de la transmisión perinatal del VHb, ya que el tratamiento inmediato del recién nacido de madre agHbs positivo con gammaglobulina y vacunación puede abortar la infección. aunque lo ideal es la investigación sistemática en todas las embarazadas, no siempre puede llevarse a cabo por limitaciones de presupuesto. 92 GUÍA DE VACUNAS EN LA OFICINA DE FARMACIA TEMA 9 Vacuna frente al virus de la varicela zóster GUÍA DE VACUNAS EN LA OFICINA DE FARMACIA Durante mucho tiempo se creyó que la varicela y el herpes zóster eran enfermedades independientes. Steiner, en 1875, demostró que la varicela estaba causada por un agente infeccioso transmitiendo la enfermedad a niños por inoculación de muestras de fluido de vesículas procedentes de pacientes con varicela. En 1888 el médico vienés Janos von Bókay fue el primero en sugerir la relación entre varicela y herpes zóster, al observar que la exposición doméstica o familiar a casos de herpes zóster aumentaba la frecuencia de casos de varicela en niños susceptibles. Kundratitz en 1925, estudiando la transmisibilidad de la varicela como agente infeccioso, observó que el fluido de la vesícula de un niño con varicela, aplicado mediante escarificación en la piel de otro niño sin historia previa de varicela podía producirle un rash de varicela, bien de manera local o generalizada. De igual manera, demostró que el fluido de vesícula de pacientes con zóster producía varicela cuando se inoculaba a niños susceptibles. Concluyó que las dos enfermedades tenían una etiología común. En 1948 se comprobó que las partículas virales de varicela y zóster eran idénticas en forma y apariencia por microscopía electrónica. Imagen 4. Micrografía electrónica del virus de la varicela zóster. 9.1. Características del agente etiológico El virus de la varicela zóster (VVZ) es un virus DNA bicatenario. Pertenece a la subfamilia Alphaherpesvirinae, género Varicellovirus, de la familia Herpesviridae. Como todos los virus herpes, son virus de tamaño grande (150-200 ηm de diámetro). El genoma, en doble hélice, contiene unos 125.000 pares de bases, que codifican aproximadamente 75 proteínas. Está envuelto por una cápsula icosaédrica de 162 capsómeros y una cubierta lipídica externa con espículas glicoproteicas a través de las cuales el virus se “fija” a las células diana. Se han codificado cinco familias de glicoproteínas (Gp I, Gp II, Gp III, Gp IV y Gp V). Puede neutralizarse la infectividad del virus con anticuerpos monoclonales a Gp I, Gp II y Gp III. Es un virus muy lábil, con una capacidad mínima de supervivencia en condiciones ambientales adversas lo que limita su infectividad. Se inactiva a temperaturas superiores a 60 ºC y no tolera bien pH fuera del rango de 6,27,8. Sin embargo, en condiciones ambientales adecuadas es extremadamente infeccioso. 94 T.9 Vacuna frente al Virus de la Varicela zóster Espigas de glucoproteínas Cubierta lipídica Genoma DNA de doble filamento Nucleocápside Tegumento Imagen 5. Estructura del virus de la varicela zóster. 9.2. Cadena epidemiológica de la varicela zóster 9.2.1. Reservorio el único reservorio del VVz es el hombre. en él, puede quedar latente, acantonado en los ganglios dorsales de las raíces posteriores medulares durante muchos años, reactivándose en respuesta a determinadas situaciones, como inmunosupresión, tratamientos con quimioterápicos, antitumorales, etc. 9.2.2. Mecanismos de transmisión debido a las características del VVz tan sensible a circunstancias ambientales hostiles, los mecanismos de transmisión se limitan prácticamente al contacto estrecho persona-persona y a la transmisión vertical madre-hijo. a) Contacto persona-persona. un paciente infectado es contagioso durante un periodo de 1-4 días antes de la aparición del exantema, hasta aproximadamente una semana después de la aparición de las primeras lesiones. el virus VVz puede infectar a un individuo susceptible en un contacto próximo mediante dos mecanismos; por inhalación de secreciones respiratorias de un paciente contagioso a través de gotitas respiratorias o aerosoles, o bien por contacto directo con el líquido de las vesículas cutáneas características de la varicela. Por ello, un paciente infectado por el VVz no deja de ser contagioso hasta que todas las lesiones cutáneas que presenta están en fase de costra, aproximadamente 6 días después de la aparición del exantema. también se ha descrito que los pacientes con herpes zóster pueden transmitir el virus a pacientes potencialmente susceptibles por contacto directo con las lesiones aunque durante un periodo más corto. b) Transmisión vertical madre-hijo. la varicela congénita y la varicela neonatal son las dos formas clínicas resultantes de la transmisión vertical del VVz de madre a hijo. aproximadamente, entre el 1-2 % de los hijos cuyas madres hayan padecido varicela en el primer o segundo trimestre, desarrollarán el síndrome de varicela congénita, resultado de la transmisión transplacentaria del VVz de la madre al feto. 95 GuÍa de Vacunas en la Oficina de farMacia la transmisión vertical no necesariamente se da por vía transplacentaria. la varicela neonatal es la infección por el VVz del neonato cuya madre ha desarrollado varicela cinco días antes o dos días después del parto. durante este periodo no existe el tiempo suficiente para que los anticuerpos protectores de la madre pasen al niño, por lo que la infección que va a desarrollarse en el lactante puede ser extremadamente grave. la mortalidad en estos casos puede llegar hasta el 31% como resultado de una varicela diseminada. 9.3. Signos y síntomas de la infección por VVZ la varicela es una enfermedad exantemática macular, papulosa y vesicular muy pruriginosa resultado de la infección primaria por el VVz. suele acompañarse, sobre todo en fase inicial, de síntomas generales como fiebre, cefalea, malestar y anorexia. el VVz accede al interior del organismo a través de las conjuntivas y las mucosas de las vías respiratorias superiores, provocando una infección local en los ganglios linfáticos regionales. Posteriormente pasa al hígado y al bazo, donde se replica de forma activa hasta que es liberado en grandes cantidades al torrente circulatorio (viremia secundaria). todo este proceso suele durar en torno a unos catorce o quince días en el sujeto inmunocompetente, pero puede ser menor en los pacientes inmunocomprometidos. la fase prodrómica, caracterizada por fiebre y síntomas inespecíficos, coincide con la viremia secundaria. suele durar unos tres días y finaliza con la aparición del exantema característico de la varicela. estas lesiones exantemáticas progresan en oleadas, apareciendo inicialmente en el cuero cabelludo y distribuyéndose por el tronco y extremidades. la media es de unas doscientas a trescientas lesiones, con un aspecto inicial de mácula, muy pruriginosa, que evoluciona a pápula, vesícula y costra. en la mayoría de los casos la infección suele remitir sin complicaciones. sin embargo, en determinados grupos como pacientes inmunodeprimidos, neonatos, adolescentes o adultos, la incidencia de complicaciones es mayor, constituyendo un grupo de riesgo de interés en salud pública. el herpes zóster es la manifestación clínica de la reactivación del VVz latente en los ganglios de la raíz dorsal de la médula espinal. Ocurre entre el 10-20% de sujetos infectados por VVz y en edades adultas de la vida, generalmente por encima de los cincuenta años. esta infección se caracteriza por la aparición de un exantema similar al de la varicela pero localizado en una región dermatomérica, es decir, en una región inervada por un nervio, habitualmente intercostal, aunque también puede afectar a otros nervios como el facial o el oftálmico, sobre todo en personas mayores. el síntoma clínico más característico de esta infección es el dolor, la neuralgia post-herpética, que puede llegar a hacerse intenso, incluso durante años. 96 T.9 Vacuna frente al Virus de la Varicela zóster Ganglio de la raíz dorsal Tracto dorsal VVZ latente Piel Infección primaria (varicela) Nervio sensorial Médula espinal Reactivación (herpes zoster) Vesícula Imagen 6. Infección por virus de la varicela zóster. la neuralgia postherpética es una complicación común (10-18%) del zóster, que cronifica en muchos casos y que consiste en un dolor limitante que se prolonga durante meses o años. Otra complicación común son los problemas oftalmológicos (10-25%). un 3% de los pacientes con zóster son hospitalizados, la mayoría de ellos padecen alguna inmunodeficiencia concomitante. el tratamiento precoz con aciclovir, valaciclovir y famciclovir reduce la gravedad y duración del episodio de zóster y sus complicaciones. 9.4. Epidemiología de la varicela zóster el VVz es extremadamente contagioso. aproximadamente el 90% de las personas vulnerables que se exponen a su contagio van a desarrollar la infección. la distribución de la infección es mundial, afectando por igual a ambos sexos. la epidemiología de la infección varía en función de sus dos formas clínicas: la varicela o el herpes zóster. la varicela es una infección fundamentalmente pediátrica que suele manifestarse en brotes epidémicos estacionales, fundamentalmente al final del invierno y al inicio de la primavera. se estima que más del 90% de los casos ocurren en personas menores de quince años; el 90% de los adultos son inmunes al VVz. según datos publicados, en españa se declararon 193.867 casos en 1998 lo que corresponde a una tasa de infección de 5,85/1000 habitantes. en ocasiones, pueden darse complicaciones que requieran hospitalización, de las cuales, las infecciones cutáneas y de partes blandas son las más frecuentes, seguidas de la neumonía y la deshidratación. anualmente, la varicela o las complicaciones que de ella se derivan son responsables en españa de 1.000 hospitalizaciones anuales y en torno a 5 ó 6 muertes al año. la frecuencia y la gravedad de las complicaciones dependen en gran medida del sujeto infectado, siendo más altas en niños menores de un año, adultos y pacientes inmunocomprometidos. 97 GuÍa de Vacunas en la Oficina de farMacia en países de clima tropical los porcentajes de seroprevalencia por infección por VVz en la población adulta son significativamente menores, por causas todavía inciertas, lo que lleva a aumentar el porcentaje de sujetos con potenciales complicaciones ante una eventual infección. aproximadamente un 10-15 % de la población seroprevalente al VVz va a desarrollar herpes zóster. el herpes zóster es una manifestación clínica eminentemente geriátrica. el 45% de los casos diagnosticados se da en personas con edades superiores a los 64 años, en los que se producen un mayor número de complicaciones y mayor mortalidad (15%) que en la infección por varicela en población pediátrica. 9.5. Prevención de la varicela las estrategias eficaces para el control de la infección por VVz tienen como objetivo proteger a los grupos de riesgo, en los que se ha descrito una mayor incidencia de enfermedad severa o complicaciones, y reducir la carga social y económica que de la enfermedad se derivan, limitando la extensión de la enfermedad y el desarrollo de herpes zóster. se han demostrado eficaces, tanto medidas de profilaxis de exposición como inmunoprofilaxis pasiva e inmunoprofilaxis activa. 9.5.1. Profilaxis de exposición todo paciente con manifestaciones clínicas de infección por VVz debe ser aislado mientras persista la erupción vesicular, al menos hasta los seis días después del inicio del exantema. los pacientes inmunodeprimidos deben ser aislados por más tiempo, recordando que un paciente sigue siendo contagioso hasta que todas sus lesiones hayan evolucionado a costras. 9.5.2. Inmunoprofilaxis pasiva actualmente no se recomienda quimioprofilaxis. se dispone de una inmunoglobulina anti-varicela zóster (no comercializada en españa) indicada dentro de los cuatro días siguientes a la exposición, en determinados pacientes en los que existe una situación de riesgo que les confiera especial susceptibilidad. en españa se restringe a sujetos inmunodeprimidos, niños mayores de 15 años, adultos y embarazadas si existe seronegatividad para VVz, pero hay que adquirirla mediante el procedimiento de medicamentos extranjeros. también se indica en neonato cuya madre padeció varicela 5 días antes del parto o 2 días después, prematuros hospitalizados de más de 28 semanas de gestación con madre sin antecedentes previos de varicela, o bien de menos de 28 semanas de gestación o menos de 1.000 g de peso independientemente de los antecedentes de la madre. en todos los casos se precisa una exposición suficiente, bien un contacto familiar continuo, un contacto con un compañero de juegos más de una hora en interiores, un contacto hospitalario con caso índice cara a cara, en cama adyacente, o en habitación de 2-4 camas, ser hijo de madre que padeció varicela 5 días antes del parto o 2 días después, haber estado en contacto con estos neonatos o haber existido un caso de varicela en la unidad neonatal. está indicada para su administración por vía intramuscular a dosis de 125 ui/kg de peso en pacientes con peso menor de 50 kg, y 625 ui en pacientes con más de 50 kg. los efectos adversos son escasos. el más frecuente ha sido la aparición de molestias locales en el lugar de la inyección. aproximadamente en el 1% de los casos puede objetivarse dolor, enrojecimiento e induración. síntomas generales como malestar, dolor de cabeza, rash o síntomas respiratorios sólo ocurren aproximadamente en el 0,2%. la administración de inmunoglobulina anti VVz también está indicada en aquellos pacientes que presenten como contraindicación relativa la trombocitopenia o algunas alteraciones de la coagulación. en estos pacientes los beneficios esperados de la administración son superiores al riesgo que conlleva la administración de la inmunoglobulina. 98 T.9 Vacuna frente al Virus de la Varicela zóster 9.5.3. Inmunoprofilaxis activa desde 1974 se dispone de una vacuna de virus vivos atenuados desarrollada por takahashi. el virus se tomó de las vesículas de un típico caso de varicela que padecía un niño japonés de tres años llamado Oka y que dio nombre a la cepa atenuada. actualmente es la única cepa recomendada para uso clínico y vacunación por la Organización Mundial de la salud. todas las vacunas se derivan de ella y las diferentes preparaciones varían en cuanto al número de pases virales en células diploides humanas, en sustancias estabilizantes en la vacuna o unidades formadoras de placas en el producto final. 9.6. Vacunas anti-varicela en españa se dispone de dos vacunas de virus vivos atenuados comercializadas frente a varicela: Varilrix® y Varivax®. 9.6.1. Eficacia vacunal la eficacia de Varilrix® frente a cualquier forma de varicela fue del 88% a los 29 meses, y del 77% a los cuatro años de seguimiento. en otro ensayo clínico, realizado con adultos, la eficacia de la vacunación con dos dosis frente a cualquier forma de varicela en adultos se estimó en un 76% tras un periodo de seguimiento de 22 meses. el porcentaje de vacunados que desarrollará herpes zóster en el futuro debido a la reactivación de la cepa Oka es actualmente desconocido. sin embargo, en la actualidad se sabe que el riesgo de zóster después de la vacunación es muy inferior al que pudiera esperarse tras la infección por el virus salvaje, debido a la atenuación de la cepa vacunal. no hay datos suficientes para valorar el nivel de protección frente a complicaciones de la varicela como encefalitis, hepatitis o neumonía Por su parte, después de 2 dosis de vacuna Varivax® la tasa de seroconversión varió del 97 al 100% y la proporción de sujetos con títulos de anticuerpos > 5 unidades gpelisa varió del 76 al 98%. la eficacia protectora de la vacuna antivaricela de virus vivos (cepa Oka/Merck) 42 días después de la vacunación fue del 95 al 100%, con una reducción relativa del 95% en el porcentaje de casos graves observados en los vacunados que adquirieron la infección tras la vacunación. la eficacia protectora en la exposición familiar durante un periodo de 6 a 7 años tras la administración de 2 dosis con un intervalo de 4 a 8 semanas en individuos de edad igual o superior a 13 años osciló desde el 80 al 100%. 9.6.2. Indicaciones, pautas y vías de administración la vacuna Varilrix® está indicada en las siguientes situaciones: a) inmunización activa frente a la varicela en adultos y adolescentes sanos a partir de los 13 años, seronegativos para el virus de la varicela-zóster. b) inmunización activa frente a la varicela de pacientes susceptibles de riesgo y sus contactos próximos sanos. recomendado especialmente en: • Pacientes con leucemia aguda. debe interrumpirse la quimioterapia de mantenimiento una semana antes y una semana después de la vacunación. los pacientes sometidos a radioterapia no deberían vacunarse durante la fase de tratamiento. 99 GuÍa de Vacunas en la Oficina de farMacia • Pacientes en tratamiento inmunosupresor, con recuentos linfocitarios superiores a 1200/mm3. • trasplante de órganos programados. la vacuna debe administrarse algunas semanas antes de la instauración del tratamiento inmunosupresor. • Pacientes con enfermedades crónicas (ePOc, enfermedades cardiovasculares, enfermedad cutánea diseminada). aunque no está indicada en niños, se puede emplear niños sanos seronegativos de 1-12 años de edad que sean contactos próximos de pacientes con riesgo elevado de varicela grave. Por su parte, Varivax® está indicada en: a) inmunización activa para la prevención primaria de la varicela en individuos de edad igual o superior a 12 meses. b) individuos susceptibles que han estado expuestos a varicela. los adolescentes mayores de 12 años y los adultos deberán recibir dos dosis en un intervalo de aproximadamente ocho semanas, aunque podría reducirse a 6 semanas. en niños de 1-12 años se administrará una dosis, salvo en niños con infección asintomática por ViH, en los que se administrarán dos dosis. la administración será subcutánea. no se dispone de datos de inmunogenicidad cuando se emplean diferentes preparados comerciales de vacuna de varicela en la primera y segunda dosis. Por lo tanto, se recomienda emplear el mismo preparado comercial para ambas dosis. 9.6.3. Contraindicaciones y precauciones a) Pacientes alérgicos a la vacuna contra la varicela, a la neomicina o a cualquier otro componente del medicamento. b) embarazadas. debe recomendarse a las mujeres que eviten un embarazo en el periodo entre la primera y la segunda dosis de vacuna y en los tres meses siguientes a la administración de la segunda dosis. c) lactancia. debido al riesgo teórico de transmisión de la cepa vacunal de madre a hijo, las mujeres no deben vacunarse durante la lactancia. d) enfermedad febril aguda y grave. e) inmunodeficiencia grave adquirida, como en pacientes con leucemia, linfoma, discrasia sanguínea, en tratamiento con inmunosupresor o con evidencia clínica de infección por ViH. f) Personas de elevado riesgo. si en un sujeto vacunado aparece exantema cutáneo que se cree relacionado con la vacunación dentro de las cuatro o seis semanas tras la administración de la primera o segunda dosis, se debe evitar el contacto con mujeres embarazadas o pacientes con inmunodeficiencia. g) administración con otras vacunas. se recomienda distanciar al menos las vacunas vivas y la de varicela un mes, y si se tienen que administrar el mismo día, se hará en jeringas separadas y en diferentes regiones del cuerpo. h) administración de salicilatos. evitar el uso de salicilatos durante las 6 semanas posteriores a la vacunación. 100 T.9 Vacuna frente al Virus de la Varicela zóster 9.6.4. Reacciones adversas es muy frecuente (>10%) la aparición de reacciones adversas generales, como enrojecimiento, dolor o inflamación en la zona de administración. también es común (1-10%) la fiebre, astenia, cefalea o la aparición de exantema papulovesicular. es raro (0,1-1,0%) que aparezcan otras reacciones adversas como tumefacción, induración, dolor torácico, malestar, mareo, migraña, náuseas y vómitos, diarrea, artralgia, dolor de espalda, mialgia, somnolencia, llanto, tos, faringitis, rinitis, prurito o linfadenopatía 9.6.5. Vacunas anti-varicela comercializadas en España Código nacional Nombre Descripción Composición 668822.9 Varilrix 103,3 UFP 1 vial liofilizado + jeringa precargada disolvente 0,5 ml Virus de la varicela atenuados, cepa Oka, obtenidos de células diploides humanas MRC5. Puede contener trazas de sulfato de neomicina y sorbitol. 651402.3 Varivax 1350 UFP 1 vial liofilizado + jeringa precargada disolvente 0,5 ml Virus de la varicela atenuados, cepa Oka/Merck, obtenidos de células diploides humanas MRC5. Puede contener trazas de neomicina. Tabla 23. Vacunas anti-varicela comercializadas en España. la vacuna debe ser empleada inmediatamente después de su reconstitución. debe conservarse en nevera +2 y +8 ºc. no se debe congelar la vacuna una vez reconstituida. la vacuna liofilizada no se afecta por la congelación. 9.7. Estrategias de vacunación se plantean dos estrategias de vacunación frente a varicela: a) Vacunación universal en la infancia. consistiría en la incorporación de la vacuna de varicela en el programa de inmunización infantil, de forma rutinaria y con carácter universal, a todos los niños a partir de los 12 meses de edad (en general 12-18 meses). el objetivo de esta vacunación sería disminuir o incluso interrumpir la circulación del virus en la población, disminuyendo por tanto la morbilidad y mortalidad por varicela. de tal manera, en estados unidos se realiza desde 1995 vacunación infantil y de preadolescentes susceptibles, habiendo disminuido la incidencia hasta un 90% y la mortalidad registrada un 66%, especialmente en niños de 1 a 4 años de edad. sin embargo, no se ha registrado descenso en personas mayores de 50 años. tampoco se conoce hasta el momento ningún efecto sobre su incidencia en el herpes zóster. inconvenientes: • necesidad de alcanzar altas coberturas de vacunación para generar una inmunidad de grupo que logre romper la transmisión del virus. 101 GuÍa de Vacunas en la Oficina de farMacia • coberturas inferiores producirían un desplazamiento a edades más avanzadas, con riesgo de mayor número de complicaciones graves y riesgo para mujeres embarazadas y sus hijos. Por tanto, se debería evaluar la necesidad de estrategias complementarias de vacunación para aumentar la efectividad de esta estrategia y minimizar el número de casos de varicela a corto plazo, tales como programa de barrido entre los 1-12 años, vacunación de susceptibles entre los 10-14 años hasta que los niños vacunados en la infancia alcancen esta edad y necesidad de una segunda dosis de refuerzo evaluando el efecto de la vacunación sobre el herpes zóster. b) Vacunación de adolescentes susceptibles. el objetivo sería disminuir la incidencia de la enfermedad en edades en que las complicaciones son más graves y hay más mortalidad, aunque tiente poco impacto en la incidencia global de la enfermedad. disminuye el riesgo de efectos adversos sobre la epidemiología de la enfermedad, pero no reduce la circulación del virus en la población, no aumenta la edad de la infección ni varía la epidemiología del herpes zóster. sin embargo, es la estrategia más coste-efectiva, porque antes de los 13 años sólo se precisa una dosis de vacuna. esta vacunación se ha seguido en suiza, vacunando a población entre 11 y 15 años sin antecedentes de haber padecido varicela y a sujetos seronegativos con riesgo elevado de complicaciones. en españa el consejo interterritorial del sistema nacional de salud celebrado el 2 de marzo de 2005 decidió recomendar la vacunación de varicela en una cohorte elegida por cada comunidad autónoma entre las edades de 10 y 14 años (ambas inclusive), en aquellas personas que refieran no haber pasado la enfermedad ni haber sido vacunadas con anterioridad, manteniendo las recomendaciones de vacunación a personas susceptibles con un alto riesgo de padecer la enfermedad, tanto en niños como en adultos, y a sus contactos más próximos. se recomienda fortalecer el sistema de vigilancia de varicela e implantar un sistema de vigilancia de herpes zóster. se realizará un análisis continuado del impacto que las diferentes estrategias de vacunación de varicela en los distintos países. algunas comunidades autónomas como Madrid han decidido incluir la vacuna de varicela en calendario vacunal a los 15 meses de edad. 9.8. Vacunas contra el herpes zóster altas coberturas de vacunación de varicela producen una gran reducción de la circulación del virus, evitando la reinfección natural en adultos. Para mantener el estado de latencia del virus se considera necesario el refuerzo inmunitario que se alcanza con su circulación. Modelos matemáticos predicen un aumento significativo del herpes zóster en un periodo entre 30-50 años. Por esta causa, se ha recomendado recientemente la inclusión de una segunda dosis de vacuna. Varios laboratorios farmacéuticos están investigando vacunas frente al herpes zóster, pero todavía no hay ninguna autorizada en nuestro país. el advisory committee on immunization Practices (aciP) de estados unidos publicó las recomendaciones de uso de la vacuna de herpes zóster (zostavaxtM, vacuna de virus vivos atenuados cepa Oka/Merck), autorizada por la fda de eeuu en Mayo de 2006 indicada para la prevención de herpes zóster en personas inmunocompetentes mayores de 60 años. 102 T.9 Vacuna frente al Virus de la Varicela zóster la vacuna de herpes zóster autorizada por la fda es un preparado liofilizado de la misma cepa de virus vivo atenuado VVz utilizada en la vacuna de varicela, pero con una potencia al menos 14 veces superior que la vacuna de varicela. la vacuna de zóster se recomienda a todas las personas mayores de 60 años que no tengan contraindicaciones descritas, incluyendo aquellos pacientes que ya han padecido un episodio de zóster o que refieren tener patología crónica asociada. se administra una única dosis subcutánea en la región deltoidea. distintos estudios epidemiológicos han concluido que zostavaxtM induce un incremento significativo de la respuesta celular y humoral en sujetos mayores de 60 años y que proporciona a los médicos una herramienta segura, bien tolerada y eficaz para reducir el riesgo de desarrollar herpes zóster y sus complicaciones en los pacientes. 9.9. Tratamiento de la varicela zóster el tratamiento de la infección es sintomático. Antipiréticos (no aspirina). Higiene sencilla: • Una a dos duchas frías/día. • Mantener cortas las uñas de las manos. Antihistamínicos sistémicos para combatir el picor. Jabón líquido antiséptico o antibióticos sistémicos para las sobreinfecciones bacterianas. Terapia antiviral (Aciclovir, famciclovir, valaciclovir, foscarnet). Tabla 24. Tratamiento de la infección por virus varicela zóster 103 GUÍA DE VACUNAS EN LA OFICINA DE FARMACIA TEMA 10 Vacuna frente al neumococo GuÍa de Vacunas en la Oficina de farMacia el neumococo fue identificado por Pasteur en 1881. Posteriormente, el descubrimiento de la tinción de Gram en 1884 permitió confirmar la asociación clínica entre la neumonía y el Streptococcus pneumoniae diferenciándolo del resto de las neumonías. desde entonces, el neumococo sigue siendo un microorganismo que despierta gran interés en la comunidad científica por su trascendencia clínica. la historia de la vacunación frente al neumococo comenzó también precozmente, a principios del siglo XX. sin embargo, el auge de la era antibiótica en 1940 relegaron los intentos de desarrollar una vacuna eficaz a un segundo plano. Pese a más de 100 años de historia, el neumococo continúa siendo un microorganismo agresivo y ha sido capaz de desarrollar mecanismos de resistencia eficaces y defenderse de las agresiones que le supone el tratamiento antibiótico. las tasas de resistencia a antibióticos considerados habitualmente como tradicionales en el tratamiento de las infecciones neumocócicas, al igual que la severidad y prevalencia de la enfermedad invasiva en determinados grupos de riesgo han impulsado de nuevo los intentos de control mediante estrategias de inmunoprofilaxis. 10.1. Características del agente etiológico el Streptococcus pneumoniae es un microorganismo encapsulado, Gram positivo, oval, lanceolado en sus extremos, que crece en medio líquido, agrupándose en cadenas cortas o parejas (diplococo). es aerobio o anaerobio facultativo, inmóvil. no forma esporas. es catalasa y oxidasa negativo. los principales determinantes de antigenicidad del neumococo son la pared celular y la cápsula. unidas a la pared celular se encuentran la sustancia c (relacionada con la respuesta inflamatoria), la proteína M y la proteína a (relacionada con la virulencia). la cápsula está formada por polisacáridos responsables de las diferencias antigénicas que clasifican a los neumococos en 90 serotipos. estos polisacáridos capsulares inducen respuesta inmune mediada por células B, sólo desarrollada completamente en los sistemas inmunocompetentes y maduros (por encima de los 2 años de edad). la fagocitosis facilitada por opsonización necesita de la presencia de anticuerpos específicos de serotipo y la activación del complemento. la clasificación de serotipo más aceptada es la danesa, con números y letras, que agrupa serotipos con similares características antigénicas en el mismo número. los serotipos más frecuentemente aislados en medio hospitalario en nuestro país son 19, 6, 3, 23, 14 y 9, por orden de frecuencia. la distribución de los serotipos no es homogénea ni en el conjunto de la población ni es el tipo de enfermedad, mostrando diferencias según los grupos de edad o según haya sido aislado en sangre y líquido cefalorraquídeo (enfermedad invasiva) o exudados óticos (enfermedad no invasiva). de hecho, por encima de los 5 años se amplía hasta 16 el número de serotipos que producen el 80% de las infecciones neumocócicas 10.2. Cadena epidemiológica del neumococo el neumococo es un colonizador habitual de la nasofaringe y rinofaringe de las personas sanas. la tasa de portador es especialmente alta en niños (30-60%), más que en jóvenes (10-25%) y adultos (6%). el índice de colonización aumenta significativamente en los meses de invierno y en comunidades cerradas, lo que puede elevar la tasa de colonización de adultos sanos en convivencia estrecha con niños hasta un 29%. la transmisión del neumococo de una persona colonizada o infectada a un huésped susceptible se realiza por vía aérea, a través de secreciones respiratorias, mediante contacto estrecho (1-2 metros) y prolongado. las guarderías 106 T.10 Vacuna frente al neuMOcOcO o escuelas infantiles constituyen el ambiente ideal para el contagio de niños pequeños. los ambientes de estrecha convivencia o la cohabitación en espacios pequeños, como campamentos o prisiones, lo son para adultos. 10.3. Signos y síntomas de la infección neumocócica desde el punto de vista de la vacunación frente al neumococo interesa la clasificación de la enfermedad neumocócica en invasiva y no invasiva. tras la colonización de la nasofaringe, el neumococo puede provocar una infección local en las zonas naturales de proximidad por fracaso o incompetencia del sistema inmune. es el caso del oído medio (otitis media) a través de las trompas de eustaquio, senos paranasales (sinusitis) y vías respiratorias bajas y parénquima pulmonar (neumonía). en ocasiones el neumococo es capaz de atravesar la barrera mucosa y provocar una diseminación bacteriémica que puede tener graves consecuencias, como la neumonía bacteriémica, bacteriemia sin foco, meningitis, endocarditis, osteomielitis o shock séptico (enfermedad invasiva) (Véase imagen 7). la bacteriemia sin foco causal claro constituye la forma clínica más frecuente de enfermedad invasiva por neumococo en niños menores de 2 años. 10.4. Epidemiología de la infección neumocócica el Streptococcus pneumoniae es una de las principales causas de morbilidad y de mortalidad en todo el mundo. en estados unidos se estima que es directamente responsable de un total de 7.000.000 de otitis media anuales, 500.000 casos de neumonía, 50.000 casos de bacteriemia y 3.000 casos de meningitis. Meningitis 5% Otros 5% Bacteriemia sin foco 30 % Neumonía 60% Imagen 7. Clínica de la enfermedad invasiva por neumococo. 107 GuÍa de Vacunas en la Oficina de farMacia en españa, las formas clínicas más prevalentes son la neumonía, la otitis media aguda y la meningitis. la incidencia de enfermedad neumocócica global es de 59,9-166 casos/100.000 habitantes, mientras que, por ejemplo, la enfermedad neumocócica invasiva oscila en menores de dos años entre 174/100.000 habitantes (Gijón), 93 (País Vasco) o 79 (sabadell). no todos los grupos de edades tienen el mismo riesgo frente a las diferentes manifestaciones de la enfermedad. los mayores índices de enfermedad invasiva se dan en niños menores de 2 años. la meningitis neumocócica en menores de 2 años alcanza tasas en españa de 13,13 casos/100.000 habitantes. la tasa de incidencia de enfermedad invasiva por neumococo en la población general fue de aproximadamente 22 casos/100.00 habitantes en estados unidos en el año 2000. sin embargo, en el grupo de edad menos de 5 años la tasa de enfermedad invasiva se puede elevar hasta 75 casos/100.000 habitantes (Véase imagen 8). Otros grupos de riesgo importante son los adultos mayores de 65 años con tasas enfermedad invasiva de hasta 58 casos/100.000 habitantes, además de los sujetos con enfermedades crónicas y los pacientes inmunodeprimidos en los cuales la incidencia de enfermedad invasiva puede ser hasta 100 veces mayor que en la población general. la letalidad de la enfermedad neumocócica invasiva es alta en las poblaciones de riesgo, especialmente en ancianos con enfermedades crónicas previas. en estados unidos, 40.000 personas mueren anualmente como consecuencia de la infección por neumococo. la mortalidad global de la enfermedad neumocócica invasiva es de 2,4/100.000 habitantes pero en población geriátrica alcanzan cifras de hasta 10/100.000. en población anciana, los índices de mortalidad secundaria a bacteriemia por neumococo se sitúan entre el 3040%. en la población infantil, la mortalidad se centra fundamentalmente en los niños que padecen meningitis neumocócica, inmunodeprimidos o niños esplenectomizados. Tasas por 100.000 hab. (casos) Tasas por 100.000 hab. (muertes) 180 12 160 10 140 120 8 100 6 80 60 4 40 2 20 0 0 < 1 mes 1 mes-1 año Casos 1-2 años 2-17 años 18-34 años 35-49 años 50-64 años Muertes Imagen 8. Enfermedad invasiva por Streptococcus pneumoniae por grupos de edad. 108 > 65 años T.10 Vacuna frente al neuMOcOcO españa presenta además uno de los mayores índices de resistencia del Streptococcus pneumoniae a los antibióticos. la tasa de resistencia en población pediátrica a la penicilina es del 61% y se ha objetivado una tasa cada vez mayor de resistencia a la eritromicina con cifras que se sitúan actualmente en el 49,3%. 10.5. Métodos de control de la infección neumocócica 10.5.1. Quimiprofilaxis la quimioprofilaxis frente a organismos encapsulados ha estado clásicamente indicada en pacientes con esplenectomía anatómica o funcional (anemia de células falciformes) con el fin de evitar la enfermedad invasiva por estos microorganismos. sin embargo, la creciente resistencia del Streptococcus pneumoniae a los antibióticos utilizados ha limitado la efectividad de esta medida, desplazando los mecanismos de control hacia medidas de inmunoprofilaxis. 10.5.2. Inmunoprofilaxis la estrategia actual eficaz para el control de la enfermedad neumocócica incluye fundamentalmente medidas de inmunoprofilaxis activa. la identificación de los serotipos más prevalentes han permitido diseñar vacunas antineumocócicas polisacarídicas cada vez más eficaces. el objetivo de estas vacunas es el de generar una respuesta inmune específica mediada por anticuerpos contra los serotipos incluidos en la vacuna que permitan la opsonización y la subsiguiente fagocitosis del neumococo por los leucocitos polimorfonucleares y macrófagos. sin embargo, la inmadurez del sistema inmunitario en los niños menores de 2 años hace ineficaces determinadas vacunas como las vacunas polisacarídicas en este grupo de población. Por otro lado, la respuesta inmunológica conseguida, aunque específica, no genera memoria inmunológica. esto ha impulsado el desarrollo de las nuevas vacunas conjugadas en los que los antígenos polisacarídicos capsulares se unen mediante enlaces covalentes a una proteína conjugada transportadora. con ello se consigue convertir antígenos t independientes en antígenos t dependientes, involucrando en la respuesta a los linfocitos t cd4 colaboradores y consiguiendo una respuesta específica frente a los serotipos incluidos, generadora de memoria inmunológica, que se ha demostrado eficaz en los primeros meses de vida. 10.6. Vacunas frente al neumococo 10.6.1. Tipos de vacunas antineumocócicas a) Vacuna antineumocócica polisacarídica polivalente. disponemos de dos vacunas polisacarídicas (Pneumo 23® y Pneumovax 23®). los serotipos incluidos en estas vacunas son: 1, 2, 3, 4, 5, 6B, 7f, 8, 9n, 9V, 10a, 11a, 12f, 14, 15B, 17f, 18c, 19a, 19f, 20, 22f, 23f, 33f. estos serotipos incluyen la mayoría de los asociados con enfermedad invasiva neumocócica en el mundo. de las infecciones neumocócicas identificadas microbiológicamente en francia, el 85% de los serotipos estaban incluidos en la vacuna, así como el 88% de los casos de enfermedad neumocócica bacteriémica en estados unidos, y al menos el 95% de los aislamientos de cultivos de sangre, esputo o lcr en reino unido. b) Vacuna antineumocócica conjugada. la necesidad de cubrir las deficiencias de las vacunas polisacarídicas ha impulsado el desarrollo de nuevas vacunas conjugadas. la ventaja principal de esta vacuna es la de 109 GuÍa de Vacunas en la Oficina de farMacia ser inmunogénica durante los primeros meses de vida y la de conseguir una respuesta inmunológica con memoria específica que se traduce en una inmunidad más eficaz y duradera. actualmente disponemos de una vacuna conjugada frente a 7 serotipos del neumococo (Prevenar®). estos serotipos son: 4, 6B, 9V, 14, 18c, 19f, 23f. estos 7 serotipos son los responsables de aproximadamente el 86% de las bacteriemias por neumococo, 83% de las meningitis neumocócicas y el 65% de las otitis media en niños menores de 6 años en los estados unidos, aunque sólo constituyen el 50% de los aislados en personas mayores de 6 años. en españa, la cobertura se encuentra entre el 71-86% de la enfermedad neumocócica invasiva en niños menores de 2 años y el 85,4% de los serotipos responsables de otitis media aguda. la vacuna conjugada emplea como proteína transportadora 20 microgramos de la denominada crM197, mutante atóxica de la toxina diftérica y 0,125 mg de aluminio. 10.6.2. Inmunogenicidad, eficacia y efectividad a) Vacuna polisacarídica polivalente. los estudios de inmunogenicidad demuestran que tras la administración de una dosis de vacuna polisacarídica 23-valente se obtiene, en 2 ó 3 semanas, una respuesta específica de serotipo en más del 80% de los adultos sanos vacunados. las personas mayores de 65 años, y aquellas con patología crónica como enfermedades pulmonares obstructivas, cirrosis hepática, diabetes mellitus tipo ii presentan también seroconversión, pero lo hacen en menor medida que los adultos sanos. a menudo, la respuesta inmunológica en pacientes inmucomprometidos está muy disminuida especialmente en los pacientes con leucemia, linfoma, mieloma múltiple. también se ha objetivado una disminución en las tasas de inmunogenicidad en aquellos pacientes sometidos a diálisis por insuficiencia renal terminal, al igual que los pacientes con síndrome nefrótico o transplante renal. la respuesta en los pacientes con sida puede corresponderse con el nivel inmunodepresión; con cd4 por encima de 500/mm3 presentan una respuesta comparable a la de los adultos sanos; sin embargo, esta respuesta disminuye significativamente cuando la población celular cae por debajo de esta cifra. en pacientes esplenectomizados anatómica o funcionalmente, los niveles de respuesta pueden equiparse a los de la población sana de su mismo grupo de edad. en los adultos sanos los niveles de anticuerpos persisten durante al menos 5 años. sin embargo, los pacientes esplenectomizados, inmunodeprimidos, enfermos con síndrome nefrótico, dializados y en general, en aquellos en los que la respuesta inmunogénica es menor, duran menos tiempo, con un intervalo que oscila entre los 3 y 5 años. b) Vacuna conjugada. en estudios realizados en niños sanos, los 7 serotipos incluidos en la vacuna fueron inmunogénicos. tras tres dosis de vacunación se observó una elevación significativa en los títulos específicos por serotipo, con una rápida respuesta amnésica específica tras una dosis de refuerzo. igualmente se ha confirmado que se dispone de una vacuna eficaz en niños menores de 2 años contra la enfermedad invasiva neumocócica y contra la otitis media aguda. en un ensayo clínico, prospectivo, aleatorio, doble ciego, en el que se randomizaron 37.830 niños sanos para recibir la vacuna antineumocócica conjugada o una vacuna control, se observó que tras 3 dosis de vacunación, una dosis de refuerzo y un periodo de seguimiento de 36 meses, la eficacia de la vacuna fue del 97% frente a la enfermedad invasiva, con un intervalo de confianza entre el 82,7-99,9% si se consideraban sólo los serotipos vacunados. considerando todos los serotipos, incluyendo aquellos frente a los cuales no se había vacunado, la eficacia de la vacuna fue del 89,1 % con un intervalo de confianza del 73,7-95,8%. en otro estudio diseñado para valorar la eficacia de la vacuna en el desarrollo de otitis media aguda se estimó una eficacia del 57% (ic: 44-67%) frente a los serotipos incluidos en la vacuna, una eficacia del 34% (ci: 21-45%) frente a todos los serotipos de neumococo y una eficacia del 6% (4-16%) frente a todos los tipos de otitis media. además, se ha demostrado, que induce inmunidad de grupo al disminuir los portadores nasofaríngeos, e igualmente un descenso de neumococos resistentes y del consumo de antibióticos. 110 T.10 Vacuna frente al neuMOcOcO los estudios de inmunogenicidad realizados en niños y adultos con sida y otros con niños y adultos diagnosticados de anemia de células falciformes son limitados. Hasta el momento, el uso de una vacuna conjugada 5-valente ha conseguido respuesta inmunogénica en niños ViH entre 2 y 9 años. la vacuna conjugada 7-valente también se ha mostrado inmunogénica en niños mayores con infecciones respiratorias de repetición y en niños y adultos jóvenes con anemia de células falciformes. una dosis de refuerzo con vacuna polisacarídica en pacientes con anemia de células falciformes que habían sido primovacunados con vacuna conjugada, obtuvo también una respuesta superior al uso de la vacuna polisacarídica sola. actualmente, no existen datos suficientes que permitan recomendar el uso de la vacuna conjugada heptavalente en niños mayores de 5 años y adultos. 10.6.3. Indicaciones, pautas y vías de administración las vacunas 23-valentes están indicadas en la prevención de neumonías neumocócicas y de infecciones sistémicas por neumococo de los serotipos incluidos en la vacuna, en sujetos de alto riesgo y mayores de 2 años, como en los siguientes casos: a) Pacientes inmunocompetentes con enfermedades crónicas (cardiovasculares, pulmonares, diabetes mellitus, alcoholismo, cirrosis o pérdida de fluido cerebroespinal). b) Pacientes inmunocomprometidos, como en asplenia asintomática o funcional, anemia falciforme, Hodgkin, linfoma, mieloma múltiple, insuficiencia renal crónica, síndrome nefrótico o trasplante orgánico. c) Pacientes con sida, sintomáticos o asintomáticos. la vacuna polisacarídica puede administrarse de manera intramuscular o subcutánea en dosis única. sólo está recomendada una dosis de recuerdo en adultos con alto riesgo de infección a los que se administró la vacuna hace más de 5 años, o en los que se haya producido una gran disminución del título de anticuerpos. se recomienda revacunar cada 3-5 años a niños menores de 10 años con síndrome nefrótico, asplenia o anemia falciforme. las recomendaciones para la utilización de estas vacunas, se recogen en la circular de la agencia española del Medicamento del Ministerio de sanidad y consumo (nº 7/2001): a) individuos inmunocompetentes con riesgo de enfermedad neumocócica o sus complicaciones debido a enfermedades crónicas (por ejemplo, cardiovasculares, respiratorias, diabetes mellitus, cirrosis, alcoholismo). b) individuos inmunocomprometidos con riesgo de enfermedad neumocócica o sus complicaciones (por ejemplo, asplenia anatómica o funcional, enfermedad de Hodgkin, linfoma, mieloma múltiple, insuficiencia renal, síndrome nefrótico, anemia falciforme, o en circunstancias específicas como transplante de órganos asociados con inmunosupresión). c) Personas con infección por ViH sintomática o asintomática. d) Personas con implante coclear o que van a recibir uno. en la actualidad, existe evidencia para recomendar la vacunación en pacientes ancianos que viven en instituciones cerradas, por el mayor riesgo de contagio. algunas comunidades autónomas incluyen en sus recomendaciones la vacunación sistemática a la población de ≥60 años (u otros rangos de edad), opción que, en algunos casos, se ha adoptado haciéndola coincidir con la vacunación antigripal (cuando corresponda) con el objetivo de asegurar una mejor cobertura en ambas vacunas. Por su parte, la vacuna conjugada está indicada en españa y, por tanto, financiada por el sistema nacional de salud, para la inmunización activa frente a las infecciones por S. pneumoniae en niños entre 2 meses y 5 111 GuÍa de Vacunas en la Oficina de farMacia años en situación de riesgo, como en caso de anemia de células falciformes, asplenia (congénita o adquirida, anatómica o funcional), infección por ViH, enfermedad crónica cardiovascular, enfermedad crónica respiratoria excluido el asma, diabetes mellitus, fístula o pérdida de líquido cefalorraquídeo, inmunodeficiencia congénita, síndrome de down, trasplante, neoplasia maligna, leucemia, linfoma, síndrome nefrótico o insuficiencia renal o inmunosupresión. no contiene tiomersal. la vacuna se administra de forma intramuscular en la región anterolateral del muslo en bebes y deltoides en adultos. en niños menores de 6 meses de edad se recomiendan 3 dosis más una dosis de refuerzo. la primera dosis debe administrarse a los 2 meses de edad seguida de dos más con un intervalo de al menos un mes. la dosis de refuerzo se recomienda al segundo año de vida. entre los 7 y 11 meses se recomiendan 2 dosis con un intervalo de al menos un mes y una dosis de refuerzo al segundo año de vida. desde los 12 meses hasta los 23 meses se recomiendan 2 dosis con un intervalo de al menos 2 meses. en la comunidad de Madrid la vacuna se encuentra incluida en el calendario de Vacunación sistemática desde el año 2006. la vacuna está autorizada en más de 70 países. la asociación española de Pediatría (2008) recomienda la inclusión de la vacuna conjugada 7V en los calendarios vacunales de las comunidades españolas. de hecho, también recomienda la Organización Mundial de la salud que sea incluida en los calendarios de los programas nacionales. sin embargo, es necesario considerar un posible fenómeno de remplazo en los serotipos dado que la vacuna sólo incluye 7 de ellos. en este sentido se está trabajando en nuevas vacunas conjugadas que incluyen 10 y 13 serotipos. 10.6.4. Contraindicaciones y precauciones la vacuna está contraindicada si existe hipersensibilidad a cualquiera de los componentes de la misma. no debe administrarse en caso de enfermedad febril aguda hasta la remisión de la misma. la utilización de la vacuna polisacarídica antineumocócica se podría hacer pero debe evitarse, durante el embarazo o la lactancia ya que no existen estudios que avalen su seguridad, los posibles efectos adversos sobre el feto o índices de excreción en leche materna. Puede administrarse en el mismo acto que la vacuna antigripal pero siempre en distinto lugar de inyección. la vacuna conjugada puede administrarse conjuntamente con otras vacunas del calendario vacunal siempre y cuando se administren en diferentes jeringas y lugares de inyección. se ha observado una reducción del título de anticuerpos frente a Haemophilus influenzae tipo b cuando se administran simultáneamente. sin embargo, todos los niños presentaron anticuerpos protectores. igualmente, se ha observado una disminución limitada en la respuesta inmunológica frente a poliovirus tipo i aunque permanece sin determinar la trascendencia clínica de estas observaciones. actualmente no se dispone de datos sobre la administración conjunta con vacunas meningocócicas conjugadas así como con la administración de vacunas hexavalentes. la vacuna conjugada, hoy por hoy, no está indicada en adultos y aún se dispone de estudios que aporten información sobre su seguridad en el embarazo y lactancia. 10.6.5. Reacciones adversas los principales efectos adversos corresponden a problemas locales en el lugar de la inyección del tipo de eritema, induración, dolor local e inflamación que se observaron en un 50% de los individuos vacunados, autolimitadas y de corta duración (menos de 48 horas). también es común la febrícula (38-39 ºc). Otros síntomas como malestar general, artralgias o fiebre por encima de 39 ºc son raros. se ha descrito algún caso ocasional de parestesias, trombocitopenia y síndrome de Guillen Barre sin que se haya podido determinar reacción causal con la vacuna. se ha descrito rash y urticaria en menos del 1%. Muy raramente (<0,1%) se reportado convulsiones. 112 T.10 Vacuna frente al neuMOcOcO 10.6.6. Vacunas antineumocócicas comercializadas Vacunas antineumocócicas polisacarídicas polivalentes Código nacional Nombre Descripción 650617.2 Pneumo 23 1 jeringa precargada 0,5 ml 603654.9 820415.1 5 jeringas precargadas 0,5 ml Pneumovax 23 1 vial 0,5 ml Composición Polisacáridos capsulares purificados de Streptococcus pneumoniae, serotipos 1, 2, 3, 4, 5, 6B, 7F, 8, 9N, 9V, 10A, 11A, 12F, 14, 15B, 17F, 18C, 19A, 19F, 20, 22F, 23F, y 33F. Polisacáridos capsulares purificados de Streptococcus pneumoniae, serotipos 1, 2, 3, 4, 5, 6B, 7F, 8, 9N, 9V, 10A, 11A, 12F, 14, 15B, 17F, 18C, 19A, 19F, 20, 22F, 23F, y 33F. Vacunas antineumocócicas conjugada Código nacional 895151.2 Nombre Prevenar Descripción 1 jeringa precargada 0,5 ml Composición Polisacáridos capsulares purificados de Streptococcus pneumoniae, serotipos 4, 6B, 9V, 14, 19F y 23F y oligosacáridos del serotipo 18C, conjugados con la proteína transportadora CRM197 y adsorbidos en fosfato de aluminio. Tabla 25. Vacunas antineumocócicas comercializadas en España. la vacuna tiene un periodo de validez de 24 meses. debe mantenerse a temperaturas entre 2 ºc y 8 ºc. no debe congelarse. 10.7. Futuras líneas de investigación aún es necesario precisar más sobre las indicaciones, inmunogenicidad y eficacia de las vacunas frente al neumococo en las poblaciones de riesgo, especialmente en niños mayores y adultos inmunocomprometidos. estudios a largo plazo, incluso con la combinación de ambas vacunas, nos permitirán conocer más datos sobre la duración de la protección y la eficacia, permitiendo elaborar una correcta estrategia de vacunación en estos grupos. igualmente, la ampliación de los serotipos contenidos en la vacuna a una 10-valente o 13-valente aportará nuevas perspectivas muy interesantes en la prevención de la enfermedad neumocócica. los objetivos ambiciosos aunque no por ello más lejanos, se orientan a conseguir vacunas que confieran inmunogenicidad para todos los serotipos del neumococo. también existen líneas prometedoras que ensayan la capacidad inmunogénica de proteínas estructurales del neumococo, como la sustancia c o la proteína a, o de toxinas como la neuroaminidasa, o incluso en empleo proteínas neumocócicas como transportadoras. 113 GUÍA DE VACUNAS EN LA OFICINA DE FARMACIA TEMA 11 Vacuna frente a la gripe GuÍa de Vacunas en la Oficina de farMacia la gripe es una enfermedad infecciosa aguda de las vías respiratorias que se caracteriza por una elevada capacidad de transmisión, presentación invernal y recurrencia epidémica periódica. la gripe es un importante problema de salud Pública, tanto por la mortalidad que puede provocar directa o indirectamente, como por la morbilidad que ocasiona y los costes económicos y sociales que origina. el virus causante de la gripe tiene una elevada capacidad de sufrir variaciones de sus antígenos de superficie lo que implica la aparición de nuevos virus gripales frente a los que no es capaz de reaccionar el ser humano. actualmente existen vacunas antigripales inactivadas con una alta efectividad y seguridad pero debido a esta alta capacidad del virus gripal de variar año tras año la vacuna debe administrarse anualmente. 11.1. Características del agente etiológico los virus de la gripe pertenecen a la familia de los Orthomyxoviridae. los antígenos de la nucleocápside y la proteína M de la membrana permiten diferenciar los virus gripales en tres tipos: a, B y c. desde el punto de vista de la salud pública sólo son relevantes los tipos a y B, ya que el c no produce epidemias y sólo provoca infecciones asintomáticas o cuadros clínicos poco trascendentes. los virus tipo a se dividen en subtipos según las glicoproteínas de superficie hemaglutinina (H) y neuraminidasa (n). los virus gripales B y c, sin embargo, presentan menos variaciones intratipo de los antígenos H y n y no reciben denominaciones de subtipo. la capacidad de los virus de la gripe para producir epidemias deriva de su facilidad para sufrir variaciones antigénicas en las proteínas H y n. las variaciones antigénicas pueden ser de dos tipos: a) Cambios antigénicos (Shift). se define como la aparición entre la población humana de un nuevo virus gripal que presenta una proteína H (o unas nuevas proteínas H y n) inmunológicamente distintas de la que han presentado los virus que han estado circulando los años anteriores. los cambios antigénicos se suelen producir como consecuencia de la transmisión al hombre de subtipos gripales que normalmente infectan a animales o tras el intercambio genético entre virus humanos y animales. afectan exclusivamente a los virus gripales tipo a. b) Desviación antigénica (Drift). son variaciones menores que se producen por la acumulación de mutaciones puntuales en los genes que codifican las proteínas H y n. afectan a los virus gripales a y B, si bien los tipo B las sufren más lentamente. Por ello durante varios años puede estar circulando una cepa idéntica a la del año anterior. los virus gripales tipo a son responsables de mucha más mortalidad derivada de gripe que los tipo B. 11.2. Cadena epidemiológica de la gripe el reservorio de la gripe en las infecciones humanas es fundamentalmente el hombre; sin embargo los virus gripales infectan frecuentemente a animales como caballos, cerdos, ballenas y a pájaros, que como ya se ha comentado son fuente de nuevos subtipos para el hombre. la capacidad demostrada de los virus gripales de las aves de saltar la barrera interespecie hace que la gripe no pueda ser considerada como una enfermedad erradicable. la fuente de la infección está constituida por los sujetos enfermos, siendo el periodo de transmisibilidad probablemente hasta 3-5 días después del comienzo clínico. la transmisión se produce fundamentalmente por vía 116 T.11 Vacuna frente a la GriPe aérea, mediante aerosoles que son originados al hablar, toser o estornudar, alcanzando a un sujeto susceptible. también son mecanismos eficaces el contacto directo y los fómites. no hay portadores crónicos de la gripe. las tasas de ataque clínico durante las epidemias oscilan entre el 10-30%, en poblaciones grandes, y son superiores al 50% en grupos de población cerrados como internados escolares o asilos. cuando aparece un subtipo nuevo la susceptibilidad es universal, excepto en las personas que han superado epidemias anteriores causadas por algún subtipo afín. la infección confiere inmunidad contra el virus infectante específico, pero la duración e intensidad de la inmunidad dependen del grado de desviación antigénica y del número de infecciones previas. 11.3. Signos y síntomas de la gripe la infección causada por los virus gripales ocasiona una alteración del epitelio respiratorio mucho más severa que la provocada por virus catarrales. a las pocas horas de la infección este epitelio está inflamado y congestivo. los virus pueden encontrarse en el lavado nasofaríngeo dentro de las primeras 24 horas tras la exposición a la fuente de la infección y su concentración suele aumentar hasta alcanzar un máximo entre las 24-72 horas tras la exposición y volver a niveles bajos alrededor del quinto día. el periodo de incubación suele durar 2-3 días. este corto periodo, junto con la alta cantidad de virus en las secreciones nasofaríngeas y la pequeña cantidad de estos virus necesaria para que se produzca el contagio explica la naturaleza explosiva de las epidemias. se calcula que aproximadamente la mitad de los pacientes infectados por el virus de la gripe permanecen asintomáticos. el cuadro clínico inicial típico suele comenzar de forma brusca con fiebre y escalofríos, acompañados de cefalea, molestias de garganta, malestar general, anorexia y tos seca. en la imagen 9 aparece la distribución de frecuencia de los signos y síntomas en 520 sujetos adultos con gripe causada por virus tipo a y con el diagnóstico confirmado serológicamente. 100 85% 80 60 80% 68% 65% 67% 63% 55% 40 20 0 Fiebre Tos Malestar Inicio brusco Escalofrios Cefalea Mialgia Imagen 9. Signos y síntomas de la gripe en 520 pacientes con gripe no complicada algunos síntomas de la gripe son comunes a todas las edades; sin embargo otros son más específicos de determinados grupos de edad. Por ejemplo, en ancianos es frecuente la aparición de disnea o la producción de esputo, mientras que en niños son síntomas frecuentes la otitis media, las convulsiones 117 GuÍa de Vacunas en la Oficina de farMacia y las molestias abdominales. los pacientes inmunocomprometidos no presentan unas manifestaciones clínicas de la gripe significativamente distintas de los sujetos sanos. sí se ha demostrado que la enfermedad puede tener una mayor duración y que el virus puede persistir replicándose durante semanas o meses. las complicaciones de la gripe son predominantemente respiratorias. la aparición de neumonía viral primaria se asocia a una alta tasa de letalidad. la neumonía bacteriana secundaria se caracteriza por la aparición de un nuevo acceso de fiebre y tos productiva en el periodo de convalecencia de la gripe. Ocasionalmente se producen cuadros de neumonía combinada viral y bacteriana que tiene una respuesta variable a los antibióticos. se ha diagnosticado neumonía viral primaria o secundaria en un 5-38% de pacientes con gripe en estudios que incluían virología y radiología. la gripe puede ocasionar reagudización de su patología en pacientes con ePOc o fibrosis quística y también provocar la exacerbación aguda de su enfermedad en asmáticos. complicaciones neurológicas raras de la gripe incluyen el síndrome de reye y el síndrome de Guillain-Barré. el riesgo de complicaciones, hospitalizaciones y muertes por gripe es más alto entre personas de 65 o más años, niños muy pequeños y personas de cualquier edad con patologías crónicas concomitantes (pacientes de alto riesgo). el número total de hospitalizaciones en exceso (por encima de los valores esperados) debidas a la gripe en estados unidos desde 1969 hasta mediados del los noventa se estima ha sido de 114.000 por año. durante las epidemias, las muertes relacionadas con la gripe pueden deberse a la propia infección, a neumonías secundarias y a la exacerbación de patologías cardiopulmonares o de otras enfermedades crónicas. en estados unidos, en 19 de las 23 epidemias de gripe que se han descrito entre 1972 y 1995 se ha producido un exceso en el número de muertes relacionadas con la gripe (es decir, el número que se producen por encima de una línea basal de las muertes esperadas). este exceso de muertes oscila entre 30-150/100.000 sujetos de 65 o más años de edad, siendo el número absoluto entre 20.000 y 40.000 muertes anuales. el progresivo envejecimiento de la población en los países desarrollados puede hacer que este número siga aumentando. 11.4. Epidemiología de la gripe el virus de la gripe es único en su capacidad de presentarse en forma de pandemias que afectan a prácticamente toda la población, como epidemias recurrentes anuales y como brotes aislados. a) Pandemias. se producen cuando aparece un nuevo virus frente al que la mayor parte de la población está desprotegida. suelen deberse a cambios antigénicos en el virus gripal a. las pandemias aparecen con una periodicidad de 10 a 50 años. en el siglo XX se han descrito cuatro pandemias. la peor pandemia gripal que se ha producido hasta el momento fue la de 1918 (“gripe española”). se estima que esta pandemia ocasionó aproximadamente 500.000 muertes sólo en los estados unidos y 20 millones en todo el mundo. la pandemia de 1957 (“gripe asiática”) fue responsable de al menos 70.000 muertes en estados unidos. Mucho menos grave fue la pandemia de 1968 (“gripe de Hong Kong) que provocó 34.000 muertes en este país. la pandemia de 1977, al igual que las dos anteriores, se describió en el continente asiático. existen evidencias de que las cepas virales de las pandemias de 1918 y 1977 provienen del cerdo y las de 1957 y 1968 de aves. actualmente no es posible saber cuando se producirá la próxima pandemia, dónde se originará y cuál será el subtipo que la ocasione, lo que imposibilita el elaborar vacunas e incide en la necesidad de disponer de sistemas de vigilancia epidemiológica que permitan una rápida detección e intervención. 118 T.11 Vacuna frente a la GriPe b) Epidemias periódicas recurrentes. se define como epidemia la aparición de brotes limitados a un área geográfica, pudiendo ser ésta un país, una ciudad o un pueblo. a diferencia de las pandemias, las epidemias de gripe no implican la aparición de un nuevo subtipo gripal, sino ligeros cambios producidos por desviaciones antigénicas en los virus gripales ya circulantes. las epidemias de gripe suelen producirse con una periodicidad anual y aparecer en los meses de invierno en ambos hemisferios, de diciembre a abril en el hemisferio norte y de mayo a septiembre en el hemisferio sur. en los países tropicales se pueden aislar virus gripales a lo largo de todo el año y la aparición de brotes suele estar relacionada con la existencia de cambios climáticos. las epidemias de gripe son causadas por virus gripales a y B. desde la pandemia de 1977 las epidemias anuales de gripe han estado causadas por dos subtipos a (H1n1 y H3n2) y un tipo B, si bien no todos los años han circulados los tres virus. c) Brotes aislados. los conceptos de inmunidad colectiva y de variación antigénica explican en gran medida, pero no totalmente, el comportamiento de las epidemias gripales; otros factores derivados del propio virus como su virulencia y transmisibilidad tiene igualmente un papel relevante. un ejemplo de esto es lo que sucedió en fort dix (new Jersey, estados unidos) en enero de 1976. en esta instalación militar se produjo un brote por un subtipo de gripe a (a/new Jersey/76/H1n1) que tenía todas las características antigénicas para provocar una epidemia y si bien produjo varios casos en el interior de la base, incluyendo una muerte, no se extendió a la población civil. Más recientemente se han producido dos pequeños brotes de nuevos subtipos gripales a (H5n1 y H9n2) que merecen una mención especial. • Gripe a (H5n1) en Hong Kong. en mayo de 1997 apareció en Hong Kong el primer y único caso humano que se había descrito hasta la fecha de gripe por el subtipo H5n1. la identificación del virus se produjo en agosto. antes de este caso este virus sólo se había detectado en diversas especies de aves incluyendo pollos y patos. Hasta marzo de 1998 se afectaron un total de 18 sujetos, de los que fallecieron 6. se realizó un estudio de casos control en el que se encontró que el principal factor de riesgo había sido el haber visitado una granja de pollos en la semana previa al inicio de los síntomas. estos resultados ayudan a confirmar la hipótesis de una transmisión de pollos infectados a humanos y la baja eficacia de la transmisión persona-persona. además de por la aparente alta letalidad (ya que es posible que sólo se identificaran los casos más graves que acudían al hospital), la gripe H5n1 se caracterizó por la prominencia de los síntomas gastrointestinales y la gran frecuencia de complicaciones respiratorias, hepáticas, hematológicas y renales. • Gripe a (H9n2) en Hong Kong. en marzo de 1999 el departamento de salud de Hong Kong aisló virus gripales a (H9n2) de dos niños. cinco casos más no confirmados se produjeron posteriormente en china. Hasta el momento actual no se han comunicado más casos. el virus a (H9n2), al igual que el a (H5n1), es un virus que generalmente afecta a aves. no se conoce cómo se produjo la exposición de los niños al virus. los dos niños afectados precisaron hospitalización pero se recuperaron completamente. en españa la gripe afecta a un número muy elevado de personas todos los años, y es una enfermedad incluida dentro del sistema de enfermedades de declaración Obligatoria (edO). este sistema de vigilancia epidemiológica implica que todos los médicos asistenciales deben notificar semanalmente al servicio de salud Publica del área correspondiente los casos de gripe observados dentro de la semana previa. a partir de estos datos el centro nacional de epidemiología publica semanalmente en el Boletín epidemiológico semanal el número total de casos notificados en españa. en los años 1998, 1999 y 2000 se notificaron en españa un total de 2.598.351 (tasa de 6,5/100.000 habitantes), 3.152.677 (tasa de 7,9/100.000 habitantes) y 1.969.202 (tasa de 4,9/100.000 habitantes), casos de gripe respectivamente. además de la información suministrada por el sistema edO, también se recoge información sobre la evolución de la gripe y sus características mediante los llamados sistemas centinelas. 119 GuÍa de Vacunas en la Oficina de farMacia 11.5. Métodos de control de la gripe los pilares sobre los que se apoya el control y manejo de la gripe son la vigilancia epidemiológica, el tratamiento y las medidas de prevención individual. 11.5.1 Vigilancia epidemiológica Hace ya más de 50 años la OMs instauró un programa internacional de vigilancia epidemiológica de la gripe; hoy 110 centros nacionales de Gripe distribuidos por 83 países recogen e identifican cepas gripales. los objetivos generales de la vigilancia epidemiológica de la gripe podrían resumirse en: a) Monitorizar las cepas virales para permitir determinar la composición de las vacunas. b) estimar la incidencia de gripe así como la morbilidad y mortalidad derivada de la misma. c) instaurar sistemas de detección precoz ante la posible aparición de una pandemia. d) Permitir diferenciar la gripe de otras epidemias ocasionadas por otros agentes causantes de enfermedades de vías respiratorias altas. e) distribuir la información sobre gripe entre países y hacerla llegar al médico de cabecera. 11.5.2. Tratamiento de la gripe el tratamiento de la gripe suele ser sintomático. sin embargo, actualmente están disponibles cuatro antivirales útiles frente a los virus gripales: amantadina, rimantadina, zanamivir y oseltamivir (Véase tabla 26). amantadina y rimantadina, éste último no autorizado en españa, actúan contra la proteína M2 de los virus gripales a y son eficaces si se dan en las primeras 48 horas. se caracterizan por tener importantes efectos secundarios (5-10%), tales como nerviosismo, ansiedad, insomnio y trastornos gastrointestinales, y porque desarrollan rápidamente resistencia intrínseca y cruzada, por lo que son poco utilizados. los nuevos inhibidores de la neuraminidasa (zanamivir inhalado y oseltamivir oral) han demostrado en ensayos clínicos que administrados en las primeras 48 horas pueden disminuir el consumo de antitérmicos, reducir la incidencia de complicaciones de la gripe y la duración de la enfermedad, y acelerar la reincorporación de los pacientes a sus actividades normales. zanamivir tiene como efectos secundarios más frecuentes la reagudización del asma, y oseltamivir alteraciones gastrointestinales. como se ha señalado, existe evidencia sobre la efectividad de los tres antivirales disponibles, en nuestro país, para el tratamiento de las formas no complicadas de gripe; sin embargo todavía no se dispone de información concluyente sobre la utilidad de estos fármacos para el tratamiento de la gripe en poblaciones de alto riesgo. 120 T.11 Vacuna frente a la gripe Principio activo Medicamento Presentación Amantadina Amantadina Level 100 mg 20 cápsulas Adultos y niños mayores 16 años: 100 mg/12 horas. Niños de 10-15 años: 100 mg/24 horas. Oseltamivir Tamiflu 30 mg 14 cápsulas Prevención (adultos y niños mayores de 13 años): 75 mg/24 horas durante 10 días (postexposición) o 6 semanas (brote). Tratamiento (adultos y niños mayores de 13 años): 75 mg/12 horas, durante 5 días. En niños más pequeños se ajustará la dosis en función del peso. 45 mg 10 cápsulas 75 mg 10 cápsulas 12 mg/ml 30 g suspensión oral Zanamivir Relenza rotadisk 5 mg 20 alveolos Posología Prevención: 10 mg/24 horas durante 10 días (postexposición) o 28 días (brote). Tratamiento (adultos y niños mayores de 5 años): 10 mg/12 horas, durante 5 días. Tabla 26. Fármacos antigripales comercializados en España. 11.5.3. Prevención individual de la gripe para la prevención de la gripe existen son estrategias: el empleo de antivirales como quimioprofilaxis y la vacunación. la amantadina ha demostrado una eficacia en torno al 70-90% para prevenir las infecciones causadas exclusivamente por virus gripales tipo a. De los nuevos inhibidores de la neuraminidasa, tanto zanamivir como oseltamivir han sido aprobados para la profilaxis. en ningún caso el uso de quimioprofilaxis debe ser un sustituto de la vacunación. actualmente se debe utilizar la quimioprofilaxis en sujetos de alto riesgo que no han podido ser vacunados, en los que no se produce una respuesta adecuada de anticuerpos tras la vacunación y en personas no vacunadas que vayan a estar en contacto con sujetos de alto riesgo. 11.6. Vacuna antigripal actualmente existen dos tipos de vacunas. a) Vacuna de virus inactivados. Son las comercializadas y pueden ser de diferentes tipos: • Virus enteros: suspensiones purificadas de viriones completos. no se suele emplear. • Virus fraccionados: viriones fraccionados por la acción de detergentes y que contienen hemaglutinina, neuraminidasa y parte de la nucleoproteína y de la proteína M. Que son las más frecuentemente empleadas. • antígenos de superficie o vacunas de subunidades, virosomas y adyuvadas. incorporadas recientemente en la mayoría de las comunidades autónomas. b) Vacuna de virus atenuados. están en fase experimental. no existen estudios comparativos rigurosos entre los tres tipos de vacunas inactivadas, aunque teóricamente las enteras pueden ser más inmunógenas y las fraccionadas menos reactógenas, de ahí que éstas últimas se aconsejen en los niños. 121 GuÍa de Vacunas en la Oficina de farMacia en la actualidad existen vacunas con adyuvantes, tales como los virosomas o la utilización de emulsiones como la Mf59 con escualeno y detergentes. la adición de estas emulsiones o de virosomas contribuye a aumentar la inmunogenicidad. la vacuna adyuvada con Mf59 ha demostrado la inducción de mayor inmunogenicidad en las personas mayores cuando se ha comparado con vacunas de virus fraccionados o de virosomas. también se ha descrito una mejor respuesta, comparada con vacunas fraccionadas de composición similar, en presencia de comorbilidad y, por último, en presencia de virus de la gripe circulantes no similares a los incluidos en la vacuna. la vacuna de la gripe contiene tres cepas (dos tipo a y una tipo B) que representan los virus que más probablemente circulen en el invierno siguiente. la OMs publica anualmente las recomendaciones sobre el contenido de la vacuna. la vacuna se fabrica a partir de virus cultivados en huevos embrionados de gallina que son inactivados con formaldehído o beta-propiolactona y fragmentados con detergentes. como conservante se añade timerosal y algunos fabricantes añaden antibióticos para prevenir la contaminación. las vacunas contienen al menos 15 μg de la hemaglutinina de cada cepa incluida en ella. 11.6.1. Respuesta inmunitaria la mayor parte de los adultos desarrollan altos títulos de anticuerpos contra la hemaglutinina tras una dosis de vacuna. los anticuerpos protectores frente a hemaglutinina aparecen en 8-10 días. se producen anticuerpos séricos y locales (iga secretora) frente al subtipo de hemaglutinina y neuraminidasa que contenga el virus. estos anticuerpos únicamente son protectores frente a los virus de la gripe similares a los incluidos en la vacuna. la duración de la inmunidad es de un año. son factores que influyen en la respuesta inmunitaria: a) edad. los ancianos tienen poca inmunogenicidad. b) enfermedades de base. Hay una menor respuesta en inmunodeprimidos y dializados. c) Vacunaciones anteriores. cuando la coincidencia entre las cepas vacunales y los virus circulantes es alta, la eficacia vacunal para prevenir la enfermedad en sujetos de menos de 65 años sin otras enfermedades crónicas asociadas es de aproximadamente del 70-90%. Para sujetos de más de 65 años, con o sin patologías asociadas, la eficacia para prevenir la enfermedad es menor, pero la vacunación es efectiva para disminuir la incidencia de complicaciones secundarias de la gripe y reducir el número de hospitalizaciones y muertes. en niños la vacunación ha demostrado ser efectiva para reducir la incidencia de otitis media y el consumo de antibióticos. su uso en población trabajadora reduce en un 25% la aparición de episodios de enfermedad respiratoria de vías altas, disminuye en el 43% del absentismo laboral y el 44% el número de consultas médicas. diferentes estudios han demostrado que la vacuna antigripal es coste efectiva para ancianos (≥65años), sujetos con enfermedades crónicas independientemente de su edad y trabajadores. Muy recientemente, un estudio en el que se evaluaba el coste/efectividad de la vacunación antigripal en Holanda concluyó que éste era mejor que el que se obtenía en otros programas de control de enfermedades infecciosas también implantados en Holanda, como por ejemplo la vacunación infantil frente a la meningitis o el screening frente a hepatitis B para embarazadas. 11.6.2. Indicaciones, pautas y vías de administración actualmente la vacuna de la gripe no es de aplicación sistemática. el advisory committee on immunization Practices (aciP) del cdc estructura sus recomendaciones sobre vacunación antigripal en cuatro grandes grupos: a) Personas que deben vacunarse por tener un riesgo elevado de presentar complicaciones en caso de padecer gripe. • Personas de 65 o más años de edad. • Habitantes de residencias o instituciones para patologías crónicas. 122 T.11 Vacuna frente a la GriPe • niños y adultos que padecen enfermedades crónicas del sistema respiratorio o cardiaco, incluyendo asma. • niños o adultos que han precisado seguimiento médico u hospitalizaciones durante el año previo por padecer trastornos metabólicos crónicos (incluyendo diabetes mellitus), disfunción renal, hemoglobinopatías o inmunosupresión (tanto la causada por tratamientos como la asociada al ViH). • niños y adolescentes (6 meses a 18 años) que reciben tratamiento prolongado con aspirina y pueden por ello estar en riesgo de padecer el síndrome de reye si sufren una infección gripal. esta recomendación no se ha implantado en españa. b) Personas que pueden transmitir la infección a sujetos en alto riesgo. • Personal sanitario y no sanitario que trabaja en hospitales, centros de salud, consultas y salas de urgencias. • trabajadores de residencias e instituciones para pacientes con patologías crónicas. • Personas que den asistencia domiciliaria a personas de alto riesgo. • Personas, incluyendo niños, que conviven con sujetos de alto riesgo. c) Personas de 50 a 64 años de edad. la recomendación de ampliar la edad de vacunación reduciéndola hasta los 50 años se basa en que en el grupo de edad de 50-64 años el porcentaje de sujetos con enfermedades crónicas asociadas es elevado (24-32% en eeuu) y en que posiblemente al hacer la vacunación universal en este grupo de edad ocasione una mayor proporción de sujetos con enfermedades crónicas que se vacunen. además, los sujetos sin enfermedades asociadas también resultarán beneficiados y se aprovecha la circunstancia de que a los 50 años de edad se inician otros programas preventivos. esta recomendación todavía no se ha implantado en españa. d) Grupos que merezcan una consideración especial. dentro de estos grupos están: • Mujeres embarazadas. no existe evidencia de que la vacuna inactivada tenga ningún efecto adverso sobre el feto. las mujeres embarazadas con alguna enfermedad que aumente su riego de sufrir complicaciones por la gripe deben vacunarse antes de que comience la epidemia, independientemente del trimestre del embarazo en que se encuentren. • Mujeres en periodo de lactancia. la vacuna no afecta a la seguridad de estas mujeres ni a la de sus niños y debe administrarse si se pertenece a algún grupo en que sea recomendada. • Personas infectadas por el ViH. la vacuna de la gripe debe administrarse a estas personas, si bien la capacidad de producir anticuerpos estará determinada por el estado inmunitario del sujeto. • Viajeros. el riesgo de gripe depende de la zona a la que se viaje y la época del año. en los trópicos la gripe puede aparecer durante todo el año. se recomienda vacunar a los viajeros que no se hayan vacunado esa temporada y se desplacen a los trópicos en cualquier época del año o al hemisferio sur en los meses de abril a septiembre. • Población general. el aciP recomienda que los médicos administren la vacuna de la gripe a toda persona que lo desee independientemente de si puede incluirse en cualquiera de los grupos señalados. Posibles indicaciones futuras. desde 1998 el aciP ha constituido un grupo de trabajo para valorar la posibilidad de incluir a los niños pequeños en las recomendaciones de vacunación antigripal. las elevadas tasas de hospitalización que se observan en los niños de corta edad, similares a las encontradas en otros grupos de alto riesgo, podría determinar la inclusión de los niños de menos de cinco años entre las indicaciones futuras. 123 GuÍa de Vacunas en la Oficina de farMacia la vacuna debe ser administrada antes del inicio de la epidemia gripal, en los meses de octubre-noviembre en el hemisferio norte y en el hemisferio sur en marzo-abril. el número de dosis recomendada varía con la edad; así para niños de menos de 9 años y en caso de primovacunación se deben administrar dos dosis separadas por un mes. en niños de menos de 9 años previamente vacunados y en sujetos mayores de esta edad, independientemente de las vacunaciones previas, la dosis será siempre única. la dosis administrada debe ser de 0,25 ml desde los 6 meses hasta los 3 años y de 0,5 ml a partir de esta edad. las vacunas inactivadas se administran en los adultos por vía iM ó sc profunda en deltoides y en niños por vía iM en el muslo. 11.6.3. Contraindicaciones y precauciones además de las generales de las vacunas hay que señalar las siguientes: a) anafilaxia a las proteínas del huevo, detergentes o antibióticos incluidos en la vacuna. b) niños menores de 6 meses. c) enfermedad febril aguda. se debe esperar hasta que se resuelvan los síntomas para administrar la vacuna. se puede administrar al mismo tiempo que la vacuna triple vírica, dtP, polio oral, Haemophilus influenzae tipo B y antineumocócica, siempre que se administren en diferentes lugares. los pacientes bajo terapia inmunosupresora pueden presentar una respuesta inmunológica disminuida a la vacuna y es preferible retrasar la vacunación hasta que la terapia inmunosupresora se discontinúe. Pueden disminuir el metabolismo hepático de la teofilina y anticoagulantes orales, así como aumentar el metabolismo hepático de la fenitoína. 11.6.4. Reacciones adversas en el momento de vacunar a los pacientes con la vacuna inactivada de la gripe es importante informarles de que la vacuna no puede contagiar la enfermedad al contener virus muertos no contagiosos y que es posible que por casualidad el paciente sufra en los días posteriores a la vacunación un cuadro de vías respiratorias altas que en ningún caso está relacionado con la administración de la vacuna antigripal. el efecto secundario más frecuente tras la administración de la vacuna es escozor en el lugar de la inyección. esta reacción en ensayos clínicos ha aparecido entre el 10-64% de los pacientes. estas reacciones locales suelen durar menos de 48 horas y rara vez interfieren con la vida normal de los vacunados. las reacciones sistémicas tales como fiebre, malestar, mialgia y otros síntomas pueden aparecer tras la vacunación y son más frecuentes en niños de menos de 12 años y vacunados por primera vez. estas reacciones se inician en las primeras 6-12 horas y suelen persistir 1-2 días. un ensayo clínico reciente ha demostrado que en ancianos y adultos jóvenes las vacunas de virus gripales fraccionados no tenían más efectos adversos sistémicos que el placebo. las reacciones alérgicas son muy poco frecuentes y suelen deberse a restos de proteínas de huevo. en las cepas de vacunas que contienen hemaglutinina porcina se han descrito aisladamente casos de síndrome de Guillain-Barré. tras la vacunación pueden producirse casos falsos positivos en la serología del ViH, el HtlV-1 y el virus de la hepatitis c. esta respuesta es rara, de corta duración y se atribuye a una respuesta inespecífica de igM. 124 T.11 Vacuna frente a la GriPe 11.6.5. Vacunas antigripales comercializadas Vacunas antigripales de virus inactivados fraccionados Código nacional Nombre Descripción Composición 842781.9 Fluarix 45 μg 1 jeringa precargada 0,5 ml Virus de la gripe inactivados y fraccionados. Puede contener trazas de gentamicina. 830885.9 Gripavac 45 μg 1 jeringa precargada 0,5 ml Virus de la gripe inactivados y fraccionados. Puede contener trazas de neomicina. 654275.0 Levrison 45 μg 1 jeringa precargada 0,5 ml Virus de la gripe inactivados y fraccionados. Puede contener trazas de neomicina. 656583.4 Mutagrip 45 μg 1 jeringa precargada 0,5 ml Virus de la gripe inactivados y fraccionados. Puede contener trazas de neomicina. 831511.6 Vacuna antigripal Pasteur 45 μg 1 jeringa precargada 0,5 ml Virus de la gripe inactivados y fraccionados. Puede contener trazas de neomicina. 651016.2 Vacuna antigripal polivalente Leti 45 μg 1 jeringa precargada 0,5 ml Virus de la gripe inactivados y fraccionados. Puede contener trazas de neomicina. Vacunas antigripales de antígenos de superf icie Código nacional Nombre Descripción Composición 653368.0 Chiroflu 45 μg 1 jeringa precargada 0,5 ml Antígenos de superficie (hemaglutinina y neuraminidasa) del virus de la gripe. Puede contener trazas de neomicina y kanamicina. 668509.9 Chiromas 45 μg 1 jeringa precargada 0,5 ml Antígenos de superficie (hemaglutinina y neuraminidasa) del virus de la gripe. Puede contener trazas de neomicina y kanamicina. 725077.7 Influvac 45 μg 1 jeringa precargada 0,5 ml Antígenos de superficie (hemaglutinina y neuraminidasa) del virus de la gripe. Puede contener trazas de gentamicina. Tabla 27. Vacunas antigripales comercializadas en España. las vacunas antigripales deben conservarse siempre en nevera (+2 a +8º c) hasta el momento de la administración. 11.6.6. Vacunas atenuadas frente a la gripe se sintetizan a partir de cepas gripales que tras múltiples pasos por células de embriones de pollo a 25 ºc crecen bien a esta temperatura. tras este proceso se consiguen cepas con las siguientes características: a) replicación disminuida a 38-39 ºc. b) replicación eficiente a 25 ºc. c) Multiplicación restringida en el tracto respiratorio. 125 GuÍa de Vacunas en la Oficina de farMacia d) Producen síntomas atenuados de gripe estas cepas gripales se conocen como “adaptadas al frío” (cold adapted) y en ellas se introducen las H y n deseadas cada año (siguiendo la misma filosofía que con las inactivadas) y conservando las características de atenuación. la vacuna presenta respecto a la inactivada la ventaja de su fácil administración (vía intranasal) y su capacidad de producir anticuerpos locales en la mucosa respiratoria. los estudios disponibles sugieren que estas vacunas son eficaces y seguras pero no existen en la actualidad estudios que comparen la eficacia con la de las vacunas inactivadas. 126 GUÍA DE VACUNAS EN LA OFICINA DE FARMACIA TEMA 12 Vacuna frente a la hepatitis A GuÍa de Vacunas en la Oficina de farMacia la hepatitis a es una infección aguda del hígado causada por un virus de transmisión fundamentalmente entérica, el virus de la hepatitis a (VHa). la hepatitis a suele ser una enfermedad leve en niños y su gravedad aumenta con la edad. a diferencia de las hepatitis B y c, la hepatitis a no cronifica y los sujetos que la padecen quedan inmunizados de por vida. la hepatitis a es la forma más frecuente de hepatitis viral aguda en gran parte del mundo. desde mediados de los 90 se dispone de una vacuna inactivada altamente eficaz y segura frente a esta enfermedad. aunque la hepatitis a se describió por primera vez en 1943, fue en 1967 cuando recibió este nombre por Krogman y colaboradores, que pasaron a denominar hepatitis a a la patología conocida como ictericia catarral. en 1973 se consiguió el aislamiento definitivo del virus en heces de voluntarios, por feinstone y colaboradores. en 1979 Provost y Hilleman lograron el cultivo del virus en células. 12.1. Características del agente etiológico el VHa pertenece a la familia Picornaviridae, y se encuentra incluido en el género Hepatavirus. se trata de un virus carente de envoltura, de forma esférica y de unos 27-28 ηm de diámetro. su material genético consiste en arn monocatenario y su cápside consta de cuatro estructuras polipeptídicas denominadas VP1, VP2, VP3 y VP4. se conocen cuatro 4 genotipos humanos, pero se considera que existe un único serotipo. la vacuna de cualquier genotipo protege frente a todos los demás. tiene una gran resistencia al calor, pudiendo resistir entre 10 y 12 horas temperaturas de 60 ºc, un mes a 25 ºc y años a -20 ºc. Puede aguantar hasta un pH de 3, y persistir durante días, e incluso meses, en el agua contaminada, en sedimentos marinos, en el agua de mar, en moluscos bivalvos, en pasteles de crema, y en heces secas. se inactiva al someterle a temperaturas de 85 ºc durante 5 minutos. también en el autoclave o con radiación ultravioleta. de igual forma se consigue su inactivación mediante la acción de la formalina, de la betapropiolactona, de la iodina y con la cloración a altas concentraciones. 12.2. Cadena epidemiológica de la hepatitis A el hospedador que muestra mayor sensibilidad al VHa es el hombre. Han sido registradas hepatitis espontáneas en otros primates no humanos en cautividad, principalmente chimpancés. no existe ninguna evidencia consistente de que otros vertebrados no primates estén involucrados en la circulación del VHa. no existen portadores crónicos de hepatitis a. el VHa se excreta en las heces, en las que se pueden encontrar virus desde 2-3 semanas antes de la clínica hasta 7 días después del inicio de la misma. sin embargo el periodo de viremia es corto (7-10 días) y las partículas virales presentes en sangre están en concentraciones relativamente bajas. en saliva pueden existir virus infectivos. la secuencia de transmisión es la siguiente: a) inoculación oral. b) transporte del VHa a través del epitelio intestinal mediante un proceso de transporte vectorial. 128 T.12 Vacuna frente a la HePatitis a c) captación por los hepatocitos. d) replicación genómica del VHa, que se produce exclusivamente en el citoplasma del hepatocito. e) Paso desde el hígado al intestino y eliminación con las heces los posibles mecanismos de transmisión incluyen: a) contacto persona-persona. es el mecanismo más probable en aquellos grupos cuyas condiciones de vida sean de una mayor masificación. explica la posible transmisión entre los miembros de una misma familia y en aquellos centros de trabajo o de actividades con niños. se ha demostrado que entre los homosexuales masculinos existe un mayor riesgo de infección pudiendo deberse a este mecanismo de transmisión. b) transmisión por agua y alimentos contaminados. la mayoría de los casos de brotes de hepatitis a son causados por esta vía. Hay una gran variedad de alimentos implicados. esta vía refleja la importancia que los manipuladores de alimentos tienen en la transmisión de la enfermedad. dentro de los alimentos es muy importante la transmisión por ingestión de marisco contaminado. los moluscos bivalvos, al ser ingeridos crudos o al vapor, suponen la causa frecuente de multitud de casos, como por ejemplo en 1987 en shanghai que aparecieron 300.000 casos de hepatitis a por la ingesta de almejas contaminadas. c) transmisión por transfusión intravenosa o por hemodiálisis. los datos disponibles demuestran la posible transmisión por esta vía, si bien con una baja eficacia. se ha observado que: • existe un aumento probado de la incidencia de la hepatitis a entre los drogadictos por vía parenteral. si bien el mecanismo de transmisión podría ser por otra vía. • niños transfundidos repetidas veces mantienen una frecuencia de anti-VHa similar a la población no transfundida. • se han descrito casos de hepatitis a post-transfusional. • Pacientes y personal de centros de hemodiálisis no tienen unos niveles de anti-VHa superiores de población normal, lo que podría indicar la baja eficacia de transmisión por esta vía. el riesgo de transmisión nosocomial es extremadamente bajo y no se transmite de manera vertical de la madre al hijo. 12.3. Signos y síntomas de la hepatitis A el curso clínico de la enfermedad varía considerablemente según la edad del paciente. en niños menores de 6 años, las infecciones cursan con apenas manifestaciones clínicas, la mayoría anictéricas o incluso asintomáticas. en adultos encontramos la situación opuesta, con expresión clínica manifiesta de la enfermedad, llegando incluso a la hepatitis fulminante. el periodo de incubación es de aproximadamente 30 días oscilando entre 15-50. la sintomatología clínica característica suele tener un comienzo agudo con febrícula, malestar general, pérdida de apetito, náuseas, vómitos, dolor abdominal y ocasionalmente diarrea. Posteriormente aparecen la ictericia, hipocolia (ausencia de color de las heces, que son casi blancas) y coluria (coloración de la orina con aspecto parecido al coñac), seguidas de una mejoría general y la recuperación total. la duración de los síntomas es en general inferior a 2 meses. 129 GuÍa de Vacunas en la Oficina de farMacia la mortalidad es de 0,015%, aumentando significativamente con la edad, pasando de un 0,1% en menores de 14 años, hasta un 2,1% en mayores de 40 años. actualmente la enfermedad no tiene tratamiento. 12.4. Epidemiología de la hepatitis A la distribución de las infecciones por el VHa es mundial. Hay 1,4 millones de casos anuales notificados, siendo probablemente la incidencia 3-4 veces esta cifra. la diferencia en la incidencia entre los distintos países está determinada por la situación económica, la situación social y los factores geográficos. como todas las enfermedades de transmisión fundamentalmente entérica los países más pobres y con más altas temperaturas tienen mayor incidencia. como consecuencia, la mayoría de los casos ocurren en África y asia. no existen diferencias significativas en la prevalencia e incidencia de esta enfermedad entre mujeres y hombres. en la actualidad se reconocen a nivel mundial tres patrones de endemicidad para el VHa: a) elevada (entre 41-150 casos/100.000 habitantes/año). Preferentemente en niños menores de 15 años, con una transmisión persona a persona, por el agua y por los alimentos. Geográficamente se corresponde con África, asia, américa del sur y américa central. b) Moderada o intermedia (entre 11-40 casos/100.000 habitantes/año). Preferentemente en adolescentes y adultos jóvenes, con una transmisión similar al patrón anterior y correspondiendo a la europa Oriental y Mediterránea. c) Baja (menos de 11 casos/100.000 habitantes/año). Preferentemente en adultos. la transmisión se produce en viajes a zonas de endemicidad elevada, en contactos domiciliarios y entre homosexuales. corresponde a europa Occidental, europa del norte, américa del norte, australia y Japón. 130 T.12 Vacuna frente a la HePatitis a Comunidad Autónoma Número de casos Tasa por 100.000 habitantes Andalucía 67 0,92 Aragón 13 1,12 Asturias 0 0,00 Baleares 9 1,20 Canarias 22 1,34 Cantabria 1 0,19 Castilla-La Mancha 19 1,10 Castilla-León 8 0,32 190 3,14 Ceuta 9 12,06 Comunidad Valenciana 63 1,59 Extremadura 3 0,28 Galicia 18 0,67 La Rioja 7 2,72 Madrid 97 1,92 Melilla 20 29,78 Murcia 26 2,31 Navarra 4 0,75 País Vasco 44 2,18 Total Estatal 620 1,57 Cataluña Tabla 28. Número de casos e incidencia declarada (EDO) de hepatitis A por Comunidades Autónomas en 2002. Fuente: Instituto de Salud Carlos III. Centro Nacional de Epidemiología. Declaración EDO. la información sobre la situación española procede de dos fuentes diferentes: el sistema de vigilancia de enfermedades de declaración Obligatoria (edO), y el sistema de información Microbiológica (siM). además, desde comienzos de 1997, se dispone de datos diferenciados de la hepatitis a respecto al resto de hepatitis virales en el sistema edO. la tabla 28 muestra el número de casos e incidencia declarada (edO) de hepatitis a por comunidades autónomas en 2002. en la imagen 10 se recoge la prevalencia de personas con anticuerpos frente al VHa en españa en 1996. estos datos han sido obtenidos de una muestra aleatoria de 4000 sujetos en la encuesta de seroprevalencia en la población española en 1996. 131 GuÍa de Vacunas en la Oficina de farMacia 100 77,3% 80 60 42% 40 29,1% 20 0 1,1% 4% 2-5 años 6-9 años 4,6% 10-14 años 14,8% 15-19 años 20-24 años 25-29 años 30-39 años Imagen 10. Seroprevalencia frente al virus de la hepatitis A por grupos de edad, en la población española en 1996. Fuente: Estudio seroepidemiológico: situación de las enfermedades vacunables en España. Ministerio de Sanidad y consumo. Instituto de Salud Carlos III. Centro Nacional de Epidemiología. aunque la mejora de las condiciones higiénicas y sanitarias ha disminuido la incidencia de infección por VHa en españa, siguen siendo altas las tasas de enfermedad entre algunos grupos de población y continúan produciéndose epidemias, por lo que la hepatitis a persiste como un importante problema de salud Publica. al no existir tratamiento antiviral eficaz, la protección frente a esta infección depende de medidas preventivas que eviten la aparición y difusión de esta. 12.5. Estrategias de control de la hepatitis A las estrategias eficaces para el control de la hepatitis a incluyen: a) Medidas socio-sanitarias. • Mejora de los niveles de educación para la salud de la población, haciendo hincapié en la higiene personal, sobre todo en el lavado cuidadoso de las manos. • Potabilización del agua de consumo. • sistema adecuado de canalización y desecho de las aguas sucias. • Preparación meticulosa de alimentos. especialmente mariscos y crustáceos. • control de manipuladores de alimentos. b) inmunoprofilaxis pasiva. la inmunización pasiva con inmunoglobulina humana que contiene igG anti-VHa ha sido la base de la profilaxis durante más de 50 años. las recomendaciones actuales en ee.uu. para su uso son la protección en niños menores de dos años ya que los anti-VHa residuales adquiridos pasivamente de la madre pueden interferir con la inmunogenicidad de la vacuna y también estaría indicada en la profilaxis postexposición de los contactos y en casos de epidemias. lamentablemente no está autorizada en nuestro país. se ha observado un descenso en el título de anticuerpos presente en lotes de los últimos años, probablemente secundario a la disminución en la prevalencia de infección por VHa en el plasma de los donantes, pero no hay evidencia clínica ni epidemiológica de menor protección tras su administración. 132 T.12 Vacuna frente a la HePatitis a se acepta que su administración por vía intramuscular (glúteo o deltoides) antes del contacto, durante el periodo de incubación o durante las dos semanas siguientes a la exposición proporciona una eficacia suficiente (90%) aunque difícilmente detiene la aparición de un brote epidémico. cuando se administraron 2 semanas después de la exposición se obtuvo una efectividad del 85%. cuando se utilizan dosis de 0,02 ml/kg en pre-exposición confiere una protección menor de 3 meses y con dosis de 0,06 ml/kg confiere protección a más largo plazo, 3-5 meses. la eficacia es mayor cuando la igG es administrada tempranamente en el periodo de incubación, ya que cuando se administra más tarde solo atenúa la expresión clínica. los efectos adversos son escasos. Ha sido descrita la anafilaxia tras repetidas administraciones en personas con déficit de iga por lo que se aconseja no administrar la igG anti-VHa en estas personas. c) inmunoprofilaxis activa. la probabilidad de cultivar el virus y su estabilidad antigénica han hecho posible la existencia de una vacuna eficaz. se han ensayado varios tipos de vacunas de las que con eficacia y seguridad contrastada solo podemos destacar las inactivadas. 12.6. Vacunas frente a la hepatitis A actualmente se dispone de dos tipos de vacunas contra la hepatitis a: a) Vacunas con virus inactivados de la hepatitis a. disponemos de Havrix® y Vaqta®. b) Vacunas virosomales. están compuestas por irVi (immunopotentiating reconstituited influenza Virosomes), vesículas liposomales a cuya superficie se incorporan los viriones de la hepatitis a, previamente cultivados e inactivados. actualmente disponemos de epaxal®. 12.6.1 Inmunogenicidad, eficacia y efectividad los estudios de inmunogenicidad demuestran que tras la administración de dos o más dosis de vacuna frente al VHa inactivada, las concentraciones séricas de anti-VHa se aproximan a las observadas tras la infección natural y son 15 veces superiores a las alcanzadas tras la administración de inmunoglobulina. tras una primera dosis de vacuna con virus enteros, el 95% de los vacunados presentan seroconversión protectora, alcanzando el 99% tras una segunda dosis. la protección conferida se estima en al menos 15 a 20 años. con vacunas virosomales, la seroconversión protectora tras una primera dosis se objetiva entre el 90% y el 100%. la dosis de refuerzo confiere protección al menos durante 10 años. los factores asociados con una disminución de la inmunogenicidad son la administración simultanea de iG anti-VHa con la primera dosis y la vacunación en niños menores de 1 año de madre con anti-VHa. 12.6.2. Indicaciones, pautas y vías de administración la vacunación de los grupos de riesgo tiene como objetivo la reducción de la incidencia en personas susceptibles. Probablemente el impacto de esta estrategia será muy escaso ya que la mayoría de las hepatitis a no se da en personas pertenecientes a grupos de riesgo bien delimitados e incluso de difícil clasificación que pueden suponer el 30-40% de los casos. no obstante debe hacerse para: a) reducir la tasa de infección en los adultos; b) disminuir el riesgo de epidemias; 133 GuÍa de Vacunas en la Oficina de farMacia c) prevenir la enfermedad en personas con enfermedades de base. se recomienda la vacunación de hepatitis a en los siguientes grupos: a) Viajeros internacionales. la necesidad de vacunar a viajeros a países de elevada endemicidad está bien demostrado ya que se estima una incidencia de 3 casos/1000 personas/mes de estancia, pero que llega a 20 casos/1000 personas/mes de estancia en viajeros que comen y beben sin tomar precauciones higiénicas estrictas. en un estudio de 1992 en españa se comprobó que existía un antecedente de viaje reciente a zonas endémicas en uno de cada 5 casos de hepatitis a. Por tanto se recomienda su uso en todos los viajeros del mundo occidental que viajen a dichos países, así como a los trabajadores que eventualmente se desplacen por motivos laborales (viajes negocios, diplomáticos, etc.), misioneros y trabajadores de agencias de viajes, etc. b) Personal de guarderías infantiles o centros de disminuidos psíquicos. en españa no hay datos epidemiológicos que afirmen con seguridad la necesidad de realizar vacunación anti-VHa a estos profesionales. no obstante, datos obtenidos en ee.uu. revelan que aproximadamente el 15% de los casos declarados de hepatitis a tiene relación con este grupo ya que, aunque en los menores de 2 años la infección es asintomática, se puede producir la transmisión a sus familiares y a sus cuidadores. Por ello sería una práctica adecuada realizar la vacunación al personal al cuidado de niños, sobre todo a los más jóvenes que probablemente no estén inmunizados. c) trabajadores de plantas de depuración de aguas y recogida de basuras. la forma habitual de contagio es por contaminación al tocar los equipos de protección (guantes, trajes, etc.) antes de comer o fumar. estos trabajadores en contacto con aguas, contaminadas con frecuencia por heces, son un grupo que razonablemente hay que vacunar. d) Manipuladores de alimentos. aunque no constituyen un grupo directamente expuesto, la consideración como cohorte vacunable se hace en función de la posibilidad de ser origen de brotes epidémicos como consecuencia de su trabajo. así, es posible la contaminación de alimentos por uno de ellos que esté incubando una hepatitis a o que la padezca de forma asintomática y con una deficiente higiene de manos. e) Personas con enfermedades hepáticas crónicas. aunque el riesgo de infección sea probablemente pequeño, hay informaciones que indican mayor gravedad en caso de coinfección por hepatitis a, observándose un aumento de casos de hepatitis fulminante en pacientes sobreinfectados con el virus de la hepatitis a y c, por lo que podría ser una buena práctica la vacunación de los pacientes susceptibles (seronegativos), incluyendo en este grupo a los pacientes pendientes de transplante hepático en los que el riesgo de infección intercurrente puede ser prevenido. f) receptores de hemoderivados. se han descrito transmisión de la enfermedad por transfusión de hemoderivados (factores de coagulación de sueros) en los que no se ha conseguido desactivar al VHa. Por ello se recomienda la vacunación siguiendo la pauta descrita aunque por vía subcutánea. g) usuarios de drogas por vía intravenosa. Probablemente los casos de contagio de hepatitis a se produzcan por las deficientes condiciones higiénicas. h) Homosexuales. en eeuu se ha demostrado una elevada incidencia de hepatitis a entre homosexuales, debido probablemente a contaminación oro-fecal durante el curso de relaciones sexuales. Junto con el grupo anterior, constituyen un importante reservorio del VHa y además suelen tener hepatopatías crónicas que complicarían su pronóstico en caso de infección. i) trabajadores sanitarios. no se ha demostrado un mayor riesgo de contagio para el personal sanitario que en el resto de la población. los brotes epidémicos surgidos suelen tener relación con comer y beber en el puesto de trabajo sin adopción de medidas higiénicas suficientes. sí debería vacunarse a los trabajadores de laboratorios de investigación en animalarios de primates o que trabajen con el VHa. actualmente en españa, el Ministerio de sanidad y consumo incluye en la circular del 29 de abril de 1997 al personal sanitario de hospitales entre los grupos a vacunar de la hepatitis a. 134 T.12 Vacuna frente a la HePatitis a j) control de brotes epidémicos. la administración de la vacuna antihepatitis a realizada en 1996 en un brote epidémico en alaska parece que fue eficaz ya que interrumpió la continuidad de la epidemia. se necesitarían ensayos controlados para demostrar que la vacunación en casos de brotes epidémicos es eficaz. k) Prevención de casos secundarios. estudios recientes sugieren la posible utilidad de la vacuna para la prevención se casos secundarios en sustitución de la gammaglobulina sérica si bien es preciso más estudios para confirmar esta hipótesis. la vacuna debe ser administrada en el deltoides. la posología depende de la presentación comercial utilizada. en general, se precisa de una primovacunación y una dosis de refuerzo tras un intervalo de entre 6 y 18 meses en función de la vacuna utilizada y la edad del vacunado. en caso de viajeros a países endémicos, la pauta a seguir sería una primera dosis 2-4 semanas antes del comienzo del viaje y una segunda dosis a los 6-12 meses. 12.6.3. Indicaciones futuras la recomendación ideal de la vacuna contra el VHa sería la vacunación universal, pero en la actualidad el coste de la vacuna hace inviable este planteamiento y por esto la vacunación se limita a personas con alto riesgo de contraer la enfermedad. esta estrategia tendrá un impacto restringido sobre la incidencia de la infección, ya que casi la mitad de las personas que padecen esta enfermedad no pertenecen a ningún grupo de riesgo establecido. Hace 10 años surgió este mismo dilema con la vacuna de la hepatitis B y las indicaciones, que en un principio fueron los grupos de riesgo, llegaron a ser de indicación universal. esto se puede vislumbrar en las medidas adoptadas en alguna de las comunidades autónomas (cataluña) donde se ha implantado la estrategia vacunal universal en pre-adolescentes (12 años). 12.6.4. Contraindicaciones y precauciones las contraindicaciones son las comunes para las vacunas inactivadas. Hay limitados estudios que demuestran que la administración simultanea con otras vacunas como difteria, tétanos, polio oral, polio inactivada, fiebre amarilla, encefalitis japonesa, rabia, tifoidea oral y cólera no disminuye la respuesta inmune ni incrementa la frecuencia de efectos adversos. también hay estudios similares con la vacuna de la hepatitis B. 12.6.5. Reacciones adversas la seguridad de la vacuna es alta. los efectos secundarios son escasos, leves y de breve duración. los más frecuentes son dolor, eritema y edema en el punto de la inyección. los sistémicos incluyen dolor de cabeza, fatiga, fiebre, mialgia. 135 GuÍa de Vacunas en la Oficina de farMacia 12.6.6. Vacunas frente a hepatitis A comercializadas Vacunas VHA solas Código nacional Nombre Descripción Composición 866335.4 Epaxal 500 U RIA 1 jeringa precargada 0,5 ml Virus de hepatitis A inactivados, cepa RG-SB, propagados en células diploides humanas (HDC). Puede contener trazas de tiomersal. 673921.1 Havrix 720 U Elisa 1 jeringa precargada 0,5 ml Virus de hepatitis A inactivados, cepa HM 175, propagados en células diploides humanas MRC-5, adsorbidos en hidróxido de aluminio. Puede contener trazas de neomicina. 676858.7 652442.8 1440 U Elisa 1 jeringa precargada 1 ml Vaqta 25 U 1 jeringa precargada 0,5 ml 652443.5 50 U 1 jeringa precargada 1 ml 670059.4 50 U 1 vial 1 ml Virus de hepatitis A inactivados, cepa CR 326F, propagados en células diploides humanas MRC5, adsorbidos en sulfato hidróxido de aluminio amorfo. Vacunas VHA + VHB Código nacional 857946.4 Nombre Descripción Twinrix “Adultos” 1 jeringa precargada 1 ml 803767.4 “Pediátrica” 1 jeringa precargada 0,5 ml Composición Virus de hepatitis A inactivados, producidos por células diploides humanas (MRC-5) adsorbidos en hidróxido de aluminio hidratado. Acompañado de antígeno de superficie (AgHBs) del virus de la hepatitis B, producido por células recombinantes de Saccharomyces cerevisae, adsorbido en fosfato de aluminio. Tabla 29. Vacunas anti-hepatitis A comercializadas en España. se debe conservar entre 2-8 ºc y proteger de la luz y la congelación. 12.6.7. Vacunas en estudio la vacuna antihepatitis a que se usa actualmente es una vacuna de virus inactivados que no se replican en el huésped por lo que tiene algunos inconvenientes en su uso: dosis elevada, coste de fabricación elevado, administración invasiva iM. la consecución de una vacuna con virus vivos atenuados es posible pero todavía no se han superado ciertas dificultades. el camino es conseguir virus altamente inmunógenos pero que a la vez sean seguros. estos virus atenuados tras el paso continuado por cultivos celulares en monos podrían usarse para fabricar la vacuna, pero al disminuir su virulencia paralelamente disminuiría su inmunogenicidad, por lo que por el momento no se puede fabricar. las vacunas de péptidos sintéticos que reproducen secuencias inmunógenas de la proteína VPi son también poco inmunógenas en los ensayos realizados en animales. en la actualidad se están estudiando la inmunogenicidad de partículas víricas vacías expresadas en baculovirus y virus de la vacuna. 136 GUÍA DE VACUNAS EN LA OFICINA DE FARMACIA TEMA 13 Vacuna frente al rotavirus GuÍa De Vacunas en la oficina De farMacia la gastroenteritis aguda (Gea) constituye un importante problema de salud tanto en países en vías de desarrollo como en países desarrollados. se producen anualmente más de 3 millones de muertes en niños menores de 5 años en los países en vías de desarrollo debidas a Gea, y aunque la mortalidad en los países industrializados es muy baja, la morbilidad, en términos de coste sanitario, número de hospitalizaciones y consultas, es extraordinariamente elevada. la Gea tiene una etiología muy variada, pero las causadas por rotavirus son las más frecuentes. Más de medio millón de niños mueren anualmente en el mundo por una diarrea debida a rotavirus. 13.1. Características del agente etiológico los rotavirus fueron descritos por primera vez en 1973 por ruth Bishop en células epiteliales de la mucosa duodenal de niños con diarrea aguda. se trata de virus icosaédricos de unos 70 ηm de diámetro, que carecen de envoltura, pertenecientes a la familia reoviridae. contiene un genoma con 11 segmentos de arn de doble cadena, que codifica proteínas no estructurales, implicadas en la replicación viral, y proteínas estructurales. Imagen 11. Micrografía electrónica de rotavirus. los rotavirus se clasifican en grupos, subgrupos, serotipos o genotipos en función de las proteínas que forman su cápside (formada por una cubierta externa, cubierta media y core) y de sus características antigénicas. se habla de serotipos cuando el método de detección es inmunológico y de genotipos cuando el método de detección es molecular. la cubierta externa del rotavirus está formada por las proteínas VP4 y VP7 (Véase imagen 12), únicos antígenos virales conocidos hasta el momento capaces de inducir respuesta inmune a través de anticuerpos neutralizantes. la VP7 es una glicoproteína, muy abundante en cubierta externa, de la que todavía se desconoce su función exacta, y que define los tipos G. la VP4 es la hemaglutinina del virus y participa en la entrada del virus a la célula y en el aumento de la infectividad del rotavirus al incrementar la actividad proteasa. Define los tipos P. la cubierta media queda expuesta una vez que el rotavirus pierde su cubierta externa al entrar en la célula. está formada por la proteína VP6, fundamental en la infectividad viral al participar en el proceso de transcripción del arn mensajero a partir del arn bicatenario del virus. es el antígeno mayor que define los grupos y subgrupos. 138 T.13 Vacuna frente al rotaVirus VP4 (Serotipo P) VP6 VP7 (Serotipo G) Imagen 12. Esquema de las proteínas antigénicas del rotavirus. la cubierta interna de la cápside o core contiene entre otras proteínas la VP2, que forma parte del complejo transcripcional del virus y es imprescindible para la estabilidad viral. como ya se ha comentado, la proteína VP6 determina la reactividad de grupo y define el subgrupo en función de sus antígenos. Hay 7 grupos, de a a G, y dos subgrupos, i y ii. la infección humana puede producirse por los grupos a, B y c. Por otro lado, y según las proteínas de la cápside externa, se conocen 15 tipos G y 13 serotipos/22 genotipos P. los serotipos y genotipos G coinciden, pero no así los tipos P, por lo que se prefiere utilizar la clasificación en genotipos. los más frecuentes son los serotipos/ genotipos G1, G2, G3, G4 y G9 y los genotipos P[8], P[4] y P[6]. Para nombrar una cepa se utiliza el serotipo/genotipo G seguido del genotipo P, por ejemplo G1P[8], G3[8], G4[8], G9[8] y G2[4], que son los más frecuentes. 13.2. Cadena epidemiológica de la infección por rotavirus el rotavirus se transmite por vía fecal-oral y se eliminan gran cantidad de partículas en heces (1011 ufP/ml). se trata de un virus muy resistente en el medio ambiente, que puede sobrevivir durante semanas en el agua y en distintas superficies, lo que permite su transmisión a través de superficies contaminadas, especialmente importante en hospitales y guarderías, y a través de agua o alimentos contaminados. el período de incubación oscila entre 1 y 3 días. la eliminación del rotavirus en las heces se produce desde antes de la aparición de los primeros síntomas hasta después de haberse superado la enfermedad. la transmisión sigue produciéndose aunque las condiciones sanitarias sean buenas, de ahí que la morbilidad de la enfermedad en los países desarrollados sea alta. la transmisión del rotavirus es muy rápida entre sujetos susceptibles, produciéndose de forma frecuente brotes epidémicos. la infección por rotavirus es claramente estacional en climas templados, aumentando la incidencia en invierno. existe una baja transmisibilidad interespecie. 139 GuÍa De Vacunas en la oficina De farMacia 13.3. Signos y síntomas de la infección por rotavirus el rotavirus infecta y destruye las células de las vellosidades del intestino delgado produciendo una diarrea osmótica por malaabsorción de nutrientes. la infección es local, se limita generalmente a la mucosa intestinal y tiene un período de incubación de 24-72 horas. los síntomas van desde la infección subclínica hasta un cuadro grave de gastroenteritis aguda. los más comunes son fiebre, vómitos y diarrea. los dos primeros comienzan al inicio de la enfermedad con una duración aproximada de 48 horas. la diarrea, consistente en numerosas deposiciones líquidas sin apenas productos patológicos, es decir sin apenas sangre ni moco, se prolonga durante días. en ocasiones se acompaña de letargia, irritabilidad, dolor abdominal, anorexia y malestar general. los síntomas se agravan y prolongan en inmunocomprometidos. el cuadro clínico es compatible con otras gastroenteritis víricas, pero suele presentar complicaciones graves con mayor frecuencia. Éstas consisten en deshidratación grave, desequilibrio electrolítico, pérdida de peso y aumento del número de ingresos hospitalarios. la gastroenteritis por rotavirus es, tras la enfermedad neumocócica y el sarampión, la tercera enfermedad inmunoprevenible que más muertes produce en niños menores de 5 años. se considera que un 9-25% de las diarreas del viajero pueden estar causadas por rotavirus. 13.3.1. Infección asintomática las infecciones por rotavirus afectan a sujetos de cualquier edad, pero la gravedad del cuadro clínico es muy variada. las infecciones neonatales son asintomáticas o presentan sintomatología muy leve debido a la presencia de anticuerpos neutralizantes de origen materno (ac transplacentarios e iga secretora en la leche materna), a una posible virulencia atenuada de las cepas que atacan a los recién nacidos, a la inmadurez intestinal y a las características especiales del sistema inmune del neonato. la mayor incidencia de rotavirus se produce entre los 6 y los 24 meses de edad. el destete se asocia a riesgo aumentado de diarrea. la primera infección es la más grave y las siguientes más leves. la inmunidad conferida por la primera infección no es duradera y se pueden producir reinfecciones, que producen inmunidad natural. el porcentaje de infecciones asintomáticas aumenta en las reinfecciones. esta protección se reduce con el tiempo y aumenta con cada nueva exposición al virus, de manera que se reduce la gravedad de la diarrea. todos los niños han sufrido al menos un episodio de rotavirus a la edad de 5 años, describiéndose una incidencia de aproximadamente un episodio por niño y año tanto en países desarrollados como en vías de desarrollo. 13.3.2. Infección nosocomial las infecciones gastrointestinales son una de las principales causas de infección nosocomial en las unidades pediátricas, y dentro de ellas las producidas por virus, especialmente por rotavirus. al contrario que en el caso de las infecciones por rotavirus adquiridas en la comunidad, las infecciones nosocomiales afectan principalmente a los niños más pequeños, sobre todo a los menores de 6 meses. la clínica aparece entre los días 2-6 de hospitalización y supone una prolongación de la misma. el alto porcentaje de portadores asintomáticos contribuye a la diseminación de la infección, ya que las medidas preventivas no se aplican a estos casos. el riesgo de contraer una infección nosocomial aumenta con el tiempo de hospitalización, con el bajo peso al nacer, presencia de patología crónica asociada, inmunosupresión, malnutrición y medidas higiénicas defectuosas. 140 T.13 Vacuna frente al rotaVirus 13.4. Respuesta inmunitaria frente al rotavirus como ya se ha comentado anteriormente, la protección frente a la infección por rotavirus natural se adquiere tras haber sufrido varias reinfecciones. la respuesta inmunitaria inducida es tanto humoral como celular, a nivel local y también sistémico. las proteínas VP4 y VP7 de la cápside externa actúan como antígenos virales capaces de inducir respuesta inmune a través de anticuerpos neutralizantes, y la proteína VP6, de la cápside interna, parece estar involucrada en la producción de anticuerpos neutralizantes que bloquearían la replicación viral en el intestino. existen dos tipos de protección: homotípica, cuando se vacuna o se tienen anticuerpos naturales frente a la misma cepa que ha infectado al sujeto y heterotípica, cuando se consigue una protección cruzada frente a otros serotipos. la protección homotípica es más eficaz, pero el hecho de que las cepas de rotavirus que infectan al ser humano tengan una proteína VP4 muy conservada (mayoritariamente serotipo P1), abre la posibilidad de proteger frente a cepas con serotipos G muy distintos, pero que comparten serotipo P. los anticuerpos específicos de rotavirus aparecen entre 3 días y 2 semanas después de la infección. en la fase aguda hay una respuesta por igM, que se sustituyen por igG e iga. se considera que la respuesta local de anticuerpos iga a nivel de mucosa es el mecanismo de protección más eficaz frente al rotavirus. no existe un marcador subrogado de protección frente a la infección por rotavirus. 13.5. Epidemiología de la infección por rotavirus la infección por rotavirus es responsable del 20-25% de las defunciones por diarrea, lo que supone aproximadamente un millón de muertes anuales en el mundo, el 6% de las muertes totales en niños menores de 5 años, la mayoría de ellos en países en vías de desarrollo. aunque la mortalidad asociada a rotavirus en los países más favorecidos es muy baja, la morbilidad, el consumo de recursos sanitarios y los costes asociados son muy elevados. se estima que el rotavirus causa en estados unidos el 5-10% de las diarreas entre niños menores de 5 años, que supone más de medio millón de visitas médicas, unas 50.000 hospitalizaciones y aproximadamente 100 muertes al año. en los primeros 5 años de vida, 4 de cada 5 niños padecerán al menos un episodio de diarrea por rotavirus, 1 de cada 7 irá a urgencias, 1 de cada 78 precisará ingreso hospitalario y 1 de cada 200.000 morirá. en europa la mortalidad asociada a rotavirus es rara, pero como ya se ha mencionado, es una causa frecuente de hospitalizaciones y visitas médicas. se estima que entre el 20-60% de los ingresos hospitalarios por diarrea aguda en niños se deben a rotavirus, siendo muchas de estas hospitalizaciones en niños menores de 6 meses. la infección nosocomial adquiere un peso importante. en españa el rotavirus causa anualmente más de 90.000 episodios de diarrea atendidas en el domicilio, más de 22.800 visitas médicas y más de 2.000 hospitalizaciones. los genotipos más prevalentes en europa y en españa son G1, G4, G2, G3 y G9, todos asociados a P[8] excepto G2, que se asocia a P[4]. la distribución varía por áreas geográficas y por año. se cree que la incidencia real del rotavirus está subestimada, puesto que no existe un sistema de vigilancia epidemiológica específico y que, ante una gastroenteritis, no se detecta y caracteriza el patógeno causante, ya que conocer el diagnóstico no modifica el tratamiento. 141 GuÍa De Vacunas en la oficina De farMacia 13.6. Prevención de la infección por rotavirus la prevención de la gastroenteritis aguda es uno de los mayores problemas pendientes de la salud pública a nivel mundial, especialmente en los países menos favorecidos en los que la carga de la enfermedad diarreica es muy importante. teniendo en cuenta que la protección de la lactancia materna observada desaparece en el destete y que las medidas higiénico-sanitarias como el lavado de manos no son suficientemente eficaces por la gran resistencia en el ambiente del rotavirus, es de gran interés para la salud pública desarrollar una vacuna que minimice la sintomatología clínica y evite la diarrea severa. se estima que la administración de una vacuna eficaz contra el rotavirus puede evitar el 35% de los casos de diarrea, el 56% de los ingresos hospitalarios y el 50% de muertes, además de suponer un enorme ahorro económico. la vacuna ideal debería ser administrada antes de los 6 meses de edad junto con otras vacunas rutinarias del calendario vacunal y conferir protección frente a los tipos más prevalentes. 13.7. Vacuna frente al rotavirus Desde mediados de los años 80, la vacunación frente a rotavirus se convierte en una prioridad para distintos organismos internacionales como la organización Mundial de la salud (oMs) y la alianza Mundial para las Vacunas y la inmunización (GaVi), especialmente en los países en vías de desarrollo. se han investigado distintos tipos de vacunas (Véase tabla 30), hasta llegar en la actualidad a la comercialización de dos vacunas en el mercado: una de rotavirus humanos (rotarix®) y otra de rotavirus resortantes humano-bovinos (rotateq®). una vacuna resortante se obtiene mediante técnicas de biología molecular, recombinando cepas distintas de microorganismos de la misma o diferente especie animal, para producir una nueva cepa que reúna las características más interesantes de cada una de ellas. las cepas resortantes se consiguen mediante la coinfección de cultivos celulares con cepas de rotavirus animales y humanos, produciéndose nuevas cepas con segmentos de rna de las dos cepas originales. se seleccionan las cepas cuyo rna codifica las proteínas virales determinantes del serotipo. en 1998 la fDa (food and Drug administration) aprobó la vacuna frente al rotavirus (rotashield®) de los laboratorios Wyeth. se trataba de una vacuna de virus resortantes humanos-simios (rhesus), tetravalente, con los serotipos G1-G4. el comité asesor en Prácticas de inmunización (aciP), y la academia norteamericana de Pediatría (aaP) recomendaron la vacunación rutinaria de niños sanos mediante administración oral de tres dosis a los 2, 4 y 6 meses de edad. se trataba de una vacuna compatible con otras vacunas del calendario habitual como el Haemophilus influenzae, DtP y polio oral. 142 T.13 Vacuna frente al rotaVirus Vacunas de origen animal: Vacunas de virus atenuados, de cepas animales. Cepas de rotavirus de simios (rhesus). Cepas de rotavirus de origen bovino. Cepa de rotavirus de cordero. Vacunas humanas: Cepas de rotavirus humano sin capacidad patogénica: M37 y RV3. Cepas humanas atenuadas: 89-12. Vacunas resortantes (animal-humana): Cepas recombinantes con un gen que codifica para las proteínas VP7/VP4 humanas que inducen la formación de anticuerpos neutralizantes específicos de tipos G ó P humanos. El resto de genes son de cepas de animales, de simio (RRV) o bovinas (WC3 ó UK), por lo que se atenúa la virulencia. Tabla 30. Tipos de vacunas de rotavirus. se vacunó aproximadamente a 10.000 niños con ella. era una vacuna inmunogénica (el 88% de los niños vacunados desarrollaron anticuerpos protectores) y eficaz (80% para infección grave; 48-68% para cualquier infección). en cuanto a la seguridad, podía producir algunas reacciones adversas no graves, como fiebre, disminución del apetito e irritabilidad. la vacuna fue retirada del mercado por el propio laboratorio un año después del lanzamiento por una posible relación, que finalmente no resultó significativa, con varios casos de intususcepción (invaginación intestinal). 13.7.1. Inmunogenicidad y eficacia el mecanismo inmunológico por el cual Rotarix® o Rotateq® protegen frente a gastroenteritis por rotavirus no está totalmente claro. no se ha establecido una relación entre respuesta de anticuerpos a la vacunación frente a los rotavirus humanos y protección frente a gastroenteritis por rotavirus. tampoco se ha identificado la correlación inmunológica de protección para la vacuna resortante de rotavirus, si bien en los ensayos de fase iii, entre el 92,5-100% de los receptores de rotateq® alcanzaron un incremento significativo de la iga sérica anti-rotavirus después de un régimen de tres dosis. la eficacia protectora de rotarix® se evaluó frente a cualquier gastroenteritis y frente a gastroenteritis grave por rotavirus. tras dos dosis de rotarix®, la eficacia protectora de la vacuna frente a cualquier forma de gastroenteritis por rotavirus durante el primer año de vida fue de un 87,1% (ic 95%: 79,6-92,1); frente a gastroenteritis grave por rotavirus un 95,8% (ic 95%: 89,6-98,7); frente a gastroenteritis por rotavirus que requiera atención médica un 91,8% (ic 95%: 84,0-96,3); y frente a hospitalización debida a gastroenteritis por rotavirus un 100% (ic 95%: 81,8-100). la eficacia protectora de rotateq® se comprobó al reducir la incidencia de gastroenteritis por rotavirus causada por los serotipos vacunales y el índice de hospitalizaciones y visitas a los servicios de urgencias por gastroenteritis por rotavirus. no existe un marcador subrogado de protección frente a la infección por rotavirus, por lo que es difícil medir la eficacia de las vacunas a no ser que se recurra a ensayos clínicos que incluyan un gran número de sujetos. estos estudios tan numerosos son muy costosos, pero están justificados para asegurar la seguridad de una vacuna tan necesaria en los países en vías de desarrollo. además es necesario realizar estudios epidemiológicos para 143 GuÍa De Vacunas en la oficina De farMacia apoyar la necesidad y coste-efectividad de la vacunación universal en niños, debido a la alta frecuencia y costes directos e indirectos asociados con rotavirus en los países industrializados. la incorporación de la vacuna de rotavirus en el Programa ampliado de inmunizaciones (Pai) resulta necesario para disminuir la mortalidad por diarreas causadas por rotavirus en los países beneficiarios. 13.7.2. Indicaciones, pautas y vías de administración la vacuna contra el rotavirus está indicada para la inmunización activa de niños a partir de 6 semanas de edad, con el objetivo de prevenir la gastroenteritis debida a una infección por rotavirus. ambas vacunas proporcionan protección eficaz para niños entre 6 semanas y 8 meses frente a las gastroenteritis debidas a rotavirus causadas por los serotipos humanos G incluidos en la vacuna. son seguras y bien toleradas y proporcionan protección durante al menos dos años. al no existir datos relativos a la intercambiabilidad de las vacunas frente a rotavirus, se recomienda que los niños reciban la misma vacuna para la primera inmunización y para las dosis siguientes. las pautas de vacunación difieren entre ambas vacunas: a) rotarix®. la pauta consta de 2 dosis. la primera dosis debe ser administrada a partir de las 6 semanas de edad. Debe haber un intervalo de al menos 4 semanas entre dosis. la pauta de vacunación debería ser administrada preferentemente antes de las 16 semanas de edad, pero debe estar finalizada a las 24 semanas de edad. b) rotateq®. la pauta consiste en 3 dosis, con intervalos de 1-2 meses, con inicio a partir de las 6 semanas de edad. la primera dosis debe administrarse no más tarde de las 12 semanas de edad. es preferible que las tres dosis se administren antes de las 20-22 semanas de edad, debiendo hacerse siempre antes de las 26 semanas de edad. en el caso de que el niño vomite o regurgite momentos después de la administración de la vacuna no hay ningún problema por la administración de otra dosis en el mismo día. la administración de la vacuna frente a rotavirus es oral, nunca inyectada. el material envase del rotarix® consta de un vial con un liofilizado, una jeringuilla con disolvente para administración oral y un adaptador de transferencia. Para administrar la vacuna, se quitará la tapa protectora de plástico del vial y se conectará el adaptador de transferencia apretando fuertemente hacia abajo con el vial en posición vertical. a continuación se agitará vigorosamente la jeringuilla con el disolvente, hasta obtener una suspensión blanquecina. tras retirar el capuchón protector de la jeringa, se conectará ésta al adaptador de transferencia y se transferirá su contenido dentro del vial. sin retirar la jeringuilla del adaptador de transferencia, se procederá a agitar vigorosamente hasta lograr una suspensión turbia. finalmente se procederá a aspirar el contenido del vial en la jeringuilla, se retirará el adaptador y se introducirá la jeringuilla en la boca del bebé, dirigiendo el contenido hacia el interior de la mejilla. Para administrar el rotateq® se procede a rasgar la bolsa protectora de la vacuna, extrayendo el tubo dosificador. a continuación se sostendrá el tubo en posición vertical, y dándole unos golpecitos en el tapón se procederá a eliminar el líquido presente en la punta dispensadora. Para abrir el tubo dosificador, se procederá a girar el tapón en el sentido de las agujas del reloj, con lo que se perforará la punta dosificadora, y a continuación se girará en el sentido opuesto, abriendo el tubo. la vacuna se verterá con cuidado en la boca del niño, dejando caer el líquido hacia la parte interior de la mejilla. 13.7.3. Contraindicaciones y precauciones la vacuna de rotavirus está contraindicada en los siguientes cuadros: a) Hipersensibilidad a cualquier componente de la vacuna o reacción alérgica previa a otras vacunas frente a rotavirus. 144 T.13 Vacuna frente al rotaVirus b) niños con historial de invaginaciones intestinales o malformaciones congénitas que pudieran predisponer a estas invaginaciones, debido a la aparición de casos de intususcepción. c) inmunodeficiencia conocida o sospechada. si bien no se espera que en pacientes con siDa asintomáticos se afecte la seguridad o eficacia, ante la ausencia de datos suficientes, no se recomienda la administración. d) enfermedades febriles agudas graves. en caso de infecciones leves, no se contraindica. e) niños con diarrea aguda o vómitos. se aconseja posponer la vacunación. se recomienda extremar las precauciones en individuos que sean contactos próximos de sujetos inmunodeficientes, así como en caso de contactos de niños recientemente vacunados (se recomienda higiene cuidadosa, especialmente cuando manipulen heces). no se ha evaluado la seguridad y eficacia en prematuros y niños con enfermedades gastrointestinales o retraso en el crecimiento. la vacuna de rotavirus puede administrarse concomitantemente con vacunas como la de poliomielitis inactivada, DtPa y DtPe, Hib, hepatitis B, antineumocócica o hexavalente (DtPa-VHB-VPi/Hib). la administración concomitante con la vacuna oral frente a la poliomielitis (VPo) no afecta a la respuesta inmune a los antígenos del poliovirus, pero podría reducir ligeramente la respuesta inmune a la vacuna frente a rotavirus. 13.7.4. Reacciones adversas las vacunas de rotavirus suelen ser bien toleradas, y sólo suelen ocasionar reacciones adversas leves como fiebre y cuadros gastrointestinales, con vómitos, diarrea, flatulencia, dolor abdominal, pérdida de apetito o regurgitación de los alimentos. raramente se han descrito otras reacciones adversas como llanto incontrolable, somnolencia, estreñimiento, infecciones respiratorias, dermatitis o erupciones cutáneas. el riesgo de invaginación intestinal ha sido evaluado en ensayos clínicos de seguridad a gran escala realizado en latinoamérica y finlandia, en el que se incluyeron 63225 sujetos. este estudio puso en evidencia que no existía aumento del riesgo de invaginación intestinal en el grupo vacunado con rotarix cuando se comparó con el grupo placebo 13.7.5. Vacunas frente a rotavirus comercializadas Código nacional Nombre Descripción Composición 654097.8 Rotarix 1 vial liofilizado + 1 aplicador oral 1 ml disolvente Rotavirus humanos atenuados RIX4414, producidos en células Vero. Contiene sacarosa y sorbitol. 654712.0 Rotateq Solución oral envase 2 ml Rotavirus humanos-bovinos atenuados, serotipos G1, G2, G3, G4 y P1[8], producidos en células Vero. Contiene sacarosa. Tabla 31. Vacunas anti-rotavirus comercializadas en España. la vacuna debe conservarse en nevera (entre 2-8 °c) y mantenerse en el embalaje original para preservarla de la luz. no congelar. tras la reconstitución del rotarix®, la vacuna debe administrarse inmediatamente, aunque es estable durante 24 horas cuando se almacena a temperatura ambiente (18-25 °c). 145 GuÍa De Vacunas en la oficina De farMacia 13.8. Tratamiento como ya se ha comentado previamente, la diarrea causada por la infección por rotavirus es generalmente un proceso autolimitado sin tratamiento específico. el principal objetivo debe ser la restitución del balance hidroelectrolítico y la recuperación nutricional, mediante la rehidratación oral y la reintroducción rápida de la dieta habitual. el tratamiento farmacológico no estaría en principio indicado. tampoco el reposo intestinal, ni las dietas restrictivas. 146 GUÍA DE VACUNAS EN LA OFICINA DE FARMACIA TEMA 14 Vacuna frente al papilomavirus humano GuÍa De Vacunas en la oficina De farMacia el cáncer cervicouterino es el segundo tumor maligno en frecuencia que afecta a las mujeres, registrándose cada año alrededor de 500.000 casos nuevos y aproximadamente 250.000 muertes en todas partes el mundo. alrededor del 80% de los casos se concentra en países de bajos ingresos, donde es el cáncer que más padecen las mujeres. la infección genital por el virus del papiloma humano (VPH), que es la infección viral más común del aparato reproductor, provoca prácticamente todos los casos (el 99%) de cáncer de cuello uterino. el papilomavirus humano (VPH) presenta una creciente importancia en salud Pública, fundamentalmente, por asociación con el cáncer de cérvix. 14.1. Características del agente etiológico los papilomavirus son virus pequeños y sin envuelta, del género Papillomavirus, integrado en la familia Papillomaviridae. la cápside viral es icosaédrica y está organizada en 72 capsómeros. cada uno de estos capsómeros está constituido por dos proteínas estructurales, ambas codificadas por el virus, que se unen y estabilizan la cápside mediante puentes disulfuro. son la proteína mayor l1, que representa el 80% del total de la cápside, y la proteína menor l2, que está en menor proporción. Imagen 13. Micrografía electrónica de papilomavirus. el papel oncogénico del papilomavirus humano (VPH) fue sugerido por primera vez a principios del año 1976, y el primer VPH genital fue identificado en 1978. en el año 1981 se detectó la presencia de aDn de VPH en neoplasias y en el año 1989 se describió la capacidad carcinogénica de las proteínas virales e6 y e7 de VPH 16. existen más de 100 tipos distintos de VPH que se pueden clasificar en cutáneos, de mucosa respiratoria o de mucosa ano-genital en función de su sitio de infección (Véase tabla 32). Dentro de los VPH que afectan a mucosa anogenital, se puede hacer una segunda clasificación en función de si están presentes o no en lesiones precancerosas o cancerosas. 148 T.14 Vacuna frente al PaPiloMaVirus HuMano Tipo de papilomavirus Enfermedades asociadas Riesgo de carcinogénesis Cutáneo Verrugas plantares y cutáneas Bajo riesgo Epidermodisplasia verruciformis Alto riesgo 6 y 11 (> 90% condilomas), 42, 43, 44, 55+ Condyloma acuminata Papilomatosis laríngea Tumor de Buschke-Loewenstein Bajo riesgo 16 y 18 (70% carcinomas de cuello de útero), 31, 33, 45, 26, 35, 39, 51, 55, 52, 56, 58, 59, 66, 68 Verrugas planas, enfermedad de Bowen Displasia y carcinoma cervical Carcinoma de pene, vulva, vagina, ano Alto riesgo Mucosa Tabla 32. Clasificación de los VPH. Tomada y modificada de Muñoz N et al. N Engl J Med. 2003; 348(6): 518-27. existe otra clasificación de los VPH, desde el punto de vista filogenético, establecido en base a las secuencias de nucleótidos del genoma. esta última permite la clasificación de nuevos tipos de VPH, aún cuando no pueda establecerse con claridad su clasificación epidemiológica, ya que está siempre supeditada a estudios clínicos con un elevado número de muestras. cuarenta genotipos distintos del VPH pueden infectar los órganos genitales de hombres y mujeres. Dos genotipos de “alto riesgo” (VPH 16 y 18) provocan la mayoría de los carcinomas de cérvix, vulva, vagina, ano y pene que se registran en todo el mundo. Dos genotipos de “bajo riesgo” (VPH 6 y 11) producen un elevado porcentaje de las displasias cervicales leves que se diagnostican con programas de detección y más del 90% de las verrugas genitales. 14.2. Cadena epidemiológica de la infección por papilomavirus el virus de papiloma humano es una infección de transmisión sexual, que puede transmitirse en las relaciones sexuales con o sin penetración, ya que infecta las mucosas genitales. esta es la razón de que el preservativo no sea totalmente eficaz en su prevención. aún así debe incidirse en la importancia del uso del preservativo en las relaciones sexuales, por la protección parcial frente a la infección por papilomavirus humano y por la protección frente a otras enfermedades. 14.3. Signos y síntomas de la infección por papilomavirus Por lo general, la incidencia máxima de las infecciones por VPH se registra entre las edades de 16-20 años. normalmente, las infecciones por VPH ceden espontáneamente, pero pueden persistir y provocar lesiones precancerosas del cuello uterino (Véase imagen 14). si no se las trata, esas lesiones pueden evolucionar y hacia un cáncer cervical en un lapso de 20-30 años. 149 GuÍa De Vacunas en la oficina De farMacia 1 AÑO HASTA 5 AÑOS MÁS DE 10 AÑOS Infección continua NCI tipo 2/3 Cáncer cérvix Infección inicial NCI tipo 1 Se estima que 28-40 millones de mujeres tienen lesiones premalignas. Se estima que el 1% de las mujeres infectadas desarrollan cáncer de cérvix. Infección remitente NCI: neoplasia cervical intraepitelial Imagen 14. Historia natural de la infección por VPH. Tomado y modificado de WHO. State of the World’s Vaccines and Immunization, 2002. los cambios precancerosos pueden detectarse en el cuello uterino durante el periodo de infección persistente por VPH; por ello, la detección precoz constituye una estrategia eficiente para prevenir el cáncer consiguiente la historia natural de las verrugas genitales es similar. Desde la infección inicial hasta el desarrollo de verrugas genitales pasan unos 20 meses. 150 T.14 Vacuna frente al PaPiloMaVirus HuMano Estadio 0 (carcinoma in situ) Clínica El carcinoma in situ es un cáncer muy temprano. Las células anormales se encuentran sólo en la primera capa de células que recubren el cuello uterino, y no invaden los tejidos más profundos del cuello uterino. I El cáncer afecta el cuello uterino, pero no se ha diseminado a los alrededores. I-a Una cantidad muy pequeña de cáncer, sólo visible por microscopio, se encuentra ya en el tejido más profundo del cuello uterino. Tratamiento 1 Conización. 2 Cirugía con rayo láser. 3 Procedimiento de escisión electroquirúrgica (LEEP). 4 Criocirugía. 5 Cirugía para eliminar el área cancerosa, cuello uterino y útero (total abdominal o histerectomía vaginal) para aquellas mujeres que no pueden o no desean tener niños. 1 Histerectomía abdominal total, con o sin salpingooforectomía bilateral. 2 Conización. 3 Histerectomía radical, con o sin disección de ganglios linfáticos). 4 Radioterapia. I-b Una cantidad mayor de cáncer se encuentra en dicho tejido. 1 Radioterapia. 2 Histerectomía radical ampliada con o sin radioterapia. II El cáncer se ha diseminado a áreas cercanas, pero aún se encuentra en el área pélvica. II-a El cáncer se ha diseminado fuera del cuello uterino a los dos tercios superiores de la vagina. 1 Radioterapia. El cáncer se ha diseminado al tejido alrededor del cuello uterino. 1 Radioterapia. El cáncer se ha diseminado a toda el área pélvica. Puede haberse diseminado a la parte inferior de la vagina, o infiltrar los uréteres. 1 Radioterapia. II-b III IV El cáncer se ha diseminado a otras partes del cuerpo. IV-a Diseminación a la vejiga o al recto. 2 Histerectomía abdominal total, con o sin salpingooforectomía bilateral. 2 Ensayos clínicos de nuevas formas de radioterapia/quimioterapia. 2 Ensayos clínicos de nuevas formas de radioterapia/quimioterapia. 1 Radioterapia. 2 Ensayos clínicos de nuevas formas de radioterapia/quimioterapia. IV-b Recurrente Diseminación a órganos distales como los pulmones. 1 Radioterapia para aliviar los síntomas como el dolor. El cáncer vuelve a aparecer después de haber sido tratado. Puede ocurrir en el propio cérvix o aparecer en otra localización. 1 Cirugía para extraer el colon inferior, el recto o vejiga (dependiendo del lugar al que se ha diseminado el cáncer) junto con el cuello uterino, útero y vagina (exenteración). 2 Quimioterapia. 2 Radioterapia y quimioterapia. 3 Si el cáncer ha recurrido fuera de la pelvis, se puede optar a una prueba clínica con quimioterapia sistémica Tabla 33. Estadios del cáncer cervicouterino y tratamiento. 151 GuÍa De Vacunas en la oficina De farMacia 14.4. Tratamiento de las infecciones por papilomavirus 14.4.1. Tratamiento del cáncer cervicouterino existen distintos tratamientos para el cáncer cervicouterino. se emplean tres clases de tratamiento: a) cirugía: • criocirugía. • cirugía con rayo láser. • conización para el tratamiento de cánceres tempranos del cuello uterino. • escisión electroquirúrgica (leeP). • Histerectomía. extirpación del útero. − Histerectomía vaginal. − Histerectomía abdominal. − Histerectomía radical. • exenteración si el cáncer se ha diseminado afuera del cuello uterino o los órganos femeninos, puede ser necesario extraer el colon inferior, recto o vejiga junto con el cuello uterino, útero y vagina. b) radioterapia. c) Quimioterapia. los tratamientos para cáncer cervicouterino dependerán de la etapa en que se encuentra la enfermedad, el tamaño del tumor, la edad, estado de salud general, y el deseo de tener hijos (Véase tabla 33). 14.4.2. Tratamiento de las verrugas genitales el tratamiento de las verrugas genitales puede ser largo, difícil y doloroso. Presenta una alta tasa de recurrencia y las lesiones permanecen infectivas mucho tiempo. son causa de angustia y ansiedad, provocan alteraciones emocionales y de la conducta sexual. Puede realizarse tratamiento farmacológico, pero el VPH no desaparece y la tasa de recurrencia es muy alta. los tratamientos quirúrgicos comprenden criocirugía, electrocauterización, terapia láser o escisión quirúrgica. si una persona sufre verrugas genitales, todos sus compañeros sexuales deben ser examinados por un médico y recibir tratamiento en caso de encontrárseles dichas verrugas. las mujeres que hayan tenido verrugas genitales y las mujeres cuyos compañeros sexuales alguna vez tuvieron este tipo de verrugas deben practicarse citologías vaginales al menos cada 6 meses. a las mujeres afectadas con verrugas en el cuello uterino, se les aconseja efectuarse citologías vaginales cada 3 meses después del tratamiento inicial. 152 T.14 Vacuna frente al PaPiloMaVirus HuMano 14.5. Epidemiología de la infección por papilomavirus se estima que la prevalencia de aDn del VPH en la población femenina oscila entre el 5-10% en los países desarrollados y en cifras ligeramente superiores al 15% en los países en vías de desarrollo. como ya se ha comentado, la prevalencia de aDn de VPH está asociada a la edad, siendo más alta en las edades inmediatas al inicio de las relaciones sexuales. en las poblaciones liberales, donde el número de compañeros sexuales distintos y ocasionales es elevado, la prevalencia puede ser tan elevada como del 3040% en los grupos de 15-25 años de edad. se ha observado un segundo pico de prevalencia en las mujeres postmenopáusicas. socialmente pueden identificarse grupos de alta prevalencia en la población de prostitución, en la población reclusa asociada al consumo de drogas y en los grupos infectados por el ViH. en términos de incidencia, el carcinoma cervical es el cuarto más frecuente en europa, mientras que en términos de mortalidad es el séptimo. esta diferencia refleja de forma indirecta la capacidad del cribaje para la realización de diagnósticos precoces y de tratamientos curativos. las asociaciones observadas entre la infección por VPH y el cáncer de cuello uterino están entre las más fuertes de las identificadas en cancerología humana, por lo que se puede hablar del VPH como causa necesaria de cáncer de cuello de útero. la presencia de aDn de los tipos fuertemente asociados a cáncer de cuello uterino se encuentra en cifras superiores al 85% en los tumores del canal anal, 70-80% en el cáncer de pene, 40-50% en el cáncer de vagina y también en gran número de cánceres de vulva en mujeres menores de 50 años y en una fracción de los casos de cáncer de la cavidad oral y orofaringe. De acuerdo con los últimos datos disponibles de mortalidad procedentes del instituto nacional de estadística (ine), en 2004 se registraron 538 fallecimientos por cáncer de cérvix, lo que supone una tasa ajustada por edad de 2 muertes/100.000 mujeres, con una edad media de defunción de 60,5 años. 14.6. Prevención de la infección por papilomavirus la principal forma de prevención frente al cáncer de cuello de útero es el cribado oportunista de cáncer de cuello uterino. en españa, en torno a un 75% de las mujeres se les ha realizado una citología en los últimos 3 años, aunque con importantes diferencias territoriales, sociales y de edad. la introducción de un programa de vacunación frente a VPH no eliminará la necesidad del cribado ya que el cáncer puede estar producido por otros tipos de VPH no incluidos en la vacuna, pero sí deberán adaptarse las recomendaciones sobre edad de inicio y frecuencia del mismo y la secuencia de utilización de otras pruebas diagnósticas. es importante recordar que la infección por VPH es una infección de transmisión sexual y que, aunque se introduzca la vacuna en calendario vacunal, no deben dejarse de usar las medidas preventivas, como el uso de preservativo, para evitar en la mayor medida posible la transmisión de estas enfermedades. 153 GuÍa De Vacunas en la oficina De farMacia 14.7. Vacuna frente al papilomavirus en los últimos años se ha investigado tanto en vacunas terapéuticas como en vacunas profilácticas frente al virus del papiloma humano. en la actualidad existen dos vacunas profilácticas comercializadas en españa: cervarix® y Gardasil®. cervarix® es una vacuna recombinante, adyuvada, adsorbida frente a los tipos 16 y 18 del VPH, mientras que Gardasil® es una vacuna recombinante adsorbida frente a los tipos 6, 11, 16 y 18 del VPH. De los tipos de VPH presentes en la vacuna, VPH 16 y 18 son responsables de aproximadamente el 70% de los casos de displasia cervical de alto grado (cin 2/3) y adenocarcinoma in situ (ais) y aproximadamente del 70% de los casos de displasia vulvar de alto grado (Vin 2/3) en mujeres jóvenes premenopáusicas. VPH 16 y 18 son también responsables de la mayoría de las lesiones vaginales escamosas de alto grado (Vin 2/3). VPH 6 y 11 son responsables de aproximadamente el 90% de los casos de verrugas genitales. VPH 6, 11, 16 y 18 son responsables del 35 al 50% de cin 1 o displasia cervical de bajo grado. 14.7.1. Inmunogenicidad y eficacia no se ha identificado el título mínimo de anticuerpos asociado con la protección frente a neoplasia cervical intraepitelial grados 2 ó 3 o frente a infección persistente asociada con los tipos de VPH de la vacuna. la administración de 3 dosis de vacuna frente al papilomavirus produjo la seroconversión al cabo de un mes frente a los tipos de VPH incluidos en la vacuna en más del 99% de las pacientes, observándose memoria inmunológica. se ha demostrado la eficacia de cervarix® y Gardasil® en ensayos clínicos controlados, doble ciego, aleatorizados de fase ii y iii, que incluyeron un total de 19.778 mujeres de 15 a 25 años de edad (cervarix®) y 20.541 mujeres de 16 a 26 años de edad (Gardasil®), comprobándose su eficacia para prevenir infección persistente al cabo de 12 meses y la protección frente a neoplasias cervicales intraepiteliales de grado 2-3. 14.7.2. Indicaciones, pautas y vías de administración cervarix® está indicada para la prevención de las lesiones cervicales premalignas y cáncer de cérvix relacionados causalmente con los tipos 16 y 18 del VPH. se ha demostrado su eficacia en mujeres de 15-25 años, y su inmunogenicidad en niñas y adolescentes de 10-25 años. Gardasil® está indicada para la prevención de las lesiones genitales precancerosas (cervicales, vulvares y vaginales), cáncer de cerviz y verrugas genitales externas (condiloma acuminata) relacionadas causalmente con los tipos 6, 11, 16 y 18 del VPH. se ha demostrado su eficacia en mujeres de 16-26 años, y su inmunogenicidad en niñas y adolescentes de 9-15 años. recientemente el consejo interterritorial de salud ha recomendado la inclusión de la vacuna del papilomavirus humano en los calendarios vacunales de las distintas comunidades autónomas en una única cohorte, entre los 11 y 14 años de edad, antes de finales de 2010. ambas vacunas se administran mediante inyección intramuscular en deltoides o en la zona anterolateral superior del muslo. se deben administrar 3 dosis en pauta 0, 1 y 6 meses (cervarix®) o 0, 2 y 6 meses (Gardasil®). no debe emplearse la vía intravascular o intradérmica. al no existir datos relativos a la intercambiabilidad de las vacunas frente a papilomavirus, se recomienda utilizar la misma vacuna para la primera inmunización y para las dosis siguientes. 154 T.14 Vacuna frente al PaPiloMaVirus HuMano 14.7.3. Contraindicaciones y precauciones las vacunas contra el VPH no deben usarse en caso de hipersensibilidad a cualquier componente de las mismas, y se recomienda posponerla en mujeres que padezcan una enfermedad febril aguda y grave (esto no es necesario en infecciones leves). la vacunación no es un sustituto del cribado rutinario del cáncer de cérvix ni de la toma de precauciones frente a la exposición al VPH o a las enfermedades de transmisión sexual. se recomienda por tanto seguir con las medidas habituales de protección frente a enfermedades de transmisión sexual. la vacuna no ha mostrado tener un efecto terapéutico. se desconoce su eficacia en inmunodeprimidos. tampoco se ha estudiado su compatibilidad con otras vacunas, si bien se puede administrar concomitantemente con la vacuna frente a la hepatitis B (VHB). el uso de anticonceptivos hormonales no afectó a la respuesta inmune a esta vacuna. no se han realizado estudios específicos de la vacuna en mujeres embarazadas. aunque los datos obtenidos no sugieren ningún problema de seguridad, son insuficientes para recomendar el uso de vacuna frente a VPH durante el embarazo. la vacunación, por tanto, se debe posponer hasta después del término del embarazo. la inmunogenicidad de la vacuna fue comparable en las mujeres en periodo de lactancia y en las que no estaban en periodo de lactancia durante la administración de la vacuna. 14.7.4. Reacciones adversas las reacciones adversas suelen ser de naturaleza local, asociadas a la propia vía de administración, como dolor, hinchazón, prurito o eritema en el lugar de la inyección. es también frecuente que aparezca fiebre. en ensayos clínicos se han descrito también cefaleas, mialgia, náuseas y vómitos, diarrea, dolor abdominal, dolores articulares y musculares o cansancio. en raras ocasiones se ha descrito urticaria o broncoespasmo. 14.7.5. Vacunas frente a papilomavirus comercializadas Código nacional 659685.2 Nombre Cervarix 659686.9 658978.6 Descripción 40 μg 1 jeringa precargada 0,5 ml 40 μg 10 jeringas precargadas 0,5 ml Gardasil 120 μg 1 jeringa precargada 0,5 ml Composición Proteínas L1 del virus del papiloma humano, tipos 16 y 18, adyuvadas con 3-O-desacil-4’monofosforil-lípido A, adsorbidas en hidróxido de aluminio hidratado. Proteínas L1 del virus del papiloma humano, tipos 6, 11, 16 y 18, adsorbidas en hidroxifosfato sulfato de aluminio amorfo. Tabla 34. Vacunas anti-papilomavirus comercializadas en España. ambas vacunas deben conservarse en nevera (entre 2-8 °c) y conservar la jeringa recargada en el embalaje exterior para protegerlo de la luz. no congelar. 155 GUÍA DE VACUNAS EN LA OFICINA DE FARMACIA TEMA 15 Vacunación en situaciones de post-accidente o exposiciones inevitables GuÍa De Vacunas en la oficina De farMacia 15.1. Vacunación antitetánica si bien el objetivo de este capítulo es el de profundizar en la actitud ante la profilaxis postexposición, sin embargo merece la pena recordar dos aspectos fundamentales de la enfermedad. el primero de ellos lo centraríamos en recordar que el tétanos es una enfermedad de declaración obligatoria, que no requiere aislamiento, ni cuarentena, ni desinfección concomitante, así como tampoco inmunización de contactos, pero es aconsejable que la investigación de la fuente esté siempre presente. su distribución es mundial, declarándose en españa entre 30-40 casos al año. la mayoría de ellos se dan en población adulta no vacunada previamente; raramente se presentan casos en menores de 20 años, aumentando la frecuencia de éstos conforme aumenta la edad. el segundo aspecto a destacar sería que la Vii conferencia internacional de tétanos apoya el objetivo primordial de la conferencia europea de la oMs de eliminar el tétanos neonatal en la región europea para este año y sugiere que se adopten medidas de inmunización activa con el fin de minimizar el número de adultos que permanezcan susceptibles a tétanos. Deja también patente que el tétanos es una enfermedad prevenible con las vacunas disponibles en la actualidad, por lo que se insta a todos los países para que se pueda erradicar, al menos en su forma de tétanos neonatal. se insiste también en la importancia de que se continúe la investigación destinada a mejorar y simplificar las estrategias y los métodos de prevención del tétanos. estas dos ideas son claves para justificar la necesidad de inmunizar a la población adulta, población sobre la que podemos hacer una búsqueda activa de sujetos no inmunizados y proceder a vacunarles, lo cual sería muy difícil a la par que costoso. Y el otro planteamiento sería proceder a inmunizar de forma adecuada a todos aquellos sujetos que requieran una profilaxis post-exposición. no hay que olvidar que el tétanos es más común en las regiones agrícolas y en las zonas subdesarrolladas donde existe la mayor posibilidad de contacto con la excreta de animales y donde la inmunización es inadecuada o no existe, echo que con frecuencia se puede observar en nuestro país. Dado que la mayoría de los casos acontecen en la población adulta y que además la mortalidad de los mismos es muy elevada, esto ha hecho que los estudios de seroprevalencia adquieran una especial relevancia. todos ellos ponen de manifiesto que las tasas de seroprotección en adultos son muy bajas oscilando entre el 12-50% según los diferentes estudios, y obedeciendo estas diferencias a los diferentes grupos de edad con los que se han realizado los estudios; de hecho las cifras más bajas obedecen a los estudios realizados en población mayor de 65 años, por lo que una vez más reiteramos la importancia de que hay que llevar programas de prevención dirigidos hacia la población adulta. esto evitaría tener que actuar con cierta urgencia en situaciones ante accidentes, traumatismos etc. como es lógico la prevención frente a tétanos debe realizarse pre-exposición mediante los programas de inmunización infantil, dejando para la profilaxis post-exposición el menor número de casos. Para ello es importante que además de que se complete el calendario vacunal se cumpla la revacunación de la población adolescente y adulta cada 10 años. en el caso de que estos dos escalones no se hayan realizado correctamente nos encontramos ante la necesidad de vacunar a aquellos sujetos que requieren asistencia sanitaria por un determinado problema y que sean susceptibles de contraer la enfermedad. entramos por tanto de lleno en la profilaxis post-exposición. De forma habitual la profilaxis post-exposición de tétanos se realiza en el momento actual con la vacuna antidifteria-tétanos del adulto (dt). esta vacuna contiene los toxoides diftérico y tetánico, obtenidos mediante tratamiento con formaldehído de las toxinas del Clostridium tetani y del Corynebacterium diphtheriae adsorbidas en hidróxido de aluminio. la vía de administración es intramuscular. la vacuna es eficaz y segura siendo sus indicaciones en nuestro país las siguientes: a) inmunización activa en niños a partir de los 7 años de edad. b) Vacunación primaria de personas no vacunadas previamente frente a tétanos y difteria, aplicándose en estos una pauta vacunal de 0 – 1 ó 2 meses – 6 ó 12 meses. 158 T.15 Vacunación en situaciones De Post-acciDente o exPosiciones ineVitaBles c) finalización del ciclo primario de vacunación en personas que no completaron el mismo antes de los 7 años de edad. d) Dosis de recuerdo, a administrar cada 10 años a partir de la última dosis, en aquellos casos en los que se completó correctamente el ciclo de vacunación primaria. e) Profilaxis tetánica en el caso de heridas, con o sin administración simultánea de inmunoglobulina antitetánica, dependiendo del tipo de herida y de los antecedentes vacunales del paciente. Vacunas Td Código Nacional Nombre Descripción Composición 656756.2 Diftavax 40/4 UI 1 jeringa precargada 0,5 ml Toxoide diftérico y toxoide tetánico adsorbidos en hidróxido de aluminio. 917641.9 Ditanrix 20/2 UI 1 jeringa precargada 0,5 ml Toxoide diftérico y toxoide tetánico adsorbidos en hidróxido de aluminio. Vacunas dTpa Código nacional 731349.6 Nombre Boostrix Descripción 1 jeringa precargada 0,5 ml Composición Toxoide diftérico, toxoide tetánico y fracción antigénica de pertussis (toxoide pertúsico, hemaglutinina filamentosa y pertactina) adsorbidos en hidróxido y fosfato de aluminio. Tabla 35. Vacunas antitetánicas utilizadas en exposición accidental o como recuerdo. a finales del año 2000 se autorizó en españa una vacuna combinada frente a difteria, tétanos y tos ferina acelular, para adolescentes y adultos con el nombre comercial de Boostrix®. la vacuna dtpa contiene los siguientes ingredientes activos por dosis (0,5 ml): a) toxoide diftérico: al menos 2 ui (2,5 lf). b) toxoide tetánico: al menos 20 ui (5 lf). c) antígenos de Bordetella pertussis (pa): • toxina pertúsica detoxificada: 8 mg. • Hemaglutinina filamentosa tratada con formalina: 8 mg. • Pertactina tratada con formalina: 2,5 mg. la vacuna dtpa está indicada para la vacunación de recuerdo frente a difteria, tétanos, y tos ferina a partir de los 4 años de edad. no está indicada para la inmunización primaria. se puede utilizar en lugar de la vacuna combinada antidiftérica y antitetánica tipo adulto (dt), cuando se desee administrar una dosis de recuerdo frente a tos ferina. no debe vacunarse con dtpa a aquellos individuos con una historia incompleta o sin historia de serie primaria de vacunación con los toxoides diftérico y tetánico. no está contraindicada en sujetos con historia incompleta o sin historia de vacunación previa frente a tos ferina, pero sólo se inducirá respuesta de recuerdo en sujetos que hayan sido previamente inmunizados mediante vacunación o infección natural. esta vacuna todavía no se ha estudiado en sujetos con heridas potencialmente tetanígenas, por lo que la indicación es esta circunstancia no se ha podido establecer. 159 GuÍa De Vacunas en la oficina De farMacia 15.2. Vacunación antirrábica afortunadamente, en españa no se han declarado casos de rabia humana desde 1995, si bien no podemos descuidar nuestra atención ante una enfermedad que constituye un importante problema de salud Pública en nuestro medio. la rabia, que sólo afecta al hombre de forma secundaria, previo contacto con animales, es fiel reflejo de la distribución de la enfermedad en los animales y del grado de contacto del hombre con estos. es por ello, importante conocer la distribución de la rabia en animales que, en el caso de nuestro país, no hay casos en mamíferos terrestres infectados desde 1975, excepto en ceuta y Melilla, pero sí que se han detectado casos en murciélagos, los últimos en 1987. en cuanto a la vacuna antirrábica, si bien tiene unas indicaciones especiales a la hora de la profilaxis preexposición, su utilización, escasa pero vital, se da en la profilaxis post-exposición. Hay varias consideraciones a la hora de realizar las indicaciones de vacunación antirrábica. una de ellas hace referencia según el área en el que nos encontremos. en el caso de nuestro país como ya hemos dicho se puede considerar un área libre de rabia por lo que las indicaciones son las siguientes. a) Prevención pre-exposición en sujetos con alto riesgo por motivos laborales. b) Viajeros que vayan a permanecer más de un mes en zonas endémicas donde corra el peligro de no recibir tratamiento adecuado, sobre todo en el caso de niños. c) Profilaxis post-exposición. en el caso que nos ocupa de la profilaxis post-exposición sólo está indicada si realmente se ha producido exposición, entendida ésta como cualquier circunstancia que permita la entrada del virus en el organismo, a través de soluciones de continuidad de la piel o membranas mucosas. la probabilidad de la infección varía según la naturaleza de la exposición, distinguiéndose entre mordedura y no mordedura. a) Mordeduras. entendemos por mordedura la penetración de la piel por los dientes del animal. el riesgo depende de la especie animal que esté involucrada, el porcentaje de animales infectados, la cepa infectante, la concentración del virus en saliva, la localización y gravedad de la herida, y de una serie de factores dependientes del huésped, como su estado general de salud, el estado inmunológico, concentración de receptores en la zona de la herida, etc. b) no mordeduras. en el caso de que no se produzcan mordeduras, se han podido producir arañazos o abrasiones, lesiones que han podido dañar a mucosas con entrada de saliva probablemente contaminada. también merecen tener una consideración especial a la hora de plantearnos nuestra actuación. la primera actuación en la profilaxis post-exposición es la de hacer un tratamiento local de la herida que debe de ir orientada a la limpieza y lavado de la misma con agua y jabón. este hecho tan simple llega a reducir el riesgo de la enfermedad hasta en un 90%. tendremos que considerar la necesidad de profilaxis antibiótica y antitetánica para proceder a ello si fuera necesario. otro aspecto clave en el tratamiento de la herida, y que no se debe olvidar, es que nunca debe suturarse la herida, ya que se podría acelerar la expansión del virus y su entrada en las terminaciones nerviosas. De forma simultánea al tratamiento de la herida, se debe proceder a la administración de la inmunoglobulina (Véase tabla 36), dentro de las primeras 24 horas, que nos confiere una protección de unos 21 días, por lo que es necesario empezar la inmunización activa con la vacuna lo antes posible. en el caso de haber recibido la vacuna de rabia en los 5 años anteriores no es necesaria la vacunación. la dosis recomendada de inmunoglobulina humana son 20 ui/ kg. se debe infiltrar la mayor cantidad posible alrededor de la herida y el resto por vía intramuscular en la región glútea. Buscamos por tanto con la iG generar la producción de anticuerpos tanto de forma general como local de manera que evitemos que el virus penetre en las terminaciones nerviosas periféricas y que pueda progresar al snc. 160 T.15 Vacunación en situaciones de post-accidente o exposiciones ineVitables Código nacional 903922.6 Nombre Descripción Imogan Rabia 300 UI 1 vial 2 ml Tabla 36. Inmunoglobulinas específicas antirrábicas comercializadas en España. por último, y como ya hemos dicho antes, habrá que proceder a la inmunización activa de forma casi simultánea con la vacuna, siendo su posología y vía de administración las siguientes: 5 dosis de 1 ml con la pauta 0-3-7-14 y 30 días por vía intramuscular, en la cara anterolateral del muslo en los niños (la edad mínima de aplicación son los 12 meses) y en el deltoides en los adultos. presentamos el esquema de vacunación en la siguiente tabla, atendiendo al tipo de lesión o puerta de entrada. Lameduras sobre piel intacta • No hacer nada. Mordeduras de piel descubierta, arañazos o erosiones leves sin sangrado. • Zonas de alto riesgo: vacunación inmediata. • Zonas de bajo riesgo: se puede esperar, haciendo observación directa del animal si es doméstico; en caso de no serlo habría que sacrificarlo. Si el animal sigue sano tras 10 días de observación veterinaria o si las muestras analizadas de los animales sacrificados son negativas, no será necesario vacunar al paciente. Mordeduras o arañazos con lesión de mucosas y sangrado • Zonas de alto riesgo: vacunación inmediata con administración de Ig específica. • Zonas de bajo riesgo: se puede esperar, haciendo observación directa del animal si es doméstico; en caso de no serlo habría que sacrificarlo. Si el animal sigue sano tras 10 días de observación veterinaria o si las muestras analizadas de los animales sacrificados son negativas, no será necesario vacunar al paciente. Tabla 37. Pautas de actuación para la prevención antirrábica. es necesario conocer que la vacuna antirrábica no está exenta de efectos secundarios entre los que merece la pena destacar los siguientes: a) ligeras reacciones locales a las 24-48 horas de la administración. b) Reacciones sistémicas en el 20% de los vacunados: cefaleas, fiebre, mialgias, vómitos. c) complicaciones neurológicas en 1/150.000-500.000 dosis administradas. d) Reacciones alérgicas con dosis de recuerdo. Código nacional 653979.8 Nombre Descripción Vacuna antirrábica Merieux 2,5 UI vial liofilizado + jeringa precargada disolvente Composición Virus de la rabia inactivados, cepa Wistar Rabies PM/WI38-1503-3M, cultivados en células diploides humanas. Podría contener trazas de neomicina. Tabla 38. Vacunas antirrábicas comercializadas en España. 161 GuÍa De Vacunas en la oficina De farMacia 15.3. Profilaxis post-exposición de picaduras de arañas y serpientes en este apartado, más que hacer unas recomendaciones para cada tipo de araña o serpiente, vamos a plantear una serie de recomendaciones generales que hay que tener presente ante este tipo de problema. en primer lugar, no hay que llevar un suero antiveneno, ya que por lo que general requieren una conservación a temperaturas que difícilmente podremos mantener, y además con frecuencia en los lugares donde vayamos dispondrán de sueros específicos de mayor utilidad que los que podamos conseguir en nuestro medio, ya que habitualmente los sueros suelen conseguirse en cada país y no es fácil disponer en españa de sueros para serpientes de asia o África. Por otra parte la mayoría de estos sueros requieren una administración con observación de un especialista sanitario que supervise cuidadosamente la misma. es más conveniente por tanto prevenir o hacer todo lo posible por prevenir la mordedura, y llevar en nuestro botiquín algunos medicamentos que puedan ser de ayuda en el caso de mordedura, hasta que se consiga el suero antiveneno. entre los consejos generales para la prevención de la mordedura podemos destacar los siguientes: a) las serpientes no suelen atacar a los hombres salvo que se las moleste. Por lo tanto debemos dejarlas en paz y no introducir objetos, palos etc. en agujeros en zonas de hierbas altas o de arenas profundas. b) llevar ropa adecuada que nos proteja o que impida dejar al aire zonas del cuerpo que sean fácilmente vulnerables a las picaduras o mordeduras. no olvidemos que aunque estemos en zonas tropicales con un clima cálido estamos expuestos a riesgos poco frecuentes en nuestro medio, por lo que llevar sandalias o pantalones cortos no es nada recomendable. c) evitar caminos oscuros o poco transitados. es importante que nuestro afán aventurero no nos ponga en peligro. con frecuencia los habitantes del lugar saben por dónde debemos ir y por lo tanto no deben explorarse zonas desconocidas solos, por el riesgo de caer enfermos o sufrir un accidente. como actuación para este tipo de problemas aconsejamos la administración de un tranquilizante o ansiolítico que calme al accidentado hasta su traslado, siempre que no provoque una depresión de su estado de conciencia. no debemos utilizar analgésicos que tengan efectos anticoagulantes ya que pueden ser perjudiciales y provocarían una hemorragia; en el caso concreto de la picadura de arañas puede ser útil la administración de anestesia local en la zona de la picadura ya que con frecuencia son muy dolorosas y en algunos casos puede ser necesario la realización de un torniquete que impida la diseminación del veneno, ahora bien teniendo el cuidado necesario que requiere siempre este tipo de maniobra. otro tipo de maniobras son la inmovilización de la extremidad que ha sufrido la mordedura o picadura, si podemos mediante férula. evitaremos otro tipo de maniobras y deberemos trasladar al enfermo al hospital más próximo. como medida importante intentaremos llevar siempre que sea posible el animal que ha producido la mordedura o picadura. 162 GUÍA DE VACUNAS EN LA OFICINA DE FARMACIA TEMA 16 Vacunación en viajeros GuÍa De Vacunas en la oficina De farMacia en la actualidad se realizan un número cada vez mayor de desplazamientos fuera de las fronteras del lugar de origen del viajero, ya sea por motivos profesionales, de ocio o por razones humanitarias. esto incluye un gran incremento en el porcentaje de viajes desde países desarrollados a zonas exóticas. este hecho, junto con la capacidad de viajar grandes distancias en tiempos muy cortos gracias a los modernos medios de transporte, ha aumentado la exposición de los viajeros a enfermedades tropicales y ha posibilitado la llegada de casos de estas enfermedades a los países más desarrollados. la generalización de los viajes internacionales a personas de cualquier edad, hace que se deba prestar especial atención a grupos de población concretos como los niños pequeños y recién nacidos, los viajeros de mayor edad, que pueden tener asociada alguna patología de base, o los inmigrantes que, o bien regresan a sus países de origen, o bien vuelven a sus países de trabajo, y que tienen unas características epidemiológicas particulares. todo viajero debería conocer los riesgos potenciales para la salud en los países a los que viaja y aprender a minimizarlos mediante una buena información y planificación previa, adecuadas medidas preventivas y seguimiento de las medidas higiénicas oportunas. las medidas individuales aplicadas en viajeros, desde el punto de vista de la salud Pública, no tienen repercusión en el control de las enfermedades en la población. sin embargo, tienen un carácter de prevención individual. 16.1. Epidemiología la organización Mundial de la salud (oMs) publica anualmente una guía sanitaria para viajes internacionales (International Travels and Health) en inglés y francés, que es traducida al castellano por el Ministerio de sanidad y consumo. en esta guía se informa de la situación epidemiológica de todos los países del mundo, de las medidas preventivas generales que se deben emplear en los viajes internacionales, de las medidas de prevención individual, como la vacunación obligatoria o recomendada en cada país, y de la quimioprofilaxis recomendada. los principales factores a tener en cuenta a la hora de evaluar el riesgo para la salud en un viaje internacional son: a) Destino. b) Duración de la estancia. c) estación del año en el lugar de destino en la que se produce el viaje. d) Motivo del viaje: trabajo, turismo, aventura. e) tipo de alojamiento. f) Higiene de los alimentos. g) conducta del viajero. h) estado de inmunización anterior del viajero. i) características inmunológicas individuales. j) estado de salud previo del viajero. 164 T.16 Vacunación en Viajeros un viaje a un destino donde el alojamiento sea de calidad y las condiciones higiénico-sanitarias sean de alto nivel no supone un incremento significativo del riesgo para la salud en viajeros sin enfermedad pre-existente. Por el contrario, los destinos donde el alojamiento es de mala calidad y la higiene es inadecuada, donde no hay agua potable, ni recursos médicos accesibles, pueden suponer un riesgo grave para la salud del viajero. se debe tener en cuenta la epidemiología de las enfermedades infecciosas en los países de destino, puesto que se pueden producir brotes epidémicos de alguna enfermedad tras circunstancias especiales, como catástrofes naturales o conflictos bélicos, que resultan muy difíciles de predecir y suponen un importante riesgo para el viajero. 16.2. Consejos sanitarios a viajeros antes de realizar un viaje internacional a un destino en un país en vías de desarrollo, el viajero debe acudir a un centro especializado en Viajes Internacionales y Medicina del Viajero. esta consulta debe producirse idealmente como mínimo de 4-6 semanas antes del inicio del viaje, ya que muchas de las pautas de vacunación o quimioprofilaxis requieren de este tiempo para ser efectivas. los profesionales de estos centros realizarán recomendaciones de vacunación y profilaxis en función de las características del viaje, las particularidades del viajero, la disponibilidad de profilaxis o tratamiento para cada enfermedad en destino, el acceso a servicios médicos y los riesgos para la salud Pública asociados. las mujeres embarazadas que estén en buen estado de salud y no presenten complicaciones en su embarazo no tienen contraindicado viajar, siempre que no esté próxima la fecha del parto y que no se viaje a zonas sin acceso a servicios sanitarios, a zonas endémicas de paludismo o a zonas situadas a grandes altitudes. se debe tener especial cuidado en la administración de vacunas durante el embarazo, especialmente aquellas vacunas de microorganismos vivos atenuados, así como en el uso de cualquier tipo de medicación que deba ser siempre prescrita por un médico. las vacunaciones y la profilaxis antipalúdica son especiales en el caso de recién nacidos y niños pequeños, que además son especialmente sensibles a la deshidratación, a la radiación ultravioleta, a los cambios de presión y de altitud. aquellas personas con enfermedades crónicas deben pedir consejo médico previo a la organización del viaje. estos viajeros deben llevar la medicación en su equipaje de mano, teniendo en cuenta la duración del viaje que van a realizar, junto con los datos de su médico, detalles de la medicación y dosis prescritas y un certificado médico justificando la necesidad de los medicamentos o material sanitario para pasar las aduanas. es recomendable un examen médico al regreso del viaje para comprobar que no existen infecciones o trastornos adquiridos como consecuencia del desplazamiento. en los viajes en avión, los efectos negativos del estancamiento de la sangre en las piernas provocado por la inmovilidad prolongada, que puede resultar peligroso en viajeros con factores de riesgo para desarrollar trombosis venosa, puede disminuirse realizando ejercicios simples que estimulen la circulación a lo largo del vuelo. otro efecto bien conocido de los viajes en avión es el “jet-lag” o alteración de los biorritmos circadianos, especialmente de las pautas de sueño. los viajeros que toman medicación pautada (por ejemplo, insulina) deben consultar a su médico. Para reducir los efectos del “jet-lag” se recomienda beber mucha agua, descansar antes del viaje, tomar comidas ligeras y limitar el consumo de alcohol. está contraindicado viajar en avión para los pasajeros que se encuentren en alguna de las situaciones siguientes: a) niños menores de 7 días. b) Mujeres en las últimas 4 semanas de embarazo (8 en embarazos múltiples) y hasta 7 días después del parto. 165 GuÍa De Vacunas en la oficina De farMacia c) angina de pecho o dolor torácico en reposo. d) enfermedad contagiosa grave y aguda. e) enfermedad de descompresión después de bucear o haber buceado en las 24 horas anteriores. f) Presión intracraneal incrementada por hemorragia, traumatismo o infección. g) infecciones de los senos, oído y nariz, especialmente si hay bloqueo de la trompa de eustaquio. h) infarto de miocardio o ictus reciente. i) cirugía o lesión reciente donde pueda alojarse aire atrapado, especialmente trauma abdominal y cirugía gastrointestinal, lesiones cráneo-faciales y oculares, operaciones cerebrales y operaciones oculares con penetración del globo. j) enfermedad respiratoria crónica grave, dificultad respiratoria en reposo o neumotórax no resuelto. k) anemia falciforme. l) Hipertensión arterial no controlada de más de 200 mmHg de presión sistólica. m) enfermedad psiquiátrica reciente. se han detectado brotes de rubéola, varicela, meningitis meningocócica, hepatitis a, legionelosis y enfermedades gastrointestinales en viajeros en barco. cambios bruscos de temperatura y humedad pueden originar una rápida pérdida de agua y electrolitos, por lo que hay que beber abundante líquido. las dermatofitosis y las irritaciones cutáneas pueden agravarse con el calor y la humedad. la altitud puede provocar hipoxia por la reducción de la presión de oxígeno, pudiendo producir el mal de altura: hipoxia aguda, debilidad y pérdida del conocimiento, pudiendo llegar a edema pulmonar y cerebral. se recomienda realizar períodos de adaptación a alturas progresivas y, si se padece algún trastorno, descender, puesto que el descenso se acompaña de un restablecimiento inmediato. los viajeros con enfermedad cardiovascular o pulmonar previa o anemia son muy sensibles a los cambios de altitud. la exposición a la radiación ultravioleta puede ocasionar quemaduras o incluso insolación en personas sensibles. los efectos adversos a largo plazo incluyen desarrollo de cáncer de piel y envejecimiento acelerado de la epidermis. se recomienda una adaptación lenta con períodos de exposición progresivos, el uso de cremas protectoras, sombrero y gafas de sol. el uso de aguas costeras, ríos y lagos de agua dulce con fines recreativos puede presentar riesgos para la salud por la posibilidad de infección por ingestión, inhalación o contacto con bacterias, hongos, parásitos o virus patógenos, el envenenamiento en aguas contaminadas con sustancias químicas o por picaduras o mordeduras de animales venenosos. se recomienda tomar precauciones al nadar o pescar en aguas que puedan estar contaminadas, restringir los baños a zonas seguras o piscinas cloradas y caminar con un calzado adecuado. Deben tomarse precauciones especiales con las mordeduras de animales en zonas endémicas de rabia. Para evitar picaduras de serpientes, arañas y escorpiones debe utilizarse calzado cerrado y revisar su interior antes de ponérselo. los insectos pueden producir la transmisión de un gran número de enfermedades infecciosas, entre ellas el paludismo. Para minimizar este riesgo se deben emplear repelentes de insectos, ropas de protección, sprays y redes mosquiteras impregnadas con insecticida. 166 T.16 Vacunación en Viajeros Gran cantidad de enfermedades infecciosas se transmiten a través de agua y alimentos contaminados. el principal problema sanitario asociado es la diarrea del viajero, que puede afectar hasta al 80% de los viajeros en algunos destinos de riesgo. una gran variedad de bacterias, virus, parásitos y hongos pueden ser causantes de diarrea en el viajero. Para minimizar la exposición a este riesgo los viajeros deben evitar el consumo de alimentos y bebidas potencialmente contaminados, como: a) alimentos cocinados que se hayan mantenido a temperatura ambiente; b) alimentos no cocinados; c) frutas y verduras con la piel íntegra; d) alimentos que contengan huevo crudo o poco cocinado; e) alimentos vendidos en puestos callejeros; f) helados de origen no seguro; g) aguas de origen y seguridad dudosa. se recomienda igualmente evitar la utilización de cubitos de hielo y el cepillado de los dientes con estas aguas. se debe tener especial precaución con pescados y mariscos que puedan tener biotoxinas, y hervir la leche pasteurizada. Para evitar la deshidratación, se recomienda aumentar la ingesta de líquidos y si la diarrea continúa más de un día se debe tomar suero de rehidratación oral (sro). si no se dispone de sro se puede sustituir con una solución de 6 cucharillas de azúcar y 1 de sal, una pizca de bicarbonato sódico y el zumo de un limón en un litro de agua segura. la pauta sería la siguiente: a) niños menores de 2 años: 50-100 ml después de cada deposición. b) niños de 2-10 años: 100-200 ml después de cada deposición. c) niños mayores de 10 años y adultos: cantidad ilimitada. si la diarrea persiste más de 3 días, hay presencia de sangre en las deposiciones, vómitos repetidos o fiebre, se debe recurrir a ayuda médica. se puede reducir el riesgo de infección evitando el contacto con sangre u otros fluidos corporales, y con agujas y jeringuillas no esterilizadas, incluyendo utensilios de acupuntura, piercing y tatuajes. en este apartado hay que prestar especial atención a las transfusiones de sangre. en un viaje internacional, una transfusión de sangre se limitará a urgencias médicas con pérdida masiva de sangre. 16.3. Enfermedades prevenibles con vacunas la vacunación es un método muy eficaz para prevenir determinadas enfermedades infecciosas. Por lo general son muy seguras y producen muy pocas reacciones adversas. el viajero siempre debe tener en cuenta que pese a la alta eficacia de las vacunas, siempre existe cierto riesgo de contraer las enfermedades frente a las que se ha vacunado. Por ello nunca se debe olvidar la importancia de las demás medidas preventivas y de higiene. 167 GuÍa De Vacunas en la oficina De farMacia la oMs proporciona la información regularmente actualizada de las recomendaciones sobre las vacunas de uso rutinario: difteria, tétanos, pertussis, Haemophilus influenzae tipo B, hepatitis B, papilomavirus humano, gripe, sarampión, paperas, rubeola, enfermedad neumocócica, poliomielitis, rotavirus, tuberculosis y varicela. 16.3.1. Vacunas de uso selectivo estas vacunas se deben administrar sólo a aquellos viajeros que se dirigen a destinos específicos. la decisión de recomendar la vacuna dependerá de la valoración individual del riesgo: cólera, hepatitis a, encefalitis japonesa, enfermedad meningocócica, rabia, encefalitis de tick-Borne, fiebre tifoidea y fiebre amarilla. 16.3.2. Vacunas de uso obligatorio el viajero debe ser consciente de que el hecho de que un país no exija la vacunación obligatoria de una enfermedad, no significa que no exista riesgo de exposición en ese país. a) fiebre amarilla. algunos países en los que no hay fiebre amarilla, pero está presente el mosquito vector y los huéspedes primates no humanos, exigen certificado de vacunación de fiebre amarilla a los viajeros. es válida desde 10 días después de la vacunación durante 10 años. si la vacunación está contraindicada en el viajero por razones médicas, se requiere un certificado médico de exención. la oMs publica anualmente el listado de países en los que se exige el certificado. b) enfermedad meningocócica. arabia saudita exige certificado de vacunación con la vacuna tetravalente (a, c, Y y W-135) en los peregrinos que visitan la Meca. c) Poliomielitis. algunos países libres de poliomielitis exigen a los viajeros esta vacunación para la obtención del visado. 16.4. Grupos de vacunación especiales a) lactantes y niños pequeños. Puesto que muchas de las vacunas existentes no se pueden administrar a niños muy pequeños, es esencial que se extremen las precauciones para asegurar su protección frente a riesgos sanitarios mediante otras medidas preventivas. es importante asegurarse de que sus vacunaciones rutinarias son correctas y están completamente actualizadas. b) adolescentes y adultos jóvenes. son el grupo más numeroso y el más expuesto a las enfermedades de transmisión sexual. suelen disponer de presupuestos más limitados y usan alojamientos de peor calidad. se debe insistir en una correcta vacunación y empleo de medidas preventivas. c) Viajeros frecuentes. los viajeros frecuentes suelen descuidar la actualización de sus vacunaciones. d) Viajeros de última hora. se debe recomendar a estos viajeros, cooperantes, trabajadores de ayuda a emergencias, que mantengan siempre actualizada su cartilla de vacunación, para evitar la vacunación múltiple en poco tiempo y las pautas incompletas. e) embarazo. las vacunas vivas están generalmente contraindicadas por el riesgo teórico para el feto. las vacunas de sarampión, paperas, rubeola, tuberculosis y fiebre amarilla se deben evitar también en el embarazo. se debe recomendar a las mujeres embarazadas no viajar a zonas con riesgo de exposición a fiebre amarilla. las vacunas de toxoides y polisacáridos muertos o inactivados no están contraindicadas en condiciones normales en el embarazo, al igual que la vacuna de polio oral. f) Viajeros mayores. Hay que tener especial cuidado con la potencial presencia de patología médica preexistente y la posibilidad de que tengan un precario estado vacunal o que no se hayan vacunado nunca. se debe ofrecer a estos 168 T.16 Vacunación en Viajeros sujetos una serie primaria completa de vacunación frente a difteria, tétanos, poliomielitis y hepatitis B. también hepatitis a a los sujetos no inmunes. se recomienda la vacuna de gripe y neumococo en viajeros mayores. g) Viajeros con problemas médicos crónicos. en viajeros con patología crónica que implique deterioro en la inmunidad, se pueden producir complicaciones severas tras la vacunación con vacunas de microorganismos vivos, por lo que deben evitarse. se debe llevar un certificado de exención médica de la vacuna de fiebre amarilla. en viajeros con enfermedades cardiovasculares y/o respiratorias crónicas, o diabetes mellitus, se recomienda la vacunación anual frente a la gripe. en viajeros con bazo no funcional deben administrarse adicionalmente vacunas frente a Hib, meningitis (c, a + c o tetravalente), neumococo y gripe. h) Viajeros ViH + e inmunocomprometidos. la efectividad de la inmunización se ve reducida en algunas personas ViH +, pero el riesgo de efectos adversos graves sigue siendo bajo. los niños ViH + asintomáticos deben ser inmunizados según los programas rutinarios. en personas ViH + sintomáticas se puede administrar la vacuna de polio oral, pero debe prestarse atención con la vacuna de sarampión. están contraindicadas fiebre amarilla y tuberculosis en individuos ViH + sintomáticos. i) Viajeros que visitan a familiares y amigos (que de forma habitual se expresa con las siglas Vfr) y peregrinos. este grupo de viajeros ve incrementado el riesgo de contraer enfermedades relacionadas con su viaje, comparado con los turistas. según datos del sistema Geosentinel de vigilancia epidemiológica, el riesgo en Vfr’s de contraer malaria es 8 veces mayor que en turistas. este riesgo incrementado se debe a un mayor riesgo de exposición y a las medidas preventivas insuficientes: acuden en menor medida a la consulta de Medicina del Viajero, viajan a zonas más rurales, la duración de su estancia es mayor, comen y beben productos de alto riesgo y están en contacto estrecho con la población nativa. además su percepción del riesgo es distinta. es importante la implicación de la atención primaria en este grupo especialmente sensible. el hacinamiento de personas en las peregrinaciones contribuye a la diseminación de enfermedades infecciosas a través del aire o por contacto persona/persona. se recomienda vacuna frente a la gripe, neumococo en mayores de 65 años, hepatitis a en no inmunes y las vacunas de rutina. 16.5. Quimioprofilaxis la quimioprofilaxis recomendada en viajes internacionales se centra básicamente en el paludismo. las zonas del planeta en las que existe riesgo de contagio se localizan en África subsahariana, centroamérica y sudamérica, sudeste asiático, subcontinente indio, oriente Medio y la península arábiga. la profilaxis se recomendará cuando exista riesgo de contagio. las dosis de administración son: a) cloroquina. 300 mg una vez por semana el mismo día de la semana o 100 mg 6 días en semana. la pauta comienza una semana antes del viaje, durante todo el viaje y 4 semanas después del regreso. b) Proguanil. 200 mg diarios desde el inicio del viaje hasta 4 semanas después del regreso. c) Mefloquina. 250 mg una vez por semana el mismo día de la semana. la pauta comienza una semana antes del viaje, durante todo el viaje y 4 semanas después del regreso. d) Doxiciclina. 100 mg una vez al día desde el inicio del viaje hasta 4 semanas después del regreso. e) Primetamina. 25 mg una vez por semana. el tratamiento comenzará inmediatamente antes de ir al área endémica, y se mantendrá 4 semanas después del regreso. en españa se ha utilizado también mucho la mefloquina (lariam®), medicamento que se adquiere a través de medicamentos extranjeros. la dosis recomendada es de 250 mg una vez por semana el mismo día de la semana. la pauta comienza una semana antes del viaje, durante todo el viaje y 4 semanas después del regreso. 169 GuÍa De Vacunas en la oficina De farMacia Principio activo Medicamento Presentación Posología Cloroquina Resochin 155 mg 50 comprimidos Adultos: dosis inicial de 310 mg/semana (inicio una semana antes) o 620 mg en 2 tomas separadas 6 horas (inicio el mismo día); dosis de mantenimiento de 310 mg/semana. Niños: dosis inicial de 5 mg/kg/semana (inicio una semana antes) o 10 mg/kg en 2 tomas separadas 6 horas (inicio el mismo día); dosis de mantenimiento de 5 mg/kg/semana. El tratamiento se mantendrá 4 semanas después del regreso. Doxiciclina1 Doxiciclina Normon 100 mg 16 grageas Doxiciclina Valomed 100 mg 12 cápsulas Adultos y niños mayores de 16 años: 100 mg/día. Niños de 8-15 años: 2 mg/kg/día. El tratamiento se iniciará 1-2 días antes del viaje y se mantendrá 4 semanas después del regreso. Doxiclat 100 mg 12 comprimidos 100 mg 28 comprimidos Proderma 50 mg 30 cápsulas 100 mg 30 cápsulas 200 mg 30 cápsulas Vibracina 100 mg 12 cápsulas 50 mg/5 ml suspensión oral 60 ml Hidroxicloroquina Dolquine 200 mg 30 comprimidos Adultos: 400 mg/semana. Niños: 6,5 mg/kg/semana. El tratamiento comenzará 2 semanas antes de la exposición. Si no fuera posible, iniciar con doble dosis en dos tomas separadas 6 horas. El tratamiento se mantendrá 8 semanas después del regreso. Pirimetamina Daraprim 25 mg 30 comprimidos Adultos y niños mayores de 10 años: 25 mg/semana. Niños de 5-10 años: 12,5 mg/semana. El tratamiento comenzará inmediatamente antes de ir al área endémica, y se mantendrá 4 semanas después del regreso. Proguanil / atovacuona Malarone 25/62,5 mg 12 comprimidos Adultos: 1 comprimido diario. El tratamiento comenzará 24-48 horas antes de ir al área endémica, y se mantendrá 7 días después del regreso. El período de estancia no debería superar 28 días. 100/250 mg 12 comprimidos 1. Sólo se incluyen las especialidades con doxiciclina en cuyas fichas técnicas se especifique la indicación de profilaxis de la malaria. Tabla 39. Fármacos para quimioprofilaxis antimalárica comercializados en España. las normas higiénicas de protección frente al paludismo de basan en las siguientes medidas: a) conocer el riesgo de infección, las medidas preventivas y la necesidad de consulta en caso de fiebre. b) evitar las picaduras del mosquito. 170 T.16 Vacunación en Viajeros c) realizar una correcta quimioprofilaxis. d) conocer la importancia del diagnóstico y tratamiento precoces. sospechar en caso de fiebre con o sin otros síntomas, entre una semana después de la primera posible exposición y dos meses después de la última posible exposición. e) evitar el viaje de mujeres embarazadas y niños pequeños a zonas palúdicas. 16. 6. El Reglamento Sanitario Internacional en 1951, los estados Miembros de la asamblea Mundial de la salud (aMs), adoptaron la primera norma internacional ideada para evitar la propagación transfronteriza de enfermedades infecciosas y establecer ciertos protocolos de notificación de casos, presentación de informes y medidas a tomar en los diferentes medios de transporte internacionales, puertos, aeropuertos y fronteras. esta norma se denominó International Sanitary Regulations, cambiando su nombre por International Health Regulations en 1969 y traduciéndose al español como reglamento sanitario internacional. este primer reglamento sanitario internacional (rsi) entró en vigor en 1969, siendo modificado en los años 1973 (se añadieron ciertas disposiciones relativas al cólera) y 1981 (se excluyó la viruela al considerarse erradicada.). en la 48ª asamblea Mundial de la salud (aMs), celebrada en 1995, se acordó la necesidad de revisarlo, pero hasta la 58ª aMs celebrada en mayo de 2005 en Ginebra (suiza), no se adoptó el nuevo rsi, que entró en vigor el 15 de junio de 2007. este reglamento suple las carencias de los anteriores y da respuesta a las necesidades actuales sobre salud internacional en materias tales como la alerta y respuesta ante epidemias, sobre la respuesta mundial de salud pública a la aparición natural, la liberación accidental o el uso deliberado de agentes biológicos y químicos o de material radionuclear que afecten a la salud, sobre el síndrome respiratorio agudo severo (sras) y otros problemas de naturaleza similar. la finalidad y el alcance de este reglamento, recogidas en el artículo 2 del título ii del propio rsi, son: “prevenir la propagación internacional de enfermedades, proteger contra esa propagación, controlarla y darle una respuesta de salud pública proporcionada y restringida para los riesgos para la salud pública y evitando al mismo tiempo las interferencias innecesarias con el tráfico y el comercio internacionales”. 16.7. Centros de vacunación provinciales en la página web del Ministerio de sanidad y consumo se puede consultar en cualquier momento las vacunas y la quimioprofilaxis antimalárica necesaria para viajes, en función del destino, duración de la estancia, tipo de alojamiento o edad del paciente. Para acceder a esta consulta, se deberá entrar en: http://www.msc.es/sanitarios/consejos/vacext.do como anexo i se incluyen las direcciones y teléfonos de los centros de vacunación internacionales situados en las distintas provincias españolas. 171 GUÍA DE VACUNAS EN LA OFICINA DE FARMACIA TEMA 17 Calendarios vacunales infantiles: cambios estratégicos GuÍa De Vacunas en la oficina De farMacia el control de las enfermedades infecto-contagiosas más comunes en la infancia mediante la administración de vacunas constituye uno de los adelantos médicos trascendentales del siglo pasado. la inmunización frente a enfermedades como poliomielitis, sarampión, tos ferina, tétanos, difteria, etc. se han asociado a una masiva reducción del problema sanitario originado por estas enfermedades. lógicamente, los mayores logros se han alcanzado en los países desarrollados, donde se han conseguido altos niveles de cobertura vacunal, pero en general en todo el mundo se ha avanzado considerablemente en la lucha contra las enfermedades transmisibles. así la erradicación total de la viruela en el siglo pasado o bien la certificación de zonas libres de poliomielitis en américa y europa a principio de nuestro nuevo siglo, pueden considerarse como una de las más importantes conquistas de la ciencia médica. Durante el siglo xx la vacunación ha sido una de las medidas de mayor impacto en salud pública, ya que con su administración se ha conseguido disminuir la carga de enfermedad y la mortalidad por enfermedades infecciosas en la infancia. en los últimos tiempos y debido a los avances tecnológicos y científicos, las expectativas de desarrollo de nuevas vacunas han ido tomando cuerpo, superándose ya las fases de investigación de vacunas frente a enfermedades transmisibles tales como la neumonía neumocócica, la varicela, el rotavirus, y el papilomavirus, y quedando con una perspectiva más de futuro la del síndrome de la inmunodeficiencia humana (siDa), la malaria o la tuberculosis. esta situación ha permitido no solo el desarrollo de nuevas vacunas potencialmente más eficaces y seguras, sino que también su coste de producción sea el menor posible. todos estos avances hacen que los calendarios vacunales hayan ido sufriendo cambios sustanciales en los últimos años, gracias a la incorporación de nuevas vacunas entre las que cabe destacar dos fundamentales que se han incorporado recientemente al calendario de vacunación de la comunidad de Madrid, como son la vacuna contra la varicela, a los 15 meses de edad y la vacuna antineumocócica conjugada heptavalente. 17.1. Cambios en el calendario de vacunación de una Comunidad Autónoma: Madrid Vamos ahora a analizar la situación concreta de estas dos enfermedades en la comunidad de Madrid y la justificación de su recomendación, para lo cual me voy a basar en los informes que a tal efecto ha realizado el comité asesor de Vacunas (caV) de la consejería de sanidad de la comunidad de Madrid y que tengo el honor de coordinar. Por lo tanto, todo lo que se detalla a continuación es el trabajo desinteresado, que día a día están haciendo los miembros de dicho comité. en el caso concreto de la varicela, anualmente presentan una primoinfección por varicela-zóster en la comunidad de Madrid unas 40.000 personas. esta cifra ha oscilado entre 51.159 en el año 1999 y 37.986 en el año 2003. en líneas generales, se estima que el número de personas que enferman anualmente por varicela se encuentra próximo a la cohorte de nacidos vivos. la varicela es una enfermedad de elevada capacidad de transmisión, encontrándose una tasa de ataque secundaria entre los contactos domésticos susceptibles del 90%. la mayoría de las personas de nuestra población (90-97%), sufren la enfermedad antes de alcanzar los 14 años de edad. esta situación se observa tanto al estudiar la incidencia por grupos de edad, como en las encuestas de seroprevalencia. la población susceptible a la varicela es baja a partir de los 11 años, siendo la proporción de susceptibles del 6,2% en el grupo de 16-20 años, del 4,2% en el de 21-30 años y 2,6% en el de 31-40 años. también hay trabajos que nos hablan de la importancia e impacto que tiene en nuestro medio las hospitalizaciones por varicela. en este sentido, en un trabajo publicado por nuestro grupo se pone de manifiesto que se han contabilizado en españa 3.083 hospitalizaciones por varicela y 6.324 por herpes zóster en el periodo 1999-2000. la mitad de las hospitalizaciones por varicela ocurrió en niños menores de 5 años, mientras el 78% de las hospitalizaciones por zóster ocurrió en personas mayores de 50 años. el coste anual de las hospitalizaciones por ambas enfermedades es 3,2 y 7 millones de euros respectivamente. con respecto a posibles complicaciones según los datos de la red de médicos centinelas de la comunidad de Madrid, el 2,9% de los pacientes presenta infección bacteriana sobreañadida (esta proporción supondría 174 T.17 calenDarios Vacunales infantiles: caMBios estratÉGicos 1.450 personas/50.000 enfermos), el 0,5% neumonía (250 personas afectadas) y el 1,3% otras complicaciones, entre las cuales se hallan otitis media aguda y conjuntivitis, y por las que han acudido en algún momento del proceso a urgencias hospitalarias el 1,2% de los pacientes. el porcentaje de complicaciones y la gravedad de las mismas aumentan al aumentar la edad. con estos datos se han valorado dos estrategias de intervención en la comunidad de Madrid, la vacunación de toda la población infantil y la vacunación de adolescentes susceptibles llegando a las siguientes recomendaciones: a) Basándonos en datos epidemiológicos y estudios de morbilidad, el caV de la comunidad de Madrid estableció que la estrategia más favorable para evitar el mayor número de casos de la enfermedad, el mayor número de hospitalizaciones y de complicaciones sería un programa de vacunación rutinaria en la infancia, a los 15 meses, junto con la vacuna triple vírica para no aumentar las visitas. se ha estimado que con este programa se evitarían más del 80% de los casos de varicela y la misma proporción de las complicaciones que dan lugar a hospitalización, asumiendo coberturas del 85%. b) un aspecto importante a considerar, a la hora de introducir una vacuna es el costo económico que supone para la comunidad. estudios realizados en canadá, donde existe un sistema sanitario público similar al de nuestro país, han calculado que los costos médicos de los casos no complicados suponen un 90% del total frente al 10% de los complicados. Por tanto, desde el punto de vista económico, la estrategia de la vacunación universal puede ser más favorable que la vacunación de pacientes de riesgo. todos los estudios de costo-beneficio demuestran que la vacunación produce un ahorro que oscila entre 1,5 y 5 veces la cantidad invertida, si se tienen también en cuenta los costos indirectos. un estudio realizado en varias ccaa de españa, ha demostrado que cada caso de varicela no complicado atendido ambulatoriamente supone 96,25 euros. c) en este sentido durante un tiempo y con el fin de mantener el consenso adoptado entre las ccaa, la estrategia de vacunación recomendable fue la vacunación de adolescentes susceptibles pero siempre se entendió que esto era un paso previo, y que se adquiría el compromiso para tomar las medidas necesarias para implantar la vacunación universal infantil, lo que se ha realizado incorporando esta vacuna en el calendario vacunal infantil a la edad de 15 meses, el día 1 de noviembre del 2006. en la segunda situación que presentamos, la vacunación antineumocócica infantil, hay diferentes estudios que ponen de manifiesto la pertinencia de su incorporación. entre ellos podemos destacar el estudio retrospectivo de todos los casos de enfermedad neumocócica en personas residentes en la comunidad de Madrid, que han requerido ingreso hospitalario y cuyo diagnóstico figura en el alta hospitalaria en el conjunto Mínimo Básico de Datos (cMBD) de los años 1998-2003 de los hospitales de la comunidad de Madrid. Para este estudio la definición de caso de enfermedad neumocócica invasora incluye los siguientes códigos de la cie-9-Mc: 481 (neumonía neumocócica), 320.1 (meningitis neumocócica), 038.2 (septicemia neumocócica) y 567.1 (peritonitis neumocócica), recogidos en el diagnóstico principal o en el primer diagnóstico secundario. en el período de estudio se han registrado 1.125 casos de enfermedad invasora por neumococo en menores de 15 años, lo que supone una tasa media anual de 24,43 enfermos/100.000 habitantes. la tasa de incidencia en menores de 2 años fue de 77,14 casos/100.000 habitantes y en menores de 5 años 59,31 casos/100.000 habitantes. la mayoría de los casos se presentaron en forma clínica de neumonía (tasa 21,75/100.000 habitantes). la incidencia media de meningitis neumocócica fue de 1,52 casos/100.000 habitantes; la letalidad global ha sido de un 0,80%. la evolución de la incidencia muestra una ligera tendencia descendente que se observa en todos los grupos de edad y sobre todo en los dos últimos años. la incidencia en el período 2001-2003 ha sido un 23,84% menor que la del período 1998-2000. el descenso más marcado se observa en los menores de 2 años (30,69%) para la enfermedad invasora global. sin embargo llama especialmente la atención, el incremento de la meningitis neumocócica en dicho período ya que se ha incrementado en más del doble en los menores de 5 años. la incidencia global de la meningitis neumocócica, recogida a través del sistema de enfermedades de Declaración obligatoria (eDo), ha mostrado un ligero incremento en los últimos años. este incremento se 175 GuÍa De Vacunas en la oficina De farMacia observa principalmente en el grupo de edad de los menores de 1 año. la incidencia en el período 2001-04 (2,33 casos por 100.000 habitantes) fue un 56,8% superior a la presentada en el período 1997-2000 (1,49); siendo un 77% superior la correspondiente al grupo de edad de los menores de 1 años (16,43 vs. 9,28). Por otra parte, en el estudio prospectivo de los casos de enfermedad invasora por neumococo confirmada que requirieron ingreso hospitalario en el año 2003. el estudio incluye a todo paciente residente en la comunidad de Madrid menor de 5 años, ingresado en un hospital con diagnóstico de laboratorio de S. pneumoniae en sangre, líquido cefalorraquídeo (lcr) o en otros lugares normalmente estériles y enfermedad aguda con clínica compatible con enfermedad neumocócica. en el período de estudio se han presentado 52 casos de enfermedad invasora por neumococo, lo que supone una incidencia de 18,18 casos por 100.000 habitantes menores de 5 años. la mayoría de los casos se presentaron en forma clínica de neumonía (7,34 casos por 100.000 habitantes), siendo la incidencia de meningitis de 5,59 casos por 100.000 habitantes. la letalidad ha sido de un 7,7%, y un 3,8% han presentado secuelas. el 57,7% de los casos eran varones y el 61,5% eran menores de 2 años. las mayores tasas se observaron en los menores de 1 año (27,22 casos por 100.000 habitantes), seguido por los menores de 2 años (26,14 casos por 100.000 habitantes). la mayor letalidad también se ha presentado en los menores de 2 años (12,50%). el 11,5% de los pacientes presentaban antecedentes patológicos que podían considerarse factores de riesgo para la enfermedad neumocócica. ocho pacientes (15,4%) habían recibido vacunación frente al neumococo (dos presentaban patología previa). con estos datos, entre otros, el comité asesor de Vacunas de la comunidad de Madrid concluyó diciendo que desde el punto de vista de la salud Pública, y considerando la efectividad de la vacuna, tanto por su efecto directo como indirecto, se recomendaba la introducción de la vacuna neumocócica conjugada heptavalente (Vcn-7V) en el calendario sistemático de vacunación infantil, todo ello sin dejar de lado la importancia de seguir insistiendo en la necesidad de vacunación de los niños pertenecientes a grupos de riesgo, utilizando esquemas mixtos con la Vcn-7V y la vacuna de 23 polisacáridos puros. Para finalizar me gustaría destacar que el calendario vacunal está vivo y es tremendamente activo y por lo tanto los cambios habrá que tenerlos en cuenta de cara al futuro ya que ya están entre nosotros nuevas vacunas eficaces y seguras como la de rotavirus, papilomavirus y herpes zóster, entre otras. como es lógico, la inclusión de vacunas en el calendario de vacunación obedece a muchos factores. Por eso, el Ministerio de sanidad, a través del consejo interterritorial, quiere armonizar las estrategias de vacunación en las diferentes ccaa a fin de que las diferencias entre éstas sean las menos posibles. 17.2. Calendarios de Vacunación a continuación se presentan los calendarios vacunales vigentes en la actualidad tanto en el Ministerio de sanidad y consumo como en alguna de las comunidades autónomas, teniendo en cuenta que los calendarios vacunales no son estáticos sino que están sometidos a cambios ya que la incorporación de nuevas vacunas así como los conocimientos científicos hacen que éstos estén sometidos a actualización y cambios, siendo el último y más reciente la incorporación de la vacuna frente a papilomavirus. 176 T.17 calenDarios Vacunales infantiles: caMBios estratÉGicos 17.2.1. Calendario del Consejo Interterritorial del Sistema Nacional de Salud Edad Meses Poliomielitis Difteria Tétanos Pertussis Haemophilus influenzae B 2 4 6 VPI1 VPI2 VPI3 Meningitis meningocócica C 12 15 18 DTPa4 Hib2 Hib4 Hib1 3 4 6 Hib3 TV1 MenC2 (c) 11 13 14 DTPa5 o DT 16 Td TV2 (a) HB 3 dosis 0, 1-2 y 6 meses MenC1 10 VPI4 DTPa1 DTPa2 DTPa3 Sarampión, rubeola, parotiditis Hepatitis B Años HB 3 dosis (b) MenC3 (d) Varicela VVZ (e) Papilomavirus VPH 3 dosis (f) Tabla 40. Calendario de vacunaciones recomendado por el Consejo Interterritorial del Sistema Nacional de Salud para el año 2007 (Aprobado el 10 de octubre de 2007). a) niños no vacunados en este rango de edad, recibirán la segunda dosis entre los 11-13 años. b) niños que no hayan recibido la primovacunación en la infancia. c) se administrarán dos dosis de vacunas Menc entre los 2 y 6 meses de vida, separadas entre sí al menos dos meses. d) se recomienda administrar una dosis de recuerdo a partir de los doce meses de vida. e) Personas que refieran no haber pasado la enfermedad ni haber sido vacunados con anterioridad, siguiendo indicaciones de la ficha técnica. f) Vacunar en una única cohorte a las niñas entre los 11-14 años de edad. 177 GuÍa De Vacunas en la oficina De farMacia 17.2.2. Calendario vacunal de Andalucía Edad Meses 0 Poliomielitis Difteria Tétanos Pertussis Haemophilus influenzae B Años 2 4 6 15 VPI1 VPI2 VPI3 VPI4 DTPa1 DTPa2 DTPa3 DTPa4 Hib1 Hib2 Hib3 Hib4 Sarampión, rubeola, parotiditis TV1 Hepatitis B HB1 (b) Meningitis meningocócica C HB2 (b) MenC1 3 12 DTPa5 14 Td (a) TV2 HB 3 dosis (c) HB3 MenC2 6 MenC3 Varicela VVZ (d) VPH 3 dosis (e) Papilomavirus Tabla 41. Calendario de vacunaciones de la Comunidad Autónoma de Andalucía (2008). a) se aconseja proceder a la revacunación cada 10 años o según las normas que se dicten al respecto. b) en recién nacidos de madres portadoras del virus de la hepatitis B, en las primeras horas de vida se le administrará una dosis de inmunoglobulina y se adelantará la segunda dosis al mes de vida. c) los escolares que ya hayan recibido tres dosis de la vacuna frente a la hepatitis B, antes de los 12 años de edad, no precisan ser vacunados. d) los escolares que no hayan padecido la enfermedad ni estén vacunados. e) sólo niñas nacidas a partir de 1994. 178 T.17 calenDarios Vacunales infantiles: caMBios estratÉGicos 17.2.3. Calendario vacunal de Aragón Edad Meses 0 Poliomielitis Difteria Tétanos Pertussis Haemophilus influenzae B Años 2 4 6 VPI1 VPI2 VPI3 VPI4 DTPa1 DTPa2 DTPa3 DTPa4 Hib1 Hib2 Hib3 Hib4 Sarampión, rubeola, parotiditis Hepatitis B 15 TV1 HB1 Meningitis meningocócica C HB2 MenC1 18 6 11 DTPa5 14 Td TV2 HB3 MenC2 MenC3 Varicela VVZ (a) VPH 3 dosis (b) Papilomavirus Tabla 42. Calendario de vacunaciones de la Comunidad Autónoma de Aragón (Orden de 21 de enero de 2008). a) a aquellos niños que no hayan padecido la enfermedad ni hayan sido vacunados con anterioridad contra la varicela. b) Únicamente para las niñas. 179 GuÍa De Vacunas en la oficina De farMacia 17.2.4. Calendario vacunal de Asturias Edad Meses 0 Poliomielitis Difteria Tétanos Pertussis Haemophilus influenzae B Años 2 4 6 VPI1 VPI2 VPI3 VPI4 DTPa1 DTPa2 DTPa3 DTPa4 Hib1 Hib2 Hib3 Hib4 Sarampión, rubeola, parotiditis Hepatitis B Meningitis meningocócica C 15 TV1 HB1 HB2 (a) MenC1 18 3 6 10 DTPa5 TV2 HB 3 dosis (b) MenC (c) MenC3 Varicela VVZ (d) VPH 3 dosis (e) Papilomavirus Tabla 43. Calendario de vacunaciones de la Comunidad Autónoma de Asturias (Resolución de 18 de agosto de 2008). a) esta dosis puede adelantarse o retrasarse un mes. b) a los niños no vacunados anteriormente, con una pauta 0-1-6 meses. c) sólo a los niños que no hayan recibido al menos 1 dosis con más de 12 meses de edad. d) sólo a los niños que no la hayan pasado ni se hayan vacunado anteriormente. e) sólo a las niñas nacidas a partir de 1995, con pauta de 3 dosis 0-1-6 meses. 180 14 Td HB3 MenC2 13 T.17 calenDarios Vacunales infantiles: caMBios estratÉGicos 17.2.5. Calendario vacunal de Baleares Edad Meses Poliomielitis Difteria Tétanos Pertussis Haemophilus influenzae B Años 2 4 6 VPI1 VPI2 VPI3 VPI4 DTPa1 DTPa2 DTPa3 DTPa4 Hib1 Hib2 Hib3 Hib4 Sarampión, rubeola, parotiditis 15 18 HB1 Meningitis meningocócica C MenC1 HB2 14 Td (a) TV (b) HB 3 dosis (c) HB3 MenC2 11 DTPa5 TV2 TV1 Hepatitis B 6 MenC3 Tabla 44. Calendario de vacunaciones de la Comunidad Autónoma de Baleares (2008). a) a partir de la sexta dosis de td (14 años), se recomienda revacunación cada 10 años. b) esta dosis no se administrará si ya se ha recibido dos dosis anteriormente. c) se administrará sólo en el caso de no haber recibido ninguna dosis de hepatitis B anteriormente. d) a aquellos niños que no hayan padecido la enfermedad ni hayan sido vacunados con anterioridad contra la varicela. 181 GuÍa De Vacunas en la oficina De farMacia 17.2.6. Calendario vacunal de Canarias Edad Meses Poliomielitis Difteria Tétanos Pertussis Haemophilus influenzae B Años 2 4 6 VPI1 VPI2 VPI3 VPI4 DTPa1 DTPa2 DTPa3 DTPa4 Hib1 Hib2 Hib3 Hib4 Sarampión, rubeola, parotiditis 15 18 Meningitis meningocócica C HB1 HB2 MenC1 MenC2 6 11 DTPa5 14 Td TV2 TV1 Hepatitis B 3 HB 3 dosis (a) HB3 MenC3 VPH 3 dosis (b) Papilomavirus Tabla 45. Calendario de vacunaciones de la Comunidad Autónoma de Canarias (2008). a) se mantendrán las 3 dosis a los 11 años hasta que la cohorte de las niñas nacidas en el 2001 alcancen esta edad. b) sólo para niñas que cumplan 14 años a partir del 1 de enero de 2008. 182 T.17 calenDarios Vacunales infantiles: caMBios estratÉGicos 17.2.7. Calendario vacunal de Cantabria Edad Meses 0 1 Poliomielitis Difteria Tétanos Pertussis Haemophilus influenzae B Años 2 4 6 VPI1 VPI2 VPI3 VPI4 DTPa1 DTPa2 DTPa3 DTPa4 Hib1 Hib2 Hib3 Hib4 Sarampión, rubeola, parotiditis 15 TV1 (b) Hepatitis B HB1 Meningitis meningocócica C HB2 18 6 DTPa5 MenC2 14 Td (a) TV2 HB 3 dosis (c) HB1 MenC1 12 MenC3 Varicela VVZ (d) VPH 3 dosis (e) Papilomavirus Tabla 46. Calendario de vacunaciones de la Comunidad Autónoma de Cantabria (2008). a) se administrará una dosis de recuerdo cada 10 años. b) en niños con especial riesgo puede administrarse una dosis a los 6 meses, con una segunda dosis a los 15 y una tercera a los 6 años. c) administrar 3 dosis con pauta 0-1-6 meses. sólo se administrará a esta edad en aquellos niños no vacunados anteriormente. esta vacunación se suspenderá en adolescentes en 2009. d) sólo se vacunarán los que no tengan antecedentes de haber padecido la enfermedad. e) a todas las niñas de 14 años. 183 GuÍa De Vacunas en la oficina De farMacia v17.2.8. Calendario vacunal de Castilla La Mancha Edad Meses 0 1 Poliomielitis Difteria Tétanos Pertussis Haemophilus influenzae B Años 2 4 6 VPI1 VPI2 VPI3 VPI4 DTPa1 DTPa2 DTPa3 DTPa4 Hib1 Hib2 Hib3 Hib4 Sarampión, rubeola, parotiditis 15 18 HB1 Meningitis meningocócica C HB2 11 DTPa5 MenC2 HB 3 dosis (a) MenC3 Varicela VVZ (b) VPH 3 dosis (c) Papilomavirus Tabla 47. Calendario de vacunaciones de la Comunidad Autónoma de Castilla La Mancha (Orden de 18-01-2008). a) nacidos con anterioridad al 1 de enero de 1999 (3 dosis con un intervalo 0-1-6 meses). b) sólo para niños y niñas que a los 11 años no hayan pasado la enfermedad. c) se vacunarán a las niñas nacidas a partir del 1 de enero de 1994. 184 14 Td HB3 MenC1 13 TV2 TV1 Hepatitis B 6 T.17 calenDarios Vacunales infantiles: caMBios estratÉGicos 17.2.9. Calendario vacunal de Castilla León Edad Meses 0 Poliomielitis Difteria Tétanos Pertussis Haemophilus influenzae B Años 2 4 6 VPI1 VPI2 VPI3 VPI4 DTPa1 DTPa2 DTPa3 DTPa4 Hib1 Hib2 Hib3 Hib4 Sarampión, rubeola, parotiditis Hepatitis B Meningitis meningocócica C 15 18 TV1 HB1 HB2 MenC1 Varicela 6 11 DTPa5 14 Td TV2 HB 3 dosis (a) HB3 MenC2 12 MenC3 VVZ (b) VPH 3 dosis (c) Papilomavirus Tabla 48. Calendario de vacunaciones de la Comunidad Autónoma de Castilla León (Orden SAN/523/2008, de 28 de marzo). a) Para aquellos que no se encuentren correctamente vacunados con anterioridad frente a HB. b) Personas que refieran no haber pasado la enfermedad ni haber sido vacunadas con anterioridad. c) niñas nacidas a partir de 1994. 185 GuÍa De Vacunas en la oficina De farMacia 17.2.10. Calendario vacunal de Cataluña Edad Meses Poliomielitis Difteria Tétanos Pertussis Haemophilus influenzae B 2 4 6 VPI1 VPI2 VPI3 VPI4 DTPa1 DTPa2 DTPa3 DTPa4 Hib1 Hib2 Hib3 Hib4 Sarampión, rubeola, parotiditis Hepatitis B Meningitis meningocócica C 12 Años 15 MenC1 HB2 4 6 12 DTPa5 HB3 MenC2 11 14 16 Td (a) TV2 TV1 HB1 18 HA+B (b) MenC3 Varicela VVZ (c) Papilomavirus VPH 3 dosis Tabla 49. Calendario de vacunaciones de la Comunidad Autónoma de Cataluña (Decreto 219/2008, de 11 de noviembre). a) se procederá a administrar una nueva dosis de recuerdo cada 10 años. b) se prorroga la vigencia del programa piloto de vacunación antihepatítica a + B, por el que se establece el calendario de vacunaciones sistemáticas, dirigido al alumnado de 6º curso de educación primaria, hasta el curso escolar 2013-2014 incluido. c) Personas que refieran no haber pasado la enfermedad ni haber sido vacunadas con anterioridad, siguiendo indicaciones de la ficha técnica. 186 T.17 calenDarios Vacunales infantiles: caMBios estratÉGicos 17.2.11. Calendario vacunal de Ceuta Edad Meses 0 Poliomielitis Difteria Tétanos Pertussis 2 4 6 VPI1 VPI2 VPI3 DTPa1 Haemophilus influenzae B Hib1 Meningitis meningocócica C 15 Hib2 18 24 DTPa4 HB2 (d) 10 11 13 Hib3 DTPa5 14 DTPa6 (a) Hib4 TV1 (b) HB1 6 VPI4 DTPa2 DTPa3 Sarampión, rubeola, parotiditis Hepatitis B Años TV2 TV (c) HB3 MenC1 MenC2 MenC3 VVZ (e) Varicela Neum1 (f) Neumococo Hepatitis A HA1 HA2 HA (g) Tabla 50. Calendario de vacunaciones de la Ciudad Autónoma de Ceuta (2007). a) se recomienda una dosis de refuerzo cada 10 años. b) en niños con especial riesgo (guardería, etc.) puede administrarse a partir de los 6 meses, con una segunda dosis a los 15. c) los vacunados a los 6 años no deben revacunarse a los 11. d) los hijos de madres portadoras del agHBs deberán recibir la segunda dosis de vacuna frente a la hepatitis B al mes del nacimiento. e) a los 10 años o 5º curso de primaria. f) sólo para niños en grupos de riesgo, por indicación de su pediatra. en función de la edad, se usará la heptavalente o la polisacarídica. g) la pauta es de 3 dosis en 6 meses (inicial, al mes y a los 6 meses de la primera). si han sido previamente vacunados de a y B, no necesitan revacunación. 187 GuÍa De Vacunas en la oficina De farMacia 17.2.12. Calendario vacunal de Comunidad Valenciana Edad Meses 0 Poliomielitis Difteria Tétanos Pertussis Haemophilus influenzae B Años 2 4 6 VPI1 VPI2 VPI3 VPI4 DTPa1 DTPa2 DTPa3 DTPa4 Hib1 Hib2 Hib3 Hib4 Sarampión, rubeola, parotiditis Hepatitis B Meningitis meningocócica C 15 18 HB2 (b) HB3(c) MenC1 MenC2 6 11 DTPa5 14 Td (a) TV2 TV1 HB1 5 MenC3 (d) Varicela VVZ (e) VPH 3 dosis (f) Papilomavirus Tabla 51. Calendario de vacunaciones de la Comunidad Autónoma Valenciana (Orden de 16 de junio de 2008). a) se recomienda una dosis de refuerzo cada 10 años. b) los hijos de madres portadoras del agHBs deberán recibir la segunda dosis de vacuna frente a la hepatitis B al mes del nacimiento. c) se completará la pauta de tres dosis en todos los menores de 20 años no vacunados. d) se vacunará con una dosis de vacuna conjugada frente al meningococo c a los menores de 20 años no vacunados. e) se administrará una sola dosis en niños/as sin antecedentes previos de enfermedad o vacunación. f) se administrarán tres dosis en niñas según indicación de la ficha técnica de la vacuna disponible. 188 T.17 calenDarios Vacunales infantiles: caMBios estratÉGicos 17.2.13. Calendario vacunal de Extremadura Edad Meses 0 1 2 4 6 VPI1 VPI2 VPI3 VPI4 DTPa1 DTPa2 DTPa3 DTPa4 Hib1 Hib2 Hib3 Hib4 Poliomielitis Difteria Tétanos Pertussis Años Haemophilus influenzae B Sarampión, rubeola, parotiditis 15 TV1 Hepatitis B HB1 Meningitis meningocócica C HB2 18 6 10 DTPa5 Varicela MenC2 14 Td (a) TV2 HB 3 dosis (b) HB3 MenC1 13 MenC3 VVZ (c) VPH 3 dosis (d) Papilomavirus Tabla 52. Calendario de vacunaciones de la Comunidad Autónoma de Extremadura (Decreto 23/2008 de 6 de septiembre). a) se recomienda revacunar cada 10 años. b) Para los no vacunados previamente. c) Para los no vacunados previamente que manifiesten no haber pasado la enfermedad. d) sólo para niñas. 189 GuÍa De Vacunas en la oficina De farMacia 17.2.14. Calendario vacunal de Galicia Edad Meses 0 Poliomielitis Difteria Tétanos Pertussis Haemophilus influenzae B Años 2 4 6 VPI1 VPI2 VPI3 VPI4 DTPa1 DTPa2 DTPa3 DTPa4 Hib1 Hib2 Hib3 Hib4 Sarampión, rubeola, parotiditis Hepatitis B Meningitis meningocócica C 15 18 TV1 HB1 HB2 MenC1 3 6 12 DTPa5 Td TV2 HB3 MenC2 MenC3 Varicela VVZ (a) VPH 3 dosis (b) Papilomavirus Tabla 53. Calendario de vacunaciones de la Comunidad Autónoma de Galicia (2008). a) Para los no vacunados previamente que manifiesten no haber pasado la enfermedad. b) sólo para niñas, con una pauta 0-1-6. 190 14 T.17 calenDarios Vacunales infantiles: caMBios estratÉGicos 17.2.15. Calendario vacunal de La Rioja Edad Meses Poliomielitis 2 4 6 VPI1 VPI2 VPI3 Años 15 18 3 6 7 11 12 13 14 VPI4 Difteria Tétanos DTPa1 DTPa2 DTPa3 DTPa4 Hib2 Hib4 DTPa5 Td Pertussis Haemophilus influenzae B Hib1 Hib3 Sarampión, rubeola, TV1 TV2 parotiditis Hepatitis B HB1 Meningitis meningocócica C HB2 MenC1 MenC2 HB3 MenC3 Varicela VVZ (a) Papilomavirus VPH 3 dosis (b) Tabla 54. Calendario de vacunaciones de la Comunidad Autónoma de La Rioja (2008). a) Vacunación para niños que no hayan padecido la enfermedad o que no hayan sido vacunados. b) sólo para niñas. 191 GuÍa De Vacunas en la oficina De farMacia 17.2.16. Calendario vacunal de Madrid Edad Meses 0 Poliomielitis Difteria Tétanos Pertussis Haemophilus influenzae B Años 2 4 6 VPI1 VPI2 VPI3 VPI4 DTPa1 DTPa2 DTPa3 DTPa4 Hib1 Hib2 Hib3 Hib4 Sarampión, rubeola, parotiditis 15 18 TV1 (a) Hepatitis B HB1 (b) Meningitis meningocócica C HB2 MenC1 DTPa5 14 Td TV2 MenC2 MenC3 VVZ Neum1 11 HB3 Varicela Neumococo 4 Neum2 Neum3 VVZ (c) Neum4 VPH 3 dosis (d) Papilomavirus Tabla 55. Calendario de vacunaciones de la Comunidad Autónoma de Madrid (2008). a) niños en riesgo se puede adelantar a los 12 meses. las dosis administradas antes de esta edad no deben ser contabilizadas. b) esquema vacunal para los niños nacidos de madres agHBs negativo. en hijos de madre portadora de agHBs se administrará la pauta 0-1-6 más gammaglobulina y determinación de anticuerpos de 1 a 3 meses después de la vacunación. en caso de screening no realizado la pauta será 0-1-6 sin gammaglobulina. actualmente no es necesaria la revacunación en población inmunocompetente si se han recibido 3 dosis de Hepatitis B, ni realizar anticuerpos post-vacunales. c) Personas que refieran no haber pasado la enfermedad ni haber sido vacunados con anterioridad. d) sólo para niñas. la pauta de vacunación son 3 dosis (0-1-6 ó 0-2-6 meses, según la vacuna administrada). 192 T.17 calenDarios Vacunales infantiles: caMBios estratÉGicos 17.2.17. Calendario vacunal de Melilla Edad Meses 0 Poliomielitis Difteria Tétanos Pertussis Haemophilus influenzae B 2 4 6 VPI1 VPI2 VPI3 VPI4 DTPa1 DTPa2 DTPa3 DTPa4 Hib1 Hib2 Hib3 Hib4 Sarampión, rubeola, parotiditis Hepatitis B Meningitis meningocócica C Años 12 15 18 TV1 (b) HB (d) HB1 HB2 MenC1 MenC2 4 6 10 DTPa5 14 dTpa6 (a) TV2 (c) HB3 HB (e) MenC3 Varicela VVZ Hepatitis A 13 HA1 VVZ (f) HA2 HA (e) Papilomavirus VPH 3 dosis (g) Tabla 56. Calendario de vacunaciones de la Ciudad Autónoma de Melilla (2008). a) se recomienda revacunación cada 10 años. b) en situaciones de especial riesgo puede administrarse una dosis a los 9 meses o a partir de los 6 meses. c) niños que no hayan recibido una 2ª dosis antes de los 6 años, recibirán la 2ª dosis a los 11 años. d) sólo en recién nacidos de madres portadoras. se administrará una primera dosis en el hospital, tras el parto, y se continuará la pauta habitual 2-4-6. e) Pauta de 3 dosis (a los 0, 1 y 6 meses). si han sido previamente vacunados de Ha y HB no necesitan revacunación. f) niños que no hayan pasado la enfermedad ni hayan sido vacunados con anterioridad. g) esta vacuna será de 3 dosis (0, 1 y 6 ó 0, 2 y 6 meses), según laboratorio. sólo para niñas. 193 GuÍa De Vacunas en la oficina De farMacia 17.2.18. Calendario vacunal de Murcia Edad Meses Poliomielitis Difteria Tétanos Pertussis Haemophilus influenzae B Años 2 4 6 VPI1 VPI2 VPI3 VPI4 DTPa1 DTPa2 DTPa3 DTPa4 Hib1 Hib2 Hib3 Hib4 Sarampión, rubeola, parotiditis 15 TV1 Hepatitis B Meningitis meningocócica C HB1 (a) HB2 MenC1 MenC2 Varicela 18 6 11 DTPa5 14 DT TV2 HB 3 dosis (b) HB3 MenC3 VVZ (c) VPH 3 dosis (d) Papilomavirus Tabla 57. Calendario de vacunaciones de la Comunidad Autónoma de Murcia (2008). a) en recién nacidos de madre portadora de agHBs: 1ª dosis de vacuna e inmunoglobulina al nacer, la 2ª dosis de vacuna a los 2 meses y la 3ª a los 6 meses. b) Para niños no vacunados previamente. c) Para aquellos niños que no la hayan padecido o no hayan sido vacunados con anterioridad. d) sólo en niñas. 194 T.17 calenDarios Vacunales infantiles: caMBios estratÉGicos 17.2.19. Calendario vacunal de Navarra Edad Meses Poliomielitis Difteria Tétanos Pertussis Haemophilus influenzae B 2 4 6 VPI1 VPI2 VPI3 15 Años 18 DTPa4 Hib2 Hib4 Hib3 Sarampión, rubeola, parotiditis TV1 (b) Hepatitis B HB1 (d) HB2 Meningitis meningocócica C MenC1 MenC2 Varicela 10 12 13 14 15 16 DTPa5 TV2 Td (a) TV (c) HB3 MenC3 VVZ Papilomavirus 6 VPI4 DTPa1 DTPa2 DTPa3 Hib1 3 VVZ (e) VVZ (f) VPH 3 dosis VPH 3 dosis (g) Tabla 58. Calendario de vacunaciones de la Comunidad Autónoma de Navarra (Decreto Foral 97/2007, de 3 de septiembre). a) Dosis de refuerzo cada 10 años. b) en situación de especial riesgo se puede adelantar a los 9 meses. si la situación epidemiológica aconseja la vacunación antes de los 12 meses, es necesario revacunar a los 15 meses. c) Para cohortes que no la recibieron a los 3 años (nacidos con anterioridad al 1 de enero de 2004). d) en el caso de madres portadoras se aplicará la primera dosis al nacimiento y se administrará la 2ª dosis un mes después. e) Para nacidos a partir del 1 de enero de 2004 que no hayan pasado la enfermedad ni estén previamente vacunados. si la ficha técnica de la vacuna lo permite, recibirán una segunda dosis de vacuna los inmunizados a los 15 meses, nacidos a partir del 1 de enero de 2006. f) Para susceptibles (no han pasado la enfermedad ni han sido previamente vacunados). g) Para niñas nacidas entre el 1 de enero de 1992 y el 31 de diciembre de 1994 que no hayan sido previamente vacunadas. 195 GuÍa De Vacunas en la oficina De farMacia 17.2.20. Calendario vacunal de País Vasco Edad Meses 1 Poliomielitis Difteria Tétanos Pertussis Haemophilus influenzae B Años 2 4 6 12 VPI1 VPI2 VPI3 VPI4 DTPa1 DTPa2 DTPa3 DTPa4 Hib1 Hib2 Hib3 Hib4 Sarampión, rubeola, parotiditis 18 TV1 Hepatitis B Meningitis meningocócica C HB1 HB2 MenC1 MenC2 4 10 13 DTPa5 HB 3 dosis (b) HB3 MenC3 VVZ (c) VPH 3 dosis (d) Papilomavirus BCG Tabla 59. Calendario de vacunaciones de la Comunidad Autónoma de País Vasco (2008). a) se recomienda una dosis de recuerdo cada 10 años. b) se administrará a la población no vacunada previamente, en pauta 0-1-6. c) sólo población no vacunada o que no haya pasado esta enfermedad. d) Para niñas de 1º de eso no vacunadas, en pauta 0-1-6. 196 16 Td (a) TV2 Varicela Tuberculosis 6 GUÍA DE VACUNAS EN LA OFICINA DE FARMACIA TEMA 18 Estrategias de vacunación en la población adulta guÍa dE vacunas En la oFicina dE FarMacia se estima que la introducción de las vacunas en el mundo ha evitado anualmente 5 millones de muertes por viruela, 2,7 millones por sarampión, 2 millones por tétanos neonatal, 1 millón por tos ferina, 600.000 por poliomielitis paralítica y 300.000 por difteria. desde 1900 a 1973 se produjo un uso masivo de vacunas, fundamentalmente en países desarrollados [viruela, tuberculosis (bcg), difteria-tétanos-pertussis (dtp), vacunas atenuadas e inactivadas contra la poliomielitis (vpo, vpi) y vacuna contra el sarampión]. a mediados de los años 50, las vacunas frente a la poliomielitis, oral e inactivada, y el inicio de su empleo masivo, bien de forma rutinaria o mediante campañas específicas de vacunación, fue el inicio de la puesta en marcha de programas de vacunación en principio dirigidos a la población infantil con el objetivo de lograr una amplia inmunidad de la población que permitiera el control de la infección. En 1974, la organización Mundial de la salud implanta el Programa Ampliado de Inmunización o pai (Expanded Programme on Immunization, EPI), con el objetivo de hacer llegar la vacunación a los países en desarrollo; dicho programa incluye la vacunación de tuberculosis (bcg), difteria, tétanos, tos ferina, poliomielitis y sarampión. En 1993 se incluye en dicho programa la vacunación de hepatitis b y de fiebre amarilla en aquellos países en los que la enfermedad es endémica. En 1998 se introduce en el pai la vacuna de Haemophilus influenzae tipo b. las políticas poblacionales de la vacunación son por lo tanto muy recientes, lo que significa que en el momento actual tenemos algunas cohortes de población adulta (justamente anteriores a las cohortes vacunadas) que no se beneficiaron de esta medida de control y, en muchos casos, se les dificultó entrar en contacto a la edad en que era habitual, con el agente infeccioso y desarrollar la enfermedad y la inmunidad consecuente. Estas cohortes presentan unos porcentajes más o menos importantes de sujetos susceptibles que en algunos casos son los responsables de la persistencia de brotes de estas enfermedades sometidas a programas de vacunación. En el caso de algunas vacunaciones administradas en la infancia, no presentan inmunidad duradera para toda la vida, por lo que si los programas no se refuerzan con dosis posteriores, al cabo de los años los sujetos vacunados se vuelven de nuevo susceptibles y por lo tanto en riesgo de enfermar. Es pues de gran importancia, extender las políticas o recomendaciones de vacunación a la población adulta con el fin de complementar los programas de vacunación infantil y reforzar su impacto en el control de la infección. a continuación se desarrollan las vacunas que se recomienda administrar en adultos. 18.1. Vacuna frente a difteria, tétanos y tos ferina si bien el número de casos declarados de tétanos en nuestro país es bajo (20-25 casos al año), la tasa de la letalidad se mantiene entre el 40-50%, ya que la inmunidad de grupo no juega ningún papel en el control de la enfermedad. para mantener altos niveles de inmunidad en toda la población es necesario mantener altas coberturas en los programas de vacunación en la infancia, una vacunación oportunista en el joven, adulto y anciano no vacunado y una profilaxis post-exposición adecuada. tradicionalmente se ha recomendado una dosis de recuerdo cada 10 años, con la finalidad de compensar la pérdida de inmunidad que se produce a lo largo del tiempo. Esta pauta decenal pretende proporcionar una protección constante durante toda la vida, pero hay razones que hacen pensar que no es la mejor alternativa (escaso cumplimiento, reacciones adversas por exceso de dosis, excepcional presentación de casos de tétanos en sujetos previamente vacunados, valoraciones económicas, etc.). por otra parte, los programas de vacunación infantil llevan más de 30 años aplicándose y en ellos se administran seis dosis de vacuna antitetánica hasta la 198 T.18 EstratEgias dE vacunación En la población adulta adolescencia. por ello, recientemente diversos países se han planteado alternativas a la revacunación cada 10 años, y en nuestro país diversos autores están apoyando la utilización de pautas alternativas. por todo lo expuesto, se realizan las siguientes recomendaciones de vacunación td en población adulta: a) Primovacunación en adultos no vacunados. se deberá mejorar la inmunidad de la población adulta utilizando estrategias que garanticen que los adultos que no hayan sido previamente vacunados, incidiendo sobre todo en los grupos de edad donde existe una mayor incidencia de enfermedad y de sus complicaciones (mayores de 50 años). para ello se deberá ofertar la vacunación de td a los adultos sin vacunar, en todos los grupos de edad, pero se hará especial hincapié en los siguientes casos: • Mayores de 65 años, ofertando la vacunación junto a la gripe. • personas que ingresen en instituciones geriátricas, socio-sanitarias, psiquiátricas, penitenciarias, etc. • personas que vivan en ambiente rural. • personas cuyo trabajo suponga un mayor riesgo de infección. • personas con hábitos de riesgo: usuarios de drogas por vía intravenosa, receptores de piercing, tatuajes, etc. • Enfermos de alto riesgo: viH, diabetes, cirugía, etc. • viajeros internacionales. • población inmigrante. la pauta de primovacunación consiste en la administración de 3 dosis, con un intervalo de 1-2 meses entre las dos primeras dosis (mínimo 4 semanas) y de 6 a 12 meses entre la segunda y la tercera. b) Adultos con primovacunación incompleta. En el caso de adultos que tengan una primovacunación incompleta, en general, no es necesario reiniciar la pauta de vacunación y sólo será necesario completar el número de dosis pendiente, independientemente del tiempo transcurrido desde la última dosis hasta completar las 3 dosis recomendadas. c) Mujeres embarazadas. se tenderá a modificar la recomendación de vacunación durante el embarazo utilizando estrategias que garanticen la llegada a la etapa reproductiva con una adecuada inmunidad frente al tétanos, como por ejemplo: • revisar el estado de vacunación en la etapa pre-concepcional (visitas médicas de atención primaria, planificación familiar, ginecólogo, etc.). • actuar en poblaciones con alta probabilidad de no vacunación: inmigrantes, etnia gitana, etc. En caso de vacunación durante el embarazo se deberá evitar el primer trimestre. d) Enfermos de tétanos. se deberá recomendar la vacunación a los enfermos de tétanos, ya que el padecimiento de la enfermedad no confiere inmunidad, por lo que los enfermos que se recuperan de un tétanos deben completar la vacunación durante la convalecencia. e) Dosis de recuerdo. En personas que han recibido una vacunación completa según el calendario infantil actual, con tres dosis de primovacunación más tres dosis de recuerdo, se recomienda una dosis de refuerzo única entre los 50 y los 65 años. En personas que han recibido la pauta de primovacunación en la edad adulta se puede mantener la recomendación de administrar una dosis de recuerdo cada 10 años, o bien aplicar una dosis de recuerdo entre 199 guÍa dE vacunas En la oFicina dE FarMacia los 50 y 65 años a todo aquél que no la haya recibido en los últimos 10 años. con esta pauta alternativa se trata de alcanzar el objetivo de incrementar la proporción de población que recibe dosis de recuerdo pero al mismo tiempo evitar un número excesivo de dosis, que causan incremento de reacciones adversas y gasto innecesario. f) Profilaxis antitetánica. En caso de heridas o lesiones se recomienda la profilaxis post-exposición que hemos visto en temas anteriores (Véase tabla 60). En caso de personas inmunodeprimidas y con una herida potencialmente tetanígena, deberá administrase inmunoglobulina independientemente de su estado de vacunación, ya que es más probable que estas personas no tengan anticuerpos protectores. no hay un criterio uniforme en cuanto a la dosis óptima de inmunoglobulina a administrar; 250 ui parece ser una dosis profiláctica razonable para el tratamiento de las heridas, pudiéndose utilizar hasta 500 ui. Herida potencialmente tetanígena1 Herida limpia Antecedentes de vacunación Vacuna Td IGT Vacuna Td IGT < 3 dosis o desconocida Sí 2 No Sí 2 Sí 3 ≥ 3 dosis No4 No No5 No 1. Heridas mayores o sucias (contaminadas con tierra, polvo, saliva, heces, pérdida de tejidos, quemaduras, etc.). 2. Comenzar o completar la vacunación. 3. Administrar en lugar diferente a la vacuna. 4. Administrar una dosis de vacuna si hace más de 10 años de la última dosis documentada. 5. Administrar una dosis de vacuna si hace más de 5 años desde la última dosis documentada. Tabla 60. Medidas a tomar en profilaxis antitetánica post-exposición. En el caso concreto de la tos ferina y con el fin de evitar la transmisión de la infección a niños en los que la enfermedad puede dar lugar a complicaciones más graves, en España se recomienda el uso de esta vacuna exclusivamente en personal sanitario que atiende a niños prematuros y a recién nacidos que precisen hospitalización. las modificaciones que se hagan de estas recomendaciones dependerán de los resultados de los estudios que se están realizando para conocer el papel de los adultos en la transmisión de la infección. 18.2. Vacuna frente a la gripe las recomendaciones actuales de utilización de estas vacunas, formuladas en 1992 en el pleno del consejo interterritorial del sistema nacional de salud, incluyen los siguientes grupos de riesgo: a) grupos con alto riesgo de padecer complicaciones gripales: • personas de 65 o más años de edad. En algunas comunidades autónomas se ha ampliado la edad de vacunación a los 60 años. 200 T.18 EstratEgias dE vacunación En la población adulta • ingresados en residencias de ancianos o en otros centros que presten asistencia a enfermos crónicos de cualquier edad. • niños/as y adultos con enfermedades crónicas cardiovasculares o pulmonares, incluyendo niños con asma. • niños/as y adultos que hayan precisado seguimiento médico periódico u hospitalización en el año precedente, por enfermedades metabólicas crónicas (incluyendo diabetes mellitus), insuficiencia renal, hemoglobinopatías o inmunosupresión (incluyendo la originada por fármacos). b) grupos que puedan transmitir la gripe a personas con alto riesgo de complicaciones gripales: • personas que proporcionen cuidados domiciliarios a pacientes de alto riesgo. • convivientes en el hogar, incluidos niños/as, de personas de alto riesgo. • personal que en su trabajo atiendan a personas de alto riesgo o que presten servicios comunitarios esenciales. c) otros grupos en los que se recomienda la vacunación: • Estudiantes y otras personas en centros institucionales que compartan dormitorios comunes. • personas infectadas por el virus de la inmunodeficiencia humana. • personas de alto riesgo, antes de un viaje al extranjero: en cualquier época del año a los que viajen al trópico y a los que viajen de abril a septiembre al hemisferio sur. d) consideraciones de la vacunación antigripal en el embarazo. la vacuna de la gripe se considera segura en cualquier momento del embarazo y en la lactancia, y se recomienda para aquellas mujeres embarazadas o en periodo de lactancia en las que se den alguna de las condiciones de riesgo anteriormente mencionadas. la inmunización rutinaria a todas las mujeres embarazadas en el segundo o tercer trimestre de gestación es recomendada por el Advisory Committee on Immunization Practices (ACIP) de EEuu en base a estudios observacionales, de notificación de casos y retrospectivos de caso-control. no está demostrado que estos estudios se puedan generalizar a Europa, y la mayoría de los países europeos, al igual que canadá, no recomiendan la vacunación antigripal de rutina a las embarazadas. no obstante, sí hay algunos países europeos, como bélgica y suiza, en los que se recomienda la vacunación a embarazadas. En España, algunas ccaa incluyen entre sus recomendaciones vacunar a las embarazadas en el segundo y tercer trimestre de gestación. 18.3. Vacuna frente al neumococo las recomendaciones para la utilización de estas vacunas, en grupos de riesgo, se recogen en la circular 7/2001 de la agencia Española del Medicamento y productos sanitarios del Ministerio de sanidad y consumo: a) individuos inmunocompetentes con riesgo de enfermedad neumocócica o sus complicaciones debido a enfermedades crónicas. b) individuos inmunocomprometidos con riesgo de enfermedad neumocócica o sus complicaciones. c) personas con infección por viH sintomática o asintomática. 201 guÍa dE vacunas En la oFicina dE FarMacia d) personas con implante coclear o que van a recibir uno. En la actualidad, existe evidencia para recomendar la vacunación en pacientes ancianos que viven en instituciones cerradas, por el mayor riesgo de contagio. algunas comunidades autónomas, como Madrid, cataluña y castilla león, incluyen en sus recomendaciones la vacunación sistemática a la población de ≥60 años (u otros rangos de edad), opción que en algunos casos se ha adoptado haciéndola coincidir con la vacunación antigripal (cuando corresponda) con el objetivo de asegurar una mejor cobertura en ambas vacunas. la revacunación no se recomienda de forma rutinaria. sólo se administrará una dosis de revacunación en individuos vacunados hace más de 5 años y en las siguientes circunstancias: a) personas mayores de 65 años, que recibieron por alguna indicación especial, la primera dosis antes de los 65 años. b) personas con alto riesgo de infección neumocócica grave (asplenia, fallo renal crónico, síndrome nefrótico, u otras condiciones asociadas con inmunosupresión). 18.4. Vacuna frente a la hepatitis 18.4.1. Vacuna frente a la hepatitis A la vacuna de la hepatitis a no está recomendada para uso rutinario en población general. las indicaciones recogidas en las fichas técnicas de las vacunas de hepatitis a se complementan con la circular de la dirección general de Farmacia, 12/97 referida a los grupos de riesgo para los que se indica la vacuna. con anterioridad a esta circular, la vacuna de la hepatitis a estaba autorizada en España con una única indicación: la vacunación de viajeros que se desplazan a países donde la hepatitis a es endémica. con posterioridad, y como consecuencia de brotes en Europa de hepatitis a ligados al uso de factores de coagulación, se amplió la indicación a los hemofílicos. En todo caso, la vacunación estaba recomendada en las situaciones que determinaran las autoridades sanitarias. En la circular 12/97 se amplió el número de grupos de población en los cuales podría estar indicada la vacunación frente a la hepatitis a. la vacuna de hepatitis a debe recomendarse, como profilaxis pre-exposición, a los sujetos que tienen un aumento de riesgo para hepatitis a o en los que la infección ocasiona graves consecuencias. se recomienda en los siguientes grupos de riesgo: a) viajeros que se desplacen a zonas de alta o moderada endemicidad de hepatitis a, especialmente los nacidos a partir del año 1966 y si se desplazan a zonas rurales o lugares con condiciones higiénico-sanitarias deficientes. b) personas que padezcan procesos hepáticos crónicos o hepatitis b o c. aunque no tienen un mayor riesgo de infección, tienen un mayor riesgo de hepatitis a fulminante. c) pacientes hemofílicos que reciban hemoderivados y pacientes candidatos a transplante de órganos. d) Familiares o cuidadores que tengan contacto directo con pacientes con hepatitis a. e) sujetos infectados con el virus de la inmunodeficiencia humana (viH). 202 T.18 EstratEgias dE vacunación En la población adulta f) personas con estilos de vida que conlleven un mayor riesgo de infección: varones homosexuales que tengan contactos sexuales múltiples, y usuarios de drogas por vía parenteral. g) sujetos con mayor riesgo ocupacional. h) recomendaciones en situaciones especiales: manipuladores de alimentos, personal que trabaje en guarderías infantiles y personal sanitario de hospitales e instituciones asistenciales. se recomienda la realización de marcadores previos de infección en aquellas personas que tienen una alta probabilidad de no tener inmunidad y siempre que se disponga del tiempo suficiente para realizar el estudio. En caso contrario se administrará la vacuna sin detección previa de anticuerpos. la presencia de anticuerpos igM anti-vHa indica infección aguda o inicio de fase de convalecencia y pueden persistir durante 6 meses. la presencia de anticuerpos igg anti-vHa se detectan durante la fase de convalecencia y tras la infección. indican inmunidad y duran toda la vida. la vacuna de la hepatitis a parece ser muy eficaz como medida post-exposición para prevenir la infección en los contactos, para lo cual deberá administrarse una dosis en la primera semana de la exposición. puede ser considerada para contactos familiares o contactos íntimos de casos sospechosos. así mismo, puede ser considerada como medida de control en brotes en comunidades cerradas o instituciones o en determinados grupos sociales con un mayor riesgo de infección, de forma coordinada con otras medidas de salud pública. su efectividad dependerá de la rapidez de la intervención, de las características de la comunidad y de la cobertura alcanzada. la inmunoglobulina (ig) se recomienda en profilaxis post-exposición en niños menores de 2 años, en personas inmunocomprometidas, que no respondan completamente a la vacuna o en aquellos en que la vacuna esté contraindicada. 18.4.2. Vacuna frente a la hepatitis B la vacunación universal de todos los recién nacidos y adolescentes es la medida más eficaz para luchar contra la infección por el vHb. la vacunación selectiva, en adultos, está indicada en los siguientes grupos de riesgo. a) personas que por su ocupación están expuestos frecuentemente a sangre o productos sanguíneos o fluidos corporales que puedan contener virus. b) población de instituciones penitenciarias y personal que trabaje en contacto con ella. c) personas deficientes mentales que estén acogidas en instituciones y personal que trabaje en contacto con ellas. d) convivientes y contactos sexuales de personas con infección aguda o crónica de virus de la hepatitis b. e) Hemofílicos y otros receptores habituales de transfusiones de sangre u otros hemoderivados. f) pacientes sometidos a prediálisis y hemodiálisis. g) pacientes en programas de trasplantes. h) personas infectadas por el viH. i) personas con hepatopatías crónicas. j) personas que practiquen punciones cutáneas frecuentes no controladas (usuarios de drogas por vía parenteral, etc.). 203 guÍa dE vacunas En la oFicina dE FarMacia k) población que cambie frecuentemente de pareja (tanto homosexuales como heterosexuales). l) viajeros desde zonas de baja incidencia a regiones hiperendémicas y para quienes tienen un alto riesgo. 18.4.3. Vacunas combinadas frente a hepatitis A y B la circular 13/97 establece los grupos de población considerados de riesgo para hepatitis a y hepatitis b de forma simultánea: a) viajeros que se desplacen a zonas endémicas de hepatitis a y b o personas que vayan a residir en ellas durante más de 6 meses y que se encuentren en riesgo frente a ambas enfermedades (probabilidad de contacto con sangre procedente de población local o contacto sexual con la misma). b) varones homosexuales que tengan contactos sexuales múltiples. c) personas drogodependientes por vía parenteral. d) pacientes hemofílicos. e) personal sanitario de hospitales e instituciones asistenciales expuesto a contactos con sangre. f) En las situaciones que determinen las autoridades sanitarias. se recomendará su administración en aquellos casos en que las vacunas de la hepatitis a y b estén recomendadas. 18.5. Vacuna frente al sarampión, rubeola y parotiditis se debe ofertar y recomendar la administración de una dosis de triple vírica a los adultos no vacunados o sin historia documentada previa de enfermedad y que no tengan contraindicación médica, aprovechando los contactos que realicen con los servicios sanitarios. los últimos brotes detectados e investigados de sarampión han puesto de manifiesto la gran transmisibilidad del virus del sarampión y la dificultad de delimitar las cohortes de susceptibles en adultos, ya que existe una importante variabilidad geográfica en función de las coberturas alcanzadas en el inicio de los programas de vacunación y de evolución de la incidencia de la enfermedad en cada zona. con carácter general, se puede delimitar la recomendación de administrar la vacuna a las cohortes nacidas con posterioridad a 1971, en base a los resultados de la Encuesta nacional de seroprevalencia realizada en 1996. sin embargo, siempre que sea posible, la recomendación se deberá adaptar en función de los resultados de las encuestas de seroprevalencia que existan a nivel local y de las circunstancias anteriormente citadas (cobertura de vacunación e incidencia de la enfermedad). se recomienda revisar el estado de vacunación y ofertar la vacuna triple vírica en las siguientes ocasiones: a) personas no vacunadas. se las recomendará la vacunación durante las visitas de rutina al médico general. b) Mujeres en edad fértil. durante las visitas de rutina al ginecólogo, durante la asistencia de rutina a las clínicas de planificación familiar y después del parto o aborto si se constata que es susceptible. c) personal sanitario sin antecedentes de enfermedad ni vacunación. para aquellos que tengan un alto grado de exposición, en algunos protocolos, se oferta una segunda dosis a las cuatro semanas de recibir la primera. 204 T.18 EstratEgias dE vacunación En la población adulta d) adolescentes y mujeres procedentes de países en donde esta vacuna tenga un uso limitado. En el caso de mujeres embarazadas, si son susceptibles a rubeola, se aconseja vacunar inmediatamente después del parto. e) viajeros a determinados países con alta incidencia de estas enfermedades y/o deficientes programas de vacunación, y particularmente las mujeres en edad fértil. deben revisar y actualizar su estado vacunal frente a sarampión antes del viaje, si no tienen antecedentes de haber padecido alguna de las tres enfermedades. f) adultos que no tengan documentado el antecedente de vacunación u otra evidencia de inmunidad, cuando aparezcan casos confirmados en su entorno o brotes, especialmente de sarampión. se aplicarán medidas inmediatas de control de la infección mediante la administración de una dosis de triple vírica. valorar la amplitud de la medida en función de las características epidemiológicas del brote. una alternativa aceptable es el uso de inmunoglobulina (ig) que puede prevenir o modificar el curso de la infección si se administra en los primeros 6 días después de la infección. Esta alternativa está indicada principalmente cuando la vacuna del sarampión está contraindicada. 18.6. Calendario vacunal de adultos actualmente, solo la comunidad autónoma de Madrid dispone de un calendario de vacunación (Véase Tabla 61), mientras que en otras ccaa se dispone ya de cartillas de vacunación para adultos, en las que se pueden incluir los datos de diferentes vacunas recomendadas (dt, gripe, hepatitis b, neumococo, triple vírica). 19-22 años1 Difteria y tétanos adulto 23-39 años 40-59 años 1 dosis de recuerdo cada 10 años Triple vírica 2 dosis Hepatitis B 3 dosis (0-1-6 meses) 3 dosis (0-1-6 meses) 1 dosis 1 dosis Meningococo ≥ 60 años Gripe Neumocócica polisacarídica 1 dosis — 1 dosis anual 1 dosis anual 1 dosis 1 dosis 1. Nacidos desde el 1 de enero de 1985. Amarillo: Para todas las personas de esta categoría y de las clases indicadas, si no hay constancia de la vacunación o inmunidad. Verde: Recomendada si existen otros factores de riesgo. Tabla 61. Calendario de vacunación para adultos en función de la edad. 205 GUÍA DE VACUNAS EN LA OFICINA DE FARMACIA TEMA 19 Conservación y almacenamiento de vacunas guÍa dE vacunas En la oFicina dE FarMacia la vacunación es considerada por la mayoría de la población como un acto para mantener una salud positiva. pero no podemos olvidar que el éxito de una campaña de vacunación no solamente depende de una correcta elaboración del producto vacunal, sino también de su adecuado almacenamiento, transporte y conservación. cualquier error producido en este proceso llevaría al fracaso de cualquier campaña de vacunación perfectamente diseñada, ya que provocaría la inactivación e ineficacia de las vacunas dispensadas. Es por ello que el conocimiento de la estructura y etapas de la cadena del frío así como de las recomendaciones generales para la manipulación y almacenamiento de las vacunas de uso más común es vital para el buen funcionamiento de los programas y campañas de vacunación. 19.1. La cadena del frío 19.1.1. Definición de la cadena del frío la cadena del frío es el proceso de refrigeración que han de seguir las vacunas desde su elaboración hasta la administración, con la finalidad de garantizar la potencia inmunizante. tradicionalmente se considera compuesta por dos partes: a) Cadena fija. referida al lugar de almacenamiento de la vacuna hasta su utilización, representada por frigoríficos y congeladores. b) Cadena móvil. compuesta por contenedores o neveras portátiles que son utilizados para el transporte. 19.1.2. Fases de la cadena del frío corresponde a una serie de procesos que concurren desde que el producto vacunal se elabora en el laboratorio farmacéutico hasta que es dispensado a la población, y en el que debe garantizarse en todo momento la termoestabilidad de la vacuna, tal y como se refleja en la imagen 15. 19.1.3. Elementos de la cadena del frío a) recursos humanos. aparece la figura del responsable de vacunas en cada nivel de aplicación de la cadena. • deben ser especialistas en la cadena del frío, con conocimientos sobre logística de programas de inmunización y termoestabilidad de las vacunas. 208 T.19 consErvación y alMacEnaMiEnto dE vacunas Laboratorio farmacéutico Distribuidor Oficina de farmacia / Centro de vacunación Paciente / pers. sanitario TERMOESTABILIDAD Fabricación Distribución Custodia y dispensación Administración Imagen 15. Fases de la cadena de frío • cada responsable tendrá asignado el control y el cuidado del equipamiento. • también será responsable de coordinar y ejecutar las actividades relativas a la gestión de los programas de inmunización. b) recursos materiales. actualmente existe una gran diversidad de productos en el mercado. surge la necesidad por tanto de estimar las necesidades y evaluar cuál es el material más adecuado para cada situación. siempre habrá que tener en cuenta unos mínimos: • toda nevera ha de disponer de un congelador para acumuladores de frío. Estos acumuladores de frío son envases de plástico que llevan en su interior soluciones salinas, que pueden congelarse y descongelarse, y permiten la refrigeración de neveras portátiles u otros recipientes. • deberá disponer de un termógrafo. • deberá tener la capacidad adecuada al volumen medio de vacunas a almacenar. 19.2. Distribución de las vacunas desde que la vacuna sale del laboratorio fabricante hasta que llegan a la población, pasa por diferentes niveles de distribución y almacenaje donde debe estar garantizada la temperatura adecuada a cada vacuna. Esta fase comprende una serie de elementos materiales y actividades a desempeñar que se detallan seguidamente. se deberá disponer de los siguientes recursos materiales según las necesidades: a) transporte isotérmico. b) nevera portátil. c) cajas isotérmicas. d) porta-vacunas. e) acumuladores de frío. 209 guÍa dE vacunas En la oFicina dE FarMacia f) controladores de temperatura (monitores, termómetros). durante esta fase, el responsable de vacunas estará controlando el proceso. la utilización de estos elementos dependerá de: a) tipo de vacuna a transportar. b) volumen de vacunas. c) temperatura ambiente durante el transporte. d) tiempo máximo de recorrido. como norma general se dispondrá de neveras portátiles, acumuladores de frío y un dispositivo controlador de la temperatura. 19.2.1. Controles de calidad de la distribución deberá mantenerse un control adecuado sobre: a) pedidos de vacunas. b) recogida de vacunas. c) organización de la distribución del producto vacunal. d) control de la distribución del mismo. En cuanto a las actividades en la fase de distribución, aparecen dos controles claves como son el control de la distribución en si y el control de la recepción del producto. a) Control de la distribución en si. igualmente deberá comprobarse una serie de circunstancias, tales como: • Fecha de caducidad de las vacunas que van a ser distribuidas. • disposición de los acumuladores de frío y de las vacunas dentro del elemento de transporte. los acumuladores de frío nunca deberán entrar en contacto con las vacunas durante su transporte o almacenaje. de igual manera, en vacunas sensibles a bajas temperaturas, habrá que evitar el riesgo de congelación por contacto. • conocimiento por parte del personal que realiza el transporte de las vacunas de la importancia del mantenimiento de la cadena del frío. • número de dosis de vacunas. • lote de vacunas. b) Control en la recepción. deberán comprobarse una serie de circunstancias como: • tipo de vacunas y número de dosis. deben corresponder al pedido solicitado. • Estado del material de acondicionamiento. El envase debe estar en perfecto estado y con el correspondiente etiquetaje. 210 T.19 consErvación y alMacEnaMiEnto dE vacunas • control de la cadena de frío. deberá comprobarse que las vacunas no han sido expuestas a condiciones indeseables. para ello será necesario verificar los indicadores de temperatura que garanticen la termoestabilidad. cuando no se disponga de un indicación de alerta de congelación, deberá realizarse el “test por agitación” (especial cuidado en vacunas como dtp, dt o t). • lote de las vacunas. • Fecha de caducidad de las mismas. • origen de las vacunas. deberá verificarse la procedencia del producto. • tipo de envases. comprobar la presentación de los envases, para ver si son monodosis o multidosis. 19.3. Almacenamiento de las vacunas se especifican a continuación los elementos y actividades relacionados con el almacenamiento de vacunas. Esta es quizá la fase más compleja de la cadena del frío en cuanto a las actividades a realizar, ya que en ella es donde se enmarca la previsión de vacunas y el control de stocks. los registros de temperatura alcanzan aquí una importancia muy relevante ya que la ruptura de la cadena del frío en esta fase supondría el desabastecimiento de vacunas a la población. 19.3.1. Elementos que intervienen en el almacenaje de vacunas a) cámara frigorífica como nevera principal. b) nevera auxiliar. c) nevera portátil. d) acumuladores de frío. e) controladores de temperatura (monitores, termómetros). durante esta fase, el responsable de vacunas estará controlando el proceso. 19.3.2. Actividades en el almacenaje de vacunas Esta fase es de especial importancia, por lo que implica una correcta realización de las mismas. a) previsión adecuada de las vacunas necesarias. b) control de stocks vacunales. c) actividades de información sobre la manipulación de vacunas. d) protocolización de la cadena del frío. se debe contar con sistemas de alerta en caso de ruptura de la cadena, y notificación del hecho a través de los circuitos de declaración habituales. dentro de estas actividades debemos detenernos en tres aspectos fundamentales como son la ubicación de las vacunas, la señalización y el control del almacenamiento. 211 guÍa dE vacunas En la oFicina dE FarMacia a) Ubicación de las vacunas. siempre se tendrán en cuenta tres aspectos: termoestabilidad, accesibilidad y caducidad. • las vacunas termolábiles estarán situadas en las zonas más frías de la nevera. nunca deberán estar colocadas en la puerta. • las vacunas de uso común se colocarán en espacios fácilmente accesibles. • los lotes de caducidad más próxima tendrán prioridad de salida, situándose en posiciones avanzadas. b) Señalización. Es necesario diseñar un croquis, que estará localizado en el exterior de la nevera, donde aparezca señalada la ubicación de las vacunas en el interior de la misma. Esta práctica facilitará su localización, evitará aperturas innecesarias y limitará el tiempo de apertura de la nevera. también deben señalizarse los estantes y las zonas de almacenaje, indicando el tipo de vacuna, el laboratorio fabricante, el número de lote, la fecha de caducidad y el número de dosis almacenadas. c) Control de almacenamiento. se deberá llevar un control del almacenamiento a cuatro niveles: • control regular de la temperatura de almacenaje. las vacunas deben estar almacenadas a la temperatura idónea. para comprobar que esta temperatura es la adecuada, se requiere un control diario de la temperatura en el lugar de almacenamiento. si no hay dispositivo de registro continuo, se recomienda controlar y registrar la temperatura dos veces al día por la mañana y por la tarde. cualquier anomalía, se comunicará de manera inmediata al servicio de mantenimiento. • control de la actividad de las vacunas. será controlada por el fabricante antes de su venta y distribución, pero si falla la cadena de frío, la vacuna se someterá a nuevas pruebas para determinar su actividad. se comunicará cualquier incidencia al centro de distribución central. • control de la congelación de las vacunas. al iniciar la jornada, se verificará que la vacuna no está congelada. una manera sencilla de comprobar esta circunstancia consiste en la realización del denominado el “test de agitación de los toxoides”. Es un procedimiento práctico, fiable y económico. consiste en la agitación enérgica de un vial de toxoide presuntamente congelado, colocándolo posteriormente sobre una superficie plana y ante la luz. Esta práctica se repite con otro vial no congelado de la misma vacuna, del mismo fabricante y se comparan. la vacuna no congelada permanece lisa y turbia; la congelada presenta gránulos y una menor turbidez. pasados 30 minutos, la vacuna no congelada empieza a aclararse sin presentar sedimento, pero la vacuna congelada está casi totalmente clara y presenta un sedimento denso. al cabo de una hora, esta situación se acentúa y la vacuna congelada tiene un sedimento al fondo que apenas se mueva la inclinar el frasco. • control de la fecha de caducidad. En dos registros de almacenaje constará la fecha de caducidad de cada uno de los lotes con la finalidad de dar salida a vacunas de caducidad más próxima. resulta imprescindible el registro constante de stocks. 19.4. Administración de las vacunas Es la única fase de la cadena del frío donde sólo existe un nivel de aplicación que corresponde en este caso al centro de vacunación. a continuación se describen los elementos y actividades correspondientes a esta fase. 212 T.19 consErvación y alMacEnaMiEnto dE vacunas 19.4.1. Elementos que intervienen en la administración de las vacunas a) cámara frigorífica (nevera principal). b) nevera auxiliar. c) nevera portátil. d) acumuladores de frío. e) controladores de temperatura (monitores, termómetros). f) Jeringas, agujas, algodón. Habrá un responsable de vacunas encargado de controlar de forma adecuada el proceso. 19.4.2. Actividades en la administración de vacunas a) preparar el material de inmunización. b) administrar las vacunas a la población. c) controlar la aparición de efectos secundarios. d) llevar los registros de vacunación. e) difundir el material divulgativo. 19.4.3. Mantenimiento del equipamiento En este apartado reflejaremos algunas actividades concernientes al proceso de administración de vacunas que están relacionadas con el correcto cuidado y mantenimiento del equipamiento necesario. a) Mantenimiento del congelador. • comprobar que no ha habido descongelación. • controlar el grosor de la capa de hielo. la capa de hielo no debe tener un grosor superior a 5 mm; en caso contrario se descongelará. • refrigerar los acumuladores antes de colocarlos en el congelador. Estos dispositivos no se apilarán unos sobre otros. Es conveniente tener siempre acumuladores de frío congelados porque así la temperatura del congelador será más fría y los nuevos acumuladores se congelarán más rápido. b) Mantenimiento de la nevera. • inspeccionar diariamente tanto la nevera como su contenido. • comprobar que las vacunas están correctamente almacenadas. • comprobar que el aire circula entre los envases de las vacunas. 213 guÍa dE vacunas En la oFicina dE FarMacia • tener siempre botellas de agua con sal (indicado adecuadamente en el envase) o acumuladores de agua en los espacios libres de la nevera para estabilizar la temperatura en caso de apertura y aumentar el tiempo de refrigeración en caso de avería. • Evitar siempre y como norma, la presencia de alimentos y bebidas en el interior de las neveras. • Examinar las paredes externas e internas, en el caso de neveras portátiles, de forma que éstas no presentan fisuras. • Evitar la exposición directa al sol de neveras portátiles, ya que puede verse favorecida la aparición de grietas y los abombamientos. 19.4.4. Control en la dispensación de vacunas cuando se dispensen vacunas a la población, se deberá asegurar que se transportan en neveras portátiles. En este caso habrá que tener en cuenta dos factores importantes relacionados con los acumuladores de frío: a) sacar los acumuladores del congelador y esperar entre 10-15 minutos antes de colocarlos en la nevera. b) colocar los acumuladores alrededor de las paredes internas de las neveras. de esta forma evitaremos la posible congelación por contacto de la vacuna. 214 GUÍA DE VACUNAS EN LA OFICINA DE FARMACIA TEMA 20 Farmacovigilancia y seguridad vacunal guÍa dE vacunas En la oFicina dE FarMacia la vacunación constituye una de las medidas más eficaces de la moderna salud pública para la prevención de importantes enfermedades que afectan a todos los ciudadanos, pero con especial repercusión en la infancia y la adolescencia. Es considerada por la mayoría de la población como un acto para mantener una salud positiva suponiendo un gran beneficio para la comunidad. Esta circunstancia lleva implícita la confianza en los productos vacunales, los profesionales sanitarios y las correspondientes administraciones sanitarias. En la actualidad y gracias a los avances experimentados en las ciencias de la salud, podemos considera a las vacunas como medicamentos biológicos eficaces y seguros. las autoridades sanitarias, conscientes de la importancia que para la salud de la población infantil y adolescente tienen estas acciones preventivas y de protección de la salud, han puesto en marcha los correspondientes programas de vacunación. En España la vacunación no es obligatoria, pero sí está recomendada por las autoridades sanitarias. nuestras coberturas de vacunación en la inmunización primaria con tres dosis de vacuna frente a poliomielitis, difteria, tétanos y tos ferina (dtp), Haemophilus influenzae tipo b (Hib), meningitis meningocócica c y hepatitis b, alcanzan valores que oscilan entre el 97,6% y el 98,5%. pero, diversas circunstancias pueden llevar a contextos desfavorables para las vacunas. programas de vacunación eficaces pueden verse afectados por posibles cambios en la aceptación de las vacunas por parte de la población, ya que el incremento de las coberturas vacunales disminuye la incidencia de las enfermedades evitables. la mayoría de las vacunas pueden presentar algún tipo de reacción adversa, si bien es cierto que rara vez se consideran de carácter grave. Existen en la actualidad diferentes procedimientos para detectar y evaluar las reacciones adversas a vacunas, que van desde los sistemas de vigilancia pasiva a los estudios epidemiológicos de casos y controles o de cohortes. a pesar de ello, circunstancias como la infranotificación o la dificultad para encontrar una asociación causal entre la aparición de la reacción adversa y la administración del preparado vacunal dificultan la actividad de farmacovigilancia. distintos estudios buscan conocer la posición de diferentes estamentos sanitarios y distintos profesionales (médicos, farmacéuticos, enfermería) frente a las vacunas, pero en la última década también se ha incorporado el rol que desempeñan los padres como parte fundamental en el contexto de la vacunación, aumentando el número de publicaciones orientadas a describir el conocimiento, la percepción y las preocupaciones por la seguridad de los preparados vacunales manifestadas por los padres. aunque la población general percibe la vacunación como un beneficio para la comunidad, conviene recordar que los padres desempeñan un papel fundamental, siendo muy importante desde el punto de vista de la salud pública conocer el valor que conceden a la inmunización como medida preventiva. podemos considera a las vacunas como medicamentos biológicos eficaces y seguros, pero este mensaje tiene que ser continuamente reforzado por todos los pilares implicados en el proceso de la vacunación para evitar que el tema de las reacciones adversas se difunda de manera inadecuada, generando contextos desfavorables para las vacunas. por todo lo anteriormente expuesto, es necesaria una constante y adecuada información sobre la eficacia y seguridad de las vacunas. 20.1. Farmacovigilancia la organización Mundial de la salud define la actividad de Farmacovigilancia como “la ciencia y las actividades relativas a la detección, evaluación, comprensión y prevención de los efectos adversos de los medicamentos o cualquier otro problema relacionado con ellos”. 216 T.20 FarMacovigilancia y sEguridad vacunal Esta actividad está orientada a la toma de decisiones que permitan mantener la relación beneficio/riesgo de los medicamentos en situación favorable, o suspender su uso cuando ello no sea posible. 20.1.1 Objetivos de la Farmacovigilancia a) Mejorar la atención al paciente y su seguridad en relación al uso de medicamentos. b) Mejorar la salud y seguridad públicas en lo tocante al uso de medicamentos. c) contribuir a la evaluación de las ventajas, la nocividad, la eficacia y los riesgos que puedan presentar los medicamentos, alentando una utilización segura, racional y más eficaz y eficiente. d) Fomentar la comprensión y la eficacia de la Farmacovigilancia así como la formación clínica y una comunicación eficaz dirigida a los profesionales de la salud y a la opinión pública. 20.2 Concepto de reacción adversa la oMs define una reacción adversa como “cualquier efecto perjudicial o no deseado que ocurre tras la administración de una dosis normalmente utilizada en la especie humana para la profilaxis, diagnóstico o tratamiento de una enfermedad, o para la modificación de alguna función fisiológica”. una reacción adversa puede ser: a) síntoma: vómitos, prurito, astenia, cefalea, ideas de suicidio, alucinaciones. b) signo: alargamiento del Qt, aumento de la presión arterial, edema, sibilancias. c) Enfermedad o síndrome: hepatitis, agranulocitosis, hemorragia digestiva, depresión, infarto agudo de miocardio. 20.2.1 Clasificación de las reacciones adversas Existen diversas clasificaciones, pero la más utilizada es la que propusieron rawlins y thompson (1977), que sigue utilizándose en la actualidad. Ellos propusieron cuatro tipos de reacciones: a, b, c y d, aunque sin consenso las dos últimas. a continuación se exponen las características más importantes de cada clasificación: a) Reacciones de tipo A (del inglés augmented, incrementadas). son reacciones adversas consecuencia del efecto farmacológico, por lo que son cuadros predecibles y dosis-dependientes. su incidencia y morbilidad es alta, pero su letalidad es baja. b) Reacciones de tipo B (del inglés bizarre, extrañas). son reacciones adversas independientes de la acción farmacológica, y debidas a reacciones alérgicas o idiosincrásicas, por lo que son cuadros anormales, inesperados e impredecibles, no observados en experimentación animal. no son dosis-dependientes. tienen una baja frecuencia (1/1000 o 1/10.000, a veces menos), pero presentan mayor gravedad y elevada letalidad. c) Reacciones de tipo C. son reacciones adversas asociadas a tratamientos prolongados. d) Reacciones de tipo D. son reacciones adversas retardadas. 217 guÍa dE vacunas En la oFicina dE FarMacia 20.3. Seguridad vacunal: acontecimientos adversos después de la vacunación (AADV) como se ha comentado anteriormente, la mayoría de las vacunas pueden presentar algún tipo de reacción adversa, si bien es cierto que rara vez se consideran de carácter grave. sin embargo siempre hay que valorar la relación riesgo/beneficio en la administración de vacunas. sirvan algunos ejemplos ilustrativos: a) beneficio alto y riesgo bajo. Es la situación ideal. por ejemplo la vacuna anti-vHb. b) beneficio alto y riesgo elevado. se podría considerar buscar una alternativa, como se ha conseguido al sustituir la vacuna dtp de células enteras por la vacuna dtp acelular. c) beneficio poco claro y riesgo bajo. vacuna frente a cólera. d) beneficio no demostrado y riesgo elevado. Es una situación inaceptable. Es importante conocer que después de la vacunación se prefiere el término evento adverso a reacción adversa porque conviene puntualizar que la relación temporal entre la administración de la vacuna y el evento adverso no implica una asociación causal (causa-efecto). recientemente otros autores y en este mismo sentido acuñan el término de acontecimiento adverso después de la vacunación (aadv). 20.3.1 Clasificación de AADV según su extensión o afectación podemos clasificar los aadv en: a) Reacciones locales. como dolor, induración, enrojecimiento. aparecen hasta en el 50% de las dosis administradas. suelen aparecer a las 48 horas tras la inyección y su naturaleza suele ser leve a autolimitada. son más frecuentes en vacunas inactivadas, sobre todo si tienen coadyuvantes (dtp). b) Reacciones sistémicas. como fiebre, malestar, dolor muscular o articular, dolor de cabeza, anorexia, convulsiones, etc. son reacciones adversas de carácter muy variado, que suelen aparecer tras la administración de la vacuna. su naturaleza suele ser leve. son raras con las vacunas inactivadas, y más frecuentes en vacunas vivas atenuadas. c) Reacciones alérgicas. pueden cursar con urticaria, rinitis, broncoespasmo o anafilaxia. son causadas por el antígeno de la vacuna o cualquier otro componente de la misma (conservante, estabilizante, antibiótico, etc.). aunque son infrecuentes (<1/500.000 dosis), pueden ser fatales. su riesgo se diminuye con una adecuada anamnesis de la persona a la que se le administrará la vacuna. d) Reacciones teratogénicas. la teratogenia es una posibilidad siempre a tener en cuenta. como norma general se recomienda no administrar vacunas en el primer trimestre del embarazo, y salvo excepciones, evitar la administración de vacunas atenuadas durante la gestación. según su posible relación de causalidad tendríamos distintas situaciones: a) AADV inducidos por la vacuna. se asocian a las características intrínsecas del preparado vacunal y a la respuesta del vacunado. biológicamente no se espera que ocurra sin la vacunación. por ejemplo, la poliomielitis asociada con la vacuna oral antipoliomielítica de virus atenuados. b) AADV potenciados por la vacuna. son reacciones que podrían ocurrir en cualquier caso en personas susceptibles, pero se ven precipitadas por la vacunación. por ejemplo convulsiones febriles en niños. 218 T.20 FarMacovigilancia y sEguridad vacunal c) AADV por error en la fabricación o manipulación. se deben a anomalías en la producción (como en caso de productos contaminados), fallos en almacenamiento o manejo (en caso de interrupción de la cadena del frío) o por fallos en la administración de la vacuna: • administración de la vacuna a un grupo de edad inadecuado. • utilización de una vía de administración incorrecta. • utilización de dosis y/o calendario vacunal no recomendado. d) AADV coincidentes con la vacuna. ocurren después de la vacunación pero no cumplen ninguno de los criterios anteriores. reflejan una relación temporal, pero no existe suficiente evidencia para establecer causalidad. 20.4. AADV y su relación con las principales vacunas como se ha indicado, son muchos y diversos los estudios que han abordado el tema desde diferentes metodologías. sirva como ejemplo los resultados del estudio realizado en España con los registros de tarjeta amarilla del sistema Español de Farmacovigilancia, durante un periodo de tiempo de 10 años, donde se atribuye a las vacunas el 11,9% (n = 291) del total de reacciones adversas presentadas. En este sentido, la oMs elabora un listado de los aavd más comunes que aparecen tras la administración de las vacunas (Véase tabla 61). Reacción local Fiebre Irritabilidad, malestar Tuberculosis Común — — Haemophilus influenzae tipo B 5-10% 2-10% — 30% (adultos) 1-8% — Vacu na Hepatitis B 5% (niños) SRP Hasta 10% Hasta 5% Hasta 5% VPO 0 < 1% < 1%1 Tétanos / DT Hasta 10%2 Hasta 10% Hasta 25% DTPe3 Hasta 50% Hasta 50% Hasta 60% 1. Diarrea, cefalea y dolores musculares. 2. Es probable que las tasas de reacciones locales aumenten con las dosis de refuerzo entre el 50-85%. 3. Para la vacuna antitosferinosa de células enteras. Las tasas para la vacuna antitosferinosa acelular son más bajas. Tabla 61. Reacciones adversas más comunes asociadas a las vacunas (Datos de OMS). surge la necesidad continua de información sobre eficacia y seguridad de las vacunas en un contexto donde la aparición reciente de los llamados grupos antivacunas, que se manifiestan abiertamente en contra de la vacunación colectiva de la población, podría acarrear consecuencias nefastas. no podemos olvidar que nos 219 guÍa dE vacunas En la oFicina dE FarMacia movemos en una sociedad cada vez más informada que desea que su opinión se tenga en cuenta en la toma de decisiones, sobre todo si afectan como es nuestro caso a la información sobre vacunas. En este sentido, la publicación científica The New England Journal of Medicine publica un editorial señalando una serie de eventos adversos no fundamentados en relación a las vacunas (Véase tabla 62). Vacu na Efecto adverso Sarampión Autismo, alteraciones relacionadas con el desarrollo. DTP Síndrome de la muerte súbita del lactante, epilepsia. Haemophilus influenzae tipo B Diabetes mellitus. VPI Poliomielitis paralítica. Hepatitis B Esclerosis múltiple. Carbunco Fatiga, síndrome de la Guerra del Golfo. Enfermedad de Lyme Artritis inflamatoria crónica. Restos de vacunas Problemas sistémicos múltiples Vacunación múltiple Efectos inmunológicos nocivos sin definir provocados por interacción entre vacunas. Tabla 62. Reacciones adversas a vacunas no fundamentados (Tomado de N Engl J Med. 2002; 347: 1477-82). 20.5. Notificación de reacciones adversas: sistema de Tarjeta Amarilla la notificación de reacciones adversas se realiza básicamente a través de la notificación espontánea. se notifican casos individuales por parte de los profesionales de la salud (médicos, farmacéuticos, personal de enfermería). Ha demostrado ser el método más eficiente para la notificación del riesgo. debido a esto se han creado sistemas permanentes de información. Estos sistemas pretenden como objetivos: a) Facilitar al profesional de la salud, la notificación de reacciones adversas con un formulario sencillo como es el sistema de tarjeta amarilla. b) recoger y validar esa información. c) registrar esa información en una base de datos común, manteniendo la confidencialidad del paciente y del notificador. Esta herramienta común es el sistema de Farmacovigilancia Española de datos de reacciones adversas (FEdra). ventajas del programa de tarjeta amarilla: a) Es un método sencillo y económico. b) abarca a toda la población. 220 T.20 FarMacovigilancia y sEguridad vacunal c) permite el seguimiento de todos los medicamentos comercializados. d) genera información inmediata. e) no interfiere en los hábitos de prescripción. f) permite detectar reacciones adversas poco frecuentes. g) sirve de base para el diseño y la realización de estudios epidemiológicos limitaciones del programa de tarjeta amarilla: a) la infranotificación disminuye su sensibilidad. b) la tasa de notificación no es constante. c) Es difícil detectar reacciones de aparición retardada. d) no pueden cuantificarse las incidencias. e) introduce sesgos de notificación: el profesional mejor informado y/o motivado, no representa al profesional medio. f) da lugar a efecto “bola de nieve”: aumenta la tasa de notificación cuando se informa de una reacción adversa concreta. 221 GUÍA DE VACUNAS EN LA OFICINA DE FARMACIA ANEXO 1 Centros provinciales de vacunación internacional 224 Badajoz Sanidad Exterior Servicio Territorial de Sanidad y Bienestar social Sanidad Exterior Servicio Extremeño de Salud Asturias Ávila Badajoz Baleares Badajoz Centro de Salud Nueva Andalucía Almería Palma de Mallorca Mahón Ibiza Sanidad Exterior Centro Insular de Sanidad de Menorca Consellería de Sanidad, Salud y Consumo Ávila Gijón Almería Vía Romana, 81 07800 Avda. José María Cuadrado, 17 07703 C/ Muelle Viejo, 7 07071 Ronda del Pilar, 22 – 3ª planta 06002 Avda. de Europa, 1 – 2ª planta 06071 C/ San Juan de la Cruz, 28 05001 C/ Almirante Claudio Alvargonzález, 30 33201 Avda. del Mediterráneo, 199 04071 C/ Campo de Mirra, 6 03005 Sanidad Exterior Alicante Alicante No posee centros de vacunación internacional. Más cercanos en Valencia, Murcia o Alicante. Avda. de Santiago 11, 1ª planta 01004 Dirección Albacete Vitoria Localidad Sanidad Exterior Centro Álava Provincia 971.30.67.64 / 00 971.36.04.26 971.36.87.03 971.98.92.54 / 59 924.01.03.13 / 14 Información: 924.979.566 924.979.445 Cita previa: 924.979.410 Información: 920.355.078 920.355.275 Cita previa: 920.355.274 984.76.94.10 950.18.62.57 96.501.94.40 / 41 / 42 / 43 / 44 945.75.94.06 Teléfono GuÍa de vaCunas en la oFiCina de FarMaCia Cantabria Sanidad Exterior Santander Algeciras Sanidad Exterior C/ Antonio López, 3 39009 Paseo de la Conferencia, s/n 11207 C/ Ciudad de Vigo, s/n Recinto portuario 11006 Paseo Sierra de Atapuerca, 4 09004 CAP Santa Coloma de Gramanet C/ Major, 49-53 08921 Cádiz Santa Coloma de Gramanet Unidad de Salud Internacional del Barcelonés Nord i Maresme Parc Taulí, s/n 08208 Sanidad Exterior Sabadell Corporación Sanitaria del Parc Taulí Unidad de Atención al Viajero Paseo Vall d’Hebron, 119-129 08035 Cádiz Barcelona Hospital Universitario Vall d’Hebron Servicio de Medicina Preventiva y Epidemiología C/ Rosellón, 163 – 5ª planta 08036 No posee centros de vacunación internacional. Más cercanos en Badajoz y Salamanca. Barcelona Hospital Clinic Edificio Antigua Escuela de Enfermería, 4ª planta C/ Feixa Llarga, s/n 08907 Avda. Drassanes, 17-21 – bajos 08001 Cáceres Hospitalet de Llobregat Hospital de Bellvitge Servicio de Medicina Preventiva Burgos Barcelona Unidad de Medicina Tropical y Salud Internacional Drassanes Dirección C/ Vergara, 12 – Edificio Vergara 08002 Servicio Territorial de Sanidad y Bienestar Social Barcelona Localidad Sanidad Exterior Centro Burgos Barcelona Provincia 942.99.90.62 / 60 / 70 956.98.92.52 / 53 956.98.92.24 947.28.01.61 947.28.01.00 93.462.86.00 93.723.10.10 93.489.42.14 93.489.41.11 93.227.54.86 93.260.75.57 93.260.76.40 93.327.05.50 93.520.96.63 Teléfono A.1 Centros provinCiales de vaCunaCión internaCional 225 226 No posee centros de vacunación internacional. Más cercanos en Badajoz y Madrid. No posee centros de vacunación internacional. Más cercanos en Málaga y Sevilla. No posee centros de vacunación internacional. Más cercanos en Valencia y Madrid. Hospital de Santa Caterina Instituto de Asistencia Sanitaria Hospital Universitario Virgen de las Nieves Servicio de Medicina Preventiva Sanidad Exterior No posee centros de vacunación internacional. Más cercanos en Madrid y Zaragoza. Sanidad Exterior Sanidad Exterior Servicio Provincial de Salud y Consumo Subdirección General de Salud Pública No posee centros de vacunación internacional. Más cercanos en Albacete y Granada. Córdoba Cuenca Girona Granada Gran Canaria Guadalajara Guipúzcoa Huelva Huesca Jaén Huesca Huelva San Sebastián Las Palmas de Gran Canaria Granada Salt Avenida del Parque, 30 22003 C/ Sanlúcar de Barrameda, 7 21001 Plaza de Lasala, 2 – 5ª planta 20003 C/ Juan Domínguez Pérez, s/n 35071 Avda. Fuerzas Armadas, 2 18014 C/ Dr. Castany, s/n 17190 C/ San Amaro, 12 51001 Ciudad Real Ceuta Sanidad Exterior Dirección Rotonda del Centenario, s/n 12100 Ceuta Castellón Localidad Sanidad Exterior Centro Castellón Provincia 974.29.33.88 959.75.90.60 / 63 / 64 943.98.93.46 / 40 928-99.91.10 / 12 / 17 / 18 958.02.01.23 972.18.26.00 956.98.44.85 / 87 964.75.92.10 Teléfono GuÍa de vaCunas en la oFiCina de FarMaCia Lugo Burela Monforte de Lemos Servicios Territoriales Departamento de Salud Complejo Hospitalario Xeral Calde Hospital Da Costa Servicio de Medicina Preventiva Hospital Comarcal de Monforte Servicio de Medicina Preventiva Lleida Lugo Lleida León Servicio Territorial de Sanidad y Bienestar Social Junta de Castilla y León León Cee Hospital Virxen Da Xunqueira Logroño Ferrol Hospital Arquitecto Marcide Sanidad Exterior Travesía de Choupana, s/n 15706 Santiago de Compostela Complejo Hospitalario Universitario de Santiago de Compostela Servicio de Medicina Preventiva C/ Corredoira, s/n 27400 C/ Rafael Vior, s/n 27880 C/ Doctor Severo Ochoa, s/n 27004 C/ Rovira Roure, 2 25006 Avda. Peregrinos, s/n – 2ª planta Edificio de “usos múltiples” de la Junta 24008 C/ Gran Vía, 49 – entreplanta izquierda 26071 C/ Recheo, s/n Paseo marítimo 15270 Carretera de San Pedro de Leixa, s/n 15405 Carretera As Xubias, 84 15006 La Coruña Complejo Hospitalario Juan Canalejo C/ Durán Lóriga, 3 – 5ª planta 15003 Dirección La Coruña Localidad Sanidad Exterior Centro La Rioja La Coruña Provincia 982.41.79.24 982.58.99.58 982.29.64.95 973.70.16.34 / 00 987.296.255 987.296.941 987.296.936 941.75.92.27 / 28 981.70.60.10 981.33.40.35 981.95.00.37 / 90 981.17.80.38 981.98.95.70 / 71 Teléfono A.1 Centros provinCiales de vaCunaCión internaCional 227 228 Pontevedra Vilagarcía de Arousa Vigo Vigo Sanidad Exterior Ambulatorio del Carmen Sanidad Exterior Complejo Hospitalario de Ourense Servicio de Medicina Preventiva Servicio Territorial de Sanidad y Bienestar Social Complejo Hospitalario de Pontevedra Servicio de Medicina Preventiva Hospital Do Salnes Servicio de Medicina Preventiva Sanidad Exterior Complejo Hospitalario de Vigo Servicio de Medicina Preventiva Murcia Navarra Ourense Palencia Pontevedra Palencia Ourense Pamplona Murcia Melilla Área Funciona de Sanidad Delegación del Gobierno en Melilla Melilla Madrid Centro Monográfico de Salud Internacional Ayuntamiento de Madrid Málaga Madrid Hospital Carlos III Sanidad Exterior Madrid Localidad Sanidad Exterior Centro Málaga Madrid Provincia C/ Pizarro, 22 36204 Estación Marítima del Puerto de Vigo 36201 C/ Estromil Ande Rubians 36600 C/ Mourente, s/n 36002 Avda. Casado del Alisal, 32 34001 C/ Ramón Puga, 54 32005 C/ Iturralde y Suit, 13 – 1ª planta 31004 C/ Auroros, 2 30002 Avda. de la Marina Española, 3 52001 Paseo Marítimo Pablo Ruiz Picasso, 43 29016 C/ Montesa, 22 – edificio A, planta baja 28006 C/ Sinesio Delgado, 10 28029 C/ Francisco Silvela, 57 – 1ª planta 28028 Dirección 986.81.60.00 986.98.91.51 / 52 / 59 / 60 / 61 986.56.80.64 986.80.00.04 979.71.54.14 979.71.54.00 988.38.55.29 948.97.93.10 968.98.90.73 968.98.90.70 952.99.11.68 / 69 952.98.90.81 / 82 Información: 91.588.59.60 91.588.51.80 91.588.59.49 Cita previa: 902.333.010 Información: 91.453.25.00 Cita previa: 91.453.26.72 902.02.73.73 Teléfono GuÍa de vaCunas en la oFiCina de FarMaCia Sanidad Exterior Servicio Territorial de Sanidad y Bienestar Social Sanidad Exterior Sanidad Exterior Servicio Provincial de Salud y Consumo Subdirección General de Salud Pública No posee centros de vacunación internacional. Más cercano en Madrid. Sanidad Exterior Servicio Territorial de Sanidad y Bienestar Social Sanidad Exterior Servicio Territorial de Sanidad y Bienestar Social Servicio Provincial de Salud y Consumo Subdirección General de Salud Pública Sevilla Soria Tarragona Tenerife Teruel Toledo Valencia Valladolid Vizcaya Zamora Zaragoza Zaragoza Zamora Bilbao Valladolid Valencia Teruel Santa Cruz de Tenerife Tarragona Soria Sevilla Segovia Servicio Territorial de Sanidad y Bienestar Social Segovia Salamanca Localidad Servicio Territorial de Sanidad y Bienestar Social Centro Salamanca Provincia C/ Ramón y Cajal, 68 50004 Plaza de Alemania, 1 49004 C/ Gran Vía, 62 – portal centro, 1º izda 48071 Avda. Ramón y Cajal, 6 47011 Muelle de la Aduana, s/n Puerto Autónomo de Valencia 46024 Ronda de Liberación, 1 44002 Rambla General Franco, 169 38001 Paseo de la Escollera, s/n (Puerto) 43071 C/ Nicolás Rabal, 7 42003 Avda. de la Raza, 2 41012 Avda. Juan Carlos I, 3 40005 Avda. de Portugal, 83-89 37005 Dirección 976.71.41.02 976.71.50.00 980.54.74.00 94.450.91.07 Información: 983.41.37.60 Cita previa: 983.41.23.27 96.307.97.00 / 01 / 02 978.64.11.57 922.99.92.10 977.99.90.80 Información: 975.23.66.00 Cita previa: 975.23.65.89 955.56.90.08 921.41.71.01 923.29.60.22 923.29.67.09 923.29.67.25 Teléfono A.1 Centros provinCiales de vaCunaCión internaCional 229 GUÍA DE VACUNAS EN LA OFICINA DE FARMACIA ANEXO 2 Glosario GuÍa de vaCunas en la oFiCina de FarMaCia en este anexo se relacionan y definen los principales términos inmunológicos y epidemiológicos citados en los temas. - Adyuvante. sustancia química que mezclada con un antígeno incrementa la respuesta inmunitaria del huésped inmunizado frente a dicho antígeno. se usan en las vacunas inactivadas para generar títulos elevados de anticuerpos. - Anatoxina. toxoide tratado por procedimientos físicos o químicos (por lo general el calor y el formaldehído) que pierde sus propiedades tóxicas conservando la inmunogenicidad. - Antigenicidad. Capacidad de un antígeno para ser reconocido como una partícula extraña a un organismo en el que es introducido. - Antitoxinas. anticuerpos protectores que neutralizan los efectos tóxicos de las exotoxinas bacterianas. - Calendario vacunal. dosis y edades de aplicación de las vacunas sistemáticas en una determinada comunidad o país. por lo general es elaborado por un comité de expertos en el tema y aprobado por las autoridades sanitarias. - Cambio antigénico (shift). variaciones mayores en los antígenos superficiales hemaglutinina (Ha) y neuraminidasa (na) del virus gripal tipo a, que dan origen a la aparición de pandemias. - Caso índice. aquel que aparece en primer lugar en un espacio o lugar determinado. - Caso primario. véase caso índice. - Caso secundario. aquel cuya fuente es un caso índice. - Cobertura vacunal. porcentaje de la población que presenta en su sangre títulos de anticuerpos considerados protectores tras administrar las dosis consideradas necesarias de una vacuna. - Complemento. Conjunto de más de 30 proteínas del plasma que actúan de forma conjunta a través de una cascada de reacciones enzimáticas, que terminan en proteínas que median la inflamación (C3a-C5a), la fagocitosis (C3b), opsonización o la lisis bacteriana (complejo de ataque de membrana o MaC). se activa espontáneamente en contacto con las paredes bacterianas (vía alternativa) o en presencia de anticuerpos específicos (vía clásica). - Contagiosidad. Capacidad de un microorganismo infeccioso para transmitirse entre huéspedes. - Determinante antigénico. el lugar más pequeño en un antígeno al cual se unen los anticuerpos. los antígenos grandes, como las proteínas, llevan varios determinantes antigénicos o epítopos en sus moléculas, contra los cuales se forman diferentes anticuerpos (uno para cada epítopo). - Dosis infectante mínima. número menor de microorganismos que es capaz de producir una enfermedad infecciosa. - Dosis de recuerdo. dosis de vacuna administrada después de la inmunización primaria, con el fin de mantener e incrementar la inmunidad conferida por las dosis de la pauta de vacunación primaria. - Eficacia vacunal. resultados o beneficios de salud proporcionados por una vacuna en los individuos vacunados cuando es aplicada en condiciones ideales - Estabilidad vacunal. resistencia a la degradación física (calor, congelación, luz, etc.) de las vacunas comercializadas, que hace que mantengan sus propiedades inmunógenas hasta la fecha de caducidad si se transportan y se almacenan de acuerdo con las condiciones recomendadas por el fabricante. 232 A.2 Glosario - Fallo vacunal primario. ausencia de respuesta protectora frente a un agente debido a que no se ha producido seroconversión tras la administración de una vacuna. - Fallo vacunal secundario. ausencia de respuesta protectora frente a un agente debido a la pérdida de los anticuerpos generados previamente con la administración de una vacuna. - Fómite. Cualquier objeto inanimado que tiene la capacidad de transmitir una enfermedad infecciosa al estar contaminado con microorganismos. - Fuente de infección. persona, animal, objeto o sustancia a partir del cual pasa un agente infeccioso a un huésped. - Genotipo. subpoblación específica de un microorganismo que se diferencia de otras subpoblaciones de la misma especie en los antígenos de su superficie celular, determinados éstos por medios moleculares. - Huésped. persona o animal que es infectado por un microorganismo infeccioso, donde se multiplica y puede dar lugar o no a una infección. - Inactivación. proceso físico o químico mediante el cual se destruye o inactiva la infecciosidad de los microorganismos patógenos sin afectar su capacidad inmunógena. - Incidencia. número de casos nuevos que aparecen de una enfermedad en una población, y en un período determinado de tiempo. - Infectividad. Capacidad de un microorganismo para acceder a un tejido y multiplicarse en él, dando lugar o no a una enfermedad infecciosa. - Inmunidad celular. respuesta inmunitaria adaptativa mediada por las células t. incluye toda la inmunidad adaptativa que no puede ser transferida a un huésped virgen con los anticuerpos séricos. - Inmunidad de grupo. resistencia de un grupo o población a la invasión o difusión de un agente infeccioso como consecuencia de la resistencia específica a la infección de una elevada proporción de los miembros individuales del grupo o población. - Inmunidad humoral. inmunidad específica mediada por los anticuerpos producidos en la respuesta inmunitaria humoral. a diferencia de la inmunidad celular, la inmunidad humoral puede transferirse a un huésped virgen con el suero de sujetos inmunizados. - Inmunidad individual. resistencia específica frente a la infección de un individuo determinado. - Inmunización. proceso de inducción o provisión de inmunidad artificial a un individuo sano susceptible mediante la administración de un producto inmunobiológico. también se refiere al acto de administración o aplicación de este producto. la inmunización puede ser activa (vacunación) o pasiva (profilaxis mediante suero inmune o inmunoglobulina humana). - Inmunización activa. proceso de inmunización de un huésped a través de la administración de un producto inmunobiológico, la vacuna, que estimula el sistema inmunitario e induce una respuesta inmunitaria específica que protege a dicho individuo en el futuro contra el agente infeccioso frente al que se vacuna. - Inmunización pasiva. proceso de inmunización de un huésped susceptible a través de la administración al individuo sano susceptible de anticuerpos producidos en otro huésped (humano o animal) con el objeto de proporcionarle una protección inmediata y temporal contra el agente infeccioso en cuestión. - Inmunización primaria. primera exposición de un huésped a un antígeno inmunógeno. 233 GuÍa de vaCunas en la oFiCina de FarMaCia - Inmunización secundaria. segunda o siguientes exposiciones de un huésped al mismo antígeno inmunógeno responsable de la exposición primaria. - Inmunogenicidad. Capacidad de un antígeno para generar una respuesta inmunitaria. - Inmunógeno. sustancia que introducida en el cuerpo humano o animal estimula una respuesta inmunitaria adaptativa, es decir, específica de antígeno. todos los inmunógenos son antígenos pero no todos los antígenos son inmunógenos - Intususcepción. introducción o invaginación de un segmento intestinal dentro de la luz de otro segmento adyacente. - Memoria inmunológica. Capacidad del sistema inmunitario para crear clones celulares específicos de un antígeno, que quedan acantonados hasta que tras la nueva entrada de este antígeno, se estimula su multiplicación, haciendo que la respuesta inmunológica sea más rápida y potente. - Neutralización. inactivación biológica de una toxina, microorganismo u otro ligando que ocurre como consecuencia directa de su unión con un anticuerpo específico. - Nucleocápside. parte de un virus constituida por el material genético del virus rodeado de su cápside proteica. - Opsonización. proceso mediante el cual las opsoninas (sustancias capaces de estimular la fagocitosis de un patógeno al que se han unido) son depositadas en la superficie del patógeno, estimulando la fagocitosis. - Patogenicidad. Capacidad de un microorganismo infeccioso para producir una enfermedad al ser transmitido. - Período de incubación. tiempo que transcurre desde que el microorganismo entra en el huésped hasta que aparecen los primeros síntomas. - Período de transmisibilidad. tiempo durante el cuál el microorganismo infeccioso puede pasar de una fuente a un huésped. - Portador. persona o animal que alberga el agente infeccioso específico, sin padecer enfermedad clínica manifiesta y sirve como fuente de infección potencial para la transmisión del agente - Prevalencia. porcentaje de individuos de una población que presentan una enfermedad en un período de tiempo determinado. - Pródromo. síntoma inespecífico que aparece al inicio de una enfermedad. - Reactogenicidad. Capacidad de un fármaco o vacuna para inducir la aparición de una reacción adversa. - Reservorio. lugar (animado o inanimado) donde el microorganismo infeccioso se multiplica a la espera de acceder a un huésped. - Seroconversión. Fase de una infección en la que los anticuerpos frente al agente infeccioso que la causa son detectados por primera vez. - Serotipo. subpoblación específica de un microorganismo que se diferencia de otras subpoblaciones de la misma especie en los antígenos de su superficie celular, determinados éstos por medios inmunológicos. - Tasa de letalidad. Capacidad de un microorganismo infeccioso para producir la muerte de los huéspedes infectados por él. 234 A.2 Glosario - Tasa de replicación. número de microorganismos nuevos que aparecen en el huésped por unidad de tiempo. - Tolerancia. estado de falta de respuesta inmunitaria frente a un inmunógeno potencial. - Toxina, toxoide. Macromolécula de estructura proteínica o liposacarídica, elaborada por distintas especies animales o por microorganismos, y con capacidad para generar daños a un tejido. - Vacuna monovalente. vacuna que contiene antígenos frente a un serotipo de una especie (p. ej., vacuna antipoliomielítica oral monovalente tipo i). - Vacuna polivalente. vacuna que contiene antígenos frente a varios serotipos de una misma especie (p. ej., vacuna antipoliomielítica oral trivalente, vacuna antineunocócica 23-valente). - Vacunación. véase inmunización primaria. - Vacunaciones no sistemáticas. vacunas que sólo tienen interés individual y carecen de interés comunitario. aplicadas en el marco de los servicios de atención primaria, son indicadas por el médico basándose en las circunstancias personales o ambientales que rodean al paciente, de acuerdo con las recomendaciones formuladas por el comité de expertos en el tema. - Vacunaciones sistemáticas. vacunas que presentan interés individual y comunitario, por lo que están indicadas en toda la población, con excepción de los casos de contraindicación general o individual. se aplican en el marco de los servicios de atención primaria en forma de programas de salud pública, financiados con fondos estatales, de acuerdo con un calendario elaborado por el comité de expertos en el tema. - Vacunas combinadas. vacunas que contienen antígenos inmunizantes frente a varios agentes infecciosos diferentes (p. ej., sarampión, rubéola y parotiditis en la vacuna triple vírica). - Vacunas conjugadas. vacuna de antígenos t-independientes que se conjugan de forma covalente a proteínas transportadoras o carriers para convertirlos en t-dependientes con objeto de que sean inmunógenos en los niños menores de 2 años y generen memoria inmunológica. - Vacunas enteras. vacunas inactivadas que contienen los virus o las bacterias completas. - Vacunas inactivadas. vacunas compuestas por gérmenes muertos que han perdido su capacidad patogénica y conservan la capacidad inmunógena. - Vacunas recombinantes. vacunas compuestas por partículas proteicas producidas en células huésped (normalmente levaduras) mediante la inserción por métodos de dna recombinante, del material genético responsable de la codificación del polipéptido deseado. - Virulencia. Capacidad de un microorganismo para ocasionar daño en el huésped al que se transmite. 235 GUÍA DE VACUNAS EN LA OFICINA DE FARMACIA ANEXO 3 Páginas web de interés GuÍa de vaCunas en la oFiCina de FarMaCia - asociación española de vacunología. http://www.vacunas.org/ - asociación española de pediatría: www.aeped.es - Centers for disease Control and prevention: www.cdc.gov/travel - eurosurveillance. dirección General de salud y protección de los consumidores de la Comisión de la ue: http://www.eurosurveillance.org - immunization action Coalition: www.immunize.org - international vaccine institute: www.ivi.org - Ministerio de sanidad y Consumo. Centros provinciales de vacunación internacional: http://www.msc.es/ sanitarios/consejos/vacext.do - organización Mundial de la salud: www.who.int - sociedad española de Medicina preventiva y salud pública: www.sempsph.com 238 GUÍA DE VACUNAS EN LA OFICINA DE FARMACIA BIBLIOGRAFÍA GuÍa de vaCunas en la oFiCina de FarMaCia - Ackerman LK. update on immunizations in children and adolescents. Am Fam Physician. 2008; 77(11): 1561-8. - Bayas JM. Generalidades en vacunas. boletín de vacunación del adulto. 1997. - Benenson, AE. Manual para el control de las enfermedades transmisibles en el hombre. ed. oficina panamericana de salud, washington.1997. - Black S, Shinefield H, Fireman B et al. efficacy, safety and immunogenicity of heptavalent pneumococcal conjugate vaccine in children. Pediatr Infect Dis J. 2000; 19: 187-95. - Campos-Outcalt D. vaccine update: new CdC recommendations from 2007. J Fam Pract. 2008; 57(3): 181-4. - Center for disease Control and prevention. immunization of Health Care workers: recommendations of the advisory Committee on immunization practices (aCip) and the Hospital infection Control practices advisory Committee (HiCpaC). MMWR. 1997; 46 (Nº RR-18): 1-35. - Center for disease Control and prevention. preventing of pneumococcal disease among infants and adult children: recommendations of the advisory Committee on immunization practices (aCip). MMWR. 2000; 49 (Nº RR-9): 1-35. - Center for disease Control and prevention. prevention of varicella: updated recommendations of the advisory Committee on immunization practices (aCip). MMWR. 2007; 56 (Nº RR-4). - Comité asesor de vacunas de la asociación española de pediatría. Calendario vacunal de la asociación española de pediatría: recomendaciones 2008. An Pediatr (barc). 2008; 68(1): 63-9. - Committee on infectious diseases of the american academy of pediatrics. recommendations for the use of live attenuated varicella vaccine. Pediatrics. 1995; 95: 791-796. - Gil A, Carrasco-Garrido P, Gallardo C et al. incidence of adverse reactions to vaccines in a paediatric population. Clinical Drug Investigation. 2004; 24(8): 457-63. - Gil A, Carrasco-Garrido P, Jiménez-García R et al. Grupo de estudio para la detección de reacciones adversas a vacunas de las áreas sanitarias 8 y 9 de atención primaria de la Comunidad de Madrid. acontecimientos adversos después de la vacunación (aadv) durante la primovacunación de la población pediátrica. Pediátrika. 2007; 27(2): 33-37. - Gil A, Oyagüez I, Carrasco P et al. epidemiology of primary varicella hospitalizations in spain. Vaccine. 2002; 20: 295-298. - Kimmel SR. vaccine adverse events: separating Myth from reality. American Family Physician. 2002; 66(11): 2113-20. - Madurga Sanz M, de Abajo Iglesias FJ. Farmacovigilancia de las vacunas: como identificar nuevos riesgos. Rev Pediátr Aten Primaria. 2005; 7(4): 75-91. - Maldonado Y. Current controversies in vaccination: vaccine safety. JAMA. 2002; 288(24): 3155-58. - Mandell, Douglas y Bennett. enfermedades infecciosas. principios y práctica. ed. panamericana, buenos aires. 1997. - Moberley SA, Holden J, Tatham DP et al. vaccines for preventing pneumococcal infection in adults. Cochrane Database Syst Rev; 2008. 23(1): Cd000422. 240 A.3 biblioGraFÍa - Murray PR; Rosenthal KS; Pfaller MA. Microbiología Médica. ed. elsevier españa, 5ª edición. 2006. - Pace D, Pollard AJ. Meningococcal a, C, Y and w-135 polysaccharide-protein conjugate vaccines. Arch Dis Child. 2007; 92(10): 909-15. - Picazo JJ. Guía de vacunaciones. Centro de estudios Ciencias de la salud. 2000. - Plotkin SA, Orenstein W, Offit P. vaccines. ed. wb saunders Company, philadelphia. 5th edition. 1998. - Salleras Ll. la seguridad de las vacunas. Vacunas. 2003; 4: 18-21. - Salleras Ll. vacunaciones preventivas. ed. Masson. 1998. - Shapiro ED, Berg AT, Austrian R et al. the protective efficacy of polivalent pneumococcal polysaccharide vaccine. N Engl J Med. 1991; 325: 1453-60. - Skull SA, Wang EEL. varicella vaccination- a critical review of the evidence. Arch Dis Child. 2001; 85: 83-90. - summary of the outcomes from the national Consensus Conference for vaccine-preventable diseases in Canada, Quebec, Quebec, June 12-14, 2005. Can Commun Dis Rep. 2007; 33(13): 8-15. - Tortora GJ. Microbiology. ed. the benjamin/Cummings publishing Company, inc. redwood City, California. 1992. - Van Damme P, Giaquinto C, Huet F et al; REVEAL Study Group. Multicenter prospective study of the burden of rotavirus acute Gastroenteritis in europe, 2004-2005: the reveal study. J Infect Dis. 2007; 195 Suppl 1: s4-s16. - Van Damme P, Giaquinto C, Huet F et al; REVEAL Study Group. distribution of rotavirus Genotypes in europe, 2004-2005: the reveal study. J Infect Dis. 2007; 195 Suppl 1: s17-25. - Van Damme P, Giaquinto C, Huet F et al; REVEAL Study Group. Clinical Consequences of rotavirus acute Gastroenteritis in europe, 2004-2005: the reveal study. J Infect Dis. 2007; 195 Suppl 1: s26-35. - Wilder-Smith A. Meningococcal vaccine in travelers. Curr Opin Infect Dis. 2007; 20(5): 454-60. - Williams C, Masterton R. pneumococcal immunisation in the 21st century. J Infect. 2008; 56(1): 13-9. 241 GUÍA DE VACUNAS EN LA OFICINA DE FARMACIA CUESTIONARIO DE EVALUACIÓN GuÍa de vaCunas en la oFiCina de FarMaCia NORMAS PARA CUMPLIMENTAR EL CUESTIONARIO • Junto con el cuestionario de evaluación, usted recibirá una plantilla para anotar sus respuestas. si no dispusiese de dicha plantilla, podrá solicitar una nueva al Consejo General de Colegios oficiales de Farmacéuticos. • antes de anotar las respuestas, no olvide escribir su nombre, apellidos, y número de dni (sin letra). de igual manera, rellene su número de matrícula de la actividad formativa. el número de matrícula le será entregados en un sobre junto con su material. si no dispusiese de este número de matrícula, podrá solicitarlo al Centro de atención al Colegiado del Consejo General (tfno: 902 460 902). • el cuestionario de evaluación se compone de 50 preguntas, con una sola contestación correcta. Cada pregunta acertada tiene el valor de 1 punto (máximo 50). las preguntas erróneas no computan en negativo. la superación del curso requiere la obtención de al menos 35 puntos. • para responder a las cuestiones planteadas en el cuestionario, marque una sola respuesta por pregunta con bolígrafo azul o negro, siguiendo las instrucciones del formulario. la respuesta que usted considere correcta se marcará con una X; en caso de equivocarse, tache la casilla completamente. • una vez haya terminado de marcar sus respuestas, no se olvide de anotar la fecha y firmar el cuestionario. • La fecha límite para la entrega del formulario de respuestas será el día 15 de julio de 2009. el cuestionario deberá ser enviado por correo postal a su Colegio Oficial de Farmacéuticos. • sólo se admitirá un cuestionario por inscrito. Únicamente se considerará válido el primer formulario recibido. • el período de reclamación sobre correcciones de cuestionarios finalizará a los 3 meses del cierre efectivo de la campaña (30 de noviembre de 2009). pasados este período, esto es, a partir del día 28 de febrero de 2010, sólo se admitirán reclamaciones relativas a extravíos de diplomas de acreditación de personas ya aprobadas. TELÉFONOS DE CONSULTA Consultas administrativas: 902 460 902 (l-v: 09:00-19:00). Consultas técnicas: 91 432 81 03 (l-v: 09:00-14:00). 244 CUESTIONARIO EVALUACIÓN CUESTIONARIO DE EVALUACIÓN “ACTUALIZACIÓN DE LOS CONOCIMIENTOS EN VACUNACIÓN” 1) señale la respuesta Falsa con respecto a los criterios que debe cumplir un microorganismo para ser considerado el responsable de una enfermedad infecciosa: a) su inoculación en un animal sano susceptible reproduce la enfermedad. b) el microorganismo se aísla y cultiva a partir de las lesiones de la persona enferma. c) la inoculación del microorganismo en un animal sano susceptible no permite aislarlo de las lesiones del animal. d) el microorganismo está presente en todos los individuos enfermos. e) el microorganismo ocasiona una respuesta inmunitaria que puede ser objetivamente cuantificada. 2) la capacidad que tiene un microorganismo para ocasionar daño al huésped que coloniza se denomina: a) patogenicidad. b) infectividad. c) transmisibilidad. d) virulencia. e) Contagiosidad. 3) señale cuál de las siguientes opciones no se considera un mecanismo de transmisión directo. a) transmisión transplacentaria. b) transmisión por ingestión de aguas contaminadas. c) transmisión por vía sexual. d) transmisión aérea. e) transmisión por una mordedura. 4) ¿Cuál de las siguientes vacunas no forma parte siempre de los calendarios de vacunación?: a) triple vírica. b) difteria, tétanos y tos ferina. c) Haemophilus influenzae tipo b. d) Hepatitis b. e) varicela. 245 GuÍa de vaCunas en la oFiCina de FarMaCia 5) señale la opción que no es una característica de las vacunas atenuadas: a) no requieren adyuvantes. b) no dan lugar a infecciones entre los no vacunados. c) inducen respuesta humoral y celular. d) suelen requerir una única dosis. e) necesitan menor número de microorganismos que las inactivadas. 6) ¿Cuál de las siguientes vacunas es atenuada? a) varicela. b) rabia. c) Gripe. d) Hepatitis b. e) papilomavirus. 7) Marque la opción CorreCta acerca de la poliomielitis: a) es una enfermedad de origen bacteriano, producida por cepas de Listeria monocytogenes. b) se caracteriza por la presencia de parálisis flácida. c) la principal fuente de infección son los animales de compañía. d) la vacunación ha conseguido erradicar esta enfermedad desde el año 2005. e) los primeros síntomas que aparecen son respiratorios, ya que es por esta vía por donde penetra el microorganismo. 8) señale en qué condiciones no se recomienda la utilización de la vacuna salk: a) vacunación sistemática infantil en países en vías de desarrollo. b) vacunación de individuos con sida. c) adultos no vacunados que convivan con niños que hayan recibido la vacuna sabin. d) pacientes hospitalizados que requieran la vacunación. e) individuos en los que esté contraindicada la vacuna sabin. 9) ¿Cuál de las siguientes pautas sería recomendable para una persona de 35 años, que presenta una herida incisa sucia y que recibió la última vacuna antitetánica siete años antes? a) vacunación antitetánica. b) vacunación antitetánica + inmunoglobulina antitetánica. 246 CUESTIONARIO EVALUACIÓN c) inmunoglobulina antitetánica. d) nada. e) c y d son correctas. 10) ¿a qué razón se debe la necesidad de revacunar cada 10 años con las vacunas contra difteria, tétanos y tos ferina?: a) no es necesaria la revacunación cada 10 años. b) para erradicar estas enfermedades infecciosas. c) porque son enfermedades que no confieren inmunidad natural, y los títulos de anticuerpos no se consideran protectores una vez pasado este período. d) todas son correctas. e) ninguna es correcta. 11) ¿Cuál de los siguientes virus puede ocasionar daños fetales cuando infecta a una mujer embarazada? a) sarampión. b) rubeola. c) parotiditis. d) tos ferina. e) Hepatitis a. 12) señale la opción Falsa acerca de la posología de la vacuna triple vírica: a) la primovacunación debe realizarse a los 15 meses de edad. b) en caso de riesgo, podría vacunarse a los niños a partir de los 9 meses. c) se debe administrar una segunda dosis entre los 4-6 años para prevenir fallos vacunales. d) si el niño no ha sido vacunado a los 4-6 años, recibirá una dosis a los 11 años. e) la vacuna debe administrarse por vía intravenosa. 13) ¿Cuál de los siguientes cuadros puede ocasionar el Haemophilus influenzae tipo b?: a) epiglotitis. b) Celulitis. c) Meningitis. d) pericarditis. e) todas las anteriores. 247 GuÍa de vaCunas en la oFiCina de FarMaCia 14) ¿a qué personas debe administrarse quimioprofilaxis anti-Haemophilus influenzae tipo b? a) todos los miembros de la familia que convivan con niños no vacunados menores de 5 años, si alguno de ellos ha tenido contacto íntimo con un caso de meningitis por Hib. b) todos los miembros de una familia en la que haya algún niño inmunodeprimido, si alguno de ellos ha tenido contacto íntimo con un caso de meningitis por Hib. c) todos los contactos íntimos de un caso de meningitis, que sean menores de 5 años, independientemente de su estado vacunal. d) todos los anteriores. e) ninguno de los anteriores. 15) señale la opción Falsa con respecto a la vacunación frente a Haemophilus influenzae tipo b. a) las reacciones adversas de esta vacuna suelen ser de tipo local, junto con fiebre e irritabilidad. b) se recomienda emplear la vacuna en niños menores de 5 años no vacunados. c) la vacuna se administrará por vía subcutánea o intramuscular. d) si una mujer no vacunada se queda embarazada, se procederá a administrar la vacuna cuanto antes. e) la eficacia de la vacuna se iniciar a las 1-2 semanas de su administración. 16) señale la opción CorreCta respecto al meningococo. a) Neisseria meningitidis es un diplococo Gram positivo. b) las fimbrias permiten establecer la diferenciación de meningococo en 20 serotipos diferentes. c) el contagio del meningococo se produce a través de la inhalación de aerosoles con la bacteria. d) el serogrupo w135 es el principal causante de infección por neumococo. e) la frecuencia de infección meningocócica, así como su letalidad, es mayor en el varón. 17) en caso de aparecer un niño con meningitis meningocócica, ¿a qué personas debería administrarse quimioprofilaxis con rifampicina? a) a las personas que vivan en la misma vivienda que el caso. b) a todos los niños del colegio al que vaya el caso. c) a las personas que hayan dormido en la misma habitación 14 días antes a su hospitalización. d) a todos los anteriores. e) a ninguno de los anteriores. 18) ¿Qué ventaja presenta la vacuna conjugada polisacarídica contra el meningococo, frente a la vacuna polisacarídica a + C? 248 CUESTIONARIO EVALUACIÓN a) es más inmunógena en niños menores de 18 meses. b) produce memoria inmunológica. c) da lugar a elevados niveles de anticuerpos. d) ocasiona efecto booster. e) todas las anteriores. 19) Marque la opción correcta sobre el virus de la hepatitis b. a) el agHbs es un determinante antigénico de la glicoproteína gp27, presente en la cubierta del virus. b) el virus de la hepatitis b pertenece a la familia paramyxoviridae. c) el virus carece de transcriptasa, por lo que tiene que emplear el enzima presente en la célula huésped. d) el virus tiene una estructura helicoidal. e) el material genético está constituido por rna monocatenario. 20) señale las posibles vías de transmisión de la hepatitis b. a) transmisión vertical intrauterina. b) transmisión vertical en el parto. c) transmisión oral. d) transmisión por inhalación de gotículas respiratorias. e) todas las anteriores. 21) Marque la opción Falsa respecto a la vacuna de hepatitis b. a) se puede encontrar tanto sola, como asociada a toxoides diftéricos, pertúsicos, Bordetella pertussis o Haemophilus influenzae tipo b. b) la vacunación en niños recién nacidos requiere tres dosis. c) en niños de bajo peso (<1500 g al nacer) se debe iniciar la vacunación cuanto antes, debido a su mayor susceptibilidad. d) no aporta protección contra el virus a, pero sí podría aportarla contra el d, ya que la infección por este virus requiere coinfección con el virus b. e) parece ser más eficaz en niños y adolescentes que en ancianos. 22) Marque la opción Falsa con respecto a la varicela: a) la varicela es una infección ocasionada por un herpesvirus. b) el único reservorio del virus es el ser humano. 249 GuÍa de vaCunas en la oFiCina de FarMaCia c) los virus de la varicela quedan acantonados en los ganglios nerviosos después de la infección. d) el virus de la varicela no atraviesa la placenta. e) la reactivación del virus de la varicela acantonado en los nervios ocasiona el herpes zóster. 23) señale la afirmación CorreCta acerca de las diferentes estrategias de vacunación contra la varicela seguidas hasta el momento: a) en la vacunación universal en la infancia, se procede a vacunar a los niños a partir de los 4 años de edad. b) la vacunación universal durante la infancia podría tener el inconveniente de dar lugar a una mayor incidencia de varicela en pacientes adultos, apareciendo mayor incidencia de complicaciones. c) la vacunación en adolescentes susceptibles es una opción más cara que la vacunación universal en la infancia. d) la vacunación en adolescentes susceptibles consigue reducir la circulación del virus en la población. e) la vacunación en adolescentes susceptibles anula el riesgo de sufrir un herpes zóster. 24) ¿Cuál es el cuadro infeccioso más común ocasionado por Streptococcus pneumoniae? a) otitis media. b) Meningitis. c) neumonía. d) Celulitis. e) bacteriemia sin foco. 25) señale las ventajas de la vacuna conjugada antineumocócica frente a las vacunas polisacarídicas. a) presenta mayor cobertura vacunal al tener más serotipos de neumococos incluidos en su composición. b) es eficaz en niños menores de 2 años. c) produce memoria específica contra el neumococo. d) b y c son correctas. e) ninguna es correcta. 26) señale la opción Falsa acerca del virus de la gripe: a) la aparición de variaciones antigénicas dota al virus de la gripe de una gran capacidad de mutación. b) se han descrito virus de gripe en animales con capacidad para saltar la barrera interespecie y afectar al hombre. c) la gripe es una enfermedad leve y autolimitada. d) el virus de la gripe se transmite fundamentalmente por vía respiratoria. 250 CUESTIONARIO EVALUACIÓN e) las pandemias de gripe se producen cuando aparece un nuevo tipo de virus de gripe. 27) Marque la opción CorreCta sobre los fármacos antivirales frente a la gripe. a) existen evidencias claras que permiten asegurar la eficacia de los antigripales en pacientes de alto riesgo. b) el oseltamivir suele dar lugar a reacciones adversas gastrointestinales. c) los inhibidores de neuraminidasa se administrar por vía oral. d) la amantadina es el antiviral más seguro y eficaz que se dispone frente al virus de la gripe. e) los pacientes asmáticos pueden usar zanamivir sin tomar ninguna precaución especial. 28) señale a cuál de los siguientes pacientes se podría recomendar la vacunación antigripal: a) paciente mayor de 65 años. b) Mujeres embarazadas. c) trabajadores en residencias de la tercera edad. d) niños asmáticos. e) todos ellos. 29) Marque la opción CorreCta acerca de la hepatitis a: a) los brotes de hepatitis a suelen deberse al consumo de agua o alimentos contaminados. b) el virus de la hepatitis a es muy lábil al calor, por lo que su transmisión es difícil. c) la hepatitis a es una enfermedad exclusiva del ser humano. d) es una enfermedad especialmente grave durante la infancia temprana, mostrando una mayor virulencia que en el adulto. e) la distribución del virus de la hepatitis a es homogénea a lo largo del mundo. 30) ¿a cuál de estas personas podría recomendarse la vacunación anti-hepatitis a? a) Mujeres embarazadas. b) pacientes con hepatitis crónica C. c) Mujeres en período de lactancia. d) pacientes con sida. e) todos ellos. 31) ¿Cuál de los siguientes elementos define los serotipos G del rotavirus? a) vp2. 251 GuÍa de vaCunas en la oFiCina de FarMaCia b) vp4. c) vp6. d) vp7. e) rna. 32) Marque la opción CorreCta respecto al rotavirus. a) la transmisión es fecal-oral. b) el virus es altamente lábil a las condiciones externas. c) la gastroenteritis por rotavirus tiene un período de incubación de una semana. d) la transmisión se da únicamente en países con condiciones sanitarias e higiénicas deficientes. e) en nuestro país la infección se da fundamentalmente en los meses de verano. 33) señale la opción Falsa acerca de la vacunación por rotavirus: a) la vacuna resortante contienen virus con antígenos de origen humano y animal. b) las diferentes vacunas disponibles son equivalentes entre sí, y por tanto sustituibles. c) la vía de administración de la vacuna del rotavirus es exclusivamente oral. d) se desconoce como actúa la vacuna, pues los niveles de anticuerpos anti-rotavirus no se correlacionan con la protección frente al virus. e) la pauta de vacunación deberá comenzarse a partir de la sexta semana de vida, y finalizarse antes de la semana 24 o 26, en función de la vacuna. 34) Marque la respuesta Falsa con respecto a la infección por papilomavirus: a) existen distintos tipos de papilomavirus, pero no todos dan lugar a neoplasias malignas. b) la utilización de preservativo es una medida totalmente eficaz para prevenir el contagio por papilomavirus. c) los papilomavirus tipos 16 y 18 constituyen uno de los principales agentes asociados a la aparición de carcinoma del cuello del útero. d) el papilomavirus genital se transmite vía sexual, con o sin penetración. e) si bien la infección por papilomavirus es muy común, sólo aquellas lesiones no tratadas de larga duración (varios años) podrían ocasionar un posible carcinoma de cérvix. 35) señale la opción CorreCta acerca de la vacuna contra el papilomavirus. a) a pesar de la vacunación, se deben continuar con las medidas de cribado de carcinoma de cuello de útero. b) para vacunar a una niña contra el papilomavirus, deben administrarse tres dosis de las vacunas disponibles, pudiendo iniciar la vacunación con una marca comercial y terminándola con otra distinta. 252 CUESTIONARIO EVALUACIÓN c) se consideran títulos protectores de anticuerpos a los niveles de al menos 1:1000. d) todas las vacunas comercializadas permiten la prevención de las displasias malignas de cérvix, así como de las verrugas genitales. e) se recomienda congelar las vacunas para asegurar su conservación. 36) señale la opción no recomendable en caso de un paciente no vacunado contra la rabia, que presente una mordedura de un animal salvaje, con sangrado y manchada de tierra: a) lavado de la herida con agua y jabón. b) administración de profilaxis antitetánica con inmunoglobulina y/o vacuna antitetánica. c) sutura rápida de la herida para evitar la pérdida de sangre. d) administración de inmunoglobulina antirrábica en los alrededores de la herida. e) administración de vacuna antirrábica. 37) ¿Qué recomendaciones sería recomendable hacer a una persona que viaje al trópico, con respecto a las picaduras de serpientes e insectos? a) en zonas de alta hierba, tantear con un palo para evitar que las serpientes se nos aproximen. b) evitar la exploración en zonas poco transitadas. c) llevar suero antiveneno para su administración en caso de picadura. d) tener en nuestro botiquín de viaje ácido acetilsalicílico para eliminar el dolor. e) todas las anteriores. 38) ¿a cuál de las siguientes personas se debería recomendar que evitase coger un avión? a) paciente con angina de pecho en reposo. b) niños menores de 1 mes. c) pacientes con enfermedad contagiosa leve. d) Mujer embarazada de 7 meses. e) pacientes hipertensos con cifras de 170 mmHg. 39) ¿Cuál de los siguientes factores no es necesario tener en cuenta cuando se va a iniciar un viaje internacional? a) nivel socio-económico del viajero. b) duración de la estancia. c) tipo de alojamiento: rural o urbano. d) estado de inmunización previo del viajero. 253 GuÍa de vaCunas en la oFiCina de FarMaCia e) destino. 40) ¿Cuál de los siguientes fármacos no se emplea habitualmente en prevención de malaria? a) Cloroquina. b) Mefloquina. c) Mebendazol. d) proguanil. e) atovacuona. 41) señale cuál de las siguientes vacunas no es sistemática en todos los calendarios de vacunación infantil. a) dtp. b) triple vírica. c) antineumocócica. d) anti-Haemophilus influenzae tipo b. e) poliomielitis. 42) ¿Cuáles de las siguientes vacunas no suelen administrarse conjuntamente en la edad infantil? a) dtp y vpi. b) antimeningocócica y varicela. c) Hib y hepatitis b. d) dtp y Hib. e) antimeningocócica y dtp. 43) Marque la opción CorreCta con respecto a los calendarios de vacunación infantil. a) los calendarios de vacunación infantiles presentan algunas diferencias, en función de la Comunidad autónoma estudiada. b) la inclusión de una vacuna en un calendario de vacunación se basa en criterios estrictamente económicos. c) todos los calendarios de vacunación recomiendan la administración de 5 dosis de vacuna contra el meningococo, tres de ellas antes del año de edad. d) la vacuna triple vírica ha sido recientemente excluida de los calendarios de vacunación. e) todas las Comunidades autónomas recomiendan la utilización de vacuna frente a varicela exclusivamente en niños de 10-15 años que no hayan pasado la enfermedad. 44) ¿por qué razón se recomienda la revacunación de ciertas enfermedades en los adultos? 254 CUESTIONARIO EVALUACIÓN a) algunas de las vacunas de la infancia no ocasionan inmunidad de por vida. b) existen cohortes de personas que no fueron vacunadas en la edad correspondiente porque la inclusión de la vacuna fue posterior. c) la utilización masiva de vacunas en la población ha impedido la puesta en contacto entre el paciente y los microorganismos, con la consiguiente generación de inmunidad natural. d) ninguna es correcta. e) todas son correctas. 45) Marque la opción inCorreCta respecto a las siguientes parejas de grupos de población y la vacuna a recomendar en cada caso: a) vacuna de la gripe en niños asmáticos. b) dtp en personas que vayan a realizarse un tatuaje. c) vacuna anti-neumocócica en enfermos de sida sintomáticos. d) triple vírica en mujeres embarazadas. e) vacuna anti-hepatitis b en pacientes hemofílicos. 46) ¿Cuál de los siguientes controles debe realizarse cuando se recepciona un envío de vacunas? a) lote de vacunas. b) Control de la cadena de frío. c) Fecha de caducidad. d) origen de las vacunas. e) todos los anteriores. 47) Marque la opción CorreCta respecto al almacenamiento de las vacunas. a) las vacunas deben colocarse en la puerta de la nevera, para evitar su congelación. b) en caso de que se rompa la cadena del frío, los lotes afectados serán desechados en cualquier circunstancia. c) se debe controlar de forma habitual la temperatura de la nevera donde se almacenen las vacunas. d) la congelación de la vacuna garantiza su estabilidad física. e) todas las anteriores son correctas. 48) las reacciones adversas de tipo b se caracterizan por ser: a) impredecibles. b) Frecuentes. 255 GuÍa de vaCunas en la oFiCina de FarMaCia c) retardadas. d) asociadas a tratamientos prolongados. e) de letalidad baja. 49) los acontecimientos adversos después de la vacunación (aadv) más frecuentes son de tipo: a) reacciones sistémicas. b) reacciones locales. c) reacciones alérgicas. d) reacciones teratogénicos. e) las reacciones adversas con vacunas son muy poco frecuentes. 50) ¿Con cuál de las siguientes vacunas son de esperar mayor número de reacciones adversas? a) poliomielitis. b) Haemophilus influenzae tipo b. c) pertussis de células enteras. d) Hepatitis b. e) Meningococo C. Cuestionario de valoración a continuación, le agradeceríamos que respondiese a las siguientes cuestiones, que nos serán de gran utilidad para mejorar el servicio prestado por el Consejo General de Colegios oficiales de Farmacéuticos. anote las respuestas en las casillas a partir del número 54. 54) ¿Cuál es su valoración global de la actividad sanitaria “Actualización de los Conocimientos en Vacunación”? a) excelente. b) Muy buena. c) buena. d) normal/suficiente. e) Mala. 55) ¿Cuál es su valoración del contenido científico de la guía de formación? a) excelente. b) Muy buena. 256 CUESTIONARIO EVALUACIÓN c) buena. d) normal/suficiente. e) Mala. 56) ¿en qué medida el contenido abordado en la actividad sanitaria y en la guía monográfica de formación es de utilidad para su actividad profesional? a) imprescindible. b) Muy conveniente. c) aconsejable. d) poco útil. e) nada útil. 57) ¿Cómo valora la presentación de los materiales gráficos de la campaña (guía de formación, dípticos, cartel)? a) Muy satisfecho. b) bastante satisfecho. c) satisfecho. d) poco satisfecho. e) nada satisfecho. 58) ¿Cómo consideraría la actualización del curso en un futuro próximo? a) imprescindible. b) Muy conveniente. c) aconsejable. d) poco necesaria. e) nada necesaria. 59) ¿Qué valoración tiene acerca del funcionamiento de la secretaría técnica –corrección de exámenes y certificados– si la ha utilizado alguna vez? a) Muy buena. b) buena. c) Mejorable. d) Mala. e) no la he utilizado. 257 GuÍa de vaCunas en la oFiCina de FarMaCia 60) ¿Qué opinión tiene acerca de la página web de la campaña en www.portalfarma.com (si la ha utilizado alguna vez)? a) Muy buena. b) buena. c) Mejorable. d) Mala. e) no la he consultado. 258 100mm 90mm 60mm 40mm 30mm 20mm 10mm 5mm