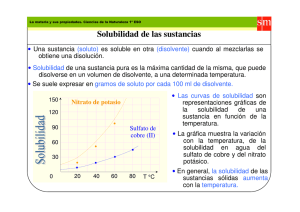
EQUILIBRIO DE PRECIPITACIÓN
Anuncio

EQUILIBRIO DE PRECIPITACIÓN 2ºBACH 1. Calcular el producto de solubilidad del Cd(OH)2 sabiendo que su solubilidad es de 2,1 · 10-3g/L s= 1,1 · 10-3 g Cd(OH)2 1 mol · l 146 g Cd(OH)2 Cd(OH)2(s) Cd(OH)2(aq) → 1,4 · 10 5 mol / l Cd2+ + 2OH- s s Kps= [Cd2+] [OH-]2 ; 2s Kps= s · (2s)2 ; Kps= 4s3 = 4 · 1,4 · 10-5 = 1,1 · 10-14 2. Calcular las concentraciones de Ba2+ y de IO3- y la solubilidad del Ba(IO3)2 en g/l a 250C en una disolución saturada de Ba(IO3)2. Kps= 6,5 · 10-10 ]Ba(IO3)2(s) → Ba(IO3)2(aq) s Ba2+ + 2IO3s Kps= [Ba2+] [IO3-]2 ; Kps= s ·(2s)2 = 4s3 ; s 2s 3 6,5· 10 4 10 ; s= 5,5 · 10-4 M La solubilidad del Ba(IO3)2 es 5,5 · 10-4 M mol 487 ,1 g Ba(IO 3 )2 5,5 · 10 l · 1 mol -4 0,27 g/l [Ba2+] = 5,5 · 10-4 M [IO3-] = 2 · 5,5 · 10-4 = 1,1 · 10-3M 3. Calcular el producto de solubilidad del Ag2SO4 si 1,6 · 10-2 mol en 1,00 l de disolución producen una disolución saturada. Ag2SO4(s) Ag2SO4(aq) → s Kps= [Ag+]2 [SO42-] = (2s)2· s= 4s3 ; 2Ag+ + SO42- 2s s Kps= 4 ( 1,6 · 10-2)3= 1,6 · 10-5 4. Calcular la [Ba2+] y la de [IO3-] así como la solubilidad del Ba(IO3)2 en una suspensión de Ba(IO3)2 a la que se le añaden 0,10 mol por litro de KIO3. Kps= 6,5 · 10-10 IES “ANTONIO CALVÍN” 1 EQUILIBRIO DE PRECIPITACIÓN 2ºBACH IO3- el equilibrio se Por Le Chatelier habrá una disminución de la solubilidad al añadir desplazará hacia la izquierda, es decir, hacia el precipitado Ba(IO3)2(s) Ba(IO3)2(aq) s → Ba2+ s + 2IO3- ; KIO3 2s 0,10M → K+ 0,10M Kps= [Ba2+] [IO3-]2= s (2s + 0,10)2 ; s<<<0,10 ; + IO3- 0,10M 6,5 · 10-10 = 0,102 · s ; s= 6,5 · 10-8M LA SOLUCIÓN DE LOS SIGUIENTES EJERCICIOS ESTÁN EN EL OTRO DOCUMENTO A MANO 1. Una solución saturada de cloruro de plomo(II) contiene, a 25 °C, una concentración de iones plomo(II) de 1,6 l0-2 mol /l. a) Calcula la concentración de iones cloruro de esta disolución. b) Calcula la constante del producto de solubilidad del cloruro de plomo a esta temperatura. 2. Los productos de solubilidad del cloruro de plata y del fosfato de plata son receptivamente: 1,6.10-11 y 1,8.10-18. Indíquese razonadamente: a) ¿Qué sal será más soluble en agua? b) ¿Cómo se modificará la solubilidad, si se las disuelve en una disolución de nitrato de plata? 3. Una disolución contiene iones calcio en concentración 0,010 M. Calcula: a) La concentración de fluoruro mínima que hay que añadir para que comience la precipitación del fluoruro cálcico. b) La concentración de fluoruro que hay que añadir para que la precipitación sea total. DATOS: Ks = 3.9.10-11 4. Se tiene una disolución saturada de carbonato cálcico en equilibrio con su sólido. ¿Cómo se verá modificada la solubilidad del precipitado, al añadirle otra de carbonato sódico? Razónese la respuesta. 5. A una cierta temperatura el Kps para el AgCl es 2,8 x 10-10 . Se desea saber la solubilidad del AgCl en una disolución 0,010 molar de HCl a esa temperatura. 6. A 25 °C la solubilidad del yoduro de plomo (II), en agua pura, es 0,70 g/l. Calcule a) El producto de solubilidad. b) La solubilidad del yoduro de plomo (II), en moles/l en una disolución acuosa de yoduro de potasio 0,50 M 7. Calcule la solubilidad del Pb(IO3)2 en una solución de un litro que contiene 0,020 moles de KIO3, sabiendo que el producto de solubilidad del primero es 3,2 .10-l3 . 8. La solubilidad del Cd3(PO4)2 en agua es 1,2 10-7 M . a) ¿Cuántos gramos del mismo habrán disueltos en 1,3 litros de disolución? b) ¿Cuánto vale el producto de solubilidad de esta sal? DATOS: masas atómicas: Cd = 112; P = 31,0; O = 16,0. IES “ANTONIO CALVÍN” 2 EQUILIBRIO DE PRECIPITACIÓN 2ºBACH IES “ANTONIO CALVÍN” 3