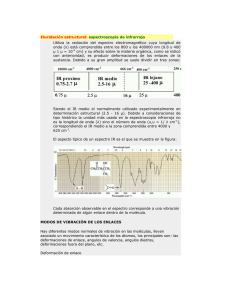
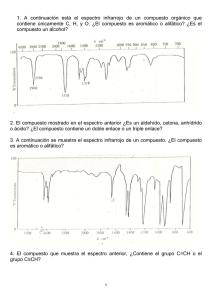
Espectroscopía infrarrojo - Departamento de Química Orgánica
Anuncio

19/08/2013 Espectroscopía infrarrojo cercano 1 19/08/2013 Diagrama de Morse Molecula diatómica: A-B R0: distancia interatómica normal c) Ionization La energía está cuantizada A A* Tipo de excitación: depende de la energía entregada -Rotacional (solo se observa en gases) -Vibracional E = h = hc/ -electrónica El comportamiento de la molécula diatómica se puede describir en base al oscilador armónico cuántico: 2 19/08/2013 F = -k r F=mxa -k r = m -k r = m x x a d2 r d2t2 Ley de Hook 1º ley de Newton Ec. diferencial. Ec. del movimiento del oscilador armónico lineal Solución (una de las posibles) r = a sen √(k/m x t ) El incremento de la distancia (r) respecto de la distancia de equilibrio es función periódica del tiempo, t, de forma sinusoidal r a t -a m t También se puede escribir r = a sen (2put) 2put = √k/m t u= 1 √(k/m) u: frecuencia 2p u= 1 √(k/m) u: número de onda 2pc u= 1 √(k/m) m: masa reducida m = M1 M2/M1 + M2 2pc Momento dipolar: m = q x d (carga por distancia) Si la distancia tiene una dependencia sinusoidal del tiempo, el momento dipolar también. Cuando una molécula diatómica heteronuclear vibra, se genera un momento eléctrico dipolar oscilante, que emite radiación electromagnética de la misma frecuencia que la de la vibración. Análogamente, una molécula expuesta a una radiación electromagnética puede absorber energía de la frecuencia coincidente con la de la vibración y vibrar con un aumento de la amplitud! FH, CO, NO Moléculas diatómicas heteronucleares Tienen me ≠ 0, mayor o menor según la diferencia de electronegatividad entre los 2 átomos. Entonces al vibrar me varía y emiten radiación electromagnética. También absorben en presencia de la radiación de la energía apropiadada. Dan lugar a una banda de absorción en el espectro infra-rojo, de una u dada . Además aparecen otras bandas mas débiles situadas a 2 u, 3 u, etc., llamadas armónicos o sobretonos, y que se deben a que las vibraciones moleculares no son estrictamente armónicas. H2, O2, N2, F2 Moléculas diatómicas homonucleares No tienen momento dipolar permanente (me = 0) pues la distribución electrónica del enlace es simétrica respecto del centro del enlace. Al vibrar la malécula su m sigue siendo = 0 , por lo tanto no hay absorción de radiación electromagnética, porque no hay dipolo oscilante. No presenta bandas en el IR 3 19/08/2013 u= 1 √(k/m) 2pc m: masa reducida m = M1 M2/M1 + M2 k: constante de fuerza Si k aumenta, el resorte Ej: C-C es mas fuerte aumenta u 800-1200 cm-1 C=C 1600-1680 cm-1 C≡C 2100-2250 cm-1 Si m disminuye, aumenta u (efecto isotópico) Ej: CH3OH CH3OD m = 16 x 1 /16+1 = 0.94 m = 16 x 2 /16+2 = 1.77 La frecuencia de la vibración es menor 4 19/08/2013 Ej: C=O, molécula lineal 3N-5= 1 O=C=O, 3N-5= 4 streching tensión simétrica tensión asimétrica flexión en el plano flexión fuera del plano Las vibraciones de flexión son degeneradas. Las vibraciones de tensión aparecen a frecuencias mayores Ej: H2O 3N-6= 3 5 19/08/2013 Una molécula puede ser modelada como un sistema de osciladores acoplados, descriptos aproximadamente por un movimiento armónico cuántico. Por compleja que sea una molécula su modelo vibracional es una combinación de sus modos normales de vibración. Cada modo normal tiene su propia curva de energía potencial. H H C C H modo asimétrico dos se estiran y uno se contrae 2962 cm-1 H H H H H C C H modo simétrico los tres se estiran y contraen en fase 2872 cm-1 H H H modo simétrico 1375 cm-1 modo asimétrico 1450 cm-1 H H C C H H modo asimétrico 1350 cm-1 modo simétrico 1150 cm-1 modos fuera del plano Espectroscopia vibratoria Una molécula compuesta por n átomos tiene 3n grados de libertad, seis de los cuales son traslaciones y rotaciones de la molécula por sí misma. Esto deja 3n6 grados de libertad vibracional (3n-5 si la molécula es lineal). A los modelos vibracionale usualmente tienen nombres característicos como "stretching", "bending", "scissoring", "rocking" y "twisting". La molécula de 4 átomos de formaldehido, cuyo espectro en fase gaseosa se muestra, provee un ejemplo de estos términos. 6 19/08/2013 La frecuencia exacta a la que ocurre una vibración, es función de la fuerza de los enlaces en cuestión y la masa de los átomos. En la práctica, el espectro infrarrojo no muestra normalmente señales de absorción separadas para cada uno de los 3n-6 modos de vibración de una molécula. El número de absorciones se puede incrementar por una suma y substracción de interacciones que resultan en una combinación de tonos de las frecuencias fundamentales de vibración. Además el número de absorciones observadas puede ser menor por simetría molecular, limitaciones del espectrómetro y reglas de selección espectroscópicas. Una regla de selección que influencia la intensidad de las absorciones infrarrojas, es que un cambio del momento en un dipolo debe ocurrir para una vibración y absorber la energía infrarroja. Las bandas de absorción asociadas al enlace C=O "stretching" son usualmente muy fuertes porque un cambio muy grande del dipolo sucede en ese modo. Para el etileno, en cambio, las bandas se observan en la misma frecuencia (fuerza de enlace comparable), pero son bandas de poca intensidad. Regiones típicas de un espectro IR La frecuencia exacta de una transición para un enlace determinado va a depender entre otras cosas de la fuerza del enlace y de la masa de los átomos en los extremos del enlace Notar que las regiones coloreadas de azul por arriba de la linea punteada se refiere a "stretching vibrations", y la banda verde coloreada debajo de la línea punteada se refiere a las vibraciones "bending". La complejidad del espectro infrarrojo en la región de 1450 a 600 hace difícil asignar todas las bandas de absorción, y dados los patrones únicos encontrados aquí, es comunmente llamada la región fingerprint (huella digital en español). Las bandas de absorción que están en la región de los 4000 a 1450 son usualmente debidas a vibraciones "stretching" de unidades diatómicas, y a veces es llamada la región frecuencia de grupo. 7 19/08/2013 ZONAS CARACTERISTICAS DE ABSORCION INFRARROJA Todos los enlaces de una molécula van a sufrir transiciones vibracionales, cada una con una frecuencia determinada y característica, y cada una de estas transiciones va a provocar una banda de absorción El espectro IR va a registrar todas estas bandas 8 19/08/2013 Espectro IR del ciclobutanol Espectro IR de la butanona 9 19/08/2013 Espectro IR del isobutiraldehido Son importantes: Intensidad de la banda, forma y la u Para cuantificar vario componentes, se elige una para cada uno Si a una contribuyen varios componentes, Atotal= ∑ eici d y se arman n ecuaciones con n incógnitas. 10 19/08/2013 • Una de las grandes ventajas de la espectroscopía por infrarrojo es que virtualmente, cualquier muestra en cualquier estado puede ser estudiada. Líquidos, soluciones, pastas, polvos, películas, fibras, gases y superficies, pueden ser examinadas eligiendo un buen modo de muestreo. • Los espectrometros han estado comercialmente disponibles desde 1940. En ese tiempo, los instrumentos utilizaban un prisma como elemento de dispersión, pero a mediados de 1950, las rejillas de difracción, se introdujeron en los 1nstrumentos de dispersión. Los avances mas significativos en la técnica, llegaron como resultado de la introducción de la Transformada de Fourier en la espectrometría. Éste tipo de instrumentos utiliza un interferómetro (inventado por Albert Abraham Michelson), y explota el proceso matemático de la Transformada de Fourier. La espectrometría por infrarrojo por transformada de fourier, incrementó dramáticamente la calidad de los espectros infrarrojos y minimizó el tiempo para adquirir la información. Espectrofotómetros IR Dispersivos: utilizan redes o prismas y se mide punto a punto la energía emergente de la muestra (luz ransmitida en función de . No dispersivos: utilizan interferómetro ((luz transmitida en función de t) Transformada de Fourier Rapidez Precisión Sensibilidad (repetición de experimentos y suma de espectros) • El proceso de muestreo depende en gran medida del tipo de muestra que será examinada, si se encuentra en estado sólido, líquido o gaseoso. FT IR Los componentes básicos de un espectrómetro FT IR, se muestran en la figura. La radiación surge de la fuente y es pasada a través de un interferómetro a la muestra antes de alcanzar el detector. Se hace una amplificación de la señal, en donde se eliminan las contribuciones de alta frecuencia por un filtro, la información se convierte en forma digital -ceros y unos-, por un convertidor analógico digital y pasado a la computadora para aplicar la Transformada de Fourier. 11 19/08/2013 FUENTE: debe ser de intensidad elevada y constante La fuente de radiación IR puede ser una cerámica contaminada con óxidos de Zirconio, Torio y Cesio, conocida como filamento de Nerst. Esta cerámica es calentada al rojo eléctricamente hasta 1000-1800 ºC y entonces emite en el rango de energías del IR Otra fuente de radiación es el Globar, que es una pequeña esfera de carburo de silicio, que al ser calentada al igual que la anterior, emite una radiación de amplio espectro que va desde los 5500 cm-1 hasta los 600 cm-1. El Nerst en cambio, muestra un espectro de energía o frecuencia que va desde 7100 cm-1 hasta los 550 cm-1. Estos rangos de frecuencia son más que suficiente para los espectroscopistas orgánicos. Ellos necesitan el rango que va desde los 4000 cm-1 hasta los 650 cm-1 aproximadamente. Sin embargo en los 2 caso la intensidad disminuye al aumentar , y llega a ser muy pequeña a 10 mm. Además los equipos modernos pueden presentar un láser (He-Ne) que permite la medición muy precisa de la longitud de onda, a través de la medición de la posición del espejo móvil. LA DETECCION: se basa en detectar el calor producido, ya que la luz involucrada es de baja energía, y esto dificulta su medición precisa. Se utilizan termocuplas: formada por una junta de 2 materiales diferentes. Cuando la energía radiante se enfoca en esa junta, debido a la diferentes características de los 2 metales, un lado de la junta se calienta más que el otro. Esta diferencia de energía térmica provoca una corriente de e- y da como resultado un pequeño V, proporcional al calor incidente. Interferómetro de Michelson El interferómetro mas usado en la espectrometría FT IR, es el de Michelson, que consiste en dos espejos colocados perpendicularmente, uno de los cuales puede moverse en dirección perpendicular al plano. Una película semi-reflectante, el beamsplitter, "parte" a la luz en dos y bisecta el plano en el que se encuentran los otros dos espejos. El material del beamsplitter se elige de acuerdo a la región del espectro que se quiere examinar. Materiales como el germanio u óxido de hierro se cubren con una capa de substrato "transparente al infrarrojo" como el bromuro de potasio ó yoduro de cesio para producir beamsplitters para la región media y cercana al infrarrojo. Delgadas películas como el poly(ethyleneterephthalate), se usan en para el lejano-infrarrojo. 12 19/08/2013 Éste método se basa en la idea de causar una interferencia entre dos rayos de luz infrarroja, para hacer un "interferograma". Lo último es una señal producida como función del cambio de las distancias recorridas entre los dos rayos. Los dominios de distancia y frecuencia, son interconvertibles a través de la transformada de Fourier. Ventajas de IR-TF: •Todas las se miden al mismo tiempo (estabilidad fuente, rapidez, suma o acumulación de espectro) •La cantidad de energía que alcanza el detector es mayor por el fenómeno de interferencia: sensibilidad, análisis de trazas, microespectroscopía Transformada de Fourier •Precisión en la medición de las frecuencias: Cada corresponde a una posición del espejo móvil, y se mide con el láser •Posibilidad de acoplar a CG o HPLC 13 19/08/2013 La celda o porta-muestra, puede ser según el propósito, para analizar gases, líquidos y sólidos. En gases, las celdas disponibles tienen entre 10 y 40 cm de longitud y los espectros en estos casos son el resultado del paso, a través de la celda con múltiples reflexiones, de manera que, en realidad la luz ha recorrido muchas veces la longitud de la celda antes de llegar al detector. De los líquidos pueden ser obtenidos los espectros en ya sea compuestos puros o en soluciones diluidas de aquellos. Los líquidos puros se colocan entre dos placas de bromuro de sodio (se pueden lograr espesores de hasta 0,01 mm o menores). Las soluciones diluidas son colocadas entre dos ventanas de cloruro de sodio o bromuro de sodio, rodeadas de anillos espaciadores que delimitan las celdas espectroscópicas a algunas fracciones de milímetro de espesor. En estos casos deben ser muy bien seleccionados los solventes a utilizar. El CCl4 y el CS2 son complementarios en estas tareas. Ambos solventes son invisibles en regiones sobre los 1333 cm-1 para el CCl4 y bajo los 1333 cm-1 para el CS2. Pueden hacerse muchas combinaciones de solventes que cubran diferentes ventanas entre los 4000 cm-1 y los 600 cm-1. (Ventana es aquella porción del espectro IR, en el cual el solvente tiene una muy baja absorción de radiación, es decir, es trasparente a la radiación infrarroja). En todos los casos las paredes del contenedor de la muestra deben ser transparentes a todo el rango de la radiación (4000-600 cm-1). Esto se consigue con ventanas hechas de cristales de Bromuro o Cloruro de sodio. SOLVENTE Región no útil cm -1 Región no útil cm-1 CHCl3 C2Cl4 C6H6 benceno CH2Cl2 ACETONA DMSO TOLUENO 600-820 750-950 600-750 600-820 1100-1850 900-1100 600-750 3000-3100 1200-1300 2800-3000 1175-1250 2800-3200 14 19/08/2013 Preparación de una muestra sólida en disolución de KBr 15 19/08/2013 IR cercano: sobretonos y combinaciones lineales de modos vibraciones fundamentales, 0.8-2.5 mm IR medio: vibraciones fundamentales, 2.5-25 mm IR lejano: movimientos rotacionales, 25-1000 mm Espectroscopía infrarrojo cercano (NIR) La Ciencia de los Alimentos ha utilizado mas frecuentemente la espectroscopía de IR cercano, pues históricamente fue la primera en poder aplicarse a materiales heterogéneos, como es el caso de los alimentos. Posteriormente, con el advenimiento de la TF, el IR medio (mas sensible, mayor resolución, mayor facilidad para la asignación) mostró el potencial de esta técnica para materiales heterogéneos. Los alimentos generalmente tienen un gran contenido de agua, que absorbe intensamente en el IR medio, resultando una transmisión pobre, y mucha dispersión: detección pobre, tiempos largos de adquisición. El advenimiento del IR TF dio la posibilidad de proveer mas energía a la muestra y al hacer barridos rápidos, poder sumarlos, y así obtener una relación señal-ruido aceptable, y eliminar la absorción del agua por sustracción espectral (supresión). Solucionados estos problemas el IR medio posibilita mejores asignaciones y resoluciones que el IR cercano. En el IR lejano puede obtenerse información por ej. del grado de vibración rotacional del agua y evaluar en base a esto la humedad de una muestra. También se estudian los movimientos de moléculas, como polímeros, y se relaciona con el peso molecular 16 19/08/2013 Bases del Infrarrojo Cercano Durante más de 30 años la Espectroscopia en el Infrarrojo Cercano (NIR) ha sido usada como una técnica analítica rápida para alimentos, granos y otros productos agrícolas. El NIR permite análisis rápidos y no destructivos sin necesidad de reactivos o metodologías complejas. Incluso es tan sencillo como para ser operado por personal no técnico. En el sentido más simple, los análisis NIR se realizan iluminando una muestra con luz en la región espectral del infrarrojo cercano y analizando la luz con la que ha interaccionado. La luz de una longitud de onda determinada interacciona con los componentes químicos específicos presentes en la muestra. Por ejemplo, midiendo la absorción en aquellas longitudes de onda que interaccionan con las proteínas es posible determinar el porcentaje de proteína presente en una muestra. Determinaciones usuales: H2O, proteínas, lípidos, hidratos de carbono Los instrumentos NIR precisan de calibraciones para analizar muestras. Estos instrumentos se han concebido para recoger datos de los espectros de muestras de composición conocida y aplicando entonces técnicas quimiométricas que relacionan los datos de los espectros con la composición química. Se dispone de calibraciones estándar para muchos productos disponiendo de un programa opcional para desarrollar nuevas calibraciones. Los espectros NIR contienen información abundante. las bandas de absorsión se deben a la combinación lineal y sobretonos (n) de bandas fundamentales de absorsión de las uniones C-H, OH and N-H de las moléculas químicas del material a analizar. Los espectros son complejos, y la superposición de bandas hace que se vean como un continuo. La interpretación es dificil, pero una vez identificada una banda es muy sencillo cuantificar en base a la intensidad de la misma. El NIR es parte de la región del espectro electromagnético comprendido entre los 700 a 2500 nanómetros, y es la porción del espectro en el cual las muestras observan una baja absorción comparado con otras regiones del infrarrojo. La baja absorción permite que la radiación infrarroja penetre muestras sin preparación, modificación o dilución. La radiación incidente provoca la vibración de los enlaces covalentes de las uniones Carbono – Hidrógeno, Oxígeno – Hidrógeno y Nitrógeno – Hidrógeno. El NIRS se caracteriza por ser un método no destructivo, no contaminante y rápido para el análisis de pasturas, raciones, silo, y otros productos agrícolas. Figura 1. Espectro NIRS de materias primas recogidos en el equipo Foss NIRSystem 6500 con diferentes contenidos en Aflatoxina B1: 1. no contaminada; 2. contenido entre 20 y 50 ppb, 3. contenido superior a 50 ppb. AA= aminoácidos 17 19/08/2013 Figure 4. Sulfamethazine absorbance scans showing spectral shift with tablet crushing strength for tablets with crushing strengths ranging from 10.1 kP to 15.6 kP Figure 5. Second derivative scans for neat sulfamethazine, corn starch, and magnesium stearate powders as received from supplier. Figura 3. Espectro infrarrojo de muestras de ensilaje de maíz (línea punteada) y desviación estándar de los espectros (línea entera). 18 19/08/2013 Reflectancia NIR vs. Transmisión NIR En la práctica, la muestra a ser analizada es bombardeada con rayos NIR de diferentes longitudes de onda. Por cada longitud de onda, algunos de los rayos serán entonces absorbidos por uniones químicas específicas. Al mismo tiempo, otros rayos serán diseminados y reflejados por otras uniones químicas. Este proceso es comúnmente descrito como Reflectancia NIR. En contraste, algunos de los rayos pasarán a través de la muestra, lo cual es denominado Transmisión NIR (a menudo referida como NIT). La Transmisión NIR, donde el detector está ubicado detrás de la muestra, es ideal para líquidos transparentes y algunos productos que no son demasiado densos ópticamente. Productos tales como muestras de girasol, canola y tierra, que son ópticamente tan densos que permiten que sólo una porción de rayos pasen a través de la muestra, que mediciones confiables son muy difíciles de obtener por NIT. De manera subsiguiente, para mediciones NIT de estos productos, la muestra debe ser vertida en células de muestreo con un tamaño de sólo 6mm. Vastenhoudt (1995) reportó que se acepta generalmente que el análisis de granos intactos por Reflectancia NIR es más exacto que por NIT. Williams y Norris (2001) adicionalmente indicaron que el análisis NIR de grano entero por reflectancia, eliminó el largo de trayectoria como un error de fuente, lo cual sugiere por lo tanto que la Reflectancia NIR antes que la NIT debe ser el principio de medición recomendado para tales productos densos y mezclas que los contengan. En la práctica, cuando se realiza un análisis en un instrumento NIR, el operador sólo tiene que colocar la muestra en el recipiente para la misma, y presionar un botón para comenzar el análisis. El análisis completo se imprime normalmente en menos de un minuto. Si esto es tan fácil, ¿por qué entonces hay diferencia de opiniones sobre el campo de aplicación y precisión de los resultados NIR? Ciertamente, no es una caja mágica que puede analizar cualquier elemento que se introduzca, pero con el correcto desarrollo y mantenimiento de las calibraciones, esta técnica está siendo rápidamente implementada como el mayor método de análisis rápidos del futuro. 19 19/08/2013 Optimizado para Grano, Harina, Alimentos y Piensos DA 7200 es ideal para: Trigo - Almidón - Pescado Harinas - Fibra - Pienso para Vacuno o Porcino - Maíz Centeno - Grano - Avena - Sorgo - Leguminosas Líquidos - Cereales - Café - Mostaza - Malta - Colza Girasol - Snacks - Alfalfa - Tapioca - Pienso Avícola Cebada - Soja - Pienso - Triticale - Arroz - Guisante Harina de Soja - Caña de Azúcar - Té - Mantequilla Lúpulo - Leche en Polvo - Queso - Carne - Ensilaje de Hierba - Harina - Heno - Pasta - Sémola - Piensos para mascotas - Aleurona - Mijo - Helado - Fertilizantes - Suero - Pellets - Semillas de algodón - Alimentos - Cacao Chocolate Mediciones: Proteína - Humedad - Aceite y Grasa Dureza - Fibra cruda - Sal - Gluten - Almidón - Almidón dañado - Azúcar - Energía metabólica - Sedimentación Digestibilidad - Lactosa - Fibra dietética - ß-Glucano Extracto VZ - Valor de Kolbach - NDF - ADF - Polaridad Balanza de humedad Equipo a constante Equipos para barrido de Con y sin TF Figura 2. Espectro NIRS de dietas completas, recogidos en el equipo Foss NIRSystem 6500 con diferentes contenidos en Zearalenona: 1. no contaminada; 2. contenido superior a 50 ppb, 20 19/08/2013 Espectro NIR de sacarosa cristalina: 21