Tema 6
Anuncio

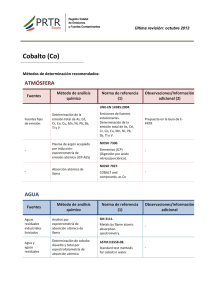
Tema 5. Espectroscopias: Ultravioleta-Visible, Infrarroja, Absorción Emisión Atómica 5.1 Introducción 5.2 Espectroscopía del Infrarrojo (IR). 5.2.1 Fundamentos 5.2.2 Descripción de la técnica 5.2.3 Interpretación de los espectros IR 5.3 Ultravioleta-Visible 5.4 Absorción atómica (AAS) y Emisión Atómica. 5.4.1 Fundamentos 5.4.2 Instrumentación 5.4.3 Modo de trabajo y factores involucrados y 5.1 Introducción 9 Las ondas electromagnéticas cubren una amplia gama de frecuencias y/o longitudes de onda (desde unos 10-9 cm hasta 103 cm) y por esta razón se dividen en diferentes regiones (llamadas regiones espectrales). 9 En una molécula se presentan tres tipos diferentes de niveles energéticos: electrónicos, vibracionales y rotacionales. Tabla 5.1: Regiones del espectro electromagnético Región Rayos gamma Rayos X Ultravioleta (UV) Longitud de onda (m) Energía (kJ mol-1) <10-10 >106 10-8 - 10-10 104 - 106 4·10 –7 -8 – 10 -7 -7 Cambios excitados Transformaciones nucleares Electrones de capas internas 3 4 Electrones de capas externas 2 3 Transiciones electrónicas 10 - 10 Visible (V) 8·10 - 4·10 Infrarrojo (IR) 10-4 - 2.5·10-6 1 - 50 10-2 - 10-4 0.01 - 1 10-2 0.01 Cambios de spin electrónico 10 10-5 Cambios de spin nuclear Micro-onda Resonancia de spin electrónico Resonancia magnética nuclear 10 - 10 Vibraciones de enlace Rotaciones moleculares 5.2 Espectroscopía del Infrarrojo (IR). 5.2.1 Fundamentos Figura 5.1. Modelo hipotético de movimientos vibracionales de una molécula de agua. 9 En una molécula, los átomos no ocupan posiciones fijas sino que vibran dentro de un determinado espacio. 9 Estos cambios de posición de los elementos de una molécula no pueden realizarse de manera discontinua sino que requieren la absorción de cierta cantidad de energía (región del infrarrojo). 9 Vibraciones entre los átomos de una molécula: - Vibraciones de valencia (tensión o elongación) - Vibraciones de deformación (torsión, flexión o tijera) Figura 5.2 . Modos de vibración de los átomos de una molécula. 9 Este movimiento de los átomos de molécula poliatómica puede descomponerse en vibraciones independientes llamadas normales de acuerdo con los grados de libertad. 9 Cada modo de vibración tiene asignada una frecuencia que corresponde a una banda de absorción en la región infrarroja. 9 No todas las vibraciones posibles se pueden detectar en forma de radiaciones infrarrojas; de esta forma sólo se perciben aquellas que implican un cambio en su momento dipolar. Figura 5.3 . Vibraciones fundamentales de las moléculas de agua y del dióxido de carbono. 5.2.2 Descripción de la técnica 9 La técnica consiste en analizar la radiación infrarroja que es absorbida al atravesar esta un compuesto dado, de tal manera que el espectro infrarrojo registra la radiación transmitida frente a la frecuencia de la radiación incidente. 9 Para que las moléculas absorba radiación IR que induzcan vibración en los enlaces, debe existir un cambio en el momento dipolar de la molécula y sus vibratos. 9 La vibraciones en el IR son más fuertes cuanto mayor sea el cambio en el momento dipolar (C-O mas fuerte que C-C). 9 La frecuencia de las fuerza de las vibraciones se obtiene mediante la ley de Hooke: ν = (1 / 2πc) √(k/μ) - ν : frecuencia de vibración (cm-1) - μ : masa reducida de los átomos (g): μ = m1 ·m2 /(m1 + m2) - k : constante de fuerza relacionada con la fuerza de disociación del enlace, o fuerza de enlace. 9 La radiación registrada debe ser solamente la originada por los movimientos vibracionales de las moléculas presentes en la sustancia objeto de estudio. Para ello, se ha de considerar: - Preparar la muestra, en forma de pastilla, mezclada en muy poca proporción con KBr (anhidro). - El portamuestras también ha de ser transparente a la radiación IR. - Los espectrofotómetros de IR van equipados de una doble fuente, una atraviesa la muestra y otra una referencia, de modo que se puede eliminar el ruido de fondo debido a H2O o CO2. 9 El modo de preparación de la muestra es muy importante para la obtención de un registro de alta calidad, el cual depende de: - Utilizar un diluyente, KBr, transparente a la radiación IR de alta calidad. - Preparar una pastilla lo más delgada y homogénea posible. - El grosor de la pastilla dependerá de la cantidad de muestra utilizada y de la presión aplicada en su preparación. La transmisión de radiación a través de la pastilla es función de una relación óptima compuesto/diluyente. 5.2.3 Interpretación de los espectros IR 9 Los espectros registrados mediante la técnica IR exhiben una serie de bandas o picos que nos proporcionan información relativa a la sustancia estudiada. 9 La frecuencia a la que aparecen las bandas es característica de los diversos modos de vibración de las moléculas/enlaces contenidas en la sustancia 9 El espectro de IR nos muestra más información, como puede ser la relacionada con la forma del pico. 9 En la interpretación de la espectroscopia infrarroja de grupos inorgánicos hay que tener en cuenta la carga del átomo central del grupo funcional. 9 El cambio el estado de oxidación es el factor más importante en la predicción de la frecuencia de absorción de un grupo inorgánico, NO2- : 1240 cm-1 o.e. = 1.5 e.o. = +3 NO3- : 1360 cm-1 o.e. = 1.33 e.o. = +5 9 El modo de reconocer un espectro de un compuesto dado es fácilmente llevado a cabo por simple comparación con espectros patrones ya registrados del mismo compuesto. 9 En caso de tratarse de un compuesto nuevo, y en general a la hora de identificar un espectro de infrarrojos, se ha de proceder del modo siguiente: 1. Observar la forma de las bandas espectrales: - Muy aguda ⇒ Compuesto aromático - Banda ancha ⇒ Grupos inorgánicos - Muy anchas ⇒ Grupos enlace-hidrógeno 2. Chequear la región entre 1600 y 2800 cm-1, en la cual cualquier pico es de interés para la conocer el compuesto.(Por ejemplo, C=O: 1700 cm-1 y C≡N: 2050 cm-1). 3. Investigar la región cercana a 3000 cm-1. - Grupos hidroxilo ⇒ bandas claras y anchas a 3500 cm-1. - Aminas ⇒ fuertes picos a 3300 cm-1. - Alquino terminales ⇒ bandas agudas y débiles a 3200 cm-1. - Alquenos ⇒ bandas moderadas a 3100 cm-1. 4. Si el compuesto posee funcionalidades aromáticas, se ha de chequear la región de flexión entre 650 – 850 cm-1. 5. Reconocer los grupos insaturados neutros unidos a metales, que tienden a aparecer a frecuencias más bajas que en los compuestos libres. Ejemplo: el triple enlace CO suele aparecer a 2100 cm-1. En carbonilos metálicos, sin embargo, la frecuencia es mucho más baja debido a la donación de electrones del metal hacia los orbitales antienlazantes del carbonilo. 6. Una vez determinado el compuesto con los cinco primeros pasos, compararlo con el espectro patrón publicado. Struvite, MgNH4PO4.6H2O 5.3 Ultravioleta-Visible 9 Muchas disoluciones o compuestos inorgánicos presentan color (frecuentemente los correspondientes a metales de transición) 9 Si una disolución es coloreada Î existe alguna especie química en la disolución que absorbe luz en la parte visible del espectro. 9 Estas absorciones se suelen también extender a las regiones vecinas del infrarrojo cercano y ultravioleta próximo, todas ellas incluidas en la expresión “espectro de absorción visible y/o ultravioleta”. 9 Los espectros de absorción de complejos de metales de transición se asocian a compuestos de metales que tienen incompletas las capas d. E1 hν = E1 – E0 E0 Distribución energética de los orbitales d de un metal de transición en un entorno octaédrico. 9 El espectro de los metales de transición puede tener diversos orígenes: a) Espectros asociados principalmente a los ligandos. b) Espectros de transferencia de carga: implica transiciones electrónicas entre el ion central y los ligandos. c) Espectros d-d, transiciones de electrones entre orbitales d (influenciadas por los ligandos) d) Espectros asociados a otros iones del compuesto. 9 Tales espectros se utilizan para explicar los colores y propiedades magnéticas de los complejos, así como para cuantificar la presencia de un ion en una disolución. 9 Espectrofotómetro: 9 El porcentaje de transmitancia se define como 100 veces la relación de energía que alcanza el detector (I) relativo a la cantidad inicial de energía (Io) %T = 100(I/I0) 9 La absorbancia es el logaritmo de la inversa de la transmitancia T A= log(Io/I) = log (100/%T) 9 Análisis cuantitativo: A = ε·b·c Ley de Beer - Lambert A = absorbacia; ε = coeficiente extinción molar (L/mol·cm); b = longitud recorrida por la radiación a través de la muestra; c =concentración molar (mol/L) 5.4 Absorción atómica (AAS) y Emisión Atómica. 5.4.1 Fundamentos 9 Todo elemento, en el estado fundamental, dispone sus electrones ordenados en diferentes niveles energéticos. 9 Cuando se aplica una energía al átomo, ésta puede ser absorbida y los electrones más externos del átomo pueden moverse a niveles energéticos superiores, originando una configuración menos estable del átomo, el estado excitado. 9 Como este estado resulta ser inestable, el átomo vuelve inmediatamente a su estado fundamental, devolviendo energía luminosa. 9 La muestra a analizar se somete a un proceso térmico de alta energía con el objeto de producir átomos en estado excitado. 9 La técnica de absorción atómica mide la energía absorbida por el átomo para alcanzar el estado excitado. 9 La técnica de emisión atómica mide espontáneamente desde el estado excitado. la energía liberada 9 Los espectros de absorción/emisión de un elemento consisten en registrar las longitudes de onda de absorción/emisión, denominadas líneas de emisión debido a la naturaleza discreta de estas longitudes de onda. 5.4.2 Instrumentación 9 La instrumentación de la técnica de absorción atómica consta de cinco componentes básicos: - Una fuente de luz que emite el espectro del elemento de interés. - Una celda de absorción en la que se producen los átomos de la muestra. - Un monocromador para dispersar la radiación. - Un detector que mide la intensidad de la luz y amplifica la señal. - Un sistema de lectura de la señal registrada y procesada por la instrumentación electrónica. a) Fuentes de luz Lámparas de cátodo hueco: proporcionan una radiación brillante y estable para la mayoría de los elementos b) Quemador y gases de combustión. En el ocurre la combustión y producción del vapor atómico. 9 Se utiliza la hélice de flujo cuando: - Las soluciones a analizar contienen muy altos niveles de sólidos disueltos. - Las soluciones a analizar atacan el vidrio (soluciones alcalinas concentradas, HF). - El análisis requiere una llama de óxido nitroso – acetileno. - Se utiliza la cabeza de impacto cuando se requiere duplicar la sensibilidad del análisis. 9 La cabeza del quemador es de Ti sólido. (10 cm para aire-acetileno, y 5 cm para óxido nitroso – acetileno) 9 Los combustibles utilizados: Tabla 6.2. Temperaturas de diferentes llamas. Oxidante Combustible Temperatura ºC Argon Hidrógeno 300 – 800 Aire Gas ciudad 1710 Aire Butano 1900 Aire Propano 1925 Aire Acetileno 2325 Oxígeno Acetileno 3025 N2O Acetileno 2950 Aire Hidrógeno 2000 Oxígeno Hidrógeno 2550 9 La mezcla aire-acetileno es la más utilizada, sirve para la determinación de unos 35 elementos. 9 La llama de la mezcla óxido nitroso – acetileno se utiliza para la determinación de elementos que forman óxidos refractarios, o para evitar interferencias químicas presentes en llamas de más baja temperatura. 5.4.3 Modo de trabajo y factores involucrados 9 Para proceder a realizar el análisis de un elemento: - Disolver el mismo en un medio adecuado. - Conocer la longitud de onda de la línea de emisión a medir. - Comparar la señal medida para dicha disolución con la de un estándar 9 La mayoría de los análisis se suelen realizar mediante la técnica de absorción atómica en vez de la de emisión, ya que la banda de emisión de la llama puede originar problemas que no ocurren en la técnica de absorción. 9 Se usa la técnica de emisión cuando no se justifica la compra de una lámpara (poco uso) o para elementos que presenten mejores límites de detección que en absorción atómica: Al, Ba, Li, K, Na y V. 9 Es muy importante seleccionar la llama que proporcione la máxima excitación y mínima emisión o ionización de fondo. 9 Los analitos no pueden coincidir con las bandas que origine el combustible. Las interferencias más comunes en el uso de ambas técnicas son: a) Emisión: - Línea cercana: otro elemento emite en la misma región espectral. - Molecular: especies moleculares obscurecen parte del espectro. - Auto-absorción: parte de la luz emitida es absorbida por átomo cercanos al monocromador durante el paso de luz. b) Absorción atómica: - Química: cuando la muestra contiene un compuesto del analito que no se descompone totalmente con la energía de la llama. - Ionización: ocurre cuando la temperatura de la llama tiene la suficiente energía para provocar la emisión de un electrón del átomo y originar un ion. - Matriz: ocurre cuando difieren las características físicas (viscosidad, características de calcinación, tensión superficial) de la muestra y el standard. 9 Es necesario conocer la curva de calibración para cada elemento. 9 La sensibilidad se define como la concentración de un elemento (en mg/L) requerida para producir una señal del 1% de absorción (0.0044 unidades de absorbancia). 9 El límite de detección se define como la concentración del elemento que produce una relación señal/ruido igual a 2.