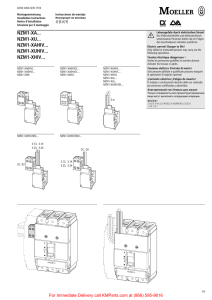
Enzygnost® HIV Integral
Anuncio

Enzygnost® HIV Integral Enzyme immunoassay for the qualitative detection of HIV infection based on the determination of HIV p24 antigen, antibodies to human immunodeficiency virus of types 1 and 2 (HIV 1 and HIV 2), as well as against antibodies to HIV 1, subtype O, in serum and plasma. Enzymimmunoassay zum qualitativen Nachweis einer HIV Infektion basierend auf der Bestimmung von HIV p24-Antigen, Antikörpern gegen die humanen Immundefizienz Viren der Klasse 1 und 2 (HIV 1 und HIV 2), sowie Antikörpern gegen das HIV 1-Subtyp O-Virus in Serum und Plasma. Test immunoenzymatique pour la mise en évidence qualitative d’une infection à VIH, basée sur la détection de l’antigène VIH p24, des anticorps anti-virus de l’immunodéficience humaine des classes 1 et 2 (VIH 1 et VIH 2), ainsi que des anticorps anti-VIH 1 sous-type O, dans le sérum ou le plasma. Metodo immunoenzimatico per l'identificazione qualitativa di una infezione HIV, basata sulla determinazione dell'antigene HIV p24, degli anticorpi contro il virus dell'immunodeficienza umana del tipo 1 e 2 (HIV 1 e HIV 2) e degli anticorpi anti-HIV1 sottotipo O, nel siero e nel plasma. Ensayo inmunoenzimático para el reconocimiento cualitativo de una infección por HIV, basado en la determinación del antígeno HIV-p24, de los anticuerpos contra los virus de la inmunodeficiencia humana de la clase 1 y 2 (HIV 1 y HIV 2), así como también, de los anticuerpos contra el virus HIV 1-subtipo O en suero y plasma. O Enzygnost® HIV Integral é um teste imunoenzimático para detecção qualitativa de infecção pelo HIV, com base na determinação do antigéneo HIV p24, de anticorpos contra os vírus da imunodeficiência humana das classes 1 e 2 (HIV 1 e HIV 2) e de anticorpos contra o vírus HIV 1 - subtipo O, no soro e no plasma. English: Deutsch: Français: Italiano: Español: Português: Page Seite Pages Pagina Página Páginas Summary of Test Procedure Kurzanleitung Testdurchführung La technique en bref Istruzioni in breve, esecuzione del Test Resumen de la técnica Resumo da técnica Page Seite Page Pagina Página Página Bibliography/Literatur/Littérature Bibliografía/Bibliografia Page/Seite/Página/Pagina OQTO G11 C0541 (1584) H 1 2 11 20 29 38 48 to bis à fino hasta a 10 19 28 37 47 56 10 19 28 37 47 56 57 Edition October 2003 Enzygnost® HIV Integral Intended Use and Application Enzyme immunoassay for the qualitative detection of HIV infection based on the determination of HIV p24 antigen, antibodies to human immunodeficiency virus of types 1 and 2 (HIV 1 and HIV 2), as well as against antibodies to HIV 1, subtype O, in serum and plasma. The enzyme immunoassay is processed on the BEP® II, BEP® III and BEP® 2000 ELISA processors. The test was developed for testing single samples and not pooled or diluted samples. The product is for in vitro diagnostic use only. Summary and Explanation Acquired immunodeficiency syndrome (AIDS) was first recognized in 1981 as a clinical picture in its own right. The disease is today considered to involve two different Human Immunodeficiency Viruses (HIV 1 and HIV 2) as causal agents. The HIV 1 virus (synonym: LAV/HTLV-III) was isolated as early as in 1983 (1,2) and a further such pathogenic human virus (HIV 2) was isolated in 1986 (3). A high level of importance is attached to the serological determination of antibodies to HIV, especially in the field of transfusion medicine where measures are needed to prevent the further spread of the disease. Consequently, from 1985 onwards, donor blood was screened for HIV 1 antibodies on a mandatory basis, both by blood banks and manufacturers of plasma products. Subsequent information on the spread of HIV 2 infections revealed that blood donors need to be tested routinely not only for anti-HIV 1 antibodies but also for anti-HIV 2 in order to exclude to the greatest possible extent the potential risk of transmission via blood transfusions or blood-derived products. In 1990 a new type of HIV virus was reported which at first was considered to be serologically of little significance (4). It was not until 1994 that two independent teams succeeded, simultaneously, in sequencing this new subtype (5,6). Parallel to this virological research, several teams were able to demonstrate the serological significance of the virus, now known as HIV 1 subtype O (7,8). This research showed that a multitude of anti-HIV 1+2 assays exhibit weaknesses in detecting subtype O antibodies (9). Consequently, a need arose for reliable concurrent detection of this new HIV variant along with the established HIV 1 and HIV 2 isolates. In some HIV seroconversion samples HIV p24 antigen was detected before the detection of HIV antibodies. To narrow the diagnostic window between the occurrence of HIV infection and its first serological detection it was therefore desirable to supplement the antibody test with a test for HIV p24 antigen. Although the determination of HIV antibodies and/or antigen does not allow definite conclusions to be made on whether infectious HIV 1 or HIV 2 is present in the blood at the time of blood collection, in the same way that a negative result does not exclude the presence of HIV 1 or HIV 2 with certainty, currently the combined antigen/antibody test provides the best means of detecting and eliminating blood donations from HIV-infected donors with a high level of probability. Principle of the Method Enzygnost® HIV Integral is an enzyme immunoassay based on the simultaneous determination of HIV antigen and HIV antibody. In the first step, the HIV immunoglobulin in the test sample reacts with the recombinant proteins/ synthetic peptides of HIV 1, HIV 2 and HIV 1 (subtype O) that are coated onto the wells of the microtitre plate. Simultaneously, any HIV p24 antigens present in the test sample can bind to the polyclonal HIV p24 antibodies attached to the wells. The unbound sample constituents are removed by washing and then, in the second step, the specifically bound antibodies are labelled (antigen sandwich) with biotin-conjugated recombinant proteins/synthetic peptides of HIV 1, HIV 2 and/or HIV 1 (subtype O). Simultaneously, any bound HIV antigens are labelled by biotin-conjugated monoclonal HIV p24 antibodies (antibody sandwich). The unbound biotin conjugates are then removed by washing and then, in the third step, Conjugate 2 (streptavidin/POD) reacts with the biotin conjugates specifically bound to the solid phase. The excess Conjugate 2 is then removed and the enzyme activity of the bound conjugate determined (blue colour reaction). The enzymatic conversion of the chromogen is terminated by the addition of Stopping Solution POD (yellow colour reaction). The colour intensity is proportional to the concentration of HIV p24 antigen and HIV antibody present in the sample. OQTO G11 C0541 (1584) H 2 Edition October 2003 Reagents Material provided Enzygnost® HIV Integral: HIV Conjugate 1: HIV Conjugate Buffer 1: HIV Conjugate 2: HIV Sample Buffer: HIV Control, positive: HIV Control, negative: Label "Empty bottle for for HIV Conjugate 1" Label "Empty bottle for HIV Conjugate 2" Package insert Barcode table of values PE bag 2 x 96 10 x 96 2 test plates 2 x 1 vial 2 x 15 mL 2 x 15 mL 2 x 15 mL 2 x 1.4 mL 2 x 2.0 mL 1 pcs. 1 pcs. 1 pcs. 10 test plates 10 x 1 vial 10 x 15 mL 10 x 15 mL 4 x 15 mL 3 x 1.4 mL 3 x 2.0 mL 1 pcs. 1 pcs. 1 pcs. 1 pcs. 1 pcs. Additional materials required, but not provided, for the 2 x 96 and 10 x 96 kits: Supplementary Reagents for Enzygnost® TMB (Order No. OUVP) Composition Enzygnost® HIV Integral test plate Microtitre plate coated with a mixture of recombinant proteins (E. coli) and synthetic peptides from HIV 1 gp41, HIV 1 (subtype O) gp41, HIV 2 gp36, as well as polyclonal antibodies (rabbit) to HIV p24. HIV Conjugate 1 Lyophilized substance consisting of recombinant HIV proteins (E. coli) / synthetic peptides of HIV 1, HIV 2 and HIV 1 (subtype O) as well as monoclonal antibodies (mouse) to HIV p24, biotinconjugated; coloured blue. Reconstitute with 15 mL of HIV Conjugate Buffer 1. HIV Conjugate Buffer 1 Tris buffer containing Sapogenat* and casein; coloured yellow. Preservative: phenol (max. 1 g/L) HIV Conjugate 2 Tris Buffer containing Sapogenat* and streptavidin, peroxidase (POD)-conjugated; coloured red. Preservative: phenol (max. 1 g/L) HIV Sample Buffer Phosphate buffer containing casein and Triton X 100*; coloured red. Preservative: phenol (max. 1 g/L) HIV Control, positive Heat-treated human serum containing antibodies to HIV 1 antigens, stabilized. Nominal absorbance: ≥ 0.7 Preservative: phenol (max. 1 g/L) HIV Control, negative Human serum without HIV antigen and without antibodies to HIV 1, HIV 2, and HIV 1 (subtype O) antigens, stabilized. Nominal absorbance: ≤ 0.15 Preservative: phenol (max. 1 g/L) Warnings and Precautions 1. For in vitro diagnostic use. 2. Each individual blood donation for use in the manufacture of the control sera is tested for HBsAg, anti-HCV, anti-HIV 1 and anti-HIV 2. Only sera with negative findings are used for manufacturing the negative control serum. The positive control serum is heat-treated (not less than 1 hour at +56 °C). OQTO G11 C0541 (1584) H 3 Nevertheless, since absence of infectious agents cannot be proven, all materials obtained from human blood should be handled with due care, observing the precautions recommended for biohazardous material (10). 3. It is advisable to wear protective gloves throughout the entire test procedure. 4. Prior to disposal, it is recommended that solid infectious materials should be autoclaved for at least one hour at +121 °C. All aspirated solutions should be collected in two receptacles connected in series. These should both contain a disinfectant suitable for inactivating pathogenic human viruses. The concentrations and reaction times specified by the manufacturer must be observed. Preparation of the Reagents Bring all the reagents and samples to +15 to +25 °C before beginning the test (without removing the test plate from the container). Test strips not needed for the test must be removed from the holder and stored for later use (see Table 1). The 10 x 96 pack of Enzygnost® HIV Integral is supplied with one barcoded label for the HIV Conjugate 1 as well as one for the HIV Conjugate 2. When processing large series of samples on the BEP® III, a frequent change of syringe can be avoided by pooling several conjugate vials in a larger bottle (e.g. surplus, unused empty bottles for the Working Chromogen Solution, see Materials required but not provided), and then labelling this vial with the respective label ("Empty bottle for Conjugate ..."). This labelled bottle is then placed into the reagent rotor. For each test plate, dilute 20 mL of Washing Solution POD (Supplementary Reagents Kit) to 400 mL with distilled or deionized water. For each test plate, dilute 1 mL of Chromogen TMB with 10 mL of Buffer/Substrate TMB (Supplementary Reagents Kit) in the empty bottle supplied with the kit (= Working Chromogen Solution) and store closed and protected from light. After use rinse the bottle thoroughly with distilled water. For technical reasons (overage) it is not permissible to transfer the contents of the Chromogen TMB vial into the vial of Buffer/Substrate TMB. HIV Conjugate 1 solution: Transfer the entire contents of a vial of HIV Conjugate Buffer 1 (15 mL, coloured yellow) into a vial of HIV Conjugate 1 (lyophilized material, coloured blue). Swirl gently to completely dissolve the lyophilized material. The HIV Conjugate 1 solution then has a green colour. Before use allow the HIV Conjugate 1 solution to equilibrate for at least 15 minutes. Storage and Stability Stored unopened at +2 to +8 °C, all components of the Enzygnost® HIV Integral kit may be used up to the dates of expiry given on the labels. Once opened, the details given in Table 1 in the Appendix apply. Equipment required: BEP® II: BEP® III: For automatic dispensing of reagent and washing For automatic processing of the test after dispensing the samples as well as for evaluation BEP® 2000: For fully automatic processing and evaluation of the test Pipettes: piston-type pipettes 25, 100 and 1000 µL Incubator: Covered water bath (+37 ± 1 °C) or comparable incubation methods All the equipment used in the test must have been validated. Specimens Suitable specimens are individual samples (human sera or EDTA/heparinized/citrated plasma) obtained by standard laboratory techniques. The samples should be stored for not more than 3 days at +2 to +8 °C. If the samples are to be stored for a longer period of time, they must be frozen. OQTO G11 C0541 (1584) H 4 Method Test procedure using the BEP® II 1.Assay scheme: Ascertain the number of wells required (= number of test samples plus 5 wells for the controls). 2.Dispense sample buffer: Introduce 25 µL of sample buffer into each well. 3.Dispense samples: Into 3 wells (A1 to C1) pipette 100 µL/well of the HIV Control, negative, and into 1 well (D1) pipette 100 µL of the HIV Control, positive. Fill each of the subsequent wells with 100 µL/well of undiluted sample. At the end of the series/plate, fill one further well with 100 µL of HIV Control, positive. Alternatively, the HIV Control, positive, can be pipetted in duplicate at the start of the series: Alternative: Into 3 wells (A 1 to C1) pipette 100 µL/well of HIV Control, negative, and into 2 wells (D1 and E1) pipette 100 µL/well of HIV Control, positive. Then fill the subsequent wells with 100 µL/well of undiluted sample. Perform the pipetting steps within 30 min per test plate. 4.Incubate: Cover the test plate with adhesive foil and incubate at 37 ± 1 °C for 30 ± 2 minutes, then proceed immediately to the washing step. 5.Wash: Remove the foil, aspirate all the wells and wash 4 times with approx. 0.3 mL/well of washing solution. 6.Dispense HIV Conjugate 1 solution: Fill each well with 100 µL of HIV Conjugate 1 solution, cover with fresh adhesive foil and immediately place in the incubator. 7.Incubate: At 37 ± 1 °C for 30 ± 2 min as described in 4.. Then proceed immediately to the next washing step. 8.Wash: Remove foil and wash 4 times as described in 5.. 9.Dispense HIV Conjugate 2: Fill each well with 100 µL of HIV Conjugate 2, then cover with fresh adhesive foil and place immediately in the incubator. 10.Incubate: At 37 ± 1 °C for 30 ± 2 min as described in 4.. Then proceed immediately to the next washing step. 11. Wash: Remove the foil and wash 4 times as described in 5.. 12.Dispense substrate: Fill each well with 75 µL of the Working Chromogen Solution. 13.Incubate: Cover with fresh adhesive foil and incubate at +15 to +25 °C for 30 ± 2 min protected from light. 14.Stop reaction: Remove the foil, then add 75 µL of Stopping Solution POD to each well, keeping to the same timing as in Step 12. 15.Read: Read at 450 nm within one hour. The recommended wavelength for the reference measurement is 650 nm (where appropriate, between 615 and 690 nm). Test procedure using the BEP® III Before using the BEP® III, prepare the test plates and sample dispensing steps (Section 1 and 2 at "Test procedure using the BEP® II"). Immediately afterwards place the uncovered test plates (i.e. not covered with adhesive foil) into the BEP® III. Note that partially filled test plates need to be made up to at least half plates (6 test strips) by adding "water-filled strips". The test is then processed fully automatically (see BEP® III instruction manual). The settings for the incubation times in the BEP® III software may differ from the times on the BEP® II for technical reasons (system speed) but have been validated for Enzygnost® on the BEP® III. Test procedure using the BEP® 2000 The sample dispensing steps and subsequent processing steps in the test are performed fully automatically in the instrument (see instruction manual for the BEP® 2000). Validation of the test The individual absorbance readings for the control sera are used for calculating the mean values if: -0.010 ≤ Aneg. ≤ 0.150 Apos. ≥ 0.700 OQTO G11 C0541 (1584) H 5 If one of the three absorbance values of the negative control is outside the specification, this value can be neglected. Both absorbance values of the positive control must comply with the specification. If these specifications are not fulfilled, the test must be repeated. Evaluation of the test On the BEP® 2000 and BEP® III the results are evaluated automatically. Please consult the instruction manuals for further details in this respect. The following sections apply if the results are evaluated without software assistance. Calculate the mean absorbance of the negative controls, then calculate the cut-off limit by adding 0.450: – Cut -off = Aneg. + 0.450 The retest range is defined as follows: Cut-off to Cut-off - 0.05 The test samples are classed as follows based on the criteria of the test: Result: 1. Asample < cut-off - 0.05 = "negative" 2. Asample > cut-off = "reactive" 3. cut-off - 0.05 ≤ Asample ≤ cut-off = "equivocal" Samples with absorbances within or above the retest range must be retested in duplicate. If, in the retest, an initially reactive sample yields absorbances which are both below the retest range, the sample is classed negative based on the criteria of the test. If at least one of the two absorbances in the retest is again within or above the retest range the sample is classed as repeatedly reactive. It is essential that all repeatedly reactive samples should be verified using a confirmatory test (e.g. Immunoblot, Nucleic acid analysis). To be on the safe side, a follow-up sample should be tested (about 2 weeks later). Limitations and Interferences 1.Anticoagulants such as heparin, EDTA and citrate do not interfere with the test. 2.Samples that are haemolytic or icteric do not interfere with the test. 3.Samples containing the potential interference factors ANA, E.-Coli and EBV antibodies, as well as sera from pregnant women, were checked in the test. The samples used were found not to interfere with the results. 4.No interferences were observed with heat-treated samples (30 min, 56 °C). 5.Serum from insufficiently coagulated blood, and samples which contain microbial contamination, should not be used. Any particulate components in the sample (e.g. fibrin clots, erythrocytes) should be removed before the test. 6.Lipaemic, rheumatoid factors and AMA containing samples, as well as samples with HAV antibodies may lead to a higher reactivity. 7.Enzygnost® HIV Integral is a test for the simultaneous detection of HIV p24 antigen and HIV antibodies, and must not be used for the sole detection of HIV p24 antigen. 8.When using thawed samples, ensure good homogenization of the material prior to use. 9.The pack contains a matched set of reagents. Reagents must not be interchanged with other kits unless the reagents are from an identical lot (i.e. they must display the required 6-digit lot numbers printed on the pack and given in the enclosed barcode table of values). Washing Solution POD, Stopping Solution POD and Working Chromogen Solution are exceptions to this requirement. Note that the Working Chromogen Solution must first be prepared from matched components (do not use Chromogen TMB and Buffer/Substrat TMB from kits with a different number). OQTO G11 C0541 (1584) H 6 10.Buffer/Substrate TMB, the Working Chromogen Solution and the Stopping Solution POD must not be allowed to come into contact with heavy metal ions or oxidizing substances (do not use pipettes with metal parts in contact with the liquid!). Do not perform the substrate reaction in the proximity of disinfectants containing hypochlorite. If the Working Chromogen Solution has spontaneously developed a blue colour before transferral into the test plate, this indicates that the solution is contaminated; in such cases prepare a fresh solution in a clean container. Skin contact with the above-mentioned solutions is to be avoided. 11.The test plate should be protected from vibration during the incubation phase (e.g. placed on a secured floatation aid, or in a non-circulating water bath); the wells of the plate must be in contact with the thermostatted water. If stabilizers are used to prevent microbial contamination of the water, care must be taken that neither the surface of the test plate nor the wells come into contact with these solutions since such contamination can lead to unspecific reactions. 12.With highly reactive samples the dye may precipitate during the stopping reaction. This does not interfere with the photometric evaluation. 13.The control sera have been prepared from native human sera. As a result, turbidity may occur but this has no effect on the test result. 14.Do not expose the test plate to direct sunlight for an extended period of time before beginning the test. Specific Performance Characteristics Sensitivity and Specificity The results of the sensitivity and specificity studies are shown in Tables 2 + 3 (Appendix). The sensitivity of the test was established by investigating a total of 515 anti-HIV 1, 164 anti-HIV 2, 26 anti-HIV 1 (subtype O) and 64 HIV antigen positive samples. All the tested HIV antigen/antibody positive samples were found to be positive according to the criteria of Enzygnost® HIV Integral. The reactivity of the test in respect to seroconversion samples was investigated using 34 seroconversion panels. Here, Enzygnost® HIV Integral was found to detect seroconversion with greater sensitivity than tests that detect only HIV antibody. Nevertheless, when the test is used on a wide scale it is not possible to rule out that some samples may escape detection. When the SFTS Panel was tested (1996), the sample with a declared value of 250 pg HIV antigen/ml (No. 2024) was found to be reproducibly positive. By testing the dilution steps of the SFTS Panel for both the 100 pg sample and the sample with a declared value of 250 pg HIV antigen/ml, an analytical sensitivity between 100 and 250 pg HIV antigen/ml was calculated. The specificity of the test was established by investigating a total of 8851 HIV-negative blood samples. The specificity results obtained were 99.3 % to 99.95 % (initial testing) and 99.7 % to 100 % (retest). Deviations are possible depending on the sample population, test procedure and other factors. Current knowledge indicates that a positive result in the test does not yield definite evidence that the blood contains infectious HIV 1 or HIV 2, just as a negative result also does not definitely exclude the presence of HIV 1 or HIV 2. Reproducibility The results of the intra-/inter-assay reproducibility study are listed in Table 4 (in the Appendix). These are exemplary data. Deviations from the values are quite possible depending on procedure and other factors. Enzygnost and BEP are registered trademarks of Dade Behring Marburg GmbH in the USA, Germany and other countries. *Sapogenat is a trademark of Clariant. Triton 100 X is a trademark of Merck. Dade Behring Marburg GmbH Emil-von-Behring-Str. 76 D-35041 Marburg www.dadebehring.com OQTO G11 C0541 (1584) H 7 0197 Tab. 1 Storage and Stability Material/Reagent * State Storage Stability* Enzygnost® HIV Integral test plate once opened +2 to +8 °C in the bag with the desiccant 4 weeks HIV Conjugate 1 once reconstituted +2 to +8 °C +15 to +25 °C 4 weeks 2 days HIV Conjugate 2 once opened +2 to +8 °C +15 to +25 °C 4 weeks 2 days HIV Sample Buffer once opened +2 to +8 °C 4 weeks HIV Control, positive once opened +2 to +8 °C -20 °C 4 weeks 3 months HIV Control, negative once opened +2 to +8 °C -20 °C 4 weeks 3 months Chromogen TMB once opened +2 to +8 °C expiry date Buffer/Substrate TMB once opened +2 to +8 °C expiry date Working Chromogen Solution diluted 1 + 10 +2 to +8 °C 5 days +15 to +25 °C 8 hours in closed container protected from light Washing Solution POD (concentrate) once opened diluted 1:20 diluted 1:20 +2 to +8 °C +2 to +8 °C +18 to +25 °C expiry date 1 week 1 day Stopping Solution POD once opened +2 to +8 °C expiry date use each component by the expiry date at the latest OQTO G11 C0541 (1584) H 8 Tab. 2 Sensitivity The sensitivity studies yielded the following data: Sample population Number of samples Initially reactive 515 164 26 64 515 164 26 64* 34 HIV panels Greater sensitivity than with HIV antibody tests Anti-HIV 1 pos. Anti-HIV 2 pos. Anti-HIV 1 (subtype O) pos. HIV antigen pos. Seroconversion panel * With early seroconversion samples, HIV p24 antigen tests show better sensitivity for the detection of HIV antigen. Tab. 3 Specificity The specificity studies yielded the following data: Sample population Number of samples Negative sera (A) Negative sera (B) Negative sera (C) Neg. plasmas (D) Initially reactive Retest active 9 1 17 1 8 0 7 1 4002 2135 2370 344 Tab. 4 Reproducibility In the studies on intra-assay reproducibility the samples were tested in 8-fold replicates on each of 5 days. The coefficients of variation (CV’s) were calculated using the variance component model. Enzygnost® HIV Integral Sample P1 P2 P3 P4 Mean absorbance % CV 0.817 1.781 1.202 0.519 4.4 5.7 4.4 3.8 In the studies on inter-assay reproducibility the samples were tested in 8-fold replicates on each of 5 days. The coefficients of variation (CV’s) were calculated using the variance component model. Enzygnost® HIV Integral Sample P1 P2 P3 P4 OQTO G11 C0541 (1584) H 9 Mean absorbance % CV 0.817 1.781 1.202 0.519 12 5.9 2.3 4.1 Tab. 5 Testprocedure and programming steps Enzygnost® HIV Integral Menuprogramming Testprocedure (BEP® II, BEP® III, BEP® 2000) Prepare reagents for the BEP® 2000 BEP® II MENU NO OPERATE 1 YES Dispense Sample Buffer 3 x 100 µL HIV Control, negative WASHINGS 0 1 x 100 µL HIV Control, positive ASPIRATE NO 100 µL undiluted sample each SOAKTIME 0 1 x 100 µL HIV Control, positive DISP VOL 25 CHANNEL NO 3 BEP® II BEP® III PHOT NO OPERATE 2 YES Wash and dispense Conjugate 1 30 min ± 2 min in the case of partially filled WASHINGS 4 (37 ± 1 °C) plates: Add "water-filled ASPIRATE NO strips" to half fill the plates SOAKTIME 0 DISP VOL 100 Wash 4 x: ® CHANNEL NO 1 BEP II PHOT NO 100 µL HIV Conjugate 1 Solution OPERATE 3 YES Wash and dispense Conjugate 2 WASHINGS 4 30 min ± 2 min ASPIRATE NO (37 ± 1 °C) SOAKTIME 0 Fully autoDISP VOL 100 matic processing Wash 4 x: CHANNEL NO 2 BEP® II PHOT NO OPERATE 4 YES 100 µL HIV Conjugate 2 Wash and dispense chromogen WASHINGS 4 ASPIRATE NO 30 min ± 2 min SOAKTIME 0 (37 ± 1 °C) DISP VOL 75 CHANNEL NO 4 PHOT NO Wash 4 x: OPERATE 5 YES BEP® II Dispense Stopping Solution WASHINGS 0 75 µL Working ASPIRATE NO SOAKTIME 0 Chromogen Solution DISP VOL 75 CHANNEL NO 5 PHOT YES 30 min ± 2 min MEAS WL 450 (+15 to +25 °C, protected from light) REF WL 650 BLK COR NO EVAL MODE 1 75 µL Stopping Solution GEN CUT NO NEG CONT 3 after max. 1 h MAX NEG 0.150 MIN NEG FACT NEG Read at 450 nm MAX POS (Reference wavelength: 650 nm) THRESH 0.450 CUT OFF Test result Test result 25 µL HIV Sample Buffer OQTO G11 C0541 (1584) H 10 Enzygnost® HIV Integral Anwendungsbereich und -zweck Enzymimmunoassay zum qualitativen Nachweis einer HIV Infektion basierend auf der Bestimmung von HIV p24-Antigen, Antikörpern gegen die humanen Immundefizienz Viren der Klasse 1 und 2 (HIV 1 und HIV 2), sowie Antikörpern gegen das HIV 1-Subtyp O-Virus in Serum und Plasma. Die Abarbeitung des Enzymimmunoassays erfolgt mit den ELISA Prozessoren BEP ® II, BEP® III und BEP® 2000. Der Test wurde entwickelt für die Untersuchung von Einzelproben, nicht von gepoolten oder verdünnten Proben. Das Produkt darf nur für in vitro diagnostische Zwecke angewendet werden. Diagnostische Bedeutung Das erworbene Immundefizienzsyndrom (AIDS) wurde erstmalig 1981 als eigenständiges Krankheitsbild erkannt. Als ursächlicher Erreger gelten heute zwei verschiedene Human Immundefizienz Viren (HIV 1 und HIV 2). Die Isolierung des HIV 1 (Synonym: LAV/HTLV III) gelang bereits 1983 (1, 2). Im Jahre 1986 wurde ein weiteres Virus (HIV 2) isoliert, das ebenfalls als humanpathogen gilt (3) . Die Bedeutung der serologischen Bestimmung von Antikörpern gegen HIV hat besonders für die Transfusionsmedizin unter dem Gesichtspunkt der Prävention zur Verhütung der weiteren Ausbreitung der Erkrankung einen hohen Stellenwert. Folgerichtig wurde ab 1985 die Testung von Spenderblut auf Anti-HIV 1-Antikörper sowohl in Blutbanken als auch bei Herstellern von Plasmaprodukten obligatorisch. Zwischenzeitliche Informationen über die Verbreitung von HIV 2-Infektionen ergaben das Bedürfnis einer routinemäßigen Untersuchung von Blutspendern außer auf Anti-HIV 1- auch auf Anti-HIV 2-Antikörper, um eine potentielle Übertragung durch Transfusion oder aus Blut hergestellten Präparaten nach Möglichkeit auszuschließen. Im Jahre 1990 wurde ein neuartiges HIV beschrieben, welches zunächst serologisch als wenig relevant eingeordnet wurde (4). Erst 1994 gelang gleichzeitig die Sequenzierung dieses neuen Subtyps bei zwei unabhängigen Arbeitsgruppen (5,6) . Parallel zu den virologischen Arbeiten konnte von mehreren Arbeitsgruppen die serologische Bedeutung von dem nun als HIV 1- Subtyp O (7,8) genannten Virus gezeigt werden. Danach zeigen eine Vielzahl von Anti-HIV 1+2Assays Schwächen bei der Detektion von Anti-Subtyp O (9). Folgerichtig entstand der Bedarf zum gleichzeitigen sicheren Nachweis dieser neuen HIV-Variante und den etablierten HIV 1und HIV 2-Isolaten. Bei einigen HIV-Seroconversionen wurde HIV p24-Antigen nachgewiesen, bevor HIV-Antikörper gefunden wurden. Um das diagnostische Fenster zwischen HIV-Infektion und dem ersten serologischen Nachweis noch weiter zu schließen, war es daher sinnvoll, den Antikörpertest um eine HIV p24-Antigen Erkennung zu erweitern. Obwohl die Bestimmung von HIV-spezifischen Antikörpern und/oder Antigen keine sicheren Aussagen darüber erlaubt, ob zum Zeitpunkt der Blutentnahme infektiöses HIV 1 bzw. HIV 2 im Blut vorhanden ist , als auch bei negativem Ergebnis keineswegs die Anwesenheit von HIV 1 oder HIV 2 sicher ausgeschlossen werden kann, stellt der kombinierte Antigen-/Antikörpertest dennoch die derzeit beste Möglichkeit dar, Blutspenden von HIV-Infizierten mit sehr großer Wahrscheinlichkeit zu erkennen und zu eliminieren. Prinzip der Methode Enzygnost® HIV Integral ist ein Enzymimmunoassay, basierend auf der gleichzeitigen Bestimmung von HIV-Antigen und HIV-Antikörper. Die in der Untersuchungsprobe vorhandenen HIV-spezifischen Immunglobuline reagieren im ersten Schritt mit den in den Vertiefungen der Mikrotitrationsplatten fixierten HIV 1-, HIV 2- und/ oder HIV 1(Subtyp O)- rekombinanten Proteinen/ synthetischen Peptiden. Simultan können in der Untersuchungsprobe vorhandene HIV-p24-Antigene an die fixierten polyklonalen Anti-HIV-p24-Antikörper binden. Nach Entfernung der ungebundenen Probenbestandteile werden im zweiten Schritt die spezifisch gebundenen Antikörper durch Biotin-konjugierte HIV 1-, HIV 2- und /oder HIV 1 (Subtyp O)rekombinante Proteine / synthetische Peptide markiert (Antigen-Sandwich). Simultan werden gebundene HIV-Antigene durch Biotin-konjugierte monoklonale HIV-p24-Antikörper markiert (Antikörper -Sandwich). OQTO G11 C0541 (1584) H 11 Ausgabe Oktober 2003 Nach Entfernung der ungebundenen Biotin-Konjugate reagiert im dritten Schritt das Konjugat 2 (Streptavidin/POD) mit den spezifischen an die Festphase gebundenen Biotin-Konjugaten. Nach Entfernung des überschüssigen Konjugat 2 wird die gebundene Enzymaktivität des Konjugates bestimmt (blaue Farbreaktion). Die enzymatische Umsetzung des Chromogens wird durch Zusatz von Stopplösung POD unterbrochen (gelbe Farbreaktion). Die Farbintensität ist der in der Probe vorhandenen HIV-p24 Antigen- und HIV-Antikörper-Konzentration proportional. Reagenzien Inhalt der Handelspackung ® Enzygnost HIV Integral: HIV-Konjugat 1: HIV-Konjugat-Puffer 1: HIV-Konjugat 2: HIV-Probenpuffer: HIV-Kontrolle, positiv: HIV-Kontrolle, negativ: Etikett "Leerflasche für HIV-Konjugat 1" Etikett "Leerflasche für HIV-Konjugat 2" Packungsbeilage Barcode-Wertetabelle PE-Beutel 2 x 96 10 x 96 2 Testplatten 2 x 1 Flasche 2 x 15 ml 2 x 15 ml 2 x 15 ml 2 x 1,4 ml 2 x 2,0 ml 1 Stück 1 Stück 1 Stück 10 Testplatten 10 x 1 Flasche 10 x 15 ml 10 x 15 ml 4 x 15 ml 3 x 1,4 ml 3 x 2,0 ml 1 Stück 1 Stück 1 Stück 1 Stück 1 Stück Zusätzlich benötigte Materialien für die Packungen 2 x 96 und 10 x 96: Zusatz-Reagenzien für Enzygnost® TMB (Bestell-Nr. OUVP) Zusammensetzung Enzygnost® HIV Integral Testplatte Mit einem Gemisch aus rekombinanten Proteinen (E.Coli) und synthetischen Peptiden aus HIV 1 gp41, HIV 1 (Subtyp O) gp41, HIV 2 gp36, sowie polyklonalen Antikörpern (Kaninchen) gegen HIV p24 beschichtete Mikrotitrationsplatte. HIV-Konjugat 1 Lyophilisat aus HIV 1-, HIV 2- und HIV 1(Subtyp O) -rekombinantem HIV-Protein (E.Coli)/ synthetischen Peptiden und monoklonalen Antikörpern (Maus) gegen HIV p24, Biotin-konjugiert; blau gefärbt. Rekonstitution mit 15 ml HIV-Konjugat-Puffer 1. HIV-Konjugat-Puffer 1 Tris-Puffer mit Sapogenat* und Casein; gelb gefärbt. Konservierungsmittel: Phenol (max. 1g/l) HIV-Konjugat 2 Tris-Puffer mit Sapogenat* und Streptavidin, Peroxidase (POD)-konjugiert; rot gefärbt. Konservierungsmittel: Phenol (max. 1g/l) HIV-Probenpuffer Phosphat-Puffer mit Casein und Triton X 100*; rot gefärbt. Konservierungsmittel: Phenol (max. 1g/l) HIV-Kontrolle, positiv Hitzebehandeltes Humanserum mit Antikörpern gegen HIV 1-Antigene, stabilisiert. Extinktionsrichtwert: ≥ 0,7 Konservierungsmittel: Phenol ( max. 1g/l) HIV-Kontrolle, negativ Humanserum ohne HIV-Antigen und ohne Antikörper gegen HIV 1-, HIV 2- und HIV1 (Subtyp O)-Antigene, stabilisiert. Extinktionsrichtwert: ≤ 0,15 Konservierungsmittel: Phenol (max. 1g/l) OQTO G11 C0541 (1584) H 12 Warnungen und Vorsichtsmaßnahmen 1. Nur zur in vitro diagnostischen Anwendung. 2. Jede individuelle Blutspende, die zur Herstellung von Kontroll-Sera vorgesehen ist, wurde auf HBsAg, Anti-HCV, Anti-HIV 1 und Anti-HIV 2 untersucht. Für die Herstellung des KontrollSerums, negativ, werden nur Sera mit negativem Befund verwendet. Das positive KontrollSerum wurde hitzebehandelt ( mindestens 1 Stunde bei + 56°C). Unabhängig davon sollten alle aus menschlichem Blut gewonnenen Proben (z. B. Patientensera) und Produkte (z.B. Kontrollsera) wegen nie völlig auszuschließender Gefährdung durch Krankheitserreger mit angemessener Sorgfalt unter Einhaltung der bei Biogefährdung empfohlenen Sicherheitsmaßnahmen gehandhabt werden (10). 3. Das Tragen von Untersuchungshandschuhen während der gesamten Testdurchführung wird angeraten. 4. Für die Entsorgung fester infektiöser Materialien empfiehlt sich eine Autoklavierung von mindestens 1 Stunde bei +121 °C. Alle abgesaugten Lösungen sind in zwei hintereinandergeschalteten Vorlagen zu sammeln. Die Vorlagen sollten ein Desinfektionsmittel enthalten, das geeignet ist, human-pathogene Viren zu inaktivieren. Die vom Hersteller angegebenen Konzentrationen und Einwirkungszeiten müssen beachtet werden. Vorbereitung der Reagenzien Alle Reagenzien und Proben vor Testbeginn auf +15 bis +25 °C erwärmen. Dabei die Testplatte nicht dem Behältnis entnehmen. Für die Testdurchführung nicht benötigte Riegel dem Halterahmen entnehmen und für die spätere Verwendung lagern (siehe Tabelle 1). Der Packung Enzygnost® HIV Integral 10 x 96 liegt je ein barcodiertes Etikett für das HIV-Konjugat 1 und das HIV-Konjugat 2 bei. Um bei großen Serienlängen einen häufigen Spritzenwechsel am BEP® III zu vermeiden, kann es sinnvoll sein, mehrere Abfüllungen der Konjugate in eine größere Flasche (z.B. noch unbenutzte überzählige Leerflaschen für Chromogen-Gebrauchslösung, siehe Zusätzlich benötigte Materialien) umzuschütten, mit dem jeweiligen Etikett "Leerflasche für Konjugat..." zu etikettieren und ins Reagenzienrad einzustellen. Je Testplatte 20 ml Waschlösung POD (Zusatzreagenzien-Kit) mit destilliertem oder entionisiertem Wasser auf 400 ml verdünnen. Je Testplatte 1 ml Chromogen TMB mit 10 ml Puffer/Substrat TMB (Zusatzreagenzien-Kit ) in der mitgelieferten Leerflasche verdünnen (Chromogen-Gebrauchslösung ) und verschlossen unter Lichtschutz aufbewahren. Flasche nach Gebrauch sorgfältig mit destilliertem Wasser spülen. Wegen technisch bedingter Überfüllung ist das Überführen des Flascheninhalts von Chromogen TMB in die Abfüllung Puffer/Substrat TMB nicht zulässig. HIV-Konjugat 1-Lösung: Den gesamten Inhalt einer Flasche HIV-Konjugat-Puffer 1 (15 ml, gelb gefärbt ) in eine Flasche HIV-Konjugat 1 (Lyophilisat, blau gefärbt) überführen. Durch leichtes Schwenken das Lyophilisat vollständig auflösen. Die HIV-Konjugat 1-Lösung ist dann grün gefärbt. Vor Gebrauch sollte die HIV-Konjugat 1-Lösung mindestens 15 Minuten äquilibrieren. Haltbarkeit und Lagerungsbedingungen Ungeöffnet sind alle Bestandteile der Kombinationspackung Enzygnost® HIV Integral bei einer Lagertemperatur von +2 bis +8 °C bis zu den auf den Etiketten angegebenen Daten verwendbar. Die Haltbarkeit und Lagerbedingungen der geöffneten Reagenzien sind der Tabelle 1 im Anhang zu entnehmen. Erforderliche Geräte: BEP® II: Zur automatischen Durchführung der Reagenzien-Dosierung und der Waschschritte BEP® III: Zur automatischen Testabarbeitung nach der Probendosierung sowie Auswertung Zur vollautomatischen Testabarbeitung sowie Auswertung BEP® 2000: Pipetten: Kolbenhubpipetten 25, 100 und 1000 µl Inkubator: Bedecktes Wasserbad (+37 ± 1 °C) oder vergleichbare Inkubationsmethoden Alle zur Testdurchführung eingesetzten Geräte müssen validiert sein. OQTO G11 C0541 (1584) H 13 Untersuchungsmaterial Zur Untersuchung können Einzelproben (Human-Seren oder EDTA/Heparin/Citrat-Plasmen) verwendet werden, welche nach Standard-Labortechniken entnommen wurden. Die Proben sollten maximal 3 Tage bei +2 bis +8 °C gelagert werden. Zur längeren Lagerung sind die Proben einzufrieren. Methodik Testdurchführung mit BEP® II 1. Ansatzschema: Benötigte Anzahl der Auftragstellen feststellen ( = Anzahl der zu untersuchenden Proben plus 5 Vertiefungen für Kontrollen). 2. Probenpufferdosierung: 25 µl Proben-Puffer je Vertiefung vorlegen. 3. Probendosierung: In 3 Vertiefungen je 100 µl HIV-Kontrolle, negativ (A1 bis C1), in 1 Vertiefung 100 µl HIV-Kontrolle, positiv ( D1 ), in die folgenden Vertiefungen je 100 µl unverdünnte Probe dosieren und am Ende der Serie bzw. Testplatte noch einmal 100 µl HIVKontrolle, positiv einpipettieren. Alternativ zu oben aufgeführtem Pipettierschema ist es auch erlaubt, die HIV-Kontrolle, positiv in Doppelbestimmung am Anfang der Testreihe aufzutragen. Pipettierschema: In 3 Vertiefungen je 100 µl HIV-Kontrolle, negativ ( A1 bis C1 ) , in 2 Vertiefungen je 100 µl HIV-Kontrolle, positiv ( D1 und E1 ) und in die folgenden Vertiefungen je 100 µl unverdünnte Probe dosieren. Die Pipettiervorgänge sollten innerhalb von 30 min pro Testplatte durchgeführt werden. 4. Probeninkubation: Die Testplatte mit Folie abkleben und 30 ± 2 min bei 37 ±1°C inkubieren, Waschvorgang unmittelbar anschließen. 5. Waschen: Folie abziehen, alle Vertiefungen aussaugen und mit je ca. 0,3 ml Waschlösung 4 mal waschen. 6. Dosierung von HIV-Konjugat 1-Lösung: In jede Vertiefung 100 µl HIV Konjugat 1-Lösung einfüllen, mit neuer Folie abkleben und sofort in den Inkubator stellen. 7. HIV-Konjugat 1 - Inkubation: 30 ± 2 min bei 37 ± 1°C, wie unter 4. beschrieben, inkubieren, Waschvorgang unmittelbar anschließen. 8. Waschen: Folie entfernen und wie unter 5. beschrieben, 4mal waschen. 9. Dosierung von HIV-Konjugat 2: In jede Vertiefung 100 µl des HIV-Konjugates 2 einfüllen, mit neuer Folie abkleben und sofort in den Inkubator stellen. 10. HIV-Konjugat 2-Inkubation: 30 ± 2 min bei 37 ± 1°C, wie unter 4. beschrieben, inkubieren, Waschvorgang unmittelbar anschließen. 11. Waschen: Folie entfernen und wie unter 5. beschrieben, 4 mal waschen. 12. Substratdosierung: In jede Vertiefung 75 µl der Chromogen-Gebrauchslösung einfüllen. 13. Substratinkubation: Mit neuer Folie abkleben und 30 ± 2 min bei +15 bis +25°C lichtgeschützt inkubieren. 14. Stoppreaktion: Folie entfernen. Je Vertiefung 75 µl Stopplösung POD zugeben, dabei den gleichen Zeittakt wie bei Punkt 12. einhalten. 15. Messung: Innerhalb einer Stunde bei 450 nm photometrieren. Als Wellenlänge der Referenzmessung wird 650 nm (ggfs. zwischen 615 nm und 690 nm) empfohlen. Testdurchführung mit BEP® III Bei der Abarbeitung mit BEP® III müssen die Testplatten einschließlich der Probendosierung (Punkt 1 und 2 der "Testdurchführung mit BEP® II") vorbereitet werden. Unmittelbar im Anschluss daran werden die Testplatten offen, d.h. nicht mit Folie abgeklebt, in den BEP® III eingegeben. Dabei ist zu beachten, dass teilbestückte Testplatten mit "Wasserriegeln" auf mindestens halbe Testplatten (6 Testriegel) zu ergänzen sind. Die anschließende Testabarbeitung erfolgt vollautomatisch (siehe BEP® III-Bedienungsanleitung). Die in der BEP® III Software eingestellten Inkubationszeiten können auf Grund der technischen Rahmenbedingungen (Gerätetaktung) von denen der BEP® II Prozessierung abweichen, sind jedoch in der Kombination BEP® III/Enzygnost® validiert worden. Testdurchführung mit BEP® 2000 Die Probendosierung und anschließende Testabarbeitung erfolgt vollautomatisch im Gerät (siehe BEP® 2000-Bedienungsanleitung). OQTO G11 C0541 (1584) H 14 Testvalidierung Die Einzelmeßwerte der Extinktionen für die Kontroll-Sera werden zur Berechnung der Mittelwerte eingesetzt, wenn: -0,010 ≤ Eneg. ≤ 0,150 Epos. ≥ 0,700 Von den drei Extinktionswerten der negativen Kontrolle kann ein außerhalb der Spezifikation liegender Wert vernachlässigt werden. Die Extinktionswerte der positiven Kontrolle müssen beide die Spezifikation erfüllen. Werden diese Spezifikationen nicht erfüllt, ist der Test zu wiederholen. Testauswertung Die Auswertungen erfolgen mit BEP® 2000 und BEP® III automatisch. Bitte dazu die Bedienungsanleitungen heranziehen. Die nachfolgenden Kapitel sind bei Auswertung ohne Softwareunterstützung zu beachten. Aus den Extinktionswerten der negativen Kontrolle wird der Mittelwert gebildet. Zur Grenzwertberechnung wird zum Extinktionsmittelwert der negativen Kontrolle ein Wert von 0,450 addiert. – Grenzwert (cut off) = E neg. + 0,450 Als grenzwertiger Bereich wird definiert: Grenzwert bis Grenzwert - 0,05 Nach den Kriterien des Tests werden die Untersuchungsproben wie folgt klassifiziert: Testergebnis: 1. 2. 3. EProbe < cut off - 0,05 = "negativ" EProbe > cut off = "reaktiv" cut off - 0,05 ≤ EProbe ≤ cut off = "grenzwertig" Proben, die Extinktionswerte im grenzwertigen Bereich oder höhere Extinktionen ergeben, sind in Doppelbestimmung erneut zu testen. Ergeben sich für initial reaktive Proben bei beiden Einzelwerten der Wiederholungstestung Extinktionswerte unterhalb des grenzwertigen Bereiches, ist die Probe nach den Kriterien des Tests als negativ anzusehen. Bei erneut grenzwertigem oder höherem Extinktionswert bei mindestens einem der beiden Einzelwerte gilt die Probe als wiederholt reaktiv. Alle wiederholt reaktiv reagierenden Proben sollten unbedingt einer Bestätigung mit Hilfe sogenannter Konfirmationstests (z.B. Immunoblot, Nucleinsäure-Analyse) zugeführt werden. Sicherheitshalber sollte eine Folgeabnahme (ungefähr 2 Wochen später) erneut analysiert werden. Einschränkungen und Fehlerquellen 1. Antikoagulantien wie Heparin, EDTA und Citrat beeinflussen das Testergebnis nicht. 2. Hämolytische oder ikterische Proben führen zu keiner Testbeeinträchtigung. 3. Proben mit den potentiell störenden Substanzen ANA, Antikörpern gegen E.-Coli und EBV, sowie Seren von Schwangeren wurden mit dem Test überprüft. Mit den eingesetzten Proben wurde keine Beeinflussung des Testergebnisses beobachtet. 4. Bei hitzebehandelten Proben ( 30 min, 56°C ) wurde keine Störung beobachtet. 5. Ungenügend geronnene Seren und mikrobiell kontaminierte Untersuchungsproben sollten nicht eingesetzt werden. Eventuell vorhandene partikuläre Komponenten (z.B. Fibrin-Gerinnsel, Erythrozyten) sollten vor der Testdurchführung entfernt werden. 6. Lipämische, rheumafaktorhaltige, AMA-haltige, sowie Proben mit Antikörpern gegen HAV können zu erhöhter Reaktivität führen. 7. Enzygnost® HIV Integral ist ein Test zum gleichzeitigen Nachweis von HIV p24-Antigen und HIVAntikörpern und darf nicht zur alleinigen Detektion von HIV p24-Antigen eingesetzt werden. OQTO G11 C0541 (1584) H 15 8. Bei aufgetauten Proben ist auf eine gute Homogenisierung des Materials zu achten. 9. Die Reagenzien (ausgenommen Waschlösung POD, Stopplösung POD und die aus den chargengebundenen Reagenzien Chromogen TMB und Puffer/Substrat TMB hergestellte Chromogen-Gebrauchslösung) sind nur chargengebunden zu verwenden, d. h. nur in der Kombination der einzelnen 6-ziffrigen Chargen-Bezeichnung (Ch.-B.), die auf der Packung aufgedruckt, bzw. der separat beigepackten Barcode-Wertetabelle zu entnehmen sind. 10. Puffer/Substrat TMB, Chromogen-Gebrauchslösung und Stopplösung POD dürfen nicht in Kontakt mit Schwermetallionen oder oxidierenden Substanzen kommen (keine Pipetten mit flüssigkeitsführenden Metallteilen verwenden). Die Substratreaktionen nicht in der Nähe von Hypochlorit-haltigen Desinfektionsmitteln durchführen. Eine spontane Blaufärbung der Chromogen-Gebrauchslösung vor der Übertragung in die Testplatte deutet auf Kontamination hin; eine frische Lösung ist in einem sauberen Gefäß anzusetzen. Hautkontakt mit den vorgenannten Lösungen ist zu vermeiden. 11. Die Testplatte soll während der Inkubation ruhig liegen ( z. B. auf fixierter Schwimmhilfe oder im nicht zirkulierenden Wasserbad); die Kavitäten sind dabei in Kontakt mit dem temperierten Wasser. Werden Stabilisatoren zur Verhinderung der Verkeimung des Wassers verwendet, so ist sorgfältig darauf zu achten, daß weder die Testplattenoberfläche noch die Näpfchen mit diesen Lösungen in Kontakt kommen, da dadurch unspezifische Reaktionen hervorgerufen werden können. 12. Bei stark reaktiven Proben kann bei der Stoppreaktion der Farbstoff ausfallen. Die photometrische Auswertung wird dadurch nicht beeinflußt. 13. Die Kontrollsera sind unter Verwendung nativer Humansera hergestellt. Daher können Trübungen auftreten, die das Testergebnis jedoch nicht beeinflussen. 14. Die Testplatte vor Testbeginn nicht längere Zeit dem direkten Sonnenlicht aussetzen. Leistungsmerkmale des Tests Sensitivität und Spezifität Die Ergebnisse zur Prüfung der Sensitivität und Spezifität sind in den Tabellen 2 + 3 ( im Anhang) zusammengefasst. Bei der Ermittlung der Sensitivität wurden insgesamt 515 Anti-HIV 1, 164 Anti-HIV 2, 26 Anti-HIV 1 ( Subtyp O ) und 64 HIV-Antigen positive Proben untersucht. Alle getesteten HIV-Antigen/-Antikörper positiven Proben wurden nach den Kriterien des Enzygnost® HIV Integral positiv gefunden. Die Reaktivität des Tests bei Serokonversionsproben wurde anhand von 34 Serokonversionspanel untersucht. Dabei zeigt sich, dass Enzygnost® HIV Integral eine verbesserte Sensitivität bzgl. der Erkennung von Serokonversionen gegenüber reinen HIVAntikörper-Testen aufweist. Unabhängig davon kann nicht ausgeschlossen werden, dass sich bei breiter Anwendung des Tests einzelne Proben dem Nachweis entziehen können. Bei der Testung des SFTS Panel (1996) wurde die mit 250 pg HIV-Antigen/ml deklarierte Probe (Nr. 2024) reproduzierbar positiv gefunden. Durch Testung der mit 100 pg und der mit 250 pg HIV Antigen/ml deklarierten Verdünnungsstufen des SFTS-Panels wurde eine analytische Sensitivität zwischen 100 und 250 pg HIV Antigen/ml ermittelt. Bei der Ermittlung der Spezifität wurden insgesamt 8851 HIV-negative Blutproben untersucht und eine Spezifität von 99,3 bis 99,95 % ( initiale Testung ) bzw. 99,7 bis 100 % (Retestung) ermittelt. Bedingt durch das Untersuchungskollektiv, die Testdurchführung u.a. sind abweichende Werte möglich. Nach derzeitigem Kenntnisstand kann aus einem positiven Ergebnis der HIV-Testung nicht mit Sicherheit abgeleitet werden, dass infektiöses HIV 1 oder HIV 2 im Blut vorhanden ist, wie auch ein negatives Testergebnis keineswegs die Anwesenheit von HIV 1 oder HIV 2 sicher ausschließt. Reproduzierbarkeit Die Ergebnisse zur Intra/Inter-assay-Reproduzierbarkeit sind der Tabelle 4 ( im Anhang ) zusammengefasst. Es handelt sich hierbei um beispielhaft ermittelte Daten. Abhängig von der Testdurchführung u. a. sind durchaus abweichende Werte möglich. Enzygnost und BEP sind eingetragene Marken der Dade Behring Marburg GmbH in den USA, Deutschland und anderen Ländern. * Sapogenat ist eine Marke von Clariant. Triton X 100 ist eine Marke von Merck. Dade Behring Marburg GmbH Emil-von-Behring-Str. 76 D-35041 Marburg www.dadebehring.com OQTO G11 C0541 (1584) H 16 0197 Tab. 1 Haltbarkeit und Lagerungsbedingungen * Material/Reagenz Zustand Lagerung Stabilität* Enzygnost® HIV Integral Testplatte nach Öffnen +2 bis +8 °C im Beutel mit Trockenpatronen 4 Wochen HIV-Konjugat 1 nach Rekonstitution +2 bis +8 °C +15 bis +25 °C 4 Wochen 2 Tage HIV-Konjugat 2 nach Öffnen +2 bis +8 °C +15 bis +25 °C 4 Wochen 2 Tage HIV-Probenpuffer nach Öffnen +2 bis +8 °C 4 Wochen HIV-Kontrolle, positiv nach Öffnen +2 bis +8 °C -20 °C 4 Wochen 3 Monate HIV-Kontrolle, negativ nach Öffnen +2 bis +8 °C -20 °C 4 Wochen 3 Monate Chromogen TMB nach Öffnen +2 bis +8 °C Verfalldatum Puffer/Substrat TMB nach Öffnen +2 bis +8 °C Verfalldatum Chromogen-Gebrauchslösung verdünnt 1 + 10 +2 bis +8 °C +15 bis +25 °C geschl. Gefäß, lichtgeschützt 5 Tage 8 Stunden Waschlösung POD (Konzentrat) nach Öffnen verdünnt 1:20 verdünnt 1:20 +2 bis +8 °C +2 bis +8 °C +18 bis +25 °C Verfalldatum 1 Woche 1 Tag Stopplösung POD nach Öffnen +2 bis +8 °C Verfalldatum in keinem Fall länger als bis zum Verfalldatum OQTO G11 C0541 (1584) H 17 Tab. 2 Sensitivität Bei den Untersuchungen von Sensitivität wurden folgende Daten ermittelt: Probenkollektiv Probenanzahl Initial reaktiv 515 164 26 64 515 164 26 64* 34 HIV Panels Sensitivität gegenüber HIVAntikörper Testen verbessert Anti-HIV 1 pos. Anti-HIV 2 pos. Anti-HIV 1 (Subtyp O) pos. HIV-Antigen pos. Serokonversionspanel * Bei frühen Serokonversionsproben haben HIV-p24-Antigen-Teste für die HIV-Antigen-Detektion eine bessere Nachweisempfindlichkeit. Tab. 3 Spezifität Bei der Untersuchung zur Spezifität wurden folgende Daten ermittelt: Probenkollektiv Probenanzahl Initial reaktiv Retest reaktiv 4002 2135 2370 344 9 1 17 1 8 0 7 1 Negative Seren (A) Negative Seren (B) Negative Seren (C) Negative Plasmen (D) Tab. 4 Reproduzierbarkeit Bei der Untersuchung zur Intra-assay-Reproduzierbarkeit wurden die Proben an 5 Tagen in jeweils 8fach-Bestimmung getestet. Die Berechnung des Variationskoeffizienten (VK) erfolgt nach dem Varianzkomponentenmodell. Enzygnost® HIV Integral Probe P1 P2 P3 P4 Extinktionsmittelwert % VK 0,817 1,781 1,202 0,519 4,4 5,7 4,4 3,8 Bei den Untersuchungen zur Inter-assay-Reproduzierbarkeit wurden die Proben an 5 Tagen in jeweils 8fach-Bestimmung getestet. Die Berechnung des Varationskoeffizienten (VK) erfolgte nach dem Varianzkomponentenmodell. Enzygnost® HIV Integral Probe P1 P2 P3 P4 OQTO G11 C0541 (1584) H 18 Extinktionsmittelwert % VK 0,817 1,781 1,202 0,519 12 5,9 2,3 4,1 Tab. 5 Testdurchführung und -programmierung Enzygnost® HIV Integral Menüprogrammierung Testdurchführung (BEP® II, BEP® III, BEP® 2000) Vorbereitung der Reagenzien für den BEP® 2000 25 µl HIV-Probenpuffer 3 x 100 µl HIV-Kontrolle, negativ 1 x 100 µl HIV-Kontrolle, positiv je 100 µl unverdünnte Probe 1 x 100 µl HIV-Kontrolle, positiv BEP® II BEP® III 30 min ± 2 min (37 ± 1 °C) teilbestückte Platten mit „Wasserriegeln“ auf halbe Platten ergänzen 4 x Waschen: BEP® II 100 µl HIV-Konjugat 1-Lösung 30 min ± 2 min (37 ± 1 °C) automatische Testabarbeitung 4 x Waschen: BEP® II 100 µl HIV-Konjugat 2 30 min ± 2 min (37 ± 1 °C) 4 x Waschen: BEP® II 75 µl Chromogengebrauchslösung 30 min ± 2 min (+15 bis +25 °C, lichtgeschützt) 75 µl Stopplösung nach maximal 1 h Auswertung 450 nm (Referenzwellenlänge: 650 nm) Testergebnis OQTO G11 C0541 (1584) H Testergebnis 19 BEP® II MENU NO OPERATE 1 YES Dosierung Probenpuffer WASHINGS 0 ASPIRATE NO SOAKTIME 0 DISP VOL 25 CHANNEL NO 3 PHOT NO OPERATE 2 YES Waschen und Dosierung Konjugat 1 WASHINGS 4 ASPIRATE NO SOAKTIME 0 DISP VOL 100 CHANNEL NO 1 PHOT NO OPERATE 3 YES Waschen und Dosierung Konjugat 2 WASHINGS 4 ASPIRATE NO SOAKTIME 0 DISP VOL 100 CHANNEL NO 2 PHOT NO OPERATE 4 YES Waschen und Dosierung Chromogen WASHINGS 4 ASPIRATE NO SOAKTIME 0 DISP VOL 75 CHANNEL NO 4 PHOT NO OPERATE 5 YES Dosierung Stopplösung WASHINGS 0 ASPIRATE NO SOAKTIME 0 DISP VOL 75 CHANNEL NO 5 PHOT YES MEAS WL 450 REF WL 650 BLK COR NO EVAL MODE 1 GEN CUT NO NEG CONT 3 MAX NEG 0.150 MIN NEG FACT NEG MAX POS THRESH 0.450 CUT OFF - Enzygnost® HIV Integral Domaine d’utilisation et indication Test immunoenzymatique pour la mise en évidence qualitative d’une infection à VIH, basée sur la détection de l’antigène VIH p24, des anticorps anti-virus de l’immunodéficience humaine des classes 1 et 2 (VIH 1 et VIH 2), ainsi que des anticorps anti-VIH 1 sous-type O, dans le sérum ou le plasma. La réalisation du test immunoenzymatique se fait à l’aide des ELISA Processeurs BEP® II, BEP® III et BEP® 2000. Le test a été mis au point pour l’analyse d’échantillons individuels, et non pas d’échantillons poolés ou dilués. Le produit ne doit être utilisé qu'à des fins de diagnostic in vitro. Intérêt diagnostique Le Syndrome d’immunodéficience acquise (SIDA) a été reconnu pour la première fois en 1981 comme tableau clinique autonome. Deux virus différents d’immunodéficience humaine (VIH 1 et VIH 2) sont aujourd’hui considérés comme responsables de la maladie. L’isolement du VIH 1 (synonymes : LAV/HTLV III) a réussi dès 1983 (1, 2). En 1986, un deuxième virus (VIH 2), également pathogène pour l’Homme, a été isolé (3). Le dosage sérologique des anticorps anti-VIH présente un intérêt particulier pour la médecine transfusionnelle, puisqu’il permet de prévenir la propagation de la maladie. Depuis 1985, la recherche d’anticorps anti-VIH 1 sur les dons de sang est obligatoire aussi bien pour les centres de transfusion sanguine que pour les fabricants de produits sanguins. Des informations complémentaires sur le développement d’infections à VIH 2 ont depuis généralisé le dépistage en routine des anticorps anti-VIH 1 et VIH 2, dans le souci d’exclure le transfert possible de la maladie par la transfusion ou l’utilisation de préparations sanguines. En 1990, un nouveau VIH a été décrit, auquel il n’a tout d’abord été attribué qu’un faible intérêt sérologique (4). Ce n’est qu’en 1994 que deux équipes indépendantes ont réussi simultanément à définir la séquence de ce nouveau sous-type (5, 6). Parallèlement aux travaux virologiques, plusieurs équipes de recherche ont pu montrer l’intérêt sérologique du virus, aujourd’hui appelé VIH 1sous-type O (7, 8). Un grand nombre de tests anti-VIH 1+2 ont alors montré qu’ils révélaient difficilement les anticorps anti-sous-type O (9). Le besoin est donc apparu de disposer d’un test fiable pour la recherche simultanée de ce nouveau variant VIH et des isolats VIH 1 et VIH 2 déjà établis. Dans quelques cas de séroconversions à VIH, l’antigène VIH p24 a été révélé avant l’apparition des anticorps anti-VIH. Afin de fermer au maximum la fenêtre diagnostique entre l’infection à VIH et la première manifestation sérologique, il était donc intéressant d’élargir le test d’anticorps à une reconnaissance de l’antigène VIH p24. Bien que la mise en évidence d’anticorps anti-VIH spécifiques et/ou de l’antigène ne permette pas de dire avec certitude si le sang contient du VIH 1 ou du VIH 2 infectieux au moment du prélèvement, de même qu’un résultat négatif ne permet pas d’exclure avec certitude la présence de VIH 1 ou de VIH 2, le test combiné antigène/anticorps constitue pourtant actuellement la meilleure solution pour dépister et éliminer avec une grande probabilité les donneurs infectés par le VIH. Principe de la méthode Enzygnost® HIV Integral est un test immunoenzymatique, basé sur la recherche simultanée d’antigènes VIH et d’anticorps anti-VIH. Les immunoglobulines HIV-spécifiques contenues dans l’échantillon à tester réagissent dans un premier temps avec les protéines recombinantes et peptides synthétiques VIH 1, VIH 2 et/ou VIH 1 (sous-type O) fixés à la surface de la plaque de microtitration. Si l’échantillon contient de l’antigène VIH p24, celui-ci se fixe simultanément aux anticorps antiVIH p24 polyclonaux fixés à la surface de la plaque de microtitration. Après élimination par lavage des éléments non liés de l’échantillon, et dans une deuxième étape, les anticorps spécifiques liés sont marqués par les protéines recombinantes et peptides synthétiques VIH 1, VIH 2 et/ou VIH 1 (sous-type O) marqués à la biotine (technique sandwich antigène). Simultanément, l’antigène VIH lié est marqué aux anticorps anti-VIH p24 monoclonaux conjugués à la biotine (technique sandwich anticorps). Après élimination des conjugués à la biotine en excès, et dans une troisième étape, le conjugué 2 (streptavidine/POD) réagit avec les conjugués à la biotine spécifiques, liés à la phase solide. Après élimination du conjugué 2 en excès, l’activité enzymatique du conjugué fixé est mesurée (réaction colorée bleue). La transformation enzymatique du chromogène est stoppée par l’addition de Solution d’arrêt POD (réaction colorée jaune). L’intensité de la coloration est proportionnelle à la concentration d’antigène VIH p24 et d’anticorps VIH présents dans l’échantillon. OQTO G11 C0541 (1584) H 20 Edition Octobre 2003 Réactifs Contenu du coffret Enzygnost® HIV Integral : HIV Conjugué 1 : HIV Tampon Conjugué 1 : HIV Conjugué 2 : HIV Tampon échantillons : HIV Contrôle positif : HIV Contrôle négatif : Etiquette «Flacon vide pour HIV Conjugué 1» Etiquette «Flacon vide pour HIV Conjugué 2» Fiche technique Tableau de valeurs en codes à barres Sachet PE 2 x 96 10 x 96 2 plaques 2 x 1 flacon 2 x 15 ml 2 x 15 ml 2 x 15 ml 2 x 1,4 ml 2 x 2,0 ml 1 1 1 10 plaques 10 x 1 flacon 10 x 15 ml 10 x 15 ml 4 x 15 ml 3 x 1,4 ml 3 x 2,0 ml 1 1 1 1 1 Autres réactifs nécessaires pour les coffrets 2 x 96 et 10 x 96: Réactifs complémentaires pour Enzygnost® TMB (code OUVP) Composition Plaque Enzygnost® HIV Integral Plaque de microtitration recouverte d’un mélange de protéines recombinantes (E. coli) et de peptides synthétiques obtenus à partir de VIH 1 gp41, VIH 1 (sous-type O) gp41, VIH 2 gp36, ainsi que d’anticorps polyclonaux de lapin anti-VIH p24. HIV Conjugué 1 Lyophilisat de protéines VIH recombinantes (E. Coli) et de peptides synthétiques obtenus à partir de VIH 1, de VIH 2 et de VIH 1 (sous-type O), ainsi que d’anticorps monoclonaux de souris anti-VIH p24, conjugué à la biotine ; coloré en bleu. Reconstitution avec 15 ml d’VIH Tampon Conjugué 1. HIV Tampon Conjugué 1 Tampon Tris additionné de Sapogenat* et de caséine ; coloré en jaune. Agent de conservation : phénol (max. 1 g/l) HIV Conjugué 2 Tampon Tris additionné de Sapogenat* et de streptadivine, conjuguée à la peroxydase (POD) ; colorée en rouge. Agent de conservation : phénol (max. 1 g/l) HIV Tampon échantillons Tampon phosphate additionné de caseine et de Triton X 100* ; coloré en rouge. Agent de conservation : (phénol max. 1 g/l) HIV Contrôle positif Sérum humain traité à la chaleur, contenant des anticorps anti-antigène VIH 1, stabilisé. Valeur de D.O. indicative : ≥ 0,7 Agent de conservation : (phénol max. 1 g/l) HIV Contrôle négatif Sérum humain exempt d’antigène VIH et d’anticorps anti-VIH 1, d’anticorps anti-VIH 2 et d’anticorps anti-VIH 1 (sous-type O), stabilisé. Valeur de D.O. indicative : ≤ 0,15 Agent de conservation : (phénol max. 1 g/l) Mises en garde et précautions d’emploi 1. Réservé strictement à un usage in vitro. OQTO G11 C0541 (1584) H 21 2. Les échantillons sanguins des donneurs ayant servi à la préparation des sérums de contrôle ont été testés vis-à-vis de l’anticorps AgHBs, de l’anticorps anti-VHC, de l’anticorps anti-VIH 1 et de l’anticorps anti-VIH 2. Seuls les dons trouvés négatifs ont été utilisés pour la préparation du sérum de contrôle négatif. Le sérum de contrôle positif a été traité à la chaleur (au moins 1 heure à +56°C). Indépendamment de cela, tout échantillon (par ex. sérum de patient) ou produit (par ex. sérum de contrôle) obtenu à partir de sang humain doit être manipulé avec les précautions recommandées en cas de risque biologique, dans la mesure où on ne peut exclure totalement un risque d’infection (10). 3. Il est recommandé de porter des gants de protection pendant toute la réalisation du test. 4. Pour décontaminer le matériel de laboratoire infecté, l’autoclaver pendant au moins 1 heure à +121°C. Toutes les solutions aspirées doivent être récoltées dans deux récipients reliés l’un à l’autre et contenant chacun un désinfectant spécialement prévu pour inactiver les virus pathogènes pour l’homme. Respecter les concentrations et temps d’incubation indiqués par le fabricant. Préparation des réactifs Porter tous les réactifs et échantillons à +15/+25°C avant le début du test. Pour cela, ne pas sortir les plaques de leur emballage. Sortir du cadre les barrettes non utilisées, et les conserver pour un test ultérieur (cf. Tabl. 1). Le coffret Enzygnost® HIV Integral 10 x 96 contient des étiquettes codes à barres pour l’HIV Conjugué 1 et l’HIV Conjugué 2. Afin d’éviter un changement fréquent d’aiguille sur le BEP® III en cas de grandes séries, il peut être intéressant de verser le contenu de plusieurs flacons de Conjugué dans un flacon plus grand (par ex. un flacon vide non encore utilisé et normalement prévu pour la solution d’emploi du chromogène ; cf. Autres réactifs et matériel nécessaires), d’étiqueter celui-ci avec l’étiquette correspondante (« Flacon vide pour HIV Conjugué … ») et de le placer dans le rack réactifs. Pour une plaque, diluer 20 ml de Solution de lavage POD (coffret de réactifs complémentaires) avec de l’eau distillée ou désionisée en complétant à 400 ml. Pour une plaque, diluer 1 ml de Chromogène TMB avec 10 ml de Tampon/substrat TMB (coffret de réactifs complémentaires) dans le flacon vide joint au coffret (solution d’emploi du chromogène), fermer le flacon et le conserver à l’abri de la lumière. Bien rincer le flacon à l’eau distillée après emploi. Pour des raisons de capacité de flacon, il est impossible de verser directement le contenu d’un flacon de Chromogène TMB dans un flacon de Tampon/substrat TMB. Solution HIV Conjugué 1 : verser la totalité du contenu d’un flacon d’HIV Tampon Conjugué 1 (15 ml, coloré en jaune) dans un flacon d’HIV Conjugué 1 (lyophilisat, coloré en bleu). Aider à l’homogénéisation de la solution en agitant avec précaution. La solution HIV Conjugué 1 est alors colorée en vert. Laisser reposer la solution HIV Conjugué 1 au moins 15 min avant utilisation dans le test. Stabilités et conditions de conservation Avant leur ouverture, tous les éléments du coffret Enzygnost® HIV Integral se conservent à +2/ +8°C jusqu’à la date indiquée sur l’étiquette. Pour les stabilités et conditions de conservation des réactifs après ouverture des flacons et préparation des solutions d’emploi, se reporter au tableau 1 en annexe. Matériel nécessaire: BEP® II : pour la distribution automatique des réactifs et l'automatisation des étapes de lavage BEP® III : pour l'automatisation du test après la distribution des échantillons et de l'exploitation des résultats BEP® 2000 : pour l’entière automatisation du test et de l’ exploitation des résultats Pipettes: pipettes à embout de 25, 100 et 1000 µl Incubateur: bain-marie couvert (+37 ± 1 °C) ou méthode d'incubation équivalente Tout le matériel utilisé pour la réalisation du test doit être validé. Echantillons à tester Utiliser des échantillons (sérums humains ou plasmas citratés, héparinés ou prélevés sur EDTA) obtenus selon les techniques standard des laboratoires. Les échantillons peuvent être conservés 3 jours maximum à +2/+8°C. Pour une conservation plus longue, les congeler. OQTO G11 C0541 (1584) H 22 Méthode Réalisation du test sur le BEP® II 1.Plan de distribution : déterminer le nombre de cupules nécessaires (= nombre d’échantillons à tester + 5 cupules pour les contrôles). 2.Distribution du Tampon échantillons : distribuer dans chaque cupule 25 µl de Tampon échantillons. 3.Distribution des échantillons : distribuer dans 3 cupules 100 µl d’HIV Contrôle négatif (A1 à C1), dans une cupule 100 µl d’HIV Contrôle positif (D1), puis 100 µl de chacun des échantillons non dilués ; à la fin de la série ou de la plaque, distribuer de nouveau 100 µl d’HIV Contrôle positif. Comme alternative, on peut également distribuer l’HIV Contrôle positif en double en début de série. On a alors le schéma de distribution suivant : 100 µl d’HIV Contrôle négatif (A1 à C1) dans 3 cupules, 100 µl d’HIV Contrôle positif dans deux cupules (D1 et E1), puis 100 µl de chacun des échantillons non dilués. La distribution doit s’enchaîner, et durer 30 min maximum pour une plaque. 4.Incubation des échantillons : couvrir la plaque d’une feuille adhésive, laisser incuber 30 ± 2 min à +37 ± 1 °C, et enchaîner immédiatement le processus de lavage. 5.Lavage : retirer la feuille adhésive, aspirer le contenu de toutes les cupules, et rincer 4 fois avec env. 0,3 ml de Solution de lavage. 6.Distribution de la solution HIV Conjugué 1 : distribuer dans chaque cupule 100 µl de solution HIV Conjugué 1, couvrir la plaque d’une nouvelle feuille adhésive et la placer immédiatement dans l’incubateur. 7.Incubation de l’HIV Conjugué 1 : laisser incuber 30 ± 2 min à +37 ± 1 °C comme décrit en 4, et enchaîner immédiatement le processus de lavage. 8.Lavage : retirer la feuille adhésive, et laver 4 fois comme décrit en 5. 9.Distribution de l’HIV Conjugué 2 : distribuer dans chaque cupule 100 µl de l’HIV Conjugué 2, couvrir la plaque d’une nouvelle feuille adhésive, et la placer immédiatement dans l’incubateur. 10.Incubation de l’HIV Conjugué 2 : laisser incuber 30 ± 2 min à +37 ± 1 °C comme décrit en 4, et enchaîner immédiatement le processus de lavage. 11.Lavage : retirer la feuille adhésive, et laver 4 fois comme décrit en 5. 12.Distribution du substrat : distribuer dans chaque cupule 75 µl de la solution d’emploi du chromogène. 13.Incubation du substrat : couvrir la plaque d’une nouvelle feuille adhésive, et la laisser incuber 30 ± 2 min à +15/+25°C à l’abri de la lumière. 14.Arrêt de la réaction : retirer la feuille adhésive, et ajouter 75 µl de Solution d’arrêt POD dans chaque cupule, en respectant le même rythme de distribution qu’en 12. 15.Mesure : faire une mesure photométrique à 450 nm dans l’heure qui suit. Comme longueur d’onde de référence, choisir de préférence 650 nm (éventuellement comprise entre 615 et 690 nm). Réalisation du test sur le BEP® III Pour une utilisation sur le BEP® III, les plaques-tests doivent être préparées jusqu’y compris la distribution des échantillons (points 1 et 2 du paragraphe «Réalisation du test sur le BEP® II»). Immédiatement après cette étape, placer la plaque ouverte, c’est-à-dire non recouverte d’une feuille adhésive, dans le BEP® III. Si la plaque n’est pas totalement utilisée, la compléter au moins pour moitié (6 barrettes) avec des barrettes remplies d’eau. La suite du test est ensuite effectuée entièrement automatiquement (cf. Manuel d’utilisation du BEP® III). Les temps d’incubation prévus dans le logiciel du BEP® III peuvent, du fait de conditions techniques (cadence de l’appareil), diverger par rapport à ceux du BEP® II. Ils ont toutefois été validés dans la combinaison BEP® III/Enzygnost®. Réalisation du test sur le BEP® 2000 La distribution des échantillons ainsi que la réalisation du test sont effectuées entièrement automatiquement par l’appareil (cf. Manuel d’utilisation du BEP® 2000). OQTO G11 C0541 (1584) H 23 Validation du test Les différentes valeurs de densité optique obtenues pour les sérums de contrôle peuvent être utilisées pour le calcul des valeurs moyennes si : -0,010 ≤ D.O.nég. ≤ 0,150 D.O.pos. ≥ 0,700 Sur les trois densités optiques du contrôle négatif, si une valeur sort du domaine indiqué, elle peut être négligée. Les deux valeurs du contrôle positif doivent être trouvées dans le domaine indiqué. Si ces critères ne sont pas remplis, le test doit être recommencé. Exploitation du test L’exploitation des résultats est effectuée automatiquement par le BEP® 2000 et le BEP® III. Respecter les instructions indiquées pour l’appareil utilisé. Ci-dessous le protocole d’exploitation du test en l’absence d’un logiciel. Calculer la valeur moyenne des densités optiques obtenues pour le contrôle négatif, et y ajouter une valeur de 0,450 pour obtenir la valeur-seuil : Valeur seuil (cut off) = D.O.nég. + 0,450 La zone grise est déterminée comme suit : Valeur-seuil jusqu’à valeur-seuil - 0,05 Selon les critères du test, les échantillons sont classés comme suit : Résultat du test : 1. D.O.échantillon < cut off - 0,05 = «négatif» 2. D.O.échantillon > cut off = «réactif» 3. cut off - 0,05 ≤ D.O.échantillon ≤ cut off = «douteux» Les échantillons dont la densité optique est trouvée dans la zone grise ou à une valeur supérieure, doivent être retestés en double. Les échantillons considérés comme réactifs selon la densité optique initiale trouvée, et dont les deux nouvelles densités optiques obtenues dans le retest sont trouvées inférieures à la zone grise, doivent être interprétés comme négatifs selon les critères du test. Si au moins une des deux densités optiques du retest est trouvée de nouveau dans la zone grise ou à une valeur supérieure lors du retest, l’échantillon est confirmé réactif. Tout échantillon confirmé réactif doit ensuite impérativement être testé selon un test dit de confirmation (par ex. Immunoblot ou test de l’acide nucléique). Par sécurité, il est recommandé de refaire l’analyse avec un deuxième échantillon (env. 2 semaines plus tard). Limites du test et sources d’erreurs 1.Les anticoagulants comme l’héparine, l’EDTA ou le citrate n’ont pas d’influence sur le test. 2.Les échantillons hémolytiques ou ictériques n’ont pas d’influence sur le test. 3.Des échantillons contenant des substances potentiellement perturbantes, comme les ANA ou les anticorps anti-E. Coli et anti-EBV, ainsi que des sérums de femmes enceintes ont été testés avec Enzygnost® HIV Integral, sans qu’aucune influence n’ait été observée sur le test. 4.L’utilisation d’échantillons traités à la chaleur (30 min à +56°C) n’a montré aucune interférence. 5.Ne pas utiliser de sérums incomplètement coagulés ni d’échantillons contaminés. En cas de présence d’éléments particulaires (par ex. des caillots de fibrine ou des érythrocytes), les éliminer avant le test. 6.Les échantillons lipémiques, contenant des facteurs rhumatoïdes, des AMA ou des anticorps anti-HAV peuvent provoquer une réactivité augmentée. 7.Enzygnost® HIV Integral est un test qui permet la détection simultanée de l’antigène VIH p24 et des anticorps anti-VIH ; il ne doit pas être utilisé pour la détection de l’antigène VIH p24 seul. OQTO G11 C0541 (1584) H 24 8.Si on utilise des échantillons décongelés, veiller à bien les homogénéiser avant emploi. 9.Les réactifs (à l'exception de la Solution de lavage POD, de la Solution d'arrêt POD et de la solution d'emploi du chromogène obtenue à partir des lots de réactifs indiqués pour le Chromogène TMB et le Tampon/substrat TMB) ne peuvent être utilisés que selon la combinaison des numéros de lots à 6 chiffres indiqués sur le coffret et dans le tableau des valeurs codes à barres joint. 10.Le Tampon/substrat TMB, la solution d’emploi du chromogène et la Solution d’arrêt POD ne doivent pas entrer en contact avec des ions de métaux lourds ni des substances oxydantes (ne pas utiliser de pipettes à parties métalliques au niveau du passage des solutions). La réaction du substrat ne doit pas être effectuée à proximité de désinfectants contenant de l’eau de Javel. Une coloration bleue de la solution d’emploi du chromogène avant son transfert dans la plaque indique une contamination ; préparer une nouvelle solution dans un récipient propre. Eviter tout contact de la peau avec les solutions sus-mentionnées. 11. La plaque doit rester immobile pendant l’incubation (la placer par ex. sur un support fixe ou dans un bain-marie sans circulation d’eau) ; le fond des cupules doit être en contact avec l’eau thermostatée. Si l’eau contient des stabilisateurs pour éviter la contamination, bien veiller à ce que ni la surface supérieure de la plaque ni l’intérieur des cupules n’entrent en contact avec cette eau, au risque d’obtenir des réactions non-spécifiques. 12.En cas d’échantillons fortement réactifs, il peut y avoir absence de coloration au moment de l’arrêt de la réaction, sans que cela ait d’influence sur l’exploitation photométrique. 13.Les sérums de contrôle sont obtenus à partir de sérums humains natifs. Ils peuvent donc devenir trouble, sans que cela ait d’influence sur le résultat du test. 14. Une fois la plaque prête pour le test, ne pas la laisser à la lumière directe du soleil. Caractéristiques du test Sensibilité et spécificité Les résultats de l’étude de sensibilité et de spécificité sont résumés dans les tableaux 2 et 3 en annexe. Pour déterminer la sensibilité du test, un total de 515 échantillons positifs en anticorps anti-VIH 1, 164 échantillons positifs en anticorps anti-VIH 2, 26 échantillons positifs en anticorps anti-VIH 1 (sous-type O) et de 64 échantillons positifs en antigène VIH ont été testés. Tous les échantillons ont été trouvés positifs selon les critères du test Enzygnost® HIV Integral. La réactivité du test vis-à-vis des échantillons en séroconversion a été testée sur un panel de 34 séroconversions. L'étude de certains panels commerciaux a montré que le test Enzygnost® HIV Integral présente une sensibilité améliorée pour la détection des séroconversions par rapport à d'autres tests qui ne révèlent que les anticorps anti-VIH. Indépendamment de cela, il ne peut être exclu, que certains sérums ne soient pas détectés. Lors du test du panel SFTS (1996), l’échantillon dont la valeur déclarée était de 250 pg d’antigène VIH/ml (n° 2024) était trouvé positif de façon reproductible. Lors du test des dilutions du panel SFTS, aux valeurs de 100 pg et de 250 pg d’antigène VIH/ml, la sensibilité analytique a été trouvée entre 100 et 250 pg d’antigène VIH/ml. Pour déterminer la spécificité du test, un total de 8851 échantillons VIH-négatifs ont été testés, donnant une spécificité comprise entre 99,3 % et 99,95 % (pour le test initial) ou entre 99,7 % et 100 % (pour le retest). Des valeurs divergentes peuvent cependant être obtenues selon le collectif utilisé ou les conditions de réalisation du test. Selon l’état actuel des connaissances, un résultat positif en VIH ne permet pas avec certitude d’affirmer la présence dans le sang de VIH 1 ou de VIH 2 infectieux, de même qu’un résultat négatif ne permet pas d’exclure avec certitude la présence de VIH 1 ou de VIH 2. Reproductibilité Les résultats de l’étude de répétabilité et de reproductibilité sont résumés dans le tableau 4 en annexe. Les données indiquées le sont à titre d’exemple. Des valeurs divergentes peuvent être obtenues selon les conditions de réalisation du test. Enzygnost et BEP sont des marques déposées de Dade Behring Marburg GmbH aux USA, en Allemagne et dans d'autres pays. *Sapogenat est une marque de Clariant. Triton X 100 est une marque de Merck. Dade Behring Marburg GmbH Emil-von-Behring-Str. 76 D-35041 Marburg www.dadebehring.com OQTO G11 C0541 (1584) H 25 0197 Tabl. 1 Stabilités et conditions de conservation Échantillons/réactifs état conservation stabilité* Plaque Enzygnost® HIV Integral après ouverture +2/+8 °C dans sachet avec capsule dessicat. 4 semaines HIV Conjugué 1 après reconstitution +2/+8 °C +15/+25 °C 4 semaines 2 jours HIV Conjugué 2 après ouverture +2/+8 °C +15/+25 °C 4 semaines 2 jours HIV Tampon échantillons après ouverture +2/+8 °C 4 semaines HIV Contrôle positif après ouverture +2/+8 °C -20 °C 4 semaines 3 mois HIV Contrôle négatif après ouverture +2/+8 °C -20 °C 4 semaines 3 mois Chromogène TMB après ouverture +2/+8 °C date de péremp. Tampon/substrat TMB après ouverture +2/+8 °C date de péremp. Solution d'emploi du chromogène diluée au 1/11 +2/+8 °C dans +15/+25 °C dans récipient fermé à l'abri de la lumière 5 jours 8 heures Solution de lavage POD (concentrée) après ouverture diluée au 1/20 diluée au1/20 +2/+8 °C +2/+8 °C +18/+25 °C date de péremp. 1 semaine 1 jour Solution d'arrêt POD après ouverture +2/+8 °C date de péremp. * jamais au-delà de la date de péremption OQTO G11 C0541 (1584) H 26 Tabl. 2 Sensibilité Les données suivantes ont été obtenues dans le cadre de l’étude de sensibilité : Collectif d'échantillons Nombre d'échant. réactifs au test initial 515 164 26 64 515 164 26 64* 34 panel d'VIH Sensibilité améliorée par rapport aux tests d'anticorps VIH Anti VIH 1 positifs Anti VIH 2 positifs Anti VIH 1 (soustype O) positif Antigène VIH-positifs Panel de séroconversions * Avec des échantillons à séroconversion précoce, les tests VIH Antigène-p24 présentent une meilleure sensibilité pour la détection de l'antigène VIH. Tabl. 3 Spécificité Les données suivantes ont été obtenues dans le cadre de l’étude de spécificité : Collectif d'échant. Nombre d'échant. réactifs au test initial réactifs au retest 4002 2135 2370 344 9 1 17 1 8 0 7 1 Sérums négatifs (A) Sérums négatifs (B) Sérums négatifs (C) Plasmas négatifs (D) Tabl. 4 Reproductibilité Dans le cadre de l’étude de répétabilité, les échantillons ont été testés 8 fois sur 5 jours. Le calcul des coefficients de variation (CV) s’est fait par analyse multivariée. Enzygnost® HIV Integral Échantillons P1 P2 P3 P4 Valeur moyenne d'extinction % CV 0,817 1,781 1,202 0,519 4,4 5,7 4,4 3,8 Dans le cadre de l’étude de reproductibilité, les échantillons ont été testés 8 fois sur 5 jours. Le calcul des coefficients de variation (CV) s’est fait par analyse multivariée. Enzygnost® HIV Integral Échantillons P1 P2 P3 P4 OQTO G11 C0541 (1584) H 27 Valeur moyenne d'extinction % CV 0,817 1,781 1,202 0,519 12 5,9 2,3 4,1 Tabl. 5 Réalisation et programmation du test Enzygnost® HIV Integral Programmation du menu Réalisation du test (BEP® II, BEP® III, BEP® 2000) pour le BEP® 2000 préparation des réactifs 25 µl de Tampon échantillons VIH 3 x 100 µl de Contrôle HIV négatif 1 x 100 µl de Contrôle HIV positif 100 µl de chaque échantillon non dilué 1 x 100 µl de Contrôle HIV positif BEP® II BEP® III MENU NO OPERATE 1 YES Distribution du Tampon échantillons WASHINGS ASPIRATE SOAKTIME DISP VOL CHANNEL NO PHOT OPERATE 2 0 NO 0 25 3 NO YES Lavage et distribution du Conjugué 1 30 min ± 2 min (37 ± 1 °C) compléter si nécessaire avec WASHINGS des barrettes remplies d'eau ASPIRATE pour obtenir une demie-plaque SOAKTIME DISP VOL CHANNEL NO PHOT OPERATE 3 4 x lavages: BEP® II 100 µl de Solution HIV Conjugué 1 4 NO 0 100 1 NO YES Lavage et distribution du Conjugué 2 30 min ± 2 min (37 ± 1 °C) réalisation automatique du test 4 x lavages: BEP® II 100 µl de Solution HIV Conjugué 2 WASHINGS ASPIRATE SOAKTIME DISP VOL CHANNEL NO PHOT OPERATE 4 4 NO 0 100 2 NO YES Lavage et distribution du Chromogène WASHINGS ASPIRATE SOAKTIME DISP VOL CHANNEL NO PHOT OPERATE 5 30 min ± 2 min (37 ± 1 °C) 4 x lavages: BEP® II 4 NO 0 75 4 NO YES Distribution de la Solution d'arrêt 75 µl de Solution d'emploi du chromogène 30 min ± 2 min (+15/+25 °C, l'abri de la lumière) 75 µl de Solution d'arrêt Après 1 heure maximum exploitation à 450 nm (longueur d'onde de référence : 650 nm) résultat du test OQTO G11 C0541 (1584) H BEP® II résultat du test 28 WASHINGS ASPIRATE SOAKTIME DISP VOL CHANNEL NO PHOT MEAS WL REF WL BLK COR EVAL MODE GEN CUT NEG CONT MAX NEG MIN NEG FACT NEG MAX POS THRESH CUT OFF 0 NO 0 75 5 YES 450 650 NO 1 NO 3 0.150 0.450 - Enzygnost® HIV Integrale Settori d’impiego e funzione Metodo immunoenzimatico per l'identificazione qualitativa di una infezione HIV, basata sulla determinazione dell'antigene HIV p24, degli anticorpi contro il virus dell'immunodeficienza umana del tipo 1 e 2 (HIV 1 e HIV 2) e degli anticorpi anti-HIV1 sottotipo O, nel siero e nel plasma. Il test immunoenzimatico viene impiegato sugli analizzatori BEP® II, BEP® III e BEP® 2000 ELISA. Il test è stato realizzato per la determinazione di singoli campioni, ma non per pool di campioni o per campioni diluiti. Il prodotto deve essere utilizzato solo per scopi diagnostici in vitro. Significato diagnostico La sindrome da immunodeficienza acquisita (AIDS) è stata riconosciuta per la prima volta nel 1981 come forma clinica a sè stante. Come agenti patogeni della malattia sono stati fino ad oggi riconosciuti due diversi virus dell’immunodeficienza umana (HIV 1 e HIV 2). Il virus HIV 1 (sinonimo: LAV/HTLV III) è stato isolato nel 19831,2. Nel 1986 è stato isolato un altro virus (HIV 2), che è risultato essere altrettanto patogeno per l’uomo3. La determinazione sierologica degli anticorpi anti-HIV riveste particolare importanza nella medicina trasfusionale, per prevenire l’ulteriore diffusione della malattia. Dal 1985 è stato reso obbligatorio il controllo degli anticorpi anti-HIV 1 presso le banche del sangue ed i produttori di emoderivati. Informazioni più recenti sulla diffusione delle infezioni da HIV 2 hanno dimostrato la necessità di un controllo sistematico degli anticorpi anti-HIV 1 e antiHIV 2 nei donatori di sangue, per escludere, per quanto possibile, ogni potenziale trasmissione del virus mediante trasfusioni di sangue ed emoderivati. Nel 1990 è stato descritto un nuovo tipo di HIV, il quale in un primo tempo fu classificato come sierologicamente poco rilevante4. Nel 1994 è stato possibile, da parte di due diversi gruppi di lavoro, determinare la sequenza nucleotidica di questo nuovo sottotipo5,6. Parallelamente a queste ricerche virologiche è stato possibile dimostrare, da parte di diversi gruppi di lavoro, l’importanza sierologica del virus ora denominato HIV 1-sottotipo O7,8. Inoltre alcuni test anti-HIV 1 + 2 hanno dimostrato scarsa sensibilità per quanto riguarda la determinazione degli anticorpi anti-sottotipo O9. Di conseguenza è scaturita la necessità di un accertamento più sicuro di questa nuova variante dell’HIV accanto alle consuete indagini per i virus HIV 1 e HIV 2. In alcune sieroconversioni HIV prima è stato idientificato l’antigene HIV p24 e poi gli anticorpi anti-HIV. Per ridurre ulteriormente l’intervallo diagnostico tra l’infezione da HIV e la prima determinazione sierologica, si è ritenuto utile combinare il test anticorpale con il test per l’identificazione dell’antigene HIV p24. Sebbene l’identificazione degli anticorpi specifici anti-HIV e/o degli antigeni non possa escludere con certezza la presenza dei virus HIV 1 o HIV 2 nel sangue al momento del prelievo, così come non si può in nessun caso escludere con sicurezza la presenza di HIV 1 o HIV 2 in caso di risultato negativo, il test combinato antigene/anticorpo oggi rappresenta la migliore possibilità per riconoscere ed eliminare, con alto grado di probabilità, i campioni di sangue infetti da HIV. Principio del metodo Enzygnost® HIV Integrale è un test immunoenzimatico per la determinazione simultanea degli antigeni HIV e degli anticorpi anti-HIV. Nella prima fase, le immunoglobuline specifiche HIV contenute nel campione si legano alle proteine ricombinanti/peptidi sintetici dell’ HIV 1, dell’ HIV 2 e dell’HIV 1 (sottotipo O) adesi sulle pareti dei pozzetti della piastra per microtitolazione Contemporaneamente l’antigene HIV p24, presente nel campione in esame, si può legare agli anticorpi anti-HIV p24 policlonali adesi alle pareti della piastra. Nella seconda fase, dopo l’eliminazione delle componenti del campione non legate, gli anticorpi legati in modo specifico sono marcati (sandwich antigene) con le proteine ricombinanti/peptidi sintetici dell’ HIV 1, dell’ HIV 2 e dell’ HIV 1 (sottotipo O) coniugati con biotina. Simultaneamente gli antigeni HIV legati vengono marcati (sandwich anticorpo) con gli anticorpi anti-HIV p24 monoclonali coniugati con biotina. Nella terza fase, dopo l’eliminazione del coniugato di biotina non legato, il Coniugato 2 (Streptavidina/POD) reagisce con i coniugati specifici di biotina legati alla fase solida. Dopo l’eliminazione del Coniugato 2 non legato viene determinata l’attività enzimatica del coniugato (reazione di colore blu). La trasformazione enzimatica del cromogeno viene interrotta mediante l’aggiunta della Soluzione bloccante POD (reazione di colore giallo). L’intensità del colore sviluppato è proporzionale alla concentrazione degli anticorpi anti-HIV e degli antigeni HIV p24 presenti nei campioni in esame. OQTO G11 C0541 (1584) H 29 Edizione Ottobre 2003 Reagenti Contenuto delle confezioni Enzygnost® HIV Integrale: HIV Coniugato 1: HIV Tampone per coniugato 1: HIV Coniugato 2: HIV Tampone per i campioni: HIV Siero di controllo, positivo: HIV Siero di controllo, negativo: Etichetta «Flacone vuoto per coniugato 1» Etichetta «Flacone vuoto per coniugato 2» Istruzioni per l'uso Tabella con i codici a barre Sacchetto in PE 2 x 96 10 x 96 2 piastre 2 x 1 flacone 2 x 15 mL 2 x 15 mL 2 x 15 mL 2 x 1,4 mL 2 x 2,0 mL 1 1 1 10 piastre 10 x 1 flacone 10 x 15 mL 10 x 15 mL 4 x 15 mL 3 x 1,4 mL 3 x 2,0 mL 1 1 1 1 1 Materiali supplementari richiesti, ma non forniti, per i kit da 2 x 96 e 10 x 96 test: Reagenti supplementari per Enzygnost® TMB (Cod. nr. UVP) Composizione Enzygnost® HIV Integrale piastra test Piastra per microtitolazione sensibilizzata con una miscela di proteine ricombinanti (E. Coli) e peptidi sintetici di HIV 1 gp41, HIV 1 (sottotipo O) gp 41, HIV 2 gp36, e con anticorpi policlonali (coniglio) anti-HIV p24. HIV Coniugato 1 Liofilizzato costituito da proteine ricombinanti HIV (E. Coli)/peptidi sintetici di HIV 1, HIV 2 e HIV 1 (sottotipo O) e anticorpi monoclonali (topo) anti HIV p24 coniugati con biotina; colorazione blu. Ricostituire con 15 mL di HIV Tampone per coniugato 1. HIV Tampone per coniugato 1 Tampone tris contenente Sapogenat* e caseina; colorazione gialla. Conservante: fenolo (max. 1 g/L) HIV Coniugato 2 Tampone Tris contenente Sapogenat* e streptavidina coniugata con perossidasi (POD); colorazione rossa. Conservante: fenolo (max. 1 g/L) HIV Tampone per i campioni Soluzione di tampone fosfato con caseina e Triton X 100*; colorazione rossa. Conservante: fenolo (max. 1 g/L) HIV Siero di controllo, positivo Siero umano inattivato al calore contenente anticorpi contro l’antigene HIV 1, stabilizzato. Valore nominale di estinzione: ≥ 0,7 Conservante: fenolo (max. 1 g/L) HIV Siero di controllo, negativo Siero umano privo di antigene HIV e anticorpi contro l’antigene HIV 1, anti-HIV 2 e anti-HIV 1 (sottotipo O), stabilizzato. Valore nominale di estinzione: ≤ 0,15 Conservante: fenolo (max. 1 g/L) Avvertenze e precauzioni 1. Solo per uso diagnostico in vitro. 2. Ogni donazione di sangue utilizzata per la produzione dei sieri di controllo, è stata esaminata per la ricerca della HBsAg e degli anticorpi anti-HCV, anti-HIV 1 e anti-HIV 2. Solo i campioni risultati negativi sono stati impiegati per la produzione. Il siero di controllo positivo è stato inattivato mediante trattamento al calore (almeno 1 ora a +56°C). OQTO G11 C0541 (1584) H 30 Tuttavia, poichè non è possibile escludere con assoluta certezza il pericolo di agenti patogeni, tutti i derivati da sangue umano devono essere trattati con le necessarie precauzioni rispettanto le norme di sicurezza sul rischio biologico10. 3. Si consiglia l’uso di guanti di protezione durante l’esecuzione del test. 4. Per la distruzione del materiale solido infettivo, si consiglia il trattamento in autoclave per almeno 1 ora a +121°C. Tutti i liquidi aspirati devono essere raccolti in due raccoglitori collegati in serie. I raccoglitori dovrebbero contenere un disinfettante adatto all’inattivazione dei virus patogeni umani. Osservare le concentrazioni ed i tempi di azione indicati dal produttore. Preparazione dei reagenti Prima dell’inizio del test portare tutti i reagenti ed i campioni in esame a +15/+25 °C. Non togliere la piastra test dal contenitore. Togliere dal supporto le file di pozzetti non necessarie per il test e conservarle per un impiego successivo (v. Tabella 1). La confezione di Enzygnost® HIV Integrale 10x96 test contiene una etichetta con codice a barre sia per il Coniugato 1, che per il Coniugato 2. Analizzando una grande quantità di campioni sul BEP® III, per evitare che la siringa venga cambiata spesso, si consiglia di versare il contenuto di diversi flaconi di coniugato in un flacone più grande (es. un grande flacone vuoto non utilizzato per la Soluzione d’uso del Cromogeno, vedere Materiali richiesti ma non forniti), etichettare questo flacone con la rispettiva etichetta («Flacone vuoto per coniugato…»). Posizionare il flacone etichettato nel rotore per i reagenti. Per ogni piastra test diluire 20 mL di Soluzione di lavaggio POD fino a 400 mL con acqua distillata o deionizzata. Per ogni piastra test diluire 1 mL di Cromogeno TMB con 10 mL di Tampone/substrato TMB (Kit Reagenti supplementari) nel flacone vuoto appositamente fornito (soluzione d’uso di cromogeno) e conservare ben chiuso al riparo dalla luce. Dopo l’uso, lavare accuratamente il flacone con acqua distillata. A causa della dimensione del flacone non è possibile versare il Cromogeno TMB direttamente nel Tampone/substrato TMB. HIV Soluzione del coniugato 1: versare il contenuto di un flacone di HIV Tampone per coniugato 1 (15 mL, colorazione gialla) nel flacone dell’HIV Coniugato 1 (liofilizzato, colorazione blu). Agitare delicatamente per disciogliere completamente il liofilizzato. La soluzione dell’HIV Coniugato 1 assume una colorazione verde. Prima dell’uso lasciar riposare la soluzione di HIV Coniugato 1 per almeno 15 min. Conservazione e validità Prima dell’apertura, tutte le componenti della confezione Enzygnost® HIV Integrale possono essere utilizzate fino alla data di scadenza indicata in etichetta, purchè conservate a +2/+8 °C. La conservazione e la validità dei reagenti aperti, sono riportate in appendice nella Tabella 1. Strumentazione necessaria: BEP® II: Per la dispensazione automatica dei reagenti e della soluzione di lavaggio BEP® III: Per l'esecuzione automatica e valutazione del test, dopo la distribuzione dei campioni BEP® 2000: Per l'esecuzione completamente automatica del test e la valutazione dei risultati Pipette: Pipette automatiche da 25, 100 e 1000 µL Sistema di incubazione: bagnomaria coperto (+37 ± 1 °C) o analoghi metodi di incubazione Tutta la strumentazione usata nel test deve essere validata. Campioni Si impiegano come campioni in esame quelli singoli (siero umano o plasma citratato/eparinizzato/ EDTA) ottenuti da tecniche standard di laboratorio. I campioni devono essere conservati a + 2/+ 8°C per non più di 3 giorni. Se i campioni devono essere conservati per un lungo periodo di tempo, devono essere congelati. OQTO G11 C0541 (1584) H 31 Metodica Esecuzione del test con il BEP® II 1. Schema del test: definire il numero di pozzetti necessari (= numero dei campioni in esame più 5 pozzetti per i controlli). 2. Dispensazione del Tampone per i campioni : pipettare in ogni pozzetto 25 µL di Tampone per i campioni. 3. Dispensazione dei campioni: pipettare 100 µL di HIV Siero di controllo, negativo in ciascuno dei primi 3 pozzetti (da A1 a C1) e 100 µL di HIV Siero di controllo, positivo nel pozzetto D1; quindi pipettare 100 µL dei campioni indiluiti in ciascuno dei pozzetti successivi e infine, al termine della serie, dispensare 100 µL di HIV Siero di controllo, positivo nell’ultimo pozzetto. In alternativa, l’HIV Siero di controllo, positivo può essere dispensato in doppio all’inizio della serie. Schema di dispensazione: pipettare 100 µL di HIV Siero di controllo, negativo in ciascuno dei primi 3 pozzetti (da A1 a C1) e 100 µL di HIV Siero di controllo, positivo nei pozzetti D1 ed E1; quindi pipettare 100 µL dei campioni indiluiti in ciascuno dei pozzetti successivi. La dispensazione deve essere completata rapidamente, entro 30 minuti per piastra. 4. Incubazione dei campioni: coprire la piastra con un foglio adesivo ed incubare a + 37 ± 1°C per 30 ± 2 min. Subito dopo procedere all’ operazione di lavaggio. 5. Lavaggio: togliere il foglio adesivo ed aspirare il contenuto di tutti i pozzetti. Quindi lavare 4 volte con circa 0,3 mL di soluzione di lavaggio ogni volta. 6. Dispensazione della Soluzione HIV Coniugato 1: pipettare in ciascun pozzetto 100 µL della Soluzione HIV Coniugato 1; quindi coprire con un nuovo foglio adesivo e, subito dopo, porre la piastra nell’incubatore. 7. Incubazione dell’HIV Coniugato 1: incubare a + 37 ± 1°C per 30 ± 2 min. come descritto al punto 4. Subito dopo procedere all’ operazione di lavaggio. 8. Lavaggio: togliere il foglio adesivo e lavare 4 volte come descritto al punto 5. 9. Dispensazione dell’HIV Coniugato 2: pipettare in ciascun pozzetto 100 µL di Coniugato 2. Coprire con un nuovo foglio adesivo e, subito dopo, porre la piastra nell’incubatore. 10.Incubazione dell’HIV Coniugato 2: incubare a + 37 ± 1°C per 30 ± 2 min. come descritto al punto 4. Subito dopo procedere all’ operazione di lavaggio. 11. Lavaggio: togliere il foglio adesivo e lavare 4 volte come descritto al punto 5. 12.Dispensazione del substrato: pipettare in ogni pozzetto 75 µL di Soluzione d’uso di cromogeno. 13.Incubazione del substrato: coprire con un nuovo foglio adesivo e incubare a +15/ +25 °C per 30 ± 2 min. al riparo dalla luce. 14.Arresto della reazione: togliere il foglio adesivo, aggiungere 75 µL di Soluzione bloccante POD in ciascun pozzetto, osservando la stessa cadenza come al punto 12. 15.Lettura: leggere a 450 nm entro 1 ora. La lunghezza d’onda consigliata per il raggio di riferimento è di 650 nm (se necessario tra 615 e 690 nm). Esecuzione del test con il BEP® III Prima di utilizzare il BEP® III, preparare le piastre test ed eseguire le operazioni di dispensamento dei campioni (Paragrafo 1 e 2 in «Esecuzione del test con il BEP® II»). Subito dopo porre le piastre non coperte da foglio adesivo nel BEP® III. Attenzione: le piastre parzialmente riempite devono essere completate almeno a metà piastra (6 strip) aggiungendo «strip riempite con acqua». Il test viene quindi eseguito in modo completamente automatico (v. Manuale d’uso BEP® III). Le impostazioni per i periodi di incubazione nel software del BEP® III possono differire dai periodi del BEP® II per motivi tecnici (velocità del sistema), ma sono state validate per i metodi Enzygnost® sul BEP® III. Esecuzione del test con il BEP® 2000 Le fasi di dispensazione del campione e la successiva esecuzione del test sono eseguite in maniera completamente automatica dallo strumento (v. manuale d’uso del BEP® 2000). OQTO G11 C0541 (1584) H 32 Validità del test I singoli valori di estinzione dei sieri di controllo vengono utilizzati per calcolare le estinzioni medie quando: -0,010 ≤ Eneg. ≤ 0,150 Epos. ≥ 0,700 Se uno dei valori di estinzione del siero di controllo negativo è fuori dall’ambito, questo valore può essere trascurato. Entrambi i valori di estinzione del siero di controllo positivo devono essere conformi alle specifiche. Se ciò non avviene, il test deve essere ripetuto. Valutazione del test Sul BEP® 2000 e sul BEP® III il calcolo dei risultati viene eseguito automaticamente. Per maggiori informazione consultare il manuale d'uso. I seguenti capitoli permettono la valutazione dei risultati senza l'ausilio del software. Calcolare il valore medio di estinzione dei sieri di controllo negativi, quindi calcolare il valore soglia aggiungendo 0,450: – Valore soglia (cut off) = E neg. + 0,450 La zona di dubbio viene così definita: Cutoff - Cutoff -0,05 Secondo i criteri del test, i campioni in esame vengono così classificati: Risultato del test: 1. 2. 3. Ecampione < cut off - 0,05 = «negativo» Ecampione > cut off = «reattivo» cut off - 0,05 ≤ Ecampione ≤ cut off = «dubbio» I campioni per i quali risultano valori d’estinzione entro la zona di dubbio o superiori alla stessa, devono essere sottoposti ad un nuovo test in doppio. Se nella ripetizione del test, per i campioni con valori di estinzione inizialmente reattivi, entrambi i valori di estinzione risultano inferiori alla zona di dubbio, i campioni sono da considerarsi negativi, secondo i criteri del test. Se uno dei due valori di estinzione risulta nuovamente entro la zona di dubbio o più alto, il campione è classificato ripetutamente reattivo. Tutti i campioni ripetutamente reattivi dovrebbero, in ogni caso, essere sottoposti a test di conferma (ad es. Immunoblot, analisi dell'acido nucleico). Per maggior sicurezza si dovrebbe analizzare un campione in follow-up (dopo circa 2 settimane). Limitazioni ed interferenze 1.Gli anticoagulanti come eparina, EDTA e citrato non influenzano il risultato del test. 2.I campioni emolitici o itterici non interferiscono con il test. 3.I campioni contenenti fattori potenzialmente interferenti ANA, anticorpi anti-E. Coli e antiEBV, e i sieri di donne in gravidanza sono stati esaminati nel test. I campioni utilizzati non hanno interferito sui risultati. 4.Non si sono avute interferenze con campioni sottoposti a trattamenti con il calore (30 min., 56°C). 5.I campioni non completamente coagulati o contaminati da microbi non dovrebbere essere utilizzati. Eventuali particelle (ad es. grumi di fibrina, eritrociti) presenti nel campione dovrebbero essere rimosse prima del test. 6.I campioni lipemici, contenenti fattori reumatoidi ed AMA, e i campioni con anticorpi anti-HAV possono portare ad un’attività più elevata. 7.L'Enzygnost® HIV Integrale e un test per la determinazione simultanea dell'antigene HIV p24 e degli anticorpi anti-HIV e non deve essere impiegato per la determinazione del solo antigene HIV p24. OQTO G11 C0541 (1584) H 33 8.Se vengono utilizzati campioni scongelati, assicurarsi che essi siano omogenei. 9.E' necessario utilizzare solo reagenti appartenenti tutti ad uno stesso lotto (ad esclusione della soluzione di lavaggio POD, la Soluzione bloccante POD e la Soluzione d'uso del cromogeno preparata con i reagenti Cromogeno TMB e Tampone/Substrato TMB appartenenti tutti allo stesso lotto). La combinazione ammessa dei numeri di lotto a 6 cifre (Lot. nr.) e quella stampata sulla confezione ed anche riportata nell'allegata tabella dei codici a barre. 10.Il Tampone/substrato TMB, la Soluzione d’uso di cromogeno e la Soluzione bloccante POD non devono venire a contatto con ioni di metalli pesanti o con sostanze ossidanti (non utilizzare pipette con parti metalliche che sono a diretto contatto con il liquido). Non eseguire la reazione del substrato in prossimità di disinfettanti contenenti ipoclorito. Se la Soluzione d’uso del cromogeno sviluppa spontaneamente una colorazione blu prima di essere trasferita nella piastra test, ciò indica che la soluzione è contaminata; in tal caso, preparare una soluzione fresca in un flacone ben pulito. Evitare il contatto della cute con le suddette soluzioni. 11. Durante la fase di incubazione, la piastra test deve essere protetta dalle vibrazioni (ad es. porla in bagnomaria senza circolazione d’acqua o su un supporto fisso); i pozzetti devono essere a contatto con l’acqua termostatata. Se si utilizzano dei conservanti per prevenire contaminazioni microbiche dell’acqua, fare in modo che nè la superficie della piastra nè i pozzetti vengano a contatto con la soluzione poichè un’eventuale contaminazione potrebbe causare reazioni aspecifiche. 12.Durante la fase di arresto della reazione, in presenza di campioni fortemente reattivi, il colorante può precipitare.Ciò non interferisce con la valutazione fotometrica. 13.Il siero di controllo è stato ottenuto da siero umano nativo. Possono manifestarsi intorbidamenti, che però non interferiscono sui risultati del test. 14.Prima del test, non esporre a lungo la piastra alla luce del sole. Caratteristiche del test Sensibilità e specificità I risultati delle ricerche sulla sensibilità e sulla specificità sono riportati nelle Tabelle 2 e 3 (vedi Appendice). La sensibilità del test è stata determinata sui seguenti campioni positivi: 515 AntiHIV 1, 164 Anti-HIV 2, 26 Anti-HIV 1 (sottotipo O) e 64 Antigene HIV. Tutti i campioni esaminati sono risultati positivi secondo i criteri dell’Enzygnost® HIV Integrale. La reattività del test, rispetto ai campioni di sieroconversione, è stata determinata su 34 panel di sieroconversione. E' risultato che l'Enzygnost® HIV Integrale presenta una maggiore sensibilita nei riguardi dell'identificazione delle sieroconversioni contro i test per la determinazione dei soli anticorpi anti-HIV. Tuttavia non si può escludere che qualche campione possa sfuggire ad un corretto risultato quando il test viene utilizzato su larga scala. Nel test con il pannello SFTS (1996), il campione con un valore dichiarato di 250 pg di antigene HIV/ml (no. 2024), è risultato positivo in maniera riproducibile. Analizzando le diluizioni del pannello SFTS con un valore dichiarato di 100 pg e di 250 pg di antigene HIV/ml, è stata calcolata una sensibilità analitica compresa tra 100 e 250 pg di antigene HIV/ml. La specificità del test, determinata su un totale di 8851 campioni di sieri HIV negativi, è risultata del 99,3 - 99,95% (test iniziale) e del 99,7 - 100% (dopo ripetizione del test). Sono possibili scostamenti dai valori indicati a seconda della collettività presa in esame, della procedura del test, ecc. Secondo lo stato attuale delle conoscenze, un risultato positivo non costituisce una prova sicura che nel sangue sia presente l’HIV 1 o l’HIV 2; come pure un risultato negativo non può escludere con assoluta certezza la presenza di HIV 1 e HIV 2. Riproducibilità I risultati delle riproducibilità intra-serie e inter-serie sono riportati nella Tabella 4 (vedi Appendice) I dati indicati sono risultati tipici. Sono possibili interferenze dovute alle modalità di esecuzione del test e ad altri fattori. Enzygnost e BEP sono marchi registrati della Dade Behring Marburg GmbH negli USA, Germania e altri paesi. *Sapogenat é un marchio della Clariant. Triton 100 X é un marchio della Merck. Dade Behring Marburg GmbH Emil-von-Behring-Str. 76 D-35041 Marburg www.dadebehring.com OQTO G11 C0541 (1584) H 34 0197 Tabella 1 Conservazione e validità Materiali/Reagenti Condizioni Conservazione Stabilità* Enzygnost® HIV Integrale (piastra test) dopo apertura +2/+8 °C nel sacchetto con l'essiccante 4 settimane HIV Coniugato 1 dopo ricostituzione +2/+8 °C +15/+25 °C 4 settimane 2 giorni HIV Coniugato 2 dopo apertura +2/+8 °C +15/+25 °C 4 settimane 2 giorni HIV Tampone del campione dopo apertura +2/+8 °C 4 settimane HIV Controllo, positivo dopo apertura +2/+8 °C -20 °C 4 settimane 3 mesi HIV Controllo, negativo dopo apertura +2/+8 °C -20 °C 4 settimane 3 mesi Cromogen TMB dopo apertura +2/+8 °C data di scaden. Tampone/substrato TMB dopo apertura +2/+8 °C data di scaden. Soluzione d'uso di cromogeno diluita 1 + 10 +2/+8 °C +15/+25 °C ben chiuso ed al riparo dalla luce 5 giorni 8 ore Soluzione di lavaggio POD (concentrata) dopo apertura diluita 1:20 diluita 1:20 +2/+8 °C +2/+8 °C +18/+25 °C data di scaden. 1 settimana 1 giorno Soluzione bloccante POD dopo apertura +2/+8 °C data di scaden. * Utilizzare ciascuna componente non oltre la data di scadenza OQTO G11 C0541 (1584) H 35 Tabella 2 Sensibilità La ricerche sulla sensibilità hanno fornito i seguenti dati: Popolazione dei campioni Numero dei camp. Inizialmente reattivi 515 164 26 64 515 164 26 64* 34 pannelli HIV Maggiore sensibilità rispetto ai test per la determin. degli anticorpi anti-HIV Anti-HIV 1 pos. Anti-HIV 2 pos. Anti-HIV 1 (sottotipo O) pos. Antigene HIV pos. Pannelli sieroconversione * Con i campioni di sieroconversione precoce, il test antigene HIV p24 presenta una migliore sensibilita per l'identificazione dell'antigene HIV. Tabella 3 Specificità La ricerche sulla specificità hanno fornito i seguenti dati: Popolaz. dei camp. Numero dei camp. Inizialmente reattivi Reattivi dopo ripetizione Sieri negativi (A) Sieri negativi (B) Sieri negativi (C) Plasmi negativi (D) 4002 2135 2370 344 9 1 17 1 8 0 7 1 Tabella 4 Riproducibilità Nelle ricerche di riproducibilità intra-serie, i campioni sono stati analizzati 8 volte in ciascuno dei 5 giorni. I coefficienti di variazione (CV) sono stati calcolati utilizzando il modello con il componente della varianza. Enzygnost® HIV Integrale Campione P1 P2 P3 P4 Valore medio d'estinzione % CV 0,817 1,781 1,202 0,519 4,4 5,7 4,4 3,8 Nelle ricerche di riproducibilità inter-serie, i campioni sono stati analizzati 8 volte in ciascuno dei 5 giorni. I coefficienti di variazione (CV) sono stati calcolati utilizzando il modello con il componente della varianza. Enzygnost® HIV Integrale Campione P1 P2 P3 P4 OQTO G11 C0541 (1584) H 36 Valore medio d'estinzione % CV 0,817 1,781 1,202 0,519 12 5,9 2,3 4,1 Tabella 5 Esecuzione del test e programma delle operazioni Enzygnost® HIV Integrale Programmazione del Esecuzione del test (BEP® II, BEP® III, BEP® 2000) Preparazione dei reagenti Menu per il BEP® 2000 BEP® II MENU NO OPERATE 1 YES Dispensazione Tampone per campioni 3 x 100 µL HIV Siero di controllo, negativo WASHINGS 0 1 x 100 µL HIVSiero di controllo, positivo ASPIRATE NO 100 µL Campione indiluito ciascuno SOAKTIME 0 1 x 100 µL HIVSiero di controllo, positivo DISP VOL 25 CHANNEL NO 3 BEP® II BEP® III PHOT NO OPERATE 2 YES 30 min ± 2 min in caso di piastra incompleta Lavaggio e dispensazione Coniugato 1 WASHINGS 4 (37 ± 1 °C) aggiungere strips riempite ASPIRATE NO acqua (almeno metà piastra) SOAKTIME 0 DISP VOL 100 4 lavaggi: ® CHANNEL NO 1 BEP II PHOT NO 100 µL HIV Soluzione del coniugato 1 OPERATE 3 YES Lavaggio e dispensazione Coniugato 2 30 min ± 2 min WASHINGS 4 (37 ± 1 °C) ASPIRATE NO SOAKTIME 0 Procedura DISP VOL 100 automatica 4 lavaggi: CHANNEL NO 2 BEP® II PHOT NO OPERATE 4 YES 100 µL HIV Coniugato 2 Lavaggio e dispensazione Cromogeno WASHINGS 4 ASPIRATE NO 30 min ± 2 min SOAKTIME 0 (37 ± 1 °C) DISP VOL 75 CHANNEL NO 4 PHOT NO 4 lavaggi: OPERATE 5 YES BEP® II Dispensazione Soluzione Bloccante WASHINGS 0 75 µL Soluzione d'uso ASPIRATE NO SOAKTIME 0 di cromogeno DISP VOL 75 CHANNEL NO 5 30 min ± 2 min PHOT YES MEAS WL 450 (+15/+25 °C, al riparo dalla luce REF WL 650 BLK COR NO EVAL MODE 1 75 µL Soluzione bloccante GEN CUT NO NEG CONT 3 dopo max. 1 h MAX NEG 0.150 MIN NEG FACT NEG Lettura a 450 nm MAX POS (Lungh. d'onda rif.: 650 nm) THRESH 0.450 CUT OFF Risultato del test Risultato del test 25 µL HIV Tampone per i campioni OQTO G11 C0541 (1584) H 37 Enzygnost® HIV Integral Campos de aplicación y objetivos Ensayo inmunoenzimático para el reconocimiento cualitativo de una infección por HIV, basado en la determinación del antígeno HIV-p24, de los anticuerpos contra los virus de la inmunodeficiencia humana de la clase 1 y 2 (HIV 1 y HIV 2), así como también, de los anticuerpos contra el virus HIV 1-subtipo O en suero y plasma. La realización del ensayo inmunológico se lleva a cabo en los ELISA Prozessores BEP® II, BEP® III y BEP® 2000. El test fue desarrollado para la investigación de muestras individuales y no para muestras en un pool o diluidas. El producto debe ser usado únicamente en diagnósticos in vitro. Significado diagnóstico El síndrome de inmunodeficiencia adquirida (SIDA) fue reconocido por primera vez en 1981 como una enfermedad con un cuadro clínico propio. Como causantes de esta enfermedad se conocen hoy dos virus de la inmunodeficiencia humana diferentes (HIV 1 y HIV 2). En 1983 fue posible aislar el HIV 1 (sinónimo: LAV/HTLV III)(1,2). En el año 1986 se logró aislar un nuevo virus (HIV 2), que también es válido como patógeno humano (3). La determinación serológica de los anticuerpos contra HIV tiene un valor muy importante, en especial, para la medicina de transfusiones desde el punto de vista preventivo, con el fin de evitar una mayor expansión de la enfermedad. Como consecuencia de esto empezó a partir de 1985 ha ser obligatorio el chequeo de anticuerpos anti-HVI 1 en sangre donada, tanto en los bancos de sangre como en los lugares de producción de productos del plasma. Informaciones aparecidas en este período, sobre la propagación de infecciones por HIV 2, crearon la necesidad de una investigación de rutina para las donaciones de sangre no sólo para anticuerpos anti-HIV 1 si no también para anti-HIV 2, y así de esta manera poder excluir un contagio potencial por medio de transfusiones o por preparados producidos a partir de sangre. En 1990 se describió un nuevo HIV al cual inicialmente se le dio muy poca relevancia serológica (4). Sólo en l994 dos grupos de trabajo, al mismo tiempo e independientemente el uno del otro, pudieron determinar la secuencia de este nuevo subtipo (5,6). Paralelamente con los trabajos virológicos pudieron otros grupos de trabajo demostrar el significado serológico del virus ahora denominado HIV 1- subtipo O (7,8). Después de esto se encontró que con la mayoría de los ensayos para anti-HIV 1+2 se tenían muchas dificultades para detectar el anti-subtipo O (9). Como consecuencia de esto se presentaba la necesidad de encontrar un método seguro para el reconocimiento simultáneo de esta nueva variante de HIV y de los ya establecidos HIV 1 y HIV 2. Para algunas seroconversiones de HIV se determinó el antígeno HIV-p24, antes de que se encontraran anticuerpos HIV. Para poder cerrar aun más la ventana diagnóstica entre una infección HIV y el primer reconocimiento serológico, fue necesario ampliar los test para anticuerpos con el reconocimiento del antígeno HIV-p24. Aunque el reconocimiento de anticuerpos específicos de HIV y/o antígenos no permite una declaración segura sobre si existen, en el momento del test, HIV 1 y HIV 2 infecciosos en la sangre, ni tampoco un valor negativo excluye la presencia de HIV 1 o HIV 2, el test combinado anticuerpos/antígeno ofrece por ahora la mayor posibilidad para reconocer y eliminar sangres donadas infectadas con HIV. Principio del método El Enzygnost® HIV Integral es un ensayo inmunoenzimático basado en la determinación simultánea del antígeno HIV y de los anticuerpos HIV. Las inmunoglobulinas específicas existentes en la muestra a investigar reaccionan, en una primera etapa, con las proteínas recombinantes/péptidos sintéticos HIV 1, HIV 2, y/o HIV 1 (subtipo O) fijados en los pocillos de la placa de microtitulación. De manera simultánea el antígeno HIV-p24 existente en la muestra a investigar puede unirse con el anticuerpo policlonal anti-HIV-p24 también fijo en la placa. Después de retirar las partes no enlazadas de la muestra, los anticuerpos enlazados específicamente se van a marcar, en una segunda etapa, por medio de conjugados de biotina de proteína recombinante/péptido sintético HIV 1, HIV 2, y/o HIV 1 (subtipo O)- (antígeno-sandwich). De forma simultánea se van a marcar los antígeno HIV enlazados mediante un conjugado de biotina anticuerpo monoclonal HIV-p24 (anticuerpo-sandwich). Después de retirar los conjugados de Biotina no enlazados, el conjugado 2 (estreptavidina/POD) reacciona, en una tercera etapa, con los conjugados de biotina unidos específicamente a la fase fija. OQTO G11 C0541 (1584) H 38 Edición Octubre 2003 Después de retirar el exceso de conjugado 2 se determina la actividad enzimática del conjugado (reacción cromática azul). La transformación enzimática del cromógeno se interrumpe por adición de la solución de detenimiento POD (reacción cromática amarilla). La intensidad del color es proporcional a la concentración en la muestra de antígeno HIV-p24 y de los anticuerpos HIV. Reactivos Contenido del envase comercial ® Enzygnost HIV Integral: Conjugado 1-HIV 1: Tampón para conjugado 1-HIV: Conjugado 2-HIV: Tampón para muestras-HIV: Control-HIV, positivo: Control-HIV, negativo: Etiqueta "Frasco vacío para Conjugado 1-HIV" Etiqueta "Frasco vacío para Conjugado 2-HIV" Boletín informativo Tabla de valores-Barcode Bolsa de PE 2 x 96 10 x 96 2 placas de prueba 2 x 1 frasco 2 x 15 ml 2 x 15 ml 2 x 15 ml 2 x 1,4 ml 2 x 2,0 ml 1 unidad 1 unidad 1 unidad 10 placas de prueba 10 x 1 frasco 10 x 15 ml 10 x 15 ml 4 x 15 ml 3 x 1,4 ml 3 x 2,0 ml 1 unidad 1 unidad 1 unidad 1 unidad 1 unidad Materiales adicionales necesarios para los kits 2 x 96 y 10 x 96: Reactivos suplementarios para Enzygnost® TMB (N° de pedido OUVP) Composición Enzygnost® HIV Integral placa de prueba Placa de microtitulación recubierta con una mezcla de proteínas recombinantes (E. Coli) y péptidos sintéticos de HIV 1 gp41, HIV 1 (subtipo O) gp41, HIV 2 gp 36, así como anticuerpos (conejo) policlonales contra HIV p24. Conjugado 1-HIV Liofilizado de proteína recombinante HIV (E. Coli)/péptidos sintéticos HIV 1, HIV 2, HIV 1 (subtipo O) y anticuerpos (ratón) monoclonales contra el HIV p24, conjugado con biotina; de coloración azul. Reconstitución con 15 ml de tampón para conjugado 1-HIV. Tampón para conjugado 1-HIV Solución tampón de Tris con Sapogenat* y caseína; de coloración amarilla. Agente de conservación: Fenol (máx. 1 g/l) Conjugado 2-HIV Tampón Tris con Sapogenat* y Estreptavidina, conjugada con peroxidasa (POD); de coloración roja. Agente de conservación: Fenol (máx. 1 g/l) Tampón para muestras HIV Solución tampón de fosfato con caseína y Triton X 100*; de coloración roja. Agente de conservación: Fenol (máx. 1 g/l) Control-HIV, positivo Suero humano con anticuerpos contra el antígeno HIV 1, tratado por calor, estabilizado. Valor normativo de extinción: > 0,7 Agente de conservación: Fenol (máx. 1 g/l) Control-HIV, negativo Suero humano sin antígeno HIV y sin anticuerpos contra los antígenos HIV 1, HIV 2, HIV 1 (subtipo O), estabilizado. Valor normativo de extinción: < 0,15 Agente de conservación: Fenol (máx. 1 g/l) Advertencias y medidas de seguridad 1. Sólo para ser utilizado en diagnósticos in-vitro. OQTO G11 C0541 (1584) H 39 2. Cada donación individual de sangre, destinada a la preparación de los sueros de control ha sido sometida a pruebas para detectar el HBsAg, anti-HCV, anti-HIV 1 y anti-HIV 2. Para la elaboración del suero de control negativo se van a utilizar únicamente sueros con resultados negativos. El suero de control positivo se somete a un tratamiento por calor (por lo menos 1 hora a + 56°C). Independientemente de esto, todas las muestras obtenidas a partir de sangre humana (p. ej. sueros de pacientes) y productos (p. ej. sueros de control) deben ser manipuladas con las precauciones necesarias, siguiendo las medidas de seguridad recomendadas en caso de riesgo biológico, puesto que nunca se puede excluir completamente la existencia de agentes patógenos (10). 3. Se aconseja utilizar guantes de seguridad durante el desarrollo del test. 4. Para eliminar el material infeccioso sólido se recomienda colocarlo en autoclave por lo menos durante 1 hora a +121 °C. Todas las soluciones aspiradas se deben recoger en dos recipientes conectados uno tras otro. Los recipientes deben contener un medio de desinfección, que sea apropiado para la inactivación de virus patógenos humanos. Se deben observar las concentraciones y los tiempos de acción dados por el fabricante. Preparación de reactivos Antes de iniciar el test calentar todos los reactivos y las muestras a investigar entre +15 y +25°C. No sacar la placa de prueba del empaque que la contiene. Retirar del marco los elementos no necesarios para la prueba y guardarlos para un uso posterior (ver Tabla 1). En el envase Enzygnost® HIV Integral 10 x 96 viene una etiqueta de barras codificada para el conjugado 1-HIV y para el conjugado 2-HIV. Para evitar el cambio de jeringa continuo en el BEP® III cuando se trabaja una serie grande de muestras, puede ser de gran utilidad, mezclar varias soluciones de conjugado en un frasco grande (p. ej., un frasco vacío sobrante de solución de uso de cromógeno)(ver Material adicional necesario), marcarlo con la etiqueta ”Frasco vacío para conjugado” y colocarlo en la rueda de reactivos. Para cada placa de prueba diluir 20 ml de la solución de lavado POD (Kit de reactivos suplementarios) con agua destilada o desionizada hasta obtener 400 ml. Por cada placa diluir 1 ml de cromógeno TMB con 10 ml de tampón/sustrato TMB (Kit de reactivos suplementarios) dentro del frasco de plástico que viene en el envase para este fin (solución lista de cromógeno), mantenerla cerrada y protegida de la luz. Lavar el frasco esmeradamente con agua destilada después de su uso. Por razones técnicas (sobrellenado) no está permitido verter el contenido del cromógeno TMB en el frasco de tampón/sustrato TMB. Solución de Conjugado 1-HIV: Verter el contenido total de un frasco de tampón para conjugado 1-HIV, (15 ml, de coloración amarilla) en un frasco de conjugado 1-HIV (liofilizado, de coloración azul). Disolver completamente el liofilizado mediante agitación suave. La solución de conjugado 1-HIV es de coloración verde. La solución de conjugado 1-HIV debe equilibrase por lo menos 15 min. antes de ser usada. Estabilidad y almacenaje Todos los componentes del envase combinado Enzygnost® HIV Integral aún cerrados, conservados a la temperatura entre +2 y +8°C, son utilizables hasta las fechas de vencimiento dadas en las etiquetas. La estabilidad y las condiciones de almacenamiento de los envases ya abiertos o de los reactivos ya diluidos listos para el uso se pueden tomar de la Tabla 1 del anexo. Equipo necesario: BEP® II: Para el desarollo automático de la dosificación de reactivos y de las etapas de lavado BEP® III: Para la realización completamente automática del test después de la distribución de las muestras, así como para la evaluación BEP® 2000: Para la realización y valoración completamente automática del test Pipetas: Pipetas a émbolo 25, 100 y 1000 µl Incubadora: Baño de agua cubierto (+37 ± 1 °C) u otros métodos de incubación similares Todos los instrumentos utilizados para el desarrollo del test deben estar validados. OQTO G11 C0541 (1584) H 40 Material a investigar Para la investigación se pueden utilizar muestras aisladas (sueros humanos o plasma con EDTA/heparina/citrato), las cuales hayan sido tomadas según las técnicas estándar de laboratorio. Las muestras se pueden almacenar máximo 3 días entre 2 y 8°C. Para tiempos más largos de almacenamiento las muestras se deben congelar. Método Procedimiento con el BEP® II 1.Esquema de distribución: Determinar el número necesario de pocillos de la placa (número de muestras a investigar más 5 pocillos para los controles). 2.Distribución del tampón para muestras: En cada uno de los pocillos colocar 25 µl de tampón para muestras. 3.Distribución de las muestras: Llenar 3 pocillos c/u con 100 µl de control-HIV, negativo (A1 hasta C1), 1 pocillo con 100 µl de control-HIV, positivo (D1); en los siguientes pocillos dosificar 100 µl de c/u de las muestras sin diluir. Al final de la serie o de la placa de pruebas pipetear de nuevo una vez más 100 µl del control-HIV, positivo. Como alternativa al esquema de distribución arriba mencionado está permitido, aplicar el control-HIV, positivo en una doble determinación al comienzo de la serie. Esquema de pipeteo: dosificar en 3 pocillos 100 µl de control-HIV, negativo por c/u (A1 hasta C1), en dos pocillos 100 µl de control-HIV, positivo por c/u (D1 y E1) y en los siguientes pocillos 100 µl de c/u de las muestras sin diluir. La etapa de pipeteo no debe durar más de 30 min. por placa de prueba. 4.Incubación de las muestras: cubrir la placa de pruebas con la lámina adhesiva e incubar durante 30 + 2 min. a + 37 + 1 °C. Lavar a continuación. 5.Lavado: Retirar la lámina adhesiva, aspirar el contenido de todos los pocillos y lavar 4 veces, cada vez, con aprox. 0,3 ml de la solución de lavado. 6.Distribución de la solución de conjugado 1-HIV: Colocar en cada pocillo 100 µl de la solución de conjugado 1-HIV, cubrir la placa con nueva lámina adhesiva e inmediatamente colocar en el incubador. 7.Incubación del conjugado 1-HIV: Incubar durante 30 + 2 min. a +37 + 1°C, como se describe en el punto 4 y lavar inmediatamente después. 8.Lavado: Retirar la lámina adhesiva y lavar 4 veces como está descrito en el punto 5. 9.Distribución del conjugado 2-HIV: Agregar en cada pocillo 100 µl del conjugado 2-HIV, cubrir la placa con nueva lámina adhesiva e inmediatamente colocar en el incubador. 10.Incubación del conjugado 2-HIV: Incubar durante 30 + 2 min. a +37 + 1°C, como se describe en el punto 4 y lavar inmediatamente después. 11.Lavado: Retirar la lámina adhesiva y lavar 4 veces como está descrito en el punto 5. 12.Distribución del sustrato: Añadir en cada pocillo 75 µl de la solución de uso del cromógeno. 13.Incubación del sustrato: Cubrir la placa con nueva lámina adhesiva e incubar durante 30 + 2 min. entre +15 y +25°C, protegido de la luz. 14.Reacción de detenimiento: Retirar la lámina adhesiva y agregar en cada pocillo 75 µl de solución de detenimiento POD; mantener el mismo ritmo que en el punto 12. 15.Medición: Realizar la medición en el fotómetro a 450 nm en el termino de una hora. Como longitud de onda de la medida de referencia se aconseja 650 nm (eventualmente entre 615 y 690 nm). Procedimiento con el BEP® III Para el desarrollo del test en el BEP® III, las placas de prueba se deben preparar hasta la distribución de las muestras (punto 1 y punto 2 del "Procedimiento con el BEP® II"). Directamente después de esto, colocar las placas de prueba abiertas, esto es, sin lámina adhesiva en el BEP® III. Aquí es importante observar que las placas de prueba que no estén llenas se deben completar con "elementos con agua" hasta por lo menos la mitad de la placa de prueba (6 elementos). Todas las etapas subsiguientes van a ser realizadas de forma completamente automática por el aparato (ver manual de funcionamiento del BEP® III). Los tiempos de incubación ajustados en el software del BEP® III pueden desviarse de los del procedimiento en el BEP® II debido a condiciones técnicas básicas (ritmo del aparato), están sin embargo validados en la combinación BEP® III/Enzygnost®. OQTO G11 C0541 (1584) H 41 Procedimiento con el BEP® 2000 La distribución de las muestras y la realización subsiguiente del test se efectúa de forma completamente automática por el aparato (ver manual de funcionamiento del BEP® 2000). Validez del test Cada uno de los valores de extinción de los sueros de control se va a usar en el cálculo del valor promedio, cuando: -0,010 ≤ Eneg. ≤ 0,150 Epos. ≥ 0,700 De los tres valores de extinción del control negativo, puede uno estar fuera de las especificaciones y éste se puede descartar. Los dos valores de extinción del control positivo deben cumplir las especificaciones anteriores. Si estas condiciones no se cumplen se debe repetir el test. Valoración del test Las valoraciones se efectúan automáticamente con el BEP® 2000 y el BEP® III. Para esto consultar los manuales de operaciones. Los siguientes capítulos son para tener en cuenta en el caso de evaluaciones sin la ayuda del software. De los valores de la extinción del control negativo se determina el valor promedio. Para calcular el valor límite se añade un valor de 0,450 al valor promedio de extinción del control negativo: – Valor límite (cut off) = Eneg. + 0,450 Como rango limítrofe se define: Valor límite hasta valor límite - 0,05 De acuerdo a los criterios del test, las muestras a investigar se clasifican de la siguiente manera: Resultados del test: 1. 2. 3. Emuestra < cut off - 0,05 = "negativo" Emuestra > cut off = "reactivo" cut off - 0,05 ≤ Emuestra ≤ cut off = "valor limítrofe" Muestras que tengan valores de extinción en el rango limítrofe o extinciones mayores se deben repetir en una doble determinación. Si después de la repetición del test para las mientras inicialmente reactivas los dos valores de extinción se encuentran por debajo del rango limítrofe, de acuerdo con los criterios del test, se deben tomar estas muestras como negativas. Para nuevos valores de extinción limítrofes o mayores para por lo menos uno de los dos valores obtenidos, se considera la prueba como positiva. Todos las muestras que reaccionan como reactivas después de la repetición deben ser necesariamente confirmadas con ayuda de los llamados test de confirmación (p. ej., Inmunoblot, Análisis de ácidos nucleicos). Como medida de seguridad se debe analizar una nueva muestra (aproximadamente 2 semanas después). Limitaciones y fuentes de error 1.Los anticoagulantes como heparina, EDTA y citrato no tienen influencia sobre los resultados del test. 2.Las muestras hemolíticas o ictéricas no influyen sobre el test. 3.Muestras con sustancias potencialmente perturbadoras como ANA, anticuerpos E.-Coli y EBV, así como, sueros de mujeres embarazadas fueron examinadas con el test. En las muestras utilizadas no se observó ninguna influencia en los resultados del test. 4.El tratamiento de las muestras con calor (30 min. a 56°C) no causa ninguna alteración. 5.Los sueros no completamente coagulados y las muestras a investigar que presenten contaminaciones microbiológicas no deben ser utilizadas. Si eventualmente existen partículas (p. ej., coagulo de fibrina, eritrocitos) estas deben ser retiradas antes de empezar el test. OQTO G11 C0541 (1584) H 42 6. Muestras lipémicas y muestras que contengan factor reumatoideo o AMA, así como, muestras con anticuerpos contra HAV pueden ocasionar un aumento de la reactividad. 7.Enzygnost® HIV Integral es un test para el reconocimiento simultáneo del antígeno HIV p24 y de los anticuerpos HIV y no debe ser usado para detectar únicamente el antígeno HIV p24. 8.En las muestras descongeladas debe observarse que haya una buena homogeneización del material. 9.Los reactivos (con excepción de la solución de lavado POD, la solución de detenimiento y la solución de uso del cromógeno, la cual ha sido preparada a partir de los reactivos dependientes del lote, cromógeno TMB y Tampón/sustrato TMB) sólo se pueden utilizar juntos si provienen del mismo lote, esto es, con el mismo número de 6 cifras (Nr. de Lote) que está impreso en el envase o que se puede tomar de la tabla de valores barcode incluida en éste. 10.El tampón/sustrato TMB, la solución de uso del cromógeno y la solución de detenimiento POD no deben entrar en contacto con iones de metales pesados ni con sustancias oxidantes (no usar pipetas con partes metálicas que puedan entrar en contacto directo con la solución). No efectuar la reacción del sustrato en la proximidad de desinfectantes que contengan hipoclorito. Una coloración azul espontánea en la solución de cromógeno de uso, antes de colocarla en la placa de prueba, indica una contaminación; en este caso, se deberá preparar una solución fresca en un recipiente limpio. Evite el contacto cutáneo con las soluciones arriba mencionadas. 11.Durante la incubación debe mantenerse la placa de ensayo quieta (p. ej. sobre un flotador fijo o en un baño de agua no circulante); los pocillos permanecen de esta manera en contacto con el agua. En el caso de usar medios de conservación en el agua, para evitar su contaminación, debe observarse cuidadosamente que ni la superficie de la placa de prueba ni los pocillos entren en contacto con estas soluciones, ya que una contaminación de este tipo puede ocasionar reacciones inespecíficas. 12.Para muestras con reactividad alta puede, durante la reacción de detenimiento, precipitarse el colorante. Esto no afecta el resultado de la valoración fotométrica. 13.Los sueros de control son fabricados a partir de sueros humanos nativos. Por esta razón puede aparecer turbidez, la cual no influye sobre los resultados del test. 14.Antes de empezar el test no exponer por mucho tiempo las placas de ensayo directamente a la luz del sol. Características del test Sensibilidad y especificidad Los resultados de la comprobación de la sensibilidad y la especificidad están resumidos en las Tablas 2 + 3 (en el anexo). Para determinar la sensibilidad se investigaron en total 515 muestras positivas de anti-HIV 1, 164 de anti-HIV 2, 26 de anti-HIV 1 (subtipo 0) y 64 de antígeno HIV. Todas las muestras positivas investigadas de antigeno-/anticuerpo HIV se encontraron, según los criterios del Enzygnost® HIV Integral, como positivas. La reactividad del test para muestras con seroconversión se investigó mediante 34 panel de seroconversión. Con esto se indica, que el Enzygnost® HIV Integral muestra una sensibilidad mejorada con relación al reconocimiento de las seroconverciones frente a otros test que solamente reconocen los anticuerpos HIV. Independientemente de esto no se puede excluir, que para un uso más amplio del test algunas muestras no se puedan comprobar. Cuando los paneles SFTS fueron estudiados (1996), se encontró que la muestra con un valor declarado de 250 pg de antígeno HIV/ml (N° 2024) era reproduciblemente positiva. Mediante el estudio de las etapas de dilución del panel STFS con valores declarados de 100 pg y de 250 pg de antígeno HIV/ml, se encontró una sensibilidad analítica entre 100 y 250 pg de antígeno HIV/ ml. Para determinar la especificidad se investigaron en total 8851 muestras de sangre con HIV negativo y se encontró una especificidad de 99,3 hasta 99,95% (ensayo inicial) o de 99,7 hasta 100% (repetición). Debido a la diferencia entre otras del colectivo a investigar y del desarrollo del test, es posible la obtención de valores discrepantes. Basados en el estado actual de los conocimientos, de un resultado positivo para el test de HIV OQTO G11 C0541 (1584) H 43 no se puede deducir con seguridad que en la sangre existan HIV 1 o HIV 2 infecciosos, así como tampoco un resultado negativo de ninguna manera excluye con seguridad la presencia de HIV 1 o HIV 2. Reproducibilidad Los resultados de los ensayos de reproducibilidad intra/inter-assay están resumidos en la Tabla 4 (en el anexo). En este caso se trata de un datos obtenidos de un ejemplo. Debido a la diferencias, entre otras, en el desarrollo del test es posible que aparezcan valores discrepantes. Enzygnost y BEP son marcas registradas de Dade Behring Marburg GmbH en USA, Alemania y en otros países. *Sapogenat es una marca de fábrica de Clariant. Triton X 100 es una marca de fábrica de Merck. Dade Behring Marburg GmbH Emil-von-Behring-Str. 76 D-35041 Marburg www.dadebehring.com . OQTO G11 C0541 (1584) H 44 0197 Tabla 1 Estabilidad y almacenaje Material/reactivos Estado Almacenamiento Enzygnost® HIV Integral (placa de prueba) abierto entre +2 y +8 °C 4 semanas en la bolsa con cápsulas deshidratantes Conjugado 1-HIV después de reconstituido entre +2 y +8 °C 4 semanas entre +15 y +25 °C 2 días Conjugado 2-HIV abierto entre +2 y +8 °C 4 semanas entre +15 y +25 °C 2 días Tampón para muestras HIV abierto entre +2 y +8 °C 4 semanas Control HIV, positivo abierto entre +2 y +8 °C -20 °C 4 semanas 3 meses Control HIV, negativo abierto entre +2 y +8 °C -20 °C 4 semanas 3 meses Cromógeno TMB abierto entre +2 y +8 °C fecha de caduc. Tampón/sustrato TMB abierto entre +2 y +8 °C fecha de caduc. Solución de uso del cromógeno diluida 1 + 10 entre +2 y +8 °C 5 días entre +15 y +25 °C 8 horas en recipiente cerr. protegido de la luz Soludión de lavado (concentrado) abierto diluida 1:20 diluida 1:20 entre +2 y +8 °C fecha de caduc. entre +2 y +8 °C 1 semana entre +18 y +25 °C 1 día Solución de parada abierto entre +2 y +8 °C * En ningún caso más allá de la fecha de caducidad OQTO G11 C0541 (1584) H 45 Estabilidad* fecha de caduc. Tabla 2 Sensibilidad En las investigaciones sobre la sensibilidad se encontraron los siguientes datos: Colectivo de muestras Número de muestras reactividad inicial 515 164 26 64 515 164 26 64* 34 HIV panels Sensibilidad mejorada frente a test para anticuerpos HIV Anti-HIV 1 positivo Anti-HIV 2 positivo Anti-HIV 1 (Sub. O) positivo Antígeno-HIV positivo Panels de seroconversión * Para muestras que presentaban antes seroconversión los test Antígeno HIV-p24 para la detección del antígeno HIV tienen una sensibilidad de comprobación mejor. Tabla 3 Especificidad En las investigaciones sobre la especificidad se encontraron los siguientes datos: Colect. de muestras Número de muestras Sueros neg. (A) Sueros neg. (B) Sueros neg. (C) Plasmas neg. (D) 4002 2135 2370 344 reactividad inicial reactividad repetida 9 1 17 1 8 0 7 1 Tabla 4 Reproducibilidad Para las investigaciones de la reproducibilidad intra-assay fueron chequeadas las muestras 5 días cada una en 8 determinaciones. El cálculo del coeficiente de variación (CV) se hizo según el modelo componentes de varianza. Enzygnost® HIV Integral Muestra P1 P2 P3 P4 valor promedio de extinción % CV 0,817 1,781 1,202 0,519 4,4 5,7 4,4 3,8 Para las investigaciones de la reproducibilidad inter-assay fueron chequeadas las muestras 5 días en 8 determinaciones. El cálculo del coeficiente de variación (CV) se hizo según el modelo componentes de varianza. Enzygnost® HIV Integral Muestra P1 P2 P3 P4 OQTO G11 C0541 (1584) H 46 valor promedio de extinción % CV 0,817 1,781 1,202 0,519 12 5,9 2,3 4,1 Tabla 5 Realización de la prueba y programación Enzygnost® HIV Integral Menú de Programación Procedimiento (BEP® II, BEP® III, BEP® 2000) Preparación de los reactivos para el BEP® 2000 BEP® II MENU NO OPERATE 1 YES Dosificación tampón para muestras 3 x 100 µl de control-HIV, negativo WASHINGS 0 1 x 100 µl de control-HIV, positivo ASPIRATE NO 100 µl de cada muestra sin diluir SOAKTIME 0 1 x 100 µl de control-HIV, positivo DISP VOL 25 CHANNEL NO 3 BEP® II BEP® III PHOT NO OPERATE 2 YES Lavado y dosificación del conjugado 1 30 min ± 2 min Completar las placas 4 (37 ± 1 °C) fraccionadas a medias placas WASHINGS ASPIRATE NO con "elementos con agua" SOAKTIME 0 4 x lavar: DISP VOL 100 ® BEP II CHANNEL NO 1 PHOT NO 100 µl de solución de conjugado 1-HIV OPERATE 3 YES Lavado y dosificación del conjugado 2 30 min ± 2 min WASHINGS 4 (37 ± 1 °C) ASPIRATE NO SOAKTIME 0 Procesamiento DISP VOL 100 automático 4 x lavar: CHANNEL NO 2 BEP® II PHOT NO OPERATE 4 YES 100 µl de solución de conjugado 2-HIV Lavado y dosificación del cromógeno WASHINGS 4 ASPIRATE NO 30 min ± 2 min SOAKTIME 0 (37 ± 1 °C) DISP VOL 75 CHANNEL NO 4 PHOT NO 4 x lavar: OPERATE 5 YES BEP® II Dosificación solución de parada WASHINGS 0 75 µl de solución ASPIRATE NO SOAKTIME 0 de uso del cromógeno DISP VOL 75 CHANNEL NO 5 30 min ± 2 min PHOT YES MEAS WL 450 (entre +15 y +25 °C, protegido de la luz) REF WL 650 BLK COR NO EVAL MODE 1 75 µl de sol. de parada GEN CUT NO NEG CONT 3 máximo 1 h después MAX NEG 0.150 MIN NEG Valoración a 450 nm FACT NEG MAX POS (longitud de onda de ref.: 650 nm) THRESH 0.450 CUT OFF Resultado de la prueba Resultado de la prueba 25 µl tampón para muestras HIV OQTO G11 C0541 (1584) H 47 Enzygnost® HIV Integral Utilização e aplicação O Enzygnost® HIV Integral é um ensaio imunoenzimático para detecção qualitativa de antigénio HIV p24, de anticorpos contra os vírus da imunodeficiência humana (HIV 1 e HIV 2) e de anticorpos contra o vírus HIV 1 - subtipo O, no soro e no plasma humano.O processamento do teste imunoenzimático faz-se com os processadores ELISA BEP® II, BEP® III e BEP® 2000. Este teste foi desenvolvido para o estudo de amostras individuais e não para «pool» ou amostras diluídas. O produto só pode ser utilizado para fins de diagnóstico in vitro. Significado diagnóstico A Síndrome de Deficiência Imunológica Adquirida (SIDA) foi reconhecida pela primeira vez em 1981 como enfermidade com um quadro clínico próprio. Hoje em dia reconhecem-se dois vírus diferentes da imunodeficiência humana (HIV 1 e HIV 2) como seus agentes patogénicos. Em 1983 foi possível isolar o HIV 1 (sinónimo: LAV/HTLV III) (1, 2). Em 1986 foi isolado um novo vírus (HIV 2), considerado também um vírus patogénico humano (3). A determinação serológica de anticorpos contra HIV é particularmente relevante para a medicina transfusional, sobretudo sob o aspecto preventivo, com vista a evitar a propagação da enfermidade. Consequentemente passou a ser obrigatório, a partir de 1985, sujeitar todas as colheitas de sangue, tanto em bancos de recolha de sangue como, nos fabricantes de produtos plasmáticos, a um teste de detecção de anticorpos contra HIV 1. Informações entretanto divulgadas sobre a propagação de infecções por HIV 2 tornaram necessário implementar também uma rotina de determinação de anticorpos contra HIV 2, a fim de excluir na medida do possível, qualquer perigo de transmissão através de transfusões ou de preparados fabricados a partir do sangue. Em 1990 foi descrito, na literatura da especialidade, um novo subtipo de HIV, classificado, de início, como serologicamente pouco relevante (4). Só em 1994 é que a sua sequência pôde ser definida, simultaneamente, mas independentemente, por dois grupos de trabalho (5, 6). Paralelamente aos trabalhos virológicos puderam outros grupos de trabalho evidenciar o significado serológico do vírus entretanto denominado HIV 1-subtipo O (7, 8). Verificou-se também que alguns testes anti-HIV 1 e anti-HIV 2 apresentavam certas deficiências na detecção de anticorpos do subtipo O (9). Urgia pois desenvolver um método capaz de reconhecer com segurança não só os tipos já isolados HIV 1 e HIV 2, mas também esta nova variante. Tendo-se constatado que, em algumas seroconversões de HIV, o antigéneo HIV p24 era detectado antes de se encontrarem anticorpos contra HIV, houve que alargar a capacidade de reconhecimento do teste ao antigéneo p24, melhorando, ao mesmo tempo, o leque de meios de diagnóstico entre infecção e detecção. Ainda que a identificação de anticorpos específicos contra HIV e/ou antigéneos de HIV não permita concluir com segurança que, no momento da colheita do sangue, existiam efectivamente nele vírus infecciosos HIV 1 ou HIV 2, e ainda que um resultado negativo tão pouco permita excluir com segurança a presença de tais vírus, o teste combinado de detecção de anticorpos e antigéneos continua sendo, ainda assim, o melhor meio ao nosso alcance para reconhecer e eliminar, com alto grau de probabilidade, colheitas de sangue infectadas pelo HIV. Princípio metodológico Enzygnost® HIV Integral é um ensaio imunoenzimático baseado na determinação simultânea de antigéneos e anticorpos HIV. Numa primeira etapa, as imunoglobulinas específicas do HIV presentes na amostra reagem com as proteínas recombinantes/péptidos sintéticos HIV 1, HIV 2 e/ou HIV 1 (subtipo O) fixados nas cuvetes da placa de microtitulação. Simultaneamente os antigéneos HIV p24 da amostra podem ligar-se com anticorpos contra o HIV p24 policlonais fixos na cuvete. Após remoção dos componentes da amostra não ligados, os anticorpos específicos ligados são marcados, numa segunda etapa, com proteínas recombinantes/péptidos sintéticos de HIV 1, HIV 2 e/ou HIV 1 (subtipo O) conjugados com biotina (sanduíche de antigéneos). Simultaneamente, os antigéneos HIV ligados são marcados com anticorpos monoclonais HIV p24 conjugados com biotina (sanduíche de anticorpos). Após remoção dos conjugados de biotina não ligados, o conjugado 2 (estreptavidina /POD) OQTO G11 C0541 (1584) H 48 Edição Outubro 2003 reage, numa terceira etapa, com os conjugados de biotina específicos ligados à fase sólida. Após remoção do excesso de conjugado 2, é medida a actividade enzimática ligada do conjugado (reacção cromática azul). A transformação enzimática do cromogéneo é interrompida por adição da solução de paragem POD (reacção cromática amarela). O aumento de intensidade da cor é proporcional ao aumento de concentração de antigéneos HIV p24 e de anticorpos contra HIV, presentes na amostra. Reagentes Conteúdo da embalagem Enzygnost® HIV Integral: Conjugado 1 HIV: Tampão Conjugado 1 HIV: Conjugado 2 HIV: Tampão Amostras HIV: Controlo HIV, positivo: Controlo HIV, negativo: Rótulo «Frasco vazio para Conjugado 1 HIV» Rótulo «Frasco vazio para Conjugado 2 HIV» Folheto Informativo Tabela de Código de Barras Bolsa de PE 2 x 96 10 x 96 2 placas de teste 2 x 1 frasco 2 x 15 ml 2 x 15 ml 2 x 15 ml 2 x 1,4 ml 2 x 2,0 ml 1 unidade 1 unidade 1 unidade 10 placas de teste 10 x 1 frasco 10 x 15 ml 10 x 15 ml 4 x 15 ml 3 x 1,4 ml 3 x 2,0 ml 1 unidade 1 unidade 1 unidade 1 unidade 1 unidade Outros materiais necessários para as embalagens com 2 x 96 e 10 x 96: Reagentes adicionais para Enzygnost® TMB (N.° de pedido OUVP) Composição Enzygnost® HIV Integral - Placa de teste Microplaca revestida com uma mistura de proteínas recombinantes (E. Coli) e péptidos sintéticos de HIV 1 gp41, HIV 1 (subtipo O) gp41 e HIV 2 gp36, assim como com anticorpos policlonais (coelho) contra HIV p24. Conjugado 1 HIV Liofilizado de proteínas recombinantes (E. Coli) e péptidos sintéticos de HIV 1, HIV 2 e HIV 1 (subtipo O) e de anticorpos monoclonais (rato) contra HIV p24, conjugado com biotina; coloração azul. Reconstituição com 15 ml de Tampão Conjugado 1 HIV. Tampão 1 Conjugado HIV Tampão Tris com sapogenato* e caseína; coloração amarela. Conservante: fenol (máx. 1 g/l). Conjugado 2 HIV Tampão Tris com sapogenato* e Estreptavidina, conjugada com peroxidase (POD); coloração vermelha. Conservante: fenol (máx. 1 g/l). Tampão Amostras HIV Tampão de fosfato com caseína e tritão X 100*; coloração vermelha. Conservante: fenol (máx. 1 g/l). Controlo HIV, positivo Soro humano tratado pelo calor, com anticorpos contra antigéneos HIV 1, estabilizado. Densidade óptica: > 0,7 Conservante: fenol (máx. 1 g/l). Controlo HIV, negativo Soro humano sem antigéneos e sem anticorpos contra HIV 1, HIV 2 e HIV 1 (subtipo O), estabilizado. Densidade óptica: < 0,15 Conservante: fenol (máx. 1 g/l). OQTO G11 C0541 (1584) H 49 Precauções e Advertências 1. Só para uso diagnóstico in vitro. 2. Cada colheita individual de sangue destinada à preparação de soros de controlo foi previamente examinada com vista à detecção de HBsAg, Anti-HCV, Anti-HIV 1 e Anti-HIV 2. Na preparação de soro de controlo negativo só se utilizam soros com resultado negativo. O soro de controlo positivo foi submetido a um tratamento por calor (pelo menos 1 hora a + 56ºC). Independentemente disto, todas as amostras obtidas a partir de sangue humano (por ex. soros de pacientes) e produtos (por ex. soros de controlo) devem ser manuseadas com as precauções necessárias, seguindo as medidas de segurança recomendadas em caso de risco biológico, uma vez que nunca se pode excluir inteiramente o risco de contaminação por agentes patogénicos (10). 3. Recomenda-se o uso de luvas para análise durante toda a realização do teste. 4. Para a eliminação dos materiais sólidos infecciosos, é recomendável fazer-se uma autoclavagem de 1 hora no mínimo, a + 121 ºC. Todas as soluções aspiradas deverão ser recolhidas em dois recipientes ligados em série. Os recipientes deverão conter um desinfectante apropriado para desactivar os vírus humanos patógenos. É necessário respeitar as concentrações e os tempos de reacção indicados pelo fabricante. Preparação dos reagentes Levar previamente todos os reagentes e amostras a uma temperatura entre +15ºC a +25ºC, mas sem tirar a placa de ensaio do seu recipiente. Retirar do suporte as tiras de teste não necessárias e guardá-las para posterior utilização (v. Tabela 1). A embalagem de Enzygnost® HIV Integral 10 x 96 é fornecida com um código de barras para cada um dos conjugados 1 e 2. Para evitar ter de mudar muitas vezes a seringa no BEP® III quando se procede a uma longa série de análises, pode ser útil verter várias soluções dos conjugados para um frasco maior (por ex. um frasco vazio, supranumerário e ainda não utilizado, destinado à solução de uso do cromogéneo, ver Outro material necessário), etiquetá-lo com o rótulo «Frasco vazio para conjugado» e colocá-lo na roda de reagentes. Por cada placa de ensaio, diluir 20 ml da Solução de Lavagem POD (kit Reagentes Complementares) com água destilada ou desionizada até obter 400 ml. Por cada placa de ensaio, diluir 1 ml de Cromogéneo TMB com 10 ml de tampão/substrato TMB (kit Reagentes Complementares) no frasco vazio fornecido com a embalagem (solução de uso do cromogéneo) e conservar fechado e protegido da luz. Depois da utilização, lavar bem o frasco com água destilada. Dada a capacidade dos frascos, não se pode verter o cromogéneo TMB para o frasco de tampão/substrato TMB. Solução Conjugado 1 HIV: Transferir todo o conteúdo de um frasco de Tampão Conjugado 1 HIV (15 ml, coloração amarela) para um frasco de Conjugado 1 HIV (liofilizado, coloração azul). Agitar suavemente para dissolver o material liofilizado completamente. A solução de conjugado 1 adquire então coloração verde. Antes de utilizar deixar equilibrar, durante pelo menos 15 min. Estabilidade e conservação Não abertos, e enquanto conservados entre +2 e +8 ºC, todos os componentes da embalagem combinada Enzygnost® HIV Integral podem ser utilizados até às datas indicadas nos rótulos. Estabilidade e condições de conservação dos reagentes depois de abertos, ver Tabela 1 em apêndice. Aparelhos necessários: BEP® II: para a execução automática da dosagem dos reagentes e das fases de lavagem BEP® III: processamento automático do ensaio e interpretação após dosagem das amostras BEP® 2000: para o processamento e interpretação do teste, de forma inteiramente automática Pipetas: pipetas com êmbolo 25, 100 e 1000 µl Incubador: banho-maria tapado (+37 ± 1 ºC) ou outros métodos de incubação comparáveis Todos os aparelhos utilizados no ensaio têm de estar validados. OQTO G11 C0541 (1584) H 50 Material a investigar Para a análise podem ser utilizadas amostras individuais (soros humanos e plasmas EDTA/ Heparina/Citrato), colhidos de acordo com as técnicas do laboratório. As amostras poderão ser conservadas durante de 3 dias, no máximo, entre +2 - +8 ºC. Se se pretender conservá-las durante um período de tempo superior, deverão ser congeladas. Método Procedimento do teste com BEP® II 1.Esquema do teste: determinar o número necessário de cuvetes (= número de amostras a testar + 5 cuvetes para controlos). 2.Distribuição do Tampão Amostras: 25 µl em cada cuvete. 3. Distribuição das amostras: 100 µl de Controlo HIV negativo em cada uma de 3 cuvetes (A1 a C1), 100 µl de Controlo HIV positivo em 1 cuvete (D1), 100 µl de amostra não diluída em cada uma das cuvetes seguintes e, no fim da série/placa, pipetar novamente 100 µl de Controlo HIV positivo. Como alternativa a este esquema de pipetagem, é permitido também pré-distribuir o Controlo HIV positivo em dupla determinação no início da série. Esquema de pipetagem: 100 µl de Controlo HIV negativo em cada um de 3 cuvetes (A1 a C1), 100 µl de Controlo HIV positivo em 2 cuvetes (D1 e E1) e 100 µl de amostra não diluída em cada um dos cuvetes seguintes. A pipetagem deve ser feita num período de 30 min para cada placa de teste. 4.Incubação das amostras: cobrir a placa com folha adesiva e deixar incubar 30 min +2 min a +37ºC +1ºC; imediatamente a seguir, proceder à lavagem. 5.Lavagem: retirar a folha adesiva, aspirar todos os cuvetes e lavar cada uma com aprox. 0,3 ml de solução de lavagem. 6.Distribuição de Solução de Conjugado 1 HIV: distribuir 100 µl de solução de conjugado 1 HIV em cada cuvete, cobrir com nova folha adesiva e colocar imediatamente na incubadora. 7.Incubação do Conjugado 1 HIV: 30 +2 min a +37ºC +1ºC como descrito em 4. Passar imediatamente à lavagem. 8.Lavagem: retirar a folha adesiva e proceder como descrito em 5. Lavar 4 vezes. 9.Distribuição do Conjugado 2 HIV: distribuir 100 µl de conjugado 2 HIV em cada cuvete, cobrir com nova folha adesiva e colocar imediatamente na incubadora. 10.Incubação do Conjugado 2 HIV: 30 +2 min a +37 +1ºC como descrito em 4. Passar imediatamente à lavagem. 11.Lavagem: retirar a folha adesiva e proceder como descrito em 5. Lavar 4 vezes. 12.Distribuição do substrato: 75 µl de solução de uso do cromogéneo em cada cuvete. 13.Incubação do substrato: cobrir com nova folha adesiva e deixar incubar 30 +2 min ao abrigo da luz entre +15 e +25ºC. 14.Reacção de paragem: retirar a folha adesiva. Juntar a cada cuvete 75 µl de solução de paragem POD, mantendo o mesmo ritmo que em 12. 15.Leitura: fazer uma leitura fotométrica no período de 1 hora, a 450 nm. Como comprimento de onda da medição de referência recomenda-se 650 nm (eventualmente entre 615 e 690 nm). Procedimento do teste com BEP® III No caso do processamento ser feito com BEP® III é necessário preparar as placas de ensaio incluindo a dosagem das amostras (ponto 1 e 2 da «Procedimento do teste com BEP® II»). Imediatamente a seguir, as placas de ensaio são colocadas no BEP® III abertas, ou seja, sem película colada. Ao mesmo tempo, é necessário prestar atenção a que as placas de ensaio parcialmente providas de «barras de água» sejam acrescentadas até ficarem, no mínimo, pelo meio ( 6 barras de água). O processamento subsequente do teste realiza-se automaticamente (vide instruções de serviço do BEP® III). Devido às condições técnicas básicas (ciclo dos aparelhos), os tempos de incubação ajustados no software do BEP® III podem divergir dos tempos do processamento com o BEP® II, mas foram validados na combinação BEP® III/Enzygnost®. Procedimento do teste com BEP® 2000 A dosagem das amostras e subsequente processamento do teste são efectuados de forma totalmente automática no aparelho (vide instruções de serviço do BEP® 2000). OQTO G11 C0541 (1584) H 51 Validação do teste As leituras individuais de absorção dos soros de controlo serão utilizados para cálculo dos valores médios, se: -0,010 ≤ Eneg. ≤ 0,150 Epos. ≥ 0,700 Onde E = média dos controlos Dos 3 valores de absorção do controlo negativo, apenas um pode mostrar-se um fora da especificação e ser negligenciado. Os valores de absorção do controlo positivo têm de corresponder ambos à especificação. Se estas especificações não estiverem preenchidas, é necessário repetir o teste. Avaliação As avaliações efectuam-se automaticamente com o BEP® 2000 e BEP® III. Para o efeito, consultar as instruções de serviço. Para uma interpretação sem a ajuda do software, é necessário prestar atenção aos seguintes capítulos. Calcular a média dos valores de absorção do controlo negativo. Para calcular o valor limite «cutoff», adicionar 0,450 ao valor médio de absorção do controlo negativo: – Valor límite (cut off) = Eneg. + 0,450 Como zona cinzenta define-se: valor limite ”cutoff” a valor limite ”cutoff” - 0,05 De acordo com os critérios do teste, as amostras serão classificadas do seguinte modo: Resultado: 1. Eamostra < cut off - 0,05 = «negativo» 2. Eamostra > cut off = «reactivo» 3. cut off - 0,05 ≤ Eamostra ≤ cut off = «duvidoso» Amostras cujos valores de absorção se encontrem compreendidos na zona cinzenta ou acima dela têm de ser novamente sujeitas a uma dupla determinação. Se, na repetição do teste, valores de absorção inicialmente classificados como reactivos se mostrarem, em ambas as determinações, inferiores à faixa de dúvida, a amostra será considerada, segundo os critérios do teste, como negativa. Se os valores de absorção se encontrarem compreendidos novamente na zona cinzenta ou acima dela em pelo menos uma das duas determinações, a amostra será classificada como repetidamente reactiva. Todas as amostras que acusem repetidamente valores reactivos têm que ser submetidas a um teste de confirmação (por ex. Immunoblot, Técnicas de aplificação de ácidos nucleícos). Para maior segurança, convém analisar uma nova amostra (colhida aprox. 2 semanas mais tarde). Limitações e fontes de erro 1.Anticoagulantes como heparina, EDTA e citrato não influenciam o resultado do teste. 2.Amostras hemolíticas ou ictéricas não prejudicam o teste. 3 Com o teste foram controladas amostras com substâncias potencialmente perturbadoras ANA, anticorpos contra o E-Coli, o EBV e soros de mulheres grávidas. Não se verificou qualquer influência sobre o resultado do teste com as amostras utilizadas. 4.Não foram observadas alterações em amostras sujeitas a tratamento térmico (30 min, 56 ºC). 5.Não empregar soros insuficientemente coagulados nem amostras contaminadas. Eventuais componentes particulados (por exp. coágulos de fibrina, eritrócitos) devem ser previamente removidos. 6.As amostras lipémicas, contendo factores reumatóides e AMA, assim como as amostras com anticorpos contra HAV podem provocar um aumento de reactividade. 7. Enzygnost® HIV Integral é um teste para determinação quantitativa simultânea do antigéneo HIV p24 e de anticorpos HIV e não deve ser utilizado para a detecção unicamente do antigéneo HIV p24. 8.Amostras descongeladas devem mostrar-se bem homogeneizadas. 9.Os reagentes (com excepção da solução de lavagem POD, da solução de paragem POD e da solução de uso de cromogéneo TMB em tampão, preparada esta última a partir dos reagentes específicos de cada lote Cromogénio TMB e Tampão/substrato TMB) só podem ser utilizados como constituintes de um mesmo lote, isto é, somente na combinação de 6 cifras (N.° de lote) que vem impressa na embalagem e indicada na Tabela de código de barras adjunta. OQTO G11 C0541 (1584) H 52 10.O tampão/substrato TMB, a solução de uso de cromogéneo TMB em tampão e a solução de paragem POD não devem entrar em contacto com iões de metais pesados nem com substâncias oxidantes (não usar pipetas com partes metálicas portadoras de líquido). Não efectuar a reacção do substrato na proximidade de desinfectantes que contenham hipoclorito. Uma coloração azul espontânea da solução de uso do cromogéneo antes de esta ser colocada na placa de ensaio é indício de contaminação; deverá então preparar-se uma solução fresca num recipiente limpo. Evite-se o contacto cutâneo com as soluções acima mencionadas. 11.Durante a incubação deve manter-se a placa de ensaio imóvel (exp. sobre um suporte fixo ou num banho-maria sem circulação de água); deste modo as cavidades mantêm-se em contacto com a água temperada. Caso se utilizem estabilizadores para evitar uma contaminação da água, tomar todo o cuidado para que nem a superfície da placa de ensaio nem os recipientes entrem em contacto com estas soluções, pois tais contaminações podem produzir reacções inespecíficas. 12.Em amostras altamente reactivas o corante pode precipitar ao adicionar-se a solução de interrupção. O facto é irrelevante para os resultados fotométricos. 13.Os soros de controlo são preparados utilizando soros humanos congénitos. Por essa razão, podem ocorrer turvações que, todavia, não influenciam o resultado do teste. 14.Antes do início do teste, não expor a placa de teste à luz solar directa, durante um período de tempo prolongado. Características do teste Sensibilidade e especificidade Os resultados dos exames de sensibilidade e especificidade encontram-se resumidos nas tabelas 2 + 3 (em apêndice). Para averiguar a sensibilidade foram investigadas 515 amostras positivas anti-HIV 1, 164 amostras positivas anti-HIV 2, 26 amostras positivas anti-HIV 1 (subtipo O) e 64 amostras positivas de antigéneo HIV. Todas as amostras positivas de antigéneo/anticorpo HIV sujeitas a teste foram reconhecidas como positivas segundo os critérios do teste Enzygnost® HIV Integral. A reactividade relativamente a amostras em seroconversão foi testada em 34 painéis de seroconversão. Enzygnost® HIV Integral tem uma sensibilidade mais apurada para a identificação de seroconversões do que os testes que são só testes de anticorpos HIV. Não é de excluir todavia que, numa larga aplicação do teste, algumas amostras se subtraiam à determinação. No teste do painel SFTS (1996) a amostra de antigene HIV declarada com 250 pg/ml (n.º 2024) foi achada com reprodutibilidade positiva. Com o teste dos níveis de diluição do painel SFTS do antigene HIV declarados com 100 pg e 250 pg/ml, foi determinada uma sensibilidade analítica de antigene HIV entre 100 e 250 pg/ml. Para a determinação da especificidade foram testadas 8851 amostras sanguíneas HIV-negativas, tendo sido revelada uma especificidade de 99,3% a 99,95% (teste inicial) e de 99,7% a 100% (repetição do teste). Estes valores podem variar em função da população sujeita ao teste, do modo de execução do teste ou de outros factores. No estado actual de conhecimentos, não se pode concluir que um resultado positivo do teste HIV indique a presença de HIV 1 ou HIV 2, no sangue, nem tão pouco um resultado negativo permite excluir a sua presença. Reprodutibilidade Os resultados para a reprodutibilidade em intra/inter-série (intra/inter-assay), estão resumidos na Tabela 4 (em apêndice). Estes dados devem ser compreendidos somente a título de exemplo. Eles podem variar em função da modalidade de execução do teste ou de outros factores. Enzygnost e BEP são marcas registadas da Dade Behring Marburg GmbH nos EUA, na Alemanha e noutros países. *Sapogenato é uma marca da Clariant. Tritão X 100 é uma marca da Merck. Dade Behring Marburg GmbH Emil-von-Behring-Str. 76 D-35041 Marburg www.dadebehring.com OQTO G11 C0541 (1584) H 53 0197 Tab. 1 Estabilidade e condições de conservação Material/Reagente Estado Armazenagem Estabilidade* Enzygnost® HIV Integral (Placa de ensaio) aberto +2 a +8 ºC na bolsa com cápsulas desidratantes 4 semanas Conjugado 1 HIV aberto reconstituído +2 a +8 ºC +15 a +25 ºC 4 semanas 2 dias Conjugado 2 HIV aberto +2 a +8 ºC +15 a +25 ºC 4 semanas 2 dias Tampão Amostras HIV aberto +2 a +8 ºC 4 semanas Controlo HIV, positivo aberto +2 a +8 ºC -20 ºC 4 semanas 3 meses Controlo HIV, negativo aberto +2 a +8 ºC -20 ºC 4 semanas 3 meses Cromógeno TMB aberto +2 a +8 ºC até data exp. Tampão/substrato TMB aberto +2 a +8 ºC até data exp. Solução de uso do cromogéneo diluída 1 + 10 +2 a +8 ºC 5 dias +15 a +25 ºC 8 horas recipiente fechado, ao abrigo da luz Solução de lavagem (concentrado) aberta diluída 1:20 diluída 1:20 +2 a +8 ºC +2 a +8 ºC +18 a +25 ºC até data exp. 1 semana 1 dia Solução de paragem aberta +2 a +8 ºC até data exp. * Nunca depois da data de expiração OQTO G11 C0541 (1584) H 54 Tabla 2 Sensibilidade Resultados do exame da sensibilidade: Amostras da população testada Número de amostras Anti-HIV 1 positivo Anti-HIV 2 positivo Anti-HIV 1 (subtipo O) positivo Antígeneo HIV positivo Painel de seroconversão * Inicialmente reactivo 515 164 26 64 515 164 26 64* 34 Painéis HIV Sensibilidade melhorada relativamente a testes de anticorpos HIV Em amostras precoces de conversão de soro, os testes do antigéneo HIV-p24 para a detecção do antigéneo contra o HIV, possuem uma maior sensibilidade de detecção. Tabla 3 Especifícidade Resultados do exame da especificidade: Amostras da pop. test. Número de amostras Inicialmente reactivo Sera neg. (A) Sera neg. (B) Sera neg. (C) Plasmas neg. (D) 4002 2135 2370 344 Repetição activa 9 1 17 1 8 0 7 1 Tabla 4 Reprodutibilidade Resultados do exame da reprodutibilidade intra-série realizado em 5 dias com 8 determinações por dia. Cálculo do coeficiente de variação (CV) segundo o modelo dos componentes de variação: Enzygnost® HIV Integral Amostra P1 P2 P3 P4 Absorção média % CV 0,817 1,781 1,202 0,519 4,4 5,7 4,4 3,8 Resultados do exame da reprodutibilidade inter-série realizado em 5 dias com 8 determinações por dia. Cálculo do coeficiente de variação (CV) segundo o modelo dos componentes de variação. Enzygnost® HIV Integral Amostra P1 P2 P3 P4 OQTO G11 C0541 (1584) H 55 Absorção média % CV 0,817 1,781 1,202 0,519 12 5,9 2,3 4,1 Tabla 5 Procedimento e programação Enzygnost® HIV Integral Realização (BEP® II, BEP® III, BEP® 2000) Preparação dos reagentes Programação do Menu para o BEP® 2000 BEP® II MENU NO OPERATE 1 YES Dosagem do tampão amostra 3 x 100 µl de Controlo HIV, negativo WASHINGS 0 1 x 100 µl de Controlo HIV, positivo ASPIRATE NO 100 µl de cada amostra não diluída SOAKTIME 0 1 x 100 µl de Controlo HIV, positivo DISP VOL 25 CHANNEL NO 3 BEP® II BEP® III PHOT NO OPERATE 2 YES Lavagem e dosagem do conjugado 1 30 min ± 2 min placas incompletas: completar WASHINGS 4 até meia placa com (37 ± 1 ºC) ASPIRATE NO tiras cheias de água SOAKTIME 0 DISP VOL 100 BEP® II: CHANNEL NO 1 lavar 4x PHOT NO OPERATE 3 YES 100 µl de Solução de Conjugado 1 HIV Lavagem e dosagem do conjugado 2 30 min ± 2 min WASHINGS 4 (37 ± 1 ºC) ASPIRATE NO SOAKTIME 0 Processamento DISP VOL 100 automático BEP® II: CHANNEL NO 2 lavar 4 x PHOT NO OPERATE 4 YES 100 µl de Conjugado 2 HIV Lavagem e dosagem do cromógeno WASHINGS 4 ASPIRATE NO 30 min ± 2 min SOAKTIME 0 (37 ± 1 ºC) DISP VOL 75 CHANNEL NO 4 PHOT NO ® BEP II: OPERATE 5 YES lavar 4 x Dosagem da solução de bloqueio WASHINGS 0 75 µl de solução ASPIRATE NO SOAKTIME 0 de uso do cromogéneo DISP VOL 75 CHANNEL NO 5 PHOT YES 30 min ± 2 min MEAS WL 450 (+15 a +25 ºC, ao abrigo da luz) REF WL 650 BLK COR NO EVAL MODE 1 75 µl de sol. de paragem GEN CUT NO NEG CONT 3 após máx. 1 hora MAX NEG 0.150 MIN NEG FACT NEG Leitura a 450 nm MAX POS (comp. de onda de ref.: 650 nm) THRESH 0.450 CUT OFF Resultado do teste Resultado do teste 25 µl Tampão para amostras HIV OQTO G11 C0541 (1584) H 56 Bibliography/Literatur/Littérature/Bibliografía/Bibliografia 1. F. Barré-Sinoussi, J.C. Chermann, F. Rey, M.T. Nugeyre, S.Chamaret, J. Gruest et al. Isolation of a T-Lymphotropic Retrovirus from a Patient at Risk for Acquired Immunodeficiency Syndrome (AIDS). Science 1983; 220: 868 - 871 2. R. C. Gallo, S. Z. Salahuddin, M Popovic, G.M. Shearer, M. Kaplan, B.F. Haynes et al. Frequent Detection and Isolation of Cytopathic Retroviruses (HTLV-III) from Patients with AIDS and at Risk for AIDS. Science 1984; 224: 500 - 502 3. F. Clavel, D. Guetard, F. Brun-Vezinet, S. Chamaret, M.-A. Rey, M.O. Santos-Ferreira et al. Isolation of a New Human Retrovirus from West African Patients of AIDS. Science 1986; 233: 343 - 346 4. R. De Leys, B. Vanderborght, M. Vanden Haesevelde, L. Heyndrickx, A. van Geel, C. Wauters et al. Isolation and Partial Characterization of an Unusal Human Immunodeficiency Retrovirus from Two Persons of West-Central African Origin. J. Virol.1990; 64: 1207 - 1216 5. L. G. Gürtler, P.H. Hauser, J. Eberle, A. von Brunn, S. Knapp, L. Zekeng et al. A New Subtype of Human Immunodeficiency Virus Type 1 (MVP-5180) from Cameroon. J. Virol.1994; 68: 1581 - 1585 6. M. vanden Haesevelde, J.- L. Decourt, R.J. De Leys, B. Vanderborght, G van der Groen, H. van Heuverswijn et al. Genomic Cloning and Complete Sequence Analysis of a Highly Divergent African Human Immunodeficiency Virus Isolate. J. Virol.1994; 68: 1586 - 1596 7. P. Charneau, A.M. Borman, C. Quillent, D. Guétard, S. Chamaret, J. Cohen et al. Isolation and Envelope Sequence of a Highly Divergent HIV-1 Isolate: Definition of a new HIV1Group. Virology 1994; 205: 247 - 253 8. G. Myers, B. Korber, S. Wain-Hobson, R.F. Smith, G.N. Pavalakis. A Compilation and Analysis of Nucleic Acid and Amino Acid Sequences. Human Retroviruses and AIDS. Los Alamos: Los Alamos National Laboratory,1993 9. I. Loussert-Ajaka, T. D. Ly, M.L. Chaix, D. Ingrand, S. Saragosti, A.M. Couroucé et al. HIV-1/ HIV-2 Seronegativity in HIV-1 Subtype 0 Infected Patients. The Lancet 1994; 343: 1393 1394 10. U.S. Department of Health and Human Services CDC, Biosafety in Microbiological and Biomedical Laboratories, HHS Publication (CDC) 93-8395; 1999; Section II; 8-16 11. S. Brust, H. Duttmann, J. Feldner, L. Gurtler, R. Thorstensson, F. Simon. Shortening of the diagnostic window with a new combined HIV p24 antigen and anti-HIV-1/2/0 screening test. J Virol Methods. 2000 Nov; 90 (2): 153-65 12. S. Polywka, J. Feldner, H. Duttmann, R. Laufs. Related Articles, Links. Diagnostic evaluation of a new combined HIV p24 antigen and anti-HIV 1/2/0 screening assay. Clin Lab. 2001; 47 (7-8): 351-6 Symbols Key / Symbolschlüssel / Explication des Symboles / Interpretazione simboli / Clave de los Símbolos / Chave dos Símbolos Manufactured by / Hergestellt von / Fabriqué par / Prodotto da / Fabricado por IVD LOT EXP CCYY-MM-DD In Vitro Diagnostic Medical Device / In Vitro Diagnosticum / Dispositif Médical Diagnostic In Vitro / Dispositivo Medico per Diagnostica In Vitro / Producto sanitario para Diagnóstico In Vitro Lot Number / Chargenbezeichnung / Numéro de Lot / Numero di Lotto / Número de Lote Expiration Date / Verfalldatum / Date de Péremtion / data di scadenza / Fecha de vencimiento / termo da validade Storage Temperature / Lagertemperatur / Température de Conservation / Temperatura di conservazione / Temperatura de almacenamiento / Temperatura de armazenagem CE Mark / CE-Zeichen / Marquage CE / Marchio CE / CE Marca / Marca CE REF Catalogue Number / Katalog Nummer / Référence / Codice Catalogo / Número de Catálogo Consult Instructions for Use / Gebrauchsanweisung beachten / Consulter la Notice d'Utilisation / Istruzioni per l'uso / Consultar Instucciones para el Uso / Consulte as Instruções de Utilização OQTO G11 C0541 (1584) H 57