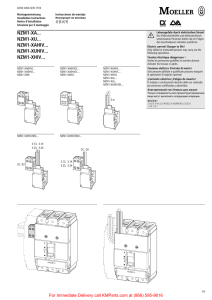
bioelisa bioelisa HIV-1+2 Ag/Ab
Anuncio

bioelisa READ HIGHLIGHTED CHANGES bioelisa HIV-1+2 Ag/Ab 3000-1172 1 x 96 TESTS 3000-1173 5 x 96 TESTS (480) ELISA test for the detection of antibodies to Human Immunodeficiency Viruses (HIV) type 1 (group M, O) or type 2 and HIV-p24 antigen in human serum or plasma samples in clinical laboratories and as a first-line screening assay in blood centers. Summary Serological evidence of infection with HIV may be obtained by testing for presence of HIV antigens or antibodies in serum or plasma of individuals suspected for HIV infection. Antigen can generally be detected during both acute phase and the symptomatic phase of AIDS. The antibodies to HIV-1 and/or HIV-2 can be detected throughout virtually the whole infection period, starting at or shortly after the acute phase and lasting till the end stage of AIDS. HIV fourth generation ELISA allows the simultaneous determination of HIV p24 antigens and HIV-1/HIV-2 antibodies reducing therefore the diagnostic window and allowing an early diagnosis of acute HIV infection. Apart from sexual transmission, the principal route of infection with HIV is blood transfusion. HIV can be present in both cellular and cell-free fractions of human blood. Therefore, all donations of blood or plasma should be tested due to the risk of HIV transmission through contaminated blood. This can be effectively achieved by testing for antibodies to HIV and p24 antigen by using a highly sensitive ELISA test. Principle bioelisa HIV-1+2 Ag/Ab is a fourth generation enzyme immunoassay for the simultaneous qualitative detection of HIV p24 antigen and antibodies to HIV-1 (groups M and O) or HIV-2. Antigens representing epitopes of HIV-1 gp41 and HIV-2 gp36 are coated onto microplate wells together with monoclonal antibodies against HIV p24. In the first step of the immunoassay, serum or plasma samples are added to these wells along with the sample diluent containing biotinylated anti-p24 antibodies. If specific HIV-1 and/or HIV-2 antibodies are present in the sample, they will form stable complexes with the HIV antigens attached to the wells. If p24 antigen is present in the sample, it will bind simultaneously to the antibodies in the well and to the biotinylated antibodies present in the sample diluent. The microwells are then washed to remove unbound serum proteins. A set of biotinylated antigens are added to the wells, these antigens will bind to the specific captured antibodies. After a second wash to remove unbound conjugate, a second conjugate of Streptavidin-HRP is added to the wells. In wells containing the “sandwich” immunocomplex, the colourless Chromogen is oxidised by the bound conjugate to a blue coloured product. The blue colour changes to yellow after stopping the reaction with sulphuric acid. The intensity of colour can be measured and is proportional to the concentration of anti-HIV 1/2 antibodies or HIV p24 antigen present in the sample. Wells containing negative samples remain colourless. Components 1. MCPL MICROPLATE: 12 x 8 wells coated with antigens representing epitopes of HIV-1 gp41 and HIV-2 gp36 and monoclonal antibodies against p24. Plates are sealed into aluminum pouch with desiccant. 2. CONTROL + 1 HIV-1 POSITIVE CONTROL: Diluted human serum containing antibodies to HIV-1 (Heat inactivated). Contains 0.1% ProClinTM 300 as preservative. Ready to use. 3. CONTROL + 2 HIV-2 POSITIVE CONTROL: Diluted human serum containing antibodies to HIV-2 (Heat inactivated). Contains 0.1% ProClinTM 300 as preservative. Ready to use. 4. CONTROL + Ag HIV POSITIVE CONTROL p24: Diluted human serum spiked with recombinant HIV-1 p24 antigen. Contains 0.1% ProClinTM 300 as preservative. Ready to use 5. CONTROL – NEGATIVE CONTROL: Diluted human serum negative for antibodies to HIV-1/2 and HIV p24 antigen. Contains 0.1% ProClinTM 300 as preservative. Ready to use. 6. DIL SAMP SAMPLE DILUENT: Biotinylated monoclonal antibodies against HIV p24 diluted in Tris-buffer. Contains 0.05% ProClinTM 300 as preservative and red dye. Ready to use. BIOKIT, S.A. - Can Malé s/n - 08186 Lliçà d’Amunt - Barcelona - SPAIN 3000-1172_R01_02.2015_eng.docx 0843 1 bioelisa 7. CONJ 1 CONJUGATE 1 READY TO USE: Phosphate buffer containing HIV-1 and HIV-2 biotinylated antigens. Contains 0.05% ProClinTM 300 as preservative and blue dye. Ready to use. 8. DIL CONJ 2 CONJUGATE DILUENT 2: Phosphate buffer containing protein stabilizers, 0.05% ProClinTM 300 as preservative and yellow dye. 9. CONJ 2 101X CONCENTRATE CONJUGATE 2 (101X): Contains peroxidase labelled streptavidin. To be diluted 1:101 in conjugate diluent 2 before use. 10. SUBS TMB SUBSTRATE-TMB: Contains 3,3', 5,5'-Tetramethylbenzidine (TMB) and hydrogen peroxide. Ready to use. 11. WASH SOLN 25x CONCENTRATE WASHING SOLUTION: Concentrate PBS buffer pH 7.4 (25x). Contains Tween-20 as detergent, <0.2% ProClinTM 300 as preservative To be diluted 1:25 in distilled or deionised water before use. 12. H2SO4 0.8N STOPPING SOLUTION: 0.8N sulphuric acid. Ready to use. 13. SEALS ADHESIVE SEALS: To cover the microplate during incubations. 14. BAG RESEALABLE BAG: For storage of unused strips. Precautions bioelisa HIV-1+2 Ag/Ab is intended for IN VITRO diagnostic use. For professional use only. WARNING: The Negative Control, HIV-1 Positive Control, HIV-2 Positive Control, HIV p24 Positive Control, Sample Diluent, Conjugate 1, Conjugate Diluent 2 and Concentrate Washing Solution contain <0.2% ProClinTM 300 as preservative. Hazard statements H317: May cause an allergic skin reaction. Precautionary statements P280: Wear protective gloves/protective clothing/eye protection/face protection. P302+P352: IF ON SKIN: Wash with plenty of soap and water. P333+P313: If skin irritation or rash occurs: Get medical advice/attention. P363: Wash contaminated clothing before reuse. P501: Dispose of contents/container in accordance with local/regional/national/international regulations. WARNING: POTENTIALLY BIOHAZARDOUS MATERIAL. All human source material used in the preparation of this product was found to be negative for the presence of HCV antibodies, Treponema pallidum antibodies, hepatitis B surface antigen and HIV 1/2 antibodies (except for the Positive Controls 1 and 2), using a commercial licensed method. Nevertheless, because no test method can offer complete assurance of the absence of infectious agents, this product should be handled with caution: - Avoid contact of reagents with the eyes and skin. If that occurs, wash thoroughly with water. Wear gloves. Do not pipette by mouth. Do not smoke. - Dispose all used materials in a suitable biohazardous waste container. Remains of samples, controls, aspirated reagents and pipette tips should be collected in a container for this purpose and autoclaved 1-hour at 121°C or treated with 10% sodium hypochlorite (final concentration) for 30 min before disposal. (Remains containing acid must be neutralised prior to the addition of sodium hypochlorite). BIOKIT, S.A. - Can Malé s/n - 08186 Lliçà d’Amunt - Barcelona - SPAIN 3000-1172_R01_02.2015_eng.docx 0843 2 bioelisa Handling instructions: - Adjust washer to the plate used (flat bottom) in order to wash properly. Do not mix reagents from different lots. Do not use reagents after the expiration date. Do not use the reagent if you observed any change in appearance of components included in the kit. Extreme care should be taken to avoid microbial contamination and cross contamination of reagents. Use a new pipette tip for each specimen and each reagent. Do not exchange reagents from different lots or use reagents from other commercially available kits. The components of the kit are precisely matched for optimal performance of the tests. CAUTION - CRITICAL STEP: Allow the reagents and specimens to reach room temperature (20-25°C) before use. Shake reagent gently before use. Return at 2-8°C immediately after use. The enzymatic activity of conjugate 2 might be affected by dust and reactive chemical substances like sodium hypochlorite, acids, alkalis etc. Do not perform the assay in the presence of these substances. It is very important to keep the Substrate-TMB solution in a well-sealed container and avoid light exposure. Soaps and/or oxidising agents remaining in containers used for the Substrate-TMB solution can interfere with the reaction. If glass containers or re-used plastic containers are used, they should be washed with 1N sulphuric or hydrochloric acid, rinsed well with distilled water and dried before use. We recommend using disposable plastic containers. Storage and stability The components will remain stable through the expiration date shown on the label if stored at 2-8°C. The bag containing the microplate should be brought to room temperature before opening to avoid condensation in the wells. Once opened the bag, the microplate wells are stable for 3 months at 2-8°C in the plastic bag tightly sealed, along with the silicagel. Discard any microplate sealed without the silicagel. Once diluted, the washing solution is stable for 6 days only if stored at 2-8°C. Do not use diluted washing solutions if stored overnight at room temperature. Once diluted, the conjugate 2 is stable for 30 days at 2-8°C. Store the Substrate-TMB solution in the dark. Available packaging 1 microplate kit (1x96 tests), REF 3000-1172. Contains: 1 microplate, 1 x 2 mL negative control, 1 x 2 mL HIV-1 positive control, 1 x 2 mL HIV-2 positive control, 1 x 2 mL HIV-1 p24 positive control, 1 x 14 mL sample diluent, 1 x 25 mL conjugate 1 ready to use, 1 x 0.250 mL concentrate conjugate 2 (101x), 1 x 25 mL conjugate 2 diluent, 1 x 20 mL substrate-TMB, 1 x 12 mL stopping solution, 2 x 50 mL concentrate washing solution, 1 resealable bag and adhesive seals. - 5 microplates kit (5 x 96 tests), REF 3000-1173. Contains: 5 microplates, 1 x 4 mL negative control, 1 x 4 mL HIV-1 positive control, 1 x 4 mL HIV-2 positive control, 1 x 4 mL HIV-1 p24 positive control, 1 x 70 mL sample diluent, 1 x 120 mL conjugate 1 ready to use, 1 x 1.2 mL concentrate conjugate 2 (101x), 1 x 120 mL conjugate 2 diluent, 1 x 100 mL substrate-TMB, 1 x 60 mL stopping solution, 3 x 100 mL concentrate washing solution, 1 resealable bag and adhesive seals. Material required not provided Distilled or deionised water. Disposable gloves and timer. Appropriate waste containers for potentially contaminated materials. Disposable V-shaped troughs. Dispensing system and/or pipette (single or multichannel) and disposable pipette tips. Absorbent tissue or clean towel. Dry incubator or water bath, 37 ± 1°C. Microplate reader with a 450 nm filter. Reference filter of 620 nm or 630 is advisable. Manual or automated wash system. Sample collection Use fresh serum with or without Serum separator tube (SST), EDTA plasma, Acid-citrate-dextrose (ACD) plasma, Lithium heparin plasma, Sodium heparin plasma, Sodium citrate plasma, Potassium oxalate/sodium fluoride plasma, CPD and CPDA plasma. Other anticoagulants should be evaluated before use. Samples can be stored at 2-8°C for 8 days. For longer periods, samples should be frozen (-20°C). Avoid repeated freezing and thawing (maximum 4 freeze-thaw cycles). Specimens showing visible particulate matter should be clarified by centrifugation. Serum or plasma samples should not be heat inactivated, since that may cause incorrect results. BIOKIT, S.A. - Can Malé s/n - 08186 Lliçà d’Amunt - Barcelona - SPAIN 3000-1172_R01_02.2015_eng.docx 0843 3 bioelisa Automatic processing Automated or semi-automated assay may be used with different instruments. It is very important to validate any automated system to demonstrate that the results obtained for samples are equivalent to the ones obtained using the manual assay. It is recommended that the users validate periodically the instrument. If there is any difficulty in the programming and setting of Biokit automatic processors, please contact your distributor. PROCEDURE Previous operations Allow all the reagents to reach room temperature (20-25°C) before running the assay. Gently mix all liquid reagents before use. Check the washing solution concentrate for the presence of salt crystals. If crystals have formed, resolubilize by warming at 37°C until crystals dissolve. Use distilled or deionized water. Negative and Positive controls should be treated as the samples. Dilute the washing solution 1:25 in distilled water. If the entire plate is used, add 40 mL of concentrate washing solution (25x) to 960 mL of deionised water. If the entire plate is not used, prepare the proportional volume of solution. Dilute the concentrated conjugate 2 1:101 with the conjugate diluent 2 according to table 1. For the 1 plate packaging, if the entire plate is to be used, add 250 µL of concentrate conjugate directly to the bottle containing 25 mL of conjugate diluent. Mix gently. TABLE 1 Strips required Conjugate diluent 2 Concentrate conjugate 2 mL µL 1 2.0 20 2 4.0 40 4 8.0 80 6 12.0 120 8 16.0 160 10 20.0 200 12 25.0 250 Assay procedure 1. Use only the number of strips required for the test. Reserve 7 wells for blank and controls. One well as Blank (e.g. A1), three wells as negative control (e.g. B1, C1, D1) and, at least, one well of each of the positive controls: positive control HIV-1 (e.g. E1), positive control HIV-2 (e.g. F1) and positive control HIV p24 (e.g. G1). 2. Add 100µL of sample diluent to all the wells except the Blank. 3. Add first 100 μl of samples, and last 100 μl of negative and each of the positive controls into their respective wells. 4. Cover the plate with an adhesive seal, mix gently and incubate at 37°C ± 1°C for 60 minutes with a tolerance range of 58 – 65 minutes 5. Remove and discard the adhesive seal. Aspirate the contents of the wells and fill them completely (approximately 350 µL) with the diluted washing solution. Repeat the process of aspiration and washing 4 more times, 5 (five) cycles in total. Ensure that each column of wells soaks for at least 15 seconds before the next aspiration cycle. 6. Transfer 200 µL of conjugate 1 into each well, except the one reserved for the substrate blank. Avoid bubbles upon addition. 7. Cover the microplate with an adhesive seal and incubate at 37°C ± 1°C for 30 minutes with a tolerance range of 28 – 35 minutes. 8. Remove and discard the adhesive seal. Aspirate and wash the wells as in the previous washing step for 3 (three) wash cycles. 9. Transfer 200 µL of working conjugate 2 into each well, except the one reserved for the substrate blank. Avoid bubbles upon addition. 10. Cover the microplate with an adhesive seal and incubate at 37°C ± 1°C for 30 minutes with a tolerance range of 28 – 35 minutes. 11. Remove and discard the adhesive seal. Aspirate and wash the wells as in step 5, for 5 (five) wash cycles. BIOKIT, S.A. - Can Malé s/n - 08186 Lliçà d’Amunt - Barcelona - SPAIN 3000-1172_R01_02.2015_eng.docx 0843 4 bioelisa 12. Add 150 µL of Substrate-TMB solution to each well, including the blank. 13. Incubate at room temperature (20-25°C) for 30 minutes with a tolerance range of 28 – 35 minutes, protected from direct light exposure 14. Stop the reaction by adding 100 µL of stopping solution in the same sequence and time intervals as for the Substrate-TMB. 15. Blank the reader at 450 nm with the blank well and read the absorbance of each well within 30 minutes. It is recommended to read in bichromatic mode using a 620 - 630 nm reference filter. Quality control Results of an assay are valid if the following criteria are accomplished: 1. The Absorbance value of the blank well must be ≤ 0.100. 2. The Absorbance value of the positive controls must be ≥ 0.900 after subtracting the blank. If not the run should be repeated. 3. Each individual absorbance value of the negative control must be ≤ 0.120 after subtracting the blank. If one of the negative control values does not meet the Quality Control criteria, it should be discarded and the mean value calculated again using the remaining two values. If two or more negative control Absorbance values do not meet the Quality Control Range specifications, the test is invalid and must be repeated. Results 1. Subtract the blank from each of the valid negative controls. Calculate the mean absorbance of the negative control (NCx). Calculate the cut-off value by adding 0.170 to the mean absorbance of the negative control. Cut-off = NCx + 0.170 Example: NCx = 0.011 2. cut-off value = 0.011 + 0.170 = 0.181 Divide the absorbance of the sample by the cut-off value. Positive: Negative: Equivocal: ratio absorbance/cut-off ≥ 1.0 ratio absorbance/cut-off < 0.9 ratio absorbance/cut-off ≥ 0.9 < 1.0 Interpretation of results Negative Results: Specimens with an absorbance to cut-off ratio lower than 0.9 are considered non reactive which indicates that no anti-HIV 1 and/or HIV-2 antibodies or HIV p24 antigen have been detected with bioelisa HIV-1+2 Ag/Ab kit. Positive Results: Specimens giving an absorbance equal to or greater than the cut-off value are considered initially reactive, which indicates that anti-HIV 1/2 antibodies or HIV p24 antigen have probably been detected using bioelisa HIV-1+2 Ag/Ab. All initially reactive specimens should be retested in duplicate to confirm the initial result. Equivocal: Specimens with an absorbance to cut-off ratio between 0.9 and 1.0 are considered equivocal and retesting of these specimens in duplicate is required to confirm the initial results. - If, after retesting the initially reactive samples, both wells report negative results (S/CO < 0.9), these samples should be considered as non-repeatable positive (or, false positive) and recorded as negative. - If, after retesting in duplicate, one or both wells report positive results, the final result from this ELISA test should be recorded as repeatedly reactive. Repeatedly reactive specimens can be considered positive for antibodies to HIV 1/2 or p24 antigen, therefore the patient is probably infected with HIV1 or HIV2. - After retesting in duplicate, samples with values close to the cut-off value should be interpreted with caution and considered as equivocal, or uninterpretable for the time of testing. - Follow-up, confirmation and supplementary testing of any positive specimen with other analytical system (e.g. WB, PCR) is required. Clinical diagnosis should not be established based on a single test result. It should integrate clinical and other laboratory data and findings. BIOKIT, S.A. - Can Malé s/n - 08186 Lliçà d’Amunt - Barcelona - SPAIN 3000-1172_R01_02.2015_eng.docx 0843 5 bioelisa Limitations of the procedure - Optimal assay performance requires strict adherence to the assay procedure described. Deviation from the procedure may lead to aberrant results. - As in all sensitive immunoassays, there is the possibility that non-repeatable positive results occur. - Positive results must be confirmed with another available method and interpreted in conjunction with the patient clinical information. - Negative results obtained with bioelisa HIV-1+2 Ag/Ab are considered negative for antibodies to HIV-1/2 and p24 antigen and further testing is not required. - The prevalence of the marker will affect the assay’s predictive values. - This assay cannot be used to test pooled (mixed) plasma. bioelisa HIV-1+2 Ag/Ab has been evaluated only with individual serum or plasma specimens. - bioelisa HIV-1+2 Ag/Ab is a qualitative assay and the results cannot be used to measure concentrations of antibodies to HIV or p24 antigen. This assay cannot distinguish between infections with HIV-1 and HIV-2. - A negative result does not exclude the possibility of exposure or infection with HIV. Expected results The number of positive results depends on the disease incidence in the geographic area and the type of tested population. In the world, the HIV incidence in people older than 15 years varies from 0.1% in Australia, New Zeeland and Asia Pacific, 0.3% in Western Europe, North Africa and Middle East, 0.5% in East Europe, Central Asia and Latin America, 0.6% in North America and South Asia and 9% in sub-Saharan Africa. In the same country, incidence also varies enormously according to the tested population. In Western Europe, HIV antibodies prevalence in blood bank donations varies from 0 to 5 cases over 100,000 donations, while the incidence among prisoners, sex workers and drug abusers may easily reach 20% in these risk populations. Performance characteristics Analytical Sensitivity The limit of detection has been estimated below 0.5 IU/ml by testing the WHO HIV p24 Antigen, First International Reference NIBSC code 90/636 with two different lots during the internal evaluation. Additionally, the limit of detection has been also estimated below 12.5 pg/ml by testing BIORAD HIV-1 Antigen Standard 72217 with two different lots during the internal evaluation. Sensitivity A total of 537 HIV-1 positive samples were evaluated with bioelisa HIV 1+2 Ag/Ab, among them: 28 HIV-1 fresh-same-day collected samples, 85 HIV-1 and 4 HIV-1 Subtype O samples in an European reference lab; 380 HIV -1 samples were evaluated at Biokit and 40 HIV-1 non B subtype samples (and at least 3 samples of each HIV-1 subtype) were evaluated in another European reference lab. bioelisa HIV 1+2 Ag/Ab detected all 537 samples. The sensitivity found was100% (537/537). - A total of 115 HIV-2 positive samples were evaluated with bioelisa HIV 1+2 Ag/Ab, among them: 27 HIV-2 samples in an European reference lab and 88 HIV-2 samples were evaluated at Biokit. bioelisa HIV 1+2 Ag/Ab detected all 115 samples. The sensitivity found was 100% (115/115). - A total of 61 HIV-1 p24 Ag positive samples were evaluated also with bioelisa HIV 1+2 Ag/Ab, among them: 15 samples in an European reference lab, 16 samples were evaluated in another European reference lab and 30 samples at Biokit. bioelisa HIV 1+2 Ag/Ab detected all 61 samples. The sensitivity found was 100% (61/61). - Additional sensitivity studies were carried out by testing a total of 31 seroconversion panels at Biokit and a European reference lab. Results obtained were comparable to the most sensitive commercial method for HIV 1+2 antigen and antibody detection. - 16 HIV Seroconversion Panels from BBI/Seracare and Zeptometrix bioelisa HIV-1+2 Ag/Ab identified correctly all the positive specimens. were BIOKIT, S.A. - Can Malé s/n - 08186 Lliçà d’Amunt - Barcelona - SPAIN at Biokit. 3000-1172_R01_02.2015_eng.docx 0843 6 evaluated bioelisa Seroconversion Panel BB1-PRB965-n=6 ZEPT-12007-n=9 BBI-PRB954-n=7 BBI-PRB932-n=9 ZEPT-9017-n=11 ZEPT-9014-n=7 ZEPT-9012-n=8 ZEPT-9032-n=14 ZEPT-6243-n=10 ZEPT-9022-n=9 ZEPT-9018-n=11 BBI-PRB939-n=9 BBI-PRB956-n=5 BBI-PRB945-n=6 BBI-PRB955-n=4 BBI-PRB958-n=6 bioelisa HIV Ag/Ab 2 4 6 4 1 1 5 8 7 7 9 6 4 3 2 3 HIV Ag/Ab HIV p24 HIV Ab Assay Assay antigen First sample detected positive in the panel 2 4 2 4 5 ND 6 7 6 ND 4 4 4 3 1 1 3 1 6 7 5 8 7 8 7 8 7 8 9 7 9 10 9 ND 8 6 4 5 4 4 4 3 2 4 2 3 5 3 NAT 1 4 4 4 1 1 1 1 1 1 1 5 2 1 1 1 - In the previous table it can be observed the first sample detected as positive in each panel evaluated with bioelisa HIV-1+2 Ag/Ab in comparison with 4th Generation assays (Ag/Ab Assays), 3rd Generation assays (Ab Assays), assays for HIV p24 antigen and HIV RNA NAT assays. bioelisa HIV-1+2 Ag/Ab showed excellent sensitivity to detect early antigen or antibodies in 16 HIV Seroconversion Panels evaluated. - Another study was conducted to assess the sensitivity in 32 early seroconversion samples. These type of samples are characterized to be positive to the presence of HIVp24 Ag and/or positive by NAT (Nucleic Acid Testing), not detected by all HIV 3rd generation methods and to be negative or Indeterminate by Western-Blot methods. bioelisa HIV 1+2 Ag/Ab detected all 32 samples. The sensitivity found was 100% (32/32). - Finally, 50 cell culture supernatans from HIV cell cultures, including different HIV-1 subtypes and HIV-2 were evaluated in a European Reference Lab. bioelisa HIV 1+2 Ag/Ab detected all 50 samples. The sensitivity found was100% (50/50). Specificity The specificity was evaluated by testing a total of 6465 unselected blood donors' samples at three different sites. - In the first site 3045 unselected samples including 684 first donors were tested. From this total, 4 samples were reactive. The specificity obtained in this study was 99.87% (3041/3045). - In the second site 500 unselected samples from Blood Bank were tested. All 500 samples were negative. The specificity was 100% (500/500) - An internal evaluation of 2920 unselected samples from Blood Bank was performed. From this evaluation, 6 samples were reactive. The specificity obtained in this study was 99.79%. (2914/2920) A detailed summary of these specificity studies is shown in the table below. BIOKIT, S.A. - Can Malé s/n - 08186 Lliçà d’Amunt - Barcelona - SPAIN 3000-1172_R01_02.2015_eng.docx 0843 7 bioelisa Evaluation 1 (3045 sera) Serum Initial Reactive Repeated Reactive False Positive Specificity % 6 4 4 99.87 (95% C.I.: 99.66 - 99.96) Evaluation 2 (500 sera) Serum Initial Reactive Repeated Reactive False Positive Specificity % 0 0 0 100 (95% C.I.: 98.89 - 100) Internal Evaluation (1000 sera + 1920 plasmas) - Initial Reactive Repeated Reactive False Positive Specificity % Plasma 8 6 6 99.69 (95% C.I.: 99.32 - 99.89) Serum 1 0 0 100 (95% C.I.: 99.44 - 100) Total 9 6 6 99.79 (95% C.I.: 99.55 - 99.93) In addition 200 samples from hospitalized patients have been tested and compared to a reference test. 194 samples were found negative by both tests and six samples were reactive. The six samples were also reactive with other ELISA tests. A specificity of 100% was obtained in this study (194/194). Precision Intra-assay reproducibility: The coefficient of variation obtained for the absorbance values of a HIV-1 positive sample assayed in a minimum of 40 replicates was 3.42%, 5.79% and 4.71% in three lots studied. The coefficient of variation obtained for the absorbance values of a HIV-2 positive sample assayed in a minimum of 40 replicates was 6.39%, 5.91% and 8.38% in three lots studied. The coefficient of variation obtained for the absorbance values of a HIV-1 p24 positive sample assayed in a minimum of 40 replicates was 4.08%, 3.44% and 3.71% in three lots studied. Inter-assay reproducibility: Four positive samples of different levels were tested in 15 different assays. The coefficients of variation obtained for the ratios absorbance/Cut-off of the four samples were 4.87%, 5.37%, 7.49% and 7.54%. Interferences Interference by addition No interference has been found for haemoglobin (500 mg/dl), bilirubin (20 mg/dl), human Albumin (5 g/dl) and triglycerides (500 mg/dl). Cross-reactivity To evaluate possible interferences, 125 potential cross-reacting specimens were analyzed. Among those samples, 4 samples (RF+), 4 samples positive for anti-nuclear antibodies (ANA), 5 samples Mononucleosis, 89 samples from other related infectious diseases and 23 samples from pregnant women. No evidence of cross reactivity was found in the samples evaluated. The 2 anti-Toxoplasma IgM samples that tested positive were also positive by other HIV assays. Potential interfering samples = 125 RF (Rheumatoid factor) ‐ 4 Elevated IgG ‐ 4 ANA (anti‐Nuclear Antibodies) ‐ 4 Elevated IgM ‐ 5 Mononucleosis ‐ 5 HSV 1 IgG (Herpes Simplex Virus) ‐ 5 Pregnant women‐ 23 (including 7 multiparous) HSV 2 IgG (Herpes Simplex Virus) ‐ 4 Syphilis Ab ‐ 6 anti‐CMV IgG (Cytomegalovirus) ‐ 5 anti‐EBV (Epstein‐Barr Virus) ‐ 3 anti‐CMV IgM (Cytomegalovirus) ‐ 7 anti‐Rubella (Rubella Virus) ‐ 4 anti‐HTLV (Human T‐lymphotropic Virus) ‐ 4 anti‐VZV IgG (Varicela Zoster Virus) ‐ 2 anti‐HCV (Hepatitis C Virus) ‐ 8 anti‐VZV IgM (Varicela Zoster Virus) ‐ 2 anti‐E.coli (Escherichia coli) ‐ 5 anti‐Toxoplasma IgG (T. gondii) ‐ 10 HBsAg (Hepatitis B Antigen) ‐ 8 anti‐Toxoplasma IgM (T. gondii) ‐ 7 BIOKIT, S.A. - Can Malé s/n - 08186 Lliçà d’Amunt - Barcelona - SPAIN 3000-1172_R01_02.2015_eng.docx 0843 8 bioelisa bioelisa: Troubleshooting guide Problem Possible causes Solution 1. Controls out of validation. 1a. Incorrect temperature, timing or pipetting. 1b. Improper preparation of reagents, error of dilution, reagents not well mixed. 1c. Cross-contamination of controls. Check procedure. Repeat assay. Check procedure. Repeat assay. 1d. 1e. 1f. 1g. 2. No colour or only a light colour developed at the end of the assay. 2a. 2b. 2c. 2d. 2e. Pipette carefully. Do not interchange caps. Repeat assay. Incorrect reading filter. Check that the wavelenght of the filter used is 450 nm. If no reference 620 - 630 nm is used, absorbance increases approximately 0.050. Interference in the optical Check the reader. Clean or pathway. dry the bottom of microplate. Check for air bubbles. Repeat reading. Used components from Do not use components from different lots. different lots as they are adjusted for each batch released. Expired reagents. Check the kit expiry date. Use a non- expired kit. One or more reagents not Check procedure. Repeat added or added in wrong assay. sequence. Inactive conjugate. Wrong Check for contamination. dilution of concentrate Check procedure. Repeat conjugate 2. Improper assay. conservation. Inactive microplate: Always keep unused strips in Improper conservation. the bag very well closed, with the desiccant inside. Repeat assay. Inactive Sustrate-TMB: Use disposable containers or Improper conservation. wash with acid or ethanol and The container used affects rinse with deionised water Substrate-TMB stability, before re-use. Check cross-contamination with procedure. Repeat assay. the stopping solution. Too cold reagents. Let reagents reach room temperature before use. BIOKIT, S.A. - Can Malé s/n - 08186 Lliçà d’Amunt - Barcelona - SPAIN 3000-1172_R01_02.2015_eng.docx 0843 9 bioelisa bioelisa: Troubleshooting guide Problem Possible causes 3. Too much colour in all microplate wells. 3a. Contaminated or oxidised Check that substrate is Substrate-TMB solution. colourless, discard if blue. Use acid or ethanol washed or disposable containers. Repeat assay. 3b. Contaminated or Check for contamination: improperly prepared turbid aspect. Check dilutions. reagents. Repeat assay. 3c. Contaminated washing Check the quality of distilled solution (1x). or deionised water used for dilution. Repeat assay. 3d. Insufficient washing or Check the washing device. Fill washing not consistent: wells with washing solution filling volume and/or close to the top, aspirate aspiration insufficient or completely. Increase the not uniform. Insufficient number of wash cycles. number of washing cycles, contaminated device. 3e. Using of a washing Use only the washing solution solution from other supplied with the kit. manufacturer. 4a. Washing problems. See 3c, 3d, 3e. 4b. Uncalibrated pipettes or Use only calibrated pipettes, tips not well fitted. with well fitted tips and pipette Improper pipetting. carefully, without bubbles and splashing. Repeat assay. 4c. Reagents too cold or not Equilibrate reagents to room well mixed before using. temperature and mix thoroughly before using. 4d. Air currents over the Keep the microplate protected microplate during from air currents. incubations. 4e. Too long time for addition Develop consistent and of samples and/or uniform technique. reagents. Inconsistency in time intervals. Air bubbles. 4f. Interference in the optical See 1e. pathway. 4. Poor reproducibility or high number of non-repeatable reactive samples. Solution BIOKIT, S.A. - Can Malé s/n - 08186 Lliçà d’Amunt - Barcelona - SPAIN 3000-1172_R01_02.2015_eng.docx 0843 10 bioelisa LEER CAMBIOS SOMBREADOS bioelisa HIV-1+2 Ag/Ab 3000-1172 1 x 96 TESTS 3000-1173 5 x 96 TESTS (480) Prueba ELISA para la detección de anticuerpos frente a los virus de la inmunodeficiencia humana (HIV) de tipo 1 (grupo M, O) o de tipo 2 y antígenos p24 del HIV en muestras humanas de suero o plasma en laboratorios clínicos y como ensayo de detección de primera línea en centros de análisis sanguíneos. Sumario Es posible obtener evidencia serológica de infección por HIV mediante la detección de la presencia de antígenos o anticuerpos frente al HIV en el suero o plasma de personas en las que se sospecha de infección por HIV. Por lo general, los antígenos pueden detectarse tanto durante la fase aguda como durante la fase sintomática del sida. Los anticuerpos frente al HIV-1 y/o el HIV-2 pueden detectarse prácticamente durante todo el período de infección, a partir o poco después de la fase aguda y hasta la fase terminal del sida. La técnica ELISA de cuarta generación para el HIV permite la determinación simultánea de antígenos p24 del HIV y anticuerpos frente al HIV-1/HIV-2, con lo que se reduce el margen diagnóstico y puede realizarse un diagnóstico precoz de la infección aguda por HIV. Aparte de la transmisión sexual, la principal vía de infección por HIV es la transfusión sanguínea. El HIV puede estar presente tanto en la fracción celular como en la acelular de la sangre humana. Por tanto, todas las donaciones de sangre o plasma deberían analizarse por el riesgo de transmisión del HIV a través de sangre contaminada. Esto puede conseguirse de forma eficaz mediante el análisis de detección de anticuerpos frente al HIV y antígeno p24 con una prueba ELISA altamente sensible. Principio bioelisa HIV-1+2 Ag/Ab es un enzimoinmunoanálisis de cuarta generación para la detección cualitativa simultánea del antígeno p24 del HIV y anticuerpos frente al HIV-1 (grupos M y O) o HIV-2. Los antígenos que representan los epítopos de gp41 del HIV-1 y gp36 del HIV-2 recubren los pocillos de las microplacas junto con anticuerpos monoclonales frente al p24 del HIV. En la primera fase del inmunoanálisis, se añaden muestras de suero o plasma a estos pocillos junto con el diluyente de muestras que contiene anticuerpos anti-p24 biotinilados. Si hay anticuerpos frente al HIV-1 y/o HIV-2 específicos en la muestra, formarán complejos estables con los antígenos del HIV unidos a los pocillos. Si hay antígeno p24 en la muestra, se unirá de forma simultánea a los anticuerpos del pocillo y a los anticuerpos biotinilados presentes en el diluyente de muestras. A continuación se lavan los pocillos para eliminar las proteínas séricas libres. Se añade un conjunto de antígenos biotinilados a los pocillos, que se unirán a los anticuerpos capturados específicos. Después de un segundo lavado para eliminar el conjugado libre, se añade un segundo conjugado de estreptavidina-HRP a los pocillos. En los pocillos que contienen el inmunocomplejo "sándwich", el cromógeno incoloro se oxida por el efecto del conjugado unido para dar lugar a un producto de color azul. El color azul cambia a amarillo después de que se detenga la reacción con ácido sulfúrico. La intensidad del color puede cuantificarse y es proporcional a la concentración de anticuerpos anti-HIV 1/2 o del antígeno p24 del HIV presentes en la muestra. Los pocillos que contienen muestras negativas permanecen incoloros. Componentes 1. MCPL MICROPLACA: 12 x 8 pocillos recubiertos de antígenos que representan epítopos de gp41 del HIV-1 y gp36 del HIV-2 y anticuerpos monoclonales frente a p24. Las placas se sellan en bolsas de aluminio con desecante. 2. CONTROL + 1 CONTROL POSITIVO HIV-1: Suero humano diluido con anticuerpos frente al HIV-1 (inactivados por calor). Contiene ProClinTM 300 al 0,1% como conservante. Listo para usar. 3. CONTROL + 2 CONTROL POSITIVO HIV-2: Suero humano diluido con anticuerpos frente al HIV-2 (inactivados por calor). Contiene ProClinTM 300 al 0,1% como conservante. Listo para usar. 4. CONTROL + Ag CONTROL POSITIVO p24 DEL HIV: Suero humano diluido inoculado con antígeno p24 del HIV-1 recombinante. Contiene ProClinTM 300 al 0,1% como conservante. Listo para usar 5. CONTROL – CONTROL NEGATIVO: Suero humano diluido negativo para anticuerpos frente al HIV-1/2 y antígeno p24 del HIV. Contiene ProClinTM 300 al 0,1% como conservante. Listo para usar. BIOKIT, S.A. - Can Malé s/n - 08186 Lliçà d’Amunt - Barcelona - SPAIN 3000-1172_R01_02.2015_spa.docx 0843 11 bioelisa 6. DIL SAMP DILUYENTE DE MUESTRAS: Anticuerpos monoclonales biotinilados frente a p24 del HIV diluidos en tampón Tris. Contiene ProClinTM 300 al 0,05% como conservante y colorante rojo. Listo para usar. 7. CONJ 1 CONJUGADO 1 LISTO PARA USAR: Tampón fosfato con antígenos biotinilados del HIV-1 y HIV-2. Contiene ProClinTM 300 al 0,05% como conservante y colorante azul. Listo para usar. 8. DIL CONJ 2 DILUYENTE DE CONJUGADO 2: Tampón fosfato con estabilizadores de proteínas, ProClinTM 300 al 0,05% como conservante y colorante amarillo. 9. CONJ 2 101X CONJUGADO CONCENTRADO 2 (101X): Contiene estreptavidina marcada con peroxidasa. Para diluir 1:101 en el diluyente de conjugado 2 antes del uso. 10. SUBS TMB SUSTRATO-TMB: Contiene 3,3', 5,5'-tetrametilbenzidina (TMB) y peróxido de hidrógeno. Listo para usar. 11. WASH SOLN 25x SOLUCIÓN DE LAVADO CONCENTRADA: Tampón PBS concentrado con pH 7,4 (25x). Contiene Tween-20 como detergente, ProClinTM 300 a < 0,2% como conservante. Para diluir 1:25 en agua destilada o desionizada antes del uso. 12. H2SO4 0.8N SOLUCIÓN DE PARADA: Ácido sulfúrico 0,8 N. Listo para usar. 13. SEALS LÁMINAS ADHESIVAS: Para cubrir la microplaca durante las incubaciones. 14. BAG BOLSA DE PLÁSTICO: Para la conservación de tiras no utilizadas. Precauciones bioelisa HIV-1+2 Ag/Ab está prevista para uso diagnóstico IN VITRO. Uso exclusivo para profesionales. ATENCIÓN: El control negativo, el control positivo para HIV-1, el control positivo para HIV-2, el control positivo para p24 del HIV, el diluyente de muestras, el conjugado 1, el diluyente de conjugado 2 y la solución de lavado concentrada contienen ProClinTM 300 a < 0,2% como conservante. Indicaciones de peligro H317: Puede provocar una reacción alérgica en la piel. Consejos de prudencia P280: Llevar guantes/prendas/gafas/máscara de protección. P302+P352: EN CASO DE CONTACTO CON LA PIEL: Lavar con agua y jabón abundantes. P333+P313: En caso de irritación o erupción cutánea: Consultar a un médico. P363: Lavar las prendas contaminadas antes de volver a usarlas. P501: Eliminar el contenido/el recipiente de acuerdo con las normativas locales/regionales/nacionales/ internacionales. ATENCIÓN: MATERIAL DE RIESGO BIOLÓGICO. Todo el material de origen humano utilizado en la preparación de este producto dio un resultado negativo para la presencia de anticuerpos frente al HCV, anticuerpos frente a Treponema pallidum, antígenos de superficie de la hepatitis B y anticuerpos frente al HIV 1/2 (excepto los controles positivos 1 y 2), según un método comercial aprobado. Sin embargo, dado que no existe un método analítico que pueda garantizar completamente la ausencia de agentes infecciosos, este producto debe manipularse con precaución: - Evitar el contacto de los reactivos con los ojos y la piel. En caso de contacto, lavar bien con agua. Usar guantes. No pipetear con la boca. No fumar. BIOKIT, S.A. - Can Malé s/n - 08186 Lliçà d’Amunt - Barcelona - SPAIN 3000-1172_R01_02.2015_spa.docx 0843 12 bioelisa - Desechar todos los materiales usados en recipientes adecuados para material biocontaminante. Los restos de muestras, controles, reactivos aspirados y puntas de pipetas deben depositarse en un contenedor para tal fin y esterilizarse en autoclave durante 1 hora a 121°C o tratarse con hipoclorito de sodio al 10% (concentración final) durante 30 minutos antes de su eliminación. (Los restos que contengan ácido deberán neutralizarse antes de la adición del hipoclorito de sodio). Instrucciones de manipulación: - - Ajustar el lavador a la placa utilizada (fondo plano) para un lavado correcto. No mezclar reactivos de diferentes lotes. No utilizar reactivos después de la fecha de caducidad. No utilizar el reactivo si se observa cualquier cambio en el aspecto de los componentes incluidos en el kit. Deberá extremarse la precaución para evitar la contaminación microbiana y la contaminación cruzada de los reactivos. Utilizar una nueva pipeta para cada muestra y cada reactivo. No intercambiar los reactivos de diferentes lotes ni utilizar reactivos de otros kits disponibles en el mercado. Los componentes del kit están ajustados con precisión para un rendimiento óptimo de las pruebas. PRECAUCIÓN - PASO CRÍTICO: Dejar que los reactivos y las muestras alcancen la temperatura ambiente (20-25°C) antes del uso. Agitar suavemente el reactivo antes del uso. Devolver a 2-8°C inmediatamente después del uso. La actividad enzimática del conjugado 2 puede verse afectada por el polvo y sustancias químicas reactivas como hipoclorito de sodio, ácidos, álcalis, etc. No realizar el ensayo en presencia de estas sustancias. Es muy importante mantener la solución de sustrato-TMB en un recipiente bien cerrado para evitar la exposición a la luz. Los jabones y/o agentes oxidantes que queden en el recipiente utilizado para la solución de sustrato-TMB pueden interferir con la reacción. Si se utilizan recipientes de vidrio o de plástico reutilizados, deberán lavarse con ácido sulfúrico o clorhídrico 1 N, aclararse bien con agua destilada y secarse antes del uso. Recomendamos utilizar recipientes de plástico desechables. Conservación y estabilidad Los componentes permanecerán estables hasta la fecha de caducidad indicada en la etiqueta si se conservan a 2-8°C. La bolsa con la microplaca deberá llevarse a temperatura ambiente antes de su apertura para evitar condensación en los pocillos. Una vez abierta la bolsa, los pocillos de la microplaca permanecerán estables durante 3 meses a 2-8°C en la bolsa de plástico herméticamente cerrada con gel de sílice. Desechar las microplacas cerradas sin el gel de sílice. Una vez diluida, la solución de lavado permanece estable durante 6 días solo si se conserva a 2-8°C. No utilizar soluciones de lavado diluidas si se conservan durante toda la noche a temperatura ambiente. Una vez diluido, el conjugado 2 permanece estable durante 30 días a 2-8°C. Conservar la solución de sustrato-TMB a oscuras. Presentaciones disponibles Kit de 1 microplaca (1x96 tests), REF 3000-1172. Contiene: 1 microplaca, 1 x 2 mL de control negativo, 1 x 2 mL de control positivo para HIV-1, 1 x 2 mL de control positivo para HIV-2, 1 x 2 mL de control positivo para p24 de HIV-1, 1 x 14 mL de diluyente de muestras, 1 x 25 mL de conjugado 1 listo para usar, 1 x 0,250 mL de conjugado concentrado 2 (101x), 1 x 25 mL de diluyente de conjugado 2, 1 x 20 mL de sustrato-TMB, 1 x 12 mL de solución de parada, 2 x 50 mL de solución de lavado concentrada, 1 bolsa de plástico y láminas adhesivas. - Kit de 5 microplacas (5 x 96 tests), REF 3000-1173. Contiene: 5 microplacas, 1 x 4 mL de control negativo, 1 x 4 mL de control positivo para HIV-1, 1 x 4 mL de control positivo para HIV-2, 1 x 4 mL de control positivo para p24 de HIV-1, 1 x 70 mL de diluyente de muestras, 1 x 120 mL de conjugado 1 listo para usar, 1 x 1,2 mL de conjugado concentrado 2 (101x), 1 x 120 mL de diluyente de conjugado 2, 1 x 100 mL de sustrato-TMB, 1 x 60 mL de solución de parada, 3 x 100 mL de solución de lavado concentrada, 1 bolsa de plástico y láminas adhesivas. Material necesario no proporcionado Agua destilada o desionizada. Guantes desechables y temporizador. Recipientes de desechos adecuados para materiales potencialmente contaminados. Cubetas en forma de V desechables. Sistema de aplicación y/o pipeta (de uno o varios canales) y puntas de pipeta desechables. Paño absorbente o toallita limpiadora. BIOKIT, S.A. - Can Malé s/n - 08186 Lliçà d’Amunt - Barcelona - SPAIN 3000-1172_R01_02.2015_spa.docx 0843 13 bioelisa - Incubadora de baño seco o baño con agua, 37 ± 1°C. Lector de microplacas con filtro de 450 nm. Se recomiendan filtros de referencia de 620 o 630 nm. Sistema de lavado manual o automático. Recolección de muestras Utilizar suero reciente con o sin tubo separador del suero (SST), plasma con EDTA, plasma con ácido-citratodextrosa (ACD), plasma con heparina de litio, plasma con heparina de sodio, plasma con citrato de sodio, plasma con oxalato de potasio/fluoruro de sodio y plasma con CPD y CPDA. Otros anticoagulantes deben ser comprobados antes del uso. Las muestras pueden conservarse entre 2-8°C durante 8 días. Para periodos más prolongados, las muestras deberán congelarse (-20°C). Evitar congelar y descongelar de forma repetida (máximo de 4 ciclos de congelado y descongelado). Las partículas en suspensión deben eliminarse por centrifugación. Las muestras de suero o plasma no deben inactivarse por calor, ya que podrían dar lugar a resultados incorrectos. Procesamiento automático Puede utilizarse un ensayo automático o semiautomático con diferentes instrumentos. Es muy importante validar los sistemas automáticos para demostrar que los resultados obtenidos para las muestras son equivalentes a los obtenidos mediante el ensayo manual. Se recomienda que los usuarios validen el instrumento de forma periódica. En caso de dificultad en la programación y configuración de los procesadores automáticos de Biokit, contacte con el distribuidor. PROCEDIMIENTO Operaciones previas Dejar que todos los reactivos alcancen la temperatura ambiente (20-25°C) antes de ejecutar el ensayo. Mezclar suavemente todos los reactivos líquidos antes del uso. Comprobar el concentrado de solución de lavado para detectar cristales de sales. Si se han formado cristales, calentar a 37°C para resolubilizar hasta que se disuelvan los cristales. Utilizar agua destilada o desionizada. Los controles negativos y positivos deben tratarse como las muestras. Diluir la solución de lavado en 1:25 en agua destilada. Si se utiliza toda la placa, añadir 40 mL de solución de lavado concentrada (25x) a 960 mL de agua desionizada. Si no se utiliza toda la placa, preparar el volumen de solución proporcional. Diluir el conjugado concentrado 2 en 1:101 con el diluyente de conjugado 2 de acuerdo con la tabla 1. Para el envase de 1 placa, si va a utilizarse toda la placa, añadir 250 µL de conjugado concentrado directamente al frasco que contiene 25 mL de diluyente de conjugado. Mezclar suavemente. TABLA 1 Tiras necesarias Diluyente de conjugado 2 Conjugado concentrado 2 mL µL 1 2,0 20 2 4,0 40 4 8,0 80 6 12,0 120 8 16,0 160 10 20,0 200 12 25,0 250 Realización de la prueba 1. Utilizar solo el número de tiras necesarias para la prueba. Reservar 7 pocillos para blancos y controles. Un pocillo como blanco (p. ej., A1), tres pocillos como control negativo (p. ej., B1, C1, D1) y, al menos, un pocillo de cada uno de los controles positivos: control positivo para HIV-1 (p. ej., E1), control positivo para HIV-2 (p. ej., F1) y control positivo para p24 del HIV (p. ej., G1). 2. Añadir 100 µL de diluyente de muestras a todos los pocillos excepto el blanco. 3. Añadir primero 100 μL de muestras y, por último, 100 μL de control negativo y de cada uno de los controles positivos a sus pocillos correspondientes. 4. Cubrir la placa con una lámina adhesiva, mezclar suavemente e incubar a 37°C ± 1°C durante 60 minutos con un intervalo de tolerancia de 58-65 minutos 5. Retirar y desechar la lámina adhesiva. Aspirar el contenido de los pocillos y llenarlos totalmente (aproximadamente 350 µL) con la solución de lavado diluida. Repetir el proceso de aspiración y lavado 4 veces más, 5 (cinco) ciclos en total. Asegurarse de que cada columna de pocillos se sumerge durante al menos 15 segundos antes del siguiente ciclo de aspiración. BIOKIT, S.A. - Can Malé s/n - 08186 Lliçà d’Amunt - Barcelona - SPAIN 3000-1172_R01_02.2015_spa.docx 0843 14 bioelisa 6. Transferir 200 µL de conjugado 1 a cada pocillo, excepto el reservado para el blanco de sustrato. Evitar la formación de burbujas durante la adición. 7. Cubrir la microplaca con una lámina adhesiva e incubar a 37°C ± 1°C durante 30 minutos con un intervalo de tolerancia de 28-35 minutos. 8. Retirar y desechar la lámina adhesiva. Aspirar y lavar los pocillos como en la fase de lavado anterior durante 3 (tres) ciclos de lavado. 9. Transferir 200 µL de conjugado de trabajo 2 a cada pocillo, excepto el reservado para el blanco de sustrato. Evitar la formación de burbujas durante la adición. 10. Cubrir la microplaca con una lámina adhesiva e incubar a 37°C ± 1°C durante 30 minutos con un intervalo de tolerancia de 28-35 minutos. 11. Retirar y desechar la lámina adhesiva. Aspirar y lavar los pocillos como en la fase 5 durante 5 (cinco) ciclos de lavado. 12. Añadir 150 µL de solución de sustrato-TMB a cada pocillo, incluido el blanco. 13. Incubar a temperatura ambiente (20-25°C) durante 30 minutos con un intervalo de tolerancia de 2835 minutos, protegido de la exposición a la luz directa. 14. Detener la reacción mediante adición de 100 µL de solución de parada en la misma secuencia e intervalos temporales que para el sustrato-TMB. 15. Poner a cero el lector a 450 nm con el pocillo de blanco y leer la absorbancia de cada pocillo en un plazo máximo de 30 minutos. Se recomienda leer en modo bicromático mediante un filtro de referencia de 620 630 nm. Control de calidad Los resultados de un ensayo son válidos si se cumplen los siguientes criterios: 1. El valor de absorbancia del pocillo de blanco debe ser ≤ 0,100. 2. El valor de absorbancia de los controles positivos debe ser ≥ 0,900 después de sustraer el blanco. De lo contrario, deberá repetirse el ensayo. 3. Cada valor de absorbancia individual del control negativo debe ser ≤ 0,120 después de sustraer el blanco. Si uno de los valores del control negativo no cumple los criterios de control de calidad, deberá desecharse y deberá volver a calcularse el valor medio con los dos valores restantes. Si dos o más valores de absorbancia del control negativo no cumplen las especificaciones del intervalo del control de calidad, la prueba no será válida y deberá volver a repetirse. Resultados 1. Sustraer el blanco de cada uno de los controles negativos válidos. Calcular la absorbancia media del control negativo (CNx). Calcular el valor umbral mediante adición de 0,170 a la absorbancia media del control negativo. Valor umbral = CNx + 0,170 Ejemplo: CNx = 0,011 2. valor umbral = 0,011 + 0,170 = 0,181 Dividir la absorbancia de la muestra entre el valor de corte. Positivo: Negativo: Dudoso: cociente de absorbancia/valor umbral ≥ 1,0 cociente de absorbancia/valor umbral < 0,9 cociente de absorbancia/valor umbral ≥ 0,9 < 1,0 Interpretación de resultados Resultados negativos: Las muestras con un cociente de absorbancia/valor umbral inferior a 0,9 se consideran no reactivas, lo que indica que no se han detectado anticuerpos frente al HIV 1 y/o HIV-2 o antígeno p24 de HIV con el kit bioelisa HIV-1+2 Ag/Ab. BIOKIT, S.A. - Can Malé s/n - 08186 Lliçà d’Amunt - Barcelona - SPAIN 3000-1172_R01_02.2015_spa.docx 0843 15 bioelisa Resultados positivos: Las muestras con una absorbancia igual o superior al valor umbral se consideran inicialmente reactivas, lo que indica que probablemente se hayan detectado anticuerpos frente al HIV 1/2 o antígenos p24 del HIV mediante bioelisa HIV-1+2 Ag/Ab. Todas las muestras inicialmente reactivas deberán volver a evaluarse por duplicado para confirmar el resultado inicial. Dudoso: Las muestras con un cociente de absorbancia/valor umbral entre 0,9 y 1,0 se consideran dudosas y se precisa volver a analizar estas muestras por duplicado para confirmar los resultados iniciales. - Si, después de volver a analizar las muestras inicialmente reactivas, ambos pocillos indican resultados negativos (S/CO < 0,9), estas muestras deberán considerarse positivas no reproducibles (o falsas positivas) y registrarse como negativas. - Si, después del segundo análisis por duplicado, uno o más pocillos indican resultados positivos, el resultado final de esta prueba ELISA deberá registrarse como reiteradamente reactiva. Las muestras reiteradamente reactivas pueden considerarse positivas para anticuerpos frente al HIV 1/2 o antígeno p24, por lo que el paciente probablemente esté infectado por el HIV1 o HIV2. - Después del segundo análisis por duplicado, las muestras con valores cercanos al valor umbral deberán interpretarse con precaución y considerarse dudosas, o no interpretables en el momento de análisis. - Se precisa seguimiento, confirmación y análisis complementarios de todas las muestras positivas con otro sistema analítico (p. ej., inmunotransferencia, PCR). El diagnóstico clínico no debería establecerse basándose en un solo resultado analítico. Deberá integrar datos clínicos y otros datos y resultados analíticos. Limitaciones del procedimiento - Un rendimiento óptimo del ensayo requiere un cumplimiento estricto del procedimiento analítico descrito. La desviación del procedimiento puede dar lugar a resultados aberrantes. - Como en todos los inmunoensayos sensibles, existe la posibilidad de obtener resultados positivos no reproducibles. - Los resultados positivos deben confirmarse con otro método disponible e interpretarse en combinación con la información clínica del paciente. - Los resultados negativos obtenidos con bioelisa HIV-1+2 Ag/Ab se consideran negativos para anticuerpos frente al HIV-1/2 y antígeno p24 y no precisan análisis adicionales. - La prevalencia del marcador afectará a los valores predictivos del ensayo. - Este ensayo no puede utilizarse para analizar el plasma agrupado (mezclado). bioelisa HIV-1+2 Ag/Ab se ha evaluado solo con muestras de suero o plasma individuales. - bioelisa HIV-1+2 Ag/Ab es un ensayo cualitativo y los resultados no pueden utilizarse para medir las concentraciones de anticuerpos frente al HIV o de antígeno p24. En este ensayo no puede distinguirse entre infecciones por HIV-1 y HIV-2. - Un resultado negativo no excluye la posibilidad de exposición o infección por HIV. Resultados esperados El número de resultados positivos depende de la incidencia de la enfermedad en el área geográfica y el tipo de población evaluada. A nivel mundial, la incidencia de HIV en personas mayores de 15 años oscila entre el 0,1% en Australia, Nueva Zelanda y Asia Pacífico, el 0,3% en Europa Occidental, norte de África y Oriente Medio, el 0,5% en el este de Europa, Asia Central y Latinoamérica, el 0,6% en Norteamérica y el sur de Asia y el 9% en el África subsahariana. En el mismo país, la incidencia también varía considerablemente en función de la población evaluada. En Europa Occidental, la prevalencia de anticuerpos frente al HIV en donaciones a bancos de sangre oscila entre 0 y 5 casos por 100.000 donaciones, mientras que la incidencia entre presos, profesionales del sexo y toxicómanos puede alcanzar fácilmente el 20% en estas poblaciones de riesgo. Características funcionales Sensibilidad analítica Se ha calculado que el límite de detección es inferior a 0,5 UI/mL mediante el análisis del antígeno p24 del HIV de la OMS, primer estándar internacional de referencia del NIBSC 90/636 con dos lotes diferentes durante la evaluación interna. Además, también se ha determinado que el límite de detección es inferior a 12,5 pg/mL mediante el análisis de BIORAD HIV-1 Antigen Standard 72217 con dos lotes diferentes durante la evaluación interna. BIOKIT, S.A. - Can Malé s/n - 08186 Lliçà d’Amunt - Barcelona - SPAIN 3000-1172_R01_02.2015_spa.docx 0843 16 bioelisa Sensibilidad Se evaluó un total de 537 muestras positivas para el HIV-1 con bioelisa HIV 1+2 Ag/Ab, entre las cuales: 28 muestras recientes del mismo día de HIV-1, 85 muestras de HIV-1 y 4 muestras de subtipo O de HIV-1 en un laboratorio de referencia europeo; 380 muestras de HIV-1 se evaluaron en Biokit y 40 muestras de subtipo diferente de B de HIV-1 (y al menos 3 muestras de cada subtipo de HIV-1) se evaluaron en otro laboratorio de referencia europeo. bioelisa HIV 1+2 Ag/Ab detectó las 537 muestras. La sensibilidad fue del 100% (537/537). - Se evaluó un total de 115 muestras positivas para HIV-2 con bioelisa HIV 1+2 Ag/Ab, entre las cuales: 27 muestras de HIV-2 en un laboratorio de referencia europeo y 88 muestras de HIV-2 en Biokit. bioelisa HIV 1+2 Ag/Ab detectó las 115 muestras. La sensibilidad fue del 100% (115/115). - También se evaluó un total de 61 muestras positivas para Ag p24 del HIV-1 con bioelisa HIV 1+2 Ag/Ab, entre las cuales: 15 muestras en un laboratorio de referencia europeo, 16 muestras en otro laboratorio de referencia europeo y 30 muestras en Biokit. bioelisa HIV 1+2 Ag/Ab detectó las 61 muestras. La sensibilidad fue del 100% (61/61). - Se llevaron a cabo otros estudios de sensibilidad mediante análisis de un total de 31 paneles de seroconversión en Biokit y un laboratorio de referencia europeo. Los resultados obtenidos fueron comparables a los del método comercial más sensible para la detección de antígenos y anticuerpos de HIV 1+2. - Se evaluaron 16 paneles de seroconversión del HIV de BBI/Seracare y Zeptometrix en Biokit. bioelisa HIV-1+2 Ag/Ab identificó correctamente todas las muestras positivas. Panel de seroconversión BB1-PRB965-n=6 ZEPT-12007-n=9 BBI-PRB954-n=7 BBI-PRB932-n=9 ZEPT-9017-n=11 ZEPT-9014-n=7 ZEPT-9012-n=8 ZEPT-9032-n=14 ZEPT-6243-n=10 ZEPT-9022-n=9 ZEPT-9018-n=11 BBI-PRB939-n=9 BBI-PRB956-n=5 BBI-PRB945-n=6 BBI-PRB955-n=4 BBI-PRB958-n=6 bioelisa HIV Ag/Ab 2 4 6 4 1 1 5 8 7 7 9 6 4 3 2 3 Ensayo HIV Antígeno p24 Ensayo HIV Ab Ag/Ab del HIV Primera muestra detectada positiva en el panel 2 4 2 4 5 ND 6 7 6 ND 4 4 4 3 1 1 3 1 6 7 5 8 7 8 7 8 7 8 9 7 9 10 9 ND 8 6 4 5 4 4 4 3 2 4 2 3 5 3 NAT 1 4 4 4 1 1 1 1 1 1 1 5 2 1 1 1 - En la tabla anterior puede observarse la primera muestra detectada como positiva en cada panel evaluado con bioelisa HIV-1+2 Ag/Ab frente a ensayos de cuarta generación (ensayos Ag/Ab), ensayos de tercera generación (ensayos Ab), ensayos para antígeno p24 de HIV y ensayos de NAT de ARN del HIV. bioelisa HIV-1+2 Ag/Ab mostró una sensibilidad excelente para detectar antígenos o anticuerpos de forma temprana en 16 paneles de seroconversión de HIV evaluados. - Se llevó a cabo otro estudio para evaluar la sensibilidad en 32 muestras de seroconversión temprana. Las muestras de este tipo se caracterizan por ser positivas a la presencia de Ag p24 del HIV y/o positivas según NAT (análisis del ácido nucleico), no detectadas por ningún método de tercera generación para HIV y negativas o indeterminadas con métodos de inmunotransferencia. bioelisa HIV 1+2 Ag/Ab detectó las 32 muestras. La sensibilidad fue del 100% (32/32). BIOKIT, S.A. - Can Malé s/n - 08186 Lliçà d’Amunt - Barcelona - SPAIN 3000-1172_R01_02.2015_spa.docx 0843 17 bioelisa - Por último, se evaluaron 50 sobrenadantes de cultivo celular de cultivos celulares de HIV, incluidos diferentes subtipos de HIV-1 y HIV-2 en un laboratorio de referencia europeo. bioelisa HIV 1+2 Ag/Ab detectó las 50 muestras. La sensibilidad fue del 100% (50/50). Especificidad La especificidad se evaluó mediante análisis de un total de 6.465 muestras de donantes de sangre aleatorias en tres centros diferentes. - En el primer centro, se analizaron 3.045 muestras aleatorias, que incluían 684 primeros donantes. De este total, 4 muestras fueron reactivas. La especificidad obtenida en este estudio fue del 99,87% (3.041/3.045). - En el segundo centro, se analizaron 500 muestras aleatorias del banco de sangre. Las 500 muestras fueron negativas. La especificidad fue del 100% (500/500). - Se llevó a cabo una evaluación interna de 2.920 muestras aleatorias del banco de sangre. De esta evaluación, 6 muestras fueron reactivas. La especificidad obtenida en este estudio fue del 99,79% (2.914/2.920). En la tabla siguiente se muestra un resumen detallado de estos estudios de especificidad. Evaluación 1 (3.045 sueros) Inicialmente reactivas Reactividad repetida Falso positivo Suero 6 4 4 Especificidad % 99,87 (I.C. 95%: 99.66 - 99.96) Evaluación 2 (500 sueros) Inicialmente reactivas Reactividad repetida Falso positivo Suero 0 0 0 Especificidad % 100 (I.C. 95%: 98.89 - 100) Evaluación interna (1.000 sueros + 1.920 plasmas) Inicialmente reactivas Reactividad repetida Falso positivo - Especificidad % Plasma 8 6 6 99,69 (I.C. 95%: 99.32 - 99.89) Suero 1 0 0 100 (I.C. 95%: 99.44 - 100) Total 9 6 6 99,79 (I.C. 95%: 99.55 - 99.93) Además, se han analizado 200 muestras de pacientes hospitalizados y se han comparado con una prueba de referencia. 194 muestras resultaron negativas mediante las dos pruebas y 6 muestras fueron reactivas. Las 6 muestras también fueron reactivas con otras pruebas de ELISA. En este estudio se obtuvo una especificidad del 100% (194/194). Precisión Reproducibilidad intraensayo: El coeficiente de variación obtenido para los valores de absorbancia de una muestra positiva para HIV-1 evaluada en un mínimo de 40 repeticiones fue del 3,42%, el 5,79% y el 4,71% en los tres lotes estudiados. El coeficiente de variación obtenido para los valores de absorbancia de una muestra positiva para HIV-2 evaluada en un mínimo de 40 repeticiones fue del 6,39%, el 5,91% y el 8,38% en los tres lotes estudiados. El coeficiente de variación obtenido para los valores de absorbancia de una muestra positiva para p24 del HIV-1 evaluada en un mínimo de 40 repeticiones fue del 4,08%, el 3,44% y el 3,71% en los tres lotes estudiados. Reproducibilidad interensayo: Se analizaron 4 muestras positivas de diferentes niveles en 15 ensayos diferentes. Los coeficientes de variación obtenidos para los cocientes de absorbancia/valor umbral de las cuatro muestras fueron del 4,87%, 5,37%, 7,49% y 7,54%. BIOKIT, S.A. - Can Malé s/n - 08186 Lliçà d’Amunt - Barcelona - SPAIN 3000-1172_R01_02.2015_spa.docx 0843 18 bioelisa Interferencias Interferencia por adición No se han observado interferencias para la hemoglobina (500 mg/dL), la bilirrubina (20 mg/dL), la albúmina humana (5 g/dL) y los triglicéridos (500 mg/dL). Reactividad cruzada Para evaluar posibles interferencias, se evaluaron 125 muestras con posible reactividad cruzada. Entre estas muestras, 4 muestras (RF+), 4 muestras positivas para anticuerpos antinucleares (ANA), 5 muestras de mononucleosis, 89 muestras de otras enfermedades infecciosas relacionadas y 23 muestras de mujeres embarazadas. No se observaron signos de reactividad cruzada en las muestras evaluadas. Las 2 muestras de anti-toxoplasma IgM que dieron un resultado positivo también fueron positivas según otros ensayos del HIV. Muestras con posible interferencia = 125 RF (factor reumatoide) ‐ 4 IgG elevadas ‐ 4 ANA (anticuerpos antinucleares) ‐ 4 IgM elevadas ‐ 5 Mononucleosis ‐ 5 HSV 1 IgG (virus Herpes Simplex) ‐ 5 Mujeres embarazadas ‐ 23 (incluidas 7 multíparas) HSV 2 IgG (Herpes Simplex) ‐ 4 Anticuerpos anti‐sífilis ‐ 6 anti‐CMV IgG (Citomegalovirus) ‐ 5 anti‐EBV (virus de Epstein‐Barr) ‐ 3 anti‐CMV IgM (Citomegalovirus) ‐ 7 anti‐Rubella (virus de la rubéola) ‐ 4 anti‐HTLV (virus linfotrópico T humano) ‐ 4 anti‐VZV IgG (virus de la varicela Zoster) ‐ 2 anti‐HCV (virus de la hepatitis C) ‐ 8 anti‐VZV IgM (virus de la varicela Zoster) ‐ 2 anti‐E. coli (Escherichia coli) ‐ 5 anti‐Toxoplasma IgG (T. gondii) ‐ 10 HBsAg (antígeno de la hepatitis B) ‐ 8 anti‐Toxoplasma IgM (T. gondii) ‐ 7 BIOKIT, S.A. - Can Malé s/n - 08186 Lliçà d’Amunt - Barcelona - SPAIN 3000-1172_R01_02.2015_spa.docx 0843 19 bioelisa bioelisa: Guía de resolución de problemas Problema Posibles causas Solución 1. Controles no validados. 1a. Temperatura, hora o pipeteado incorrectos. 1b. Preparación inadecuada de los reactivos, error de dilución, reactivos no mezclados correctamente. 1c. Contaminación cruzada de los controles. Comprobar el procedimiento. Repetir el ensayo. Comprobar el procedimiento. Repetir el ensayo. 1d. Lectura incorrecta del filtro. 1e. Interferencia en la vía óptica. 1f. Se han utilizado componentes de diferentes lotes. 1g. Reactivos caducados. 2. Sin color o solo color claro al final del ensayo. 2a. Uno o más reactivos no se han añadido o se han añadido en una secuencia errónea. 2b. Conjugado inactivo. Dilución errónea del conjugado concentrado 2. Conservación incorrecta. 2c. Microplaca inactiva: Conservación incorrecta. Pipetear cuidadosamente. No intercambiar los tapones. Repetir el ensayo. Comprobar que la longitud de onda del filtro utilizado sea de 450 nm. Si no se utilizan los filtros de referencia de 620630 nm, la absorbancia se incrementa en aproximadamente 0,050. Comprobar el lector. Limpiar o secar la base de la microplaca. Comprobar si hay burbujas. Repetir la lectura. No utilizar componentes de diferentes lotes, ya que están ajustados para cada lote autorizado. Comprobar la fecha de caducidad del kit. Utilizar un kit no caducado. Comprobar el procedimiento. Repetir el ensayo. Comprobar si hay contaminación. Comprobar el procedimiento. Repetir el ensayo. Mantener siempre las tiras no utilizadas en la bolsa bien cerrada, con el desecante dentro. Repetir el ensayo. 2d. Sustrato-TMB inactivo: Utilizar recipientes Conservación incorrecta. desechables o lavar con ácido El recipiente utilizado o etanol y aclarar con agua afecta a la estabilidad del desionizada antes de volver a sustrato-TMB, utilizar. Comprobar el contaminación cruzada procedimiento. Repetir el con la solución de ensayo. parada. 2e. Reactivos demasiado Dejar que los reactivos fríos. alcancen la temperatura ambiente antes del uso. BIOKIT, S.A. - Can Malé s/n - 08186 Lliçà d’Amunt - Barcelona - SPAIN 3000-1172_R01_02.2015_spa.docx 0843 20 bioelisa bioelisa: Guía de resolución de problemas Problema Posibles causas 3. Demasiado color en todos los pocillos de la microplaca. 3a. Solución de sustrato-TMB Comprobar que el sustrato contaminada u oxidada. sea incoloro, desechar si es azul. Utilizar recipientes lavados con ácido o etanol o desechables. Repetir el ensayo. 3b. Reactivos contaminados Comprobar si hay o preparados de forma contaminación: aspecto incorrecta. turbio. Comprobar las diluciones. Repetir el ensayo. 3c. Solución de lavado Comprobar la calidad del contaminada (1x). agua destilada o desionizada utilizada para la dilución. Repetir el ensayo. 3d. Lavado insuficiente o Comprobar el dispositivo de inconsistente: volumen de lavado. Llenar los pocillos con llenado y/o aspiración solución de lavado casi hasta insuficiente o no el tope, aspirar en su uniforme. Número totalidad. Aumentar el insuficiente de ciclos de número de ciclos de lavado. lavado, dispositivo contaminado. 3e. Se ha utilizado una Utilizar solo la solución de solución de lavado de lavado suministrada con el kit. otro fabricante. 4a. Problemas de lavado. Ver 3c, 3d, 3e. 4b. Pipetas no calibradas o Utilizar solo pipetas puntas no colocadas calibradas, con puntas bien correctamente. Pipeteado colocadas y pipetear con incorrecto. cuidado, sin burbujas ni salpicaduras. Repetir el ensayo. 4c. Reactivos demasiado Equilibrar los reactivos a fríos o no mezclados temperatura ambiente y correctamente antes del mezclar bien antes de usar. uso. 4d. Corrientes de aire en la Mantener la microplaca microplaca durante las protegida de las corrientes de incubaciones. aire. 4e. Tiempo de adición de Desarrollar una técnica muestras y/o reactivos uniforme y consistente. demasiado prolongado. Inconsistencia en los intervalos de tiempo. Burbujas de aire. 4f. Interferencia en la vía Ver 1e. óptica. 4. Mala reproducibilidad o número alto de muestras reactivas no repetibles. Solución BIOKIT, S.A. - Can Malé s/n - 08186 Lliçà d’Amunt - Barcelona - SPAIN 3000-1172_R01_02.2015_spa.docx 0843 21 bioelisa HERVORGEHOBENE ÄNDERUNGEN LESEN bioelisa HIV-1+2 Ag/Ab 3000-1172 1 x 96 TESTS 3000-1173 5 x 96 TESTS (480) ELISA-Test zur Erkennung von Antikörpern humaner Immundefizienzviren (HIV) Typ 1 (Gruppe M, O) oder Typ 2 und des HIV-p24-Antigens in menschlichen Serum- oder Plasmaproben in klinischen Laboratorien und als First-Line-Screening-Assay in Blutspendezentren. Zusammenfassung Der serologische Nachweis einer HIV-Infektion kann mithilfe von Tests erbracht werden, die das Vorhandensein von HIV-Antigenen oder Antikörpern im Serum oder Plasma von Personen prüfen, bei denen eine HIV-Infektion vermutet wird. Das Antigen kann in der Regel sowohl während der akuten als auch während der symptomatischen Phase der AIDS-Erkrankung erkannt werden. Die Antikörper für HIV-1 und/oder HIV-2 können nahezu während des gesamten Infektionszeitraums erkannt werden, der mit oder kurz nach der Akutphase beginnt und bis zum Endstadium von AIDS andauert. Der HIV-Assay der vierten Generation ELISA ermöglicht die gleichzeitige Bestimmung von HIV-p24-Antigenen und HIV-1-/HIV-2-Antikörpern. Er reduziert somit das diagnostische Fenster und erlaubt eine frühzeitige Diagnose einer akuten HIV-Infektion. HIV wird neben dem sexuellen Kontakt vor allem bei einer Bluttransfusion übertragen. HIV kann sowohl in zellulären als auch zellfreien Fraktionen des menschlichen Bluts vorhanden sein. Deshalb müssen alle Blut- oder Plasmaspenden hinsichtlich des Risikos der HIV-Übertragung durch kontaminiertes Blut getestet werden. Dies kann effektiv durch das Testen auf HIV-Antikörper und das HIV-p24-Antigen mithilfe des hochempfindlichen ELISA-Tests erfolgen. Prinzip bioelisa HIV-1+2 Ag/Ab ist ein Enzym-Immunassay der vierten Generation für die gleichzeitige Erkennung des HIV p24-Antigens und der HIV-1- (Gruppen M und O) oder HIV-2-Antikörper. Die Vertiefungen von Mikrotiterplatten werden mit Antigenen, die HIV-1 gp41- und HIV-2 gp36-Epitope repräsentieren, zusammen mit monoklonalen Antikörpern gegen HIV p24 beschichtet. Im ersten Schritt des Immunassays werden Serum- oder Plasmaproben zusammen mit dem Probenverdünner, der biotinilierte Anti-p24-Antikörper enthält, in diese Vertiefungen pipettiert. Wenn spezifische HIV-1- und/oder HIV-2-Antikörper in der Probe vorhanden sind, bilden sie stabile Komplexe mit den HIV-Antigenen in den Vertiefungen. Wenn das p24-Antigen in der Probe vorhanden ist, bindet es sich gleichzeitig an die Antikörper in der Vertiefung und an die biotinilierten Antikörper, die im Probenverdünner vorhanden sind. Die Mikrotiterplattenvertiefungen werden dann gewaschen, um ungebundene Serumproteine zu entfernen. Ein Satz biotinilierter Antikörper wird in die Vertiefungen gegeben. Diese Antigene binden sich an die spezifischen gebundenen Antikörper. Nach einem zweiten Waschschritt zur Entfernung eines ungebundenen Konjugats wird ein zweites Streptavidin-HRP-Konjugant in die Vertiefungen pipettiert. In den Vertiefungen, die den „Sandwich“-Immunkomplex enthalten, wird das farblose Chromogen durch das gebundene Konjugat in ein blaues Produkt oxidiert. Die blaue Farbe wird gelb, nachdem die Reaktion mit Schwefelsäure gestoppt wird. Die Farbintensität kann gemessen werden und verhält sich proportional zur Konzentration der Anti-HIV-1/2-Antikörper oder des HIV p24-Antigens, die in der Probe vorhanden sind. Vertiefungen, die negative Proben enthalten, bleiben farblos. Bestandteile 1. MCPL MIKROTITERPLATTE: 12 x 8 Vertiefungen beschichtet mit Antigenen, die Epitope von HIV-1 gp41 und HIV-2 gp36 repräsentieren, und mit monoklonalen Antikörpern gegen p24. Die Platten werden in einem Aluminiumbeutel, der ein Trocknungsmittel enthält, versiegelt. 2. CONTROL + 1 HIV-1-POSITIVKONTROLLE: Verdünntes Humanserum, das HIV-1-Antikörper (hitzeinaktiviert) enthält. Enthält 0,1 % ProClinTM 300 als Konservierungsmittel. Gebrauchsfertig. 3. CONTROL + 2 HIV-2-POSITIVKONTROLLE: Verdünntes Humanserum, das HIV-2-Antikörper (hitzeinaktiviert) enthält. Enthält 0,1 % ProClinTM 300 als Konservierungsmittel. Gebrauchsfertig. 4. CONTROL + Ag HIV-POSITIVKONTROLLE p24: Verdünntes Humanserum, mit zugesetztem rekombinantem HIV-1 p24-Antigen. Enthält 0,1 % ProClinTM 300 als Konservierungsmittel. Gebrauchsfertig 5. CONTROL – NEGATIVKONTROLLE: Verdünntes Humanserum, negativ auf HIV-1/2 und HIV p24-Antigen. Enthält 0,1 % ProClinTM 300 als Konservierungsmittel. Gebrauchsfertig. BIOKIT, S.A. - Can Malé s/n - 08186 Lliçà d’Amunt - Barcelona - SPAIN 3000-1172_R01_02.2015_ger.docx 0843 22 bioelisa 6. DIL SAMP PROBENVERDÜNNER: Biotinilierte monoklonale Antikörper gegen HIV p24, verdünnt im Tris-Puffer. Enthält 0,05 % ProClinTM 300 als Konservierungsmittel und roten Farbstoff. Gebrauchsfertig. 7. CONJ 1 GEBRAUCHSFERTIGES KONJUGAT 1: Phosphatpuffer mit biotinilierten HIV-1- und HIV-2-Antigenen. Enthält 0,05 % ProClinTM 300 als Konservierungsmittel und blauen Farbstoff. Gebrauchsfertig. 8. DIL CONJ 2 KONJUGATVERDÜNNER 2: Phosphatpuffer mit Proteinstabilisatoren, 0,05 % ProClinTM 300 als Konservierungsmittel und gelbem Farbstoff. 9. CONJ 2 101X KONZENTRATKONJUGAT 2 (101X): Enthält Peroxidase-konjugiertes Streptavidin. Vor der Anwendung 1:101 in Konjugatverdünner 2 verdünnen. 10. SUBS TMB SUBSTRAT-TMB: Enthält 3,3', 5,5'-Tetramethylbenzidin (TMB) und Wasserstoffperoxid. Gebrauchsfertig. 11. WASH SOLN 25x KONZENTRAT WASCHLÖSUNG: Konzentrat-PBS-Puffer pH 7,4 (25x). Enthält Tween-20 als Waschmittel, < 0,2 % ProClinTM 300 als Konservierungsmittel. Vor der Anwendung 1:25 in destilliertem oder deionisiertem Wasser verdünnen. 12. H2SO4 0.8N STOPPLÖSUNG: 0,8 N Schwefelsäure. Gebrauchsfertig. 13. SEALS HAFTFOLIE: Zur Abdeckung der Mikrotiterplatte während der Inkubationen. 14. BAG WIEDERVERSCHLIESSBARER BEUTEL: Zur Aufbewahrung nicht genutzter Streifen. Vorsichtsmaßnahmen bioelisa HIV-1+2 Ag/Ab ist zur diagnostischen IN VITRO-Anwendung bestimmt. Ausschließlich für den Gebrauch durch Fachpersonal. WARNUNG: Die Negativkontrolle, HIV-1-Positivkontrolle, HIV-2-Positivkontrolle, HIV p24-Positivkontrolle, der Probenverdünner, das Konjugat 1, der Konjugatverdünner 2 und die konzentrierte Waschlösung enthalten < 0,2 % ProClinTM 300 als Konservierungsmittel. Gefahrenhinweise H317: Kann allergische Hautreaktionen verursachen. Sicherheitshinweise P280: Schutzhandschuhe / Schutzkleidung / Augenschutz / Gesichtsschutz tragen. P302+P352: BEI KONTAKT MIT DER HAUT: Mit viel Wasser und Seife waschen. P333+P313: Bei Hautreizung oder -ausschlag: Ärztlichen Rat einholen/ärztliche Hilfe hinzuziehen. P363: Kontaminierte Kleidung vor erneutem Tragen waschen. P501: Inhalt/Behälter gemäß den lokalen/regionalen/nationalen/internationalen Vorschriften entsorgen. WARNUNG: BIOGEFÄHRDENDES MATERIAL. Sämtliches menschliches Ausgangsmaterial, das bei der Herstellung dieses Produkts verwendet wurde, wurde mithilfe einer handelsüblichen, zugelassenen Methode negativ auf HCV-Antikörper, Treponema pallidumAntikörper, Hepatitis B-Oberflächenantigen und HIV 1/2-Antikörper getestet (mit Ausnahme der Positivkontrollen 1 und 2). Es gibt jedoch keine Analysemethode, die garantieren kann, dass die Proben oder Reagenzien keinerlei infektiöse Agenzien enthalten, weshalb dieses Produkt mit äußerster Vorsicht gehandhabt werden muss: - Kontakt der Reagenzien mit Augen und Haut vermeiden. Bei Kontakt gründlich mit Wasser ausspülen. Handschuhe tragen. Nicht mit dem Mund pipettieren. Nicht rauchen. BIOKIT, S.A. - Can Malé s/n - 08186 Lliçà d’Amunt - Barcelona - SPAIN 3000-1172_R01_02.2015_ger.docx 0843 23 bioelisa - Alle verwendeten Materialien in für biogefährdende Materialien geeigneten Behältern entsorgen. Rückstände von Proben, Kontrollen, aspirierten Reagenzien und Pipettenspitzen müssen vor der Entsorgung in einem eigens für diesen Zweck bestimmten Behälter gesammelt und 1 Stunde lang bei 121°C autoklaviert oder mit 10 % Natriumhypochlorit (Endkonzentration) 30 Minuten lang behandelt werden. (Rückstände, die Säure enthalten, müssen vor dem Zusatz von Natriumhypochlorit neutralisiert werden). Handhabungshinweise: - - - - Wäscher an die verwendete Platte (flacher Boden) anpassen, um sie richtig zu waschen. Keine Reagenzien aus unterschiedlichen Chargen mischen. Reagenzien nicht nach dem Verfalldatum verwenden. Reagenz nicht verwenden, wenn Sie Veränderungen im Aussehen der im Kit enthaltenen Komponenten bemerken. Äußerste Sorgfalt ist geboten, um eine mikrobielle und Kreuzkontaminierung der Reagenzien zu vermeiden. Verwenden Sie für jede Probe und jedes Reagenz eine neue Pipettenspitze. Tauschen Sie Reagenzien nicht aus unterschiedlichen Chargen aus und verwenden Sie keine Reagenzien von anderen handelsüblichen Kits. Die Komponenten des Kits sind genau auf eine optimale Leistung der Tests abgestimmt. ACHTUNG - WICHTIGER SCHRITT: Vor der Anwendung müssen die Reagenzien und Proben auf Raumtemperatur (20-25°C) gebracht werden. Reagenz vor der Anwendung sanft schütteln. Sofort nach der Anwendung bei 2-8°C aufbewahren. Die enzymatische Aktivität des Konjugats 2 kann durch Staub und reaktive chemische Stoffe, wie z. B. Natriumhypochlorit, Säuren, Laugen, usw., beeinträchtigt werden. Führen Sie den Test bei Vorhandensein dieser Stoffe nicht durch. Es ist sehr wichtig, die Substrat-TMB-Lösung in einem gut verschlossenen Behälter vor Licht geschützt aufzubewahren. Seifen und/oder oxidierende Stoffe, die in Behältern verbleiben, die für die Substrat-TMB-Lösung verwendet werden, können die Reaktion beeinträchtigen. Wenn Glasbehälter oder wiederverwendete Kunststoffbehälter verwendet werden, müssen diese vor der Anwendung mit 1N Schwefel- oder Salzsäure gewaschen, gut mit destilliertem Wasser gespült und getrocknet werden. Wir empfehlen die Verwendung von Einwegbehältern aus Kunststoff. Lagerung und Stabilität Die Komponenten bleiben bis zum auf dem Etikett angegebenen Verfalldatum stabil, wenn sie bei 2-8°C aufbewahrt werden. Der Beutel mit der Mikrotiterplatte muss vor dem Öffnen auf Raumtemperatur gebracht werden, um eine Kondensation in den Vertiefungen zu vermeiden. Nach Öffnen des Beutels sind die Vertiefungen der Mikrotiterplatte 3 Monate lang bei 2-8°C im fest mit Silikagel verschlossenen Kunststoffbeutel stabil. Entsorgen Sie Mikrotiterplatten, die ohne Silikagel verschlossen wurden. Nach der Verdünnung ist die Waschlösung 6 Tage lang nur dann stabil, wenn sie bei 2-8°C aufbewahrt wird. Verwenden Sie keine verdünnten Waschlösungen, wenn sie über Nacht bei Raumtemperatur aufbewahrt wurden. Nach der Verdünnung ist das Konjugat 2 30 Tage lang bei 2-8°C stabil. Bewahren Sie die Substrat-TMB-Lösung im Dunkeln auf. Packungsgrößen Kit mit 1 Mikrotiterplatte (1 x 96 Tests), REF 3000-1172. Enthält: 1 Mikrotiterplatte, 1 x 2 mL Negativkontrolle, 1 x 2 mL HIV-1-Positivkontrolle, 1 x 2 mL HIV-2Positivkontrolle, 1 x 2 mL HIV-1 p24-Positivkontrolle, 1 x 14 mL Probenverdünner, 1 x 25 mL gebrauchsfertiges Konjugat 1,1 x 0,250 mL Konzentratkonjugat 2 (101x), 1 x 25 mL Konjugat 2-Verdünner, 1 x 20 mL Substrat-TMB, 1 x 12 mL Stopplösung, 2 x 50 mL Konzentrat Waschlösung, 1 wiederverschliessbarer beutel und Haftfolie. - Kit mit 5 Mikrotiterplatten (5 x 96 Tests), REF 3000-1173. Enthält: 5 Mikrotiterplatten, 1 x 4 mL Negativkontrolle, 1 x 4 mL HIV-1-Positivkontrolle, 1 x 4 mL HIV-2Positivkontrolle, 1 x 4 mL HIV-1 p24-Positivkontrolle, 1 x 70 mL Probenverdünner, 1 x 120 mL gebrauchsfertiges Konjugat 1,1 x 1,2 mL Konzentratkonjugat 2 (101x), 1 x 120 mL Konjugat 2-Verdünner, 1 x 100 mL Substrat-TMB, 1 x 60 mL Stopplösung, 3 x 100 mL Konzentrat Waschlösung, 1 wiederverschliessbarer beutel und Haftfolie. Erforderliches, nicht mitgeliefertes Material Destilliertes oder deionisiertes Wasser. Einweghandschuhe und Timer. Geeignete Abfallbehälter für potenziell kontaminierte Materialien. BIOKIT, S.A. - Can Malé s/n - 08186 Lliçà d’Amunt - Barcelona - SPAIN 3000-1172_R01_02.2015_ger.docx 0843 24 bioelisa - V-förmige Einmalwannen. Abgabesystem und/oder Pipette (Einfach- oder Mehrkanal) und Einweg-Pipettenspitzen. Absorbierende Papiertücher oder sauberes Handtuch. Brutschrank oder Wasserbad, 37 ± 1°C. Mikrotiterplatten-Lesegerät mit 450-nm-Filter. Es wird ein Referenzfilter von 620 nm oder 630 nm empfohlen. Manuelles oder automatisches Waschsystem. Probenmaterial Verwenden Sie frisches Serum mit oder ohne Serum-Trennröhrchen (SST), EDTA-Plasma, Acid-Citrate-Dextrose(ACD)-Plasma, Lithium-Heparin-Plasma, Natrium-Heparin-Plasma, Natrium-Citrate-Plasma, Kaliumoxalat/Natriumfluorid-Plasma, CPD- und CPDA-Plasma. Andere Antikoagulanzien müssen vor Anwendung geprüft werden. Die Proben können 8 Tage lang bei 2-8°C gelagert werden. Wenn sie länger gelagert werden, müssen sie eingefroren werden (-20°C). Vermeiden Sie wiederholtes Einfrieren und Auftauen (maximal 4 Einfrier-AuftauZyklen). Proben, die sichtbare Partikel aufweisen, müssen durch Zentrifugieren geklärt werden. Serum- oder Plasmaproben dürfen nicht hitzeinaktiviert werden, da dies die Ergebnisse verfälschen kann. Automatische Verarbeitung Ein automatischer oder halbautomatischer Assay kann mit unterschiedlichen Instrumenten verwendet werden. Es ist besonders wichtig, bei automatischen Systemen nachzuprüfen, ob die für die Proben erzielten Ergebnisse den Ergebnissen manueller Assays entsprechen. Es wird empfohlen, dass die Anwender das Instrument regelmäßig überprüfen. Wenn es Schwierigkeiten bei der Programmierung und Einrichtung der automatischen Biokit-Prozessoren gibt, wenden Sie sich bitte an Ihren Händler. DURCHFÜHRUNG Vorbereitungen Vor der Testdurchführung müssen die Reagenzien Raumtemperatur (20-25°C) erreicht haben. Vermischen Sie vor der Anwendung vorsichtig alle flüssigen Reagenzien. Kontrollieren Sie das Waschlösungskonzentrat auf das Vorhandensein von Salzkristallen. Wenn sich Kristalle gebildet haben, lösen Sie sie erneut bei 37°C, bis sich die Kristalle auflösen. Verwenden Sie destilliertes oder deionisiertes Wasser. Die Negativ- und Positivkontrollen müssen wie die Proben behandelt werden. Verdünnen Sie die Waschlösung im Verhältnis 1:25 in destilliertem Wasser. Wenn die gesamte Platte verwendet wird, geben Sie 40 mL der konzentrierten Waschlösung (25x) auf 960 mL deionisiertes Wasser hinzu. Wenn nicht die gesamte Platte verwendet wird, bereiten Sie das verhältnismäßige Lösungsvolumen auf. Verdünnen Sie das konzentrierte Konjugat 2 im Verhältnis 1:101 mit dem Konjugatverdünner 2 gemäß Tabelle 1. Bei der Verpackung mit 1 Platte geben Sie, wenn die gesamte Platte verwendet wird, 250 µL des konzentrierten Konjugats direkt in die Falsche mit den 25 mL des Konjugatverdünners. Sanft vermischen. TABELLE 1 Erforderliche Streifen Konjugatverdünner 2 Konzentriertes Konjugat 2 mL µL 1 2,0 20 2 4,0 40 4 8,0 80 6 12,0 120 8 16,0 160 10 20,0 200 12 25,0 250 Testverfahren 1. Verwenden Sie nur so viele Streifen, wie für den Test benötigt werden. Lassen Sie 7 Vertiefungen für Blindproben und Kontrollen frei: eine Vertiefung als Blindprobe (z. B. A1), drei Vertiefungen als Negativkontrolle (z. B. B1, C1, D1) und mindestens eine Vertiefung jeweils für die Positivkontrollen: Positivkontrolle HIV-1 (z. B. E1), Positivkontrolle HIV-2 (z. B. F1) und Positivkontrolle HIV p24 (z. B. G1). 2. Geben Sie 100 µL Probenverdünner in alle Vertiefungen mit Ausnahme der Blindproben. 3. Geben Sie zuerst 100 μL der Proben und zuletzt 100 μL der Negativ- und Positivkontrollen in ihre jeweiligen Vertiefungen. 4. Bedecken Sie eine Platte mit einem Haftfolie, mischen Sie vorsichtig und inkubieren Sie bei 37°C ± 1°C 60 Minuten lang mit einem Toleranzbereich von 58 – 65 Minuten. BIOKIT, S.A. - Can Malé s/n - 08186 Lliçà d’Amunt - Barcelona - SPAIN 3000-1172_R01_02.2015_ger.docx 0843 25 bioelisa 5. Entfernen und entsorgen Sie das Haftfolie. Aspirieren Sie den Inhalt der Vertiefungen und füllen Sie sie vollständig (ungefähr 350 µL) mit verdünnter Waschlösung. Wiederholen Sie den Aspirations- und Waschvorgang 4 Mal 5 (fünf) Zyklen insgesamt. Stellen Sie sicher, dass jede Spalte mit Vertiefungen mindestens 15 Sekunden lang eingeweicht wird, bevor Sie den nächsten Aspirationszyklus starten. 6. Übertragen Sie 200 µL des Konjugats 1 in jede Vertiefung, nur nicht in die Vertiefung, die für die Substrat-Blindprobe bestimmt ist. Achten Sie darauf, dass beim Zusetzen keine Blasen entstehen. 7. Bedecken Sie eine Mikrotiterplatte mit einem Haftfolie und inkubieren Sie bei 37°C ± 1°C 30 Minuten lang mit einem Toleranzbereich von 28 – 35 Minuten. 8. Entfernen und entsorgen Sie das Haftfolie. Aspirieren und waschen Sie die Vertiefungen wie im vorherigen Waschschritt fürl 3 (drei) Waschzyklen. 9. Übertragen Sie 200 µL des Gebrauchskonjugats 2 in jede Vertiefung, außer in die Vertiefung, die für die Substrat-Blindprobe bestimmt ist. Achten Sie darauf, dass beim Zusetzen keine Blasen entstehen. 10. Bedecken Sie eine Mikrotiterplatte mit einem Haftfolie und inkubieren Sie bei 37°C ± 1°C 30 Minuten lang mit einem Toleranzbereich von 28 – 35 Minuten. 11. Entfernen und entsorgen Sie das Haftfolie. Aspirieren und waschen Sie die Vertiefungen wie in Schritt 5 für 5 (fünf) Waschzyklen. 12. Geben Sie 150 µL der Substrat-TMB-Lösung in jede Vertiefung, auch in die Vertiefung für die Blindprobe. 13. Inkubieren Sie bei Raumtemperatur (20-25°C) 30 Minuten lang mit einem Toleranzbereich von 28 – 35 Minuten. Vor direkter Lichteinstrahlung schützen. 14. Stoppen Sie die Reaktion durch Zugabe von 100 µL Stopplösung in der gleichen Reihenfolge und in den gleichen Zeitintervallen wie beim Substrat-TMB. 15. Führen Sie eine Blindmessung bei 450 nm mit der Blindvertiefung durch und lesen Sie die Absorption jeder Vertiefung innerhalb von 30 Minuten ab. Es wird empfohlen, im bichromatischen Modus mit einem Referenzfilter von 620 - 630 nm abzulesen. Qualitätskontrolle Die Ergebnisse eines Tests sind gültig, wenn die folgenden Kriterien erfüllt werden: 1. Der Absorptionswert der Blindvertiefung muss bei ≤ 0,100 liegen. 2. Der Absorptionswert der Positivkontrollen muss nach Abzug des Blindwerts bei ≥ 0,900 liegen. Wenn nicht, muss der Durchgang wiederholt werden. 3. Jeder einzelne Absorptionswert der Negativkontrollen muss nach Abzug des Blindwerts bei ≤ 0,120 liegen. Wenn einer der Werte der Negativkontrollen nicht die Kriterien für die Qualitätskontrolle erfüllt, muss er verworfen und der Mittelwert anhand der beiden verbleibenden Werte neu berechnet werden. Wenn zwei oder mehr Absorptionswerte der Negativkontrollen nicht die Bereichskriterien für die Qualitätskontrolle erfüllen, ist der Test ungültig und muss wiederholt werden. Ergebnisse 1. Ziehen Sie den Blindwert von jeder gültigen Negativkontrolle ab. Berechnen Sie den Absorptionsmittelwert der Negativkontrolle (NCx). Berechnen Sie den Schwellenwert durch Addieren von 0,170 zum Absorptionsmittelwert der Negativkontrolle. Schwellenwert = NCx + 0,170 Beispiel: NCx = 0,011 2. Schwellenwert = 0,011 + 0,170 = 0,181 Teilen Sie den Absorptionswert der Probe durch den Schwellenwert. Positiv: Verhältnis von Absorption/Schwellenwert ≥ 1,0 Negativ: Verhältnis von Absorption/Schwellenwert < 0,9 Unbestimmt: Verhältnis von Absorption/Schwellenwert ≥ 0,9 < 1,0 BIOKIT, S.A. - Can Malé s/n - 08186 Lliçà d’Amunt - Barcelona - SPAIN 3000-1172_R01_02.2015_ger.docx 0843 26 bioelisa Interpretation der Ergebnisse Negative Ergebnisse: Proben mit einem Verhältnis von Absorption zu Schwellenwert unter 0,9 gelten als nicht reaktiv, was darauf hindeutet, dass keine Anti-HIV 1- und/oder HIV-2-Antikörper oder kein HIV p24-Antigen mit dem Kit bioelisa HIV-1+2 Ag/Ab erkannt wurden. Positive Ergebnisse: Proben mit einem Absorptionswert gleich oder größer als der Schwellenwert gelten als anfänglich reaktiv, was darauf hindeutet, dass womöglich Anti-HIV 1/2-Antikörper oder das HIV p24-Antigen mit bioelisa HIV-1+2 Ag/Ab erkannt wurden. Alle anfänglich reaktiven Proben müssen zweifach neu getestet werden, um das Anfangsergebnis zu bestätigen. Unbestimmt: Proben mit einem Verhältnis von Absorptionswert zu Schwellenwert von 0,9 und 1,0 gelten als unbestimmt. Sie müssen zweifach neu getestet werden, um die Anfangsergebnisse zu bestätigen. - Wenn nach dem erneuten Testen von anfangs reaktiven Proben beide Vertiefungen negative Ergebnisse zeigen (S/CO < 0,9), müssen diese Proben als nicht wiederholbar positiv (oder falsch-positiv) betrachtet und als negativ vermerkt werden. - Wenn nach dem erneuten zweifachen Testen eine oder beide Vertiefungen positive Ergebnisse zeigen, muss das Endergebnis dieses ELISA-Tests als wiederholt reaktiv vermerkt werden. Wiederholt reaktive Proben können als positiv auf HIV-1/2-Antikörper oder das p24-Antigen betrachtet werden. Daher ist der Patient wahrscheinlich mit HIV1 oder HIV2 infiziert. - Nach dem erneuten zweifachen Testen müssen Proben mit Werten in der Nähe des Schwellenwerts mit Vorsicht interpretiert werden und als unbestimmt oder zum Testzeitpunkt als nicht interpretierbar gelten. - Ein nachfolgender, bestätigender und zusätzlicher Test einer positiven Probe mit einem anderen Analysesystem (z. B. WB, PCR) ist erforderlich. Die klinische Diagnose darf nicht allein anhand eines einzigen Testergebnisses gestellt werden. Sie muss klinische und andere Labordaten und Befunde berücksichtigen. Begrenzung der Methode - Für eine optimale Testdurchführung muss das Testverfahren streng eingehalten werden. Abweichungen vom Verfahren können zu verfälschten Ergebnissen führen. - Wie bei allen sensitiven Immunassays können nicht wiederholbare positive Ergebnisse auftreten. - Positive Ergebnisse müssen mit einer anderen verfügbaren Methode bestätigt und zusammen mit den klinischen Daten des Patienten interpretiert werden. - Negative Ergebnisse, die mit bioelisa HIV-1+2 Ag/Ab erhalten werden, gelten als negativ auf HIV-1/2-Antikörper und das p24-Antigen. Weitere Tests sind nicht erforderlich. - Das Vorhandensein des Markers wirkt sich auf die prädiktiven Werte des Assays aus. - Dieser Test kann nicht verwendet werden, um gepooltes (vermischtes) Plasma zu testen. bioelisa HIV-1+2 Ag/Ab wurde nur mit einzelnen Serum- oder Plasmaproben bewertet. - bioelisa HIV-1+2 Ag/Ab ist ein qualitativer Assay. Die Ergebnisse können nicht herangezogen werden, um Konzentrationen der HIV-Antikörper oder des p24-Antigens zu messen. Dieser Assay kann nicht zwischen Infektionen mit HIV-1 und HIV-2 unterscheiden. - Ein negatives Ergebnis schließt eine HIV-Infektion nicht vollständig aus. Erwartete Ergebnisse Die Anzahl der positiven Ergebnisse hängt von der Verbreitung der Krankheit in der geografischen Region und von der Art der getesteten Population ab. Weltweit variiert die HIV-Verbreitung bei Menschen über 15 Jahren von 0,1 % in Australien, Neuseeland und Asien-Pazifik, 0,3 % in Westeuropa, Nordafrika und im Nahen Osten, 0,5 % in Osteuropa, Zentralasien und Lateinamerika, 0,6 % in Nordamerika und Südasien und 9 % in Schwarzafrika. Im gleichen Land variiert die Verbreitung zudem stark abhängig von der getesteten Population. In Westeuropa reicht die Verbreitung von HIV-Antikörpern in Blutbankspenden von 0 bis 5 Fällen in 100.000 Spenden, während die Verbreitung unter Risikopopulationen wie Häftlingen, Sexarbeitern und Drogenabhängigen leicht 20 % erreichen kann. Charakteristika des Tests Analytische Sensitivität Die Erkennungsgrenze wird auf unter 0,5 IU/mL durch Testen des WHO HIV p24-Antigens, Erste Internationale Referenz NIBSC-Code 90/636 mit zwei unterschiedlichen Chargen während der internen Bewertung geschätzt. Außerdem wird die Erkennungsgrenze auch unter 12,5 pg/mL durch Testen des BIORAD HIV-1-Antigens Standard 72217 mit zwei unterschiedlichen Chargen während der internen Bewertung geschätzt. BIOKIT, S.A. - Can Malé s/n - 08186 Lliçà d’Amunt - Barcelona - SPAIN 3000-1172_R01_02.2015_ger.docx 0843 27 bioelisa Sensitivität Insgesamt 537 HIV-1-positive Proben wurden mit bioelisa HIV 1+2 Ag/Ab bewertet, unter anderem: 28 HIV-1 frische, am gleichen Tag entnommene Proben, 85 HIV-1- und 4 HIV-1-Proben vom Subtyp O in einem europäischen Referenzlabor; 380 HIV -1-Proben wurden bei Biokit und 40 HIV-1-Proben, die nicht vom Subtyp B waren, (und mindestens 3 Proben jedes HIV-1-Subtyps) wurden in einem anderen europäischen Referenzlabor getestet. bioelisa HIV 1+2 Ag/Ab erkannte alle 537 Proben. Die Sensitivität lag bei 100 % (537 von 537 Proben erkannt). - Insgesamt 115 HIV-2-positive Proben wurden mit bioelisa HIV 1+2 Ag/Ab bewertet, unter anderem: 27 HIV-2-Proben in einem europäischen Referenzlabor und 88 HIV-2-Proben wurden bei Biokit bewertet. bioelisa HIV 1+2 Ag/Ab erkannte alle 115 Proben. Die Sensitivität lag bei 100 % (115 von 115 Proben erkannt). - Insgesamt 61 HIV-1-p24-positive Proben wurden mit bioelisa HIV 1+2 Ag/Ab bewertet, unter anderem: 15 Proben in einem europäischen Referenzlabor, 16 Proben wurden in einem anderen europäischen Referenzlabor und 30 Proben bei Biokit bewertet. bioelisa HIV 1+2 Ag/Ab erkannte alle 61 Proben. Die Sensitivität lag bei 100 % (61 von 61 Proben erkannt). - Zusätzliche Sensitivitätsstudien wurden durch Testen von insgesamt 31 Serokonversionspanels bei Biokit und einem europäischen Referenzlabor durchgeführt. Die erzielten Ergebnisse waren vergleichbar mit der sensitivsten handelsüblichen Methode für die Erkennung von HIV 1+2-Antigenen und Antikörpern. - 16 HIV-Serokonversionspanels von BBI/Seracare und Zeptometrix bioelisa HIV-1+2 Ag/Ab erkannte korrekt alle positiven Proben. Serokonversionspanel BB1-PRB965-n=6 ZEPT-12007-n=9 BBI-PRB954-n=7 BBI-PRB932-n=9 ZEPT-9017-n=11 ZEPT-9014-n=7 ZEPT-9012-n=8 ZEPT-9032-n=14 ZEPT-6243-n=10 ZEPT-9022-n=9 ZEPT-9018-n=11 BBI-PRB939-n=9 BBI-PRB956-n=5 BBI-PRB945-n=6 BBI-PRB955-n=4 BBI-PRB958-n=6 bioelisa HIV Ag/Ab 2 4 6 4 1 1 5 8 7 7 9 6 4 3 2 3 wurden bei HIV Ag/AbHIV p24HIV Ab-Assay Assay Antigen Erste Probe im Panel als positiv erkannt 2 4 2 4 5 ND 6 7 6 ND 4 4 4 3 1 1 3 1 6 7 5 8 7 8 7 8 7 8 9 7 9 10 9 ND 8 6 4 5 4 4 4 3 2 4 2 3 5 3 Biokit bewertet. NAT 1 4 4 4 1 1 1 1 1 1 1 5 2 1 1 1 - In der vorstehenden Tabelle ist zu sehen, dass die erste Probe in jedem Panel, das mit bioelisa HIV-1+2 Ag/Ab im Vergleich zu den Assays der 4. Generation (Ag/Ab-Assays), der 3. Generation (Ab-Assays), den HIV p24-Assays und den HIV RNA NAT-Assays bewertet wurde, als positiv erkannt wurde. bioelisa HIV-1+2 Ag/Ab zeigte eine hervorragende Sensitivität, um früh das Antigen oder die Antikörper in 16 bewerteten HIV-Serokonversionpanels zu erkennen. - Eine weitere Studie wurde durchgeführt, um die Sensitivität in 32 frühen Serokonversionsproben zu bewerten. Diese Proben wurden als positiv auf das Vorhandensein von HIV p24 Ag und/oder positiv in NAT (Nukleinsäuretest) getestet. Sie wurden nicht von allen HIV-Methoden der 3. Generation erkannt und als negativ oder unbestimmt von Western-Blot-Methoden eingestuft. bioelisa HIV 1+2 Ag/Ab hat alle 32 Proben erkannt. Die Sensitivität lag bei 100 % (32 von 32 Proben erkannt). BIOKIT, S.A. - Can Malé s/n - 08186 Lliçà d’Amunt - Barcelona - SPAIN 3000-1172_R01_02.2015_ger.docx 0843 28 bioelisa - Abschließend wurden 50 Zellkulturüberstände von HIV-Zellkulturen, einschließlich unterschiedlicher HIV-1-Subtypen und HIV-2, von einem europäischen Referenzlabor bewertet. bioelisa HIV 1+2 Ag/Ab erkannte alle 50 Proben. Die Sensitivität lag bei 100 % (50 von 50 Proben erkannt). Spezifität Die Spezifität wurde durch Testen von insgesamt 6465 nicht ausgewählten Proben von Blutspendern an drei unterschiedlichen Einrichtungen bewertet. - In der ersten Einrichtung wurden 3045 nicht ausgewählte Proben, darunter 684 Erstspender, getestet. Von sämtlichen Proben waren 4 reaktiv. Die in dieser Studie erzielte Spezifität lag bei 99,87 % (3041 von 3045 Proben). - In der zweiten Einrichtung wurden 500 nicht ausgewählte Proben aus der Blutbank getestet. Alle 500 Proben waren negativ. Die Spezifität lag bei 100 % (500 von 500 Proben). - Eine interne Bewertung von 2920 nicht ausgewählten Proben aus der Blutbank wurde durchgeführt. Von sämtlichen Proben waren 6 reaktiv. Die in dieser Studie erzielte Spezifität lag bei 99,79 % (2914 von 2920 Proben). Eine ausführliche Zusammenfassung dieser Spezifitätsstudien ist in der folgenden Tabelle angegeben. Bewertung 1 (3045 Sera) Serum Anfangs reaktiv Wiederholt reaktiv Falsch positiv Spezifität % 6 4 4 99,87 (95% K.I.: 99.66 - 99.96) Bewertung 2 (500 Sera) Serum Anfangs reaktiv Wiederholt reaktiv Falsch positiv Spezifität % 0 0 0 100 (95% K.I.: 98.89 - 100) Interne Bewertung (1000 Sera + 1920 Plasmata) - Anfangs reaktiv Wiederholt reaktiv Falsch positiv Spezifität % Plasma 8 6 6 99,69 (95% K.I.: 99.32 - 99.89) Serum 1 0 0 100 (95% K.I.: 99.44 - 100) Gesamt 9 6 6 99,79 (95% K.I.: 99.55 - 99.93) Außerdem wurden 200 Proben von stationär aufgenommenen Patienten getestet und mit einem Referenztest verglichen. 194 Proben wurden von beiden Tests als negativ und 6 Proben als reaktiv erkannt. Die 6 Proben waren auch mit anderen ELISA-Tests reaktiv. In dieser Studie wurde eine Spezifität von 100 % erzielt (194 von 194 Proben). Präzision Intra-Assay-Reproduzierbarkeit: Der Variationskoeffizient, der für die Absorptionswerte einer HIV-1-positiven Probe, die in mindestens 40 Replikaten analysiert wurde, erzielt wurde, betrug 3,42 %, 5,79 % und 4,71 % in drei untersuchten Chargen. Der Variationskoeffizient, der für die Absorptionswerte einer HIV-2-positiven Probe, die in mindestens 40 Replikaten analysiert wurde, erzielt wurde, betrug 6,39 %, 5,91 % und 8,38 % in drei untersuchten Chargen. Der Variationskoeffizient, der für die Absorptionswerte einer HIV-1-p24-positiven Probe, die in mindestens 40 Replikaten analysiert wurde, erzielt wurde, betrug 4,08 %, 3,44 % und 3,71 % in drei untersuchten Chargen. Inter-Assay-Reproduzierbarkeit: Vier positive Proben unterschiedlicher Konzentrationen wurden in 15 unterschiedlichen Assays getestet. Die für die Absorption-Schwellenwert-Verhältnisse der vier Proben erzielten Variationskoeffizienten waren 4,87 %, 5,37 %, 7,49 % und 7,54 %. BIOKIT, S.A. - Can Malé s/n - 08186 Lliçà d’Amunt - Barcelona - SPAIN 3000-1172_R01_02.2015_ger.docx 0843 29 bioelisa Interferenzen Interferenz durch Addition Es wurden keine Interferenzen für Hämoglobin (500 mg/dl), Bilirubin (20 mg/dl), humanes Albumin (5 g/dl) und Triglyceride (500 mg/dl) gefunden. Kreuzreaktivität Um mögliche Interferenzen zu bewerten, wurden 125 potenzielle kreuzreagierende Proben analysiert. Dabei handelte es sich um 4 Proben (RF+), 4 auf antinukleäre Antikörper (ANA) positive Proben, 5 MononukleoseProben, 89 Proben von anderen verwandten Infektionskrankheiten und 23 Proben von schwangeren Frauen. Es wurden keine Nachweise einer Kreuzreaktivität in den bewerteten Proben gefunden. Die 2 Anti-Toxoplasma IgM-Proben, die positiv getestet wurden, wurden auch von anderen HIV-Assays positiv getestet. Potenzielle interferierende Proben = 125 RF (Rheumafaktor) ‐ 4 IgG erhöht ‐ 4 ANA (Antinukleäre Antikörper) ‐ 4 IgM erhöht ‐ 5 Mononukleose ‐ 5 HSV 1 IgG (Herpes simplex‐Virus) ‐ 5 Schwangere ‐ 23 (einschließlich 7 multiparen) HSV 2 IgG (Herpes simplex‐Virus) ‐ 4 Syphilis‐Antikörper ‐ 6 Anti‐CMV IgG (Zytomegalievirus) ‐ 5 Anti‐EBV (Epstein‐Barr‐Virus) ‐ 3 Anti‐CMV IgM (Zytomegalievirus) ‐ 7 Anti‐Röteln (Röteln‐Virus) ‐ 4 anti‐HTLV (Humanes T‐lymphotropes Virus) ‐ 4 Anti‐VZV IgG (Varizella Zoster‐Virus) ‐ 2 Anti‐HCV (Hepatitis C‐Virus) ‐ 8 Anti‐VZV IgM (Varizella Zoster‐Virus) ‐ 2 Anti‐E.coli (Escherichia coli) ‐ 5 Anti‐Toxoplasma IgG (T. gondii) ‐ 10 HBsAg (Hepatitis B‐Antigen) ‐ 8 Anti‐Toxoplasma IgM (T. gondii) ‐ 7 BIOKIT, S.A. - Can Malé s/n - 08186 Lliçà d’Amunt - Barcelona - SPAIN 3000-1172_R01_02.2015_ger.docx 0843 30 bioelisa bioelisa: Leitfaden zur Problemlösung Problem Mögliche Ursachen Lösung 1. Kontrollen nicht bewertbar. 1a. Falsche Temperatur, Zeitmessung oder Pipettierung. 1b. Falsche Aufbereitung der Reagenzien, Verdünnungsfehler, Reagenzien nicht gut durchmischt. 1c. Kreuzkontaminierung der Kontrollen. Verfahren prüfen. Assay wiederholen. 1d. Ungenaue Filtermessung. 1e. Interferenz im optischen Pfad. 1f. Komponenten aus unterschiedlichen Chargen verwendet. 1g. Abgelaufene Reagenzien. 2. Am Ende des Assays entwickelt sich keine oder nur eine helle Farbe. 2a. Es wurden ein oder zwei Reagenzien gar nicht oder in der falschen Reihenfolge zugesetzt. 2b. Inaktives Konjugat. Falsche Verdünnung des konzentrierten Konjugats 2. Falsche Konservierung. 2c. Inaktive Mikrotiterplatte: Falsche Konservierung. 2d. Inaktives Substrat-TMB: Falsche Konservierung. Der verwendete Behälter beeinflusst die SubstratTMB-Stabilität, Kreuzkontaminierung mit der Stopplösung. 2e. Zu kalte Reagenzien. Verfahren prüfen. Assay wiederholen. Sorgfältig pipettieren. Kappen nicht austauschen. Assay wiederholen. Prüfen Sie, ob die Wellenlänge des verwendeten Filters 450 nm ist. Wenn kein Referenzfilter von 620 - 630 nm verwendet wird, erhöht sich die Absorption um ungefähr 0,050. Lesegerät prüfen. Boden der Mikrotiterplatte reinigen oder trocknen. Auf Luftblasen überprüfen. Messung wiederholen. Verwenden Sie keine Komponenten aus unterschiedlichen Chargen, da sie auf jede freigegebene Charge abgestimmt werden. Verfalldatum des Kits prüfen. Ein nicht abgelaufenes Kit verwenden. Verfahren prüfen. Assay wiederholen. Auf Kontaminierung prüfen. Verfahren prüfen. Assay wiederholen. Bewahren Sie ungenutzte Streifen immer im gut verschlossenen Beutel mit darin befindlichem Trocknungsmittel auf. Assay wiederholen. Verwenden Sie Einwegbehälter oder waschen Sie den Behälter vor der Wiederverwendung mit Säure oder Ethanol und spülen Sie ihn mit deionisiertem Wasser aus. Verfahren prüfen. Assay wiederholen. Sorgen Sie dafür, dass die Reagenzien vor der Verwendung Raumtemperatur erreichen. BIOKIT, S.A. - Can Malé s/n - 08186 Lliçà d’Amunt - Barcelona - SPAIN 3000-1172_R01_02.2015_ger.docx 0843 31 bioelisa bioelisa: Leitfaden zur Problemlösung Problem Mögliche Ursachen Lösung 3a. Kontaminierte oder 3. Zu viel Farbe in allen oxidierte Substrat-TMBMikrotiterplattenvertiefun Lösung. gen. 3b. 3c. 3d. 3e. 4. Schlechte Reproduzierbarkeit oder hohe Anzahl nicht wiederholbarer reaktiver Proben. 4a. 4b. 4c. 4d. 4e. 4f. Prüfen Sie, ob das Substrat farblos ist. Wenn es blau ist, entsorgen Sie es. Verwenden Sie mit Säure oder Ethanol gewaschene Behälter oder Einwegbehälter Assay wiederholen. Kontaminierte oder falsch Auf Kontaminierung prüfen: aufbereitete Reagenzien. trübes Aussehen. Verdünnungen prüfen. Assay wiederholen. Kontaminierte Prüfen Sie die Qualität des Waschlösung (1x). destillierten oder deionisierten Wassers, das für die Verdünnung verwendet wurde. Assay wiederholen. Unzureichender oder Waschgerät prüfen. Füllen Sie uneinheitlicher die Vertiefungen mit Waschvorgang: Waschlösung bis fast ganz Füllvolumen und/oder oben. Vollständig aspirieren. Aspiration unzureichend Anzahl der Waschzyklen oder nicht einheitlich. erhöhen. Unzureichende Anzahl an Waschzyklen, kontaminiertes Gerät. Verwendung einer Verwenden Sie ausschließlich Waschlösung eines die mit dem Kit mitgelieferte anderen Herstellers. Waschlösung. Waschprobleme. Siehe 3c, 3d, 3e. Nicht kalibrierte Pipetten Verwenden Sie ausschließlich oder Spitzen nicht richtig kalibrierte Pipetten mit richtig aufgesetzt. Falsche aufgesetzten Spitzen und Pipettierung. pipettieren Sie sorgfältig ohne Blasen und Spritzer. Assay wiederholen. Reagenzien zu kalt oder Reagenzien auf vor der Anwendung nicht Raumtemperatur bringen und richtig gemischt. vor der Anwendung gründlich mischen. Luftströme über der Schützen Sie die Mikrotiterplatte während Mikrotiterplatte vor Inkubationen. Luftströmen. Zu lange Zeit für die Entwickeln Sie eine Zugabe von Proben einheitliche und gleichmäßige und/oder Reagenzien. Technik. Uneinheitliche Zeitintervalle. Luftblasen. Interferenz im optischen Siehe 1e. Pfad. BIOKIT, S.A. - Can Malé s/n - 08186 Lliçà d’Amunt - Barcelona - SPAIN 3000-1172_R01_02.2015_ger.docx 0843 32 bioelisa LIRE LES CHANGEMENTS SURLIGNÉS bioelisa HIV-1+2 Ag/Ab 3000-1172 1 x 96 TESTS 3000-1173 5 x 96 TESTS (480) Test ELISA visant à détecter des anticorps contre le HIV (virus de l'immunodéficience humaine) de type 1 (groupe M, O) ou de type 2 et l'antigène p24 du HIV dans des échantillons de sérum ou de plasma humain dans des laboratoires cliniques et servant d'essai de dépistage de première intention dans les centres de transfusion sanguine. Sommaire Des éléments sérologiques de l'infection par le HIV peuvent être obtenus en réalisant des tests pour déterminer la présence d'antigènes ou d'anticorps contre le HIV dans le sérum ou le plasma des patients susceptibles d'être infectés par le HIV. L'antigène peut généralement être détecté pendant la phase aiguë et la phase symptomatique du sida. Les anticorps du HIV-1 et/ou du HIV-2 sont détectables virtuellement tout au long de la période d'infection, dès le début ou peu après la phase aiguë et jusqu'à l'étape finale du sida. Le test ELISA HIV de quatrième génération permet la détermination simultanée des antigènes p24 du HIV et des anticorps contre le HIV-1/HIV-2, réduisant ainsi la durée de la fenêtre sérologique et permettant d'établir un diagnostic précoce de l'infection à HIV aiguë. Mis à part la transmission sexuelle, la principale voie d'infection par le HIV est la transfusion sanguine. Le HIV peut être présent dans les fractions cellulaires et non cellulaires du sang humain. Par conséquent, tous les dons de sang ou de plasma doivent être analysés en raison du risque de transmission du HIV par le sang contaminé. Cela est rendu possible grâce au test ELISA à haute sensibilité, qui détecte la présence d'anticorps contre le HIV et de l'antigène p24. Principe bioelisa HIV-1+2 Ag/Ab est un immunoessai enzymatique de quatrième génération pour réaliser une détection qualitative simultanée de l'antigène p24 du HIV et des anticorps contre le HIV-1 (groupes M et O) ou contre le HIV-2. Les antigènes représentant les épitopes gp41 du HIV-1 et gp36 du HIV-2 sont appliqués sur des puits de microplaques avec les anticorps monoclonaux contre le HIV p24. Dans la première étape de l'immunoessai, des échantillons de sérum ou de plasma sont ajoutés aux puits avec le diluant d'échantillon contenant les anticorps anti-p24 biotinylés. Si des anticorps contre le HIV-1 et/ou le HIV-2 spécifiques sont présents dans l'échantillon, ils formeront des complexes stables avec les antigènes du HIV fixés aux puits. Si l'antigène p24 est présent dans l'échantillon, il se fixera simultanément aux anticorps dans le puits et aux anticorps biotinylés présents dans le diluant d'échantillon. Les micropuits sont ensuite lavés afin d'éliminer les protéines sériques non liées. Un ensemble d'antigènes biotinylés est ajouté aux puits ; ces antigènes se fixeront aux anticorps de capture spécifiques. Après un second lavage visant à éliminer le conjugué non lié, un second conjugué de streptavidineHRP est ajouté aux puits. Dans les puits contenant l'immunocomplexe en « sandwich », le chromogène incolore est oxydé par l'effet du conjugué lié, créant ainsi un produit de couleur bleue. La couleur bleue devient jaune après l'arrêt de la réaction à l'acide sulfurique. L'intensité de la couleur peut être mesurée et est proportionnelle à la concentration d'anticorps contre le HIV 1/2 ou d'antigènes p24 du HIV présents dans l'échantillon. Les puits contenant les échantillons négatifs restent incolores. Composants 1. MCPL MICROPLAQUE : 12 x 8 puits recouverts d'antigènes représentant les épitopes gp41 du HIV-1 et gp36 du HIV-2 et d'anticorps monoclonaux anti-p24. Les plaques sont scellées dans un étui en aluminium à l'aide d'un déshydratant. 2. CONTROL + 1 CONTRÔLE POSITIF HIV-1 : Sérum humain dilué contenant des anticorps contre le HIV-1 (inactivé par la chaleur). Contient 0,1 % de ProClinTM 300 (agent conservateur). Prêt à l'emploi. 3. CONTROL + 2 CONTRÔLE POSITIF HIV-2 : Sérum humain dilué contenant des anticorps contre le HIV-2 (inactivé par la chaleur). Contient 0,1 % de ProClinTM 300 (agent conservateur). Prêt à l'emploi. 4. CONTROL + Ag CONTRÔLE POSITIF HIV p24 : Sérum humain dilué enrichi en antigène p24 du HIV-1 recombinant. Contient 0,1 % de ProClinTM 300 (agent conservateur). Prêt à l'emploi 5. CONTROL – CONTRÔLE NÉGATIF : Sérum humain dilué négatif aux anticorps contre le HIV-1/2 et à l'antigène p24 du HIV. Contient 0,1 % de ProClinTM 300 (agent conservateur). Prêt à l'emploi. BIOKIT, S.A. - Can Malé s/n - 08186 Lliçà d’Amunt - Barcelona - SPAIN 3000-1172_R01_02.2015_fre.docx 0843 33 bioelisa 6. DIL SAMP DILUANT D'ÉCHANTILLON : Anticorps monoclonaux biotinylés contre le HIV p24 dilués dans le tampon Tris. Contient 0,05 % de ProClinTM 300 (agent conservateur) et colorant rouge. Prêt à l'emploi. 7. CONJ 1 CONJUGUÉ 1 PRÊT A L'EMPLOI : Tampon phosphate contenant des antigènes du HIV-1 et HIV-2 biotinylés. Contient 0,05 % de ProClinTM 300 (agent conservateur) et colorant bleu. Prêt à l'emploi. 8. DIL CONJ 2 DILUANT DU CONJUGUÉ 2 : Tampon phosphate contenant des stabilisateurs protéiques ; 0,05 % de ProClinTM 300 (agent conservateur) et colorant jaune. 9. CONJ 2 101X CONJUGUÉ 2 CONCENTRÉ (101X) : Contient de la streptavidine marquée à la peroxydase. À diluer au 1:101 avec le diluant du conjugué 2 avant usage. 10. SUBS TMB SUBSTRAT TMB : Contient 3,3', 5,5' de tetra-méthyl-benzidine (TMB) et de peroxyde d'hydrogène. Prêt à l'emploi. 11. WASH SOLN 25x SOLUTION DE LAVAGE CONCENTRÉE : Tampon de PBS concentré pH 7,4 (25x). Contient du Tween-20 (détergent), < 0,2 % ProClinTM 300 (agent conservateur). À diluer au 1:25 dans de l'eau distillée ou déionisée avant usage. 12. H2SO4 0.8N SOLUTION D'ARRÊT : acide sulfurique 0,8 N. Prêt à l'emploi. 13. SEALS ADHÉSIFS : Servent à couvrir la microplaque pendant les incubations. 14. BAG SAC REFERMABLE: Sert à stocker les barrettes non utilisées. Précautions bioelisa HIV-1+2 Ag/Ab est destiné à un usage diagnostique IN VITRO. Utilisation réservée aux professionnels. ATTENTION : Le contrôle négatif, le contrôle positif au HIV-1, au HIV-2 et au HIV p24, le diluant d'échantillon, le conjugué 1, le diluant du conjugué 2 et la solution de lavage concentrée contiennent < 0,2 % de ProClinTM 300 (agent conservateur). Mentions de danger H317 : Peut provoquer une allergie cutanée. Conseils de prudence P280 : Porter des gants de protection/des vêtements de protection/un équipement de protection des yeux/du visage. P302+P352 : EN CAS DE CONTACT AVEC LA PEAU : Laver abondamment à l’eau et au savon. P333+P313 : En cas d’irritation ou d’éruption cutanée : Consulter un médecin. P363 : Laver les vêtements contaminés avant réutilisation. P501 : Éliminer le contenu/récipient conformément aux réglementations locales/régionales/nationales et internationales. ATTENTION : MATIÈRE PRÉSENTANT UN RISQUE BIOLOGIQUE. Toutes les matières d'origine humaine utilisées dans la préparation de ce produit ont donné des résultats négatifs aux anticorps contre le HCV, aux anticorps contre le Treponema pallidum, à l'antigène de surface de l'hépatite B ainsi qu'aux anticorps contre le HIV 1/2 (excepté pour les contrôles positifs 1 et 2), au moyen d'une méthode commerciale autorisée. Cependant, vu qu'il n'existe pas de méthode analytique pouvant garantir l'absence totale d'agents infectieux, il convient de manipuler ce produit avec prudence : - Évitez le contact des réactifs avec les yeux et la peau. Si un tel contact se produit, lavez abondamment à l'eau. Portez des gants. Ne pas pipeter avec la bouche. Ne fumez pas. BIOKIT, S.A. - Can Malé s/n - 08186 Lliçà d’Amunt - Barcelona - SPAIN 3000-1172_R01_02.2015_fre.docx 0843 34 bioelisa - Jetez toutes les matières utilisées dans des récipients destinés aux biocontaminants. Les restes d'échantillons, de contrôles, de réactifs aspirés et de pointes de pipettes doivent être recueillis dans un récipient spécialement prévu à cet effet et être autoclavés pendant 1 heure à 121°C ou bien traités avec 10 % d'hypochlorite de sodium (concentration finale) pendant 30 minutes avant élimination. (Les restes contenant de l'acide doivent être neutralisés avant l'ajout d'hypochlorite de sodium.) Consignes de manipulation : - - Réglez le laveur à la plaque utilisée (fond plat) afin de réaliser un lavage correct. Ne mélangez pas des réactifs issus de lots différents. N'utilisez pas de réactifs périmés. N'utilisez pas un réactif si vous observez un changement dans l'apparence des composants inclus dans le kit. Toutes les précautions doivent être prises pour éviter la contamination microbienne et la contamination croisée des réactifs. Servez-vous d'une pointe de pipette neuve pour chaque échantillon et réactif. N'échangez pas les réactifs issus de lot différents et n'utilisez pas les réactifs d'autres kits commercialisés. Les composants du kit sont assemblés de façon précise pour une efficacité optimale des tests. AVERTISSEMENT - ÉTAPE ESSENTIELLE : Laissez les réactifs et les échantillons atteindre la température ambiante (entre 20 et 25°C) avant usage. Agitez doucement les réactifs avant usage. Faites redescendre leur température entre 2 et 8°C immédiatement après usage. L'activité enzymatique du conjugué 2 peut être affectée par la poussière et les substances chimiques réactives telles que l'hypochlorite de sodium, les acides, les alcalis, etc. Ne réalisez pas l'essai en présence de ces substances. Il est primordial de conserver la solution de substrat TMB dans un récipient correctement fermé et d'éviter de l'exposer à la lumière. Les savons et/ou agents oxydants restants dans les récipients utilisés pour la solution de substrat TMB peuvent interférer avec la réaction. Si des récipients en verre ou en plastique réutilisés sont employés, ils doivent être lavés avec de l'acide sulfurique ou chlorhydrique à 1 N, rincés abondamment à l'eau distillée et séchés avant usage. Nous recommandons d'utiliser des récipients en plastique jetables. Conservation et stabilité Les composants resteront stables jusqu'à la date de péremption indiquée sur l'étiquette à condition qu'ils soient stockés à une température comprise entre 2 et 8°C. Le sac contenant la microplaque doit atteindre la température ambiante avant d'être ouvert afin d'éviter la formation de condensation dans les puits. Une fois le sac ouvert, les puits de la microplaque sont stables pendant 3 mois à une température comprise entre 2 et 8°C dans le sac en plastique fermement scellé avec le gel de silice. Éliminez toute microplaque scellée sans gel de silice. Une fois diluée, la solution de lavage est stable pendant 6 jours à condition qu'elle soit stockée à une température comprise entre 2 et 8°C. N'utilisez pas de solutions de lavage diluées si elles ont été stockées pendant la nuit à température ambiante. Une fois dilué, le conjugué 2 est stable pendant 30 jours à condition qu'il soit stocké à une température comprise entre 2 et 8°C. Conservez la solution de substrat TMB à l'abri de la lumière. Présentations disponibles Kit d'une microplaque (1 x 96 tests), RÉF 3000-1172. Il contient : 1 microplaque, 1 x 2 mL contrôle négatif, 1 x 2 mL contrôle positif HIV-1, 1 x 2 mL contrôle positif HIV-2, 1 x 2 mL contrôle positif p24 HIV-1, 1 x 14 mL diluant d'échantillon, 1 x 25 mL conjugué 1 prêt à l'emploi,1 x 0,250 mL conjugué 2 concentré (101x), 1 x 25 mL diluant du conjugué 2, 1 x 20 mL substrat TMB, 1 x 12 mL solution d'arrêt, 2 x 50 mL solution de lavage concentrée, 1 sac refermable et des adhésifs. - Kit de 5 microplaques (5 x 96 tests), RÉF 3000-1173. Il contient : 5 microplaques, 1 x 4 mL contrôle négatif, 1 x 4 mL contrôle positif HIV-1, 1 x 4 mL contrôle positif HIV-2, 1 x 4 mL contrôle positif p24 HIV-1, 1 x 70 mL diluant d'échantillon, 1 x 120 mL conjugué 1 prêt à l'emploi, 1 x 1,2 mL conjugué 2 concentré (101x), 1 x 120 mL diluant du conjugué 2, 1 x 100 mL substrat TMB, 1 x 60 mL solution d'arrêt, 3 x 100 mL solution de lavage concentrée, 1 sac refermable et des adhésifs. Matériel requis non fourni Eau distillée ou déionisée. Gants jetables et minuteur. Poubelles appropriées pour les matériaux potentiellement contaminés. Bacs en forme de V jetables. Système de distribution et/ou pipette (à canal unique ou à canaux multiples) et pointes de pipettes jetables. Papier absorbant ou serviette propre. Étuve sèche ou bain d'eau 37 ± 1°C. Lecteur de microplaque pourvu d'un filtre de 450 nm. Un filtre de référence de 620 ou 630 nm est conseillé. Système de lavage manuel ou automatique. BIOKIT, S.A. - Can Malé s/n - 08186 Lliçà d’Amunt - Barcelona - SPAIN 3000-1172_R01_02.2015_fre.docx 0843 35 bioelisa Prélèvement d'échantillons Utilisez du sérum frais avec ou sans tubes de gel séparateur de sérum, de l'EDTA plasmatique, de l'acide-citratedextrose (ACD) plasmatique, de la Li-héparine plasmatique, de la Na-héparine plasmatique, du Na-citrate plasmatique, de l'oxalate de potassium/fluorure de sodium plasmatique, du CPD et du CPDA plasmatique. D'autres anticoagulants doivent être vérifiés avant utilisation. Les échantillons peuvent être stockés à une température comprise entre 2 et 8°C pendant 8 jours. Pour une période de temps plus longue, les échantillons doivent être congelés à une température de -20°C. Évitez les congélations et décongélations répétées (4 cycles de congélation et décongélation maximum). Les particules en suspension présentes dans les échantillons doivent être retirées par centrifugation. Les échantillons de sérum ou de plasma ne doivent pas être inactivés par la chaleur car cela peut fausser les résultats. Traitement automatique Des essais automatiques ou semi-automatiques peuvent être utilisés avec différents instruments. Il est essentiel de valider tout système automatique en vue de démontrer que les résultats obtenus pour les échantillons sont équivalents à ceux obtenus lors de l'essai manuel. Nous recommandons aux utilisateurs de valider régulièrement l'instrument. Si vous rencontrez des difficultés à programmer et configurer les processeurs automatiques de Biokit, veuillez contacter votre distributeur. PROCÉDURE Opérations préalables Laissez les réactifs atteindre la température ambiante (entre 20 et 25°C) avant de procéder à l'essai. Mélangez doucement tous les réactifs liquides avant usage. Vérifiez l'absence de cristaux de sel dans la solution de lavage concentrée. Si des cristaux se sont formés, solubilisez-les en les faisant chauffer à 37°C jusqu'à ce qu'ils se dissolvent. Utilisez de l'eau distillée ou déionisée. Les contrôles négatifs et positifs doivent être traités comme les échantillons. Diluez la solution de lavage au 1:25 dans de l'eau distillée. Si l'intégralité de la plaque est employée, ajoutez 40 mL de solution de lavage concentrée (25x) aux 960 mL d'eau déionisée. Si la plaque n'est pas utilisée intégralement, préparez le volume proportionnel de solution. Diluez le conjugué 2 concentré au 1:101 avec le diluant du conjugué 2 selon le tableau 1. Pour un kit d'1 plaque, si l'intégralité de la plaque est utilisée, ajoutez 250 µL de conjugué concentré directement dans la bouteille contenant 25 mL de diluant de conjugué. Mélangez doucement. TABLEAU 1 Barrettes requises Diluant du conjugué 2 Conjugué 2 concentré mL µL 1 2,0 20 2 4,0 40 4 8,0 80 6 12,0 120 8 16,0 160 10 20,0 200 12 25,0 250 Réalisation du test 1. Servez-vous uniquement du nombre de barrettes requises pour le test. Réservez 7 puits pour le blanc et les contrôles. Un puits pour le blanc (par ex. A1), 3 puits pour le contrôle négatif (par ex. B1, C1, D1) et au moins 1 puits pour chaque contrôle positif : le contrôle positif HIV-1 (par ex. E1), le contrôle positif HIV-2 (par ex. F1) et le contrôle positif p24 HIV (par ex. G1). 2. Ajoutez 100 µL de diluant d'échantillon dans tous les puits, excepté celui du blanc. 3. Ajoutez d'abord 100 µL d'échantillons, 100 μL de contrôle négatif et chaque contrôle positif dans leurs puits respectifs. 4. Recouvrez la plaque avec un adhésif, mélangez doucement et incubez à 37°C ± 1°C pendant 60 minutes avec un intervalle de tolérance de 58 – 65 minutes. 5. Retirez et jetez l'adhésif. Aspirez le contenu des puits et remplissez-les complètement (d'environ 350 µL) de la solution de lavage diluée. Répétez le processus d'aspiration et de lavage 4 fois supplémentaires, 5 (cinq) cycles au total doivent être exécutés. Veillez à ce que chaque colonne des puits soit immergée pendant au moins 15 secondes avant le cycle d'aspiration suivant. 6. Transposez 200 µL du conjugué 1 dans chaque puits, excepté celui réservé au substrat du blanc. Évitez la formation de bulles lors de l'ajout. BIOKIT, S.A. - Can Malé s/n - 08186 Lliçà d’Amunt - Barcelona - SPAIN 3000-1172_R01_02.2015_fre.docx 0843 36 bioelisa 7. Recouvrez la microplaque avec un adhésif et incubez à 37°C ± 1°C pendant 30 minutes avec un intervalle de tolérance de 28 – 35 minutes. 8. Retirez et jetez l'adhésif. Aspirez et lavez les puits de la même façon que dans l'étape de lavage précédente ; 3 (trois) cycles de lavage doivent être exécutés. 9. Transposez 200 µL du conjugué de travail 2 dans chaque puits, excepté celui réservé au substrat du blanc. Évitez la formation de bulles lors de l'ajout. 10. Recouvrez la microplaque avec un adhésif et incubez à 37°C ± 1°C pendant 30 minutes avec un intervalle de tolérance de 28 – 35 minutes. 11. Retirez et jetez l'adhésif. Aspirez et lavez les puits comme à l'étape 5, 5 (cinq) cycles de lavage doivent être exécutés. 12. Ajoutez 150 µL de solution de substrat TMB dans chaque puits, y compris celui du blanc. 13. Incubez à température ambiante (entre 20 et 25°C) pendant 30 minutes avec un intervalle de tolérance de 28 – 35 minutes, à l'abri de la lumière directe. 14. Arrêtez la réaction en ajoutant 100 µL de solution d'arrêt en suivant la même séquence et les mêmes intervalles que pour le substrat TMB. 15. Utilisez le blanc dans le lecteur à 450 nm et lisez la valeur de l'absorbance de chaque puits au bout de 30 minutes. Nous recommandons de réaliser la lecture en mode bichromatique en se servant du filtre de référence de 620 - 630 nm. Contrôle de qualité Les résultats d'un essai sont valides si les critères suivants sont remplis : 1. La valeur d'absorbance du puits du blanc doit être ≤ 0,100. 2. La valeur d'absorbance des contrôles positifs doit être ≥ 0,900 après avoir retiré le blanc. Si ce n'est pas le cas, le test doit être répété. 3. Chaque valeur d'absorbance individuelle du contrôle négatif doit être ≤ 0,120 après avoir retiré le blanc. Si l'une des valeurs du contrôle négatif ne satisfait pas les critères du contrôle de qualité, la valeur ne doit pas être prise en compte et la valeur moyenne doit être recalculée en utilisant les deux valeurs restantes. Si deux valeurs d'absorbance du contrôle négatif ou plus ne sont pas conformes aux limites spécifiées par le contrôle de qualité, le test n'est pas valable et doit être réalisé à nouveau. Résultats 1. Supprimez le blanc de chaque contrôle négatif valable. Calculez la valeur moyenne d'absorbance du contrôle négatif (CNx). Calculez la valeur seuil en ajoutant 0,170 à la valeur d'absorbance moyenne du contrôle négatif. Valeur seuil = CNx + 0,170 Exemple : CNx = 0,011 2. valeur seuil = 0,011 + 0,170 = 0,181 Divisez la valeur d'absorbance de l'échantillon par la valeur seuil. Résultat positif : Résultat négatif : Résultat incertain : rapport valeur absorbance/valeur seuil ≥ 1,0 rapport valeur absorbance/valeur seuil < 0,9 rapport valeur absorbance/valeur seuil ≥ 0,9 < 1,0 Interprétation des résultats Résultats négatifs : Les échantillons dont le rapport absorbance-seuil est inférieur à 0,9 sont considérés non réactifs, ce qui indique qu'aucun anticorps contre le HIV 1 et/ou HIV-2 ou antigène p24 du HIV n'a été détecté à l'aide du kit bioelisa HIV-1+2 Ag/Ab. BIOKIT, S.A. - Can Malé s/n - 08186 Lliçà d’Amunt - Barcelona - SPAIN 3000-1172_R01_02.2015_fre.docx 0843 37 bioelisa Résultats positifs : Les échantillons dont la valeur d'absorbance est égale ou supérieure à la valeur seuil sont considérés initialement réactifs, ce qui indique que des anticorps contre le HIV 1/2 ou l'antigène p24 du HIV ont probablement été détectés à l'aide du kit bioelisa HIV-1+2 Ag/Ab. Tous les échantillons initialement réactifs doivent être analysés deux autres fois afin de confirmer le résultat initial. Résultat incertain : Les échantillons dont le rapport absorbance-seuil est compris entre 0,9 et 1,0 sont considérés incertains et deux tests supplémentaires doivent être réalisés sur ces échantillons en vue de confirmer les résultats initiaux. - Si après les nouvelles analyses effectuées sur les échantillons initialement réactifs, les deux puits donnent des résultats négatifs (signal/seuil < 0,9), ces échantillons doivent être considérés positifs non reproductibles (ou faux positifs) et enregistrés comme négatifs. - Si après les deux tests supplémentaires, l'un ou les deux puits donnent des résultats positifs, le résultat final du test ELISA doit être enregistré comme réactif de façon répétée. Les échantillons réactifs de façon répétée peuvent être considérés positifs aux anticorps contre le HIV 1/2 ou à l'antigène p24, ce qui signifie que le patient est probablement infecté par le HIV1 ou le HIV2. - Suite aux deux nouvelles analyses, les échantillons dont les résultats sont proches de la valeur seuil doivent être interprétés avec prudence et considérés incertains ou non interprétables au moment de l'essai. - Le suivi, la confirmation et les tests supplémentaires de tout échantillon positif à l'aide d'un autre système analytique (par ex. WB, PCR) sont requis. Le diagnostic clinique ne doit pas être établi en fonction d'un seul résultat de test. Il doit se fonder sur des données et résultats cliniques d'autres laboratoires. Limites de la procédure - Pour obtenir de l'essai des résultats optimaux, la procédure décrite doit être respectée à la lettre. Un écart par rapport à la procédure peut mener à des résultats aberrants. - Comme dans tous les immunoessais sensibles, il est possible que des résultats positifs non reproductibles se produisent. - Les résultats positifs doivent être confirmés au moyen d'une autre méthode disponible et interprétés conjointement avec les renseignements cliniques du patient. - Les résultats négatifs obtenus à l'aide du bioelisa HIV-1+2 Ag/Ab sont considérés négatifs aux anticorps contre le HIV-1/2 et à l'antigène p24 ; des tests supplémentaires ne sont pas requis. - La prévalence du marqueur aura une incidence sur les valeurs prévues de l'essai. - Cet essai ne peut pas être utilisé pour analyser du plasma commun (mélangé). bioelisa HIV-1+2 Ag/Ab a été évalué uniquement avec des échantillons de sérum ou de plasma individuel. - bioelisa HIV-1+2 Ag/Ab est un essai qualitatif et les résultats ne peuvent pas servir à mesurer des concentrations d'anticorps contre le HIV ou d'antigène p24. Cet essai ne permet pas de différencier les infections au HIV-1 et au HIV-2. - Un résultat négatif n'exclut pas la possibilité d'une exposition ou d'une infection au HIV. Résultats attendus Le nombre de résultats positifs dépend de l'incidence de la maladie dans la zone géographique et le type de population testée. Dans le monde, l'incidence du HIV sur des personnes âgées de plus de 15 ans varie de 0,1 % en Australie, en Nouvelle Zélande et dans la zone Asie-Pacifique ; 0,3 % en Europe de l'Ouest, en Afrique du Nord et au Moyen-Orient ; 0,5 % en Europe de l'Est, en Asie centrale et en Amérique latine ; 0,6 % en Amérique du Nord et en Asie du Sud et 9 % en Afrique sub-saharienne. Au sein d'un même pays, l'incidence varie également beaucoup en fonction de la population testée. En Europe de l'Ouest, la prévalence des anticorps contre le HIV dans les dons aux banques du sang varie de 0 à 5 cas sur 100 000 dons, tandis que l'incidence parmi les prisonniers, les travailleurs de l'industrie du sexe et les toxicomanes peut facilement atteindre 20 % dans ces populations à risque. Caractéristiques fonctionnelles Sensibilité analytique La limite de détection a été estimée en-dessous de 0,5 UI/mL en analysant l'antigène p24 du HIV de l'OMS selon la première référence internationale du code NIBSC (Institut britannique des normes et contrôles biologiques) 90/636, avec deux lots différents lors de l'évaluation interne. En outre, la limite de détection a été estimée en-dessous de 12,5 pg/mL en analysant l'antigène BIORAD HIV-1 Standard 72217, avec deux lots différents lors de l'évaluation interne. BIOKIT, S.A. - Can Malé s/n - 08186 Lliçà d’Amunt - Barcelona - SPAIN 3000-1172_R01_02.2015_fre.docx 0843 38 bioelisa Sensibilité Un total de 537 échantillons positifs au HIV-1 ont été évalués à l'aide du bioelisa HIV 1+2 Ag/Ab, parmi lesquels : 28 échantillons de HIV-1 frais du jour même, 85 échantillons de HIV-1 et 4 échantillons de sous-type O de HIV-1 dans un laboratoire de référence européen ; 380 échantillons de HIV-1 chez Biokit et 40 échantillons de HIV-1 non sous-type B (et au moins 3 échantillons de chaque sous-type de HIV-1) dans un autre laboratoire de référence européen. bioelisa HIV 1+2 Ag/Ab a détecté les 537 échantillons. La sensibilité constatée a été de 100 % (537/537). - Un total de 115 échantillons positifs au HIV-2 ont été évalués à l'aide du bioelisa HIV 1+2 Ag/Ab, parmi lesquels : 27 échantillons de HIV-2 dans un laboratoire de référence européen et 88 échantillons de HIV-2 chez Biokit. bioelisa HIV 1+2 Ag/Ab a détecté les 115 échantillons. La sensibilité constatée a été de 100 % (115/115). - Un total de 61 échantillons positifs à l'Ag p24 du HIV-1 ont été évalués à l'aide du bioelisa HIV 1+2 Ag/Ab, parmi lesquels : 15 échantillons dans un laboratoire de référence européen, 16 échantillons dans un autre laboratoire de référence européen et 30 échantillons chez Biokit. bioelisa HIV 1+2 Ag/Ab a détecté les 61 échantillons. La sensibilité constatée a été de 100 % (61/61). - Des études de sensibilité supplémentaires ont été conduites en testant un total de 31 panels de séroconversion chez Biokit et dans un laboratoire de référence européen. Les résultats obtenus ont été comparables à la méthode commerciale la plus sensible de détection de l'antigène et de l'anticorps contre le HIV 1+2. - 16 panels de séroconversion du HIV de BBI/SeraCare et ZeptoMetrix ont été évalués chez Biokit. bioelisa HIV-1+2 Ag/Ab a identifié correctement tous les échantillons positifs. Panel de séroconversion BB1-PRB965-n=6 ZEPT-12007-n=9 BBI-PRB954-n=7 BBI-PRB932-n=9 ZEPT-9017-n=11 ZEPT-9014-n=7 ZEPT-9012-n=8 ZEPT-9032-n=14 ZEPT-6243-n=10 ZEPT-9022-n=9 ZEPT-9018-n=11 BBI-PRB939-n=9 BBI-PRB956-n=5 BBI-PRB945-n=6 BBI-PRB955-n=4 BBI-PRB958-n=6 bioelisa HIV Ag/Ab 2 4 6 4 1 1 5 8 7 7 9 6 4 3 2 3 Essai HIV Antigène p24 Essai HIV Ab Ag/Ab du HIV Premier échantillon détecté positif dans le panel 2 4 2 4 5 ND 6 7 6 ND 4 4 4 3 1 1 3 1 6 7 5 8 7 8 7 8 7 8 9 7 9 10 9 ND 8 6 4 5 4 4 4 3 2 4 2 3 5 3 TAN 1 4 4 4 1 1 1 1 1 1 1 5 2 1 1 1 - Le tableau précédent présente le premier échantillon détecté positif dans chaque panel évalué à l'aide du bioelisa HIV-1+2 Ag/Ab en comparaison avec les essais de 4ème génération (essais Ag/Ab), les essais de 3ème génération (essais Ab), les essais sur l'antigène p24 du HIV et sur l'acide ribonucléique du HIV. bioelisa HIV-1+2 Ag/Ab a démontré une excellente sensibilité à la détection de l'antigène ou des anticorps dans les 16 panels de séroconversion HIV précoce évalués. - Une autre étude a été menée en vue d'évaluer la sensibilité sur 32 échantillons de séroconversion précoce. Ces types d'échantillons sont caractérisés positifs à la présence de l'antigène p24 du HIV et/ou positifs au test de détection de l'acide nucléique, non détectés par toutes les méthodes de 3ème génération du HIV et négatifs ou indéterminés par les méthodes Western-Blot. bioelisa HIV 1+2 Ag/Ab a détecté les 32 échantillons. La sensibilité constatée a été de 100 % (32/32). BIOKIT, S.A. - Can Malé s/n - 08186 Lliçà d’Amunt - Barcelona - SPAIN 3000-1172_R01_02.2015_fre.docx 0843 39 bioelisa - Enfin, 50 surnageants de cultures de cellules du HIV, y compris différents sous-types du HIV-1 et du HIV-2, ont été évalués dans un laboratoire de référence européen. bioelisa HIV 1+2 Ag/Ab a détecté les 50 échantillons. La sensibilité constatée a été de 100 % (50/50). Spécificité La spécificité a été évaluée en analysant un total de 6 465 échantillons de donneurs de sang non sélectionnés provenant de trois centres différents. - Dans le premier centre, 3 045 échantillons non sélectionnés (dont 684 de nouveaux donneurs) ont été testés. Au total, 4 échantillons ont été réactifs. La spécificité obtenue dans cette étude a été de 99,87 % (3 041/3 045). - Dans le deuxième centre, 500 échantillons non sélectionnés provenant de la banque du sang ont été testés. Les 500 échantillons ont été négatifs. La spécificité obtenue a été de 100 % (500/500). - Une évaluation interne de 2 920 échantillons non sélectionnés de la banque du sang a été menée. 6 échantillons se sont avérés réactifs selon cette évaluation. La spécificité obtenue dans cette étude a été de 99,79 % (2 914/2 920). Un résumé détaillé de ces études spécifiques est présenté dans le tableau ci-dessous. Évaluation 1 (3 045 sérums) Sérum Initialement réactif Réactif de façon répétée Faux positif % de spécificité 6 4 4 99,87 (I.C. 95%: 99.66 - 99.96) Évaluation 2 (500 sérums) Sérum Initialement réactif Réactif de façon répétée Faux positif % de spécificité 0 0 0 100 (I.C. 95%: 98.89 - 100) Évaluation interne (1 000 sérums + 1 920 plasmas) Initialement réactif Réactif de façon répétée Faux positif % de spécificité Plasma 8 6 6 99,69 (I.C. 95%: 99.32 - 99.89) Sérum 1 0 0 100 (I.C. 95%: 99.44 - 100) Total 9 6 6 99,79 (I.C. 95%: 99.55 - 99.93) - De plus, 200 échantillons de patients hospitalisés ont été testés et comparés au test de référence. 194 échantillons ont été détectés négatifs par les deux essais et 6 échantillons réactifs. Les 6 échantillons ont également été réactifs lors d'autres tests ELISA. Une spécificité de 100 % a été obtenue dans cette étude (194/194). Précision Reproductibilité intra-essai : Le coefficient de variation obtenu pour les valeurs d'absorbance d'un échantillon positif au HIV-1 testé dans un minimum de 40 réplicats a été de 3,42 % ; 5,79 % et 4,71 % dans les trois lots étudiés. Le coefficient de variation obtenu pour les valeurs d'absorbance d'un échantillon positif au HIV-2 testé dans un minimum de 40 réplicats a été de 6,39 % ; 5,91 % et 8,38 % dans les trois lots étudiés. Le coefficient de variation obtenu pour les valeurs d'absorbance d'un échantillon positif à l'antigène p24 du HIV-1 testé dans un minimum de 40 réplicats a été de 4,08 % ; 3,44 % et 3,71 % dans les trois lots étudiés. Reproductibilité inter-essai : 4 échantillons positifs de différents niveaux ont été analysés lors de 15 essais différents. Les coefficients de variation obtenus pour les rapports valeur d'absorbance/valeur seuil des 4 échantillons ont été de 4,87 % ; 5,37 % ; 7,49 % et 7,54 %. BIOKIT, S.A. - Can Malé s/n - 08186 Lliçà d’Amunt - Barcelona - SPAIN 3000-1172_R01_02.2015_fre.docx 0843 40 bioelisa Interférences Interférences par ajout Aucune interférence n'a été détectée pour l'hémoglobine (500 mg/dL), la bilirubine (20 mg/dL), l'albumine humaine (5 g/dL) et les triglycérides (500 mg/dL). Réactivité croisée Afin d'évaluer les interférences possibles, 125 échantillons à réactivité croisée potentielle ont été analysés. Parmi ces échantillons, 4 échantillons (RF+), 4 échantillons positifs aux anticorps antinucléaires (ANA), 5 échantillons positifs à la mononucléose, 89 échantillons positifs à d'autres maladies infectieuses apparentées et 23 échantillons positifs à la grossesse. Aucune preuve de réactivité croisée n'a été fournie pour les échantillons évalués. Les 2 échantillons d'IgM anti-Toxoplasma testés positifs se sont également révélés positifs lors des autres essais HIV. Échantillons potentiellement interférents (125) RF (facteur rhumatoïde) ‐ 4 IgG élevés ‐ 4 ANA (anticorps antinucléaires) ‐ 4 IgM élevés ‐ 5 Mononucléose ‐ 5 IgG anti‐HSV 1 (virus herpès simplex) ‐ 5 Femmes enceintes ‐ 23 (dont 7 multipares) IgG anti‐HSV 2 (virus herpès simplex) ‐ 4 Anticorps anti‐syphilis ‐ 6 IgG anti‐CMV (cytomégalovirus) ‐ 5 anti‐EBV (virus d'Epstein‐Barr) ‐ 3 IgM anti‐CMV (cytomégalovirus) ‐ 7 anti‐Rubella (virus de la rubéole) ‐ 4 anti‐HTLV (virus T‐lymphotropique humain) ‐ 4 IgG anti‐VZV (virus varicelle‐zona) ‐ 2 anti‐HCV (virus de l'hépatite C) ‐ 8 IgM anti‐VZV (virus varicelle‐zona) ‐ 2 anti‐E.coli (Escherichia coli) ‐ 5 IgG anti‐Toxoplasma (T. gondii) ‐ 10 HBsAg (antigène de l'hépatite B) ‐ 8 IgM anti‐Toxoplasma (T. gondii) ‐ 7 BIOKIT, S.A. - Can Malé s/n - 08186 Lliçà d’Amunt - Barcelona - SPAIN 3000-1172_R01_02.2015_fre.docx 0843 41 bioelisa bioelisa : guide de problèmes Problème Causes possibles Solution 1. Contrôles non valables. 1a. Température, minutage ou pipetage incorrect(e). 1b. Préparation des réactifs incorrecte, erreur de dilution, mélange des réactifs insatisfaisant. 1c. Contamination croisée des contrôles. Vérifiez la procédure. Renouvelez l'essai. Vérifiez la procédure. Renouvelez l'essai. 1d. 1e. 1f. 1g. 2. Absence de couleur ou apparition d'une vague couleur claire à la fin de l'essai. 2a. 2b. 2c. 2d. 2e. Pipetez soigneusement. N'échangez pas les bouchons. Renouvelez l'essai. Filtre de lecture incorrect. Assurez-vous que la longueur d'onde du filtre utilisé est de 450 nm. Si le filtre de référence 620 - 630 nm n'est pas employé, l'absorbance augmente d'environ 0,050. Interférence dans le Contrôlez le lecteur. Nettoyez chemin optique ou séchez le fond de la microplaque. Vérifiez l'absence de bulles d'air. Effectuez une nouvelle lecture. Utilisation de composants N'utilisez pas de composants provenant de lots venant de lots différents car différents. ils sont ajustés à chaque lot commercialisé. Réactifs périmés. Vérifiez la date de péremption du kit. Servez-vous d'un kit non périmé. Un ou plusieurs réactifs Vérifiez la procédure. non ajoutés ou ajoutés Renouvelez l'essai. dans un ordre incorrect. Conjugué inactif. Vérifiez l'absence de Mauvaise dilution du contamination. Vérifiez la conjugué 2 concentré. procédure. Renouvelez Conservation inadéquate. l'essai. Microplaque inactive : Conservez toujours les Conservation inadéquate. barrettes inutilisées dans le sac fermé de façon hermétique, avec le déshydratant à l'intérieur. Renouvelez l'essai. Substrat TMB inactif : Utilisez des récipients Conservation inadéquate. jetables ou lavez-les avec de Le récipient employé l'acide ou de l'éthanol et altère la stabilité du rincez-les à l'eau déionisée substrat TMB, avant de les réemployer. contamination croisée Vérifiez la procédure. avec la solution Renouvelez l'essai. d'obturation. Réactifs excessivement Laissez les réactifs atteindre froids. la température ambiante avant usage. BIOKIT, S.A. - Can Malé s/n - 08186 Lliçà d’Amunt - Barcelona - SPAIN 3000-1172_R01_02.2015_fre.docx 0843 42 bioelisa bioelisa : guide de problèmes Problème Causes possibles 3. Présence d'une couleur excessive dans tous les puits de microplaquette. 3a. Solution de substrat TMB Vérifiez que le substrat est contaminée ou oxydée. incolore ; jetez-le s'il est de couleur bleue. Utilisez des récipients lavés à l'acide ou à l'éthanol ou des récipients jetables. Renouvelez l'essai. 3b. Réactifs contaminés ou Vérifiez l'absence de préparés de façon contamination (aspect incorrecte. trouble). Contrôlez les dilutions. Renouvelez l'essai. 3c. Solution de lavage Contrôlez la qualité de l'eau contaminée (1x). distillée ou déionisée utilisée pour la dilution. Renouvelez l'essai. 3d. Lavage insuffisant ou Contrôlez le dispositif de inégal : volume de lavage. Remplissez les puits remplissage et/ou presque complètement avec aspiration insuffisants ou la solution de lavage et hétérogènes. Nombre aspirez l'intégralité du insuffisant de cycles de contenu. Augmentez le lavage, dispositif nombre de cycles de contaminé. lavage. 3e. Emploi d'une solution de Servez-vous uniquement de lavage d'un autre la solution de lavage fournie fabricant. avec le kit. 4a. Problèmes de lavage. Voir 3c, 3d, 3e. 4b. Pipettes non calibrées ou Servez-vous uniquement de pointes mal ajustées. pipettes calibrées dont les Pipetage incorrect. pointes sont bien ajustées et pipettez soigneusement, sans faire de bulles ni d'éclaboussures. Renouvelez l'essai. 4c. Réactifs excessivement Équilibrez les réactifs à froids ou mal mélangés température ambiante et avant usage. mélangez bien avant usage. 4d. Présence de courants Maintenez la microplaque à d'air sur la microplaque l'abri des courants d'air. pendant les incubations. 4e. Délai excessif pour l'ajout Mettez au point une technique des échantillons et/ou des cohérente et invariable. réactifs. Intervalles de temps inégaux. Présence de bulles d'air. 4f. Interférence dans le Voir 1e. chemin optique. 4. Reproductibilité insatisfaisante ou nombre élevé d'échantillons réactifs non reproductibles. Solution BIOKIT, S.A. - Can Malé s/n - 08186 Lliçà d’Amunt - Barcelona - SPAIN 3000-1172_R01_02.2015_fre.docx 0843 43 bioelisa VEDI CAMBI RISALTATI bioelisa HIV-1+2 Ag/Ab 3000-1172 1 x 96 TEST 3000-1173 5 x 96 TEST (480) Test ELISA per l'individuazione degli anticorpi contro il virus dell'immunodeficienza umana (HIV) di tipo 1 (gruppo M, O) o tipo 2 e dell'antigene p24 dell'HIV in campioni di siero o plasma umano in laboratori clinici e come saggio di screening di prima linea in centri di donazione del sangue. Sommario L'evidenza sierologica dell'infezione da HIV può essere ottenuta confermando mediante un test la presenza di anticorpi o antigeni dell'HIV nel siero o nel plasma di individui con una sospetta infezione da HIV. Generalmente, l'antigene può essere rilevato sia nella fase acuta dell'AIDS che in quella sintomatica. Gli anticorpi anti-HIV-1 e/o anti-HIV-2 possono essere rilevati praticamente nel corso dell'intero periodo di infezione, a partire dalla fase acuta dell'AIDS, o subito dopo la sua conclusione, e fino allo stadio terminale. Il test ELISA di quarta generazione per l'HIV consente di individuare simultaneamente gli antigeni p24 dell'HIV e gli anticorpi anti-HIV-1/HIV-2, riducendo così la finestra diagnostica e consentendo una diagnosi precoce delle infezioni acute da HIV. Oltre alla trasmissione sessuale, la principale via di infezione da HIV sono le trasfusioni di sangue. L'HIV può essere presente sia nella frazione cellulare che in quella acellulare del sangue umano. Pertanto, tutte le donazioni di sangue o di plasma dovrebbero essere analizzate per escludere il rischio di trasmissione dell'HIV attraverso il sangue contaminato. Una soluzione efficace a tal fine è l'analisi per l'individuazione degli anticorpi anti-HIV e dell'antigene p24 mediante un test ELISA altamente sensibile. Principio bioelisa HIV-1+2 Ag/Ab è un test immunoenzimatico di quarta generazione per l'individuazione qualitativa simultanea dell'antigene p24 dell'HIV e degli anticorpi anti-HIV-1 (gruppi M e O) o anti-HIV-2. I pozzetti della micropiastra sono rivestiti da antigeni che rappresentano epitopi del gp41 dell'HIV-1 e del gp36 dell'HIV-2, nonché da anticorpi monoclonali contro il p24 dell'HIV. Nella prima fase dell'immunotest, i campioni di siero o di plasma vengono aggiunti a questi pozzetti unitamente al diluente dei campioni contenente anticorpi biotinilati anti-p24. Qualora nel campione siano presenti anticorpi anti-HIV-1 e/o anti-HIV-2 specifici, si formeranno dei complessi stabili con gli antigeni dell'HIV attaccati ai pozzetti. Se nel campione è presente l'antigene p24, questo si legherà simultaneamente agli anticorpi presenti nel pozzetto e agli anticorpi biotinilati contenuti nel diluente dei campioni. I pozzetti sono quindi sottoposti a lavaggio al fine di rimuovere le proteine del siero non legate. A questo punto viene aggiunto ai pozzetti un insieme di antigeni biotinilati, che si combinano con gli anticorpi specifici catturati. Dopo un secondo lavaggio per rimuovere il coniugato non legato, viene aggiunto ai pozzetti un secondo coniugato di streptavidina-HRP. Nei pozzetti contenenti immunocomplessi "a sandwich", il cromogeno incolore viene ossidato mediante l’aggiunta del coniugato, ottenendo un prodotto di colore blu. Al termine della reazione con acido solforico, il colore blu diventa giallo. È possibile misurare l'intensità del colore, che è proporzionale alla concentrazione di anticorpi anti-HIV-1/2 o dell'antigene p24 dell'HIV presente nel campione. I pozzetti contenenti campioni negativi rimangono incolori. Componenti 1. MCPL MICROPIASTRA: 12 x 8 pozzetti rivestiti con antigeni che rappresentano epitopi del gp41 dell'HIV-1 e del gp36 dell'HIV-2 e con anticorpi monoclonali anti-p24. Le piastre sono sigillate in un sacchetto di alluminio con essiccante. 2. CONTROL + 1 CONTROLLO POSITIVO HIV-1: Siero umano diluito contenente anticorpi anti-HIV-1 (inattivato mediante calore). Contiene 0,1% di ProClinTM 300 come conservante. Pronto all'uso. 3. CONTROL + 2 CONTROLLO POSITIVO HIV-2: Siero umano diluito contenente anticorpi anti-HIV-2 (inattivato mediante calore). Contiene 0,1% di ProClinTM 300 come conservante. Pronto all'uso. 4. CONTROL + Ag CONTROLLO POSITIVO HIV p24: Siero umano diluito addizionato con l'antigene ricombinante p24 dell'HIV-1. Contiene 0,1% di ProClinTM 300 come conservante. Pronto all'uso. 5. CONTROL – CONTROLLO NEGATIVO: Siero umano diluito negativo per gli anticorpi anti-HIV-1/2 e per l'antigene p24 dell'HIV. Contiene 0,1% di ProClinTM 300 come conservante. Pronto all'uso. BIOKIT, S.A. - Can Malé s/n - 08186 Lliçà d’Amunt - Barcelona - SPAIN 3000-1172_R01_02.2015_ita.docx 0843 44 bioelisa 6. DIL SAMP DILUENTE DEI CAMPIONI: Anticorpi monoclonali biotinilati contro l'antigene p24 dell'HIV, diluiti nel tampone Tris. Contiene 0,05% di ProClinTM 300 come conservante e colorante rosso. Pronto all'uso. 7. CONJ 1 CONIUGATO 1 PRONTO ALL'USO: Tampone fosfato contenente antigeni biotinilati dell'HIV-1 e HIV-2. Contiene 0,05% di ProClinTM 300 come conservante e colorante blu. Pronto all'uso. 8. DIL CONJ 2 DILUENTE DEL CONIUGATO 2: Tampone fosfato contenente stabilizzanti proteici e 0,05% di ProClinTM 300 come conservante e colorante giallo. 9. CONJ 2 101X CONIUGATO CONCENTRATO 2 (101X): Contiene streptavidina marcata con perossidasi. Da diluire ad un rapporto 1:101 nel diluente del coniugato 2 prima dell'uso. 10. SUBS TMB SUBSTRATO-TMB: Contiene 3,3',5,5'-tetrametilbenzidina (TMB) e perossido di idrogeno. Pronto all'uso. 11. WASH SOLN 25x SOLUZIONE DI LAVAGGIO CONCENTRATA: Tampone PBS concentrato con pH 7,4 (25x). Contiene Tween-20 come detergente e <0,2% di ProClinTM 300 come conservante. Da diluire ad un rapporto 1:25 in acqua distillata o deionizzata prima dell'uso. 12. H2SO4 0,8N. SOLUZIONE STOPPANTE: Acido solforico 0,8 N. Pronto all'uso. 13. SEALS FOGLI ADESIVI: Per coprire la micropiastra durante le incubazioni. 14. BAG SACCHETTO RICHIUDIBILE: Per la conservazione delle strisce inutilizzate. Precauzioni bioelisa HIV-1+2 Ag/Ab è concepito per uso diagnostico IN VITRO. Solo per uso professionale. AVVERTENZA: Il controllo negativo, il controllo positivo HIV-1, il controllo positivo HIV-2, il controllo positivo HIV-p24, il diluente dei campioni, il coniugato 1, il diluente del coniugato 2 e la soluzione di lavaggio concentrata contengono <0,2% di ProClinTM 300 come conservante. Indicazioni di pericolo H317: Può provocare una reazione allergica cutanea. Consigli di prudenza P280: Indossare guanti/indumenti protettivi/Proteggere gli occhi/il viso. P302+P352: IN CASO DI CONTATTO CON LA PELLE: Lavare abbondantemente con acqua e sapone. P333+P313: In caso di irritazione o eruzione della pelle: consultare un medico. P363: Lavare gli indumenti contaminati prima di indossarli nuovamente. P501: Smaltire il prodotto/recipiente in conformità con le norme locali/regionali/nazionali/internazionali. AVVERTENZA: MATERIALE A RISCHIO BIOLOGICO. Tutti i materiali di origine umana impiegati nell'elaborazione di questo prodotto sono risultati negativi ai test degli anticorpi anti-HCV, degli anticorpi anti-Treponema pallidum, dell'antigene di superficie dell'epatite B e degli anticorpi anti-HIV-1/2 (ad eccezione dei controlli positivi 1 e 2) condotti mediante un metodo autorizzato in commercio. Ciononostante, poiché non esiste un metodo analitico che possa garantire la totale assenza di agenti infettivi, questo prodotto deve essere trattato con precauzione. - Evitare il contatto dei reagenti con gli occhi e la pelle. In caso di contatto, lavare abbondantemente con acqua. Indossare dei guanti. Non pipettare con la bocca. Non fumare. BIOKIT, S.A. - Can Malé s/n - 08186 Lliçà d’Amunt - Barcelona - SPAIN 3000-1172_R01_02.2015_ita.docx 0843 45 bioelisa Smaltire tutti i materiali usati in appositi recipienti per materiale biocontaminante. Raccogliere in un recipiente adeguato i residui di campioni, controlli, reagenti aspirati e puntali per pipette, e sterilizzarli in autoclave per 1 ora a 121°C o trattarli con ipoclorito di sodio al 10% (concentrazione finale) per 30 minuti prima dello smaltimento. (I residui contenenti acido devono essere neutralizzati prima dell'aggiunta dell'ipoclorito di sodio). Istruzioni di manipolazione: - - Per un lavaggio corretto, regolare il dispositivo di lavaggio a seconda della piastra utilizzata (a fondo piatto). Non mescolare i reagenti appartenenti a lotti differenti. Non usare i reagenti dopo la data di scadenza. Non usare il reagente se si osserva qualche cambiamento nell'aspetto dei componenti inclusi nel kit. Prestare particolare attenzione per evitare la contaminazione microbica e la contaminazione crociata dei reagenti. Utilizzare un nuovo puntale per ciascun campione e ciascun reagente. Non scambiare reagenti appartenenti a lotti diversi né utilizzare reagenti provenienti da altri kit disponibili in commercio. I componenti del kit sono perfettamente abbinati per ottenere prestazioni ottimali dai test. ATTENZIONE - FASE CRITICA: Lasciare che i reagenti e i campioni raggiungano la temperatura ambiente (20-25°C) prima dell'uso. Agitare delicatamente il reagente prima dell'uso. Riportare a una temperatura di 2-8°C subito dopo l'uso. L'attività enzimatica del coniugato 2 potrebbe essere influenzata dalla polvere e da sostanze chimiche reattive, quali ipoclorito di sodio, acidi, alcali ecc. Non eseguire il test in presenza di queste sostanze. È fondamentale conservare la soluzione substrato-TMB in un contenitore ben chiuso e al riparo dalla luce. I saponi e/o gli agenti ossidanti che rimangono nei contenitori utilizzati per la soluzione substrato-TMB possono interferire con la reazione. Se vengono utilizzati contenitori di vetro o contenitori di plastica riutilizzati, questi devono essere lavati con acido cloridrico o solforico 1N, sciacquati abbondantemente con acqua distillata e asciugati prima dell'uso. Si consiglia di utilizzare contenitori di plastica usa e getta. Conservazione e stabilità I componenti rimarranno stabili fino alla data di scadenza indicata sull'etichetta se conservati a 2-8°C. Il sacchetto contenente la micropiastra deve essere portato a temperatura ambiente prima dell'apertura, al fine di evitare la formazione di condensa nei pozzetti. Una volta aperto il sacchetto, i pozzetti restano stabili per 3 mesi se conservati a 2-8°C nel sacchetto di plastica ben sigillata, assieme al gel di silice. Eliminare le micropiastre sigillate senza gel di silice. Una volta diluita, la soluzione di lavaggio è stabile per 6 giorni solo se conservata a 2-8°C. Non utilizzare le soluzioni di lavaggio diluite che siano state lasciate a temperatura ambiente durante la notte. Una volta diluito, il coniugato 2 è stabile per 30 giorni a 2-8°C. Conservare la soluzione substrato-TMB al buio. Confezioni disponibili: kit da 1 micropiastra (1 x 96 test), REF 3000-1172. Contiene: 1 micropiastra, 1 x 2 mL di controllo negativo, 1 x 2 mL di controllo positivo HIV-1, 1 x 2 mL di controllo positivo HIV-2, 1 x 2 mL di controllo positivo HIV-1 p24, 1 x 14 mL di diluente dei campioni, 1 x 25 mL di coniugato 1 pronto all'uso,1 x 0,250 mL di coniugato concentrato 2 (101x), 1 x 25 mL di diluente del coniugato 2, 1 x 20 mL di substrato-TMB, 1 x 12 mL di soluzione stoppante, 2 x 50 mL di soluzione di lavaggio concentrata, 1 sacchetto richiudibile e fogli adesivi. - kit da 5 micropiastre (5 x 96 test), REF 3000-1173. Contiene: 5 micropiastre, 1 x 4 mL di controllo negativo, 1 x 4 mL di controllo positivo HIV-1, 1 x 4 mL di controllo positivo HIV-2, 1 x 4 mL di controllo positivo HIV-1 p24, 1 x 70 mL di diluente dei campioni, 1 x 120 mL di coniugato 1 pronto all'uso,1 x 1,2 mL di coniugato concentrato 2 (101x), 1 x 120 mL di diluente del coniugato 2, 1 x 100 mL di substrato-TMB, 1 x 60 mL di soluzione stoppante, 3 x 100 mL di soluzione di lavaggio concentrata, 1 sacchetto richiudibile e fogli adesivi. Materiale necessario non incluso Acqua distillata o deionizzata. Timer e guanti monouso. Recipienti appositi per materiali potenzialmente contaminati. Recipienti monouso a forma di V. Sistema di erogazione e/o pipetta (singola o multicanale) e puntali monouso. Tessuto assorbente o asciugamano pulito. Incubatrice a secco o bagnomaria, a 37 ± 1°C. Lettore di micropiastre con filtro da 450 nm. Si consiglia l'uso di un filtro di riferimento da 620 o 630 nm. Sistema di lavaggio automatico o manuale. BIOKIT, S.A. - Can Malé s/n - 08186 Lliçà d’Amunt - Barcelona - SPAIN 3000-1172_R01_02.2015_ita.docx 0843 46 bioelisa Raccolta dei campioni Utilizzare siero fresco con o senza provette con gel separatore di siero (SST), plasma in EDTA, plasma in acido citrico-citrato-destrosio (ACD), plasma in eparina di litio, plasma in eparina di sodio, plasma in citrato di sodio, plasma in fluoruro di sodio/ossalato di potassio, plasma in CPDA e CPD. Controllare altri anticoagulanti prima del loro uso. I campioni possono essere conservati tra 2°C e 8°C per 8 giorni. Per conservarli durante un periodo di tempo più lungo dovranno essere congelati (a -20°C). Evitare cicli ripetuti di congelamento e scongelamento (massimo 4 cicli). Le particelle in sospensione eventualmente presenti nei campioni devono essere eliminate per centrifugazione. I campioni di siero o plasma non dovrebbero essere inattivati mediante calore, poiché ciò può portare a risultati errati. Trattamento automatico È possibile utilizzare il test automatizzato o semi-automatizzato con strumenti diversi. È molto importante convalidare qualsiasi sistema automatizzato per dimostrare che i risultati ottenuti per i campioni sono equivalenti a quelli ottenuti con il test manuale. Si raccomanda agli utenti di convalidare periodicamente lo strumento. In caso di difficoltà nella programmazione e nella configurazione dei processori automatici di Biokit, contattare il distributore. PROCEDURA Operazioni preliminari Lasciare che tutti i reagenti raggiungano la temperatura ambiente (20-25°C) prima di eseguire il test. Mescolare delicatamente tutti i reagenti liquidi prima dell'uso. Verificare che la soluzione di lavaggio concentrata non contenga cristalli di sale. Qualora si siano formati dei cristalli, ridiluire la soluzione portandola a una temperatura di 37°C fino alla loro dissoluzione. Usare acqua distillata o deionizzata. I controlli negativi e positivi devono essere trattati come i campioni. Diluire la soluzione di lavaggio ad un rapporto 1:25 in acqua distillata. Se viene utilizzata l'intera piastra, aggiungere 40 mL di soluzione di lavaggio concentrata (25x) a 960 mL di acqua deionizzata. Se non viene utilizzata l'intera piastra, preparare il volume di soluzione proporzionale. Diluire il coniugato concentrato 2 ad un rapporto 1:101 con il diluente del coniugato 2 secondo la tabella 1. Per la confezione da 1 piastra, qualora venga utilizzata l'intera piastra, aggiungere 250 µL di coniugato concentrato direttamente nel flacone contenente 25 mL di diluente del coniugato. Mescolare delicatamente. TABELLA 1 Strisce necessarie Diluente del coniugato 2 Coniugato concentrato 2 mL µL 1 2,0 20 2 4,0 40 4 8,0 80 6 12,0 120 8 16,0 160 10 20,0 200 12 25,0 250 Esecuzione del test 1. Usare solo il numero di strisce necessarie per il test. Lasciare liberi 7 pozzetti per il bianco e i controlli. Un pozzetto come bianco (ad es. A1), tre pozzetti come controllo negativo (ad es. B1, C1, D1) e almeno un pozzetto per ciascun controllo positivo: controllo positivo HIV-1 (ad es. E1), controllo positivo HIV-2 (ad es. F1) e controllo positivo HIV-p24 (ad es. G1). 2. Aggiungere 100 µL di diluente dei campioni a tutti i pozzetti ad eccezione di quello del bianco. 3. Aggiungere nei relativi pozzetti dapprima 100 μL di campioni e quindi 100 μL di controllo negativo e di ciascun controllo positivo. 4. Coprire la piastra con un foglio adesivo, mescolare delicatamente e incubare a 37°C ± 1°C per 60 minuti con un intervallo di tolleranza di 58-65 minuti. 5. Rimuovere il foglio adesivo e gettarlo via. Aspirare il contenuto dei pozzetti e riempirli completamente (circa 350 µL) con la soluzione di lavaggio diluita. Ripetere il processo di aspirazione e di lavaggio altre 4 volte, per un totale di 5 (cinque) cicli. Assicurarsi che ogni colonna di pozzetti resti ammollo per almeno 15 secondi prima del successivo ciclo di aspirazione. 6. Trasferire 200 µL di coniugato 1 in ciascun pozzetto, tranne in quello riservato per il bianco del substrato. Evitare la formazione di bolle con l'aggiunta. BIOKIT, S.A. - Can Malé s/n - 08186 Lliçà d’Amunt - Barcelona - SPAIN 3000-1172_R01_02.2015_ita.docx 0843 47 bioelisa 7. Coprire la micropiastra con un foglio adesivo e incubare a 37°C ± 1°C per 30 minuti con un intervallo di tolleranza di 28-35 minuti. 8. Rimuovere il foglio adesivo e gettarlo via. Aspirare e lavare i pozzetti come nella fase di lavaggio precedente per 3 (tre) cicli di lavaggio. 9. Trasferire 200 µL di coniugato di lavoro 2 in ciascun pozzetto, tranne in quello riservato per il bianco del substrato. Evitare la formazione di bolle con l'aggiunta. 10. Coprire la micropiastra con un foglio adesivo e incubare a 37°C ± 1°C per 30 minuti con un intervallo di tolleranza di 28-35 minuti. 11. Rimuovere il foglio adesivo e gettarlo via. Aspirare e lavare i pozzetti come nel passo 5 per 5 (cinque) cicli di lavaggio. 12. Aggiungere 150 µL di soluzione substrato-TMB in ciascun pozzetto, compreso quello del bianco. 13. Incubare a temperatura ambiente (20-25°C) per 30 minuti con un intervallo di tolleranza di 28-35 minuti, al riparo dalla luce diretta. 14. Interrompere la reazione aggiungendo 100 µL di soluzione stoppante nella stessa sequenza e con i medesimi intervalli di tempo impiegati per il substrato-TMB. 15. Azzerare il lettore a 450 nm con il pozzetto del bianco e leggere l’assorbanza di ciascun pozzetto entro 30 minuti. Si raccomanda di effettuare la lettura in modalità bicromatica con un filtro di riferimento da 620-630 nm. Controllo di qualità I risultati di un test sono validi se vengono soddisfatti i seguenti criteri: 1. Il valore di assorbanza del pozzetto del bianco deve essere ≤0,100. 2. Il valore di assorbanza dei controlli positivi deve essere ≥0,900 dopo la sottrazione del bianco. In caso contrario, occorre ripetere il test. 3. Ciascun valore di assorbanza individuale del controllo negativo deve essere ≤0,120 dopo la sottrazione del bianco. Se uno dei valori del controllo negativo non soddisfa i criteri del Controllo di qualità, deve essere eliminato e il valore medio deve essere ricalcolato utilizzando i due valori restanti. Se due o più valori di assorbanza del controllo negativo non soddisfano le specifiche del Range del controllo della qualità, il test non è valido e deve essere ripetuto. Risultati 1. Sottrarre il bianco da ciascuno dei controlli negativi validi. Calcolare l'assorbanza media del controllo negativo (CNx). Calcolare il valore di soglia aggiungendo 0,170 all'assorbanza media del controllo negativo. Valore di soglia = CNx + 0,170 Esempio: CNx = 0,011 2. valore di soglia = 0,011 + 0,170 = 0,181 Dividere l'assorbanza del campione per il valore di soglia. Positivo: Negativo: Equivoco: rapporto assorbanza/ valore di soglia ≥1,0 rapporto assorbanza/ valore di soglia <0,9 rapporto assorbanza/ valore di soglia ≥0,9 e <1,0 Interpretazione dei risultati Risultati negativi: i campioni con un rapporto assorbanza/ valore di soglia inferiore a 0,9 sono considerati non reattivi; ciò indica che mediante il kit bioelisa HIV-1+2 Ag/Ab non sono stati rilevati anticorpi anti-HIV-1 e/o anti-HIV-2 né l'antigene p24 dell'HIV. Risultati positivi: i campioni con un'assorbanza uguale o superiore al valore di soglia sono considerati inizialmente reattivi; ciò indica che mediante bioelisa HIV-1+2 Ag/Ab sono stati probabilmente rilevati anticorpi anti-HIV-1/2 o l'antigene p24 dell'HIV. Tutti i campioni inizialmente reattivi dovrebbero essere riesaminati in duplicato per confermare il risultato iniziale. BIOKIT, S.A. - Can Malé s/n - 08186 Lliçà d’Amunt - Barcelona - SPAIN 3000-1172_R01_02.2015_ita.docx 0843 48 bioelisa Risultati equivoci: i campioni con rapporto assorbanza/valore di soglia tra 0,9 e 1,0 sono considerati equivoci, ed è necessario riesaminarli in duplicato per confermare i risultati iniziali. - Se, dopo aver ripetuto il test per i campioni inizialmente reattivi, entrambi i pozzetti riportano risultati negativi (S/CO <0,9), i campioni riesaminati devono essere considerati come positivi non ripetibili (o falsi positivi) e registrati come negativi. - Se, dopo aver ripetuto il test in duplicato, uno o entrambi i pozzetti riportano risultati positivi, il risultato finale di questo test ELISA dovrebbe essere registrato come ripetutamente reattivo. I campioni ripetutamente reattivi possono essere considerati positivi per gli anticorpi anti-HIV-1/2 o l'antigene p24, pertanto il paziente è probabilmente infetto da HIV-1 o HIV-2. - Dopo il secondo test in duplicato, i campioni con valori vicini al valore di soglia devono essere interpretati con cautela e considerati equivoci o non interpretabili al momento del test. - Tutti i campioni positivi devono essere sottoposti a follow-up, confermati e riesaminati con altri sistemi di analisi (ad es. WB, PCR). La diagnosi clinica non dovrebbe essere stabilita sulla base di un singolo test. Essa dovrebbe integrare i dati e i risultati clinici e di altri esami di laboratorio. Limitazioni della procedura - Per ottenere prestazioni ottimali dal test occorre seguire rigorosamente le procedure illustrate. Qualsiasi deviazione dalla procedura può provocare risultati erronei. - Come in tutti i test immunologici sensibili, vi è la possibilità di ottenere risultati positivi non ripetibili. - I risultati positivi devono essere confermati con un altro metodo disponibile e interpretati in combinazione con le informazioni cliniche del paziente. - I risultati negativi ottenuti con bioelisa HIV-1+2 Ag/Ab sono considerati negativi per gli anticorpi anti-HIV-1/2 e l'antigene p24 e non sono necessari ulteriori test. - La prevalenza del marcatore influenzerà i valori predittivi del test. - Questo test non può essere utilizzato per analizzare campioni di plasma raggruppati (misti). bioelisa HIV-1+2 Ag/Ab è stato valutato per l'analisi di un unico campione di siero o plasma. - bioelisa HIV-1+2 Ag/Ab è un test qualitativo e i suoi risultati non possono essere utilizzati per misurare le concentrazioni degli anticorpi anti-HIV o dell'antigene p24. Questo test non è in grado di differenziale le infezioni da HIV-1 da quelle da HIV-2. - Un risultato negativo non esclude la possibilità di esposizione o infezione da HIV. Risultati previsti Il numero di risultati positivi dipende dall'incidenza della malattia nella zona geografica e nel tipo di popolazione testata. Nel mondo, l'incidenza dell'HIV in individui di età superiore a 15 anni registra valori variabili: 0,1% in Australia, Nuova Zelanda e Asia Pacifica, 0,3% in Europa occidentale, Nordafrica e Medio Oriente, 0,5% in Europa orientale, Asia centrale e America Latina, 0,6% in Nord America e Asia meridionale, e 9% nell'Africa subsahariana. All'interno di uno stesso Paese, l'incidenza varia enormemente a seconda della popolazione testata. In Europa occidentale, la prevalenza degli anticorpi anti-HIV nelle donazioni di sangue varia da 0 a 5 casi su 100.000 donazioni, mentre l'incidenza in popolazioni a rischio quali detenuti, lavoratori del sesso e tossicodipendenti può facilmente raggiungere il 20%. Caratteristiche funzionali Sensibilità analitica Il limite di rilevazione è risultato inferiore a 0,5 UI/mL nel test dell'antigene p24 dell'HIV della OMS (primo reagente di riferimento internazionale, codice NIBSC 90/636) con due lotti differenti durante la valutazione interna. Inoltre, il limite di rilevamento è risultato inferiore a 12,5 pg/mL nel test dell'antigene dell'HIV-1 di BIORAD Standard 72217 con due lotti differenti durante la valutazione interna. Sensibilità È stato valutato con bioelisa HIV 1+2 Ag/Ab un totale di 537 campioni positivi all'HIV-1, tra cui: 28 campioni positivi all'HIV-1 freschi, raccolti lo stesso giorno, 85 campioni positivi all'HIV-1 e 4 campioni positivi all'HIV-1 di sottotipo O analizzati in un laboratorio europeo di riferimento; 380 campioni positivi all'HIV-1 valutati in Biokit e 40 campioni positivi all'HIV-1 di sottotipo non B (e almeno 3 campioni di ciascun sottotipo di HIV-1) esaminati in un altro laboratorio europeo di riferimento. bioelisa HIV 1+2 Ag/Ab ha rilevato tutti i 537 campioni. La sensibilità riscontrata è stata del 100% (537/537). BIOKIT, S.A. - Can Malé s/n - 08186 Lliçà d’Amunt - Barcelona - SPAIN 3000-1172_R01_02.2015_ita.docx 0843 49 bioelisa - È stato valutato con bioelisa HIV 1+2 Ag/Ab un totale di 115 campioni positivi all'HIV-2, tra cui: 27 campioni positivi all'HIV-2 analizzati in un laboratorio europeo di riferimento e 88 campioni positivi all'HIV-2 esaminati in Biokit. bioelisa HIV 1+2 Ag/Ab ha rilevato tutti i 115 campioni. La sensibilità riscontrata è stata del 100% (115/115). - È stato valutato con bioelisa HIV 1+2 Ag/Ab un totale di 61 campioni positivi all'antigene p24 dell'HIV-1, tra cui: 15 campioni analizzati in un laboratorio europeo di riferimento, 16 campioni valutati in un altro laboratorio europeo di riferimento e 30 campioni esaminati in Biokit. bioelisa HIV 1+2 Ag/Ab ha rilevato tutti i 61 campioni. La sensibilità riscontrata è stata del 100% (61/61). - Ulteriori studi di sensibilità sono stati condotti testando un totale di 31 pannelli di sieroconversione in Biokit e in un laboratorio europeo di riferimento. I risultati ottenuti sono stati paragonabili al metodo commerciale più sensibile per l'individuazione degli anticorpi e dell'antigene del virus HIV 1+2. - Sono stati valutati presso Biokit 16 pannelli di sieroconversione per l'HIV di BBI/SeraCare e Zeptometrix. bioelisa HIV-1+2 Ag/Ab ha individuato correttamente tutti i campioni positivi. Pannello di sieroconversione BB1-PRB965-n=6 ZEPT-12007-n=9 BBI-PRB954-n=7 BBI-PRB932-n=9 ZEPT-9017-n=11 ZEPT-9014-n=7 ZEPT-9012-n=8 ZEPT-9032-n=14 ZEPT-6243-n=10 ZEPT-9022-n=9 ZEPT-9018-n=11 BBI-PRB939-n=9 BBI-PRB956-n=5 BBI-PRB945-n=6 BBI-PRB955-n=4 BBI-PRB958-n=6 bioelisa HIV Ag/Ab 2 4 6 4 1 1 5 8 7 7 9 6 4 3 2 3 Antigene p24 dell'HIV Primo campione identificato positivo nel pannello 2 4 2 4 5 ND 6 7 6 ND 4 4 4 3 1 1 3 1 6 7 5 8 7 8 7 8 7 8 9 7 9 10 9 ND 8 6 4 5 4 4 4 3 2 4 2 3 5 3 Test HIV Ag/Ab Test HIV Ab NAT 1 4 4 4 1 1 1 1 1 1 1 5 2 1 1 1 - Nella tabella di cui sopra si può osservare il primo campione individuato come positivo in ciascun pannello valutato con bioelisa HIV-1+2 Ag/Ab rispetto ai test di 4a generazione (test Ag/Ab), ai test di 3a generazione (test Ab), ai test per l'antigene p24 dell'HIV e ai test HIV RNA NAT. bioelisa HIV-1+2 Ag/Ab ha mostrato un'eccellente sensibilità nell'individuazione degli anticorpi o dell'antigene precoce nei 16 pannelli di sieroconversione per l'HIV valutati. - È stato altresì condotto un altro studio per valutare la sensibilità in 32 campioni di sieroconversione precoce. Questo tipo di campioni si contraddistinguono per essere positivi alla presenza dell'antigene p24 per l'HIV e/o positivi al NAT (test dell'acido nucleico), non rilevati da tutti i metodi di 3ª generazione e con risultato negativo o indeterminato in test Western-Blot. bioelisa HIV 1+2 Ag/Ab ha rilevato tutti i 32 campioni. La sensibilità riscontrata è stata del 100% (32/32). - Infine, in un laboratorio europeo di riferimento, sono stati analizzati 50 surnatanti di coltura cellulare provenienti da colture di cellule dell'HIV, compresi i diversi sottotipi di HIV-1 e HIV-2. bioelisa HIV 1+2 Ag/Ab ha rilevato tutti i 50 campioni. La sensibilità riscontrata è stata del 100% (50/50). BIOKIT, S.A. - Can Malé s/n - 08186 Lliçà d’Amunt - Barcelona - SPAIN 3000-1172_R01_02.2015_ita.docx 0843 50 bioelisa Specificità La specificità è stata valutata testando un totale di 6.465 campioni di donatori di sangue non selezionati presso tre diversi centri. - Nel primo centro sono stati testati 3.045 campioni non selezionati, tra cui 684 di donatori nuovi (prima donazione). 4 di questi campioni sono risultati reattivi. La specificità ottenuta in questo studio è stata del 99,87% (3.041/3.045). - Nel secondo centro sono stati testati 500 campioni non selezionati provenienti dalla Banca del sangue. Tutti i 500 campioni sono risultati negativi. La specificità riscontrata è stata del 100% (500/500). - È stata effettuata una valutazione interna di 2.920 campioni non selezionati provenienti dalla Banca del sangue. 6 di questi campioni sono risultati reattivi. La specificità ottenuta in questo studio è stata del 99,79% (2.914/2.920). Nella tabella seguente viene riportata una sintesi dettagliata di questi studi di specificità. Valutazione 1 (3.045 campioni di siero) Siero Inizialmente reattivi Ripetutamente reattivo Falso positivo Specificità (%) 6 4 4 99,87 (I.C. 95%: 99.66 - 99.96) Valutazione 2 (500 campioni di siero) Siero Inizialmente reattivi Ripetutamente reattivo Falso positivo Specificità (%) 0 0 0 100 (I.C. 95%: 98.89 - 100) Valutazione interna (1.000 campioni di siero + 1.920 campioni di plasma) - Inizialmente reattivi Ripetutamente reattivo Falso positivo Specificità (%) Plasma 8 6 6 99,69 (I.C. 95%: 99.32 - 99.89) Siero 1 0 0 100 (I.C. 95%: 99.44 - 100) Totale 9 6 6 99,79 (I.C. 95%: 99.55 - 99.93) Sono stati testati e confrontati con un test di riferimento oltre 200 campioni di pazienti ricoverati. 194 campioni sono risultati negativi con entrambi i test e sei campioni sono risultati reattivi. I sei campioni sono risultati reattivi anche in altri test ELISA. La specificità ottenuta in questo studio è stata del 100% (194/194). Precisione Riproducibilità intra-test: Il coefficiente di variazione ottenuto per i valori di assorbanza di un campione positivo all'HIV-1, testato in un minimo di 40 duplicati, è stato del 3,42%, 5,79% e 4,71% in tre lotti studiati. Il coefficiente di variazione ottenuto per i valori di assorbanza di un campione positivo all'HIV-2, testato in un minimo di 40 duplicati, è stato del 6,39%, 5,91% e 8,38% in tre lotti studiati. Il coefficiente di variazione ottenuto per i valori di assorbanza di un campione positivo all'antigene p24 dell'HIV-1, testato in un minimo di 40 duplicati, è stato del 4,08%, 3,44% e 3,71% in tre lotti studiati. Riproducibilità inter-test: Quattro campioni positivi di diversi livelli sono stati testati in 15 diversi test. I coefficienti di variazione ottenuti per i rapporti assorbanza/valore di soglia dei quattro campioni sono stati pari a 4,87%, 5,37%, 7,49% e 7,54%. Interferenze Interferenza per aggiunta Non è stata rilevata alcuna interferenza per l'emoglobina (500 mg/dL), la bilirubina (20 mg/dL), l'albumina umana (5 g/dL) e i trigliceridi (500 mg/dL). BIOKIT, S.A. - Can Malé s/n - 08186 Lliçà d’Amunt - Barcelona - SPAIN 3000-1172_R01_02.2015_ita.docx 0843 51 bioelisa Reattività crociata Per valutare le possibili interferenze, sono stati analizzati 125 campioni cross-reagenti potenziali. I campioni analizzati includevano: 4 campioni positivi al fattore reumatoide (RF+), 4 campioni positivi agli anticorpi antinucleo (ANA), 5 campioni positivi alla mononucleosi, 89 campioni positivi ad altre malattie infettive correlate, e 23 campioni provenienti da donne in gravidanza. Nei campioni valutati non è stata trovata alcuna evidenza di reattività crociata. I 2 campioni anti-Toxoplasma IgM che sono risultati positivi hanno dato risultato positivo anche in altri test per l'HIV. Potenziali campioni interferenti = 125 RF (fattore reumatoide) ‐ 4 IgG elevate ‐ 4 ANA (anticorpi anti‐nucleo) ‐ 4 IgM elevate ‐ 5 Mononucleosi ‐ 5 HSV 1 IgG (virus Herpes simplex) ‐ 5 Donne in gravidanza ‐ 23 (incluse 7 multipare) HSV 2 IgG (virus Herpes simplex) ‐ 4 Anticorpi anti‐sifilide ‐ 6 anti‐CMV IgG (citomegalovirus) ‐ 5 anti‐EBV (virus di Epstein‐Barr) ‐ 3 anti‐CMV IgM (citomegalovirus) ‐ 7 anti‐Rubella (virus della rosolia) ‐ 4 anti‐HTLV (virus T‐linfotropico umano) ‐ 4 anti‐VZV IgG (virus della Varicella‐Zoster) ‐ 2 anti‐HCV (virus dell'Epatite C) ‐ 8 anti‐VZV IgM (virus della Varicella‐Zoster) ‐ 2 anti‐E.coli (Escherichia coli) ‐ 5 anti‐Toxoplasma IgG (T. gondii) ‐ 10 HBsAg (antigene dell'epatite B) ‐ 8 anti‐Toxoplasma IgM (T. gondii) ‐ 7 BIOKIT, S.A. - Can Malé s/n - 08186 Lliçà d’Amunt - Barcelona - SPAIN 3000-1172_R01_02.2015_ita.docx 0843 52 bioelisa bioelisa: Guida alla soluzione dei problemi Problema Possibili cause 1. Controlli non convalidati. 1a. Temperatura, tempistica o pipettaggio scorretti. 1b. Preparazione inadeguata dei reagenti, errore di diluizione, reagenti non mescolati correttamente. 1c. Contaminazione crociata dei controlli. 1d. 1e. 1f. 1g. 2. Assenza di colore o sviluppo solo di un colore chiaro al termine del test. 2a. 2b. 2c. 2d. 2e. Soluzione Controllare la procedura. Ripetere il test. Controllare la procedura. Ripetere il test. Pipettare con cautela. Non scambiare i cappucci. Ripetere il test. Filtro di lettura errato. Verificare che la lunghezza d'onda del filtro usato sia di 450 nm. Se non viene usato alcun riferimento da 620-630 nm, l'assorbanza aumenta di circa 0,050. Interferenza nel percorso Controllare il lettore. Pulire e ottico. asciugare il fondo della micropiastra. Verificare che non vi siano bolle d'aria. Ripetere la lettura. Componenti usati Non utilizzare componenti appartenenti a lotti appartenenti a lotti diversi diversi. poiché essi sono regolati specificatamente per ciascun lotto prodotto. Reagenti scaduti. Controllare la data di scadenza del kit. Utilizzare un kit non scaduto. Uno o più reagenti non Controllare la procedura. sono stati aggiunti o sono Ripetere il test. stati aggiunti in una sequenza errata. Coniugato inattivo. Verificare la presenza di Diluizione scorretta del contaminazione. Controllare coniugato concentrato 2. la procedura. Ripetere il test. Conservazione scorretta. Micropiastra inattiva: Tenere sempre le strisce Conservazione scorretta. inutilizzate nel sacchetto ben chiuso, con l'essiccante all'interno. Ripetere il test. Substrato-TMB inattivo: Utilizzare recipienti monouso Conservazione scorretta. o lavare con acido o etanolo e Il recipiente utilizzato sciacquare con acqua influenza la stabilità del deionizzata prima del substrato-TMB, riutilizzo. Controllare la contaminazione crociata procedura. Ripetere il test. con la soluzione stoppante. Reagenti troppo freddi. Lasciare che i reagenti raggiungano la temperatura ambiente prima dell'uso. BIOKIT, S.A. - Can Malé s/n - 08186 Lliçà d’Amunt - Barcelona - SPAIN 3000-1172_R01_02.2015_ita.docx 0843 53 bioelisa bioelisa: Guida alla soluzione dei problemi Problema Possibili cause 3. Eccessiva quantità di colore in tutti i pozzetti della micropiastra. 3a. Soluzione substrato-TMB Verificare che il substrato sia contaminata od ossidata. incolore; eliminarlo se è blu. Usare recipienti monouso o lavati con acido o etanolo. Ripetere il test. 3b. Reagenti contaminati o Verificare la presenza di non preparati contaminazione: aspetto correttamente. torbido. Controllare le diluizioni. Ripetere il test. 3c. Soluzione di lavaggio Controllare la qualità contaminata (1x). dell'acqua distillata o deionizzata usata per la diluizione. Ripetere il test. 3d. Lavaggio insufficiente o Controllare il dispositivo di non omogeneo: volume di lavaggio. Riempire i pozzetti riempimento e/o con la soluzione di lavaggio aspirazione insufficiente o quasi fino al bordo; aspirare non uniforme. Numero di completamente la soluzione. cicli di lavaggio Aumentare il numero di cicli insufficiente; dispositivo di lavaggio. contaminato. 3e. Uso di una soluzione di Utilizzare unicamente la lavaggio di altri soluzione di lavaggio fornita fabbricanti. con il kit. 4a. Problemi di lavaggio. Vedere 3c, 3d, 3e. 4b. Pipette non calibrate o Utilizzare solo pipette puntali posizionati in calibrate, con puntali ben modo scorretto. posizionati, e pipettare con Pipettaggio scorretto. cautela, evitando bolle e schizzi. Ripetere il test. 4c. Reagenti troppo freddi o Lasciare che i reagenti non miscelati raggiungano la temperatura correttamente prima ambiente e miscelare dell'uso. accuratamente prima dell'uso. 4d. Correnti d'aria sulla Tenere la micropiastra al micropiastra durante riparo da correnti d'aria. l'incubazione. 4e. Tempo di aggiunta dei Sviluppare una tecnica campioni e/o reagenti coerente e uniforme. troppo lungo. Intervalli di tempo non uniformi. Bolle d'aria. 4f. Interferenza nel percorso Vedere 1e. ottico. 4. Scarsa riproducibilità o elevato numero di campioni reattivi non ripetibili. Soluzione BIOKIT, S.A. - Can Malé s/n - 08186 Lliçà d’Amunt - Barcelona - SPAIN 3000-1172_R01_02.2015_ita.docx 0843 54 bioelisa LER ALTERAÇÕES DESTACADAS bioelisa HIV-1+2 Ag/Ab 3000-1172 1 x 96 TESTS 3000-1173 5 x 96 TESTS (480) Teste ELISA para a detecção de anticorpos para o Vírus da Imunodeficiência Humana (HIV) tipo 1 (grupo M, O) ou tipo 2 e de antígeno HIV-p24 no soro humano ou amostras de plasma para laboratórios clínicos e como um ensaio de triagem de primeira linha em centros de hematologia. Sumário A evidência sorológica de infecção por HIV pode ser obtida ao testar-se a presença de antígenos ou anticorpos contra HIV no soro ou plasma de indivíduos com suspeita de infecção por HIV. O antígeno normalmente pode ser detectado tanto durante a fase aguda quanto a fase sintomática da AIDS. Os anticorpos contra HIV-1 e/ou HIV-2 podem ser detectados teoricamente por todo o período da infecção, começando na fase aguda ou pouco depois dela e durando até o estágio final da AIDS. O teste ELISA de quarta geração para HIV permite a determinação simultânea dos antígenos HIV p24 e dos anticorpos ao HIV-1/HIV-2, reduzindo assim a janela diagnóstica e permitindo um diagnóstico precoce de infecção aguda por HIV. Excetuando-se a transmissão sexual, a principal rota de infecção por HIV é a transfusão de sangue. O HIV pode estar presente tanto nas frações celulares quanto nas sem células do sangue humano. Portanto, todas as doações de sangue ou plasma devem ser testadas devido ao risco de transmissão de HIV por sangue contaminado. Essa medida pode ser realizada de forma bem sucedida pela realização de testes quanto a anticorpos contra HIV e antígeno p24 utilizando um teste ELISA de alta sensibilidade. Princípio bioelisa HIV-1+2 Ag/Ab é um ensaio imunoenzimático de quarta geração para a detecção simultânea e qualitativa de antígeno HIV p24 e anticorpos ao HIV-1 (grupos M e O) ou HIV-2. Os antígenos representando os epítopos do HIV-1 gp41 e HIV-2 gp36 são inseridos nos poços da microplaca juntamente com anticorpos monoclonais contra HIV p24. Na primeira etapa do ensaio imunológico, as amostras de soro ou plasma são colocadas nesses poços com o diluente de amostra contendo anticorpos biotinilados anti-p24. Se anticorpos específicos para HIV-1 e/ou HIV-2 estiverem presentes na amostra, eles formarão complexos estáveis com os antígenos HIV agregados nos poços. Caso o antígeno p24 esteja presente na amostra, ele irá se combinar simultaneamente aos anticorpos no poço e aos anticorpos biotinilados presentes no diluente de amostra. Os micropoços são lavados em seguida para remover as proteínas séricas não combinadas. Um conjunto de antígenos biotinilados é adicionado aos poços. Estes antígenos irão combinar-se aos anticorpos específicos capturados. Após uma segunda lavagem para remoção do conjugado não combinado, um segundo conjugado de estreptavidina-HRP é adicionado aos poços. Naqueles poços contendo o imunocomplexo "sanduíche", o cromógeno incolor será oxidado pelo conjugado de ligação e virará um produto de cor azul. A cor azul muda para amarelo ao se interromper a reação com ácido sulfúrico. A intensidade da cor pode ser medida e é proporcional à concentração de anticorpos anti-HIV 1/2 ou antígeno HIV p24 presente na amostra. Os poços contendo amostras negativas permanecem incolores. Componentes 1. MCPL MICROPLACA: 12 x 8 poços revestidos pelos antígenos representando os epítopos de HIV-1 gp41 e HIV-2 gp36 e anticorpos monoclonais contra p24. As placas são acondicionadas em uma bolsa de alumínio com dessecante. 2. CONTROL + 1 CONTROLE HIV-1 POSITIVO: Soro humano diluído contendo anticorpos contra HIV-1 (inativados por calor). Contém 0,1% de ProClinTM 300 como conservante. Pronto para usar. 3. CONTROL + 2 CONTROLE HIV-2 POSITIVO: Soro humano diluído contendo anticorpos contra HIV-2 (inativados por calor). Contém 0,1% de ProClinTM 300 como conservante. Pronto para usar. 4. CONTROL + Ag CONTROLE HIV POSITIVO p24: Soro humano diluído enriquecido com antígeno recombinante HIV-1 p24. Contém 0,1% de ProClinTM 300 como conservante. Pronto para usar. 5. CONTROL – CONTROLE NEGATIVO: Soro humano diluído negativo para anticorpos contra HIV-1/2 e antígeno HIV p24. Contém 0,1% de ProClinTM 300 como conservante. Pronto para usar. BIOKIT, S.A. - Can Malé s/n - 08186 Lliçà d’Amunt - Barcelona - SPAIN 3000-1172_R01_02.2015_por.docx 0843 55 bioelisa 6. DIL SAMP DILUENTE DE AMOSTRA: Anticorpos monoclonais biotinilados contra HIV p24 diluídos em tampão Tris. Contém 0,05% de ProClinTM 300 como conservante e corante vermelho. Pronto para usar. 7. CONJ 1 CONJUGADO 1 PRONTO PARA USAR: Tampão fosfato contendo antígenos biotinilados contra HIV-1 e HIV-2. Contém 0,05% de ProClinTM 300 como conservante e corante azul. Pronto para usar. 8. DIL CONJ 2 DILUENTE DO CONJUGADO 2: Tampão de fosfato contendo estabilizadores de proteína, 0,05% de ProClinTM 300 como conservante e corante amarelo. 9. CONJ 2 101X CONJUGADO 2 CONCENTRADO (101X): Contém estreptavidina marcada com peroxidase. Para ser diluído em 1:101 no diluente do conjugado 2 antes do uso. 10. SUBS TMB SUBSTRATO TMB: Contém 3,3', 5,5'-tetrametilbenzidina (TMB) e peróxido de hidrogênio. Pronto para usar. 11. WASH SOLN 25x SOLUÇÃO CONCENTRADA DE LAVAGEM: Tampão PBS concentrado pH 7,4 (25x). Contém Tween-20 como detergente, <0,2% de ProClinTM 300 como conservante. A ser diluído a 1:25 em água destilada ou deionizada antes do uso. 12. H2SO4 0.8N SOLUÇÃO DE PARAGEM: 0,8N de ácido sulfúrico. Pronto para usar. 13. SEALS FOLHAS ADESIVAS: Para cobrir as microplacas durante as incubações. 14. BAG BOLSA RESSELÁVEL: Para armazenamento das tiras não utilizadas. Precauções bioelisa HIV-1+2 Ag/Ab é destinado para o uso diagnóstico IN VITRO. Uso exclusivo por profissionais. ATENÇÃO: O Controle Negativo, Controle HIV-1 Positivo, Controle HIV-2 Positivo, Controle HIV p24 Positivo, Diluente de Amostra, Conjugado 1, Diluente do Conjugado 2 e Solução Concentrada de Lavagem contêm <0,2% de ProClinTM 300 como conservante. Advertências de perigo H317: Pode provocar uma reação alérgica cutânea. Recomendações de prudência P280: Usar luvas de proteção/vestuário de proteção/proteção ocular/proteção facial. P302+P352: SE ENTRAR EM CONTATO COM A PELE: Lavar abundantemente com sabonete e água. P333+P313: Em caso de irritação ou erupção cutânea: Consulte um médico. P363: Lavar a roupa contaminada antes de a voltar a usar. P501: Eliminar o conteúdo/recipiente de acordo com as regulações locais/regionais/nacionais/internacionais. ATENÇÃO: MATERIAL DE RISCO BIOLÓGICO POTENCIAL Todo o material de fonte humana utilizado na preparação deste produto não tinha presença de anticorpos HCV, anticorpos Treponema pallidum, antígeno de superfície da hepatite B e anticorpos HIV 1/2 (exceto para os Controles 1 e 2 Positivos), e foram utilizados de acordo com um método comercial licenciado. Dado que não existe um método analítico que possa garantir completamente a ausência de agentes infecciosos, este produto deve ser manipulado com precaução: - Evite o contato dos reagentes com os olhos e a pele. Caso isso ocorra, lave abundantemente com água. Use luvas. Não faça a pipetagem com a boca. Não fume. BIOKIT, S.A. - Can Malé s/n - 08186 Lliçà d’Amunt - Barcelona - SPAIN 3000-1172_R01_02.2015_por.docx 0843 56 bioelisa - Descarte todos os materiais usados em recipientes adequados para material de risco biológico. Amostras, controles, reagentes aspirados e pontas de pipeta que restarem devem ser coletados em um recipiente para esse fim e submetidos à autoclave por 1 hora a 121 °C ou tratados com hipoclorito de sódio a 10% (concentração final) por 30 min antes do descarte. (Restos contendo ácido devem ser neutralizados antes da adição do hipoclorito de sódio). Instruções de manuseio: - - Ajuste a lavadora à placa utilizada (fundo plano) para poder lavar corretamente. Não misture reagentes de lotes diferentes. Não utilize reagentes com a data de validade vencida. Não utilize o reagente se perceber qualquer alteração na aparência dos componentes, inclusive do kit. Tome muito cuidado para evitar contaminação microbiana e contaminação cruzada dos reagentes. Use uma nova ponta de pipeta para cada amostra e cada reagente. Não troque reagentes de lotes diferentes ou use reagentes de outros kits disponíveis no mercado. Os componentes do kit são precisamente combinados para o desempenho ideal dos testes. PRECAUÇÃO - ETAPA CRÍTICA: Espere os reagentes e as amostras atingirem a temperatura ambiente (20-25 °C) antes de usar. Agite levemente o reagente antes de usar. Retorne a 2-8 °C imediatamente após o uso. A atividade enzimática do conjugado 2 pode ser afetada por poeira e reativa a substâncias químicas como hipoclorito de sódio, ácidos, álcalis, etc. Não realize o ensaio se estas substâncias estiverem presentes. É muito importante manter a solução do substrato TMB em um recipiente bem fechado e evitar a exposição à luz. Sabões e/ou agentes oxidantes que sobrarem nos recipientes utilizados para a solução do substrato TMB podem interferir na reação. Se forem utilizados recipientes de vidro ou plástico reutilizáveis, eles devem ser lavados com 1N de ácido sulfúrico ou clorídrico, enxaguados bem com água destilada e secados antes do uso. Recomendamos o uso de recipientes de plástico descartáveis. Conservação e estabilidade Os componentes permanecerão estáveis até a data de validade exibida na bula se armazenados a 2-8 °C. A bolsa contendo a microplaca deve ser colocada à temperatura ambiente antes de ser aberta para evitar a condensação nos poços. Uma vez aberta a bolsa, os poços da microplaca permanecerão estáveis por 3 meses a 2-8 °C na bolsa plástica hermeticamente fechada e com sílica-gel. Descarte qualquer microplaca selada sem a sílica-gel. Uma vez diluída, a solução de lavagem é estável por 6 dias somente se armazenada a 2-8 °C. Não utilize soluções de lavagem diluídas se armazenadas de um dia para o outro à temperatura ambiente. Uma vez diluído, o conjugado 2 é estável por 30 dias a 2-8 °C. Armazene a solução do substrato TMB no escuro. Apresentações disponíveis kit de 1 microplaca (1x96 testes), REF 3000-1172. Contém: 1 microplaca, 1 x 2 mL controle negativo, 1 x 2 mL controle HIV-1 positivo, 1 x 2 mL controle HIV-2 positivo, 1 x 2 mL controle HIV-1 p24 positivo, 1 x 14 mL diluente de amostra, 1 x 25 mL conjugado 1 pronto para usar,1 x 0,250 mL conjugado 2 concentrado (101x), 1 x 25 mL diluente de conjugado 2, 1 x 20 mL substrato TMB, 1 x 12 mL solução de paragem, 2 x 50 mL solução concentrada de lavagem, 1 bolsa resselável e folhas adesivas. - kit de 5 microplacas (5 x 96 testes), REF 3000-1173. Contém: 5 microplacas, 1 x 4 mL controle negativo, 1 x 4 mL controle HIV-1 positivo, 1 x 4 mL controle HIV-2 positivo, 1 x 4 mL controle HIV-1 p24 positivo, 1 x 70 mL diluente de amostra, 1 x 120 mL conjugado 1 pronto para usar,1 x 1,2 mL conjugado 2 concentrado (101x), 1 x 120 mL diluente de conjugado 2, 1 x 100 mL substrato TMB, 1 x 60 mL solução de paragem, 3 x 100 mL solução concentrada de lavagem, 1 bolsa resselável e folhas adesivas. Material necessário não incluído Água destilada ou deionizada. Luvas descartáveis e cronômetro. Recipientes de descarte adequado para materiais potencialmente contaminados. Canaletas descartáveis em forma de V. Sistema de dispensação e/ou pipeta (de canal único ou múltiplo) e pontas de pipeta descartáveis. Pano absorvente ou toalha limpa. Incubadora a seco ou banho-maria, 37 ± 1 °C. Leitor de microplaca com um filtro de 450 nm. Sugere-se filtro de referência de 620 nm ou 630. Sistema de lavagem manual ou automática. BIOKIT, S.A. - Can Malé s/n - 08186 Lliçà d’Amunt - Barcelona - SPAIN 3000-1172_R01_02.2015_por.docx 0843 57 bioelisa Coleta de amostra Utilize soro fresco com ou sem um tubo separador de soro (SST), plasma com EDTA, plasma com ácido citrato dextrose (ACD), plasma com heparina de lítio, plasma com heparina de sódio, plasma com citrato de sódio, plasma com oxalato de potássio/fluoreto de sódio, plasma CPD e CPDA. Outros anticoagulantes devem ser avaliados antes do uso. As amostras podem ser armazenadas a 2-8 °C durante 8 dias. Para um período de tempo mais longo, as amostras devem ser congeladas (-20 °C). Evite congelamento e descongelamento repetitivos (máximo de 4 ciclos de congelamento-descongelamento). As amostras que apresentarem partículas em suspensão visíveis devem ser clarificadas por centrifugação. As amostras de soro ou plasma não devem ser inativadas por calor, pois isso pode gerar resultados incorretos. Processamento automático O ensaio automatizado ou semiautomatizado pode ser utilizado com diferentes instrumentos. É muito importante validar qualquer sistema automatizado para demonstrar que os resultados obtidos das amostras equivalham àqueles obtidos pelo ensaio manual. Recomenda-se que os usuários validem periodicamente o instrumento. Caso haja alguma dificuldade na programação e no ajuste dos processadores Biokit automáticos, entre em contato com seu distribuidor. PROCEDIMENTO Operações prévias Deixe que todos os reagentes atinjam a temperatura ambiente (20-25 °C) antes de realizar o ensaio. Misture suavemente todos os reagentes líquidos antes de usá-los. Verifique se o concentrado da solução para lavagem contém cristais de sal. Se os cristais tiverem se formado, solubilize novamente com aquecimento a 37 °C até que eles se dissolvam. Utilize água destilada ou deionizada. Os controles negativo e positivo devem ser tratados como as amostras. Dilua a solução de lavagem em 1:25 de água destilada. Se toda a placa for utilizada, adicione 40 mL de concentrado de solução de lavagem (25x) a 960 mL de água deionizada. Se não for utilizar a placa inteira, prepare o volume proporcional da solução. Dilua o conjugado 2 concentrado em 1:101 com o diluente do conjugado 2 de acordo com a tabela 1. Para a embalagem com 1 placa, se a placa inteira for utilizada, adicione 250 µL de conjugado concentrado diretamente no frasco contendo 25 mL de diluente de conjugado. Misture suavemente. TABELA 1 Tiras necessárias Diluente conjugado 2 Conjugado 2 concentrado mL µL 1 2,0 20 2 4,0 40 4 8,0 80 6 12,0 120 8 16,0 160 10 20,0 200 12 25,0 250 Realização da prova 1. Utilize somente o número de tiras necessárias para o teste. Reserve 7 poços para o branco e os controles. Um poço como branco (p. ex., A1), três poços como controle negativo (p. ex., B1, C1, D1) e pelo menos um poço para cada um dos controles positivos: controle HIV-1 positivo (p. ex., E1), controle HIV-2 positivo (p. ex., F1) e controle HIV p24 positivo (p. ex., G1). 2. Adicione 100 µL de diluente da amostra em todos os poços, exceto o branco. 3. Adicione primeiro 100 μL das amostras e, por último, 100 μL do negativo e cada um dos controles positivos em seus respectivos poços. 4. Cubra a placa com uma folha adesiva, misture suavemente e incube a 37 °C ± 1 °C por 60 minutos com uma faixa de tolerância de 58 – 65 minutos. 5. Retire e descarte a folha adesiva. Aspire os conteúdos dos poços e encha-os completamente com a solução diluída de lavagem (aproximadamente 350 µL). Repita o processo de aspiração e lavagem mais 4 vezes, 5 (cinco) ciclos no total. Certifique-se de que cada coluna de poços fique submersa por no mínimo 15 segundos antes do próximo ciclo de aspiração. 6. Transfira 200 µL do conjugado 1 em cada poço, exceto naquele reservado para o substrato do branco. Evite a formação de bolhas ao adicionar. BIOKIT, S.A. - Can Malé s/n - 08186 Lliçà d’Amunt - Barcelona - SPAIN 3000-1172_R01_02.2015_por.docx 0843 58 bioelisa 7. Cubra a microplaca com uma folha adesiva e incube a 37 °C ± 1 °C por 30 minutos com uma faixa de tolerância de 28 – 35 minutos. 8. Retire e descarte a folha adesiva. Aspire e lave os poços como na etapa de lavagem anterior por 3 (três) ciclos de lavagem. 9. Transfira 200 µL do conjugado de trabalho 2 em cada poço, exceto aquele reservado para o substrato do branco. Evite a formação de bolhas ao adicionar. 10. Cubra a microplaca com uma folha adesiva e incube a 37 °C ± 1 °C por 30 minutos com uma faixa de tolerância de 28 – 35 minutos. 11. Retire e descarte a folha adesiva. Aspire e lave os poços como na etapa 5, por 5 (cinco) ciclos de lavagem. 12. Adicione 150 µL da solução do substrato TMB a cada poço, incluindo o branco. 13. Incube à temperatura ambiente (20-25 °C) por 30 minutos com uma faixa de tolerância de 28 – 35 minutos, protegida da exposição direta à luz. 14. Interrompa a reação adicionando 100 µL de solução de paragem na mesma sequência e intervalos de tempo usados para o substrato TMB. 15. Faça o blanking do leitor a 450 nm com o poço de branco e leia a absorbância de cada poço em 30 minutos. Recomenda-se ler em modo dicromático usando um filtro de referência de 620 - 630 nm. Controle de qualidade Os resultados do ensaio são válidos se os seguintes critérios forem atingidos: 1. O valor de absorbância do poço de branco deve ser ≤ 0,100. 2. O valor de absorbância dos controles positivos deve ser ≥ 0,900 após a retirada do branco. Se não for, o ensaio deve ser repetido. 3. Cada valor de absorbância individual do controle negativo deve ser ≤ 0,120 após a retirada do branco. Se algum dos valores do controle negativo não atender aos critérios do Controle de Qualidade, ele deverá ser descartado e o valor médio calculado novamente utilizando os dois valores restantes. Se dois ou mais valores de absorbância do controle negativo não atenderem às especificações da Faixa do Controle de Qualidade, o teste foi inválido e deverá ser repetido. Resultados 1. Retire o branco de cada um dos controles negativos válidos. Calcule a absorbância média do controle negativo (CNx). Calcule o valor cut-off adicionando 0,170 à absorbância média do controle negativo. Valor Cut-off = CNx + 0,170 Exemplo: CNx = 0,011 2. valor cut-off = 0,011 + 0,170 = 0,181 Divida a absorbância da amostra pelo valor cut-off. Positivo: Negativo: Equívoco: razão absorbância/cut-off ≥ 1,0 razão absorbância/cut-off < 0,9 razão absorbância/cut-off ≥ 0,9 < 1,0 Interpretação de resultados Resultados negativos: As amostras com uma razão de absorbância para cut-off menor que 0,9 são consideradas não reativas, indicando que não foram detectados anticorpos anti-HIV 1 e/ou HIV-2 ou antígeno HIV p24 com o kit bioelisa HIV-1+2 Ag/Ab. Resultados positivos: As amostras com absorbância igual ou maior que o valor cut-off são consideradas inicialmente reativas, indicando que anticorpos anti-HIV 1/2 ou antígeno HIV p24 provavelmente tenham sido detectados pelo bioelisa HIV-1+2 Ag/Ab. Todas as amostras inicialmente reativas devem ser testadas novamente em duplicata para confirmar o resultado inicial. BIOKIT, S.A. - Can Malé s/n - 08186 Lliçà d’Amunt - Barcelona - SPAIN 3000-1172_R01_02.2015_por.docx 0843 59 bioelisa Equívoco: As amostras com uma razão de absorbância para cut-off entre 0,9 e 1,0 são consideradas equívocas e necessita-se a realização de um novo teste com estas amostras em duplicata para confirmar os resultados iniciais. - Se, após testar novamente as amostras inicialmente reativas, os dois poços gerarem resultados negativos (S/CO < 0,9), estas amostras devem ser consideradas como positivo não repetido (ou falso positivo) e registradas como negativas. - Se, após testar novamente em duplicata, um ou ambos os poços gerarem resultados positivos, o resultado final deste teste ELISA deve ser registrado como repetidamente reativo. As amostras repetidamente reativas podem ser consideradas positivas para anticorpos para HIV 1/2 ou antígeno p24, portanto, o paciente provavelmente está infectado por HIV1 ou HIV2. - Após testar novamente em duplicata, as amostras com valores próximos ao valor cut-off devem ser interpretadas com cuidado e consideradas como equívocas ou impassíveis de interpretação durante o tempo do teste. - Exige-se um acompanhamento, confirmação e teste complementar com outro sistema analítico (p. ex., WB, PCR) de qualquer amostra positiva. O diagnóstico clínico não deve ser estabelecido com base em apenas um resultado de teste. Ele deve conter também achados clínicos e outros dados laboratoriais. Limitações do procedimento - O desempenho ideal do ensaio requer uma adesão rigorosa ao procedimento do ensaio descrito. O desvio do procedimento pode levar a resultados anômalos. - Como em todos os ensaios imunológicos sensíveis, existe a possibilidade da obtenção de resultados positivos não repetidos. - Os resultados positivos devem ser confirmados com outro método disponível e interpretados em conjunto com as informações clínicas do paciente. - Os resultados negativos obtidos com bioelisa HIV-1+2 Ag/Ab são considerados negativos para anticorpos contra HIV-1/2 e antígeno p24 e não é necessária a realização de mais testes. - A prevalência do marcador afetará os valores preditivos do ensaio. - Este ensaio não pode ser utilizado para testar pool de plasma (agrupado). bioelisa HIV-1+2 Ag/Ab foi avaliado somente com amostras individuais de soro ou plasma. - bioelisa HIV-1+2 Ag/Ab é um ensaio qualitativo e os resultados não podem ser utilizados para medir as concentrações de anticorpos para HIV ou antígeno p24. Este ensaio não faz distinção entre as infecções com HIV-1 e HIV-2. - Um resultado negativo não exclui a possibilidade de exposição a ou infecção por HIV. Resultados esperados O número de resultados positivos depende da incidência da doença na área geográfica e do tipo de população testada. No mundo, a incidência de HIV nas pessoas acima de 15 anos varia de 0,1% na Austrália, Nova Zelândia e Ásia Pacífico, 0,3% na Europa Ocidental, Norte da África e Oriente Médio, 0,5% na Europa Oriental, Ásia Central e América Latina, 0,6% na América do Norte e Sul da Ásia e 9% na África Subsaariana. A incidência também varia muito dentro de um único país de acordo com a população testada. Na Europa Ocidental, a prevalência de anticorpos para HIV em doações para bancos de sangue varia de 0 a 5 casos para cada 100.000 doações, enquanto a incidência entre detentos, profissionais do sexo e usuários de drogas pode atingir facilmente os 20% nessas populações de risco. Características do procedimento Sensibilidade analítica O limite de detecção foi estimado abaixo de 0,5 IU/mL por meio do teste do Antígeno HIV p24 da OMS, First International Reference NIBSC código 90/636, com dois lotes diferentes durante a avaliação interna. Além disso, o limite de detecção também foi estimado abaixo de 12,5 pg/mL pelo teste BIORAD HIV-1 Antigen Standard 72217 com dois lotes diferentes durante a avaliação interna. Sensibilidade Um total de 537 amostras positivas para HIV-1 foram avaliadas com bioelisa HIV 1+2 Ag/Ab, entre elas: 28 amostras de HIV-1 coletadas frescas no mesmo dia, 85 HIV-1 e 4 amostras HIV-1 do subtipo O em um laboratório de referência europeia; 380 amostras de HIV -1 foram avaliadas na Biokit e 40 amostras de HIV-1 subtipo não B (e pelo menos 3 amostras de cada subtipo HIV-1) foram avaliadas em outro laboratório de referência europeia. bioelisa HIV 1+2 Ag/Ab detectou todas as 537 amostras. A sensibilidade encontrada foi de 100% (537/537). BIOKIT, S.A. - Can Malé s/n - 08186 Lliçà d’Amunt - Barcelona - SPAIN 3000-1172_R01_02.2015_por.docx 0843 60 bioelisa - Um total de 115 amostras positivas para HIV-2 foram avaliadas com bioelisa HIV 1+2 Ag/Ab, entre elas: 27 amostras HIV-2 em um laboratório de referência europeia e 88 amostras HIV-2 avaliadas na Biokit. bioelisa HIV 1+2 Ag/Ab detectou todas as 115 amostras. A sensibilidade encontrada foi de 100% (115/115). - Um total de 61 amostras positivas para HIV-1 p24 Ag também foram avaliadas com bioelisa HIV 1+2 Ag/Ab, entre elas: 15 amostras em um laboratório de referência europeia, 16 amostras em outro laboratório de referência europeia e 30 amostras na Biokit. bioelisa HIV 1+2 Ag/Ab detectou todas as 61 amostras. A sensibilidade encontrada foi de 100% (61/61). - Estudos de sensibilidade adicional foram realizados testando-se um total de 31 painéis de soroconversão na Biokit e em um laboratório de referência europeia. Os resultados obtidos foram comparáveis ao método comercial mais sensível para a detecção de antígeno e anticorpo para HIV 1+2. - 16 painéis de soroconversão HIV da BBI/Seracare e da Zeptometrix foram avaliados na Biokit. bioelisa HIV-1+2 Ag/Ab identificou corretamente todas as amostras positivas. Painel de soroconversão BB1-PRB965-n=6 ZEPT-12007-n=9 BBI-PRB954-n=7 BBI-PRB932-n=9 ZEPT-9017-n=11 ZEPT-9014-n=7 ZEPT-9012-n=8 ZEPT-9032-n=14 ZEPT-6243-n=10 ZEPT-9022-n=9 ZEPT-9018-n=11 BBI-PRB939-n=9 BBI-PRB956-n=5 BBI-PRB945-n=6 BBI-PRB955-n=4 BBI-PRB958-n=6 bioelisa HIV Ag/Ab 2 4 6 4 1 1 5 8 7 7 9 6 4 3 2 3 Ensaio HIV Antígeno HIV Ensaio HIV Ab Ag/Ab p24 Primeira amostra detectada como positiva no painel 2 4 2 4 5 ND 6 7 6 ND 4 4 4 3 1 1 3 1 6 7 5 8 7 8 7 8 7 8 9 7 9 10 9 ND 8 6 4 5 4 4 4 3 2 4 2 3 5 3 NAT 1 4 4 4 1 1 1 1 1 1 1 5 2 1 1 1 - Na tabela acima se pode observar a primeira amostra detectada como positiva em cada painel avaliado com bioelisa HIV-1+2 Ag/Ab em comparação aos ensaios de 4ª geração (ensaios Ag/Ab), ensaios de 3ª geração (ensaios Ab), ensaios para antígeno HIV p24 e ensaios HIV RNA NAT. bioelisa HIV-1+2 Ag/Ab mostrou excelente sensibilidade para detectar antígeno ou anticorpos precoces em 16 dos painéis de soroconversão de HIV avaliados. - Outro estudo foi realizado para avaliar a sensibilidade em 32 amostras de soroconversão inicial. Estes tipos de amostras caracterizam-se por serem positivos à presença de HIVp24 Ag e/ou positivos por NAT (Teste de Ácido Nucleico), não detectados por todos os métodos HIV de 3ª geração e negativos ou indeterminados pelos métodos de Western-Blot. bioelisa HIV 1+2 Ag/Ab detectou todas as 32 amostras. A sensibilidade encontrada foi de 100% (32/32). - Por fim, 50 sobrenadantes de cultura de células de culturas de células de HIV, incluindo-se diferentes subtipos de HIV-1 e HIV-2 foram avaliadas em um laboratório de referência europeia. bioelisa HIV 1+2 Ag/Ab detectou todas as 50 amostras. A sensibilidade encontrada foi de 100% (50/50). BIOKIT, S.A. - Can Malé s/n - 08186 Lliçà d’Amunt - Barcelona - SPAIN 3000-1172_R01_02.2015_por.docx 0843 61 bioelisa Especificidade A especificidade foi avaliada pelo teste de um total de 6465 amostras não selecionadas de doadores de sangue em três centros diferentes. - No primeiro centro, testaram-se 3045 amostras não selecionadas, incluindo 684 primeiras doações. Deste total, 4 amostras foram reativas. A especificidade obtida neste estudo foi de 99,87% (3041/3045). - No segundo centro, testaram-se 500 amostras não selecionadas do banco de sangue. Todas as 500 amostras foram negativas. A especificidade foi de 100% (500/500). - Realizou-se uma avaliação interna de 2920 amostras não selecionadas do banco de sangue. Desta avaliação, 6 amostras foram reativas. A especificidade obtida neste estudo foi de 99,79% (2914/2920). Um resumo detalhado destes estudos de especificidade é apresentado na tabela abaixo. Avaliação 1 (3045 soros) Soro Inicialmente reativos Reativos repetidos Falso positivo Especificidade % 6 4 4 99,87 I.C. 95%: 99.66 - 99.96) Avaliação 2 (500 soros) Soro Inicialmente reativos Reativos repetidos Falso positivo Especificidade % 0 0 0 100 (I.C. 95%: 98.89 - 100) Avaliação interna (1000 soros + 1920 plasmas) - Inicialmente reativos Reativos repetidos Falso positivo Especificidade % Plasma 8 6 6 99,69 (I.C. 95%: 99.32 - 99.89) Soro 1 0 0 100 (I.C. 95%: 99.44 - 100) Total 9 6 6 99,79 (I.C. 95%: 99.55 - 99.93) Além disso, 200 amostras de pacientes hospitalizados foram testadas e comparadas ao teste de referência. 194 amostras foram negativas para ambos os testes e seis amostras foram reativas. As seis amostras também foram reativas com outros testes ELISA. Uma especificidade de 100% foi obtida neste estudo (194/194). Precisão Reprodutibilidade intraensaio: O coeficiente de variação obtido dos valores de absorbância de uma amostra HIV-1 positiva submetida a ensaio em, no mínimo, 40 réplicas foi de 3,42%, 5,79% e 4,71% nos três lotes estudados. O coeficiente de variação obtido dos valores de absorbância de uma amostra de HIV-2 positiva submetida a ensaio em, no mínimo, 40 réplicas foi de 6,39%, 5,91% e 8,38% nos três lotes estudados. O coeficiente de variação obtido dos valores de absorbância de uma amostra HIV-1 p24 positiva submetida a ensaio em, no mínimo, 40 réplicas foi de 4,08%, 3,44% e 3,71% nos três lotes estudados. Reprodutibilidade entre ensaios: Quatro amostras positivas de diferentes níveis foram testadas em 15 ensaios diferentes. Os coeficientes de variação obtidos das razões de absorbância/cut-off das quatro amostras foram 4,87%, 5,37%, 7,49% e 7,54%. Interferências Interferência por adição Não se encontrou interferência para hemoglobina (500 mg/dL), bilirrubina (20 mg/dL), albumina humana (5 g/dL) e triglicérides (500 mg/dL). BIOKIT, S.A. - Can Malé s/n - 08186 Lliçà d’Amunt - Barcelona - SPAIN 3000-1172_R01_02.2015_por.docx 0843 62 bioelisa Reatividade cruzada Para avaliar possíveis interferências, analisaram-se 125 amostras potenciais de reatividade cruzada. Entre estas amostras havia 4 (RF+), 4 amostras positivas para anticorpos antinucleares (ANA), 5 amostras com mononucleose, 89 amostras de outras doenças infecciosas relacionadas e 23 amostras de mulheres grávidas. Não se encontrou evidência de reatividade cruzada nas amostras avaliadas. As 2 amostras de IgM antitoxoplasma testadas como positivas também foram positivas em outros ensaios de HIV. Amostras potencialmente interferentes = 125 RF (fator reumatóide) ‐ 4 IgG elevado ‐ 4 ANA (anticorpos antinucleares) ‐ 4 IgM elevado ‐ 5 Mononucleose ‐ 5 IgG HSV 1 (vírus Herpes simplex) ‐ 5 Mulheres grávidas ‐ 23 (incluindo 7 multíparas) IgG HSV 2 (vírus Herpes simplex) ‐ 4 Anticorpos antisífilis ‐ 6 IgG anti‐CMV (Citomegalovírus) ‐ 5 anti‐EBV (vírus Epstein‐Barr) ‐ 3 IgM anti‐CMV (Citomegalovírus) ‐ 7 antirrubéola (vírus da rubéola) ‐ 4 anti‐HTLV (vírus linfotrópico T humano) ‐ 4 IgG anti‐VZV (vírus da Varicela zoster) ‐ 2 anti‐HCV (vírus da hepatite C) ‐ 8 IgM anti‐VZV (vírus da Varicela zoster) ‐ 2 anti‐E.coli (Escherichia coli) ‐ 5 IgG antitoxoplasma (T. gondii) ‐ 10 HBsAg (antígeno da hepatite B) ‐ 8 IgM antitoxoplasma (T. gondii) ‐ 7 BIOKIT, S.A. - Can Malé s/n - 08186 Lliçà d’Amunt - Barcelona - SPAIN 3000-1172_R01_02.2015_por.docx 0843 63 bioelisa bioelisa: Guia de problemas Problema Possíveis causas Solução 1. Controles fora da validação. 1a. Temperatura, pipetagem ou tempo incorretos. 1b. Preparação inadequada dos reagentes, erro na diluição, reagentes não bem misturados. 1c. Contaminação cruzada dos controles. Verifique o procedimento. Repita o ensaio. Verifique o procedimento. Repita o ensaio. 1d. 1e. 1f. 1g. 2. Ausência de cor ou cor clara desenvolvida no fim do ensaio. 2a. 2b. 2c. 2d. 2e. Pipete cuidadosamente. Não troque as tampas. Repita o ensaio. Filtro de leitura incorreto. Verifique se o comprimento de onda do filtro utilizado é de 450 nm. Se não for utilizado o filtro de referência de 620 630 nm, a absorbância aumenta aproximadamente 0,050. Interferência no caminho Verifique o leitor. Limpe ou óptico. seque o fundo da microplaca. Verifique se há bolhas de ar. Repita a leitura. Componentes de Não utilize componentes de diferentes lotes utilizados. diferentes lotes, já que os mesmos são ajustados para cada lote liberado. Reagentes com data de Verifique a data de validade validade vencida. do kit. Utilize um kit cuja data de validade não tenha expirado. Um ou mais reagentes Verifique o procedimento. não adicionados ou Repita o ensaio. adicionados na sequência errada. Conjugado inativo. Verifique quanto à Diluição incorreta do contaminação. Verifique o conjugado 2 concentrado. procedimento. Repita o Conservação ensaio. inadequada. Microplaca inativa: Sempre mantenha as tiras Conservação não utilizadas na bolsa muito inadequada. bem fechada com o dessecante dentro. Repita o ensaio. Substrato TMB inativo: Utilize recipientes Conservação descartáveis ou lave com inadequada. O recipiente ácido ou etanol e enxágue utilizado afeta a com água deionizada antes estabilidade do substrato da reutilização. Verifique o TMB, contaminação procedimento. Repita o cruzada com a solução ensaio. de paragem. Reagentes muito frios. Espere que os reagentes atinjam a temperatura ambiente antes do uso. BIOKIT, S.A. - Can Malé s/n - 08186 Lliçà d’Amunt - Barcelona - SPAIN 3000-1172_R01_02.2015_por.docx 0843 64 bioelisa bioelisa: Guia de problemas Problema Possíveis causas 3. Muita cor em todos os poços da microplaca. 3a. Solução do substrato TMB contaminada ou oxidada. 3b. 3c. 3d. 3e. 4. Baixa reprodutibilidade ou alto número de amostra reativas não repetitivas. 4a. 4b. 4c. 4d. 4e. 4f. Solução Verifique se o substrato está incolor, descarte se estiver azul. Utilize recipientes lavados com ácido ou etanol, ou recipientes descartáveis. Repita o ensaio. Reagentes contaminados Verifique quanto à ou preparados contaminação: aparência inadequadamente. turva. Verifique as diluições. Repita o ensaio. Solução de lavagem Verifique a qualidade da água contaminada (1x). destilada ou deionizada utilizada para a diluição. Repita o ensaio. Lavagem insuficiente ou Verifique o dispositivo de não consistente: volume lavagem. Encha os poços de enchimento e/ou com solução de lavagem até aspiração insuficiente ou quase a boca, aspire não uniforme. Número completamente. Aumente o insuficiente de ciclos de número dos ciclos de lavagem, dispositivo lavagem. contaminado. Uso de uma solução de Use apenas a solução de lavagem diferente da do lavagem fornecida com o kit. fabricante. Problemas de lavagem. Consulte 3c, 3d, 3e. Pipetas não calibradas ou Utilize apenas pipetas pontas não bem calibradas, com pontas bem ajustadas. Pipetagem ajustadas e pipete inadequada. cuidadosamente, sem formar bolhas e respingar. Repita o ensaio. Reagentes muito frios ou Equilibre os reagentes à mal misturados antes do temperatura ambiente e uso. misture bem antes de usar. Correntes de ar através Mantenha a microplaca da microplaca durante as protegida das correntes de ar. incubações. Período muito longo para Realize uma técnica adicionar as amostras consistente e uniforme. e/ou reagentes. Inconsistência nos intervalos de tempo. Bolhas de ar. Interferência no caminho Consulte 1e. óptico. BIOKIT, S.A. - Can Malé s/n - 08186 Lliçà d’Amunt - Barcelona - SPAIN 3000-1172_R01_02.2015_por.docx 0843 65 bioelisa READ HIGHLIGHTED CHANGES bioelisa HIV-1+2 Ag/Ab 3000-1172 3000-1173 1 x 96 TESTS 5 x 96 TESTS (480) Procedural flow chart / Esquema del procedimiento / Schematischer Ablauf / Schéma de la procédure / Schema del procedimento / Esquema do procedimento Pipette Sample Diluent: 100 µL/well Dispensar el Diluyente de Muestras: 100 µL/pocillo Proben verdünnungsmittel verteilen: 100 µL/Vertiefung Dispenser le Diluant des Échantillons: 100 µL/puits Dispensare il Diluente dei Campioni: 100 µL/pozzetto Pipetar o Diluente de Amostras: 100 µL/pocinho Ð Pipette Samples and Controls: 100 µL/well Dispensar Muestras y Controles: 100 µL/pocillo Proben und Kontrollen verteilen: 100 µL/Vertiefung Dispenser Échantillons et Contrôles: 100 µL/puits Dispensare Campioni e Controlli: 100 µL/pozzetto Pipetar Amostras e Controles: 100 µL/pocinho Ð Incubate 60 minutes at 37°C ± 1°C Incubar 60 minutos a 37°C ± 1°C 60 Minuten bei 37°C ± 1°C inkubieren Incuber 60 minutes à 37°C ± 1°C Incubare 60 minuti a 37°C ± 1°C Incubar 60 minutos a 37°C ± 1°C Ð Wash 5x / Lavar 5x Waschen 5x / Laver 5x Lavare 5x / Lavar 5x Ð Pipette Conjugate 1: 200 µL/well Dispensar el Conjugado 1: 200 µL/pocillo Konjugat pipettieren 1: 200 µL/Vertiefung Pipeter le Conjugué 1: 200 µL/puits Dispensare il Coniugato 1: 200 µL/pozzetto Pipetar o Conjugado 1: 200 µL/pocinho Ð Incubate 30 minutes at 37°C ± 1°C Incubar 30 minutos a 37°C ± 1°C 30 Minuten bei 37°C ± 1°C inkubieren Incuber 30 minutes à 37°C ± 1°C Incubare 30 minuti a 37°C ± 1°C Incubar 30 minutos a 37°C ± 1°C Ð Wash 3x / Lavar 3x Waschen 3x / Laver 3x Lavare 3x / Lavar 3x Ð Pipette Conjugate 2: 200 µL/well Dispensar el Conjugado 2: 200 µL/pocillo Konjugat pipettieren 2: 200 µL/Vertiefung Pipeter le Conjugué 2: 200 µL/puits Dispensare il Coniugato 2: 200 µL/pozzetto Pipetar o Conjugado 2: 200 µL/pocinho Ð Incubate 30 minutes at 37°C ± 1°C Incubar 30 minutos a 37°C ± 1°C 30 Minuten bei 37°C ± 1°C inkubieren Incuber 30 minutes à 37°C ± 1°C Incubare 30 minuti a 37°C ± 1°C Incubar 30 minutos a 37°C ± 1°C Ð Wash 5x / Lavar 5x Waschen 5x / Laver 5x Lavare 5x / Lavar 5x Ð Pipette Substrate-TMB: 150 µL/well Dispensar el Sustrato-TMB: 150 µL/pocillo Substrat-TMB pipettieren: 150 µL/Vertiefung Dispenser le Substrat-TMB: 150 µL/puits Dispensare il Substrato-TMB: 150 µL/pozzetto Pipetar o Substrato-TMB: 150 µL/pocinho Ð Incubate 30 minutes at RT Incubar 30 minutos a TA 30 Minuten bei RT inkubieren Incuber 30 minutes à TA Incubare 30 minuti a TA Incubar 30 minutos a TA Ð Pipette Stopping Solution: 100 µL/well Dispensar la Solución de Parada: 100 µL/pocillo Stopplösung zufügen: 100 µL/Vertiefung Pipeter la Solution d’Arrêt: 100 µL/puits Dispensare la Soluzione Bloccante: 100 µL/pozzetto Pipetar a Solução de Bloqueio: 100 µL/pocinho Ð Cut-off: NCx + 0.170 Valor umbral: CNx + 0,170 Schwellenwert: NCx + 0,170 Valeur seuil: CNx + 0,170 Valore di soglia: CNx + 0,170 Cut-off: CNx + 0,170 Read at 450 nm Leer a 450 nm Bei 450 nm ablesen Lire à 450 nm Leggere a 450 nm Ler a 450 nm BIOKIT, S.A. - Can Malé s/n - 08186 Lliçà d’Amunt - Barcelona - SPAIN 3000-1172_R00_05.2014_procedural flow chart.doc 0843 66 bioelisa READ HIGHLIGHTED CHANGES bioelisa HIV-1+2 Ag/Ab 3000-1172 3000-1173 1 x 96 TESTS 5 x 96 TESTS (480) Bibliography - Bibliografía - Literatur - Bibliographie - Bibliografia - Bibliografia 1. Barre-Sinoussi F, Chermann JC, Rey F, Nugeyre MT, Chamaret S, Gruest J, Dauguet C, Axler-Blin C, Vezinet-Brun F, Rouzioux C, Rozenbaum W, Montagnier L. Isolation of a T-lymphotropic retrovirus from a patient at risk for acquired immune deficiency syndrome (AIDS). Science. 1983;220(4599):868-871. 2. Clavel F, Guetard D, Brun-Vezinet F, Chamaret S, Rey MA, Santos-Ferreira MO, Laurent AG, Dauguet C, Katlama C, Rouzioux C, Klatzmann D, Champalimaud JL, Montagnier L. Isolation of a new human retrovirus from West African patients with AIDS. Science. 1986;233(4761):343-346. 3. Constantine NT. Serologic tests for the retroviruses: approaching a decade of evolution. AIDS. 1993;7(1):1-13. 4. Devare SG. Early diagnosis of HIV infection. J Med Virol. 2007;79(Suppl 1):S11-S15. 5. Frankel DH. Structure of HIV p24 capsid protein revealed. Lancet. 1996;348(9021):184-184. 6. Ly TD, Martin L, Daghfal D, Sandridge A, West D, Bristow R, Chalouas L, Qiu X, Lou SC, Hunt JC, Schochetman G, Devare SG. Seven human immunodeficiency virus (HIV) antigen-antibody combination assays: evaluation of HIV seroconversion sensitivity and subtype detection. J Clin Microbiol. 2001;39(9):3122-3128. 7. Malm K, von Sydow M, Andersson S. Performance of three automated fourth-generation combined HIV antigen/antibody assays in large-scale screening of blood donors and clinical samples. Transfus Med. 2009;19(2):78-88. 8. Miedouge M, Greze M, Bailly A, Izopet J. Analytical sensitivity of four HIV combined antigen/antibody assays using the p24 WHO standard. J Clin Virol. 2011;50(1):57-60. 9. Pandori M W, Hackett J = Jr, Louie B, Vallari A, Dowling T, Liska S, Klausner J D. Assessment of the ability of a fourth-generation immunoassay for human immunodeficiency virus (HIV) antibody and p24 antigen to detect both acute and recent HIV infections in a high-risk setting. J Clin Microbiol. 2009;47(8):2639-2642. 10. Saville RD, Constantine NT, Cleghorn FR, Jack N, Bartholomew C, Edwards J, Gomez P, Blattner WA. Fourth-generation enzyme-linked immunosorbent assay for the simultaneous detection of human immunodeficiency virus antigen and antibody. J Clin Microbiol. 2001;39(7):2518-2524. 11. Simon F, Mauclere P, Roques P, Loussert-Ajaka I, Muller-Trutwin MC, Saragosti S, Georges-Courbot MC, Barre-Sinoussi F, Brun-Vezinet F. Identification of a new human immunodeficiency virus type 1 distinct from group M and group O. Nat Med. 1998;4(9):1032-1037. 12. UNAIDS (United Nations Programme on HIV/AIDS); WHO (World Health Organization). AIDS epidemic update: December 2009 [Internet]. Geneva: UNAIDS; 2009. [cited 2013 May 10] 99 p. UNAIDS/09.36E / JC1700E. Available from: http://data.unaids.org/pub/Report/2009/JC1700_Epi_Update_2009_en.pdf 13. Valadez-Gonzalez N, Gevorkian G, Soler C. Transmembrane glycoprotein cross reactive HIV-1/HIV-2 epitope. Rev Biomed. 2000;11(3):155-160. 14. Weber B, Fall EH, Berger A, Doerr HW. Reduction of diagnostic window by new fourth-generation human immunodeficiency virus screening assays. J Clin Microbiol. 1998;36(8):2235-2239. 15. Wigglesworth E, Heath A, Holmes H. Development of a World Health Organisation International Reference Panel for Anti-HIV. J Virol Methods. 2010;163(1):101-108. 16. Zaaijer HL, Exel-Oehlers PV, Kraaijeveld T, Altena E, Lelie PN. Early detection of antibodies to HIV-1 by third-generation assays. Lancet. 1992;340(8822):770-772. BIOKIT, S.A. – Can Malé s/n, 08186 Lliçà d’Amunt - Barcelona - SPAIN 67 3000-1172_R00_05.2014_bibliography.docx 0843 BIOKIT, S.A. – Can Malé s/n, 08186 Lliçà d’Amunt - Barcelona - SPAIN 68 T3800-4420 R01 0843