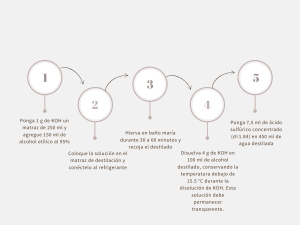
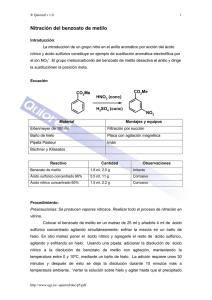
PROBLEMAS 1) El volumen de una solución preparada a partir de
Anuncio

PROBLEMAS 1) El volumen de una solución preparada a partir de 15 g de soluto y 80 g de agua es 90 mL. Calcular su concentración en % m/v y en % m/m. 2) Una solución acuosa contiene 15 g de azúcar (C12H22O11) en 120 mL de solución. La densidad de la solución es 1,047 g/mL. Calcular la molaridad y el % m/m. 3) Dos recipientes iguales A y B contienen soluciones acuosas de ácido sulfúrico (H2SO4). El rótulo de A dice: ácido sulfúrico 20% m/m, densidad 1,30 g/mL. El rótulo B: ácido sulfúrico 4 M. Indicar en qué recipiente está la solución más concentrada. 4) 120 mL de una solución contienen 4,32 g de glucosa (C6H12O6), siendo la densidad 1,05 g/mL. Calcular la molaridad, el % m/v y el % m/m. 5) Se necesita preparar una solución acuosa al 15% m/m y sólo se dispone de 45 g de sólido. ¿Qué cantidad en gramos de solución podrá prepararse y cuánta masa de agua deberá emplearse? 6) ¿Cuál de las siguientes soluciones es más concentrada? a) 0,0004 moles de sacarosa (C12H22O11) en 0,05 moles de agua b) 1 g de sacarosa en 1000 g de agua. 7) ¿A qué volumen se deben diluir 925 mL de ácido sulfúrico 0,1032 M para preparar una solución que sea exactamente 0,1000 M? 8) Se requieren 400 mL de una solución 10% m/m de ácido clorhídrico (HCl) cuya densidad es 1,02 g/mL. a) ¿Cuál es la masa de soluto y solvente necesaria? b) ¿Cuál es la concentración molar? c) ¿Cuál es la concentración en %m/v? 9) Un estudiante preparó una solución de hidróxido de sodio (NaOH) colocando 1,577 g de este sólido en un matraz aforado de 250 mL añadiendo agua hasta el aforo. a) ¿Cuál es la molaridad? b) ¿En qué volumen de solución se encuentran 0,532 g de soluto? 10) Se usa una pipeta para medir 50 mL de ácido clorhídrico (HCl) 0,1027 M en un matraz aforado de 250 mL. Se añade agua destilada al matraz hasta el aforo. ¿Cuál es la concentración de la solución diluida? 11) Un químico decidió preparar una solución 0,1 M de nitrato de plata (AgNO3) en agua colocando la sal en un matraz de 50 mL. ¿Cuántos gramos pesó? 12) ¿Cuántos gramos de ácido nítrico (HNO3) se necesitarán para preparar 1,5 L de solución 0,60 M? ¿Qué volumen de ácido nítrico concentrado comercial se deben usar, si éste tiene una densidad = 1,41g/ml y 70%m/m? -2 13) Se preparó un litro de una solución de cloruro de sodio (NaCl) 2.10 M. Si se evaporan 200 mL de agua: ¿La solución resultará más diluida o más concentrada? ¿Cuál es la nueva concentración? 14) ¿Hasta qué volumen se deben diluir 100 mL de solución de cloruro de potasio (KCl) 1,00 M para obtener una solución 0,500 M? 15) Se tienen dos litros de solución concentrada de ácido nítrico (HNO3) que contienen 36 moles de soluto. ¿Cuántos mL de solución concentrada se necesitarán para preparar medio litro de solución 0,1 M y qué volumen de agua se deberá agregar? 16) Calcular el volumen y la concentración de la solución resultante de mezclar 25 mL de una solución 0,2 M con 35 mL de una solución 0,3 M del mismo compuesto.