Malformaciones congénitas asociadas al uso de
Anuncio

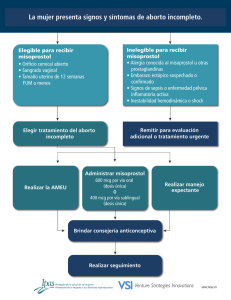
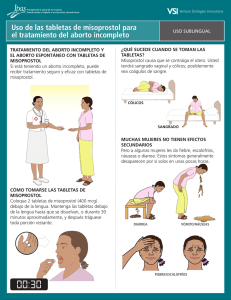
CASO CLÍNICO Malformaciones congénitas asociadas al uso de misoprostol: Reporte de dos casos Sánchez-Rodríguez Guillermina,* Luévanos-Gurrola Karla,** Ramírez-Cázares Ana Carolina,*** Rodríguez-Bonito Rogelio,* Rodríguez-Balderrama Isaías* * Servicio de Neonatología. Facultad de Medicina y Hospital Universitario Dr. José Eleuterio González, Universidad Autónoma de Nuevo León (UANL), Monterrey, N.L., México. ** Servicio de Medicina Crítica Pediátrica. Facultad de Medicina y Hospital Universitario Dr. José Eleuterio González, Universidad Autónoma de Nuevo León (UANL), Monterrey, N.L., México. *** Departamento de Pediatría. Facultad de Medicina y Hospital Universitario Dr. José Eleuterio González, Universidad Autónoma de Nuevo León (UANL), Monterrey, N.L., México. Revista Mexicana de Neurociencia INTRODUCCIÓN El misoprostol es un análogo de la prostaglandina E 1, aprobado por la FDA como preventivo en úlceras gástricas secundarias al uso de analgésicos no esteroideos. Es ampliamente utilizado en obstetricia para inducción de trabajo de parto, tratamiento de hemorragia postparto, facilitación en la expulsión de huevo muerto retenido; sin embargo, para ninguno de estos casos ha sido aprobado, aunque la FDA reconoce que en algunas circunstancias el uso extraoficial de algunos productos es aceptado en la práctica médica.1 El misoprostol pertenece a la clasificación X, dentro de la guía terapéutica sobre el uso de sustancias durante el embarazo realizada por la FDA en 1979, lo cual indica que estudios en animales o humanos o los resultados de estudios durante el periodo de la investigación o después de la comercialización evidencian ries- Enero-Febrero, 2013; 14(1): 50-53 go para el feto, el cual claramente sobrepasa cualquier posible beneficio, por lo que se contraindica durante el mismo.2 El misoprostol tiene un gran potencial como abortivo y se relaciona con múltiples malformaciones congénitas, tales como: Microcefalia, defectos de pared abdominal, artrogriposis, síndrome de Moebius, meromelia, sindactilia, afección de pares craneales, holoprocencefalia, entre otras. A pesar de lo antes expuesto, la automedicación del misoprostol en etapas tempranas del embarazo se ha convertido en un problema de salud pública en países donde el aborto es ilegal. Ante la falta de legislación en nuestro país acerca de este problema, ha aumentado el número de casos de aborto autoinducido. Sin embargo; el misoprostol presenta alto índice de falla en la inducción del aborto como agente único y hasta 40% de las mujeres que lo utilizan en el primer trimestre logran tener un embarazo a término.1 RESUMEN El uso de misoprostol está contraindicado en el embarazo por su gran potencial como abortivo y su relación con diversas malformaciones como microcefalia, síndrome de Moebius, pie equinovaro, entre otras. Presentamos dos recién nacidos de término, con antecedente de ingesta de misoprostol por la madre en el primer trimestre, con malformaciones evidentes al nacimiento. El uso de misoprostol en países donde el aborto es ilegal, incrementa el mal uso del mismo con la consecuente aparición de diversas malformaciones congénitas. Es importante la difusión y el conocimiento de los efectos teratogénicos de dicho medicamento, así como el control en el uso del mismo. Congenital malformations associated with misoprostol use: Report of two cases Palabras clave: Holoprosencefalia, malformaciones congénitas, misoprostol, síndrome de Moebius. Key words: Congenital malformations, holoprosencephaly, misoprostol, Möbius syndrome. ABSTRACT The use of misoprostol is contraindicated in pregnancy because of its potential as an abortifacient and its relationship with malformations such as microcephaly, Möbius syndrome and clubfoot, among other complications. We present two cases of patients with malformations evident at term birth with a history of misoprostol intake by the mother in the first trimester. The use of misoprostol in countries where abortion is illegal increases its misuse with the consequent appearance of newborns with various congenital malformations. It is important to disseminate and understand the teratogenic effects of this drug, as well as the control of its use. Rev Mex Neuroci 2013; 14(1): 50-53 Sánchez-Rodríguez G, et al. Malformaciones congénitas Presentamos dos casos de malformaciones congénitas secundarias al uso de misoprostol. REPORTES DE CASO Caso 1 Paciente femenino de término, producto de primera gesta de embarazo no planeado ni deseado, con administración vía vaginal de misoprostol (cuatro tabletas cada 12 horas), repitiendo la dosis por dos semanas consecutivas. Nace por cesárea por presentación podálica, Apgar 8/9, pesó 2,900 g, talla 48 cm, requiriendo únicamente pasos iniciales de reanimación. A la exploración física: con presencia de microcefalia (PC 32 cm), implantación baja de cuero cabelludo en región occipital, pabellones auriculares con adecuada implantación. Narinas permeables, labio y paladar íntegros. Fontanela normotensa, reflejos primitivos presentes, sin alteraciones en pares craneales. Resto de la exploración sin alteraciones. Exámenes de laboratorio sin alteraciones. A las 24 horas de vida presentó episodio de crisis convulsiva tónica generalizada de 1 minuto de duración, acompañada de cianosis. Se controlaron con fenitoína. La resonancia magnética cerebral reportó malformaciones con presencia de atrofia cortical, polimicrogiria occipital, lisencefalia frontal, pérdida de la relación sustancia gris-sustancia blanca, hipoplasia de cuerpo calloso, ventriculomegalia (Figura 1). Electroencefalograma con presencia de foco epileptógeno en región frontal. Durante su estancia sin nuevos eventos convulsivos, tolerando la vía enteral por succión. Se egresó a casa a los 10 días de vida con seguimiento en Consulta Externa por genética, neonatología y neurología pediátrica. 51 A la exploración física se apreció frente amplia con línea del cabello anterior con implantación alta y sutura metópica prominente, fontanela anterior amplia; cejas escasas y arqueadas, ojos con aperturas oblicuas hacia abajo, estrabismo convergente bilateral y telecanto. Implantación baja de pabellones auriculares y rotados posteriormente, puente nasal plano, punta bulbosa con narinas antevertidas (Figura 2). Paladar ojival y micrognatia. En tórax se auscultó soplo cardiaco grado II/VI en cuarto espacio paraesternal izquierdo sin irradiaciones. Las extremidades se encontraron hipotónicas generalizadas, presentó manos empuñadas con clinodactilia del quinto dedo de ambas manos; con pie equino varo bilateral. En lo neurológico: Parálisis facial bilateral, incapacidad para cerrar los párpados, el llanto fue de tono agudo y el reflejo de Moro incompleto. El paciente no presentó succión y la deglución se encontró alterada. Presentó alteración de los pares craneales VI y VII, involucro de otros nervios y núcleos del tallo como XII y IX, que condicionaban apneas centrales, mal manejo de secreciones y reflujo severo. Se realizó una TAC de cráneo en el cual se reportó megacisterna magna, ventriculomegalia y calcificaciones subependimarias. En RMN de cráneo se apreció alteración del desarrollo cortical cerebral, adelgazamien- Caso 2 Recién nacido masculino de término, a la exploración se encontraron anomalías físicas. Producto de la primera gesta; la madre en el segundo mes de embarazo ingirió misoprostol sin especificar dosis, sin lograr aborto y posteriormente en ultrasonido del tercer trimestre se detectó ventriculomegalia bilateral. Durante el trabajo de parto presentó bradicardia, motivo por el cual pasó a cesárea de urgencia bajo anestesia general, obteniendo producto sin esfuerzo respiratorio y requiriendo ventilación con presión positiva. Se le otorgó Apgar 6-8, Silverman-Andersen 1, peso de 2480 g, talla 46 cm y PC 35 cm. Figura 1. Resonancia magnética de cráneo del paciente 1, con atrofia cortical, polimicrogiria occipital, lisencefalia frontal, pérdida de la relación sustancia blanca y gris, hipoplasia del cuerpo calloso y ventriculomegalia. 52 Figura 2. Paciente del caso 2 que presenta ojos con aperturas oblicuas hacia abajo, estrabismo bilateral convergente e implantación baja de pabellones auriculares. Las manos se encuentran empuñadas con clinodactilia y pie equino varo bilateral. to, obliteración del conducto de Silvio, dilatación del sistema ventricular supratentorial (Figura 3). En estudio ecocardiográfico se detectó foramen oval pequeño permeable. Se consultó al Departamento de Genética que al agrupar las alteraciones neurológicas y físicas encontradas apoyadas por el único antecedente de la ingesta de misoprostol, se agruparon en el síndrome de Moebius. Rev Mex Neuroci 2013; 14(1): 50-53 Sánchez-Rodríguez G, et al. Malformaciones congénitas defectos del tubo neural, encontraron aumento en el síndrome de Moebius (OR 29.7; IC 95%,11.6 a 76.0) en madres que durante el primer trimestre de gestación utilizaron misoprostol.12 Esto se relaciona con una de las teorías del origen del síndrome de Moebius donde se cree que se origina por la disrupción de la arteria subclavia primitiva y sus ramas, previo al establecimiento del aporte sanguíneo adecuado al tallo cerebral por las arterias vertebrales6 ocasionando isquemia con necrosis y calcificación de los nervios craneales como el facial, el trigémino y el hipogloso con la consiguiente manifestación clínica observada. También puede ser la explicación a algunos casos de pie equinovaro donde se le asocia a hipoplasia o disrupción prematura de la arteria tibial y de la arteria plantar media.9 Las manifestaciones antes descritas se observan en el caso 2, que son las más comunes, según González Claudette, Marques Dias, et al., en 1998;9 quienes observaron la presentación de pie equinovaro como una manifestación de artrogriposis más extensas y en algu- DISCUSIÓN En este artículo presentamos la asociación del uso de misoprostol como abortivo y la presencia de malformaciones congénitas como microcefalia, alteraciones estructurales del SNC y síndrome de Moebius. Se ha considerado que el proceso de aborto inducido por el misoprostol (v.gr. contracciones uterinas y sangrado) puede ser la causa, produciendo un trastorno vascular transitorio en la unidad feto-placentaria. Esta alteración reduce el suministro sanguíneo a la placenta y produce hipoperfusión, hipoxia, fenómeno de tromboembolia y defectos en la angiogénesis.2 Diversos estudios han mostrado cómo se asocia la exposición prenatal a misoprostol con los defectos secundarios a una disrupción vascular. González, et al. hacen el primer informe de siete recién nacidos con síndrome de Moebius y el antecedente de uso de misoprostol durante el primer trimestre del embarazo en Brasil en 1993.11 Pastuszak, et al., en 1998, al comparar la información de madres de pacientes con síndrome de Moebius y los datos de madres de niños con Figura 3. Resonancia magnética de cerebro del paciente del segundo caso. Presenta anormalidad en el desarrollo cortical cerebral, adelgazamiento, obliteración del conducto de Silvio, dilatación del sistema ventricular supratentorial. 53 Rev Mex Neuroci 2013; 14(1): 50-53 Sánchez-Rodríguez G, et al. Malformaciones congénitas nas ocasiones hasta amioplasia, acompañados de alguna de las manifestaciones de defectos de los nervios craneales especialmente de los nervios V, VI y VII. En una búsqueda electrónica se identificaron seis artículos, en los cuales se presentan 69 casos sobre defectos congénitos asociados al misoprostol durante el embarazo.7-11,22 Casi todos los casos (97.1%, n = 67) fueron documentados en Brasil. Se describieron más de 35 diferentes anomalías. Los defectos de las extremidades inferiores fueron los más frecuentemente descritos y se presentaron en las cuatro quintas partes (82.6%, n = 57) de todos los casos. Más de la mitad de los casos (55.1%, n = 38) presentaron anomalías del sistema nervioso central, mientras que dos quintas partes (40.6%, n = 28) y una cuarta parte (27.5%, n = 19) presentaron anomalías de las extremidades superiores y del sistema esquelético, respectivamente. CONCLUSIONES En nuestro país existe un subregistro del consumo de misoprostol con fines abortivos, ya que de haberlo consumido la madre no lo notifica y el estudio o detección se hace al tener un recién nacido con malformaciones con la sospecha del consumo de dicho medicamento, de aquí la importancia de la información sobre sus efectos teratogénicos y la necesidad de campañas de prevención, para evitar las malformaciones asociadas a este agente claramente teratogénico con el impacto social y personal que implica. FUENTES DE REFERENCIAS 1. Goldberg A, Greenberg M, Darney P, Misoprostol and pregnancy. New England J Med 2001; 341: 38-47. 2. Philip N, et al. Misoprostol y teratogenicidad: Revisión de la evidencia Informe de una reunión organizada por el Population Council New York, New York 22 de mayo de 2002, 1-25. 3. Da Silva T, et al. Exposure to misoprostol and hormones during pregnancy and risk of congenital anomalies. Cad Saúde Pública Rio de Janeiro 2008; 24: 1447-53. 4. Isaza C, et al. Uso inadecuado de misoprostol. ¿Un problema de salud pública? Colomb Med 2008; 39 (Suppl. 2). 5. Satro-Opaleye E, Luna-Cohelo H, Shüler-Faccini L, et al. Evaluation of the teratogenic risks in gestations exposed to misoprostol. Rev Bras Ginecol Obstet 2010; 32: 19-25. 6. Pastuszak L, Schüler L, Speck-Martins C, et al. Use of Misoprostol during pregnancy and Moebius Syndrome in Infants. N Engl J Med 1998; 338: 1881-5. 7. Pirmez R, Freitas MET, Gasparetto EL, Araujo APQC, Moebius syndrome and holoprosencephaly following exposure to misoprostol. Pediatr Neurol 2010; 43: 371-3. 8. Nobuko K, Katsuyoshi K, Tomohiro K, Makoto H, Tadao A. A case of Moebius syndrome presenting with congenital bilateral vocal cord paralysis. Eur J Pediatr 2007; 166: 831-3. 9. Gonzalez H, Marques-Dias MJ, Kim A, Sugayama M, Da Paz JA, Huson SM, et al. Congenital abnormalities in Brazilian children associated with misoprostol misuse in first trimester of pregnancy. Lancet 1998; 351: 1624-27. 10. Akoury A, Hannah ME, Chitayat D, Thomas M, Winsor E, Ferris E. Randomized controlled trial of misoprostol for second-trimester pregnancy termination associated with fetal malformation. Am J Obstet Gynecol 2004; 190: 755e62. 11. Vargas FR, Schuler-Faccini L, Brunoni D, Kim C, Meloni VFA, Sugayama SMM, et al. Prenatal exposure to misoprostol an vascular disruption defects: a casecontrol study. Am J Med Genet 2000;95: 302-6. 12. Dal TdS, Pozzobon F, Serrate S. Prenatal exposure to misoprostol and congenital anomalies: Systematic review and meta-analysis. Reprod Toxicol 2006; 22: 666-71. FINANCIAMIENTO Ninguno. DECLARACIÓN DE CONFLICTOS DE INTERÉS Los autores han declarado que no existen potenciales conflictos de interés competentes a este informe científico. Correspondencia: Guillermina Sanchez Rodriguez. Servicio de Neonatología, 5to. piso Torre de Pediatría. Hospital Universitario “Dr. José Eleuterio González” Francisco I. Madero y Av. Gonzalitos s/n Col. Mitras Centro Monterrey, N.L. México. C.P. 64460. Tel.: 01(81) 8389-1111, Ext.: 3355. Correo electrónico: [email protected] Artículo recibido: Junio 11, 2012. Artículo aceptado: Diciembre 11, 2012.