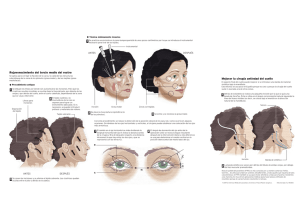
•050-incisiones en facoemulsificacion.qxd
Anuncio

50 Incisiones en facoemulsificación Javier Mendicute, Ramón Lorente INTRODUCCIÓN La incisión perfecta no existe; tal vez, la cirugía perfecta del cristalino sería aquella que no requiriera incisión. Mientras tal objetivo sea una quimera, es necesario conocer las transformaciones más notables que han hecho posible las incisiones tal y como las practicamos actualmente y profundizar en los fundamentos que es necesario conocer para poder ejecutar una incisión adecuada, segura y reproducible. Al igual que la cirugía del cristalino, las incisiones han experimentado grandes cambios en los últimos 50 años; tal vez, el desplazamiento de las incisiones de la zona superior (meridiano de las 12 horas) a córnea temporal y la drástica reducción de su tamaño han sido las transformaciones más importantes. Para transformar una cirugía con incisiones corneales o esclerales de 12-13 mm, en la época de la cirugía intracapsular, de 9-10 mm, en la de la cirugía extracapsular, a incisiones menores de 2 mm, a partir del desarrollo de la facoemulsificiación, han sido necesarios un mejor conocimiento de sus principios básicos y una mejora notable en su diseño y arquitectura. Los fines perseguidos con la incisión también son diferentes: de ser únicamente la vía de salida del cristalino cataratoso a ser la vía de entrada del instrumental necesario para fragmentarlo in situ manteniendo adecuadamente la cámara anterior y permitiendo el espacio mínimo necesario para implantar las lentes intraoculares actuales. Sin embargo, también se han pretendido ciertos fines secundarios, contradictorios algunos de ellos: se redujo el tamaño de la incisión para disminuir el astigmatismo inducido y posteriormente se pretendió alargarla, practicando incisiones limbares relajantes e incisiones opuestas en el eje más curvo, para reducir el astigmatismo existente o, dicho en otras palabras, para inducir astigmatismo en el sentido deseado que compensara el astigmatismo preexistente. Objetivos Los objetivos de la incisión en cirugía del cristalino deberían ser: 1) Facilitar la entrada del instrumental necesario para retirar el cristalino; y 2) Permitir la implantación de la lente intraocular deseada. En definitiva, los objetivos principales de la reducción del tamaño de la incisión han sido permitir la práctica de la cirugía de una forma segura y reducir el astigmatismo inducido; son objetivos secundarios, que no menos importantes, reducir la posibilidad de inflamación, acelerar la estabilidad de la herida y poder lograr una más rápida rehabilitación visual. 586 Sin embargo, dos problemas ensombrecen el desarrollo de las incisiones corneales en los últimos años: 1) El riesgo de quemadura; y 2) Su supuesta asociación a una mayor incidencia de endoftalmitis. El primero ha sido resuelto con los desarrollos tecnológicos que han permitido nuevas formas de liberación de energía durante la facoemulsificación; y el segundo, sigue siendo tema de debate y controversia. El cirujano de cristalino debería conocer la historia clínica del paciente, las características morfológicas de su órbita y segmento anterior, sus limitaciones posturales así como considerar la utilización de la refracción manifiesta, de la queratometría y de la topografía corneal en el momento de planificar su cirugía. Su obligación es conocer no sólo las diferentes técnicas quirúrgicas existentes sino también los diferentes tipos de incisión, su dificultad de ejecución y su efecto astigmático y debería ser capaz de definir sus propias indicaciones en función del resultado deseado. El tipo de incisión dependerá del tipo de catarata, de las técnicas a practicar, de las lentes intraoculares a implantar y del efecto astigmático deseado: inducción cero o corrección de astigmatismos previos. Actualmente, la cirugía de cristalino/catarata debe ser entendida como un procedimiento refractivo y, como tal, el objetivo es la emetropía; por ello, interesa una incisión que presente una inducción astigmática predecible o que pueda neutralizar el astigmatismo previo del paciente. Aunque la introducción de las lentes intraoculares tóricas pudiera hacernos pensar que tales principios son menos necesarios, entendemos que lo siguen siendo en cuanto que del conocimiento del astigmatismo inducido por nuestras incisiones será posible mejorar los resultados refractivos logrados con tales lentes, pudiendo incluso aumentar los rangos de corrección astigmática de las mismas; entendemos que la existencia de lentes intraoculares tóricas no nos exime del conocimiento de los principios en los que se basan las incisiones para cirugía de cristalino/catarata, tal y como las entendemos actualmente. Considerando que existen capítulos en los que especificamente se desarrollarán la cirugía intracapsular y la cirugía extracapsular, en este capítulo se abordarán explícitamente las incisiones propias de la técnica de facoemulsificación. Evolución de las incisiones de facoemulsificación Ya en 1967, Kelman predijo que la incisión menor de 3 mm pudiera ser astigmáticamente neutra dado su reducido 50. INCISIONES EN FACOEMULSIFICACIÓN tamaño1 y el tiempo no ha hecho sino corroborar tal afirmación para lograr el fin perseguido: inducción astigmática cero. Múltiples han sido los avatares de la facoemulsificación; de las limitaciones tecnológicas de los primeros años al desarrollo de las lentes intraoculares de PMMA en los años 70 que exigían incisiones de 6-7 mm, hecho que favoreció el desarrollo de la cirugía extracapsular. Posteriormente, desplazamiento de las incisiones de córnea y limbo a esclera2,3 y, al alejarnos de la córnea, posibilidad de practicar incisiones con mínima inducción astigmática y de tamaño suficiente como para implantar lentes rígidas de 5-7 mm pudiendo evitar el uso de suturas2,4 según se mejoró el diseño de las mismas. En los años 90, mejora de los equipos de facoemulsificación y desarrollo de la técnica quirúrgica y disponibilidad de lentes plegables con regreso a la córnea, aunque no ya a su zona superior sino a la córnea temporal. Kratz y Girard son considerados como los primeros autores en sugerir el desplazamiento de las incisiones hacia la esclera, sentando las bases de lo que entendemos como incisiones autosellables2,3,5. En 1989, Shepherd6 introdujo las suturas horizontales, a las que se les suponían notables ventajas en relación con las suturas radiales propias de la cirugía extracapsular de la época; otros autores desarrollaron también suturas en dicha línea. McFarland4 modifica la arquitectura de la incisión, reconoce la importancia de alargar el trayecto escleral de la misma y de la entrada corneal y sugiere que las suturas pueden ser innecesarias. Se destaca la importancia de la entrada interna corneal, especialmente del llamado labio corneal y se reconoce la posibilidad de autosellado de tal diseño incisional. Diferentes autores describen modificaciones de la incisión externa (escleral o corneal), del trayecto intraestromal (escleral o corneal) y de la incisión interna (corneal), conceptos que manejaremos en este capítulo (Fig. 1). Se extiende el uso de la facoemulsificación, se avanza en la comprensión de la arquitectura de las incisiones y la cirugía se prepara para el siguiente cambio: el desarrollo de las incisiones corneales. Kelman, en su descripción original de la facoemulsificación, sugería que el mejor abordaje pudiera ser corneal1. Diferentes autores sugerían la incisión corneal para cirugía intracapsular7, extracapsular8 y facoemulsificación9. Más recientemente, Fine10 y Shimizu11, sentando las bases de las incisiones corneales actuales, han sido los propulsores de las incisiones en córnea temporal. Fine2 refiere que se inició en la incisión corneal en la zona temporal, en 1979, a partir de la necesidad de practicar implantaciones secundarias en cámara anterior en pacientes previamente operados de cirugía intracapsular y en los que el estado del limbo superior era impredecible; posteriormente siguió con tal opción para facoemulsificación, a partir de 1986, en pacientes con ampollas filtrantes por cirugía de glaucoma en la zona superior, siendo la sutura la norma en dicha época; a partir de 1992, la córnea clara temporal fue su incisión de rutina en facoemulsificación, inicialmente con sutura para posteriormente considerar el abandono, por falta de necesidad, de las mismas2,12. Hasta este momento hablábamos de incisiones de 2,75 mm o mayores. No obstante, aún hay una nueva transformación: la introducción de la técnicas de facoemulsificación bimanual (inci- Fig. 1. Incisión externa, trayecto intraestromal e incisión interna. Dichos trayectos pueden ser practicados en uno, dos o tres pasos. 1.1. Incisión escleral. La distancia de la incisión externa a la cámara anterior obliga a que el trayecto intraestromal sea algo más largo. 1.2. Incisión corneal. Su proximidad a cámara anterior disminuye el tamaño del trayecto intraestromal; además, el riesgo de sangrado es inexistente. 587 IV. CIRUGÍA DE LA CATARATA: FACOEMULSIFICACIÓN siones menores de 1,75 mm) y de la microcoaxial (incisiones menores de 2,2 mm) han hecho reconsiderar la incisión y su arquitectura y desarrollar instrumental específico para tales incisiones. Sorprendentemente, según se ha reducido el tamaño de la incisión es donde ha sido necesario un mayor desarrollo del instrumental y de la arquitectura de las mismas con objeto de evitar complicaciones. Como última reflexión de esta introducción, comentaríamos que con astigmatismos preoperatorios menores de 2,50 dioptrías, éstos pueden ser corregidos modificando ciertas características propias de la incisión (tamaño, distancia del centro de la córnea, localización e incisiones en el eje)13. La corrección intraoperatoria de mayores astigmatismos obligará a recurrir a procedimientos quirúrgicos adicionales: incisiones limbares relajantes14, queratotomías arqueadas15-17 o la implantación de lentes tóricas18; dichos temas serán tratados en los capítulos correspondientes. eje más curvo (con ello, intentaremos corregir el astigmatismo previo del paciente); y 3) Sería recomendable conocer todos los principios básicos que intentamos acercar en este capítulo pues nos permitirán aprovechar las ventajas de todas ellas y seleccionar la mejor incisión para un caso concreto. Incisiones en facoemulsificación Limbo esclero-corneal Entre las características deseables que debe tener una incisión para facoemulsificación (Tabla I) destacaríamos, como básicas19: 1) Que fuera sencilla de practicar y reproducible; 2) Arquitectura excepcional según los estándares aceptados; 3) Que facilitara todas las maniobras propias y particulares de la facoemulsificación en sí, no comprometiendo su visualización; 4) Que permitiera la implantación de la lente intraocular deseada, sin alterar la estructura de la incisión ni de la lente; 5) También debería proporcionar seguridad en el cierre, ser preferentemente autosellable; 6) Predecible en su evolución astigmática o preferiblemente anastigmática; 7) Que cicatrice rápidamente; y 8) Que asegure una rápida estabilización refractiva. Como recomendaciones para quien se inicia en la técnica puede sugerirse que: 1) La incisión a practicar puede ser una incisión corneal temporal (facilita el abordaje intraocular, elimina las limitaciones de movilidad y acceso que puede representar el reborde orbitario y no presenta riesgo de sangrado), menor de 3 mm (la mayor parte de los equipos de facoemulsificación están diseñados para incisiones menores de 3 mm); 2) Aprendida la técnica, podemos desplazarnos por los meridianos del ojo, intentando practicar la incisión en el El limbo esclero-corneal es el lugar de localización preferente para la mayoría de las incisiones utilizadas en cirugía de cataratas. La córnea y la esclera presentan peculiaridades anatómicas que las diferencian y una zona de transición, el limbo esclero-corneal (Fig. 2), con características transicionales entre ambas20. El limbo es una zona estrecha transicional de epitelio y tejido conectivo entre la córnea y la conjuntiva bulbar, constituyendo el márgen entre la córnea, transparente, y la esclera, opaca; a sus peculiaridades anatómicas se superponen sus peculiaridades fisiológicas (aporta nutrición a la periferia corneal y contiene las vías de salida del humor acuoso) y quirúrgicas (zona de incisión en cirugía de catarata y glaucoma). El radio de curvatura de la superficie ocular cambia abruptamente a dicho nivel formando, externamente, el sulcus escleral externo. El sulcus escleral interno, formado por el espolón escleral, contiene el canal de Schlemm y las vías de salida del humor acuoso21. La interfase córneo-escleral es más ancha en el meridiano vertical que en el horizontal dado que la esclera y la conjuntiva se extienden sobre la córnea a las 6,00 y 12,00 h. Así, el diámetro medio corneal promedio es de 10,6 mm verticalmente y de 11,7 mm horizontalmente21. Externamente el limbo está formado por la unión de la córnea y el epitelio conjuntival21; internamente empieza en la unión de la extensión periférica de la membrana de Descemet y el endotelio corneal y sobre la extensión anterior de la malla trabecular identificable gonioscópicamente como línea de Schwalbe21. Bajo la conjuntiva, la extensión anterior de la cápsula de Tenon, un tejido conectivo denso, cubre el globo, uniéndose con la epiesclera y la conjuntiva sobre una banda de 1-2 mm situada aproximadamente a 2 mm de la unión de conjuntiva y córnea21. Diversos cambios anatómicos se producen en el limbo. El epitelio de la córnea se continúa con las estructuras respectivas de la conjuntiva, pero en el limbo se torna más grueso conteniendo alrededor Tabla I. Incisiones en facoemulsificación: características deseables 1. 2. 3. 4. 5. 6. 7. 8. Facilidad de ejecución Arquitectura excepcional Que facilite maniobras sin comprometer visualización Que permita implantar lentes sin alterar su morfología Seguridad en el cierre y, preferentemente, autosellable Anastigmática o predecible en la inducción astigmática Rápida cicatrización Precoz estabilización refractiva 588 PRINCIPIOS BÁSICOS Como fundamentos teóricos en los que se han apoyado las modificaciones en el diseño de la incisión, deben conocerse las características anatómicas macro y microscópicas de córnea y esclera en su lugar de encuentro, el limbo esclerocorneal, y los siguientes conceptos previos19: 1) Anillo óptico corneal; 2) Fenómeno de barrera; 3) Reglas generales: válvula y bisagra; 4) Concepto de embudo anastigmático (Koch); y 5) Efecto de cada tipo de incisión. 50. INCISIONES EN FACOEMULSIFICACIÓN Fig. 2. Limbo esclero-corneal. Zona de características transicionales entre córnea y esclera. 2.1. Aspecto macroscópico. Pueden visualizarse las referencias anatómicas de interés quirúrgico. 2.2. Aspecto microscópico. Se aprecian, a mayor detalle, las diferencias histológicas entre las estructuras del limbo y del ángulo (cortesía de la Dra. Irune Ruiz). de doce capas celulares. En el limbo, el estroma de la córnea pierde su transparencia y las láminas del estroma pierden su disposición ordenada. Aunque ambos tejidos, córnea y esclera, están constituídos de colágeno, esta unión es difícil de definir con técnicas histológicas convencionales, aunque el colágeno corneal es algo menos eosinofílico que el escleral. Las fibras de colágeno corneal son típicamente menores de 600 Å de diámetro; están dispuestas según un patrón altamente regular que proporcionan una cualidad cristalina al tejido y contribuyen a su transparencia. Las fibras esclerales, por otro lado, son más anchas, 700-1000 Å, más ramificadas, no paralelas y siguen un patrón menos regular dando un aspecto opaco. Las fibras esclerales se extienden más anteriormente en la superficie externa de la unión córneo-escleral que en la interna21. Sin embargo, la diferencia más notable entre córnea y esclera, además de su transparencia, viene dada por la ausencia de vasos sanguíneos a nivel corneal; ésto es posible debido a que su metabolismo es asegurado a partir del aporte de glucosa y oxígeno del humor acuoso y de las lágrimas22. Esta ausencia de vascularización corneal tiene importancia quirúrgica: por un lado, la coagulación no es necesaria en incisiones corneales, circunstancia relacionada con el astigmatismo inducido23 y, por otro, los procesos de reparación estromal serán diferentes, como veremos. En definitiva, el limbo es una zona de interés para el cirujano dado que gran número de intervenciones son practicadas a través de incisiones a dicho nivel. El conocimiento de los límites de esa zona permitirá la correcta ejecución de dichas intervenciones. El limbo quirúrgico es conocido por los clínicos como la zona grisácea observada externamente una vez retirada la conjuntiva. El anillo grisáceo ocupa una franja de aproximadamente 1,2 mm entre la esclera, situada poste- riormente, blanca, y la córnea, anteriormente, transparente. El cirujano puede correlacionar la localización de las estructuras intraoculares con la apariencia externa del limbo quirúrgico asegurando, así, la incisión en el lugar adecuado21. Conceptos previos Entendemos que para la adecuada comprensión de la evolución experimentada en el diseño de incisiones en cirugía de cataratas en los últimos años es necesario familiarizarse con algunos conceptos previos (Tabla II). Revisemos dichos conceptos: 1. Anillo óptico corneal El anillo óptico corneal puede corresponder al llamado limbo quirúrgico (Fig. 2), entendiendo como tal la zona azulgrisácea de transición existente entre la esclera, blanca, y la córnea, transparente y cuya estructura anatómica más identificable sería su borde posterior que coincide, internamente, Tabla II. Incisiones en facoemulsificación: conceptos previos 1. 2. 3. 4. 5. 6. Anillo óptico corneal Fenómeno de barrera Reglas generales: válvula y bisagra Concepto de embudo anastigmático de Koch Astigmatismo corneal regular, macro y microirregular Efecto astigmático de diferentes tipos de incisión 589 IV. CIRUGÍA DE LA CATARATA: FACOEMULSIFICACIÓN con la porción anterior de la malla trabecular21,24. La zona óptica corneal central, cuyos cambios de curvatura condicionarán los cambios refractivos, tiene un diámetro de 4 mm. Toda manipulación quirúrgica por dentro de lo que se ha dado en llamar anillo óptico corneal25 (Fig. 3) inducirá modificaciones en la curvatura, y con ello en el astigmatismo, de la zona óptica corneal central. Ambas zonas, zona óptica corneal central y anillo óptico corneal, están unidas por unas zonas de soporte intermedio y periférico. 2. Fenómeno de barrera Del conocimiento de las características mencionadas, se deduce que el anillo óptico corneal puede ejercer un fenómeno de barrera25. Es un hecho conocido que los procedimientos quirúrgicos practicados posteriormente a dicho anillo, es decir, por ejemplo, sobre musculatura extraocular así como sobre esclera (vg: cerclajes, estafilomas miópicos y escleromalacia) no inducen modificaciones de la curvatura corneal. Del mismo modo, manifiestas alteraciones de la curvatura corneal no repercuten sobre la curvatura escleral. Puede entenderse que el mencionado fenómeno de barrera que ejerce el anillo óptico corneal haga posible que una incisión de catarata practicada externamente a dicho anillo tenga un mínimo efecto sobre la curvatura corneal; por el contrario, una incisión en córnea clara, por dentro de dicho anillo, puede inducir una mayor modificación del astigmatismo corneal. De lo mencionado, también es sencillo entender que una incisión en córnea clara tendrá mayor capacidad de modificar un astigmatismo previo que lo que pueda modificarlo una incisión escleral. Del mismo modo, la corrección de un astigmatismo residual tras cirugía de catarata requerirá que el procedimiento quirúrgico corrector sea practicado por dentro del anillo óptico corneal y su efecto será mayor cuanto mayor sea su proximidad a la zona óptica corneal central. 3. Reglas generales en incisiones: regla de la válvula y regla de la bisagra Cualquier incisión que presente una incidencia diferente a la perpendicular al tejido corneal produce un efecto valvular que va a asegurar el cierre de la herida si los bordes de la incisión se desplazan. La magnitud permisible de este desplazamiento, denominado márgen de hermeticidad, se expresa en la regla de la válvula26: «Las incisiones a través de la pared del globo ocular producen válvulas cuyo margen de seguridad es igual a la proyección de la superficie de la incisión sobre la superficie del globo ocular». Así, cuando aumenta la presión intraocular, una incisión perpendicular va a abrirse siempre, mientras que una incisión valvular va a cerrarse aún más herméticamente; en otras palabras, una incisión valvular no puede abrirse por elevación de la presión intraocular. Cuanto más grande es el área proyectada de la superficie de la herida sobre la superficie ocular, mejor es la calidad de la válvula (Fig. 4). La regla de la bisagra26 postula: «Una incisión sobre la que actúan fuerzas perpendiculares va a mantenerse hermética si su bisagra se encuentra completamente dentro de la superficie de la herida». Esencialmente, una incisión se mantendrá hermética si el eje imaginario de bisagra que une los límites del borde externo no intercepta el borde interno de la herida cuando ambos son proyectados sobre la superficie ocular (Fig. 5). El factor decisivo en cualquier incisión para cirugía de catarata es la relación entre la longitud y la anchura de la superficie de la herida: 1) Las incisiones largas y perpendiculares a la superficie de corte se abren con facilidad, siendo por ello necesarios múltiples puntos de sutura para asegurar su estanqueidad; 2) Por el contrario, las incisiones cortas y poco perpendiculares, o tangenciales, tienden a mantenerse herméticas, siendo posible tal hermeticidad sin recurrir a las suturas. En este último caso, el aumento de la presión intraocular aumenta la estanqueidad de la herida al enfrentar los planos del túnel incisional, uno contra otro. La lectura práctica, sería la siguiente: las heridas herméticas se van a mantener cerradas por sí mismas y las heridas no herméticas requerirán suturas para asegurar su cierre. 4. Concepto de embudo anastigmático de Koch Fig. 3. Anillo óptico corneal. Puede corresponder al llamado limbo quirúrgico, siendo una referencia relevante para una mejor comprensión de los cambios observados en los astigmatismos en relación con las incisiones quirúrgicas. 590 El llamado embudo incisional de Koch27 (Fig. 6.1) se encuentra delimitado por dos líneas curvas imaginarias cuya forma está basada en la relación existente entre el astigmatismo y dos características de la incisión: su longitud y su distancia al limbo. Las incisiones practicadas dentro de dicho embudo serán astigmáticamente equivalentes; es decir, inci- 50. INCISIONES EN FACOEMULSIFICACIÓN Fig. 4. Regla de la válvula. El márgen de seguridad de una incisión es proporcional a la proyección de su superficie de corte. 4.1. Incisión perpendicular. Incisión sin efecto valvular, tendencia a la apertura, necesitaría gran número de suturas (4.1.A. Incisión perpendicular. En relación con la córnea; 4.1.B. Superficie de proyección. Es una línea). 4.2. Incisión oblicua o tangencial. Elevado efecto valvular, mínima tendencia a la apertura y pudiera no necesitar suturas en función de su tamaño y plano de proyección; 14.2.B. Superficie de proyección. Gran superificie de proyección, un plano). siones pequeñas próximas al limbo tendrán una evolución astigmática similar a otras mayores alejadas del mismo (Fig. 6.2). Una incisión curvilínea y paralela al limbo cruzaría los límites imaginarios del embudo incisional y sería inestable (Fig. 6.3). Las incisiones rectas practicadas a la misma distancia también superarían dichos límites pero en menor medida y serían, por ello, discretamente más estables (Fig. 6.4). Las incisiones tipo frown y chevron serían, al no superar dichos límites, las más estables (Fig. 6.5). Sin embargo, todas las incisiones mencionadas cortan perpendicularmente el tejido escleral que, característicamente, en esta zona próxima al limbo presenta una orientación radial de sus fibras; por ello, al menos teóricamente, las incisiones radiales (Fig. 6.6) superarían en estabilidad a todas las mencionadas aunque su trayecto más distal debe ser paralelo al limbo para posibilitar la manipulación instrumental y permitir la implantación de la lente intraocular. Como se ha comentado, alejando la incisión externa del limbo se logra una mayor estabilidad de la misma; sin embargo, el desplazamiento posterior de la incisión dificulta la cirugía limitando el movimiento de los instrumentos. Esta dificultad se solucionó parcialmente con la introducción de incisiones tipo frown y chevron, en las que, manteniendo la cuerda de la incisión externa, su zona central se encuentra próxima al limbo (Fig. 6.5) acortando, por ello, el tamaño del túnel y facilitando la manipulación instrumental. Las incisiones tipo frown gozaron de gran vigencia en la década de los 90, abrieron la posibilidad de implantar lentes rígidas hasta de 7 mm sin necesidad de suturas y, lentamente, fueron desplazadas por las incisiones corneales al desarrollarse la anestesia tópica y las lentes plegables implantables por incisiones corneales sin sutura. Entendemos que actualmente presentan escasa vigencia. 5. Astigmatismo corneal regular, macro y microirregular Desde hace algunas décadas, los cirujanos han intentado inducir el menor astigmatismo posible; el conformismo ha cambiado: hace unos años, éramos tolerantes con astigmatismos corregibles con gafas; actualmente, el objetivo es evitar la presencia de astigmatismo tras la cirugía. Consideramos es de gran importancia el adecuado conocimiento del astigmatismo preoperatorio, tanto cualitativa como cuantitativamente; con ello, seremos capaces de planificar la cirugía de la forma más adecuada, seleccionar las técnicas para corrección del astigmatismo a practicar e identificar patrones patológicos sobre los que establecer la conveniencia o la posibilidad de plantearnos, o no, un abordaje refractivo del caso. Tal planteamiento exige manejar la refracción manifiesta, la queratometría manual y la topografía corneal. En cualquier caso, el astigmatismo corneal regular sigue siendo la forma más frecuente. El astigmatismo debe entenderse como un vector dotado de magnitud/potencia (dioptrías) y dirección (eje) cuando hablamos del astigmatismo refractivo; hablaremos de diferencia queratométrica (dioptrías) 591 IV. CIRUGÍA DE LA CATARATA: FACOEMULSIFICACIÓN Fig. 5. Regla de la bisagra. Una incisión es hermética si el eje imaginario de bisagra que une los límites de su borde externo no intercepta su borde interno. 5.1. Incisión hermética. El eje de bisagra no intercepta el borde interno: no precisaría suturas. 5.2. Incisión no hermética. El eje interno es interceptado por el eje de bisagra: las suturas son obligatorias. 5.3. Cierre de una incisión no hermética. Un punto de sutura reconvierte una incisión no hermética (5.2) en una incisión hermética al hacer que los nuevos ejes de bisagra no intercepten el borde interno. y meridiano (grados), al referirnos al astigmatismo corneal. Según la dirección del astigmatismo, expresión condicionada por la localización del eje más curvo y suponiendo la relación de ejes como puramente ortogonal, diferenciamos tres formas básicas de astigmatismo (Fig. 7): 1) Con la regla (meridiano vertical más curvo); 2) Contra la regla (meridiano horizontal más curvo); y 3) Oblicuo (cualquiera de los meridianos oblicuos más curvo). Tres pruebas diagnósticas definen el tipo de astigmatismo: refracción manifiesta (astigmatismo refractivo), queratometría (astigmatismo corneal, en general central) y topografía corneal (astigmatismo corneal)28. También suele ser relevante el conocimiento de las características, diríamos que morfológicas, del astigmatismo más allá de la valoración aislada de su magnitud. Algunas de dichas características pueden contraindicar un abordaje refractivo (cirugía incisional asociada, procedimientos láser para su corrección), y tal circunstancia es conveniente conocerla previamente a plantear una cirugía de catarata o de cristalino. Dos circunstancias pueden ser de relevancia clínica: 1) El astigmatismo macroirregular; y 2) El astigmatismo microirregular. Ambos tipos de astigmatismos suelen quedar mejor definidos por los hallazgos topográficos (Fig. 8), siendo en ocasiones inidentificables por exploración en lámpara de hendidura. El astigmatismo macroirregular expresa variaciones regionales irregulares en la curvatura corneal, estando mejor definido por 592 los hallazgos topográficos29. En su origen destacaríamos el queratocono (Fig. 8.1) y la degeneración pelúcida marginal (Fig. 8.2), como expresiones clínicas de mayor relevancia a la hora de comprometer la recuperación visual tras cirugía de cristalino, y las cicatrices corneales (Fig. 8.3 y 8.4), que además de comprometer la recuperación funcional pueden dificultar la cirugía al plantear problemas de visualización durante el acto quirúrgico. Por el contrario, el astigmatismo microirregular es expresión de irregularidades de la superficie corneal que, en general, suelen ser identificables en exploración con lámpara de hendidura29 con o sin tinción con fluoresceína dependiendo de su naturaleza. Pueden ser inducidas por queratopatías superficiales, por cirugías previas o por cicatrices corneales29. Su importancia, siendo reconocida en cirugía refractiva, puede no ser tan crítica en cirugía de cataratas. Consideramos que la topografía corneal aporta información que, no siendo imprescindible, puede ser relevante al plantearnos una cirugía de cataratas/cristalino: 1) Descarta la presencia de alteraciones morfológicas que han podido no ser identificadas en exploración con lámpara de hendidura (queratocono, degeneración pelúcida marginal, entre otras); 2) Detecta alteraciones de la morfología corneal que pueden contraindicar una cirugía incisional relajante corneal o limbar para la corrección intraoperatoria del astigmatismo; y 3) Nos asegura si se podrá practicar un abordaje láser excimer si quedara algún defecto residual postquirúrgico y nos permitirá plantear un abordaje refractivo de la catarata al paciente. Entendemos que de los diferentes tipos de mapas topográficos que se utilizan, en cirugía de cataratas los más útiles pueden ser los siguientes (Fig. 9): • El mapa tangencial o instantáneo (Fig. 9.1). Puede resultar el más fiel para expresar la presencia de posibles irregularidades astigmáticas, siendo útil para la valoración paracentral y periférica de los meridianos astigmáticos y para la planificación de la cirugía astigmática incisional. • El mapa diferencial (Fig. 9.2). Muestra los cambios entre dos exámenes, siendo útil para monitorizar los cambios en el astigmatismo inducidos por la cirugía. 6. Efecto astigmático de diferentes tipos de incisión Aunque se acepta que las incisiones menores de 3 mm pudieran no inducir astigmatismos1,30,31, su arquitectura, tamaño, localización y peculiaridades de cicatrización hacen que lo mencionado no sea absolutamente cierto. Cómo influyen los mencionados factores en el astigmatismo inducido será comentado en los siguientes apartados. • Incisiones corneales. Se acepta que las incisiones corneales inducen astigmatismos en contra de la herida independientemente del eje del astigmatismo preoperatorio31-35 y que tal efecto se logra precozmente tras la cirugía32-34,36, manteniéndose en el tiempo. Considerando exclusivamente el valor absoluto del astigmatismo inducido, obviando su eje, las incisiones en 50. INCISIONES EN FACOEMULSIFICACIÓN Fig. 6. Embudo anastigmático de Koch. Correlaciona astigmatismo y longitud y distancia al limbo de las incisiones. 6.1. Límites del embudo de Koch. Las incisiones practicadas dentro de estos límites presentarán similar inducción astigmática. 6.2. Equivalencia de incisiones en función de su distancia a limbo. Una incisión de mayor tamaño, si se aleja del limbo induce menor astigmatismo, similar a una de menor tamaño y más próxima al limbo. 6.3. Incisión curvilínea paralela a limbo. Al superar los límites del embudo, será inestable e inductora de astigmatismo. 6.4. Incisiones rectas. A pesar de superar los límites, sería algo más estable que una curvilínea paralela al limbo. 6.5. Incisión tipo frown. Forma más estable de incisión escleral. 6.6. Incisiones radiales. Respetan la distribución de las fibras esclerales, radiales en esa zona. córnea clara practicadas en la zona superior inducen mayor astigmatismo que las practicadas en córnea temporal; este fenómeno viene explicado por la forma oval de la córnea: las incisiones superiores se encuentran más próximas a la zona óptica central, de ahí su mayor inducción astigmática. La gravedad y el parpadeo también pueden arrastrar las incisiones dispuestas horizontalmente, circunstancia que no se produce en las incisiones verticales37,38. Para incisiones de 3,5 mm la inducción astigmática es, según se locali- cen en zona superior o temporal, de: 1,39 vs 0,81 (1 día); 0,92 vs 0,63 (1 semana); 1,25 vs 0,68 (1 mes) y 0,56 vs 0,48 dioptrías (3 meses)39. Para incisiones de 3,2 mm, el cambio en el astigmatismo es de 0,73 ± 0,29 para incisiones superiores, 0,42 ± 0,07 para temporales, 0,53 ± 0,18 para nasales y de 0,61 ± 0,17 y 0,68 ± 0,29 para oblicuas temporales y nasales, respectivamente40. Para el mismo tamaño de incisión, otros autores41, observan una inducción del astigmatismo de 0,55 ± 1,15 para incisiones superiores Fig. 7. Patrones topográficos en astigmatismo. La topografía proporciona información cuantitativa y cualitativa que puede ser de interés cuando nos planteamos un abordaje refractivo de la cirugía de catarata; además, proporciona una información más intuitiva para abordar las incisiones en el eje más curvo. 7.1. Astigmatismo con o a favor de la regla. Eje más curvo en el meridiano vertical; la zona superior parece la localización más lógica de la incisión. 7.2. Astigmatismo en contra de la regla. Eje más curvo en el meridiano horizontal; el abordaje temporal, en el meridiano horizontal, puede ser la primera opción. 7.3. Astigmatismo oblicuo. Según se trate de un ojo derecho o de un ojo izquierdo o de un astigmatismo a 45° o a 135°, la posición de la incisión vendrá condicionada por la anatomía y la comodidad del cirujano. 593 IV. CIRUGÍA DE LA CATARATA: FACOEMULSIFICACIÓN Fig. 8. Topografías de diferentes formas de astigmatismos macroirregulares. Algunas formas pueden pasar inadvertidas en lámpara de hendidura. 8.1. Queratocono. La topografía puede ser diagnóstica. 8.2. Degeneración pelúcida marginal. Sospechar en astigmatismos elevados e irregulares. 8.3. Cicatriz corneal. Puede dificultar la cirugía y comprometer el resultado visual tras cirugía de cataratas. 8.4. Astigmatismo macroirregular en relación con cicatriz corneal. Topografía en relación con cicatriz corneal (8.3). y de 0,58 ± 0,99 para incisiones temporales. Para incisiones de 2,75 mm, dicho cambio es de 0,57 ± 0,30 en incisiones superiores, 0,38 ± 0,21 para temporales, 0,42 ± 0,18 para nasales y de 0,41 ± 0,16 y 0,49 ± 0,23 para incisiones oblicuas temporales y nasales40. En incisiones en córnea temporal, el astigmatismo inducido quirúrgicamente es mayor en córneas finas en los primeros días tras la cirugía; tal efecto no se observa a más largo plazo42. También se ha pretendido encontrar diferencias en incisiones corneales según se localicen en córnea temporal o nasal40,43; comparando incisiones temporales y nasales de 3,5 mm se ha observado que el astigmatismo inducido quirúrgicamente es de 0,74 para incisiones en córnea temporal y de 1,65 para córnea nasal a las 6 semanas de la cirugía y de 0,71 y 1,41 dioptrías respectivamente al año de la cirugía43; para incisiones de 3,2 y 2,75 mm tales diferencias son menores: 0,42 ± 0,07 y 0,38 ± 0,21 para temporales y 0,53 ± 0,18 y 0,42 ± 0,18 para nasales40. Tal vez, la mayor distancia de la córnea temporal al eje visual sea responsable de dicha diferencia. Otros autores, no encuentran tales diferencias cuando comparan incisiones oblicuas superiores temporales y nasales44,45. • Incisiones esclerales. Aunque las incisiones esclerales pudieran ser practicadas en esclera superior o temporal, las características anatómicas de la zona temporal y su excesiva visibilidad no las hacen aconsejables; sin embargo, han sido utilizadas en algunas ocasiones. Para incisiones esclerales de 7 mm el astigmatismo inducido quirúrgicamente es de 1,16 ± 0,44 dioptrías cuando se utiliza un abordaje superior y de 0,66 ± 0,32 dioptrías con incisión escleral en zona temporal46; en incisiones esclerales de 5 mm el astigmatismo induci- do quirúrgicamente es también mayor (0,7 ± 0,1 dioptrías) para incisiones superiores que para incisiones temporales (0,3 ± 0,1 dioptrías)47. Para una incisión escleral de 3 mm la inducción astigmática en contra de la regla varía de 0 a 0,26 dioptrías en estudios en ojos de cadáver48. Ambos tipos de incisiones esclerales (superiores y temporales) pueden inducir cierto astigmatismo irregular en relación con la situación preoperatoria, pero no presentan diferencias entre ellas en cuanto a frecuencia de astigmatismo irregulares postquirúrgicos cuando se practican incisiones esclerales sin sutura de 4,1 mm49. Con incisiones mayores de 4 mm la inducción astigmática dependerá de múltiples factores: tamaño y posición de la incisión, longitud y profundidad de las suturas si existieran, elasticidad del material de sutura y procesos de reparación estromal, entre otros. Instrumental Al igual que ha evolucionado la concepción de las incisiones, se ha venido desarrollando material específico que facilitara su práctica. Los cambios más relevantes han venido de la mano de la utilización de nuevos materiales de corte (diamante y aceros de alta calidad) y de nuevos diseños (modificación de tamaños, perfiles, ángulos y bordes del material de corte) que han contribuido notablemente a lograr una arquitectura incisional de excepcional calidad y alta reproductibilidad. Hoy, deseamos un instrumento de corte que permita superar la resistencia del tejido y crear una incisión externa de morfología lineal, una trayectoria intraestromal de, al menos, 2 mm, un labio interno también lineal y que, todo ello, pueda ser practicado sin distorsionar el tejido corneal y con el mínimo daño estructural posible. Tabla III. Inducción de astigmatismos en incisiones corneales Autor Año Incisión (mm) Temporal Superior Nasal Oblicua temporal Olicua nasal Cristóbal40 Cristóbal40 2006 2006 3,2 2,75 0,42±0,07 0,38±0,21 0,73±0,29 0,57±0,30 0,53±0,18 0,42±0,18 0,61±0,17 0,41±0,16 0,68±0,29 0,49±0,23 594 50. INCISIONES EN FACOEMULSIFICACIÓN Fig. 9. Mapas topográficos de utilidad en cirugía de cataratas. Aunque las opciones son múltiples, entendemos que estos pueden ser los más relevanes. 9.1. Mapa tangencial o instantáneo. Identifica irregularidades en el astigmatismo. 9.2. Mapa diferencial. Permite identificar los cambios observados entre dos exploraciones complementarias. 1. Fijación El uso de la anestesia tópica, que ha posibilitado practicar cirugías sin necesidad de recurrir a la oclusión postoperatoria, y la utilización de elementos de corte de gran precisión han obligado a cambiar ciertas concepciones relativas a la fijación del globo ocular durante las diferentes fases de la cirugía ocular. Hoy nos exigimos fijar el globo ocular y manipu- Fig. 10. Instrumental para fijación del globo ocular en cirugía de catarata. Los anillos de fijación y las pinzas son los materiales más utilizados. 10.1. Anillo de fijación de Fine-Thornton. Presenta bordes dentados y una zona de apertura a través de la cual practicar la incisión. 10.2. Pinza tipo colibrí de Barraquer. Presenta dientes de 0,12 mm, angulados, y plataformas para el manejo de suturas, siendo su extremo distal también angulado. 10.3. Pinza de Bonn. Idénticas características (dientes 0,12 mm, angulados y plataformas) pero con extremo distal recto. larlo sin provocar desgarros ni hemorragias conjuntivales y evitando abrasiones corneales. Como instrumental de fijación, las pinzas han perdido cierta vigencia siendo desplazadas por los anillos de fijación (Fig. 10.1) en los primeros pasos de la cirugía donde son más necesarios: ejecución de incisión de entrada y paracentesis. De utilizar pinzas (Fig. 10.2 y 10.3), conviene recordar algunos principios deseables para una pinza de uso en cirugía ocular50: 1) Preferible una pinza de mango corto (dos apoyos: tejido y dedos); 2) Que proporcione mínima sujeción (mejora su movilidad); y 3) Que presente mínima apertura (mejora la visibilidad bajo el microscopio). Una pinza clásica larga proporciona 595 IV. CIRUGÍA DE LA CATARATA: FACOEMULSIFICACIÓN información táctil y propioceptiva con apoyo en tejido, dedos y metacarpo para lograr la fijación; en una pinza de uso ocular para cirugía de catarata entendemos que la información visual es más relevante, perdiendo importancia la información táctil y propioceptiva, por lo que una pinza de mango corto, para la fijación, proporciona mayor versatilidad. Respecto a las puntas, las no dentadas serán más convenientes para la presa de tejidos delicados como la conjuntiva, que excepcionalmente es necesaria actualmente en cirugía de catarata, y la morfología de la punta con superficies ranuradas perpendicular, paralelamente o mixtas dependerá del uso a dar a las mismas. Evidentemente, una pinza con dientes favorece la sujeción; los dientes pueden ser a 90º o angulados, afilados (para córnea o esclera) o romos (para conjuntiva o iris). Del tamaño y de la forma de los dientes se derivarán sus usos. En general, en cirugía de catarata, serán preferibles las pinzas con dientes angulados, afilados y del menor tamaño posible (0,12 mm es la medida más utilizada); si, además, la punta presentara plataforma, la misma pinza resultará útil para la manipulación de tejidos (fundamentalmente conjuntiva y córnea) y suturas (de ser necesarias). 2. Corte El material de corte ha presentando grandes mejoras; especialmente en dos áreas fundamentales: 1) El material; y 2) El diseño. El material condiciona el filo y la capacidad de penetración del instrumental de corte y el diseño abre la posibilidad de practicar diferentes arquitecturas incisionales. En cuanto a materiales, se ha pasado del acero al diamante y se han introducido también nuevos materiales, con pretendidas características intermedias entre ambos, que deberían permitir practicar incisiones con precisión, reproductibilidad y sin comprometer los procesos de reparación estromal. Entre los materiales más utilizados para practicar incisiones, en cirugía de cataratas, destacaríamos: diamante, zafiro, diamante negro, composites cerámicos y aceros. Las diferencias entre ellos se valoran en términos de acabado, dureza, filo, capacidad de penetración, condiciones de reesterilización, desechabilidad, durabilidad y precio. Los materiales se clasifican básicamente en función de la dureza; para tal fin, se utiliza la clasificación de Mohs, descrita en 1822, y que utiliza un escalado del 1 al 10 (Fig. 11), siendo el talco un material de dureza 1 y el diamante de dureza 10. La clasificación no es lineal y sí tiene algo de arbitraria: un mineral de dureza 3 no es tres veces más duro que un material de dureza 1, el diamante (dureza 10) es cuatro veces más duro que el corundum (dureza 9); para tal medida se utilizan instrumentos específicos. Como mencionábamos, el material condicionará: • Filo. A mayor dureza del material, mayor posibilidad de afilarlo, y a mayor filo, mayor control por parte del cirujano; de esta forma se podrá reducir el trauma sobre el tejido y las incisiones serán más reproducibles. El diamante puede ser preparado para su uso quirúrgico por medio de dos métodos: 1) Tallado o pulido de su 596 Fig. 11. Clasificación de Mohs. Es una clasificación de dureza de materiales universalmente aceptada. superficie; 2) Tallado láser. El segundo es el método más económico pero ambos métodos ofrecen diamantes con excelente filo. La posibilidad de conseguir filos adecuados disminuye con otros materiales de menor dureza, aunque se están introduciendo métodos industriales que mejoran tal posibilidad. • Capacidad de penetración. Otro aspecto que depende del material es su capacidad de penetración que es consecuencia directa del espesor del bisturí; en general, los de uso actual son de 150-200 µm para poder asegurar una adecuada rigidez; los de diamante pudieran ser más finos pero, al necesitar bordes tallados, su espesor es similar al de los bisturís de acero. • Ángulo de ataque. Cuanto menos afilado es el bisturí (acero, por ejemplo), el ángulo de ataque deber ser más agudo y, por ello, aumenta la posibilidad de que el trayecto intraestromal sea más largo. Estudios histológicos de incisiones corneales con bisturís de acero y diamante han demostrado que el diamante es superior al permitir un menor deterioro del estroma corneal antes y después de la implantación de la lente intraocular, pudiendo favorecer los procesos de reparación tisular en relación con el acero51,52. Respecto al diseño, condiciona tanto la capacidad de penetración de un bisturí como la geometría de la incisión. Se ha pasado de diseños triangulares a diseños trapezoidales, de poder practicar geometrías de incisión cuadradas o rectangulares a trapezoidales; todos los diseños tienen sus ventajas e inconvenientes que serán discutidos en este mismo capítulo. La posibilidad de practicar una u otra geometría depende, entre otros factores, del diseño del bisturí. 50. INCISIONES EN FACOEMULSIFICACIÓN También es de obligado reconocimiento que al igual que los diamantes han revolucionado el mundo de los materiales de corte, los aceros han mejorado notablemente su calidad al mismo tiempo. Los bisturís han pasado de ser triangulares (Fig. 12.1) a conservar su morfología triangular en la zona proximal para presentar bordes paralelos en la región distal (Fig. 12.2); con ellos, las incisiones externas e internas, así como sus bordes laterales, son paralelos y del mismo tamaño; más recientemente, especialmente con el desarrollo de las técnicas de microincisión, la forma trapezoidal en el extremo distal de los mismos (Fig. 12.3) ha permitido practicar incisiones con aspecto trapezoidal: incisión externa más ancha que la interna y bordes laterales no paralelos con configuración trapezoidal de la incisión. El aspecto frontal de los mismos también ha cambiado en lo que se ha dado en llamar diseño 3-D; el aspecto frontal de los bisturís ofrece diferentes pendientes en sus bordes superior e inferior (Fig. 13.1), siendo por lo tanto diferente el aspecto de los mismos por su zona superior (Fig. 13.2) e inferior (Fig. 13.3). Con tal diseño, se pretende que el bisturí, al entrar en contacto con la córnea en la zona de inicio de la incisión externa, avance suavemente sin dañar el tejido y logrando una incisión externa recta, una trayecto intraestromal uniforme y que no precise reorientar su punta hacia abajo para diseñar la incisión interna, maniobra que se ha relacionado con cierta tendencia a desgarrar el tejido pudiendo provocar el enrrollamiento de la Descemet2. Existen otros múltiples diseños que permiten diferentes fines pero que suponen mínimas diferencias sobre los diseños comentados. incisiones de pequeño tamaño y que, en general, pueden no necesitar suturas. Lo que ha sido entendido como incisión pequeña ha experimentado múltiples cambios en los últimos años. Si revisamos la literatura53, para algunos autores la incisión de 7 mm, para otros la de 5,1 mm, y así siempre ha sido entendida como incisión pequeña la incisión discretamente menor que la habitual para determinada época. Si revisamos la historia, la reclinación de cristalino permitía operar cataratas a través de menos de 1 mm, empeño en el que actualmente seguimos comprometidos. En general, como mencionábamos, el objetivo de la cirugía de catarata debe ser practicar todo el procedimiento, extracción de catarata e implantación de la lente intraocular, a través de la incisión más pequeña posible; con el discurrir de los años, los equipos actuales pueden permitir eliminar el cristalino a través de incisiones menores de 1 mm; sin embargo, las lentes a implantar requieren, hoy por hoy, incisiones algo mayores. Hoy, 2008, debemos entender como incisiones pequeñas aquellas que utilizamos para facoemulsificación, técnica actualmente vigente, y que, en general, son incisiones menores de 3 mm. En los últimos años ha sido introducido el concepto de microincisión que, entendemos, pudiera ser sinónimo de incisión pequeña; no obstante, existe una tendencia generalizada a considerar como microincisiones a las incisiones menores de 2,2 mm; con ellas, es necesario recurrir a técnicas de cirugía microcoaxial (sub 2,2 mm) o microincisional bimanual (sub 1,8 mm). Ventajas e inconvenientes de las incisiones pequeñas INCISIONES EN FACOEMULSIFICACION Cuando hablamos de incisiones de facoemulsificación, por contraposición con la cirugía extracapsular, pensamos en Fig. 12. Bisturís para cirugía de catarata. Diseños más frecuentemente utilizados. 12.1. Diseño triangular. Diseño clásico para facoemulsificación en 3,2 mm. 12.2. Diseño triangular con extremo distal de bordes paralelos. Bisturí diseñado para incisiones de 2,75 mm. 12.3. Diseño trapezoidal. Para incisiones de 1,8 mm y con marcas que delimitan 1,6 y 1,8 mm. Algunas de las ventajas de las incisiones pequeñas (Tabla IV) son evidentes: 1) Menor inflamación a nivel incisional; 2) Menor ruptura de la barrera hemato-acuosa; 3) Menor inducción astigmática; 4) Rápida rehabilitación visual; 5) Mayor estabilidad de la incisión; y 6) Menor variabilidad refractiva en el tiempo. Es evidente, que algunos deben ser sus inconvenientes: 1) Limitan el instrumental que pueda ser introducido en cámara anterior; 2) Dificultan la manipulación de dicho instrumental; 3) Condicionan el flujo de fluidos; 4) Aumentan el riesgo de quemadura, al menos con la tecnología actual; y 5) Condicionan el tamaño de las lentes a implantar. En las tres últimas décadas, trabajamos con incisiones pequeñas para aprovechar sus ventajas intentando adaptarnos y superar sus inconvenientes; para lograrlo, se ha evolucionado en el diseño de su arquitectura, localización y tamaño y se han introducido mejoras en el instrumental utilizado para tal fin. Arquitectura y diseño de incisiones La arquitectura, el tamaño y la distancia al eje visual son los factores que más condicionan el astigmatismo inducido quirúrgicamente (Tabla V) para cualquier tipo de incisión. En 597 IV. CIRUGÍA DE LA CATARATA: FACOEMULSIFICACIÓN Fig. 13. Prototipo de bisturí de diamante 3-D. Existiendo diferentes modelos, se presenta el esquema de un prototipo estándar. 13.1. Visión frontal. Se pueden visualizarse las diferentes inclinaciones de las caras superior e inferior. 13.2. Visión superior. Es posible apreciar la punta del bisturí (prácticamente plana en la zona superior con bordes laterales de corte) y sus superficies de corte en la cara superior (superficie de corte ligeramente inclinada). 13.3. Visión inferior. Extremo con mayor pendiente que los bordes laterales. Tabla IV. Ventajas e inconvenientes de las incisiones pequeñas Ventajas 1. 2. 3. 4. 5. 6. Inconvenientes Menor inflamación incisional Menor ruptura barrera hemato-acuosa Menor inducción astigmática Rápida rehabilitación visual Mayor estabilidad incisional Menor variabilidad refractiva 1. 2. 3. 4. 5. incisiones de mayor tamaño y que requerían sutura, ésta y el material utilizado condicionaban notablemente el astigmatismo inducido. La arquitectura, la posición (horizontal o vertical), la localización (esclerales, limbares o corneales), el tamaño, la distancia al eje visual, la morfología y su profundidad condicionan la manipulación instrumental durante la cirugía, la visualización correcta de las estructuras endooculares, el riesgo de complicaciones intra o postoperatorias, el astigmatismo inducido y la estabilidad refractiva en relación con la inTabla V. Factores incisionales relacionados con el astigmatismo inducido Principales 1. 2. 3. 4. Arquitectura Tamaño Distancia al eje visual Suturas 598 Secundarios 1. 2. 3. 4. 5. Posición Localización Morfología Profundidad Cauterización Limitan introducción instrumental Dificultan manipulación instrumental Condicionan flujo de fluidos Aumentan riesgo de quemaduras Condicionan lentes a implantar cisión tras cirugía de catarata. En incisiones esclerales donde puede ser necesario el uso de cauterización, ésta puede ser un factor más que concicione el astigmatismo inducido. Cualquiera que sea el tipo de incisión, reconocemos 3 pasos en su diseño: incisión externa, trayecto intraestromal e incisión interna (Fig. 1); pasos que describimos en los siguientes apartados. 1. Arquitectura Aunque una incisión puede ser practicada en un único trayecto quirúrgico, dentro de los que entendemos como arquitectura de una incisión, las mismas pueden ser practicadas en uno, dos o tres trayectos (Fig. 14). Si se construyen en un paso (Fig. 14.1), el trayecto es directo y, por supuesto, debe evitar ser perpendicular a la córnea pues condicionaría su hermeticidad. Si se construyen en dos pasos (Fig. 14.2), se diferencian una preincisión y una tunelización que penetra directamente en cámara anterior. Si se realizan en tres pasos (Fig. 14.3), el primero será la preincisión, el segundo la tunelización 50. INCISIONES EN FACOEMULSIFICACIÓN Fig. 14. Arquitectura de incisiones. Las incisiones pueden ser practicadas en 1, 2, 3 pasos y con preincisión según Langerman. 14.1. Incisión en 1 paso (14.1.A. Esquema; 14.1.B. Entrada directa en cámara anterior; 14.1.C. Imagen OCT). 14.2. Incisión en 2 pasos (14.2.A. Esquema; 14.2.B. Preincisión antes de abordar cámara anterior; 14.2.B. Imagen OCT). 14.3. Incisión en 3 pasos (14.3.A. Esquema; 14.3.B. Cambio de dirección al entrar en cámara anterior; 14.3.C. Imagen OCT). 14.4. Incisión tipo Langerman (14.4.A. Esquema; 14.4.B. La preincisión previa se practica con un cuchillete precalibrado de 400 a 600 µm; 14.4.C. Imagen OCT). 599 IV. CIRUGÍA DE LA CATARATA: FACOEMULSIFICACIÓN y el tercero la incisión interna; el labio corneal de la incisión interna proporciona una resistencia añadida debido al efecto de válvula que puede ejercer54. Una novedad, respecto a los tipos de incisión mencionados, constituyó la introducción del concepto de bisagra en la construcción de la preincisión, novedad que fue introducida por Langerman55 (Fig. 14.4). La arquitectura de la incisión externa también puede ser modificada; en incisiones esclerales, que en la década de los 90 se practicaron con regularidad, las opciones son múltiples y las arquitecturas de los diseños externos casi tantos como autores tal y como se describe en los próximos apartados; por el contrario, las incisiones corneales presentan menor número de variantes y destacaríamos los diseños paralelelos al limbo de Fine12 y los rectos de Williamson56 aunque algunos autores adaptan la incisión frown/sonrisa invertida diseñada para incisiones esclerales a su localización corneal o más bien limbar. Suele aceptarse que con el cambio de forma de la incisión externa de paralela al limbo a recta o curvada en dirección opuesta al limbo (tipo frown, por ejemplo) se logra una incisión más estable57. En cualquier caso, la ejecución de la incisión externa debe ser perpendicular a la esclera o a la córnea cuando se practican incisiones con más de un trayecto, siendo el resto de los trayectos, intraestromal y corneal interno, tangenciales; en incisiones practicadas en un único trayecto, éste debe ser tangencial a la córnea. En relación con el trayecto intraestromal, de su longitud dependerá la estanqueidad de la incisión por lógica aplicación de las reglas de la válvula y de la bisagra26: a mayor trayecto intraestromal, mayor hermeticidad de la herida; los únicos inconvenientes de trayectos intraestromales excesivos: pueden comprometer, por distorsión, la visualización de algún paso quirúrgico y la circulación del flujo por el manguito de irrigación, por compresión y estrangulamiento, aumentando el riesgo de quemadura. Este plano intraestromal ha sido practicado con bisturís tipo lanceta y de diseño plano; se da una incongruencia entre las curvaturas corneales y el tallado de dicho trayecto intraestromal: sin embargo, tal hecho no ha despertado, en general, controversias. Más recientemente, se ha sugerido que la inducción de aberraciones pudiera ser diferente en relación con el tipo de bisturí utilizado para la tunelización del trayecto intraestromal de la incisión corneal; para algunos autores58, con bisturís arqueados (Fig. 15) no se produce inducción de aberraciones de alto orden tras incisiones en córnea clara temporal y, por el contrario, con bisturís planos convencionales (Fig. 15) la posibilidad de inducir aberraciones de alto orden aumenta. El bisturí arqueado (patente USA, nº 5797397) es diferente de los planos convencionales en cuanto tiene un perfil arqueado, con una elevación del arco de 0,5 mm y 2,9 mm de anchura, y permite practicar incisiones también arquedas, no en su diseño sobre el borde corneal sino en su trayectoria intraestromal, y diseñar una incisión en tres dimensiones, evitando riesgos sobre la incisión cuando en su trayecto se introduce el instrumental quirúrgico. Existe un modelo comercializado de tal lanceta en 3,2 mm (BD Xstar slit knife; KOJO BD Ophthalmic Systems, NJ, 3,2 mm), que hemos 600 Fig. 15. Lancetas para cirugía de catarata. Se representan dos modelos de 3,2 mm. 15.1. Convencional 3,2 mm (15.1.A. Visión frontal; 15.1.B. Visión lateral). 15.2. De Kojo 3,2 mm (15.2.A. Visión frontal; 15.2.B. Visión lateral). tenido ocasión de utilizar. No hemos observado las ventajas sugeridas por los autores y sí algunos inconvenientes: solo es fabricado en 3,2 mm, tamaño de incisión que estamos abandonando, y el labio interno corneal, siempre según nuestra experiencia, tiene cierta tendencia a retraerse pues no es lineal sino lanceolado. Pensamos que las posibles ventajas de tales bisturís son más teóricas que reales. A pesar de la importancia del diseño externo de la incisión, es la incisión interna la que más directamente se relaciona con la estanqueidad incisional, de ahí el interés por su diseño y ejecución. De la pulcritud en la ejecución de la incisión externa derivará el estado del epitelio a su nivel y la calidad de sus bordes, aspectos que condicionan la adhesividad bacteriana; con la hermeticidad del borde interno se evitará la entrada de sangre en cámara anterior cuando se practican incisiones esclerales57 y las hipotensiones de las primeras horas que pudieran facilitar la entrada de gérmenes en cámara anterior59. En general, es deseable que el labio interno sea recto y para su correcta ejecución es necesario verticalizar la punta del bisturí desde el plano tangencial, que es necesario para el tallado del trayecto intraestromal, hacia la cúpula del cristalino para practicar el último tramo de cualquier tipo de incisión para cirugía de catarata; no debería ser necesario advertir que dicho último tramo debe discurrir en córnea clara, alejados del ángulo camerular para evitar la raíz del iris y su posibilidad de herniación. 2. Tamaño Aunque actualmente estemos inmersos en reducir el tamaño de la incisión en pasos de 0,1 mm, es aceptado universalmente que tales logros son deseables, especialmente cuando la tecnología actual permite eliminar una catarata por una incisión de menos de 2 mm e implantar una lente de un material altamente biocompatible y calidad óptica adecuada por la misma incisión. 50. INCISIONES EN FACOEMULSIFICACIÓN Algunos de los motivos que justifican el reducir el tamaño de la incisión son: 1. La resistencia de una incisión al aumentar la presión, en estudios en ojos de cadáver, aumenta según decrece el tamaño de la incisión60. 2. A menor incisión, la respuesta inflamatoria observada en cámara anterior durante la primera semana tras la intervención es menor61. 3. Es un hecho conocido, y derivado de la práctica clínica, que a mayor tamaño de incisión, mayor aplanamiento del meridiano sobre el que se localice, así como mayor inducción astigmática62. 4. Las incisiones menores de 3 mm inducen pocos cambios en el astigmatismo1,30,31,63. 5. A menor tamaño de incisión, más rápida rehabilitación visual (permitirá mejores agudezas visuales en menos tiempo)64,65 y una precoz y mayor estabilidad refractiva (permitirá refracción y alta médica, más precozmente)65,66. 6. Otras ventajas, no menos desdeñables, de las incisiones pequeñas serían: permiten practicar cirugía de cataratas con mayor rapidez, facilitan la capsulorrexis al permitir un mejor balance de presiones e incluso podemos abordar la cirugía en situaciones de presión intraocular positiva. A pesar de todos los beneficios expresados, entendemos que el objetivo principal de reducir el tamaño de las incisiones es evitar el astigmatismo inducido por la cirugía. Parece existir una relación lineal entre el incremento del tamaño de la incisión y el aplanamiento inducido sobre la córnea en el eje incisional31; o lo que es lo mismo: a menor tamaño de incisión, menor inducción astigmática. La inducción astigmática de una incisión pudiera ser evitada con incisiones menores de 3 mm1, hecho corroborado en estudios experimentales practicados en ojo de cadáver31 y demostrado con la práctica clínica40,45. Según aumenta el tamaño de la incisión, la magnitud del cambio en el astigmatismo también aumenta, así como la desviación estándar de tal cambio, reduciendo la predictibilidad del resultado y retrasando la estabilidad refractiva y la recuperación visual40,67. También es cierto que el empeño de reducir el tamaño de las incisiones suele llevar implícito una pérdida de calidad de las mismas mientras se desarrolla el instrumental adecuado y se realiza la puesta a punto de la técnica. Es la experiencia vivida al pasar de 2,75 mm a 2,2 mm o a 1,5 mm; en las primeras fases de la transición, al menos en nuestra práctica, ha sido habitual obtener diseños inadecuados con tendencia a desarrollar «bocas de pez» y una mayor incidencia de quemaduras corneales, factores que han comprometido la hermeticidad de la incisión en algunas ocasiones. Reconocemos que, sobretodo al iniciarnos con técnicas bimanuales microincisionales, hemos tenido que recurrir a instrumental no diseñado para tal fin (lancetas 19G –1,1 mm– de vitrectomía, por ejemplo), la arquitectura no estaba perfectamente definida (diseños cuadrados o trapezoidales con menor incisión externa o interna), la técnica en desarrollo (mayor manipulación instrumental) y nosotros en transición, factores todos ellos sobre los que después hemos mejorado. Con la utilización de material adecuado, con el uso racional de la energía aprovechando las nuevas formas de liberación de la misma y siendo exquisitos en la manipulación instrumental a través de la incisión, dichas complicaciones han disminuido drásticamente. 3. Distancia al eje visual Cuando hablábamos de incisiones limbares o esclerales, el desplazar la incisión de catarata alejándola del eje visual tuvo un efecto más beneficioso que la reducción de su tamaño. Tales incisiones pudieron ser desplazadas posteriormente en incisiones superiores, siendo su primera forma las incisiones esclerales tunelizadas, pero en esclera temporal no fue un estilo de práctica cuyo uso se generalizara. Con el desarrollo de las incisiones corneales, se observó que las incisiones en córnea temporal gozaban, entre otras ventajas, de la posibilidad de alejarse del eje visual: el beneficio intuido era claro, posibilidad de disminuir el astigmatismo inducido cuando la incisión fuera practicada en córnea temporal, para un mismo tamaño de incisión. La forma oval que presenta la córnea en su cara anterior (Fig. 16) con un diámetro promedio de 10,6 mm en su meridiano vertical y de 11,7 mm en el horizontal21 o una distancia promedio entre vértice corneal y limbo superior de 5,20 mm y de 6,23 entre Fig. 16. Relación entre diámetro corneal vertical y horizontal. En general, el diámetro horizonal es mayor que el vertical. El límite corneal está más alejado del ápex corneal en su zona temporal que en su zona superior. 601 IV. CIRUGÍA DE LA CATARATA: FACOEMULSIFICACIÓN vértice corneal y limbo temporal68 ya había sido destacado anteriormente69. No obstante, siendo cierto que tal patrón oval es prácticamente universal, la variabilidad entre individuos puede ser manifiesta. Sin embargo, una mayor distancia entre la incisión y el eje visual no solo condicionará una menor inducción de astigmatismo; las incisiones han sido relacionadas con la inducción de astigmatismos irregulares70 y aberraciones corneales71,72: cuanto más próximas se encuentren al eje visual, mayor puede ser su posible repercusión sobre la calidad visual. La cirugía de catarata por facoemulsificación puede inducir cambios en las aberraciones corneales como el astigmatismo, el coma y el trefoil71; no obstante, conociendo que las manifestaciones clínicas de las aberraciones de alto orden son pupilo-dependientes, entendemos que con pupilas de tamaños normales y en condiciones fotópicas pueden ser de escasa relevancia72. Las incisiones menores de 3,5 mm, en cualquier localización, deberían tener escasa repercusión clínica independientemente de su capacidad para inducir aberraciones tal y como ha sido sugerido71,72. 4. Posición: horizontal, vertical u oblicua Toda incisión mayor de 3 mm, independientemente de su localización y configuración, deslizará el astigmatismo contra la zona de la incisión31; es decir, si la incisión se practica en la zona superior evolucionará en contra de la regla y si se practica en la zona temporal evolucionará a favor de la regla. Luego, la posición de la incisión condiciona su evolutividad. La gravedad y el parpadeo presentan vectores de fuerza verticales; por ello, una incisión situada horizontalmente se verá arrastrada por su efecto (Fig. 17), no así las incisiones dispuestas verticalmente (Fig. 17) que serán paralelas a los vectores de ambas fuerzas37. Estos hechos parecen ser la base, en teoría, de lo observado en clínica: las incisiones verticales, en general en córnea temporal, se estabilizan más precozmente. Las diferencias observadas en astigmatismo inducido entre las incisiones superiores y temporales pudieran no ser únicamente explicables por efecto del parpadeo, de la gravedad y de la distancia al eje visual; tal vez, también la biología y los procesos de curación de la córnea superior y de la córnea temporal pudieran ser diferentes condicionando la respuesta postquirúrgica67,73. En cualquier caso, la magnitud y la duración de los cambios queratométricos observados en incisiones practicadas en los meridianos horizontales y verticales dependen tanto de la localización de la incisión como de su tamaño67. Las incisiones oblicuas presentan características intermedias de ambos tipos de incisión40,44. • Horizontales. Las incisiones horizontales (Fig. 18.1), dispuestas en general en la zona superior, bien a nivel corneal o escleral, presentan una discreta tendencia al deslizamiento de los bordes, fenómeno inducido principalmente por el efecto de la gravedad y del parpadeo37,38; de dicho deslizamiento se induce la separación 602 Fig. 17. Efecto de la gravedad y el parpadeo. Ambas fuerzas, gravedad y parpadeo, ejercen cierta acción en incisiones horizontales, circunstancia que puede condicionar su estabilidad; dicha acción es mínima en incisiones verticales. de los bordes externos de la incisión, una mayor inestabilidad de la herida durante más tiempo y cierto aplanamiento de la córnea sobre dicho meridiano. La estabilidad refractiva se dilata en el tiempo y los cambios en el astigmatismo inducido pueden observarse incluso al año de la cirugía de catarata original. Este fenómeno será más acusado cuanto mayor sea el tamaño de la incisión y más próxima sea la misma al limbo esclero-corneal y, con ello, al eje visual. El diseño de incisiones horizontales ha sido ampliamente utilizado para incisiones esclerales, en general en esclera superior, y conserva su vigencia en incisiones corneales cuando éstas sean practicadas en el meridiano de las 12,00 horas. • Verticales. La práctica de incisiones verticales (Fig. 18.2) en la zona temporal disminuye la inducción astigmática, el cambio del astigmatismo en función del tiempo y el desarrollo de astigmatismos en contra de la regla para cualquier tamaño de incisión36. El diseño de incisiones verticales se ha visto popularizada con la introducción de las incisiones en córnea clara temporal aunque, anteriormente, existieron intentos de popularizarlas en abordaje escleral37,47,49. Las ventajas de practicar incisiones sobre córnea clara hoy parecen evidentes74: no es necesaria la disección conjuntival, la manipulación incisional es mínima y el riesgo de sangrado inexistente. • Oblicuas. La incision Bent («between nine and twelve o´clock»: entre 9 y 12 horas) (Fig. 18.3) es un tipo de 50. INCISIONES EN FACOEMULSIFICACIÓN Fig. 18. Posición de incisiones. 18.1. Horizontal. Incisión corneal practicada en el meridiano vertical: más próxima al eje visual y menor tendencia a la rápida estabilización refractiva; mayor protección palpebral. 18.2. Vertical. Más alejada del eje visual y rápida estabilización refractiva; mínima protección palpebral. 18.3. Incisión oblicua o bent (between nine and twelve o´clock”). Características intermedias en relación con las horizontales y las verticales. incisión para penetrar en cámara anterior por la zona oblicua75,76. Tanto las incisiones corneales como las esclerales pueden ser dispuestas en los meridianos oblicuos cuyas características, respecto a interfase esclero-corneal y distancia al eje visual, son intermedias de las observadas en las zonas superiores y laterales de la encruzijada esclero-corneal. Suzuki75 le supone las siguientes ventajas: 1) Menor astigmatismo inducido que las incisiones habituales; 2) Menor modificación de la curvatura corneal; 3) Mejor agudeza visual que con otros procedimientos. Dichas ventajas, apoyadas en hallazgos queratométricos76 y topográficos77, pudieran ser consecuencia de la menor influencia que pudieran ejercer sobre dicho tipo de incisión tanto la compresión palpebral, la gravedad como el efecto del músculo recto superior. Aunque, originalmente, dicha incisión fue diseñada para ser practicada en las zonas súpero-temporales, algunos autores recomiendan practicarla en el meridiano más curvo con objeto de corregir astigmatismos oblicuos relevantes46, aunque éste sea la zona supero-externa nasal40. Asimismo, se ha venido sugiriendo que las incisiones temporales presentan un mayor riesgo de desarrollar endoftalmitis postquirúrgica78; en un estudio prospectivo multicéntrico reciente sobre 225.471 cirugías, se ha observado que el riesgo de tal complicación es del 0,040% para incisiones superiores y del 0,055% para las incisiones temporales, sin diferencias estadísticamente significativas79. Convencionalmente se ha venido postulando que el menor riesgo de las incisiones superiores puede venir condicionado por la protección que puede suponer el párpado superior para las mismas. Pero no es menos cierto que en estudios prospectivos78,79, retrospectivos80, multicéntricos79,80 o en un único centro81, la incidencia de endoftalmitis varía notablemente; entre los factores que condicionan el riesgo de endoftalmitis se encuentra no sólo el lugar de la incisión sino también el diferente uso que se hace de medidas antisépticas y del uso de antibióticos preoperatorios entre centros. Se ha comunicado que, utilizando las mismas medidas profilácticas para prevención de la infección, se puede esperar una endoftalmitis más por cada 5.500 casos cuando se utiliza la incisión temporal, suponiendo una incidencia de endoftalmitis de un caso por cada 2.400 operaciones79. 5. Localización: corneal, limbar o escleral El limbo anatómico establece un límite y sirve para diferenciar diferentes tipos de incisiones para cirugía de catarata según se localicen sobre él (incisiones limbares), anterior (incisiones corneales) o posteriormente (incisiones esclerales); estos tres tipos de incisiones son las más frecuentemente utilizadas a lo largo de la historia. Existen condicionantes anatómicos estructurales que aconsejan que las incisiones corneales se practiquen preferentemente en zona temporal y que las esclerales y las limbares se practiquen en la zona superior. Además, hay otros condicionantes de las estructuras adyacentes (reborde y morfología orbitaria, principalmente) que pueden complicar el abordaje de la catarata por determinadas localizaciones. Será necesario personalizar la localización de la incisión, como venimos mencionando, en función de las características morfológicas del paciente y del astigmatismo preoperatorio cuando deseemos incidir sobre él quirúrgicamente. Si estamos seguros de practicar incisiones astigmáticamente neutras, la preferencia la marcará en general nuestra propia comodidad durante la cirugía. Sí que es necesario saber que las incisiones esclerales presentan una neutralidad astigmática superior a las limbares y corneales a igualdad de tamaño82, que a menor tamaño de incisión menor inducción astigmática para cualquier localización de la incisión31, que las incisiones corneales presentan una mayor tendencia a evolucionar en con603 IV. CIRUGÍA DE LA CATARATA: FACOEMULSIFICACIÓN tra de la regla que las limbares cuando ambas se practican en la zona superior83 y que la incisión en córnea clara temporal se estabiliza refractivamente de forma más precoz19,37. También se ha sugerido que las incisiones corneales aumentan el riesgo de endoftalmitis postquirúrgica80, al igual que las incisiones en la zona temporal78. La explicación para tal fenómeno se ha pretendido justificar experimental y clínicamente en base a: 1) Experimentalmente, en ojos de cadáver, se observó entrada de fluidos externos tras incisiones corneales al ejercer presión sobre el globo o al hipotonizar el mismo84; 2) Clínicamente, Nagaki78 refiere que el riesgo de endoftalmitis tras incisiones corneales pudiera llegar a duplicarse en relación con los casos de cirugía de cataratas en los que se practica incisión esclero-corneal; y 3) Existe una tendencia generalizada a pensar que el párpado puede proteger a una incisión escleral superior, haciéndola menos vulnerable a la infección que una incisión corneal. En el estudio prospectivo multicéntrico sobre 225.471 cirugías que hemos mencionado79, se ha observado que el riesgo de endoftalmitis es del 0,053% para incisiones corneales y del 0,036% para las incisiones esclerocorneales, sin diferencias estadísticamente significativas. Tal información debe sopesarse cuando nos decidimos por incisiones en córnea clara temporal considerando la conveniencia de tal práctica en base a otros múltiples factores (facilidad quirúrgica, corrección de astigmatismo, reborde orbitario, cirugías previas filtrantes en zona superior, entre otras)79. 6. Profundidad De la profundidad a la que sea practicada una incisión dependerán ciertas circunstancias de la cirugía propiamente dicha y la evolución posterior de la misma. La profundidad de la incisión condiciona el plano de disección del trayecto intraestromal o túnel incisional, aspecto más relevante de la incisión y que condicionará su capacidad para asegurar la hermeticidad de la incisión y su posterior estabilidad refractiva. En incisiones esclerales, siendo, en general, la esclera más gruesa que la córnea, será posible practicar las incisiones esclerales a mayor profundidad, aunque es necesario saber que la esclera vuelve a adelgazarse a 3-4 mm del limbo. Si la incisión es muy superficial la estabilidad de la incisión es menor y el aplanamiento del eje en el que se encuentra es más probable. Si la incisión es profunda habrá una mayor y más precoz estabilidad y un menor aplanamiento sobre dicho eje. Los mencionados hechos pueden condicionar el recomendar incisiones superficiales cuando se desea una mayor inducción astigmática e incisiones profundas cuando lo que deseamos es una mínima inducción astigmática o una rápida estabilidad refractiva19. En general, la disección escleral suele practicarse a 0,25-0,30 mm de profundidad (50% de profundidad de la esclera en la zona paralimbar). Si la disección escleral es superficial, puede perforarse el tapete escleral, y de no perforarse, tras la cirugía puede retraerse y no asegurar un recubrimiento adecuado ni un balance entre las fuerzas 604 de tracción y retracción. Si, por el contrario, la disección escleral es profunda, aumenta el riesgo de sangrado, el cuerpo ciliar puede quedar sobreexpuesto y el plano posterior puede no ofrecer resistencia a la retracción. En incisiones corneales, los fundamentos son similares; incisiones excesivamente superficiales presentan riesgo de perforación de la zona externa y de no perforarse, el riesgo de retracción con la consecuente inestabilidad postquirúrgica puede resultar manifiesta; las incisiones profundas aumentan el riesgo de perforación, la entrada inadvertida por una zona no planificada, el riesgo de sinequias periféricas y pueden comprometer la estanqueidad de la incisión. Hay diseños incisionales, especialmente los que presentan una arquitectura en dos o más trayectos, que consideran como relevante la profundidad a la que se practican algunos de sus pasos, como por ejemplo la incisión tipo Langerman55. 7. Diferencias en los procesos de reparación-curación Hirasaka85 investigó histológicamente los procesos de reparación tisular en incisiones autoselladas esclerales y corneales; comparó la proliferación celular observada, de fibroblastos para las incisiones esclerales y de queratocitos para las corneales, en incisiones de idéntico tamaño (4 x 2 mm); la proliferación observada en las incisiones esclerales era mayor que la observada en las corneales y sugería que dicha diferencia pudiera afectar al astigmatismo postoperatorio inducido. En incisiones esclerales se produce un crecimiento de tejido fibrovascular epiescleral que puede separar de forma permanente los bordes de la incisión, sin recuperar nunca su tensión original, aunque a los 2 meses se ha recuperado el 50% de dicha tensión y a los 2 años, el 75%86. Un crecimiento similar de tejido fibrovascular puede observarse en incisiones limbares en los primeros 7 días, no así en las incisiones corneales donde, por tal motivo, los procesos de reparación son más lentos y pueden llevar más de 2 meses87,88; los mencionados argumentos pudieran ir a favor de una mayor seguridad para las incisiones limbares en relación con las corneales. Sin embargo, pensamos como Fine2, quien opina que en la cirugía de catarata, tal y como debe ser entendida en el momento actual, lo importante no son los procesos de reparación estromal sino la capacidad de autosellado de las incisiones practicadas: autosellada la incisión, y estable refractivamente, el tiempo de reparación tisular en incisiones corneales puede ser irrelevante desde un punto de vista clínico; por ello, las diferentes incisiones deberían ser comparadas en relación con su facilidad de ejecución, reproductibilidad, riesgo de complicaciones intraoperatorias y postoperatorias y estabilización refractiva. INCISIONES LIMBARES Se entienden como tales las incisiones practicadas en el limbo quirúrgico y posteriormente al frente corneal de las ar- 50. INCISIONES EN FACOEMULSIFICACIÓN cadas vasculares perilímbicas y a la inserción de la conjuntiva, tejido que es necesario disecar para su práctica. Tipo de incisiones popularizadas para extracción intracapsular y extracapsular pero poco utilizada en facoemulsificación avanzada. Pudieron ser útiles para cirujanos que, practicando cirugía extracapsular, hicieron la transición a facoemulsificación; en tales circunstancias, se trataban de incisiones conocidas y sencillas de practicar; además, facilitan la reconversión a cirugía extracapsular. Hoy, los programas docentes contemplan el aprendizaje directo de la técnica de facoemulsificación; en tales casos, creemos que la incisión limbar puede tener inconvenientes en relación con la corneal: el riesgo de quemosis conjuntival por ruptura de la inserción conjuntival puede comprometer la visualización durante la cirugía y complicarla más que simplificarla. Como inconvenientes19 frente a la incisión escleral: mayor inducción astigmática, más lenta estabilización de la refracción final y mayor tendencia al deslizamiento en contra de la regla (Tabla VI). Como ventajas19, al menos teóricamente, conservan la integridad corneal, inducen menor astigmatismo que las corneales al estar más alejadas del limbo quirúrgico, cicatrizan más rápidamente al encontrarse en una zona vascularizada y presentan mayor facilidad para manipular las suturas, cuando sea necesario practicarlas, en caso de astigmatismos indeseados (Tabla VI); estas ventajas, reales para cirugía extracapsular, son menos ciertas para facoemulsificación en cuanto manejamos menores incisiones con menor necesidad de suturas. Una incisión limbar, al igual que cualquier otra incisión, entreabre los bordes del tejido causando una aplanamiento sobre el meridiano de la incisión y un encurvamiento del meridiano situado a 90º, cuya magnitud dependerá de la longitud de la incisión y de su localización relativa en relación con el centro de la córnea86. Existen tres aspectos controlables en las incisiones limbares: 1) Localización; 2) Tamaño; y 3) Configuración. Respecto a la localización, conociendo que la evolución final de la incisión será el aplanamiento sobre el meridiano de la incisión, el cirujano puede operar sobre el meridiano más curvo favoreciendo que, en su evolución, se reduzca el astigmatismo preexistente del paciente; no obstante, no es posible practicar la incisión en el meridiano más curvo en todos los casos: por ejemplo, en astigmatismo oblicuos (vg, 45º en el ojo derecho o 135º en el ojo izquierdo) unas prominentes cejas y/o nariz pueden comprometer tal abordaje. En cuanto al tamaño, cuanto mayor sea la incisión, mayor su posibilidad de aplanar el meridiano de la incisión; en pacientes con mínimo astigmatismo, el reducir el tamaño de la incisión limitará la inducción de astigmatismo. Por otro lado, la configuración de la incisión puede condicionar su estabilidad o su evolución en contra de la zona de la incisión; una incisión recta o una frown parecen inducir un menor deslizamiento astigmático que una incisión paralela al limbo. Es necesario añadir que toda incisión mayor de 3 mm, independientemente de su localización y configuración, tendrá tendencia a deslizarse en contra de la zona de la incisión31, es decir, inducirá un astigmatismo en contra de la regla si se practica en la zona superior y un astigmatismo a favor de la regla si se practica en la zona temporal en ojos sin astigmatismos previos. Técnica quirúrgica La mayor parte de los principios quirúrgicos aplicables a este tipo de incisiones se describen en los apartados de incisiones esclerales e incisiones corneales. Entendemos que en este tipo de incisiones es necesaria la peritomía conjuntival, no tanto para exponer el campo, motivo por el que debe practicarse en incisiones esclerales, como para evitar la quemosis conjuntival por paso de fluido a espacio subconjuntival durante la facoemulsificación. 1. Preparación En un primer paso, se libera la conjuntiva a nivel de limbo en los 2-3 mm donde practicaremos la incisión (Fig. 19). Tal liberación se puede practicar directamente con unas tijeras atraumáticas tipo Westcott (Fig. 19.1) no siendo, en general, necesarias las incisiones laterales de descarga conjuntival. Dada la escasa entidad de la arcada vascular perilímbica, excepcionalmente es necesaria la coagulación salvo que con la disección conjuntival se comprometa el espacio epiescleral. 2. Incisión externa, trayecto intraestromal e incisión interna Para estos pasos quirúrgicos aplicaremos todos los principios quirúrgicos que se describirán en incisiones corneales. Tabla VI. Incisiones limbares: ventajas e inconvenientes Ventajas 1. Respecto a las incisiones corneales: • Menor inducción astigmática • Cicatrización más rápida 2. Incisión conocida 3. Fácil reconversión a extracapsular 4. Fácil manipulación de suturas Inconvenientes 1. Respecto a incisiones esclerales: • Mayor inducción astigmática • Lenta estabilización refractiva 2. Riesgo de sangrado 605 IV. CIRUGÍA DE LA CATARATA: FACOEMULSIFICACIÓN Fig. 19. Incisión limbar. Incisión limbar para facoemulsificación. 19.1. Disección de conjuntiva. Se practica con tijeras atraumáticas y para facoemulsificación, en general, no son necesarias incisiones de descarga. 19.2. Trayecto intraestromal. Tunelización ligeramente mayor que en incisiones corneales puras. Tal vez, la única diferencia es que al tratarse de una incisión posterior el trayecto intraestromal para evitar la raíz del iris debe ser algo mayor (Fig. 19.2). INCISIONES ESCLERALES Las incisiones esclerales para cirugía de cataratas han sido utilizadas durante años. Aunque han perdido su vigencia, entendemos que son incisiones que es necesario conocer pues pudieran estar indicadas en algunas circunstancias. Ventajas e inconvenientes Las ventajas e inconvenientes de este tipo de incisiones han sido ampliamente debatidas durante años (Tabla VII); hoy creemos que son pocos los cirujanos que continuan practicándolas. Se acepta que fue Kratz el primer cirujano en proponer el desplazamiento escleral de las incisiones tunelizadas en ciru- gía de la catarata3,89 a partir de las incisiones limbares. Girard90 reclamaba dicho privilegio3, asegurando que presentó el procedimiento con anterioridad; a él se le debe la denominación de incisión escleral tunelizada aceptada para este tipo de incisiones2,90. Con tales incisiones se pretendía aumentar las superficies esclerales de aposición, favorecer con ello los procesos de reparación estromal y disminuir el astigmatismo inducido2. Así, este tipo de incisiones suponían la evolución de las incisiones limbares siendo una variante de una incisión conocida que lograba una rápida cicatrización y una rápida estabilización refractiva con una mínima inducción astigmática; dichos beneficios aumentaron según se redujo el diámetro de las lentes intraoculares y con ello el tamaño de la incisión. También suponían ciertos inconvenientes: mayor tiempo de ejecución, necesidad de disecar conjuntiva y preparar esclera así como de cauterización y cierta dificultad en ojos hundidos para introducir el intrumental intraocularmente durante la cirugía; tampoco es un tipo de incisión recomendable en pacientes anticoagulados dado el riesgo de sangrado que presentan. En cualquier caso, el desarrollo de las incisio- Tabla VII. Incisiones esclerales: ventajas e inconvenientes Ventajas 1. 2. 3. 4. 5. 6. Incisión conocida Alta resistencia Cicatrización rápida Rápida estabilización refractiva Mínima inducción astigmática ¿Reduce el riesgo de endoftalmitis? 606 Inconvenientes 1. 2. 3. 4. 5. 6. 7. 8. 9. Mayor tiempo de ejecución Precisa disecar conjuntiva y esclera Necesidad de cauterización No útil en pacientes anticoagulados Órbitas prominentes/ojos hundidos Dificultad para introducir el tip de faco Riesgo de hifema Difícil reconversión a extracapsular Aspecto postquirúrgico 50. INCISIONES EN FACOEMULSIFICACIÓN nes esclerales obligó a tunelizar las incisiones para poder abordar la cámara anterior con el suficiente avance como para evitar el prolapso del iris; se sentaban las bases de la necesidad de obtener un labio corneal (Fig. 20) alejado de la raíz del iris, probablemente el primer paso para el desarrollo posterior de las incisiones autosellables. Otro de los debates actuales y motivo de controversia es la tendencia a considerar que el riesgo de endoftalmitis tras cirugía de cataratas es menor con incisiones esclerales que con incisiones corneales; dicho riesgo se ha asociado a técnicas quirúrgicas (mayor con intra que con extracapsular91), a localización de las incisiones (mayor con corneales que con esclerales80; mayor con corneales temporales que con esclerales superiores78) y material de la lente intraocular (mayor con siliconas que con lentes de superficie modificada con heparina92; mayor con siliconas y con acrílicas hidrófilas que con acrílicas hidrófobas93). Si las incisiones corneales aumentan el riesgo de endoftalmitis o si las incisiones esclerales lo disminuyen ha sido comentado en el apartado referente a arquitectura de incisiones en este mismo capítulo. Originalmente, la incisión se practicaba en esclera a 2 mm de la porción anterior del limbo quirúrgico: una vez disecada la conjuntiva, se marcaba una preincisión escleral de espesor parcial, se tunelizaba la zona escleral de la incisión y se penetraba en cámara anterior periféricamente, a nivel de la malla trabecular94. Girard y Hoffman propusieron el desplazamiento anterior de la entrada en cámara anterior, salvando la raíz del iris90. La distancia de la incisión escleral al limbo condiciona la dificultad de construcción del túnel escleral, las maniobras con el instrumental y la visualización de la zona subincisional. Inicialmente se aconsejaba practicar la incisión escleral de forma posterior, tan alejada del limbo como fuera posible con objeto de disminuir el astigmatismo inducido y para facilitar el autosellado de la misma. Actualmente se acepta que, con una buena construcción de la incisión, es suficiente hacerla a 1,5-2,0 mm del limbo para obtener un adecuado control astigmático y una capacidad de autosellado suficiente pero sin sacrificar la facilitación de las maniobras quirúrgicas. Las técnicas de incisión escleral que se describen comparten la mayor parte de los pasos quirúrgicos; difieren en el diseño externo de las mismas. Por ello, dichos pasos se describen en el apartado de incisión escleral tunelizada. Incisión escleral tunelizada Muchas de las incisiones esclerales pueden ser consideradas como variantes de la incisión escleral tunelizada, siendo aplicables a todas ellas algunas generalidades respecto a su ejecución. Sus principios fueron descritos cuando aún no se había generalizado el uso de lentes intraoculares plegables y era frecuente disecar tejido suficiente como para, tras la facoemulsificación, ampliar la incisión a 5-7 mm para implantar la lente. Técnica quirúrgica Hoy en día, las incisiones esclerales tunelizadas se practican en tamaños inferiores a 4 mm, habiéndose adaptado los principios desarrollados para tal tipo de incisiones en los años 9074,85,90 a tal tamaño. 1. Preparación Fig. 20. Concepto de «labio corneal» en incisión escleral tunelizada. El avance de la entrada en cámara anterior, para evitar la raíz del iris, favoreció el posterior desarrollo de las incisiones autosellables. Las fuerzas internas y externas que actuán sobre el labio interno tienden, en general, a autosellarlo, salvo la presión sobre las esclera posterior a la incisión que puede separar los planos del túnel esclero-corneal. En un primer paso es necesario disecar la conjuntiva; tal disección debe ser practicada base en fórnix con objeto de evitar problemas de visualización en el campo quirúrgico y debería quedar limitada al tamaño de la incisión prevista. La zona incisional se prepara despegando la conjuntiva de su unión limbar, preferentemente tras practicar dos incisiones radiales, extendidas posteriormente unos 5 mm, en los bordes de la zona y procediendo a la disección de Tenon y del tejido epiescleral con una tijera de bordes atraumáticos tipo Westcott (Fig. 21.1); disecado el espacio subconjuntival se practica la peritomía a nivel limbar (Fig. 21.2) y se desplaza posteriormente la conjuntiva disecada para exponer el tejido escleral. Es deseable que la peritomía conjuntival deje un mm de conjuntiva a nivel limbar para evitar el avance de la conjuntiva sobre la córnea en el postoperatorio2. Una vez expuesta la zona, se procede a la cauterización de los pequeños vasos superficiales (Fig. 21.3), cauterización suave a nivel próximo al limbo y de mayor intensidad si nos desplazamos posteriormente, en función de la entidad de la vasculatura en tales zonas; lo ideal es utilizar un equipo de diatermia y practicar la coagulación en campo húmedo de forma controlada. Los va607 IV. CIRUGÍA DE LA CATARATA: FACOEMULSIFICACIÓN Fig. 21. Incisión escleral tunelizada. Evolución de las incisiones limbares y antesala de las incisiones sin sutura y autosellables. 21.1. Disección conjuntival y coagulación. Se diseca la conjuntiva y se coagulan los pequeños vasos de forma previa a practicar la incisión escleral. 21.2. Preincisión escleral. Este paso debe ser practicado de forma perpendicular al tejido escleral. 21.3. Tunelización escleral. Con un cuchillete adecuado se avanza con movimiento laterales hasta superar la arcada vascular perilímbica. 21.4. Entrada en cámara anterior. Se modifica la dirección del cuchillete respecto al plano del túnel escleral, orientando su punta hacia el interior de la cámara anterior; es conveniente practicarla con la cámara anterior llena de viscoelástico. 21.5. Finalización. Acabada la cirugía la incisión se encuentra autosellada. 21.6. Detalle. Pueden observarse los bordes de la incisión escleral tunelizada tipo frown. 21.7. Cierre de conjuntiva. Puede o no cerrarse con suturas; en este caso se infiltra con corticoides. 21.8. Detalle de la incisión a las 24 h. En OCT se observa que el trayecto intraestromal es más largo que en incisiones corneales. sos que, procedentes de los músculos, penetran en la esclera próximos al limbo deben ser motivo de especial atención: su coagulación individualizada evitará la presencia de sangre en el campo quirúrgico y la presencia de hifema en el postoperatorio. Es necesario conocer los efectos indeseables de una cauterización excesiva: 1) Retracción escleral (motivo de inducción astigmática y alejamiento de los bordes externos de la incisión); 2) Alteración estructural de la esclera que puede comprometer su integridad. 2. Preincisión escleral Es útil conocer la anatomía del limbo y las correlaciones anatómicas del llamado limbo quirúrgico con objeto de practicar la preincisión escleral en el lugar correcto. La preincisión que más se practica actualmente es la recta lineal. Se sugiere que en los primeros casos, la preincisión se practique no más allá de 1-1,5 mm del borde anterior del limbo (zona de unión conjuntival) (Fig. 21.3), dado que un desplazamiento posterior de la misma dificulta el manejo del instrumental quirúrgico intraocularmente: sería necesario elevar el instrumental en la zona posterior del túnel para abordar las estructuras intraoculares, acción que puede distorsionar la córnea, entreabrir la incisión y dificultar el mantenimiento de la cámara anterior, aspectos negativos que se acentúan si el globo ocular es pequeño. Una vez adquirida experiencia, la preincisión puede desplazarse a 2-3 mm del borde anterior del limbo, aunque desplazarlo más allá de 2 mm puede presentar algunos inconvenientes, entre ellos el riesgo de sangrado, sin 608 ventajas añadidas manifiestas. La preincisión puede practicarse según diferentes formas (paralela al limbo, recta, frown, chevron,...), tal y como describiremos. Diferentes cirujanos aconsejan diferentes profundidades, desde 0,17 mm a 0,40 mm95; cada opción tiene sus ventajas así como sus inconvenientes; si la incisión es superficial, el riesgo de rotura de la capa escleral superficial es mayor y el riesgo de abordaje excesivamente anterior de la cámara anterior también (distorsionará la córnea al manipular el instrumental); si la incisión es profunda el riesgo de sangrado es mayor así como el riesgo de entrada prematura en cámara anterior, junto a la raíz del iris (expondrá a la herniación del iris durante los diferentes tiempos quirúrgicos de la facoemulsificación). Es difícil aconsejar una profundidad para todos los casos, especialmente cuando es conocido que el espesor escleral será mayor en personas jóvenes y que estará especialmente adelgazado en grandes miopes; 0,30 mm puede ser una buena opción utilizando cuchilletes precalibrados. 3. Tunelización escleral Es importante que la profundidad de la tunelización sea controlada, uniforme y paralela a la superficie escleral anterior. Todo ello requiere la utilización del instrumental quirúrgico adecuado. Bryant94 aconseja utilizar cuchilletes con angulación de 60º entre el mango y la cabeza de corte; así, orientados por la profundidad de la preincisión, se diseca el plano deseado y se crea el túnel escleral. Fine2 recomienda utilizar un cuchillete tipo crescent (en «media luna creciente») 50. INCISIONES EN FACOEMULSIFICACIÓN con corte superior para disecar el túnel escleral. La disección escleral se practica avanzando con movimientos orientados lateral y anteriormente (Fig. 21.3) siguiendo un curso paralelo a la curvatura escleral, curso que es necesario modificar al alcanzar el espacio corneal, avanzando hasta alcanzar el nacimiento de la Descemet y superar las arcadas vasculares limbares en 0,25-0,50 mm. En la tunelización deben cuidarse, fundamentalmente, dos aspectos19: 1. Mantener correctamente la profundidad del túnel escleral. Esto se logra conservando, en todo momento, el cuchillete paralelo a la curvatura escleral en sus componentes anteroposterior y lateral. Si, a pesar de extremar los cuidados, se produjera un ojal o un desgarro lateral del colgajo escleral superficial, el procedimiento quirúrgico puede ser completado evitando siempre la manipulación excesiva del túnel; sin embargo, al finalizar el procedimiento, la estanqueidad puede quedar comprometida siendo necesarias las suturas que deben evitar las zonas adelgazadas de tejido, pudiendo ser practicadas horizontal (evitando los ojales) o radialmente (por encima de los ojales). 2. Evitar una entrada incorrecta (anterior o posterior) en la cámara anterior. Para evitarlo es necesario trabajar en una tunelización de profundidad adecuada y modificar la orientación del cuchillete, adaptándola al cambio de curvatura de la zona escleral a la corneal. El problema más frecuente es penetrar en cámara anterior junto a la raíz del iris aunque, excepcionalmente, también es posible desgarrar la raíz del iris: el prolapso del iris y el sangrado pueden comprometer todos los pasos quirúrgicos. Lo deseable es evitar llegar a esta situación; si somos conscientes de la incorrecta tunelización, es útil abandonarla y practicar una nueva incisión en otra zona escleral o a nivel limbar o corneal. Si, a pesar de las precauciones, se produce el abordaje incorrecto de la cámara anterior, puede ser más útil, y de menor riesgo, cerrar dicha entrada con suturas que aseguren completamente su estanqueidad e iniciar una nueva zona de entrada. Si se decide continuar el mismo abordaje, es necesario ser generoso en la utilización de viscoelásticos y evitar al máximo el número de entradas y salidas con el instrumental quirúrgico, momentos en los que se puede comprometer el mantenimiento de la integridad del iris; una vez introducido el tip del faco, evitando la raíz del iris, puede producirse un bloqueo suficiente de la zona de entrada como para evitar las hernias de iris; sin embargo, respetar su integridad dependerá no sólo de la habilidad sino también de la experiencia del cirujano. 4. Paracentesis de asistencia Es más fácil realizarla con un cuchillete de diamante o con uno de acero desechable, siendo más deseable fueran preca- librados. La paracentesis de asistencia debe ser practicada a 45-90º de la zona de tunelización escleral, deseablemente paralela al iris y cornealmente respecto a la inserción conjuntival en el limbo; para su ejecución es preciso fijar el globo ocular, bien con un anillo de Fine-Thorton o con una pinza adecuada. Practicada la paracentesis, se introduce la cánula hasta la zona opuesta de la cámara anterior y, una vez allí, se procede a inyectar el viscoelástico lentamente: de esta forma, el humor acuoso fluye por la punción de asistencia y la cámara se rellena con viscoelástico. 5. Entrada en cámara anterior Una vez repuesta la cámara anterior y seleccionado el cuchillete precalibrado de anchura deseada (2,2-3,2 mm, en general), se procede a avanzar el cuchillete a través del túnel escleral y una vez que su punta alcanza el extremo anterior de la tunelización previamente practicada se procede a modificar su dirección hacia el interior del ojo, orientándola hacia la cúpula del cristalino, haciendo que la zona más ancha del cuchillete penetre en cámara anterior (Fig. 21.4). La entrada ideal en cámara anterior debe suponer una incisión recta en la membrana de Descemet para lograr una arquitectura adecuada de la incisión. Con este proceder, y debido al almohadillado que proporciona el viscoelástico, se aborda con suavidad la cámara anterior, se controla la entrada y se evita el daño del cristalino, lográndose una incisión de la anchura deseada y lo suficientemente alejada de la raíz del iris como para facilitar la facoemulsificación. Para Ernest54, el realizar un labio corneal interno de 1,5 mm proporciona mayor resistencia y seguridad a la herida. Configuraciones externas Las configuraciones externas de las incisiones esclerales tunelizadas fueron múltiples19; hoy en tamaños de incisión menores de 3-4 mm, las que persisten son las rectas y la tipo frown (en «sonrisa invertida»). Las incisiones esclerales rectas han sido descritas al tratar la incisión escleral tunelizada en general; como hemos mencionado, constituyen una de las configuraciones externas más extendidas y de precisar reconversión a extracapsular son las más fáciles de transformar. 1. Incisión frown Singer96 describió la incisión frown (Fig. 22.1), incisión que practicaba desde 1990. El nombre, en inglés, hace referencia al aspecto que presenta la incisión para el cirujano, simulando enojo o enfado (literalmente, frown significa: ceño, entrecejo, enojo, rigor; se ha extendido el uso «en sonrisa invertida»). En su artículo original describía incisiones de 6 y 7 609 IV. CIRUGÍA DE LA CATARATA: FACOEMULSIFICACIÓN Fig. 22. Configuraciones externas de incisiones esclerales. Se recogen algunas de las variantes diseñadas para tal tipo de incisiones. 22.1. Incisión tipo frown. Probablemente el diseño más extendido y precursor de otros diseños. 22.2. Incisión chevron o en V invertida. Aproxima su vértice al limbo para facilitar la entrada en cámara anterior. 22.3. Incisión trapezoidal. Variante, como puede observarse, de las dos anteriores. 22.4. Incisión en W. Todos los trayectos de la configuración externa son radiales respecto al limbo. 22.5. Incisión radial. Un trayecto radial y una incisión escleral horizontal alejada del limbo. 22.6. Incisión en J. Combinación de incisión frown y radial. mm que eran cerradas con una sutura horizontal; al reducir su tamaño, las suturas para tal tipo de incisión fueron perdiendo vigencia. Son practicadas de forma preferente en esclera superior y en nuestra experiencia con tal incisión observamos su tendencia a desarrollar astigmatismos en contra de la regla incluso a medio y largo plazo (6-12 meses); es decir, la estabilidad refractiva no se logra a corto plazo. Fue la incisión que practicamos en los años 90, nos abrió la posibilidad de implantar lentes rígidas de 5 mm de óptica sin necesidad de sutura y fue una incisión con la que nos encontramos cómodos y a la que recurrimos cuando nos planteamos incisiones esclerales en la actualidad. 2. Incisión chevron o en V invertida Pallin97 describió una incisión en V invertida (Fig. 22.2) a la que le suponía las siguientes ventajas: el vértice de la V facilitaba la entrada en la cámara anterior y la manipulación del instrumental minimizándose los pliegues corneales, y con ello las dificultades de visualización, durante las maniobras quirúrgicas. Las ramas de la V deben formar un ángulo próximo a 90º entre ellas y la separación entre sus extremos debía ser suficiente como para permitir el paso de una lente intraocular de 5,5 mm, diámetro habitual de las lentes intraoculares cuando fue descrita esta incisión; el trayecto intraestromal es trapezoidal y el autor no presta especial anterior al labio corneal interno, manifestando que 0,5 mm pudiera ser 610 suficiente. Esta incisión presenta grandes similitudes con la incisión tipo frown y a diferencia de otras incisiones clásicas (incisiones esclerales rectas o paralelas al limbo) sus extremos se alejan del limbo. 3. Incisión trapezoidal Este tipo de incisión fue sugerida por diferentes autores98,99. Maloney98 describió una incisión con configuración trapezoidal (Fig. 22.3) a la que llamaba universal y la suponía astigmáticamente neutra. La preincisión, practicada al 50% del espesor escleral, debería ser perpendicular a esclera y paralela al limbo en su tramo central, alejándose oblicuamente del mismo en los dos trayectos laterales; generalmente, el tramo central es de 3 mm de ancho. Como puede observarse (Fig. 22.3), sus similitudes con las incisiones frown (Fig. 22.1) y chevron (Fig. 22.2) son manifiestas. Para el autor98, este tipo de incisiones tendrían un comportamiento similar a las incisiones de 3 mm pero permitirían la implantación de lentes de 5 mm, práctica habitual anterior al desarrollo y extensión del uso de las lentes plegables. Incisión en W. Hennekes100 desarrolló una incisión en W (Fig. 22.4) a la que consideró como una evolución de la frown (Fig. 22.1) y de la trapezoidal (Fig. 22.3) y a la que supuso una mayor estabilidad y una menor inducción astigmática, al igual que todos los demás autores96-98,100 para sus propios diseños. La suposición de tales ventajas se apoyaba en la 50. INCISIONES EN FACOEMULSIFICACIÓN disposición radial de todos los trayectos del diseño de la incisión externa de este tipo de incisión escleral, pudiendo ser intermedia entre una doble frown o una doble V invertida. Además, la mayor superficie escleral comprometida proporcionaría una mayor superficie escleral de curación y reduciría el tiempo para la estabilización refractiva. En nuestro conocimiento no fue una incisión cuyo uso se generalizara. 4. Incisión escleral radial Siepser101 describió una incisión radial transversa (Fig. 22.5) con la que afirmaba conseguía la estabilización astigmática a la semana y con la que no observaba evolución en contra de la regla en seguimientos a 3 meses. La incisión se iniciaba con un cuchillete precalibrado a 0,30 mm; se marcaba una incisión escleral radial de 3,5 mm localizando su inicio a 1,5 mm de la arcada vascular; posteriormente se practicaba una tunelización escleral a ambos lados de la incisión radial, preservando así las fibras esclerales radiales superficiales; finalmente, se abordaba cámara anterior con una anchura máxima de 3,5 mm. Con tal tipo de incisión, que practicamos en el pasado, observamos que el desplazamiento posterior alejado del limbo invadía una zona de mayor vascularización escleral y de vasos de mayor calibre; por ello, el riesgo de sangrado era mayor así como la necesidad de coagulación; además, no le encontramos las ventajas descritas por los autores respecto a rápida estabilización refractiva. 5. Incisión en J Una última variante de diseño externo de incisiones esclerales, a las que nos referimos en este capítulo, es la descrita por Ans102, incisión a la que el autor se refirió como incisión en J (Fig. 22.6). La misma combinaría una incisión frown corta, exagerando su curvatura y extendiendo uno de sus extremos posteriormente, con una incisión radial; la tunelización escleral sería más ancha que la correspondiente al tamaño de su diseño externo con el fin de permitir la entrada de la punta de facoemulsificación y facilitar la implantación de cualquier tipo de lente. Una de las dificultades con las que nos podemos encontrar con este tipo de incisiones es la reconversión a cirugía extracapsular si tal situación se planteara en la práctica (Fig. 23). Personalmente, en incisiones rectas y frown, extendemos sus extremos laterales hasta el limbo, marcamos una preincisión limbar y ampliamos la incisión lateralmente bien con cuchillete o preferiblemente con tijeras de ramas de Castroviejo. INCISIONES CORNEALES La córnea como lugar para la incisión de catarata ha sido redescubierta en los últimos años, habiendo sido Fine quien ha extendido sus usos actuales en facoemulsificación2,12,103. La expansión de la utilización de la anestesia tópica y de las lentes plegables han condicionado su nuevo resurgir. Ya en 1968, Kelman1 propuso la práctica de facoemulsificación a partir de una in- Fig. 23. Reconversión a incisión para cirugía extracapsular. Una situación para la que es preciso estar preparado. 23.1. Reconversión de incisión escleral recta. Se prolongan, a 90°, los bordes laterales de la incisión hasta el limbo y a este nivel se completa la apertura de la cámara anterior. 23.2. Reconversión de incisión frown. Igualmente, se incide la esclera en los bordes laterales hasta el limbo y se extiende la incisión lateralmente de forma paralela al limbo. 611 IV. CIRUGÍA DE LA CATARATA: FACOEMULSIFICACIÓN cisión en córnea clara. En la era moderna de la facoemulsificación, junto a Fine2,12,103, Shimizu11 ha liderado el abordaje corneal. Ventajas e inconvenientes Entendemos como incisiones corneales a las practicadas por delante de las arcadas vasculares perilímbicas. Actualmente, su uso se ha extendido debido, entre otras ventajas, a poder ser practicadas bajo anestesia tópica. Sin embargo, entendemos que sus ventajas son múltiples (Tabla VIII): 1) Practicables bajo anestesia tópica; 2) Rápida ejecución; 3) No precisan suturas de tracción; 2) No precisan disección conjuntival ni escleral, circunstancias relacionadas con el sangrado; 3) Evitan la necesidad de practicar cauterización; 4) El acceso a cámara anterior durante las diferentes maniobras quirúrgicas es más sencillo; 5) El cierre conjuntival, con sutura o cualquier otra técnica, es innecesaria; y 6) Poca irritación postquirúrgica y rápida recuperación de aspecto de normalidad, entre otras. También se ha sugerido que la cirugía de catarata practicada a través de incisiones en córnea clara puede tener un efecto hipotensor significativo, ventaja que no se observa para las incisiones esclerales104. Evidentemente, también se han venido destacando algunos posibles inconvenientes (Tabla VIII) de este tipo de incisiones: 1) Logísticos (reorganización de quirófanos e instrumental específico); 2) Mayor riesgo de quemaduras105; 3) Filtración diferida de las heridas84; 4) Riesgo de hipotonía en las primeras horas tras la cirugía106; 5) Curación más lenta y enlentecimiento de la estabilización refractiva85; y 6) Mayor riesgo de endoftalmitis78,80,107, entre otras. Otras de las críticas vertidas sobre este tipo de incisiones han venido desde el punto de vista de si pudieran ser o no tan resistentes como las incisiones limbares o esclerales. Fueron determinantes a este respecto los trabajos sobre ojos de cadáver de Ernest108-110: en ellos, se demostraba que las incisiones corneales de diseño cuadrado eran menos resistentes a la presión externa selectiva que las incisiones limbares y es- clerales del mismo tamaño y que tal resistencia aumentaba para las corneales, igualándose con las limbares y las esclerales, según se disminuía el tamaño de la incisión. Otros autores afirman que para incisiones menores de 3 mm la tunelización de 2,5 mm pudiera ser suficiente para lograr una adecuada resistencia, similar a las de incisiones esclerales del mismo tamaño, a la presencia de presiones externas111. En cualquier caso, existen situaciones en la práctica clínica en las que son más aconsejables las incisiones corneales: entre ellas, destacaríamos los ojos con cirugías filtrantes o esclerales previas, pacientes en anticoagulación por cualquier motivo o quienes presenten un mayor riesgo de sangrado y aquellos con patología conjuntival de carácter cicatricial tipo penfigoide ocular, entre otros. Además, la práctica de facoemulsificación a través de incisiones corneales con anestesia tópica ha extendido sus indicaciones a pacientes en los que la cirugía de cataratas pudiera estar contraindicada; entre ellos, pacientes anticoagulados o con patologías sistémicas cardiovasculares o pulmonares. De las posibles localizaciones de las incisiones corneales, la temporal es la más utilizada; sin embargo, son cada vez más los cirujanos que practicando incisiones en córnea temporal tienden a realizarlas también en el eje más curvo: tal práctica es necesario si nos decidimos por un abordaje refractivo de la catarata. Entendemos que el abordaje temporal tiene grandes ventajas para la práctica de facoemulsificación pero que la cirugía en el eje más curvo sigue siendo hoy deseable, debiendo soslayar algunos de sus inconvenientes. Se acepta que una incisión corneal menor de 3 mm es astigmáticamente neutra1. Así, sería necesario utilizar incisiones superiores a 3 mm si se deseara inducir cierto astigmatismo para corregir astigmatismos preexistentes o asociar otras técnicas incisionales (queratotomías arcuatas, incisiones limbares relajantes u otras) con incisiones corneales inferiores a 3 mm. Al menos en teoría, aquella incisión corneal que indujera mayor astigmatismo sería la más adecuada para ser practicada en el eje más curvo15 si lo que pretendemos es corregir astigmatismos corneales previos sin otras técnicas asociadas. Tabla VIII. Incisiones en córnea clara: ventajas e inconvenientes Ventajas 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. 12. Practicables bajo anestesia tópica Rápida ejecución No precisan suturas de tracción No precisan disección conjuntival ni escleral Evitan la necesidad de practicar cauterización Acceso más sencillo a cámara anterior Faco no limitada por anatomía (nariz, cejas, órbitas) Útil en ojos con cirugías previas Útil en pacientes anticoagulados Cierre conjuntival innecesario Poca irritación postquirúrgica Rápida recuperación de normalidad 612 Inconvenientes 1. 2. 3. 4. 5. 6. Logísticos Mayor riesgo de quemaduras Filtración diferida de las heridas Riesgo de hipotonía Curación más lenta ¿Mayor riesgo de endoftalmitis? 50. INCISIONES EN FACOEMULSIFICACIÓN La incisión en córnea temporal presenta también ciertas ventajas propias (Tabla IX); entre ellas: 1) La incisión se practica más alejada del eje visual que en cualquier otro tipo de incisión corneal y por ello el riesgo de transmitir el aplanamiento al eje visual es menor; 2) La localización temporal no se encuentra obstruida por los párpados, evitando la necesidad de suturas de tracción; 3) La disposición paralela del plano iridiano favorece el efecto «reflejo rojo» y mejora la visualización de las estructuras oculares; 4) Existe menor tendencia al encharcamiento del campo quirúrgico por el drenaje natural de los fluidos durante la facoemulsificación; y 5) La tendencia al autosellado es mayor pues ambos bordes verticales de la incisión se disponen en el sentido de la gravedad y no se produce la tendencia al deslizamiento que existe en las incisiones horizontales que pueden ser arrastradas por el parpadeo. Desde la introducción de las incisiones corneales para facoemulsificación, muchas han sido las novedades en su arquitectura y su diseño, la mayoría en relación con la disminución del tamaño de las mismas. En este apartado diferenciaremos tipos de incisiones corneales: 1) Incisiones para facoemulsificación convencional (coaxial), incisiones de 2 a 3,2 mm; y 2) Incisiones para facoemulsificación microincisional (bimanual no coaxial), incisiones inferiores a 2 mm. Entendemos presentan ciertas similitudes pero también algunas diferencias que querríamos destacar. 2. Por su arquitectura: • Incisión corneal en un plano. En este tipo de incisión no existe preincisión en el diseño externo de la misma. • Incisión corneal con preincisión superficial. Cuando la preincisión es inferior a 400 µm de profundidad. • Incisión corneal con preincisión profunda. La preincisión compromete más de 400 µm de profundidad en el diseño del borde externo de la incisión; posteriormente, la tunelización se practica profunda pero no en continuidad con el fondo de la preincisión, a la que será perpendicular. Esta última incisión correspondería a la descrita por Langerman55. Los autores que, a nuestro entender, más han contribuido al diseño de las incisiones corneales que practicamos hoy en día han sido: Fine2, Williamson56 y Langerman55. Describiremos los aspectos más relevantes de sus enseñanzas. A pesar de requerir más tiempo para su ejecución, hay evidencias en la literatura que demuestran que las incisiones esclerales o limbares corneales son más resistentes que las practicadas en córnea clara y que las incisiones corneales con preincisión profunda son más resistentes que las practicadas con preincisión superficial o que las practicadas en un plano112. En cualquier caso, una incisión corneal, practicada según los cánones actuales y cualquiera de las arquitecturas descritas, es lo suficientemente estable como para asegurar la estanqueidad ocular en situaciones normales. Clasificación de las incisiones corneales Los cambios en las incisiones para cirugía de cataratas en los últimos años han llevado a ciertas controversias sobre la localización real de las mismas; Fine tomó tal testigo y propone una clasificación de las incisiones corneales basado en su localización anatómica y arquitectura2, en la que diferencia (Tabla X): 1. Por su localización anatómica: • Incisión en córnea clara. Se entiende como tal a la incisión corneal cuyo borde externo es anterior a la inserción limbar de la conjuntiva. • Incisión limbar corneal. Sería la incisión con borde externo sobre la conjuntiva que se superpone al limbo esclero-corneal. • Incisión escleral corneal. En ella, la incisión externa es posterior al limbo. Incisiones corneales para facoemulsificación coaxial (2-3,2 mm) En los últimos años, el abordaje a través de la córnea temporal se ha constituido en el estilo de práctica más extenTabla X. Incisiones corneales: clasificación 1. Por localización anatómica 2. Por arquitectura • Incisión en córnea clara • Incisión corneal limbar • Incisión escleral corneal • Incisión corneal en un plano • Incisión corneal con preincisión superficial • Incisión corneal con preincisión profunda Tabla IX. Incisiones en córnea clara temporal: ventajas e inconvenientes Ventajas 1. 2. 3. 4. 5. 6. 7. Fácilmente practicable bajo anestesia tópica Incisión más alejada del eje visual Adecuada exposición del globo ocular Excelente visualización del «reflejo rojo» Facilita el drenaje de fluidos Mayor tendencia al autosellado Conjuntiva intacta para procedimientos futuros Inconvenientes 1. Logísticos (organización de quirófanos) 2. Cierta dificultad de aprendizaje 3. Otros riesgos controvertidos: • Quemaduras incisionales • Heridas filtrantes • Hipotonía postquirúrgica • ¿Endoftalmitis? 613 IV. CIRUGÍA DE LA CATARATA: FACOEMULSIFICACIÓN dido. La alternativa a la incisión en córnea clara temporal es la incisión, también corneal, en el eje más curvo y a cuya práctica pueden aplicarse todos los principios de aquella. Ciertas maniobras son comunes a todas las incisiones corneales que se describen a continuación. Una, la técnica de paracentesis. Otras, las técnicas de fijación. Lo que describimos es un compendio de aspectos recogidos ampliamente en la literatura y que actualizamos en base a nuestra propia experiencia y práctica habitual. inyección de viscoelástico justo en la entrada, se concentraría el humor acuoso en cámara anterior en la zona opuesta a la paracentesis y, al retirar la cánula, dicho viscoelástico sería expulsado por la hiperpresión generada. Es importante inyectar suficiente viscoelástico como para ofrecer un globo ocular con suficiente tono como para practicar la incisión corneal; también es importante que el viscoelástico no sea excesivo pues la hiperpresión del globo ocular aumenta el riesgo de entradas prematuras en cámara anterior por trayecto intraestromal insuficiente al practicar la incisión. 1. Paracentesis o incisión de asistencia 3. Incisión corneal tunelizada, según Fine Es útil practicar la paracentesis, y rellenar la cámara anterior con viscoelástico, de forma previa a iniciar la incisión corneal. Es paso clave la fijación del globo para asegurar su estabilidad y ofrecer suficiente contrapresión como para avanzar el bisturí al practicar la paracentesis de forma muy controlada. Para fijar el globo, especialmente cuando utilizamos anestesia tópica, puede ser útil utilizar el anillo de fijación escleral de Thornton-Fine (Fig. 24.1) que es una modificación del anillo de Thornton en el que se ha eliminado una sección para facilitar la entrada del instrumental al practicar las incisiones. Otra opción es utilizar una pinza (Fig. 24.2); esta opción es más asequible y debería emplearse a modo de ancla sobre la conjuntiva y esclera, evitando morder la conjuntiva pues en tal caso aumenta el riesgo de desencadenar dolor y de provocar una hemorragia; de utilizar pinza es aconsejable apoyarla en la zona enfrentada a 180º de la zona donde practicaremos la paracentesis. 2. Reposición de cámara anterior con viscoelásticos Practicada la paracentesis, la cánula del viscoelástico es introducida por la misma y avanzada hasta el extremo opuesto de la cámara anterior (Fig. 25), momento en el que se inicia su llenado desplazando el humor acuoso que saldrá lentamente a través de la paracentesis. Si se iniciara la Partiendo de la idea de que la paracentesis constituía una incisión corneal tunelizada autosellable, Fine describió lo que entendemos hoy por una incisión corneal tunelizada2,12,103,113. Fijado el globo con el anillo de Fine-Thornton de 13 mm, con su zona abierta orientada temporalmente, el cuchillete penetra sobre el epitelio corneal justo por delante de la arcada vascular limbar aplanando la superficie del globo (Fig. 26.1.A y 26.1.B). El cuchillete de diamante, habitual- Fig. 25. Reposición de cámara anterior con viscoelásticos. Debe ser lenta y el paso previo a la práctica de la incisión corneal para la facoemulsificación. 25.1. Posicionamiento de la cánula. Antes de iniciar la inyección de viscoelástico es necesario desplazar la cánula al extremo opuesto de la cámara anterior. 25.2. Llenado de la cámara anterior con sustancia viscoelástica. Debe ser una maniobra lenta que permita la salida del humor acuoso por la paracentesis y su sustitución por viscoelástico. Fig. 24. Técnicas de fijación del globo ocular. Las técnicas que mencionamos son posibilidades de fijar el globo ocular para la práctica de maniobras que requieran cierta contrapresión. 24.1. Fijación con anillo de Thornton-Fine. Se apoya sobre conjuntiva y esclera, dejando una zona libre para practicar la incisión. 24.2. Fijación con pinza. Ésta debe apoyarse, a modo de ancla, en una zona libre de vasos. 24.3. Fijación con pinza en la paracentesis. Se evita siempre el sangrado, como ventaja, y puede distorsionar ligeramente la córnea, como inconveniente. 614 50. INCISIONES EN FACOEMULSIFICACIÓN Fig. 26. Incisión corneal tunelizada según Fine. Se describe una incisión corneal en un plano de morfología rectangular. 26.1. Trayecto intraestromal corneal en el inicio de la incisión (26.1.A. Visión frontal; 26.1.B. Visión lateral donde se visualiza la inclinación del cuchillete recomendable durante esta fase). 26.2. Entrada en cámara anterior a través de la Descemet (26.2.A. Visión frontal; 26.2.B. Visión lateral donde se observa el cambio de dirección del cuchillete para abordar la cámara anterior; atravesada la Descemet se reorienta el cuhillete en el plano del túnel para lograr una entrada lineal a nivel de Descemet). 26.3. Incisión tipo según Fine (26.3.A. Incisión de 3x2 mm; 26.3.B. OCT a las 24 horas). 615 IV. CIRUGÍA DE LA CATARATA: FACOEMULSIFICACIÓN mente de 3 mm, avanza 2 mm hasta que entra en contacto con Descemet y, deprimiendo su punta, penetra en cámara anterior (Fig. 26.2.A y 26.2.B). Una vez que dicha punta penetra en cámara anterior, se reestablece el plano de penetración del cuchillete con objeto de obtener una configuración lineal del corte sobre la Descemet. Con el mencionado proceder logra una incisión de configuración rectangular de 3 mm de ancho por 2 mm de trayecto intraestromal corneal, incisión que, por otro lado, es fácilmente reproducible (Fig. 26.3.A y 26.3.B). Sin embargo, dicho proceder, incisión en un paso, deja una solapa corneal delgada en su zona de entrada periférica que ocasionalmente adquiere un aspecto irregular39. En la última versión de su incisión, comenta es posible practicar una preincisión de 300 µm justo delante de la arcada vascular perilímbica; cuando se practica una preincisión antes de crear el túnel corneal, el cuchillete deprime la córnea en su zona externa y la incisión se completa de la forma descrita. Entendemos que con preincisión sería ya una incisión en dos planos y poco diferenciable a la incisión de Williamson56, salvo que la de Fine sería de configuración externa recta, paralela al limbo la de Williamson, y de morfología rectangular frente a la trapezoidal de Williamson. 4. Incisión corneal, según Williamson Williamson56 fue el primer autor en proponer la práctica de una preincisión de 300-400 µm. También diseñó, junto a Dykes, el primer bisturí trapezoidal de bisturís de diamante para facoemulsificación114. La incisión corneal de Williamson se inicia, en un primer paso, con el marcado de una incisión arqueada, discurriendo paralela la limbo, justo por delante del límite de la arcada vascular limbar (Fig. 27.1.A y 1.B). Originalmente dicha preincisión tenía una profundidad de 400 µm pero, actualmente, prefiere practicarla a 300 µm. A continuación se repone cámara anterior con viscoelástico, como se ha descrito previamente, a través de la paracentesis de servicio, y se inicia el segundo paso. Fijado el globo, se practica el túnel corneal. Para Williamson56, la incisión deseable para facoemulsificación e implantación de una lente plegable debe tener forma trapezoidal con una apertura interna de 3,2 mm, una externa de 3,5 mm y un recorrido tunelizado de 1,75 mm. La mayor apertura externa permite un mejor manejo lateral del faco y de la punta de irrigación-aspiración. El diseño del cuchillete de diamante trapezoidal facilita la práctica este tipo de incisión. La punta del cuchillete se avanza a través de la preincisión arqueada previamente marcada, de forma paralela al plano del iris, hasta que los ángulos del cuchillete alcanzan la incisión externa (Fig. 27.2.A); en este momento, la punta ha avanzado 1,75 mm en estroma corneal y debería estar ya en disposición de alcanzar Descemet. Se penetra en cámara anterior y se avanza hasta que los ángulos del cuchillete alcanzan la apertura interna (Fig. 27.2.B). En este momento, el túnel incisional corneal tiene una forma trapezoidal y las dimensiones citadas (Fig. 27.3.A y 27.3.B). 616 5. Incisión corneal en bisagra, según Langerman La incisión corneal en bisagra de Langerman (Fig. 28) es una incisión corneal con preincisión profunda, tunelizada y autosellable55. En su descripción original55, Langerman sugería que la preincisión podía profundizarse 750 µm o más; es conveniente utilizar un bisturí precalibrado para este primer paso con objeto de obtener una buena reproducibilidad y poder conocer nuestros propios resultados. Actualmente, se comercializan cuchilletes precalibrados para el marcado de la preincisión; los más extendidos están precalibrados para penetrar a 300, 400, 500 ó 600 µm de profundidad. En nuestra práctica utilizamos un precalibrado de 600 µm: nos permite una adecuada profundización para lograr un efecto bisagra y una suficiente seguridad para evitar perforaciones sin tener que recurrir a la medida sistemática del espesor corneal en el lugar donde practicaremos la preincisión. La preincisión debe ser trazada por dentro de la arcada vascular y el bisturí debe hacer su recorrido perpendicular a la córnea a dicho nivel; la preincisión discurre paralela al limbo y en el recorrido coincidente con la anchura seleccionada para la incisión corneal (Fig. 28.1.A y 28.1.B). Posteriormente, la tunelización corneal se iniciaría a 2/3 de profundidad de la preincisión (400 µm de profundidad para preincisión de 600 µm, por ejemplo); el bisturí deprime la zona más periférica de la incisión y avanza disecando el túnel corneal (Fig. 28.2.A); al final, al penetrar en cámara anterior modifica su trayectoria para penetrar la Descemet y la recupera según el túnel corneal para lograr una incisión lineal en Descemet (Fig. 28.2.B). En este tipo de incisión (Fig. 14.4.A y 14.4.B; Fig. 28), el trayecto más profundo de la preincisión serviría a modo de bisagra no permitiendo el filtrado por la incisión al ejercer presión en el labio posterior de la incisión (Fig. 28.3.A y 28.3.B), siendo esta su mayor diferencia con los diseños de Fine2,12,103,113 y Williamson56. Las diferencias en inducción astigmática entre estos tipos de incisiones han sido mínimas115. La incisión corneal según Langerman es una incisión que hemos practicado y practicamos profusamente; su mayor ventaja, la seguridad; algunos de sus inconvenientes: 1) Más laboriosa, por lo que exige mayor tiempo de ejecución; 2) Según se reduce el tamaño de la incisión, la preincisión dificulta la introducción de la punta del facoemulsificador y la de los inyectores para implantar la lente intraocular; 3) Tenemos la impresión de que produce mayor sensación álgica en el postoperatorio, en relación con las incisiones directas. El debate actual de las incisiones en córnea clara se está centrando en cual debiera ser la configuración más adecuada de dichas incisiones para disminuir el riesgo de hipotensión ocular en el postoperatorio inmediato, hipotensión que pudiera ser el origen de reflujo de secreciones conjuntivales hacia cámara anterior84,116. Tanto Fine2,12,103,113 como Williamson56, autores de los diseños más profusamente utilizados en los últimos diez años, proponen incisiones de configuración rectangular; rectangular de 3 x 2 mm, según Fine12 y trapezoidal 3,5 (externa)-3,2 (interna) x 1,75 mm, según William- 50. INCISIONES EN FACOEMULSIFICACIÓN Fig. 27. Incisión corneal según Williamson. Es una incisión en dos planos de morfología trapezoidal. 27.1. Preincisión corneal de 300 µm (27.1.A. Preincisión paralela al limbo; 27.1.B. Preincisión perpendicular al limbo). 27.2. Bisturí trapezoidal penetrando en cámara anterior (27.2.A. Definición longitud trayecto intraestromal de 1,75 mm por penetración del primer tramo del bisturí; 27.2.B. Se completa la entrada en cámara anterior cuando los ángulos del bisturí superan el límite de la Descemet). 27.3. Morfología trapezoidal de la incisión de Williamson (27.3.A. Dimensiones recomendadas en la descripción original de la incisión; 27.3.B. OCT a las 24 horas). IV. CIRUGÍA DE LA CATARATA: FACOEMULSIFICACIÓN Fig. 28. Incisión corneal según Langerman. Es una incisión con una preincisión que actuará a modo de bisagra, proporcionando seguridad. 28.1. Preincisión corneal de 600 µm (28.1.A. Preincisión paralela al limbo con bisturí precalibrado a 600 µm; 28.1.B. Preincisión perpendicular al limbo). 28.2. Tunelización corneal (28.2.A. Tunelización corneal a 2/3 del espesor de la preincisión; 28.2.B. Visión lateral, primera fase en la que se deprime la zona posterior de la preincisión para, posteriormente modificar la inclinación del bistrurí para penetrar Descemet, retomando el plano del túnel al completar la entrada en cámara anterior). 28.3. Efecto bisagra al ejercer presión posterior (28.3.A. Presión en la esclera posterior a la preincisión; 28.3.B. Con la incisión de Langerman, se desplaza la esclera posterior, se entreabre la preincisión pero el túnel corneal permanece hermético). 618 50. INCISIONES EN FACOEMULSIFICACIÓN son56. Sin embargo, recientemente se aboga que los diseños cuadrados (3 x 3 mm; 2,2 x 2,2 mm, por ejemplo) o casi cuadrados (3 x 2,75, por ejemplo) pudieran ser más estancos en base a estudios experimentales109,116 y clínicos59,106. Evidentemente, en incisiones en córnea clara, con un diseño cuadrado de 3 mm el labio interno se aproximará más al eje visual, con sus conocidos inconvenientes, que lo que lo haría una incisión de 2,2 mm. Incisiones corneales para facoemulsificación microincisional (<2 mm) Con más o menos éxito, la facoemulsificación microincisional va ganando adeptos y no dudamos que será la rutina en pocos años; si la técnica microcoaxial superará la barrera de los 2 mm o si será necesario practicar cirugía bimanual es una pregunta para la que hoy no tenemos respuesta. Entendemos que la arquitectura y diseño de incisiones de 2-3 mm han quedado suficientemente revisadas en el apartado anterior; bajar de incisiones de 3,2 mm a 2 mm ha requerido pocos cambios y, prácticamente, la reducción de los calibres de los bisturís ha resultado ser lo único imprescindible. En este apartado nos referiremos a las incisiones menores de 2 mm necesarias para practicar cirugía bimanual. Parafraseando a Soler117, en una técnica que denominamos microincisional es obvio que este paso quirúrgico defina la esencia del procedimiento. De ahí la importancia de la incisión, mayor a menor tamaño de la misma, por la dificultad de ejecución y por la posibilidad de complicaciones que pudieran comprometer su hermeticidad. En la primera época de la cirugía microincisional fue práctica habitual adaptar bisturís utilizados para otras técnicas (vitrectomía, por ejemplo) a la cirugía de catarata; la calidad de las incisiones no era la deseable y la técnica despertó el interés de la industria desarrollando nuevo instrumental. Sería injusto no reconocer que se retomaron la mayor parte de los principios conocidos para cirugía en córnea clara y se adaptaron a este esperanzadora técnica; la arquitectura de las incisiones en uno o dos planos, los bisturís de diamante con sus perfectos diseños y los principios de las incisiones trapezoidales descritos por Williamson56, entre otros. También es cierto que la estrechez de las incisiones aumentó el riesgo de las quemaduras, empeoró la calidad de las incisiones y obligó a desarrollar nuevas formas de administración de energía por parte de los aparatos de facoemulsificación así como a modificar algunas de las técnicas quirúrgicas existentes. La inexistencia de bisturís para incisiones menores de 2 mm nos obligó a utilizar las lancetas de esclerotomía utilizadas en vitrectomía; así, se nos hizo familiar conocer y utilizar las equivalencias entre las unidades de medida G (gauge) y mm (Tabla XI). Tales lancetas son precalibradas y nos permiten practicar incisiones del tamaño deseado; pero, por otro lado, son rectas, no presentando angulación entre el mango y la cabeza de corte, por lo que la posición Tabla XI. Equivalencia entre unidades G (gauge) y mm G (Gauge) 8 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 29 30 Mm 4 3,5 3 2,8 2,4 2-2,1 1,8 1,6 1,4-1,5 1,2-1,3 1-1,1 0,9 0,8 0,7 0,6 0,55 0,5 0,45 0,4 0,35 0,3 Tomado de: Atlas of Retinal and Vitreous Surgery; Travis A. Meredith; Mosby, 1999. de la mano del cirujano es poco natural y el control que permiten, sobre la arquitectura de la incisión, escaso y muy cirujano-dependiente. Afortunadamente, tal época pasó y hoy existen bisturís, tanto de acero como de diamante, que permiten practicar incisiones menores de 2 mm con absoluta seguridad (Fig. 29); además, presentan otras peculiaridades derivadas de la necesidad que han generado las microincisiones: tienen configuración trapezoidal y marcas que permiten conocer su an- Fig. 29. Bisturí para cirugía microincisional. Pueden observarse tanto su configuración trapezoidal como sus marcas de 1,6 y 1,8 mm de anchura en este caso. 619 IV. CIRUGÍA DE LA CATARATA: FACOEMULSIFICACIÓN chura a diferentes niveles, siendo así posible escoger el tamaño de la incisión que deseamos penetrando hasta una u otra marca del bisturí. El tamaño de la incisión y su relación con el diámetro del instrumental a introducir es también motivo de larga controversia; para algunos autores es necesaria cierta holgura, especialmente en la incisión principal, para asegurar cierta refrigeración por pérdidas incisionales105,118; para otros, el ajuste debe ser perfecto para asegurar el mantenimiento de la cámara anterior y aprovechar toda la dinámica de fluidos para que los fragmentos puedan desplazarse hacia la punta del facoemulsificador por las corrientes generadas dentro del ojo y presenten tendencia a desplazarse hacia la incisión si por ella saliera un exceso de fluido119. Todos los autores están de acuerdo en que la incisión debe ser lo más ajustada posible pero no tan pequeña como para que no podamos introducir el instrumental con suficiente holgura como para no dañar el tejido corneal adyacente. El tamaño de la incision vendrá condicionado por el diámetro de la punta de faco desprovista de manguito; las puntas más pequeñas actualmente comercializadas son de 0,9 mm (20 G), luego las incisiones deberían ser algo mayores (11,2 mm). Además, al prescindir de manguito de irrigación a nivel de la incisión, digamos principal, es necesario que la incisión de servicio, digamos secundaria, sea mayor que una paracentesis de servicio habitual; en general, la incisión secundaria debe también permitir la entrada de irrigadores de calibres superiores a 0,9 mm (20 G) pues con calibres menores no se asegura el flujo de líquidos suficiente como para practicar un procedimiento quirúrgico seguro. Otro aspecto relevante de las incisiones de cirugía microincisional y derivado de su pequeño tamaño es la dificultad que puede presentar su localización para la introducción del instrumental. Recientemente, se ha descrito una técnica de tinción120 que pretende facilitar la localización de las incisiones en córnea clara y que pensamos puede tener especial utilidad en cirugía microincisional, donde la localización de las incisiones es especialmente crítica. Dicha técnica120 (Fig. 30.1.A y 30.1.B) contempla la práctica de las incisiones corneales con bisturís previamente teñidos con azul tripán 0,4%; para ello, se humedece el bisturí en azul tripán 0,4% (Vision Blue, D´Orc) y se deja secar durante 15 minutos, tiempo en el que tras el secado se observan partículas del colorante en la superficie del bisturí; a continuación se practica la incisión y dichas partículas quedan retenidas sobre el epitelio corneal y el trayecto intraestromal sin penetrar en cámara anterior; las incisiones serán fácilmente localizables a lo largo de la cirugía. Técnica quirúrgica Al igual que hemos descrito para los demás tipos de incisión, describiremos la técnica a considerar al practicar incisiones menores de 2 mm para facoemulsificación bimanual. 620 1. Localización Será necesario practicar una incisión principal y una incisión secundaria de características similares, localizada una a 90º de la otra. Localizadas ambas incisiones a 90º una de otra y siendo de tamaño similar, su efecto astigmatógeno, de presentarlo, se neutraliza; esto sería cierto si no fuera necesario ampliar una de ellas para implantar la lente intraocular. Por ello, en teoría cabe cualquier localización para ellas aunque sería deseable intentar ubicar la incisión a través de la cual implantaremos la lente intraocular en el eje más curvo. En general y para cirujanos diestros, en abordaje superior, las incisiones principales se localizarán a 135º (ambos ojos) y las secundarias a 45º (ambos ojos); en abordaje temporal, las principales a 45º (temporal inferior en ojo derecho, temporal superior en ojo izquierdo) y las secundarias a 135º (temporal superior en ojo derecho, temporal inferior en ojo izquierdo). También es práctica habitual, cuando se practica abordaje temporal, que la incisión principal se localice a 180º (ojo derecho) ó 0º (ojo izquierdo), siendo entonces el meridiano vertical la localización habitual de la incisión secundaria (superior en ojo derecho e inferior en ojo izquierdo). Sin embargo, las posibilidades son, evidentemente, múltiples. Tsuneoka118,121, uno de los propulsores de la técnica microincisional bimanual, prefiere practicar la incisión principal en córnea temporal en ambos ojos utilizando una lanceta de vitrectomía de 19 G (1-1,1 mm) para un tip de 0,9 mm o una de 20 G (0,9 mm) para un microtip de 0,8 mm y, con el cirujano sentado a la cabecera del paciente, practicar la incisión Fig. 30. Incisiones para cirugía microincisional. De forma preferente, presentan configuración trapezoidal con la incisión externa mayor que la interna. 30.1. Técnica de tinción (30.1.A. Tras dejar secar el colorante sobre el bisturí, se practica la incisión de la forma habitual; 30.1.B. A mayor detalle, el colorante queda retenido a nivel de incisión externa y trayecto intraestromal y permitirá siempre su localización). 30.2. Arquitecturas aceptadas para cirugía microincisional (30.2.A. Diseño cuadrado; 30.2.B. Diseño trapezoidal con incisión interna menor que la externa). 50. INCISIONES EN FACOEMULSIFICACIÓN secundaria a 120º de la incisión principal: a las 1,00 h en ojo derecho y a las 11,00 en ojo izquierdo (trabaja con facoemulsificador en mano derecha en ojo derecho y en mano izquierda en ojo izquierdo; con el manipulador, al contrario). mental deterioraban la morfología de la incisión externa117. Las formas trapezoidales con incisión interna menor que la externa son, actualmente, las más recomendables pues facilitan la entrada del instrumental117 y permiten una mejor manipulación de los instrumentos122, disminuyendo por otro lado los riesgos de distorsión corneal durante dicha manipulación. 2. Tamaño Su tamaño deberá ser 0,1-0,2 ó 0,2-0,3 mm mayor que el calibre externo del instrumental que pretendemos introducir por ellas, la punta del facoemulsificador a través de la incisión principal y el irrigador a través de la incisión secundaria. La incisión principal debe ser algo más holgada que la secundaria, dado que en la principal se genera fricción por el tip del facoemulsificador, no cubierto por manguito de irrigación en cirugía microincisional, por lo que es necesario asegurar refrigeración con la circulación de fluidos tanto intraluminal como extraluminalmente a través de las pérdidas incisionales105,118,121, siendo esta última la única forma de refrigeración en modo «oclusión» salvo que utilicemos un tip con sistema ABS®. La incisión secundaria no requiere refrigeración extraluminal pues no se produce fricción de alta frecuencia a su nivel; por ello, puede ser más ajustada y su tamaño suficiente como para permitir la introducción del instrumental. Conocidos tales principios, las incisiones deberían ser del suficiente tamaño como para permitir la introducción del instrumental sin generar tal tensión en sus bordes como para alterar su estructura; es decir, 1,1-1,2 mm para la introducción de un tip de 0,9 mm de diámetro externo (MicroTip® ABS® de Alcon®, por ejemplo) o 1,4-1,5 mm para un tip estándar de 1,3 mm de diámetro externo, cuando nos referimos a la incisión principal; 1,2-1,3 mm (18 G) para las incisiones secundarias si pretendemos introducir un sistema de irrigación (mayor de 1,1 mm o 19 G) que proporcione suficiente flujo. 3. Arquitectura Los diseños incisionales para microincisión han sido diversos; las formas cuadradas y trapezoidales las más extendidas. Las rectangulares, profusamente utilizadas en facoemulsificación convencional, no se utilizan en microincisional debido a que hacer un trayecto intraestromal menor de 1-1,2 mm (anchura habitual de las microincisiones) llevaría implicito un mínimo trayecto intraestromal y un elevado riesgo de filtraciones a través de esa herida. Las formas cuadradas comprometen la movilidad del instrumental dentro de la incisión y los movimientos laterales generan pliegues que pueden distorsionar la visualización endoocular durante la cirugía. Las formas trapezoidales, derivadas de los diseños originales de Williamson56, han resultado ser especialmente útiles en cirugía microincisional. Inicialmente, se abogó por las formas trapezoidales con incisión externa menor que la interna; se defendía que con tal diseño las pérdidas incisionales eran menores y la manipulación instrumental más sencilla: no obstante, se observó que los movimientos del instru- CIERRE DE INCISIONES En las técnicas de facoemulsificación actuales, una incisión perfectamente practicada no precisa de maniobras especiales para su cierre. Que las arquitecturas de las incisiones utilizadas para facoemulsificación, en el momento actual, son autosellables está fuera de toda duda. Tal vez el debate se haya desplazado a la discusión de: 1) Si una incisión puede evitar el reflujo de fluidos de la superficie ocular a cámara anterior, aumentando el riesgo de enfotalmitis, después de la cirugía y en cualquier circunstancia; y 2) Qué medidas pueden ser útiles para evitar tal posibilidad. La necesidad de cierre de la incisión vendrá condicionada por una defectuosa ejecución de la misma, por una excesiva manipulación instrumental durante la cirugía o por una indecuada relación entre lente a implantar y dispositivo de implantación utilizado y tamaño de incisión. En cualquier caso, como hemos mencionado, excepcionalmente puede ser necesario recurrir a alguna forma de cierre de la incisión. De forma convencional, se reconocen cinco formas básicas de cierre de las incisiones (Tabla XII) de cirugía de cataratas: 1) Las suturas; 2) Los adhesivos tisulares; 3) Las basadas en la arquitectura o diseño de la propia incisión; 4) La hidratación estromal; y 5) El recubrimiento epitelial. El astigmatismo inducido será expresión de la arquitectura de la incisión, de su cierre y de los procesos de reparación en la herida. De la arquitectura de la incisión se ha escrito profusamente en este capítulo; de las técnicas de cierre se ha tratado en el capítulo referido a suturas y los procesos de reparación dependen de la localización de la incisión, de aspectos propios del paciente y de la modulación medicamentosa que se ejerza sobre dichos procesos. Suturas Sólo mencionaremos algunos puntos que consideramos de especial interés y relevancia. ¿Cuándo entendemos debe Tabla XII. Facoemulsificación: técnicas básicas de cierre de incisiones 1. 2. 3. 4. 5. Suturas Adhesivos tisulares Formas basadas en el diseño de la incisión Hidratación estromal Recubrimiento epitelial 621 IV. CIRUGÍA DE LA CATARATA: FACOEMULSIFICACIÓN ser suturada una incisión?: 1) Cuando la incisión sea mayor de 4 mm; 2) Cuando el trayecto intraestromal de la incisión sea menor de 1,75 mm, para incisiones menores de 3 mm; 3) Cuando observemos pérdida de fluido por la incisión a pesar de haber hidratado los bordes; 4) Incisiones de dudosa calidad (quemaduras, «boca de pez», bordes defectuosos, entre otras); y 5) Dudas sobre la colaboración del paciente. También recordaremos que las suturas tensas o ajustadas inducirán un encurvamiento corneal sobre su meridiano; por el contrario, las suturas flojas o la dehiscencia de la herida aplanarán la córnea sobre su eje123. Es necesario el equilibrio entre ambas posibilidades. Con la introducción de la facoemulsificación y el desarrollo de las incisiones esclerales tunelizadas primero y las corneales después, se modificaron primero las formas de suturas de las incisiones y la arquitectura de las mismas después para evitar la necesidad de las mismas. En 1989, Shepherd6 introdujo la sutura horizontal única para el cierre de incisiones esclerales tunelizadas de 4 mm; rápidamente le fue reconocida la neutralidad astigmática en base a que las fuerzas de tracción eran tangenciales al limbo, no ejerciendo, por ello, tracciones sobre la córnea y no modificando sus curvaturas. Para incisiones esclerales tunelizadas de 5 mm, la sutura horizontal demostró la menor inducción astigmática, cuando fue comparada con incisiones limbares y esclerales de 5, 6 y 9 mm124. Con el mismo principio, sutura tangencial al limbo, se desarrollaron y popularizaron, con diferente éxito, otras variantes que resultaron útiles incluso con incisiones de mayor tamaño: sutura sin fin de Fine125, suturas horizontales de Masket126 y Fishkind127. Con la facoemulsificación con abordaje corneal e incisiones menores de 3 mm la necesidad de suturar es excepcional; de precisarla, si la arquitectura de la incisión externa es aceptable, una sutura radial de suficiente longitud y aproximando los bordes tanto como para compensar la retracción espontánea, pero no más, es suficiente para asegurar su estanqueidad y cumplir la premisas exigidas por las reglas de la válvula y la bisagra26; por el contrario, si los bordes externos de la incisión se encuentran entreabiertos, será necesario recurrir a una sutura tangencial según técnica descrita por Osher128. Adhesivos titulares La utilización de adhesivos tisulares, como la fibrina, parecen disminuir la inducción astigmática frente a los casos en los que se utiliza sutura129 y parece proteger respecto al desarrollo postoperatorio de astigmatismo en contra de la regla cuando se utiliza una incisión escleral130. Con otros adhesivos, más que un efecto cierre que, en general, viene dado por la arquitectura de la incisión, lo que se busca es un efecto barrera; así el 2-octyl cianoacrilato ha demostrado, experimentalmente, asegurar la impermeabilización de las incisiones como para evitar la entrada de fluidos de la superficie ocular en cámara anterior, pudiendo comportarse como una sustancia de barrera131. La fibrina también ha sido propuesta con 622 tal fin tras diferentes experiencias a nivel experimental en ojos de banco: parece evitar la entrada de fluidos desde superficie ocular a cámara anterior a la compresión del borde posterior de la herida132. Sin embargo, existen aún ciertas reservas: 1) Necesidad de estudiar la posible toxicidad del adhesivo de fibrina sobre las estructuras de la cámara anterior; 2) Duración de la capacidad adhesiva de la fibrina (7 días) más allá de los procesos de curación que en córnea pueden ser especialmente lentos; y 3) Si realmente es necesario asegurar el cierre de la incisión más allá de las 24 horas, tiempo en el que el epitelio regenera sobre el borde externo de la herida y la puede permeabilizar. Incisiones sin sutura La arquitectura y el diseño de la incisión, así como su tamaño, condicionarán la posibilidad de no precisar suturas para asegurar el autosellado de la misma. Entendemos como incisiones autosellables aquéllas que de forma espontánea presentan tendencia al cierre o la autoobturación; en ellas, sin presiones externas, la presión intraocular no pueda entreabrirlas; es más, los aumentos de presión intraocular aumentan su hermeticidad debido a la presión ejercida sobre la llamada «válvula» o «labio» corneal. La estanqueidad de las incisiones corneales no es biológica ni histológica, que se alcanzarán en el tiempo, sino mecánica y reversible en el periodo postoperatorio inmediato2,133. En 1989, McFarland4 introdujo una incisión que permitía practicar facoemulsificación e implantación de lentes intraoculares sin necesidad de suturarla; dicha incisión, siendo escleral, presentaba una larga tunelización asegurando la entrada en cámara anterior a nivel corneal. Fue Ernest2 quien precisó que la incisión escleral tunelizada descrita por McFarland penetraba en córnea y que su borde posterior, el llamado «labio corneal», actuaba a modo de válvula unidireccional proporcionado a la incisión características de estanqueidad o autosellado. La presión que es necesaria ejercer para inducir la apertura de una incisión, en estudios en ojos de cadáver, es similar en incisiones autosellables de 4 mm sin sutura y limbares de 5,2 mm suturadas60. El suturar una incisión autosellable de 4 mm tampoco modifica su resistencia60. La arquitectura actual de las incisiones las hace estancas y autosellables si se practican adecuadamente; tal vez la única vulnerabilidad viene por la compresión directa de la esclera posterior a la incisión que puede entreabrirla en el postoperatorio inmediato; tal posibilidad es menor con los diseños tipo Langerman donde la preincisión actúa a modo de bisagra como se ha comentado (Fisg. 28.3.A y 28.3.B). Hidratación estromal La hidratación del estroma corneal perincisional contribuye a edematizar los bordes de la herida y puede contribuir a su sella- 50. INCISIONES EN FACOEMULSIFICACIÓN do. Tal vez su mayor función sea asegurar una estanqueidad inmediata de la incisión evitando el reflujo de secreciones conjuntivales a cámara anterior que pudieran ser fuente de problemas, generalmente infecciosos116; posteriormente, una vez recuperado el tono ocular, la arquitectura de la incisión y la válvula corneal asegurarán la hermeticidad de la herida. Dicha medida no es útil para cualquier tipo de incisión, ni para cualquier tamaño, y debe entenderse como una medida coadyuvante para el cierre de incisiones que, por su diseño, presentan cierta tendencia al autosellado. De practicarlas, es necesario hidratar tanto los bordes laterales de la incisión como la zona superficial de la tunelización corneal59. Para esta maniobra, en nuestra práctica preferimos utilizar cánulas de borde aplanado (tipo sección «pico de pato») que convencionales (tipo sección «circular»), pues entendemos que estas últimas presentan tendencia a entreabrir la herida. Es necesario ser conscientes de que el efecto de la hidratación estromal es muy limitado en el tiempo y que, si la herida no está correctamente construida, no estamos libres del riesgo de hipotensión en las primeras horas tras la cirugía, con su pernicioso efecto de permitir el flujo hacia cámara anterior. Hidratada la herida, y la paracentesis, existen tres formas de comprobar su estanqueidad una vez secados los restos de fluido de la superficie ocular y, especialmente, los presentes junto a la incisión; dichas formas son: 1) Introduciendo fluidos por la paracentesis y comprobando si existen pérdidas por la incisión principal; 2) Deprimiendo la esclera posteriormente al borde externo de la incisión en córnea clara; y 3) Comprimiendo la córnea en su centro y observando si se pierden fluidos por la incisión principal o por la paracentesis. La primera maniobra puede inducir una hiperpresión ocular si la herida es estanca; la segunda, sólo comprueba la estanqueidad ante una presión positiva en una localización concreta, poco probable en la práctica clínica; pensamos que la tercera comprueba estanqueidad de incisión y paracentesis y se puede aproximar más al efecto que pudiera suponer el frotarse el ojo por parte del paciente. Ninguna de las dos primeras maniobras demuestra la estanqueidad de la paracentesis. Todas ellas, además de comprobar si existen pérdidas incisionales deberían comprobar que la presión intraocular no es tan alta como para comprometer el flujo sanguíneo a nivel de la cabeza del nervio óptico. Tratamos la paracentesis o la incisión secundaria en cirugía bimanual con las mismas pautas de manejo que la incisión principal. En todos los casos bajo anestesia tópica nos gusta comprobar la presión intraocular final por compresión ocular, alejados de cualquiera de las incisiones y preguntando al paciente si presenta una buena percepción de la luz del microscopio; en este último caso, si la respuesta fuera negativa, drenamos cámara anterior a través de la paracentesis. Recubrimiento epitelial Los procesos de curación se inician precozmente a nivel epitelial. Así, tras una incisión de catarata debe esperarse que la epitelización se produzca en las primeras 24 horas, contribuyendo a su cierre. Debe entenderse que el recubrimiento epitelial por sí mismo no es suficiente para asegurar el cierre de la incisión y que pudiera relevar a la hidratación del estroma corneal asegurando el sellado externo de la incisión pasadas las primeras horas tras la cirugía. Al igual que la hidratación estromal, la reepitelización de la herida debe entenderse como un factor más que contribuye al cierre de la incisión; especialmente importante en cuanto que pequeños defectos epiteliales pudieran favorecer la adhesividad bacteriana en esas primeras horas. CONCLUSIONES Hemos revisado los conceptos que consideramos fundamentales para practicar incisiones para facoemulsificación, atendiendo a la evolución de la cirugía de la catarata en los últimos 20 años. También hemos descrito los diferentes tipos de incisión con especial énfasis en las incisiones corneales, estilo de práctica que consideramos más extendido. Sin embargo, es oportuno recordar la necesidad de conocer diferentes tipos de incisión, tanto su diseño y ejecución como las ventajas e inconvenientes de cada una de ellas; pero todo quedaría en nada si no insistiéramos en la siguiente reflexión: cuando uno se inicia en facoemulsificación, la incisión a practicar no debe ser diferente a la que venía practicando (debe facilitarse la reconversión, de ser necesaria); cuando uno avanza en su práctica, debería aprovechar las posibilidades que la técnica le ofrece (incisiones sin sutura y anestesia tópica, por ejemplo) que le llevarán a incisiones menores de 3 mm y a córnea temporal para, posteriormente, pasar a incisiones menores de 2,2 mm bajo cirugía microcoaxial e incisiones menores de 1,5 mm y cirugía bimanual, aunque hoy siga siendo necesario ampliar la incisión para implantar una lente intraocular adecuada. Así, estará donde se encuentra la cirugía de la catarata hoy y en las puertas de la cirugía de la catarata de mañana. BIBLIOGRAFIA 1. Kelman CD. Phacoemulsification and aspiration: A new technique of cataract removal: a preliminary report. Am J Ophthalmol 1967; 64: 23-35. 2. Fine IH, Hoffman RS, Packer M. In: Steinert RF, ed. Cataract surgery: technique, complications and management. Philadelphia: Saunders; 2004; 121-135. 3. Masket S. Origin of scleral tunnel methods (letter). J Cataract Refract Surg 1993; 19: 812-813. 4. McFarland MS. Surgeon undertakes phaco, foldable IOL series sans sutures. Ocular Surgery News 1990; 8; 1-15. 5. Girard LJ, Hoffman RF. Scleral tunnel to prevent induced astigmatism. Am J Ophthalmol 1984; 97: 450-456. 6. Shepherd JR. Induced astigmatism in small incision cataract surgery. J Cataract Refract Surg 1989; 15: 85-88. 7. Harms H, Mackensen G. Intracapsular extraction with a corneal incision using the Graefe knife. In: Harms H, Mackensen G, eds. Ocular surgery ünder the microscope. Stuttgart: Thieme Verlag; 1967; 144-153. 623 IV. CIRUGÍA DE LA CATARATA: FACOEMULSIFICACIÓN 8. Galand A. La technique de l´enveloppe. Liege: Pierre Mardaga publisher; 1988. 9. Arnott EJ. Intraocular implants. Trans Ophthalmol Soc U K 1981; 101: 58-60. 10. Brown DC, Fine IH, Gills JP. The future of foldables. Panel discussion. American Society of Cataract and Refractive Surgery, 1992. 11. Shimizu K. Pure corneal incision. Phaco & Foldables 1992; 5: 5-8. 12. Fine IH. Corneal tunnel incision with a temporal approach. In: Fine IH, Fichman RA, Grabow HB, eds. Clear-corneal cataract surgery & topical anestesia. Thorofare: Slack; 1993; 5-26. 13. Kohnen T, Koch DD. Methods to control astigmatism in cataract surgery. Curr Opin Ophthalmol 1996; 7: 75-80. 14. Budak K, Friedman NJ, Koch DD. Limbal relaxing incisions with cataract surgery. J Cataract Refract Surg 1998; 24: 503-508. 15. Troutman RC, Buzard KA. Surgical management of congenital and postcataract astigmatism. In: Troutman RC, Buzard KA, eds. Corneal astigmatism: etiology, prevention and management. St. Louis: Mosby; 1992; 317-348. 16. Casebeer JC. Incisional keratotomy. Thorofare: Slack; 1995; 173-180. 17. Inoue T, Maeda N, Sasaki K, Watanabe H, Inoue Y, Nishida K, Inoue Y, Yamamoto S, Shimomura Y, Tano Y. Factors that influence the surgical effects of astigmatic keratotomy after cataract surgery. Ophthalmology 2001; 108: 1269-1274. 18. Sun XY, Vicia D, Montgomery P, Griffiths M. Toric intraocular lenses for correcting astigmatism in 130 eyes. Ophthalmology 2000; 107: 1776-1781. 19. Mendicute J. Incisiones en facoemulsificación. In: Mendicute J, Cadarso L, Lorente R, Orbegozo J, Soler JR, eds. Facoemulsificación. Madrid: CF Comunicación; 2000; 113-137. 20. Grayson M. Anatomía. In: Grayson M, ed. Enfermedades de la córnea. Buenos Aires: Editorial Panamericana; 1985; 9-23. 21. Van Buskirk EM. The anatomy of the limbus. Eye 1989; 3: 101-108. 22. Friend J, Kenyon KR. Physiology of the conjuctiva: metabolism and biochemistry. In: Smolin G, Thoft RA, eds. The Corneal. Scientific Foundations and Clinical Practice. Boston/Toronto: Little, Brown & Co; 1987: 52-62. 23. Grabow HB. Early results of 500 cases of no-stitch cataract surgery. J Cataract Refract Surg 1991:17: 726-730. 24. Minckler D. Anatomy in glaucoma-related surgery. In: Waltman SR, Keates RH, Hoyt CS, Frueh BR, Herschler J, Carroll DN, eds. Surgery of the eye. New York: Churchill Livingstone Inc; 1987: 311-322. 25. Troutman RC, Buzard KA. The cornea: optical considerations. In: Troutman RC, Buzard KA, eds. Corneal astigmatism: etiology, prevention and management. St Louis: Mosby Year Book Inc; 1992: 36-63. 26. Eisner G. Planeamiento del abordaje hacia el interior del ojo. In: Eisner G, ed. Cirugía del Ojo. Introducción a la técnica operatoria. Madrid: Ed. Médica Panamericana; 1985: 126-139. 27. Koch PS. Structural analysis of cataract incision construction. J Cataract Refract Surg 1991; 17(Suppl): 661-667. 28. Grene RB, Lindstrom RL. Reduction of preoperative and postoperative astigmatism for cataract surgeons. In Kershner RM, ed. Refractive keratotomy for cataract surgery and the correction of astigmatism. Thorofare: Slack; 1994: 51-61. 29. Nordan LT, Grene RB. The importance of corneal asphericity and irregular astigmatism in refractive surgery. Refract Corneal Surg 1990; 6: 200-204. 30. Neumann AC, McCarty GR, Sanders DR, Raanan MG. Small incisions to control astigmatism during cataract surgery. J Cataract Refract Surg 1989; 15: 78-84. 31. Samuelson SW, Koch DD, Kuglen CC. Determination of maximal incision length for true small-incision surgery. Ophthalmic Surg 1991; 22: 204-207. 32. Pfleger T, Skorpik C, Menapace R, Scholz U, Weghaupt H, Zehetmayer M. Long-term course of induced astigmatism after clear corneal incision cataract surgery. J Cataract Refract Surg 1996; 22: 72-77. 33. Nielsen PJ. Prospective evaluation of surgically induced astigmatism and astigmatic keratotomy effects of various self-sealing small incisions. J Cataract Refract Surg 1995; 21: 43-48. 34. Joo CK, Han HK, Kim JH. Computer-assisted video-keratography to measure changes in astigmatism induced by sutureless cataract surgery. J Cataract Refract Surg 1997; 23: 555-561. 624 35. Rainer G, Menapace R, Vass C, Annen D, Findl O, Schmetterer K. Corneal shape change after temporal and superolateral 3.0 mm clear corneal incisions. J Cataract Refract Surg 1999; 25: 1121-1126. 36. Axt JC, McCaffery JM. Reduction of postoperative against-the-rule astigmatism by lateral incision technique. J Cataract Refract Surg 1993; 19: 380-386. 37. Cravy TV. Routine use of the lateral approach to cataract extraction to achieve rapid and sustained stabilization of postoperative astigmatism. J Cataract Refract Surg 1991; 17: 4: 415-423. 38. Simsek S, Yasar T, Demirok A, Cinal A, Yilmaz OF. Effect of superior and temporal clear corneal incisions on astigmatism after sutureless phacoemulsification. J Cataract Refract Surg 1998; 24: 515-518. 39. Grabow HB. The clear-corneal incision. In: Fine IH, Fichman RA, Grabow HB, eds. Clear-corneal cataract surgery & topical anestesia. Thorofare: Slack; 1993; 29-62. 40. Cristóbal JA, Faus F, Mateo A. Incisiones y efecto astigmático en la cirugía del cristalino. In: Cristóbal JA. Corrección del astigmatismo. Madrid; Mac Line; 2006; 129-139. 41. Alfonso J, Fernández-Vega L, Señaris A. Corrección intraoperatoria del astigmatismo durante la facoemulsificación: incisión única e incisiones opuestas perforantes en el meridiano más curvo. In: Cristóbal JA. Corrección del astigmatismo. Madrid; Mac Line; 2006; 159-169. 42. Woo SJ, Lee JH. Effect of central corneal thickness on surgically induced astigmatism in cataract surgery. J Cataract Refract Surg 2003; 29: 2401-2406. 43. Barequet IS, Yu EY, Vitale S, Cassard S, Azar DT, Stara WJ. Astigmatsim outcomes of horizonal temporal versus nasal clear corneal incision cataract surgery. J Cataract Refract Surg 2004; 30: 418-423. 44. Jacobs BJ, Gaynes BI, Deutsch TA. Refractive astigmatism after oblique clear corneal phacoemulsification cataract incision. J Cataract Refract Surg 1999; 25: 949-952. 45. Ermis SS, Inan ÜÜ, Öztüurk F. Surgically induced astigmatism after superotemporal and superonasal clear corneal incisions in phacoemulsification. J Cataract Refract Surg 2004; 30: 1316-1319. 46. Wirbelauer C, Anders C, Pham DT, Wollensak J. Effect of incision location on preoperative oblique astigmatism after scleral tunnel incision. J Cataract Refract Surg 1997; 23: 365-371. 47. Kohnen T, Mann PM, Husain SE, Abarca A, Koch DD. Corneal topographic changes and induced astigmatism resulting from superior and temporal scleral pocket incisions. Ophthalmic Surg Lasers 1996; 27: 263-269. 48. Koch D, Del Pero R, Wong TC, McCulloch M, Weaver T. Scleral flap surgery for modification of corneal astigmatism. Am J Ophthalmol 1987; 104: 259-264. 49. Oshika T, Sugita G, Tanabe T, Tomidokoro A, Amano S. Regular and irregular astigmatism after superior versus temporal scleral incision cataract surgery. Ophthalmology 2000; 107: 2049-2053. 50. Eisner G. Los instrumentos y su uso. In: Eisner G, ed. Cirugía del Ojo. Introducción a la técnica operatoria. Madrid: Ed. Médica Panamericana; 1985: 15-62. 51. Jacobi FK, Dick B, Bohle R. Histological and ultrastructural study of corneal tunnel incisions using diamond and steel keratomes. J Cataract Refract Surg 1998; 24: 498-502. 52. Radner W, Menapace R, Zehetmayer M, Mallinger R. Ultrastructure of clear corneal tunnel incisions. Part I: Effect of keratomes and incision width on corneal trauma after lens implantation. J Cataract Refract Surg 1998; 24: 487-492. 53. Pacifico RL, Morrison C. Astigmatically neutral sutured small incision. J Cataract Refract Surg 1991; 17: 710-712. 54. Ernest PH, Kiessling LA, Lavery KT. Relative strength of cataract incisions in cadaver eyes. J Cataract Refract Surg 1991; 17(Suppl): 668-671. 55. Langerman DW. Architectural design of a self-sealing corneal tunnel, single-hinge incision. J Cataract Refract Surg 1994; 20: 84-88. 56. Williamson CH. Cataract keratotomy surgery. In: Fine IH, Fichman RA, Grabow HB, eds. Clear-corneal cataract surgery & topical anestesia. Thorofare: Slack; 1993; 87-93. 57. Koch PS. Techniques and instruments for cataract surgery. Curr Opin Ophthalmol 1994; 5: 33-39. 58. Kojima T, Kaga T, Watanabe M, Uda K, Naito N, Saito Y, Ichikawa K. Clinical evaluation of the arched blade for cataract surgery. Acta Ophthalmol Scand 2005; 83: 306-311. 50. INCISIONES EN FACOEMULSIFICACIÓN 59. Masket S, Belani S. Proper wound construction to prevent shortterm ocular hipotony after clear corneal incision cataract surgery. J Cataract Refract Surg 2007; 33: 383-386. 60. Kondrot EC. Rupturing pressure in cadaver eyes with three types of cataract incisions. J Cataract Refract Surg 1991; 17(Suppl): 745748. 61. Gills JP, Sanders DR. Use of small incisions to control induced astigmatism and inflammation following cataract surgery. J Cataract Refract Surg 1991; 17(Suppl): 740-744. 62. Cristóbal JA, Minguez E, Ascaso J, Vicente E, Huerva V, Castillo J, Palomar A. Taille de l´incision et astigmatism induit dans la chirurgie de la cataracte. J Fr Ophthalmol 1993; 16: 311-314. 63. Giansanti F, Rapizzi E, Virgili G, Mencucci R, Bini A, Vannozzi L, Menchini U. Clear corneal incision of 2,75 mm for cataract surgery induces little change of astigmatism in eyes with low preoperative corneal cylinder. Eur J Ophthalmol 2006; 16: 385-393. 64. el-Maghraby A, Anwar M, el-Sayyad F, Matheen M, Marzouky A, Gazayerli E, Salah T, Ballew C. Effect of incision size on early postoperative visual rehabilitation after cataract surgery and intraocular lens implantation. J Cataract Refract Surg 1993; 19: 494-498. 65. Uusitalo RJ, Ruusuvaara P, Jarvinen E, Raivio I, Krootila K. Early rehabilitation after small incision cataract surgery. Refract Corneal Surg 1993; 9: 67-70. 66. Leen MM, Ho CC, Yanoff M. Association between surgically-induced astigmatism and cataract incision size in the early postoperative period. Ophthalmic Surg 1993; 24: 586-592. 67. Merriam JC, Zheng L, Merriam JE, Zaider M, Lindström B. The effect of incisions for cataract on corneal curvature. Ophthalmology 2003; 110: 1807-1813. 68. Shimizu k, Misawa A, Suzuki Y. Toric intraocular lenses: correcting astigmatism while controlling axis shift. J Cataract Refract Surg 1994; 20: 523-526. 69. Duke-Elder S, Wybar KC. The ocular tissues. In: Duke-Elder S, ed. System of Ophthalmology. The Anatomy of the Visual System. St Louis: Mosby; 1961; 2: 92. 70. Oshika T, Sugita G, Tanabe T, Tomidokoro A, Amano S. Regular and irregular astigmatism after superior versus temporal scleral incision cataract surgery. Ophthalmology 2000; 107: 2049-2053. 71. Guirao A, Tejedor J, Artal P. Corneal aberrations before and after small-incision cataract surgery. Invest Ophthalmol Vis Sci 2004; 45: 4312-4319. 72. Mendicute J, Ubeda M, Gutiérrez E. Incisiones corneales enfrentadas y aberraciones corneales. In: Cristóbal JA, ed. Corrección del astigmatismo. Madrid: Mac Line S.L.; 2006: 179-190. 73. Jakus MA. The fine structure of the human cornea. In: Smelser GK, ed. The structure of the eye. New York: Academic Press; 1961: 343-380. 74. Osher RH. Microcoaxial phacoemulsification. Part 2: clinical study. J Cataract Refract Surg 2007; 33: 408-412. 75. Suzuki R, Kurimoto S. Astigmatism after phacoemulsification and aspiration procedures: BENT versus standard incisions. Ophthalmologica 1992; 205: 131-137. 76. Kawano K. Modified corneoscleral incision to reduce postoperative astigmatism after 6 mm diameter intraocular lens implantation. J Cataract Refract Surg 1993; 19: 387-392. 77. Hayashi K, Nakao F, Hayashi F. Corneal topographic analysis of superolateral incision cataract surgery. J Cataract Refract Surg 1994; 20: 392-399. 78. Nagaki Y, Hayasaka S, Kadoi C, Matsumoto M, Yanagisawa S, Watanabe K, Watanabe K, Hayasaka Y, Ikeda N, Sato S, Kataoka Y, Togashi M, Abe T. Bacterial endophthalmitis after small-incision cataract surgery: effect of incision placement and intraocular lens type. J Cataract Refract Surg 2003; 29: 20-26. 79. Lundström M, Wejde G, Stenevi U, Thorburn W, Montan P. Endophtalmitis after cataract surgery: a nationwide prospective study evaluating incidence in relation to incision type and location. Ophthalmology 2007; 114: 866-870. 80. Schmitz S, Dick HB, Krummenauer F, Pfeiffer N. Endophthalmitis in cataract surgery: results of a German survey. Ophthalmology 1999; 106: 1869-1877. 81. Miller JJ, Scott IU, Flynn HW Jr, Smiddy WE, Newton J, Miller D. Acute-onset endophthalmitis after cataract surgery (2000-2004): inci- 82. 83. 84. 85. 86. 87. 88. 89. 90. 91. 92. 93. 94. 95. 96. 97. 98. 99. 100. 101. 102. 103. 104. 105. 106. 107. 108. dence, clinical settings and visual acuity outcomes after treatment. Am J Ophthalmol 2005; 139: 983-987. Van Oye R. Postoperative astigmatism in cataract surgery. Bull Soc Belge Ophthalmol 1991; 242: 55-59. Andenmatten R, Balmer A, Hiroz CA. Astigmatism in cataract surgery. Retrospective study of 1304 cases. Klin Monatsbl Augenheilkd 1991; 198: 347-350. Sarayba MA, Taban M, Ignacio TS, Behrens A, McDonnell PJ. Inflow of ocular surface fluid through clear corneal cataract incisions: a laboratory model. Am J Ophthalmology 2004; 138: 206-210. Hirasaka T. Corneoscleral wound healing after self-sealing cataract surgery: scleral incision vs corneal incision. Nippon Ganka Gakkai Zasshi 1995; 99: 770-777. Koch DD, Lindstrom RL. Controlling astigmatism in cataract surgery. Seminars in Ophthalmology 1992; 7: 224-233. Lavery KT. Animal study examines healing, leakage of corneal vs limbal incisions. Ocular Surgery News 1997; 9: 6. Ernest P, Tipperman R, Eagle R et al. Is there a difference in incision healing based on location? J Cataract Refract Surg 1998; 24:482-486. Colvard DM, Kratz RP, Mazzoco TR et al. Clinical evaluation of the Terry surgical keratometer. J Am Implant Soc 1980; 6:249-251. Girard LJ, Hoffman RF. Scleral tunnel to prevent induced astigmatism. Am J Ophthalmol 1984; 97: 450-456. Javitt JC, Vitale S, Canner JK et al. National outcomes of cataract extraction; endophthalmitis following inpatient surgery. Arch Ophthalmol 1991; 109: 1085-1089. Montan PG, Koranyi G, Setterquist HE. Endophthalmitis after cataract surgery: risk factors relating to technique and events of the operation and patients history; a retrospective case-control study. Ophthalmology 1998; 105: 2171-2177. Alava I, Garagorri N, Briz N, Mendicute J. Effects of bacterial adhesion with respect to the type of material, structure and design of intraocular lenses. J Mater Sci Mater Med 2005; 16: 313-317. Bryant WR. The scleral pocket incision. In: Rozakis GW, ed. Cataract surgery: alternative small-incision techniques. Thorofare; Slack; 1990; 1-44. John ME, Noblitt RL, Boleyn KL, Raanan MG, DeLuca M. Effect of a superficial and a deep scleral pocket incision on the incidence of hyphema. J Cataract Refract Surg 1992; 18: 495-499. Singer JA. Frown incision for minimizing induced astigmatism after small incision cataract surgery with rigid optic intraocular lens implantation. J Cataract Refract Surg 1991; 17(Suppl): 677-688. Pallin SL. Chevron sutureless closure: a preliminary report. J Cataract Refract Surg 1991; 17(Suppl): 706-709. Maloney WF, Shapiro DR. Universal small incision for cataract surgery. J Cataract Refract Surg 1991; 17(Suppl): 702-705. Pham DT, Wollensak J. «No-stitch»-Kataraktchirurgie als routineverfahren: technik und erfahrung. Klin Monstsbl Augenheilkd 1992; 200: 639-643. Hennekes R. A high-stability, one-stitch W incision for cataract surgery. J Cataract Refract Surg 1996; 26: 407-410. Siepser SB. Sutureless cataract surgery with radial transverse incision. J Cataract Refract Surg 1991; 17(Suppl): 716-718. Ans JB. The J-incision for phacoemulsification. J Cataract Refract Surg 1996; 22: 1401-1405. Fine IH. Self-sealing corneal tunnel incision for small-incision cataract surgery. Ocular Surgery News, 1992; May 1. Tennen DG, Masket S. Short- and long-term effect of clear corneal incisions on intraocular pressure. J Cataract Refract Surg 1996; 22: 568-570. Mendicute J, Gallego Y. Etiopatogenia de la quemadura corneal. In: Soler F, Lorente R, Asís O, eds. Cirugía microincisional de la catarata. Mac Line; 2004: 49-57. Shingleton BJ, Wadhwani RA, O´Donoghue MV. Evaluation of intraocular pressure in the immediate period after phacoemulsification. J Cataract Refract Surg 2001; 27: 524-527. Masket S. Is there a relationship between clear corneal cataract incisions and endophthalmitis? [editorial]. J Cataract Refract Surg 2006; 32: 1556-1559. Ernest PH, Lavery KT, Kiessling LA. Relative strength of scleral tunnel incisions with internal corneal lips constructed in cadaver eyes. J Cataract Refract Surg 1993; 19: 457-461. 625 IV. CIRUGÍA DE LA CATARATA: FACOEMULSIFICACIÓN 109. Ernest PH, Lavery KT, Kiessling LA. Relative strength of scleral corneal and clear corneal incisions constructed in cadaver eyes. J Cataract Refract Surg 1994; 20: 626-629. 110. Ernest PH, Fenzl R, Lavery KT. Relative stability of clear corneal incisions in a cadaver eye model. J Cataract Refract Surg 1995; 21: 39-42. 111. Mackool RJ, Russell RS. Strength of clear corneal incisions in cadaver eyes. J Cataract Refract Surg 1996; 22: 721-725. 112. Ernest PH, Neuhann T. Posterior limbal incision. J Cataract Refract Surg 1996; 22: 78-84. 113. Fine IH. Incision construction. In : Steinert RF, ed. Cataract surgery: technique, complications and management. Philadelphia: Saunders; 1995: 125-133. 114. Williamson CH. Diamond knives. Cataract & Refractive Surgery Today 2007; June: 82-84. 115. Vass C, Menapace R, Rainer G et al. Comparative study of corneal topographic changes after 3.0 mm beveled and hinged clear corneal incisiones. J Cataract Refract Surg 1998; 24: 1498-1504. 116. Taban M, Sarayba MA, Ignacio TS. Ingress of India ink into the anterior chamber through sutureless clear corneal cataract wounds. Arch Ophthalmol 2005; 123: 643-648. 117. Soler F, Lorente R, Asís O. Los pasos quirúrgicos. Cirugía microincisional de la catarata, Madrid: MacLine; 2003: pág. 95. 118. Tsuneoka H, Shiba T, Takahashi Y. Feasibility of ultrasound cataract surgery with a 1.4 mm incision. J Cataract Refract Surg 2001; 27: 934-940. 119. Olson RJ. Microphaco: concerns and opportunities. In: Agarwal A, ed. New Delhi: Jaypée; 1988. 120. Kayikçioglu Ö. Clear corneal incision with trypan-blue-coated blades. J Cataract Refract Surg 2007; 33: 351-352. 121. Tsuneoka H. Ultrasmall incision bimanual phaco surgery and foldable IOL. In: Agarwal A, ed. Phacoemulsification, lasers, cataract surgery & foldable IOLs. New Delhi; Jaypée: 1988. 122. Alió J, Rodríguez Prats JL. La excedencia en la cirugía de catarata. 626 Barcelona: Expas; 2006. 123. Gelender H. Management of corneal astigmatism after cataract surgery. Refract Corneal Surg 1991; 7: 99-102. 124. Vazquez LA, Panesso JL. Surgically induced astigmatism: a comparison of different cataract incisions and closures. P R Health Sci J 1993; 12: 99-103. 125. Fine IH. Infinity suture: modified horizontal suture for 6,5 mm incisions. In: Gills JP, Sanders DR, eds. Small-Incision Cataract Surgery: Foldable Lenses, One-Stitch surgery, Sutureless Surgery, Astigmatic Keratotomy. Thorofare: Slack; 1990; 191-196. 126. Masket S. Horizontal anchor suture closure method for small incision cataract surgery. J Cataract Refract Surg 1991; 17 (Suppl): 689-695. 127. Fishkind WJ. Horizontal overlap suture: a new astigmatism-free closure, focus on phaco. Ocular Surg News 1990; 8. 128. Osher RH. Shark fin: a new sign of thermal injury. J Cataract Refract Surg 2005; 31: 640-642. 129. Mulet ME, Alió J, Gobby F. Eficacia de la fibrina como bioadhesivo en la cirugía de la catarata realizada por túnel escleral. Arch Soc Esp Oftalmol 1997; 72: 427-430. 130. Mester U, Zuche M, Rauber M. Astigmatism after phacoemulsification with posterior chamber lens implantation: small incision technique with fibrin adhesive for wound closure. J Cataract Refract Surg 1993; 19: 616-619. 131. Ritterband DC, Meskin SW, Shapiro DE, Kusmierczyk J, Seedor JA, Koplin RS. Laboratory modelo f tissue adhesive (2-octyl cyanoacrylate) in sealing clear corneal cataract wounds. Am J Ophthalmol 2005; 140: 1039-1043. 132. Hovanesian JA, Karageozian VH. Watertight cataract incision closure using fibrin tissue adhesive. J Cataract Refract Surg 2007; 33: 1461-1463. 133. Lebuisson DA, Laroche L. Incisiones cortas. In: Laroche L, Lebuisson DA, Montard M, ed. Cirugía de la catarata. Barcelona: Masson; 1998: 153-171.