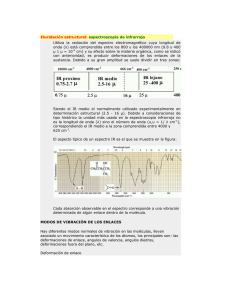
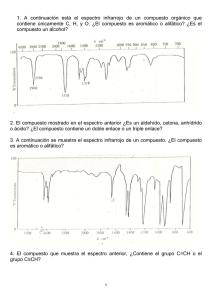
Interacción materia-radiación Espectros de rotación de
Anuncio

Interacción materia-radiación 1. Indicar en qué zona del espectro electromagnético aparece cada uno de los tránsitos siguientes: a) 3000 cm-1; b) 100 Kcal/mol; c) 3.3 10-12 ergios y d) 6 109 sg1. 2. Cierto sistema posee cuatro niveles de energía definidos por el número cuántico n -16 -16 con las siguientes energías: Eo=0.0, E1=8.28 10 , E2=24.84 10 -16 y E3 = 49.68 10 ergios. A cada uno de los niveles corresponden n+1 estados degenerados y la regla de selección para las transiciones es ∆n = ±1, ±3. Suponiendo que las intensidades de las líneas espectrales dependen únicamente de la fracción de moléculas en el nivel de partida, dibujar un diagrama de niveles de energía con las transiciones permitidas entre ellos (sólo en absorción) y el espectro correspondiente. Tabular las frecuencias de las líneas en cm-1 y sus intensidades relativas. (T=27oC). 3. A 330 nm los coeficientes de extinción molar de los iones ferricianuro Fe(CN)6-3 y ferrocianuro Fe(CN)6-4 son 800 y 320 l.mol-1.cm-1, respectivamente. La reducción de ferria ferrocianuro es seguida espectrofotométricamente en una celda de 1cm de longitud. La disolución tiene una concentración inicial de ferricianuro de 10-3 mol.l-1 y no contiene ferrocianuro. Después de 340 s la absorbancia de la disolución es 0.701. Calcular el porcentaje de ferricianuro que ha reaccionado. 4. Una mezcla de 2, 3 y 4–metil heptano (C8H18) en una célula de 0.013 cm de espesor tiene una densidad óptica de 0,45 a 1170 cm-1, 0.18 a 770 cm-1 y 0.97 a 748 cm-1. Los coeficientes de extinción molar (l.mol-1.cm-1) son: Frecuencia Isómero 2 Isómero 3 Isómero 4 1170 11.8 2.1 3.8 770 2.1 5.2 0.9 748 3.2 3.6 14.4 ¿Cuáles son las proporciones de cada isómero? La densidad de cada compuesto y de la mezcla puede tomarse como 0.82. Espectros de rotación de moléculas diatómicas. 5. Si la distancia internuclear para la molécula de ClH es 1.29 Å: a) Calcular sus niveles de energía desde J=0 a J=6, expresándola en ergios, eV y cm-1; b) Calcular las frecuencias para las transiciones entre los niveles anteriores en cm-1 y representar el espectro resultante. 6. El bromuro de hidrógeno presenta una serie de líneas en el infrarrojo lejano con -1 una separación de 16.94 cm . Calcular el momento de inercia de la molécula y su distancia internuclear. 7. En el espectro de microondas del monóxido de carbono aparecen las siguientes líneas: 115271.20, 230537.97, 345795.90, 461040.70 y 576267.80 MHz. Determinar el error cometido en la determinación de la distancia internuclear del CO usando el modelo del rotor rígido en comparación con el modelo no rígido. Espectros de rotación de moléculas poliatómicas. 8. Una molécula triatómica tiene la formula A2B. Su espectro de microondas muestra líneas intensas a 15, 30 y 45 GHz y no otras líneas. Cuales de las siguientes estructuras son compatibles con el espectro: a) Lineal AAB, b) Lineal ABA, c) Angular AAB, d) Angular ABA. 9. Un espectrómetro de microondas resuelve líneas separadas al menos en 0.3 MHz. Para el CF3C≡CH se han obtenido B=2877.95 MHz DJ=0.0002 MHz DJK=0.0063 MHz ¿A partir de qué‚ valor de J empezará a notarse el desdoblamiento debido a la no rigidez de la molécula?. Dibujar el espectro hasta ese punto. 10. Para determinar la geometría del SCO se realizan un conjunto de espectros en la región de microondas, correspondientes a una serie de sustituciones isotópicas de dicha molécula. El espaciado entre líneas correspondiente a cada espectro es: Molécula 12 32 O C S 16 12 34 O C S 18 12 32 O C S 16 Espaciado (MHz) 12163.42 11866.38 11401.77 Determinar las distancias internucleares SC y CO en esta molécula. 11. Los espectros de microondas del NH3 y ND3 constan de una serie de líneas separadas 19.89 y 10.26 cm-1, respectivamente. Suponiendo que las dos moléculas tienen estructuras idénticas, determinar sus geometrías. 12. Determinar los momentos principales de inercia para la molécula FNO, siendo: rFN=1.52 Å, rNO=1.13 Å y αFNO = 110°. 13. El análisis del espectro de microondas del agua conduce a los siguientes valores de las constantes rotacionales (en cm-1) A=27.877 B=14.512 C=9.285 Determinar la geometría de la molécula. 14. Los valores promedios de los desplazamientos Stokes y anti-Stokes para las primeras líneas observables en el espectro Raman del CS2 son (en cm-1): 4.96 5.87 6.76 Calcúlese la longitud del enlace CS. 7.64 8.50 Espectros de vibración de moléculas diatómicas. 15. Calcular la frecuencia fundamental de vibración del monóxido de carbono (cm-1), suponiendo que se comporta como un oscilador armónico cuya constante de fuerza es 19.02 105 dinas cm-1. 16. La banda fundamental en el espectro de vibración del bromuro de hidrógeno tiene su centro situado a 2650 cm-1. Considerando que la constante de fuerza del enlace no es modificada por la sustitución isotópica, calcular el desplazamiento de la frecuencia cuando el átomo de hidrógeno se reemplaza por uno de deuterio. 17. En el espectro de infrarrojo del ClH se han observado diversas bandas de rotación-vibración, para cuyos centros (o líneas cero) se han obtenido las siguientes frecuencias: 2885.9, 5668.0, 8346.9, 10923.1 y 13396.5 cm-1. Calcular: a) la frecuencia clásica y la constante de anarmonicidad de la molécula, b) la constante de fuerza y c) el calor molar de disociación. 18. En el espectro de vibración-rotación del ClH aparecen las siguientes líneas: 2752.03, 2775.79, 2798.78, 2821.43, 2843.56, 2865.09, 2906.25, 2925.78, 2944.89, 2963.24, 2980.90 y 2997.78 cm-1. Calcular los momentos de inercia de la molécula en el estado fundamental de vibración, en el primer estado vibracional excitado y en la posición de equilibrio. ¿Cuál será la distancia internuclear de equilibrio? 19. El espectro Raman del ClH, obtenido usando como radiación excitatriz la línea azul del mercurio, centrada a 4385 Å, presenta las siguientes líneas: 5102.48, 5092.57, 5082.55, 5072.40, 5062.15, 5046.61, 5030.70, 5020.00, 5009.20, 4998.29 y 4987.28 Å. Determinar el valor de la distancia internuclear de equilibrio de esta molécula. Espectros de vibración de moléculas poliatómicas. 20. La tabla adjunta muestra el espectro IR de SO2. Asignar estas bandas a transiciones vibracionales. ν (cm-1) 518 845 1151 1362 1876 2296 2500 2715 2808 3603 Int. Relativa 455 0.05 565 1000 6 5.5 20 0.2 0.8 0.8 21. Indicar a qué representación irreducible corresponden las vibraciones normales del pentafluoruro de fósforo, PF5. ¿Cuales serán activas en infrarrojo?. 22. Demostrar que una molécula del tipo X3 con estructura de triángulo equilátero y potencial de vibración 1 2 2 2 k (δr1 ) + k (δr2 ) + k (δr3 ) 2 1 3k 1 3k posee las frecuencias fundamentales de vibración ν 1 = y ν2 = ν3 = 2π m 2π 2m Dibujar la forma de las coordenadas normales. V= [ ] 23. Una molécula triatómica de formula A2B presenta dos bandas intensas en el infrarrojo a 400 y 1500 cm-1 y una banda intensa, desplazada 650 cm-1 respecto a la frecuencia de la radiación excitatriz, en el espectro Raman. Todas las demás bandas IR y Raman son débiles. Cuales de las siguientes estructuras son compatibles con el espectro: a) Lineal AAB, b) Lineal ABA, c) Angular AAB, d) Angular ABA. 24. La molécula N2O tiene un espectro de microondas consistente en un conjunto de líneas con un espaciado constante de 0.838 cm-1. Sus tres frecuencias vibracionales, 2223.76, 588.78 y 1284.91 cm-1 son activas en Infrarrojo y Raman. ¿Que estructura del N2O es consistente con estos datos? 25. Los seis modos normales de vibración del formaldehído pueden representarse en la forma siguiente: H H C O H H C O C H H (i) (iii) H (v) H C O H (-) C O H (ii) O (+) (-) (-) (iv) (vi) a) Asignar estas vibraciones a las representaciones irreducibles del grupo de simetría a que pertenece la molécula. b) Indicar qué vibraciones son activas en IR y cual es la dirección del momento de transición correspondiente a las vibraciones activas. c) Indicar que vibraciones son activas en Raman y cual es la componente del tensor de polarizabilidad implicado en las mismas. 26. La diimida (N2H2) puede existir en forma cis y trans. Determínese las siguientes propiedades para estos dos isómeros: a) Los grupos puntuales a que pertenecen b) Las representaciones irreducibles a que corresponden los modos normales de vibración de ambas formas. c) Su actividad en IR y Raman. 27. Dados los siguientes seis modos normales de vibración del etileno ¿Cuales son activos en el IR?, ¿y en Raman?. (+) (-) (-) (+) (a) (b) (c) (+) (-) (-) (+) (d) (+) (e) (-) (f) Espectros electrónicos de moléculas diatómicas. 28. Las bandas del espectro ultravioleta del oxígeno convergen hacia un límite bien definido en 1759 Å. Los productos de la disociación son un átomo de oxígeno en su estado fundamental y otro en un estado excitado situado 1.97 eV por encima del normal. Calcular la energía de disociación del oxígeno en el estado fundamental en cm-1, eV y Kcal/mol. 29. Las bandas que aparecen en el espectro del radical ClO son: v’ -1 ν(cm ) v’ -1 ν(cm ) 4 32945 13 36360 5 33402 14 36627 6 33839 15 36874 7 34261 18 37425 8 34664 19 37569 9 35056 20 37689 Calcular la energía de disociación del ClO en el primer estado excitado. 30. Obtener la configuración electrónica del estado fundamental y de los tres primeros estados excitados del NO. ¿Cuáles son las transiciones permitidas entre ellos? Espectros electrónicos de moléculas poliatómicas. 31. En la tabla se dan los valores de los coeficientes de los orbitales atómicos en cada uno de los orbitales moleculares obtenidos para la molécula de H2O por un método SCF, usando una base mínima de STO. Obtener la configuración electrónica del estado fundamental y de los tres primeros estados excitados, indicando las transiciones permitidas entre ellos. O.A. \ E. 1sO 2sO 2pxO 2pyO 2pzO 1sH1 1sH2 −20.24 0.99 0.03 0.00 0.00 0.01 −0.01 −0.01 −1.27 −0.23 0.83 0.00 0.00 0.13 0.16 0.16 −0.62 0.00 0.00 0.61 0.00 0.00 −0.44 0.44 −0.45 0.10 −0.54 0.00 0.00 0.78 0.27 0.27 −0.39 0.00 0.00 0.00 1.00 0.00 0.00 0.00 0.61 −0.13 0.90 0.00 0.00 0.74 −0.81 −0.81 0.76 0.00 0.00 1.00 0.00 0.00 0.85 −0.85 32. En la tabla se dan los valores de los coeficientes de los orbitales atómicos en cada uno de los orbitales moleculares obtenidos para la molécula de NH3 por un método SCF usando una base de valencia de STO. Obtener la configuración electrónica del estado fundamental y de los dos primeros estados excitados. Calcular la longitud de onda correspondiente a la transición de menor energía. O.A.\ E. 2sN 2pxN 2pyN 2pzN 1sH 1sH' 1sH” −1.08 0.74 0.00 0.00 0.11 0.16 0.16 0.16 −0.58 0.00 0.59 0.00 0.00 −0.24 −0.24 0.48 −0.58 0.00 0.00 −0.59 0.00 −0.42 0.42 0.00 −0.34 −0.36 0.00 0.00 0.93 0.10 0.10 0.10 0.63 1.32 0.00 0.00 0.45 −0.72 −0.72 −0.72 0.76 0.00 1.08 0.00 0.00 0.51 0.51 −1.02 0.76 0.00 0.00 −1.08 0.00 0.88 −0.88 0.00 33. El espectro ultravioleta del etileno presenta una banda intensa a 2070 Å. Partiendo de los valores de los coeficientes de los orbitales atómicos en cada uno de los orbitales moleculares, recogidos en la tabla, asignar dicha banda. OA\E -0.98 -0.75 -0.61 -0.54 -0.46 -0.33 0.32 0.63 0.70 0.71 0.95 1.01 2sC1 0.47 0.41 0.00 -0.02 0.00 0.00 0.00 0.00 0.83 -1.06 0.00 -0.90 2pxC1 0.00 0.00 0.39 0.00 0.39 0.00 0.00 0.70 0.00 0.00 0.96 0.00 2pyC1 0.00 0.00 0.00 0.00 0.00 0.63 -0.81 0.00 0.00 0.00 0.00 0.00 2pzC1 -0.12 0.20 0.00 0.50 0.00 0.00 0.00 0.00 0.52 -0.22 0.00 1.17 2sC2 0.47 -0.41 0.00 -0.02 0.00 0.00 0.00 0.00 0.83 1.06 0.00 0.90 2pxC2 0.00 0.00 0.39 0.00 -0.39 0.00 0.00 0.70 0.00 0.00 -0.96 0.00 2pyC2 0.00 0.00 0.00 0.00 0.00 0.63 0.81 0.00 0.00 0.00 0.00 0.00 2pzC2 0.12 0.20 0.00 -0.50 0.00 0.00 0.00 0.00 -0.52 -0.22 0.00 1.17 1sH1 0.11 0.22 0.26 0.22 0.35 0.00 0.00 -0.63 -0.63 0.65 -0.62 -0.12 1sH2 0.11 -0.22 0.26 0.22 -0.35 0.00 0.00 -0.63 -0.63 -0.65 0.62 0.12 1sH3 0.11 -0.22 -0.26 0.22 0.35 0.00 0.00 0.63 -0.63 -0.65 -0.62 0.12 1sH4 0.11 0.22 -0.26 0.22 -0.35 0.00 0.00 0.63 -0.63 0.65 0.62 -0.12 Espectros de resonancia magnética nuclear 34. ¿Cual es la intensidad del campo magnético de un espectrómetro de 500 MHz?¿A qué frecuencia producirían señal de absorción los nucleos de -1 -1 -1 13 C en este -1 espectrómetro? (γH = 26.7519 × 107 rad T s , γC = 6.7283× 107 rad T s ) 35. Cual es la diferencia entre las frecuencias de resonancia protónica del benceno y la acetona (7% en CDCl3) en un campo magnético constante de 7,046 T? ¿Cual es la diferencia entre las constantes de pantalla de los protones de las dos moléculas? Molécula en CDCl3 δ (ppm respecto a TMS) Benceno 7.37 Acetona 2.17 36. El espectro de RMN de un sistema de dos núcleos de espín ½, en un instrumento que opera a 40 MHz, presenta cuatro líneas de igual intensidad situadas a 111,7, 112,6, 180,4 y 181,3 Hz, a) Determinar los parámetros magnéticos de la molécula indicando el significado físico de los mismos. b) ¿Que ocurriría en el caso de que el instrumento operase a 60 MHz? c) Explicar a qué se debe que las cuatro líneas tengan la misma intensidad e indicar de qué tipo de sistema se trata. 37. La figura muestra el espectro de RMN de 14 N (I=1) de un nitrato en solución acuosa. ¿De que sal se trata? 38. La figura muestra el espectro de RMN de 1H (I=1/2) del CD3-CO-CD2H. Justifíquelo 39. Las constantes de pantalla de los núcleos en una molécula de BH3 son: σH =0,12 ppm y σB=0,21 ppm. Cuando una molécula de BH3 se introduce en un campo magnético de 7,0 T, ¿A qué frecuencia se produciría absorción de radiación? ¿Cual seria la forma de la señal? (I11B = 3/2, γH = 26,7519 × 107 rad T-1 s-1, γB = 8,5843× 107 -1 -1 rad T s ) 40. Dibujar el espectro de RMN –1H del 2-cloro, 5-metil furano; sabiendo que: HA HB δA = 6,95 ppm JAB = 3,3 Hz MeM Cl δB = 6,04 ppm JAM = 0,9 Hz δM = 2,37 ppm JBM = 0,5 Hz O 41. Dibujar el espectro de RMN – 1H del cis,ciano-metil-etileno, sabiendo que: HA HB C δA = 6,53 ppm JAB = 11,0 Hz δB = 5,22 ppm JAM = 6,7 Hz C δM = 1,86 ppm JBM = 1,5 Hz MeM CN