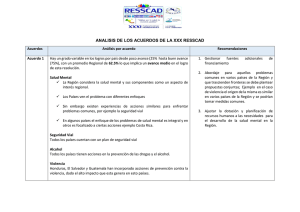
REF MV 39 - Virbac Colombia
Anuncio

4 3 8 GERENTE EDITOR TOMA S MOR ALES MONCRIEFF TOMAS MORALES Referencias para x consultorio MV revista de resúmenes de medicina veterinaria edición 39 - octubre 2014 DIRECTOR DE LA PUBLICACIÓN LÁCIDES SERRANO VEGA PRESENTACIÓN COLABORADORES PERMANENTES JOSÉ DARÍO MOGOLLÓN G. DMV, PhD FRANCISCO BUSTOS M. DMVZ, MSc, MVSc. WENDIE O. ROLDÁN V. DMV, Esp. MSc. CLAUDIA JIMÉNEZ ESCOBAR DMVZ, MSc, DVSc, DACT FRANK HARRY SUÁREZ S. DMV, Esp, PhD IOVANA CASTELLANOS L. DMV, Esp, MSc. COLABORADORES INVITADOS ROY JOSÉ ANDRADE B. DMV, Esp., MSc PhD ARTURO ANADÓN N DMV, PHD JUAN DAVID SAMACÁ DMV FRÉDERIC CLIMENT C. DMV, PhD LUIS ALFONSO GRACIA DMV, MSc REVISIÓN EDITORIAL IVÁN DARÍO OCAMPO L. DMVZ DISEÑO E I MPRESIÓN TOMA S MOR ALES MONCRIEFF TOMAS MORALES CRA 3# 21 - 46 Of. 3103 TORRE B 2833698 e-mail: [email protected] La mastitis es una inflamación de la glándula mamaria y sus tejidos secretores, que reduce la producción del volumen de leche, alterando su composición incluso su sabor, además de elevar su carga bacteriana normal. De acuerdo a su duración, se puede clasificar en aguda o crónica. En relación a sus manifestaciones clínicas, puede ser clínica o subclínica.Aunque en muchos casos hay tumefacción, calor, dolor y endurecimiento de la glándula mamaria, la mastitis no se identifica fácilmente, ni por examen visual ni por leche obtenida en la copa de ordeño. Esta enfermedad provoca graves pérdidas económicas a la industria lechera; es por ello que en éste número, el Dr. Roy José Andrade, además de hablar acerca de los tipos de mastitis y su control, hace énfasis en las pérdidas económicas generadas por dicha patología en Colombia. En la patología clínica de pequeños animales, son las dermatitis uno de los procesos más frecuentes y más a menudo objeto de consulta profesional. Por su alta incidencia dentro del conjunto de dermopatías, así como por la enorme variedad de manifestaciones clínicas que pueden presentar, las dermatofitosis animales constituyen un objeto de máximo interés clínico y epizootiológico. Clínicamente pueden definirse como afecciones superficiales de las capas queratinizadas de la piel y sus anexos, originadas por un grupo de hongos filamentosos y queratinofílicos, conocidos como dermatofitos, pertenecientes a los géneros Microsporum y Trichophyton. Por la importancia del tema, en la presente edición la Dra. Wendie Oriana Roldán nos habla de la patogénesis, diagnóstico y tratamiento de la dermatofitosis en caninos y felinos. El riñón elimina (en parte o en su totalidad) la mayoría de los medicamentos, incluyendo los metabolitos de fármacos metabolizados por el hígado. La excreción renal de un fármaco (o sus metabolitos) es una función que incluye 3 procesos: filtración glomerular, secreción tubular y reabsorción tubular. La mayoría de fármacos que causan nefrotoxicidad producen sus efectos tóxicos por uno o varios mecanismos patogénicos. Estos incluyen la alteración de la hemodinámica intraglomerular, la toxicidad de las células tubulares y la inflamación. Los doctores Frank H. Suárez, Arturo Anadón y Juan David Samacá, nos entregan un artículo donde nos dan a conocer la nefropatía inducida por algunos fármacos y sus respectivos mecanismos patogénicos implicados en el daño renal en caninos. Estos y otros artículos de interés, los podrá encontrar en las diferentes secciones de la presente publicación. Referencias para x consultorio MV BOGOTÁ, D.C., COLOMBIA ISSN 1657-3595 1 Referencias para consultorio MV x Referencias para x consultorio MV Ed. 39 - 10/2014 Referencias para consultorio MV x ENFERMEDADES VASCULARES EN AVES DE PRESA Michael P. Jones - DMV, Dip ABVP. Journal of Exotic Pet Medicine. 22 (2.013). University of Tennessee, Veterinary Medical Center, Knoxville, TN USA. TRADUCCIÓN Y SÍNTESIS Francisco Bustos M. - DMVZ, MSc, MVSc RESUMEN En aves de presa las enfermedades vasculares pueden ser causadas por un número de agentes infecciosos y no infecciosos, y son probablemente no diagnosticadas. Esta revisión intenta suministrar una discusión de la literatura disponible, relacionada con enfermedades vasculares en aves de presa, describiendo un número de condiciones o agentes etiológicos (como aterosclerosis, aneurismas, condiciones bacteriales y septicémicas, enfermedades tromboembólicas, virales, fúngicas, parasitarias y enfermedades misceláneas), y la patología vascular que puede ocurrir con cada una. INTRODUCCIÓN En especies aviares la causa de enfermedad vascular está asociada con varias etiologías infecciosas y no infecciosas. Una revisión de la enfermedad vascular en aves de presa comunes y los reportes de patologías, sugieren que esta condición ocurre con menos frecuencia que en aves de compañía. En general, varias revisiones de morbi-mortalidad en aves rapaces en cautiverio y libres abren una amplia categoría de enfermedades. Sin embargo, las primeras revisiones con reportes de necropsia de varias instituciones y la literatura presente, aporta descripciones más detalladas de las lesiones patológicas encontradas en los vasos sanguíneos. De estas enfermedades vasculares reportadas, la aterosclerosis se presenta con mayor frecuencia en un número de especies rapaces. La relativa frecuencia con las cuales las enfermedades cardiovasculares fueron reportadas en aves de presa en las primeras revisiones, sugieren que estas pueden ser no reportadas en la literatura actual. Los objetivos de este artículo son la revisión y discusión de condiciones y agentes etiológicos (aterosclerosis, aneurismas, condiciones bacterianas y septicémicas, enfermedad tromboembólica, viral, fungal y parasitaria), que causan enfermedad vascular en rapaces y describe la patología vascular asociada con ésta. ENFERMEDADES VASCULARES NO INFECCIOSAS Aterosclerosis Es la enfermedad vascular más común reportada en aves de presa y las lesiones de severidad diferente han sido reportadas o descritas en un número de especies captivas y libres, incluyendo diferentes especies de águilas, halcones, cernícalos, azores, buitres, cóndores, lechuzas y gavilanes. Finlayson sugiere que aves carnívoras son particularmente susceptibles a enfermedades degenerativas arteriales; sin embargo, la prevalencia de ateroesclerosis reportada en aves de presa, varía entre los autores. Fox encontró que el 3% de falconiformes incluidos en los órdenes Falconiformes y Accipitriformes, presentó lesiones consistentes con aterosclerosis y que murieron en el zoológico de Filadelfia. Una última revisión reveló una prevalencia alta de aterosclerosis del 54% en el orden Falconiforme, mayor que en otros órdenes de aves u otros animales. Cuando fueron revisados los informes de necropsia de la Sociedad de Zoológicos de Londres y la literatura disponible relacionada con enfermedades vasculares en animales en cautiverio, no incluyó aves del orden Strigiformes. En una revisión posterior de 125 necropsias en aves de presa que murieron, los resultados de las etiologías fueron inciertos; Keymer determinó que 8% de Falconiformes y 15.6% de Strigiformes examinados presentaron lesiones de aterosclerosis. Una reciente revisión retrospectiva de morbimortalidad en aves de presa libres, indicó que el 1.8% murió de ateroesclerosis. La patogénesis de la ateroesclerosis en rapaces es probablemente similar a la descrita en otros animales y humanos, y se caracteriza por cambios degenerativos en la túnica interna y media de las arterias que comprende varios grados de calcificación distrófica, metaplasia condroide, deposición de colágeno y fibrina, deposición y 2 AVICULTURA retención de lípidos, colesterol e injuria proteolítica, inflamación crónica y necrosis de las paredes arteriales. El resultado es el desarrollo de placas ateroescleróticas que afectan significativamente la elasticidad de las paredes arteriales y pueden conllevar a varios grados de reducción de la luz del vaso y aún ruptura de la pared del mismo. Lesiones ateroescleróticas pueden estar presentes en cualquier arteria, sin embargo, el tronco braquiocefálico, arco aórtico y aorta distal parecen ser los más afectados en las aves de presa. Lesiones adicionales han sido descritas en las arterias carótidas, subclavia, pectoral y femoral. Lesiones en las arterias coronarias pueden causar infarto del miocardio, asociado con engrosamiento de la íntima de arterias coronarias pequeñas y trombosis de venas coronarias. La causa exacta de la aterosclerosis no es completamente clara, sin embargo factores de riesgo como la obesidad, edad, falta de ejercicio, largos periodos de inactividad y dietas altas en grasa, pueden jugar un pa- pel importante. Aves rapaces obesas con pérdida de peso rápida, durante reducción del mismo por entrenamiento o como secuela de enfermedad, pueden también estar en riesgo. La aterosclerosis puede afectar aves rapaces de cualquier edad, aunque esta es más frecuente en adultos de presa (mayores de 5 años de edad). Muchos reportes consideran como un factor de riesgo, la edad, basados en la captividad de las aves de presa, pero se desconoce si la edad juega un papel significativo en la patogénesis de la enfermedad en rapaces libres, pero no hay estudios que apliquen en esta presentación. La prevalencia de lesiones de aterosclerosis avanzada fue asociada con varios factores de riesgo en psittacines, incluyendo edad, sexo en hembras y algún género, como lo discutió Beaufrere en su publicación; sin embargo, esto no ha sido determinado en aves de presa. En humanos el desarrollo de placas ateroscleróticas se piensa es acelerada por la hipertensión sistémica. Bohórquez y Stout; Lumeij y Richie, sugirieron que la relativa alta presión sanguínea y niveles de colesterol en el suero de las aves, están ligados a una incidencia alta de aterosclerosis observada en especies aviares en general. Las rapaces afectadas por aterosclerosis pueden presentar enfermedad subclínica por un periodo significativo de tiempo y entonces mueren súbitamente o pueden mostrar una o más progresión crónica de enfermedad, marcada por una pobre condición corporal, debilidad, disnea y signos neurológicos. En general los signos clínicos están asociados con reducción del flujo sanguíneo a través de las arterias afectadas y la placa induce la formación de trombos. En especies de compañía y rapaces, la muerte súbita está asociada con infartos del miocardio o severa disminución de la luz de las arterias carótidas, con disminución del flujo sanguíneo al cerebro. Otra secuela puede incluir la hipertrofia del ventrículo izquierdo, el cual finalmente termina con falla del corazón derecho. El vasodilatador periférico Isoxsuprime puede ser útil terapéuticamente, pero no existe un tratamiento específico para la aterosclerosis. Por lo tanto, la prevención de la enfermedad cardiovascular en aves rapaces captivas es necesaria. Las aves de presa en cautiverio no deben presentar obesidad. Esta puede manejarse monitoreando su peso y manejando la dieta en forma juiciosa. Esta es una práctica común para aumentar el peso en forma significativa en aves rapaces durante el entrenamiento (halcones, cetrería, educación de rapaces en vuelo), para optimizar el desarrollo del plumaje y durante el proceso de muda. Sin embargo, un aumento de peso de un 10% aproximadamente por encima del normal durante el entrenamiento, es adecuado para permitir un buen desarrollo de las plumas, sin que el ave rapaz esté obesa. Para aquellas aves que son alimentadas ad livitum, uno o más días de ayuno por semana en concordancia con un adecuado monitoreo de su peso, puede estar indicado siempre y cuando se observen saludables. Los lectores están invitados a revisar descripciones detalladas de Chitty y Forbes, y Flint, sobre los requerimientos nutricionales y recomendaciones para aves de presa. Aneurismas Han sido reportados en especies aviares, pero no considerados como una enfermedad común en mascotas o aves en cautiverio. Cuando se presenta el aneurisma, se aprecia una dilatación variable del tamaño de las arterias y puede estar asociado con placas ateroscleróticas y están a menudo presentes sin presentar una etiología. El aneurisma sacular ha sido descrito en aves de presa. En un águila se diagnosticó un aneurisma sacular en la aorta, el cual tenía placas ateroscleróticas. Una lechuza (Scotopelia bouvieri) mostró una hemorragia masiva intratoráxica y pulmonar, como resultado de una ruptura de un aneurisma sacular de la aorta descendente, con tejido conectivo perivascular de la pared aórtica cercana a la ruptura, siendo identificado como un tejido de granulación y fibrosis, sin aterosclerosis. Los autores de este caso especularon que el aneurisma aórtico pudo haber sido una complicación de aortitis parasitaria (nematodos). El aneurisma aórtico disecante con aterosclerosis se ha diagnosticado en una colonia de colodra negra en Francia (Facon y Beaufrere). ENFERMEDADES VASCULARES INFECCIOSAS Enfermedades bacterianas Los organismos bacterianos pueden causar lesiones vasculares en cualquier órgano por invasión local de tejidos o por unabacteremia 3 AVICULTURA o septicemia, originada presumiblemente de una endocarditis valvular por Enterobacter sp, Streptococcus sp, Pasteurella sp, Erysipelothrix sp y Lactobacillus sp, los cuales han sido reportados como causantes de endocarditis en rapaces y otras especies aviares. Staphilococcus sp Lemon y col. describieron una sepsis bacteriana aguda iniciada probablemente por una endocarditis en un halcón de cola roja. En este caso la válvula aórtica estaba severamente engrosada, ulcerada y unida al miocardio adyacente por fibrina. La secuela de la endocarditis valvular incluyó trombos sépticos grandes con numerosas bacterias presentes en las arterias coronarias, pequeños émbolos bacterianos en el miocardio y trombos sépticos de fibrina en el encéfalo, leptomeninges, riñones, mucosa y submucosa gástrica. Necrosis fibrinoide de los vasos, e inflamación local y difusa heterofílica o granulomatosa fue observada en muchas lesiones. Pasteurella multocida Es el agente del cólera, el cual afecta una amplia variedad de especies aviares en cautiverio o libres. El cólera se reconoce por sus frecuentes epizootias en aves acuáticas a lo largo de sus rutas de migración; sin embargo, su rango de huéspedes se extiende a Falconiformes, Accipitriformes y Strigiformes. Lesiones típicas asociadas con el cólera aviar dependen del serotipo de Pasteurella y de la cronicidad de la infección. En aves acuáticas las lesiones agudas son encontradas a menudo en aves con buena condición corporal, asociada con enfermedad vascular debido a la septicemia y coagulación intravascular diseminada. Morishita y col. describieron lesiones asociadas con P. multocida en rapaces presentadas para necropsia en el Hospital Médico de la Universidad Davis de California, desde 1.980-1.994. Este reporte mostró endocarditis valvular, inflamación y trombos de fibrina en los vasos pulmonares, los capilares llenos de bacterias Gram negativas en el sistema respiratorio, trombos de fibrina con tapones de bacterias en la cubierta de las arterias del sistema linfoide y células inflamatorias (heterófilos) en los vasos intralobulares del sistema urinario. Jessup reportó lesiones sugestivas de Referencias para consultorio MV x Ed. 39 - 10/2014 Ed. 39 - 10/2014 Referencias para consultorio MV x P. multocida en águilas libres que resultó con endocarditis valvular de la válvula atrioventricular izquierda. El reporte describió trombosis, fibrina y obstrucción de arterias coronarias y venas de tamaño medio, como también arterias del hígado y riñones; sin embargo, la presencia de P. multocida no fue confirmada. Micobacteriosis aviar Es ocasionada por el Mycobacterium avium y otras bacterias relacionadas, y puede afectar un amplio rango de huéspedes aviares de compañía y libres. Se piensa que la micobacteriosis ocurre menos frecuentemente en aves rapaces de vida libre, comparadas con otras especies en varios ambientes de captividad. Las lesiones como arteritis se presenta con infecciones micobacteriales y están a menudo asociadas con el pericardio, en la base del corazón en aves de compañía y otras. La frecuencia de lesiones vasculares asociadas con micobacteriosis en aves en captividad o de vida libre se desconoce, o quizá es rara; solamente un reporte describe las lesiones granulomatosas encontradas en grandes vasos en especies de rapaces. Pododermatitis (absceso podal) Es una condición inflamatoria crónica degenerativa, a menudo diagnosticada en aves de presa en cautiverio y caracterizada por una lesión local con desvitalización del tejido epitelial de la superficie plantar del pie. Numerosas bacterias se han identificado como factores de confusión en las lesiones de la pododermatitis, incluyendo Streptococcus sp, Escherichia coli, Proteus sp, Pasteurella sp, Pseudomona sp, Klebsiella sp,Clostridium sp, Corynebacterium sp, Bacillus sp, Diplococcus sp, Nocardia sp, Actinobacillus sp, Actinomices sp y Aeromonas sp. El organismo más comúnmente aislado es el Staphylococcus aureus, el cual no es común en rapaces con pododermatitis. Los estados iniciales de la enfermedad se caracterizan por una inflamación aguda o crónica, con edema, degeneración del colágeno y vasculitis necrotizante. Con el progreso de la enfermedad, proliferación vascular nodular, fibrosis, hiperplasia del endotelio vascular y musculatura lisa, estrechamiento de la luz de los vasos y endarteritis obliterante. Enfermedades micóticas Entre las enfermedades producidas por hongos, la aspergillosis afecta comúnmente las especies aviares y son fuente de varios artículos y publicaciones. El sistema respiratorio es frecuentemente afectado, sin embargo la difusión hematógena del Aspergillus sp y la Candida sp, puede ocurrir por invasión de los vasos sanguíneos de las hifas del hongo, esporos u otros elementos del mismo o embolias que pueden causar vasculitis en otros órganos. La enfermedad vascular e injuria debida a organismos del hongo resulta en una extensión directa de una infección local. La lesión focal es una inflamación granulomatosa, con necrosis y trombosis vascular con abundantes hifas del hongo y ocasionalmente conidiosforos del Aspergillus sp; fue observado en una lechuza cornuda que murió de una infección simultánea por virus herpes. Sorpresivamente y a pesar de la frecuencia con la cual la aspergillosis es observada en aves de presa, muchos reportes de enfermedad vascular por hongos involucra aves comerciales. Schmidt y otros describen necrosis e infiltrados inflamatorios pleocelulares en las paredes de los vasos, de mascotas infectadas y otras especies aviares. Oxalosis pulmonar (depósitos de cristales de oxalato de Ca), asociado con Aspergillus niger, en una descripción de una lechuza cornuda en la cual los vasos pulmonares fueron invadidos por trombos de hifas septadas con características de phycomicetos; sin embargo, solo Aspergillus niger y pocas colonias de Scopulariopsis sp fueron aisladas en cultivo de los pulmones. No hubo descripciones de alteraciones vasculares. Enfermedad tromboembólica en el cerebelo debida a diseminación sistémica de Candida albicans se describió en un águila dorada, con una infección simultánea con virus pox. Las lesiones incluyeron hemorragias multifocales en el cerebelo, con trombos vasculares, constituidos por un material asociado con eritrocitos, trombocitos y pseudohifas septadas. en especies aviares domésticas, aves de vida libre, incluyendo varias especies de rapaces. La familia Adenoviridae consta de 5 géneros incluyendo Mastadenovirus, Aviadenovirus, Atadenovirus, Siadenovirus e Ichtadenovirus. Recientemente, una nueva especie de adenovirus en halcones rapaces (Adenovirus 1:RAdV-1) se demostró, para lo cual los halcones peregrinos pueden considerarse como reservorio natural y que pertenece al género Siadenovirus. Las lesiones vasculares asociadas con RAdV-1 han sido descritas en un cernícalo Mauritius y un halcón Vanuatu; el cernícalo presentó vasculitis multifocal en el endotelio de los vasos del tracto gastrointestinal, como también al azar en otros vasos, hemorragias en los pulmones y músculo esquelético. Vasculitis y arterioesclerosis multifocal fueron identificadas en el halcón infectado con RAdV-1. Varios reportes describen hallazgos patológicos en rapaces infectadas con el West Nile Virus. La enfermedad vascular en lechuzas grises no fue un hallazgo frecuente fuera de una coagulación intravascular diseminada. La arteritis fue un hallazgo común en cernícalos americanos, halcones de cola roja y lechuzas cornudas, experimental y naturalmente infectados con el West Nile Virus. Entre las rapaces, un halcón de cola roja (naturalmente infectado) y 3 (experimentalmente infectados), presentaron arteritis cerebral, 3 cernícalos americanos (experimentalmente infectados), 1 cernícalo (naturalmente infectado), 1 lechuza cornuda (experimentalmente infectada) y un halcón cola roja (experimentalmente infectado), presentaron arteritis en el miocardio; 2 cernícalos (experimentalmente infectados) y uno (naturalmente infectado) presentaron moderada y subaguda nefritis, con severa arteritis necrotizante; 1 lechuza cornuda grande (experimentalmente infectada) exhibió arteritis y 1 cernícalo (naturalmente infectado), presentó arteritis hepática. Enfermedades virales ENFERMEDADES VASCULARES PARASITARIAS Virus (Adenovirus y flavivirus (West Nile Virus)) han sido demostrados como causantes de enfermedad vascular en aves de presa. Los adenovirus son encontrados a nivel mundial y son considerados ubicuos Sarcocystis sp y Sarcocystis falcatula infestan comúnmente aves del orden Psitaciformes, Passeriformes, Columbiformes y Strigiformes, aunque miembros del género Falconiformes pueden ser también in- 4 AVICULTURA festadas y servir como huéspedes intermediarios. Signos clínicos y muerte en aves afectadas son el resultado de encefalitis con infección neuronal o endotelial pulmonar. Los huéspedes intermediarios se infestan por la ingestión de esporocistos u ooquistes, después de lo cual los esporozoitos son liberados al intestino y eventualmente migran a través de las paredes de éste, al endotelio arterial pulmonar, donde la merogonia (reproducción asexual) se presenta. Los merontes que se desarrollan en el endotelio pulmonar pueden causar hipertrofia y obstrucción de los capilares y formación de trombos. Hematozoarios El Haemoproteus sp y Plasmodium sp infestan comúnmente aves en cautiverio y de presa de vida libre. De los dos, Haemoproteus sp es considerado no patógeno y un incremento de la parasitemia es notado usualmente durante un periodo de estrés o enfermedad concurrente. En contraste, el Plasmodium sp es bien conocido como causante de enfermedad (Malaria aviar) en aves de presa. El Plasmodium sp entra en su huésped por inoculación directa del mosquito vector. Una vez introducido, la esquizogonia inicial se presenta en el sitio de la inoculación y los merozoitos son liberados para infectar tejidos del sistema retículo endotelial. Las futuras esquizogonias se presentan en los tejidos retículo endoteliales, como también en forma extensa en el endotelio capilar renal y pulmonar. En un reporte, la causa de muerte de un halcóngyr fue el resultado de un edema pulmonar, debido a una ruptura masiva de esquizontes y liberación de merozoitos en el endotelio capilar pulmonar. Una vez inyectados los esporozoitos del Haemoproteus en el huésped, se desarrollan esquizontes en varios tejidos incluyendo el endotelio vascular de pulmones, hígado, riñones, bazo, corazón y músculo esquelético. Daño vascular no ha sido reportado, pero es posible si la ruptura de esquizontes resulta en daño al endotelio vascular. Nematodos Los parásitos de los sacos aéreos del género Diplotriaena, Serratospiculoides, como también nematodos filaroides del género Aproctella, Cardiofilaria, Chandlerella, Lemdana, Poronchocerca, Pelecitus y Splendi- dofilaria, pueden causar enfermedad vascular en rapaces. Todos los nematodos mencionados presentan confusión en su taxonomía (filarid, filariid, filarioid, filarial). Es importante notar que la superfamilia Filairoidea ha sido dividida en tres superfamilias Filariodea, Diplotriaenoidea y Aproctoidea. Miembros del género Diplotriaena, Serratospiculum (familia Diplotriaenidae) y superfamilia Diplotriaenoidea, afectan comúnmente los sacos aéreos de especies aviares y comparten en forma similar ciclos de vida indirectos que requieren un artrópodo como huésped intermediario; ninfa o adulto joven de un saltamonte coprófago en el caso de Diplotriaena o escarabajo en el caso de Serratospiculum y Serratospiculoides. Los ciclos de vida del género Diplotriaena, Serratospiculum y Serratospiculoides son revisados en detalle por Sterner y col, Cawthorn y Anderson, Anderson, Ansari y Samour, y Samour y Naldo. Varias especies de paseriformes son consideradas huéspedes definitivos para Diplotriaena sp, los cuales son a menudo identificados en los sacos aéreos y tejidos subcutáneos de especies aviares de los órdenes Anseriformes, Apodiformes, Galliformes, Charadiformes, Columbiformes, Piciformes y Paseriformes. Kobishev reportó recuperar Diplotriaena falconis de una polla de agua (busardo) y lebrer pequeño en la unión soviética. Serrastopiculum sp tiene una distribución mundial con el Serrastospiculum scurati, diagnosticado comúnmente en halcones en el Medio Este y Serratospiculoides amaculata, identificado en varias especies de rapaces de Norte América. Recientemente S. gluttatum ha sido reportada en halcones en Nueva Zelandia. Diplotriaena sp puede causar patologías en varios órganos como resultado de la actividad del parásito adulto, así como también de la migración larval y la presencia de huevos. El tercer estadio (L3) de la larva migra de los intestinos al sistema hepático portal en donde llega a L4 y a subadulto. De allí migra a los pulmones a través del corazón y vasos pulmonares y luego a los sacos aéreos para llegar a la forma adulta. Los pulmones, hígado, sacos aéreos y sistema vascular son comúnmente infestados por este parásito filarid y los cambios patológicos vasculares incluyen dilatación endotelial y vacuolización, trombosis arterial y 5 AVICULTURA periarteritis, debido a la invasión de la túnica media de las arterias por macrófagos, si los adultos cumplen la migración pulmonar. La larva puede causar trombosis una vez alcanza los pulmones. En contraste con Diplotriaena sp, una vez el huésped intermediario es ingerido por el ave, la larva L3 de Serratospiculoide sp penetra el proventrículo o ventrículo y de allí al saco aéreo. La Serratospiculiasis ocurre con lesiones en el tracto gastrointestinal, pulmones, hígado y tracto respiratorio, aunque muchos cambios se presentan en asociación con formas adultas en los sacos aéreos. La patología vascular asociada con Serratospiculiasis está caracterizada por edema de la media en las arteriolas. Nematodos filaroides se consideran que afectan un amplio rango de huéspedes y son considerados generalmente no patógenos. Miembros del género Aproctella, Cardiofilaria, Chandlerella, Lemdana, Paronchocerca, Pelecitusy y Splendidofilaria han sido reportados en Falconiformes y Strinfiformes. Estos géneros (familia Onchocercidae y superfamilia Filaroidea), produce microfilarias que habitan la corriente sanguínea o la piel y requieren de un huésped vertebrado definitivo y un intermediario invertebrado (vector artrópodo hematófago), para completar su ciclo de vida. Nematodos machos y hembras se aparean en el huésped vertebrado, mientras la hembra produce microfilarias que entran en el huésped definitivo en la sangre o la piel. La microfilaria es ingerida por el artrópodo chupador de sangre, en el cual ellas progresan al tercer estado de larva y migra a la cabeza y partes de la boca de las especies vectoras. Cuando los artrópodos vectores se alimentan de un vertebrado, la microfilaria se hace libre en la piel del vertebrado y entra en la herida creada por el cuerpo del huésped vector alimentador. Una vez dentro del cuerpo del huésped vertebrado, la microfilaria se desarrolla a través del 4 y 5 estadio larval, el cual es el estado adulto. Aunque la microfilaria y el nematodo adulto filaroide se consideran no patógenos, la microfilaria de Splendidofilaria coperata ha sido reportada de incitar una respuesta inflamatoria crónica en las arterias pulmonares de cuervos americanos. Larrat y col. reportaron la muerte de lechuzas boreales como resultado de Referencias para consultorio MV x Ed. 39 - 10/2014 Ed. 39 - 10/2014 Referencias para consultorio MV x reacciones inusuales a la presencia de microfilarias en grandes vasos del pulmón, hígado, corazón y cerebro. En este reporte, una concentración variable de microfilarias fueron observadas en los vasos sanguíneos, con una acumulación de material fibrinoide sobre el parásito. Se sugirió que la carga alta de microfilarias en las lechuzas puede producir la muerte, alterando la dinámica circulatoria, intercambio de gases y costo metabólico. Diplotriaena y Serratospiculoides son los géneros más comunes de los parásitos de los sacos aéreos de las aves. Nematodos que pertenecen al género Serratospiculoides se encuentran menos frecuentemente, pero están relacionados estrechamente. Todos los 3 géneros pertenecen al orden Spirurida, suborden Spirurina; y como todos los miembros de este suborden, utilizan artrópodos como huéspedes intermediarios. Estos 3 géneros han sido confundidos con nematodos filarioides, debido a sus cuerpos filiformes, dimorfismo sexual y presencia de sacos aéreos. Los machos son más pequeños que las hembras y usualmente tienen una cola en espiral. MISCELÁNEA DE ENFERMEDADES VASCULARES Émbolo graso pulmonar Los émbolos grasos pulmonares son considerados insignificantes y son reportados en humanos traumatizados severamente con grandes fracturas, pero no son de ocurrencia común en especies animales. Émbolos grasos pulmonares se diagnosticaron en un águila adulta, sin signos de trauma. Los hallazgos histológicos incluyeron múltiples émbolos en arterias pulmonares y difusos en el parénquima pulmonar, constituidos por tejido conectivo adiposo y material hematopoyético característico de la médula ósea. Los émbolos estuvieron Edema y necrosis de la punta del ala reducción en la insulación, debida a demasiada suavidad del primer plumaje, los hacen más susceptibles. En adición, Chitty recomienda no utilizar perchas en rapaces jóvenes cerca de la tierra (- 45 cms), durante el invierno, a menos que sea suplementado calor. Aunque la congelación ha sido propuesta como causa del edema y necrosis de la punta del ala, Chetty y Hudleson dudan de su significado, como etiología primaria. Algunos casos son reportados en rapaces más acostumbradas a climas cálidos (Halcón Harris, Halcón Lanner); sin embargo, rapaces más tolerantes al frio han desarrollado esta condición. Adicionalmente, Hudleson y Hudleson establecen que es muy rara en rapaces salvajes (no reportado) en climas fríos, y ellos lo han observado personalmente en halcones Harris captivos en climas fríos, como en OntarioCanada. Chitty sugiere que la enfermedad puede ser originada en una vasculitis resultante de una infección o toxina y nota un aumento de alfa globulina, con disminución de beta y gamma globulinas en el curso de la enfermedad, progresando con un aumento en todas las fracciones de proteínas en los últimos estados. La figura de ocho en vendas, se usa comúnmente en la medicina de rapaces, pero otros han reportado edema de la punta del ala posterior a la colocación de vendas con la figura de ocho hermético, sobre el ala de un guacamayo. El edema y necrosis de la punta del ala es una condición que resulta de una disminución del suplemento sanguíneo en la porción distal del ala. Existen varios factores que predisponen al ave a esta condición y es más común en aves rapaces en cautiverio durante periodos fríos o tiempos helados; sin embargo, la etiología exacta es aún desconocida. Forbes sugiere que halcones jóvenes (1er. año) con peso bajo y con menos desarrollo del suplemento sanguíneo de la parte distal del ala o posible Sin considerar la etiología, las rapaces presentan usualmente alas caídas, inflamación y edema de la parte distal del ala. Finalmente la condición progresa a gangrena seca, a menos que se trate en forma temprana en el curso de la enfermedad. Antibióticos de amplio espectro, masaje del área afectada, aplicación de Preparación H, Isoxsuprime (vasodilatador), han sido recomendados como posible opción de tratamiento para aves rapaces que presentan esta condición. mezclados con fibrina, leucocitos y trombocitos. Necrosis de la extremidad distal La necrosis de la extremidad distal es una afección gangrenosa, como resultado de una disminución o pérdida del suplemento sanguíneo periférico de una extremidad (el pie completo, o dedos individuales), que a menudo implica la amputación del dedo afectado o posible eutanasia. La necrosis distal de las extremidades en aves rapaces puede estar asociada con una descamación extensa (sarna) relacionada con una infección por virus pox o por una congelación. Sin embargo, el traumatismo y otras condiciones cardiovasculares (arterioesclerosis, endocarditis valvular e isquemia del miocardio), vasculitis o enfermedad embólica pueden predisponer a esta condición en aves rapaces. En humanos, la alteración de la microcirculación en las extremidades debida a poliarteritis y enfermedad microembólica, puede inducir a una necrosis distal. Samour describe necrosis avascular de la porción distal del tercer dedo en halcones en el medio Oriente, asociada a cambios cardiovasculares y cesación súbita del ejercicio. La presente revisión la integran 116 referencias. 6 AVICULTURA MASTITIS EN VACAS LECHERAS REVISIÓN DE LITERATURA Roy José Andrade Becerra - DMV, Esp, MSc, PhD 1 INTRODUCCIÓN La mastitis es la inflamación de la glándula mamaria. En general en las vacas es causada por bacterias que entran dentro del canal del pezón y se trasladan al tejido glandular de la ubre. Las bacterias se multiplican y causan una infección donde el resultado es la inflamación de la ubre y se conoce como mastitis (NMC, 2014). PRINCIPALES TIPOS DE MASTITIS zones en soluciones desinfectantes y los tratamientos de vaca seca. Mastitis contagiosa o mastitis producida por gérmenes asociados a la vaca Streptococcus dysgalactiae es un germen productor de mastitis que se encuentra en el medio ambiente y puede vivir en casi cualquier lugar: en el rumen, en las heces, en el alimento, en las instalaciones y en la ubre; son moderadamente susceptibles a los antibióticos y pueden ser controlados con saneamiento adecuado. Se pueden prevenir mejorando los procedimientos en el ordeño: buena higiene de la ubre, ordeñar pezones limpios y secos, no permitir que las pezoneras se resbalen durante el ordeño, sumergir los pezones en una solución germicida efectiva, mantener la rutina de ordeño, eliminar las infecciones intramamarias y hacer secado de todos los cuartos con antibióticos, con productos diseñados específicamente para vaca seca; se deben tratar las vacas con infecciones crónicas. Las bacterias que causan este tipo de mastitis viven la mayoría de las veces en el interior de las ubres o en la piel del pezón. Las vacas sanas se contagian a partir de vacas infectadas. Las principales bacterias causantes de mastitis contagiosas son el Staphylococcus aureus y el Streptococcus agalactiae (Graeme, 2013). La trasmisión de estas bacterias entre vacas y entre cuartos, suele ocurrir en el momento del ordeño por contacto con leche infectada. Esta propagación puede ocurrir por salpicaduras o pequeñas gotas de leche que se convierten en aerosoles, o por las manos contaminadas de los ordeñadores o fundas de pezoneras contaminadas. Staphylococcus aureus puede invadir el tejido de la ubre y vivir dentro de las células (Ryan et al., 2010). Estos microorganismos a menudo forman focos de infección (microabcesos) que se protegen muy bien de la acción de los antibióticos por tejido de cicatrización. La tasa de curación para este tipo de mastitis es muy baja; las mastitis por Staphylococcus muchas veces se convierten en crónicas y las vacas tienen que ser sacrificadas. Streptococcus agalactiae es la mayor causa de mastitis en Colombia (Andrade et al., 2012); es una bacteria muy sensible a la penicilina y esto hace que su tratamiento sea relativamente fácil y su tasa de curación muy alta. Esta bacteria tiende a localizarse en zonas del conducto de la ubre, donde los antibióticos son altamente eficaces. Este tipo de mastitis puede ser erradicada con buenas prácticas de control de mastitis, incluyendo la inmersión de los pe- Mastitis ambiental o mastitis producida por gérmenes que se encuentran en el medio ambiente Las bacterias que causan la mastitis ambiental se han encontrado en los alrededores de la vaca: suelo, estiércol, cama, salas de parto, agua, y los otros sitios de la vaca que no son la glandula mamaria. El riesgo es más grande cuando las vacas están estabuladas, que cuando las vacas están en pastoreo. Las principales bacterias son Streptococcus uberis, Pseudomona sp y E. coli (Malmo et al., 2009). Estas bacterias no están particularmente adaptadas a la vida en la ubre lactante y con frecuencia estas infecciones no persisten. La mayoría de los casos de mastitis ambiental coinciden cuando las vacas entran en periodo de parto, bien en preparto o semanas después del parto, cuando las vacas son muy susceptibles a infección debido a que sus mecanismos de defensa natural son bajos. Los altos números de bacterias causantes de mastitis ambiental pueden contaminar los cuartos, sobre todo si las ubres están húmedas y expuestas a barro y estiércol. Esto es muy común si las vacas están en el suelo en el momento del parto. La contaminación del medio ambiente se puede producir por introducir tubos intramamarios no estériles o cuando no se desinfecta correctamente la punta del pezón, en el momento de aplicar la droga para secar. La mayoría de estos casos se presentan en lactancia temprana y a menudo se manifiestan como mastitis clínica aguda. CONTROL DE LA MASTITIS MEDIOAMBIENTAL Prevención: Reducir el número de bacterias a las que los pezones se exponen. El entorno de las vacas debe ser lo más limpio y seco posible; las vacas no se deben exponer al estiércol, al barro o a piscinas de agua estancadas; el entorno de la vaca debe ser tan importante como el medio ambiente que rodea la vaca en periodo de lactancia. Las áreas de parto deben estar Fig. 1 Las mastitis ambientales son aquellas que se producen por gérmenes cuyo hábitat es el medio ambiente que rodea a los animales. Profesor Titular Universidad Pedagógica y Tecnológica de Colombia -Tunja. Facultad de Ciencias Agropecuarias, Escuela de Medicina Veterinaria y Zootecnia 7 BOVINOS Referencias para consultorio MV x Ed. 39 - 10/2014 Ed. 39 - 10/2014 Referencias para consultorio MV x limpias, los puestos de los animales deben estar correctamente diseñados, la población bacteriana del medio ambiente depende de los nutrientes desperdiciados, humedad y temperatura. Camas con materiales inorgánicos son bajas en recuentos bacterianos, como piedra caliza o arena, los cuales son bajos en nutrientes y humedad. Camas con material orgánico como aserrín, viruta, estiércol reciclado, mazorca de maíz picada, cascaras de semillas o paja picada, contienen altos recuentos bacterianos. Para controlar la propagación de mastitis contagiosa, son importantes los selladores de pezones, la inmersión del pezón en una solución germicida y ejercer control sobre coliformes. Los selladores no permiten reinfecciones con coliformes, pero no son tan eficaces contra Streptococcus. Los intentos por controlar mastitis medioambientales durante el periodo seco utilizando germicidas o selladores de barrera, no han tenido éxito. Tratamiento al secado: Se recomienda hacer tratamientos para vaca seca en todos los cuartos. Mantener un medio ambiente limpio especialmente en los primeros momentos de vaca seca, controla especialmente Streptococcus, pero tiene poco o ningún valor para coliformes. Preparación de la ubre: Se deben tener ubres limpias y secas y pezones limpios y secos, listos para ser ordeñados. Lave pezones, pero no lave ubres. Los pezones deben estar limpios y secos antes de colocar la máquina de ordeño; al ordeñar pezones húmedos, tal vez se aumente la probabilidad de mastitis. Se deben utilizar toallas de papel desechables para secar. Los pezones se deben sumergir en solución de desinfección para presellado; el contacto con el desinfectante debe ser mínimo de 30 segundos para matar microorganismos; si no se deja un buen tiempo de contacto, se puede estar perdiendo la inversión en el presellado. Luego se seca el desinfectante con una toalla desechable; se debe secar bien el presellador, pues pueden aparecer residuos en la leche. El presellador es importante porque reduce considerablemente la presentación de casos de mastitis. Al final del ordeño se debe aplicar el sellador de pezones. Sumergir los pezones en una solución germicida reduce en un 50% la mastitis ambiental durante la lactancia. Máquina de ordeño: La máquina de ordeño se debe mantener y operar correctamente, pues el mal funcionamiento de ésta, resulta en frecuentes resbalamientos de las pezoneras, y los impactos en la punta del pezón aumentarán la incidencia de mastitis por gérmenes ambientales. Se debe colocar la unidad de ordeño de pezones, donde la admisión de aire sea mínima y su ajuste prevenga el deslizamiento. Si se permite impacto de aire, la unidad puede causar la propulsión de microorganismos de un pezón infectado a uno no infectado; esto también puede ocurrir cuando suspendemos una pezonera antes que las demás. Las unidades se deben retirar solo después de que el vacío se apague. Esto se logra con el uso de válvulas de vacío, e impide los impactos de leche en la punta del pezón y la inyección de microorganismos. El retrolavado se ha desarrollado para desinfectar los revestimientos durante el ordeño (Boughton et al., 2006). La mayoría de unidades en el mercado tienen 4 o 5 ciclos; el primer ciclo es un enjuague con agua, seguido de un enjuague con yodo o soluciones desinfectantes similares, luego un enjuague con agua limpia y después un ciclo de aire seco. Las investigaciones muestran que el retrolavado reduce el número de bacterias en los revestimientos, pero no reduce el número de bacterias en los pezones. El retrolavado puede detener la propagación del contagio de microorganismos, pero no tiene ningún efecto sobre los patógenos ambientales que se encuentran entre ordeños. Mientras que la inmersión de los pezones es eficaz contra todos los organismos de mastitis, especialmente Staphylococcus aureus y Streptococcus agalactiae, hay controversia de su efecto sobre E. coli y Streptococcus uberis, pues estos patógenos se encuentran en el entorno de la ubre. Nutrición: Una nutrición adecuada reducirá el riesgo de mastitis medioambiental. Los niveles adecuados de vitamina E y Selenio reducen la incidencia de mastitis del medio ambiente. Hay reportes contradictorios sobre el efecto de Vitamina A y el Betacaroteno sobre la salud de la ubre. Algunos estudios indican que el cobre puede desempeñar un papel en el mantenimiento del sistema inmune. Las investigaciones sobre el papel de las vacunas es prometedor (Philphot, 2014). Manejo: Los procedimientos adecuados de ordeño son importantes para la prevención de la mastitis y para asegurar una completa extraccion de la leche de la ubre. Los movimientos de la vacas se debe hacer en forma tranquila y de manera suave. Si las vacas están asustadas o son apresuradas, 8 BOVINOS el proceso de bajada o eyección de leche puede ser molesto, así que se debe evitar el manejo brusco de los animales. Detección de la mastitis El ordeño puede empezar con un chequeo de todos los cuartos (Lotthamer, 2004). Cualquier vaca que muestre mastitis clínica o subclínica debe ser examinada, y debemos adoptar las medidas apropiadas. Se debe hacer control visual de cuartos inflamados. Formas de mastitis Las formas y los signos de mastitis varían, dependiendo de las bacterias causantes de la infección y la respuesta inmune de la vaca hacia las bacterias. La mayoría de los casos de mastitis ambientales son clínicos (en todas sus formas), pero también pueden ocurrir casos subclínicos. Los casos de mastitis causadas por Staphylococcus aureus, se pueden encontrar en las diversas formas de mastitis. Streptococcus agalactiae no produce mastitis gangrenosa, pero se puede manifestar en cualquiera de las otras formas. Importancia del control de la mastitis Los compradores nacionales e internacionales de productos lácteos exigen cada vez mayor calidad (Bramley et al., 2013). Para que los productores lecheros puedan satisfacer a los compradores, deben controlar la mastitis. El mayor beneficio económico se puede lograr a partir de una mayor producción, pago más alto por leche de calidad, y reducción en los costos de tratamiento y por sacrificio. Al disminuir los casos clínicos por mastitis, se disminuye el riesgo de contaminación con antibiótico tanto en carne como en leche, o subproductos. Pérdidas económicas Las pérdidas económicas por mastitis se calculan en 150 dólares al año por vaca en Colombia y se asume el mismo precio de la leche para todas las vacas, y este valor se multiplica por el número total de vacas en ordeño (5.5 millones de cabezas); el costo anual total de la mastitis es de unos 825 mil millones; esto es aproximadamente el 10% del valor total de las ventas de leche en finca, y aproximadamente dos terceras partes son debido a una menor producción de leche en las vacas con infección subclínica. Tabla 1. Presentación de diferentes formas de mastitis. Forma de mastitis Vaca Ubre Tabla 3. Ahorro estimado anual de un programa efectivo en el control de la mastitis (por vaca anualmente en dólares) Leche Mastitis clínica severa Extremadamente enferma Puede convertirse Aparentemente la vaca y deprimida; puede morir en gangrenosa está normal, aunque obviamente la vaca está enferma, pero la leche pronto se convierte en anormal; a menudo la leche es acuosa y se muestran manchas de sangre Mastitis clínica aguda Puede o no estar enferma Caliente, hinchada Anormal y puede ser de y dolorosa colorada y contiene la formación de coágulos y/o sangre Mastitis clínica No se observan cambios Muestra pequeños Se ven las anormalidades cambios Mastitis clínica leve No se observan cambios No muestra anormalidades Pequeños coágulos o escamas se producen en la leche Mastitis crónica No se observan cambios Se pueden sentir protuberancias Cambios leves hacia leche acuosa Mastitis subclínica No se observan cambios No se observan cambios No se observan cambios; los cambios son severos en la composición de la leche Fuente: Andrade-Becerra R.J., 2014. Otras pérdidas se deben a descarte de leche, leche anormal por vacas tratadas con antibióticos, costos por vacas que deben ser reemplazadas por mastitis no curables, costos de medicamentos, costos de servicios veterinarios, costos en la mano de obra, etc. En estas estimaciones no están incluidos los costos adicionales derivados de la mastitis, asociados a problemas relacionados con residuos de antibióticos en la leche para consumo humano, como costos en control de calidad, fabricación de productos lácteos, calidad nutricional de la leche, degradantes de la leche como bacterias, y presencia de altos contenidos de células. Cuando se analizan los costos para el control de la mastitis, se debe considerar en primer lugar el costo de la producción perdida. Pérdidas calculadas anualmente para control de mastitis: 117 + 20 = 137 dólares por vaca, que no retornan al productor. Se debe considerar también cuánto se ahorra el productor cuando implementa un programa de control de mastitis efectivo. El programa de control aumenta la producción de leche y compensa fácilmente los gastos. Tabla 2. Pérdidas anuales estimadas, debidas a mastitis. Causa de la Pérdidas por Porcentaje perdida vaca total Reducción en la producción 112 74.66 Costos de reemplazos 23 15.33 Leche descartada 5 3.33 Tratamientos 4 2.66 Servicios veterinarios 3 2.00 Mano de obra 2 1.33 Imprevistos 1 0.66 150 100.00 Total Fuente: Andrade-Becerra R.J., 2014 Efecto de la mastitis en la producción, composición y calidad de leche La mastitis reduce la producción y altera la composición de la leche. La magnitud de La presente revisión la integran 10 referencias. 9 BOVINOS Reducción en la producción 112 Leche descartada Total 5 117 Fuente: Andrade-Becerra R.J., 2014 Tabla 4. Costos para controlar mastitis (por vaca anualmente en dólares). Sellador de pezones 10 Medicamentos de secado 5 Papel para secar 5 Total 20 Fuente: Andrade-Becerra R.J., 2014 estos cambios varía con la severidad, la duración de la infección y el microorganismo causante en cada vaca individual. Casi siempre la mastitis es causada por bacterias. Estos microorganismos producen toxinas que pueden dañar directamente el tejido productor de leche de la glándula mamaria; la presencia de la bacteria inicia la inflamación dentro del tejido mamario, por un intento de éste, de eliminar el microorganismo invasor. La inflamación contribuye a la disminución en la producción de leche y es el principal responsable de los cambios observados en la composición de la leche de los cuartos de las vacas infectadas. En general, cambios en la composición implican un incremento en los componentes sanguíneos presentes en la leche y una disminución de los constituyentes normales de la leche. La Asociación para Mejorar el Hato Lechero (DHIA) de los Estados Unidos ha adoptado la puntuación de Recuento de Células Somáticas (RCS) que divide los conteos en 10 categorías de 0 a 9 y se conocen como puntuaciones lineales. Este programa determina el RCS de cada vaca ordeñada durante el mes y estima la puntuación lineal. Los puntajes lineales se pueden utilizar para estimar las pérdidas en producción. Las vacas con puntajes más altos producen menos leche. Las pérdidas en producción de vacas viejas son casi el doble de vacas de primera lactancia. Los RCS elevados casi siempre son debidos a infección intramamaria. Referencias para consultorio MV x Ed. 39 - 10/2014 Ed. 39 - 10/2014 Referencias para consultorio MV x PROLAPSO RECTAL EN UNA YEGUA REPORTE DE CASO Fréderic Climent Cot - DMV Phd 1 Luis Alfonso Gracia - DMV, MSc 1 RESUMEN Los prolapsos rectales no son frecuentes en caballos. Se clasifican en cuatro tipos principales, del I al IV, en los que cada designación creciente indica una mayor afectación de tejidos. En los tipos I y II puede aplicarse un tratamiento conservador, que tendrá más éxito cuanto más precozmente se inicie tras la aparición del prolapso. En algunos casos, puede ser necesaria una resección submucosa. En este artículo se describe un caso de prolapso rectal en una yegua de raza árabe y se analizan los diferentes aspectos del tratamiento necesarios para obtener un resultado satisfactorio. INTRODUCCIÓN El prolapso rectal es una patología poco frecuente en la clínica equina. Las principales causas del prolapso rectal en el caballo se asocian a patologías que cursan con tenesmo. Su diagnóstico y tratamiento deben ser precoces y eficaces, ya que en pocas horas pueden aparecer complicaciones severas que pueden incluso provocar la muerte del animal. CASO CLÍNICO Se describe el caso de una yegua pura raza Árabe de 17 años de edad, que fue hallada en el campo con prolapso de recto. Por ello fue referida con urgencia a la Unidad Equina del Hospital Clínico Veterinario de la Universidad Autónoma de Barcelona. En el examen clínico de ingreso, el animal se mostraba atento, en buen estado de carnes y las constantes vitales del animal estaban dentro de valores normales. En la exploración física del animal, destacaba el prolapso completo de la ampolla rectal, con la mucosa muy edematosa y congestiva. Por palpación rectal se diagnosticó un prolapso completo de la ampolla rectal de grado 2, sin implicación del colon menor. Se sedó al animal con una combinación de beta-2 agonistas y agonista/antagonista morfínico, y se realizó una anestesia epidural caudal, con una mezcla de xilacina 0.17 mg/Kg, lidocaína (5 ml) y suero salino fisiológico, hasta completar un volumen de 10 ml en total. Una vez alcanzada la analgesia se procedió a vaciar el recto y a reducir el prolapso, introduciéndolo manualmente en la ampolla rectal. Una vez reducido el prolap1 Figura 1. Aspecto del prolapso en el momento del ingreso del animal. so, para impedir que se volviera a prolapsar, se realizó una sutura en bolsa de tabaco alrededor del esfínter anal con ácido poliglicólico de 5 USP. La sutura se anudó de manera que fuera fácil deshacerla y reanudarla cuando fuera necesario. Se instauró un tratamiento antibiótico con trimetroprim/ sulfadiacina (30 mg/Kg BID per os) y antiinflamatorio con flunixín meglumine (1 mg/Kg BID iv). Durante los primeros días tras su ingreso y cada cuatro horas, se deshacía el nudo de la sutura, se introducía un enema de 200 ml de aceite mineral por sonda en la ampolla rectal y se vaciaba el recto de contenido fecal, de formamanual, Servicio de Cirugía Equina, Hospital Clínico Veterinario, Universidad Autónoma de Barcelona 10 EQUINOS a los 5 minutos de haber introducido el enema. Una vez vaciado se volvía a anudar la sutura de bolsa de tabaco y, para reducir el edema de la mucosa rectal, se introducían 200 ml de una solución sobresaturada de azúcar. Durante la hospitalización la yegua tomaba dieta laxante para facilitar la evacuación de las heces, consistente en grandes cantidades de salvado remojado, tres veces al día. Se realizó un examen coprológico por flotación en el que se hallaron huevos de grandes estróngilos, por lo que se desparasitó con ivermectina (200 mg/Kg per os). impactaciones o proctitis eosinofílica, pueden provocar también prolapso rectal. En el caso descrito, la causa inicial más probable para el desarrollo del prolapso es la parasitación intestinal por nematodos del género Strongylus spp. Las yeguas adultas parecen estar más predispuestas a padecer esta patología, aunque también se diagnostica en machos y puede ocurrir en animales de todas las edades. También parece haber una predisposición en aquellos animales con una pobre condición física. Figura 3. Sutura en bolsa de t abaco en el ano, con un nudo fácil de hacer y deshacer. A los tres días del ingreso se retiró la sutura de bolsa de tabaco para inspeccionar el estado de la mucosa rectal prolapsada, hallándose una parte de ésta necrosada. Se decidió reseccionar la parte de mucosa rectal necrosada en estación, y para ello se realizó una sedación y una anestesia epidural caudal. El tratamiento local posterior consistió en la aplicación de antibiótico en pomada (nitrofurazona) en el defecto de mucosa reseccionada, y enemas con agua y jabón neutro cada seis horas. Además se vaciaba el recto de forma manual, cada dos horas, previa aplicación de aceite mineral. También se continuó con la antibioterapia sistémica. Cinco días tras la resección de la mucosa, la yegua empezó a pasar heces por sí misma, sin que se prolapsara el recto. Cinco días más tarde se le retiró el antibiótico y se le dio el alta médica. La evolución tras el alta fue favorable, cicatrizó el defecto correctamente y tras la reintroducción a la dieta habitual, continuó pasando heces con la frecuencia y consistencia normal. DISCUSIÓN El prolapso rectal es poco frecuente en el caballo, si tenemos en cuenta la incidencia de problemas gastrointestinales o la frecuencia de aparición de esta patología en otras especies (ganado). Cualquier condición que cause tenesmo puede inducir al prolapso rectal, tales como diarrea, parasitismo, obstrucciones urinarias y distocia. Así mismo, ciertas patologías rectales como neoplasias, laceraciones de grado 2, El diagnóstico se hace en base a la historia y los hallazgos de la exploración. Para establecer un plan de tratamiento y poder dar un pronóstico, se ha categorizado el prolapso rectal en cuatro tipos. El prolapso rectal de grado 1 afecta a la mucosa y submucosa. Típicamente se presenta como una protuberancia edematosa y redondeada en el ano. Debido a la congestión venosa, con el paso de las horas la mucosa se vuelve friable y necrótica. El prolapso de grado 2 implica el desplazamiento de toda la pared de la ampolla rectal. Su apariencia es cilíndrica y mayor que el tipo 1, frecuentemente con aspecto de coliflor. Este es el aspecto que ofrecía la yegua tratada en este caso. El prolapso de grado 3 involucra, además de todo el recto, a la porción más terminal del colon menor, que sufre una invaginación. A la palpación resulta más firme y engrosado que el prolapso de grado 2. Finalmente, el prolapso de grado 4 es el resultado de una intususcepción masiva del colon menor a través del ano. En este caso puede palparse la unión mucocutánea entre el prolapso y el ano. La interrupción de la irrigación sanguínea colónica y mesocolónica hacen de este prolapso el más grave, pudiendo producirse una rotura visceral irreparable, peritonitis y muerte. El tratamiento del prolapso rectal implica identificar y tratar la causa primaria específica. En los prolapsos de grado 1 y 2, como el descrito en este caso, el tratamiento de elección es conservador y se resume en 4 puntos: 1. Disminuir el tenesmo. El uso de anestesia epidural no sólo ayuda a relajar las contracciones realizadas por el animal, sino que facilita la manipulación para reducir el prolapso e induce una 12 EQUINOS anestesia local, que puede ser utilizada en el caso de necesitar una resección de mucosa o para colocar una sutura. La elección de una combinación de lidocaína y xilacina, produce una buena analgesia durante un tiempo más prolongado, que el solo uso de anestésicos locales. Alternativamente, en el caso de no poder realizar una anestesia epidural, se puede recurrir a enemas de lidocaína. Algunos autores proponen la intubación nasotraqueal para controlar la presión abdominal. El uso de bloqueadores ganglionares autonómicos, como el bromuro de propantelina (0,014 mg/Kg IV), puede inducir cierto grado de relajación de la musculatura lisa colorrectal. 2. Disminuir la inflamación y el edema de la mucosa. Para este propósito se utilizan soluciones hiperosmóticas como manitol, glicerina o dextrosa al 50% o, en su defecto, una solución sobresaturada de azúcar. Sustancias lubricantes y emolientes también ayudan a proteger los tejidos. 3. Reducir el prolapso. Siempre que sea posible, la reducción manual del prolapso debe realizarse sin demora, para evitar la isquemia tisular y favorecer la reducción de la inflamación y el edema. Una vez reducido el prolapso es difícil que se mantenga reducido por sí solo, por lo que la colocación de una sutura en bolsa de tabaco alrededor del esfínter anal durante las primeras horas, resulta esencial en el tratamiento. En el caso descrito, esta sutura se realizó de manera que pudiera ser liberada y nuevamente anudada en cualquier momento. De esta manera, puede evitarse la constipación rectal, una complicación frecuente asociada a la colocación de una sutura de nudo permanente. 4. Facilitar el paso de heces. El control de la dieta y de la defecación son esenciales para el éxito en estos casos. Una dieta blanda, consistente en alimentos con alto contenido acuoso (hierba fresca), es la primera opción, que puede ser además complementada con la administración de sustancias laxantes (sulfato de sodio). En algunos casos puede ser necesaria la intubación naso- Referencias para consultorio MV x Ed. 39 - 10/2014 Ed. 39 - 10/2014 Referencias para consultorio MV x gástrica para sobrehidratación oral, o el uso de enemas rectales para ablandar las heces. En el caso descrito, la combinación de una dieta adecuada, los enemas rectales y el vaciado manual periódico del recto fueron suficientes para evitar un nuevo prolapso y la obstrucción rectal. 5. Incluso si el tratamiento conservador tiene éxito, en algunos pacientes el daño severo a la mucosa produce una necrosis tisular y deben desbridarse los tejidos desvitalizados. Dependiendo del tamaño y profundidad de las lesiones, puede dejarse cicatrizar por segunda intención, como en este caso, o realizar dos incisiones circulares y aposicionar los bordes sanos con sutura reabsorbible. Las resecciones de mucosa pueden tener como complicación la constricción y la estenosis de la luz rectal, con el consecuente riesgo de constipación rectal, o la infección local, que puede derivar en una fístula o un absceso submural. Por esta razón, el tratamiento coadyu- vante con antibióticos sistémicos y locales, así como antiinflamatorios, está siempre indicado. 6. En resumen, el diagnóstico precoz y la valoración de los tejidos afectados es necesaria para instaurar el tratamiento adecuado. El seguimiento intensivo de los casos es imprescindible durante los primeros días, hasta que el paciente es capaz de defecar por sí solo sin prolapsar el recto. El diagnóstico y tratamiento de la causa primaria evitará la recidiva del problema. BIBLIOGRAFÍA 1. 2. 3. 4. 5. Management of rectal injuries. M. C. Rick. Advances in Equine Abdominal Surgery. Veterinary Clinics of North America. Vol 5, 2. August, 1989. Rectal prolapse in a foaling mare. W.G. Blythman. The Veterinary Record. May, 1988. Focal eosinophilic proctitis with associated rectal prolapse in a pony. K.T. Gibso, et al. Australian Veterinary Journal, vol 79, 10. October, 2001. Clinical use of epidural xylazine in the horse. Ph LeBlanc y J.P. Caron. Equine Veterinary Journal. 22 (3) 1990. Standing rectal and tail surgery. R.M. Debowes. Standing Surgery. Veterinary Clinics of North America. VoI 7,3. December, 1991. 13 EQUINOS CONSIDERACIONES FARMACOLÓGICAS GENERALES EN LA FUNCIÓN RENAL EN CANINOS REVISIÓN DE LITERATURA Frank H. Suárez Sánchez - DMV, PhD 1 Juan David Samacá - DMV Arturo Anadón N. - DMV, PhD 2 RESUMEN El riñón es un órgano muy vulnerable por estar expuesto a una variedad de nefrotoxinas de naturaleza diversa; parte de su sensiblidad se debe a que recibe del 20 al 25% del gasto cardiaco, y excreta gran parte de los medicamentos a los que están expuestos los caninos. Normalmente estos fármacos se concentran en el riñón y la reabsorción del filtrado glomerular incrementa progresivamente la concentración de las nefrotoxinas intraluminales. INTRODUCCIÓN Para una buena prevención de la nefrotoxicidad, se requiere conocer los mecanismos patogénicos del daño renal, los factores de riesgo relacionados con el paciente y con los medicamentos, teniendo en cuenta las medidas preventivas y de vigilancia y la intervención temprana. Muchos fármacos pueden causar daño renal, que se genera por mecanismos comunes, que incluyen la alteración de la hemodinámica intraglomerular, la toxicidad de las células tubulares y la inflamación. Estos mecanismos patogénicos pueden dar lugar a un fallo renal agudo. El fallo renal agudo es una disminución rápida de la función renal que está asociada con alteraciones del volumen de orina, azoemia y modificación de la homeostasis bioquímica. En cuanto a la severidad, esta puede variar desde la azoemia asintomática hasta el fallo renal agudo que requiere en ciertas ocasiones el sometimiento del paciente a diálisis. Los fármacos pueden causar fallo renal agudo por tres mecanismos: pre-renal, intrínseco y obstructivo. El riñón al recibir del 20-25% del flujo sanguíneo total corporal es una vía importante de excreción de productos de desecho, así como es responsable de mantener el balance de líquidos y electrolitos. La distribución del flujo sanguíneo en el riñón no es uniforme; en cambio, la mayor parte de su flujo sanguíneo va a la corteza renal, mientras que menos del 10% de todo su flujo sanguíneo que recibe, va a la médula renal. El abundante flujo sanguíneo que recibe el riñón lo hace especialmente vulnerable a los efectos de las toxinas, y la disparidad del flujo sanguíneo renal hace a la médula renal susceptible al daño isquémico, y la corteza a las toxinas (Rieser, 2005). Los riñones son vulnerables, ya que excretan varios medicamentos, administrados en forma de sustancia farmacológica inalterada o sus metabolitos. El riñón posee varios rasgos que permiten el acúmulo de nefrotoxinas; está altamente vascularizado y el túbulo proximal renal presenta una gran superficie que le permite unirse a las nefrotoxinas y facilitar el transporte dentro del epitelio renal. La reabsorción del filtrado glomerular incrementa progresivamente a medida que aumenta la concentración de las nefrotoxinas intraluminales (Xiaoqing, 2002). Para una buena prevención del fallo renal agudo, se requieren conocer los mecanismos patogénicos del daño renal y los factores de riesgo relacionados con el paciente y los medicamentos. La mayoría de fármacos que causan nefrotoxicidad (Tabla 1) producen sus efectos tóxicos por uno o varios mecanismos patogénicos. Estos incluyen la alteración de la hemodinámica intraglomerular, la toxicidad de las células tubulares y la inflamación. El conocimiento adecuado de los fármacos y sus respectivos mecanismos patogénicos implicados en el daño renal es crítico para conocer y prevenir la posible nefropatía inducida por los mismos (Naughton, 2008). 1 2 Profesor Farmacología y Toxicología Universidad de La Salle - Facultad de Ciencias Agropecuarias Catedrático Departamento de Toxicología y Farmacología - Universidad Complutense de Madrid - Facultad de Veterinaria 14 FARMACOLOGÍA Referencias para consultorio MV x Ed. 39 - 10/2014 Ed. 39 - 10/2014 Referencias para consultorio MV x ALTERACIÓN DE LA HEMODINÁMICA INTRAGLOMERULAR estar expuestas a elevadas concentraciones de tóxicos (Grauer, 1996). El riñón mantiene o autorregula la presión intraglomerular modulando el tono de las arterias aferentes o eferentes para preservar la tasa de filtración glomerular y la producción de orina. Por ello, en pacientes con hipovolemia, la perfusión renal depende de la cantidad de prostaglandinas circulantes que serán responsables de la vasodilatación de las arteriolas aferentes, permitiendo así un mejor flujo sanguíneo hacia el glomérulo. Igualmente, la presión intraglomerular se mantiene por la acción de la vasoconstricción mediada por la angiotensina II. Los fármacos con actividad antiprostaglandinas (AINES) o aquellos que tienen actividad antiangiotensina II (inhibidores de la enzima convertidora de angiotensina, ECA), o los bloqueantes de los receptores de angiotensina, pueden interferir con la capacidad de los riñones para autorregular la presión glomerular, llevando así a la disminución de la tasa de filtración glomerular. Otros medicamentos como los inhibidores de la calcineurina (por ejemplo, la ciclosporina) causan una vasoconstricción dosisdependiente de las arteriolas aferentes, lo que origina una disfunción renal en pacientes de riesgo (Naughton, 2008). Inflamación Toxicidad de las células tubulares La corteza renal es especialmente susceptible a la exposición de tóxicos, ya que recibe el 90% del flujo sanguíneo renal y contiene una amplia área de superficie endotelial en los capilares glomerulares. Dentro de la corteza renal, el túbulo proximal (segmento S3) y las células epiteliales del asa delgada ascendente de Henle, son los que se afectan más frecuentemente por el daño inducido por la isquemia o tóxicos, debido a su función en el transporte de solutos y sus elevadas tasas metabólicas (Grauer, 1996). Los fármacos que causan toxicidad de las células tubulares afectan la función mitocondrial, interfieren con el transporte tubular, incrementan el estrés oxidativo o favorecen la formación de radicales libres. Los fármacos asociados con este mecanismo patogénico incluyen los aminoglicósidos, anfotericina B, antiretrovirales y cisplatino (Naughton, 2008). Debido a que el agua y los electrolitos se reabsorben a partir del filtrado glomerular, las células epiteliales tubulares pueden Los medicamentos causan alteraciones inflamatorias en el glomérulo, en las células de los túbulos renales y en el intersticio adyacente, lo que conlleva a fibrosis renal. La glomerulonefritis es una condición inflamatoria causada principalmente por mecanismos inmunes. Los fármacos que han sido reportados como agentes causantes incluyen: hidralazina, interferón alfa, litio y AINES, entre otros. La nefritis intersticial aguda, que suele ser resultado de una respuesta alérgica a un determinado fármaco sospechoso, se desarrolla en una forma idiosincrática y no es dosis-dependiente. Los medicamentos que causan nefritis intersticial aguda, se piensa se unen a los antígenos en el riñón o bien actúan como antígenos que son a continuación depositados en el intersticio, induciendo así a una reacción inmune. De todas formas, no siempre se observan los síntomas clásicos de una reacción de hipersensibilidad (fiebre, eosinofilia, sarpullido). Una gran variedad de fármacos se han visto implicados en este tipo de respuesta, incluyendo antibióticos (betalactámicos, quinolonas, sulfonamidas y vancomicina), antivirales (aciclovir, indinavir), diuréticos (tiazídicos), AINES, inhibidores de la bomba de protones (omeprazol) y antihistamínicos H2 (ranitidina) (Naughton, 2008). Fallo renal agudo Este proceso consiste en una disminución rápida de la funcionalidad renal asociada con alteraciones en el volumen urinario, azoemia y homeostasis bioquímica. En cuanto a la severidad, esta puede variar, desde una azoemia asintomática hasta un fallo renal agudo severo que requiere en ciertas ocasiones diálisis. Los medicamentos pueden causar tres tipos de fallo renal agudo: pre-renal, intrínseco y obstructivo. Fallo renal agudo pre-renal: La azoemia pre-renal ocurre cuando el flujo sanguíneo hacia el riñón disminuye, como puede ocurrir en la hipovolemia, en la hipotensión, o en el aumento a la resistencia vascular. La azoemia pre-renal se revierte rápidamente cuando se controla la causa subyacente (Langston, 2008). Los fármacos implicados en el fallo renal agudo pre-renal, incluyen los AINES e inhi- 15 FARMACOLOGÍA bidores de la ECA, entre otros. Los pacientes en riesgo son aquellos que ya tienen comprometido el flujo sanguíneo renal, como ocurre en el caso de: la estenosis bilateral de la arteria renal, la disminución del volumen circulatorio efectivo y el fallo cardiaco congestivo. En cuanto a los hallazgos en la orina, debido a que los riñones se encuentran relativamente bien pero su flujo sanguíneo es bajo, se caracterizan por volúmenes bajos de orina y de excreción de sodio, mientras que la osmolaridad es alta. Por ello, hay que evitar la administración de fármacos que usualmente son causantes de este proceso (Xiaoqing, 2002). Fallo renal agudo intrínseco: El fallo renal intrínseco ocurre cuando hay daño en el parénquima renal. El daño puede ser reversible o irreversible y puede abarcar a los glomérulos, túbulos, intersticio o vasculatura renal (Langston, 2008). La pérdida de más de dos tercios de la población de nefronas en el fallo renal, origina un déficit en la concentración urinaria y una disminución en la capacidad para mantener el estatus hídrico normal (Grauer, 1998). Los tipos de fallo renal agudo intrínseco son la necrosis tubular aguda y la nefritis intersticial aguda. Necrosis tubular aguda: La mayoría de los fármacos que causan esta necrosis se excretan por el riñón. Estos fármacos incluyen a los aminoglicósidos, anfotericina B y cisplatino. La combinación de cisplatino con aminoglicósidos podría ser más nefrotóxica que los fármacos usados por si solos. Los mecanismos de daño renal incluyen la toxicidad tubular directa, las alteraciones en la producción energética de las células, los radicales libres y el metabolismo anormal de los fosfolípidos, entre otros. Para la mayoría de fármacos que causan necrosis tubular aguda, el lugar diana de acción son predominantemente los primeros o últimos segmentos del túbulo proximal, aunque se conoce que otros segmentos pueden también sufrir un daño variable (Xiaoqing, 2002). Nefritis intersticial aguda alérgica: Este proceso se puede presentar con o sin manifestaciones sistémicas de una reacción de hipersensibilidad tales como fiebre, erupciones en la piel y artralgia. Los medicamentos implicados incluyen a: penicilinas, cefalosporinas, AINES, anfotericina B, diuréticos, ranitidina y omeprazol, entre otros. En la mayoría de casos, si se deja de administrar el medicamento causante, la nefritis revierte la nefritis intersticial aguda. Si la patología persiste, está indicada la terapia con esteroides (Xiaoqing, 2002). Fallo renal agudo obstructivo: Se presenta cuando hay una obstrucción del flujo de orina, desde el nivel de la pelvis renal hasta la uretra, o cuando la orina se filtra hacia los tejidos adyacentes y se reabsorbe (por ejemplo en la ruptura de la vejiga, el uréter o la uretra), aparece una azoemia post-renal (Langston, 2008). La obstrucción del flujo urinario asociada a fármacos ocurre en diversos lugares: en el interior de los túbulos o los uréteres, o en el exterior de los uréteres. Entre los fármacos implicados se incluye el metotrexato. El fallo renal puede ser reversible si se suspende la administración del fármaco, se hidrata adecuadamente al paciente y se alcaliniza la orina. En pacientes tratados con metotrexato, la alcalinización de la orina mediante el uso de bicarbonato sódico ayuda a prevenir la cristaluria y el fallo renal agudo (Xiaoqing, 2002). A pesar de la causa subyacente, la obstrucción uretral prolongada origina déficit de fluidos, con la consiguiente hipovolemia y disminución de la perfusión tisular. Los efectos adversos del gasto cardiaco y, por lo tanto, de perfusión de los tejidos, se exacerban por las alteraciones electrolíticas y ácido-base que aparecen en la obstrucción. Adicionalmente a la azoemia, la obstrucción uretral está asociada con la acidosis metabólica, la hiperkalemia, la hiperfosfatemia y la hipocalcemia (Rieser, 2005). Fármacos antiinflamatorios no esteroides (AINES) Se ha sugerido que los inhibidores de la COX2 disminuyen la inflamación, mientras que los inhibidores de la COX-1 son responsables de las reacciones adversas asociadas con el uso de los AINES, incluyendo la ulceración gastrointestinal y la disfunción renal. La isoforma de la COX-2 no es activa únicamente durante la inflamación, ya que bajo la ausencia del estímulo inflamatorio tiene también actividad basal en el riñón y en el cerebro (Stokes, 2004). No todas las COX-2 pueden ser inducibles, de hecho, existe evidencia de las COX-2 constitutivas en el sistema nervioso central, y se conoce que no todos los procesos fisiológicos pueden estar gobernados por la COX1 constitutiva. Por ejemplo, se conoce que la perfusión renal en la hipovolemia es responsabilidad de las prostaglandinas, pero estudios de hibridación llevados a cabo in situ han demostrado que tanto la COX-1 como la COX-2 están presentes en algunas especies en el riñón. De forma consecuente, asumir que los AINES específicos de la COX-2 no comprometen la hipovolemia en la respuesta renal, porque este es un proceso constitutivo, puede ser discutible (Livingston, 2000). La enzima COX-2 constitutiva se encuentra en diferentes partes del riñón. La administración de fármacos que son más selectivos de ésta enzima puede afectar de forma severa al riñón bajo las condiciones en que se encuentre en estrés (por ejemplo, deshidratación, perfusión disminuida u otro tipo de enfermedad) (Papich, 2008). En el riñón, las prostaglandinas tienen un papel importante en la modulación del tono de los vasos sanguíneos y la regulación del balance de agua y sales. El daño renal se presenta cuando se inhibe la síntesis renal de prostaglandinas. En los animales que presentan una disminución de la perfusión renal causada por la deshidratación, la anestesia, el estado de shock o la enfermedad renal preexistente, puede llevar a cabo a la isquemia renal. En los casos en que existe compromiso renal, dependerá de las enzimas COX-1 y COX-2 para que se sinteticen las prostaglandinas que autorregulan el metabolismo hídrico, la función tubular y el flujo renal (Papich, 2008). Bajo condiciones normales, los AINES tienen poco efecto sobre el riñón debido a que existe una relativa baja producción de prostaglandinas. Sin embargo, bajo la presencia de baja perfusión renal, la síntesis local de prostaglandinas vasodilatadoras está aumentada para proteger la hemodinámica glomerular y mantener un apropiado transporte tubular de fluidos y electrolitos; la inhibición de la síntesis de prostaglandinas por los AINES puede llevar al fallo renal por vasoconstricción y también a desordenes en los fluidos y electrolitos tales como la retención de sodio, la resistencia a los diuréticos, la hiponatremia y la hiperkalemia (Wen, 1997). En consecuencia, el fallo renal producido por los AINES se clasifica como pre-renal, 16 FARMACOLOGÍA y es el resultado de la disminución de la síntesis de prostaglandinas renales vasodilatadoras, lo que conduce a la reducción del flujo sanguíneo renal y de la tasa de filtración glomerular. Normalmente, el flujo sanguíneo renal no depende de estos icosanoides, pero los pacientes se vuelven susceptibles al fallo renal agudo si está reducido el flujo sanguíneo renal. La disminución en la excreción de sodio a la que sigue la reducción en la síntesis renal de prostaglandinas puede originar la elevación de la presión sanguínea sistémica, especialmente en pacientes de edad avanzada (Xiaoquing, 2002). La toxicidad de los AINES ocurre típicamente como resultado de una sobredosis, pero puede desarrollarse en pacientes bajo algunas condiciones que predisponen al daño renal agudo, dentro de las que se incluyen: la enfermedad renal preexistente, la edad avanzada, la enfermedad cardiovascular, la septicemia, la deshidratación, la fiebre, la hipovolemia, la hipotensión y la diabetes mellitus, entre otras. Un diagnóstico presuntivo de la insuficiencia renal aguda inducida por AINES se basa normalmente en la historia clínica, el examen físico y el análisis laboratorial. No existe una terapia específica para la insuficiencia renal aguda inducida por AINES, sino únicamente una terapia de soporte (Stokes, 2004). En el riñón normal, la filtración glomerular está en función del flujo sanguíneo glomerular, el balance de la presión a través de la pared capilar y la permeabilidad y superficie total de los capilares de filtración. Un adecuado flujo sanguíneo glomerular depende del gasto cardiaco, la vasodilatación arteriolar aferente mediada por prostaglandinas y la vasoconstricción arteriolar eferente mediada por la angiotensina II. Estos dos últimos factores son especialmente importantes en estados de fallo cardiaco, hipovolemia y enfermedad de los vasos renales, condiciones que son comunes en pacientes mayores. La terapia con AINES inhibe la ciclooxigenasa, con la consiguiente disminución de la producción de prostaglandinas y en consecuencia se disminuye el flujo arteriolar aferente con un descenso de la filtración glomerular. En cuanto a los fármacos inhibidores de la ECA, estos deprimen la angiotensina II y, por lo tanto, inhiben la vasoconstricción mediada por la ECA; ello disminuye la presión y la tasa de filtración glomerular. La Referencias para consultorio MV x Ed. 39 - 10/2014 Ed. 39 - 10/2014 Referencias para consultorio MV x reducción compensatoria en la resistencia vascular sistémica aumentaría el gasto cardiaco y el flujo sanguíneo renal, pero los pacientes de edad avanzada con reserva miocárdica limitada y depleción de volumen o hipovolemia debida a los diuréticos, no serían capaces de aumentar lo suficiente el gasto cardiaco, lo que daría lugar a una hipoperfusión renal. El efecto de la terapia combinada conllevaría a la disminución de la tasa de filtración glomerular, potencialmente agravada por el volumen de depleción o hipovolemia y la disfunción miocárdica (Adhiyaman, 2001). Fármacos inhibidores de la Enzima Convertidora de Angiotensina (ECA) En pacientes adultos, los AINES e inhibidores de la ECA son la principal causa de la insuficiencia renal aguda. Debido a que la depleción de sodio es un factor precipitante, la adición de un diurético aumenta el riesgo de fallo renal (Adhiyaman, 2001). También se ha reportado fallo renal agudo funcional en pacientes con estenosis de la arteria renal que recibían AINES e inhibidores de la ECA. En algunos pacientes que tienen estenosis de la arteria renal, la filtración glomerular puede ser muy dependiente de los efectos arteriolares eferentes de la angiotensina II. En estos pacientes, el fallo renal agudo es el resultado de la pérdida del tono vascular arteriolar eferente post-glomerular, y es reversible si se suspende la administración del fármaco. La tasa de filtración glomerular previa al tratamiento es la mejor predicción para el fallo renal agudo resultante del uso de los inhibidores de la ECA. Los factores de riesgo del fallo renal asociado con este tipo de fármacos, incluye la enfermedad arterioesclerótica difusa (con enfermedad renal unilateral o bilateral), la hipovolemia, el uso concomitante de AINES, el fallo cardiaco congestivo o la insuficiencia renal preexistente (Xiaoqing, 2002). Los fármacos inhibidores de la ECA se emplean en la hipertensión y en la disminución de la función del ventrículo izquierdo. Estos fármacos bloquean la conversión de angiotensina I en angiotensina II. La angiotensina II tiene un efecto vasoconstrictor en la arteriola eferente. Los fármacos inhibidores de la ECA pueden revertir este efecto vasoconstrictivo y disminuir la resistencia de las arteriolas eferentes; por medio de la dilatación de la arteriola renal eferente, se puede disminuir la tasa de filtración glomerular, lo que puede conducir un aumento moderado de los niveles séricos de creatinina. Estos cambios no son normalmente motivos suficientes para retirar la terapia de los fármacos inhibidores de la ECA. De todas formas, en situaciones especiales como en la obstrucción de la arteria renal, el gasto cardiaco bajo o la hipovolemia, puede aparecer una disfunción renal severa. En definitiva, el uso de AINES e inhibidores de la ECA es una causa común del fallo renal agudo. La combinación de AINES e inhibidores de la ECA puede originar fallo renal agudo como consecuencia de la disminución de la filtración glomerular por sus efectos combinados sobre el flujo sanguíneo renal. Los AINES inhiben la ciclooxigenasa, y por lo tanto se reduce la producción de prostaglandinas vasodilatadoras renales. Este fenómeno es especialmente importante en aquellos pacientes en que los efectos vasodilatadores renales dependen de las prostaglandinas. Los inhibidores de la ECA inhiben el efecto vasoconstrictor de la angiotensina II a nivel de las arteriolas eferentes y hace que el control de la filtración glomerular sea más dependiente de las prostaglandinas. Otros factores de riesgo para la insuficiencia renal como lo son la enfermedad renal preexistente, el fallo cardiaco congestivo, la edad avanzada y la hipovolemia, suelen incrementar el riesgo de disfunción renal durante el uso simultáneo de AINES e inhibidores de la ECA. No obstante, se debe de evitar en pacientes geriátricos que reciban inhibidores de la ECA sean tratados simultáneamente con AINES. Datos preliminares de los inhibidores selectivos de la COX-2 sugieren que esta afecta también a las prostaglandinas renales. Se ha reportado fallo renal como consecuencia de la administración de dosis elevadas de inhibidores de la COX-2 (Bouvy, 2003). Antibióticos aminoglicósidos Los antibióticos aminoglicósidos pueden causar fallo renal mediado por diferentes mecanismos, incluyendo la toxicidad directa sobre los túbulos renales, la nefritis intersticial alérgica y la cristalización del antibiótico en el interior de los túbulos renales. Los antibióticos aminoglicósidos pueden ser nefrotóxicos, así que en pacientes con disfunción renal deben ajustarse las dosis. La dosis ajustada tampoco garantiza una total seguridad. Los aminoglicósidos se 17 FARMACOLOGÍA excretan a través de la orina y son tóxicos directos de los túbulos proximales. Los aminoglicósidos no deberían administrarse si existe una insuficiencia renal. La nefritis intersticial alérgica es una reacción idiosincrática y puede ser un efecto adverso originado por varios fármacos. Aunque las penicilinas y cefalosporinas son reconocidas como agentes causantes, aunque también lo pueden causar otros antibióticos (Hewlett, 2004). Los aminoglicósidos son agentes bactericidas que son muy efectivos frente a infecciones bacterianas causadas por Gram-negativos. Los aminoglicósidos se administran por vía parenteral, se unen poco a la albumina plasmática, se excretan sin metabolizar por filtración glomerular y se reabsorben en el túbulo proximal (Oliveria, 2006). Aproximadamente el 10% del antibiótico administrado por vía parenteral se acumula en la corteza renal, originando daño del túbulo proximal, cambios estructurales y discapacidad funcional de la membrana plasmática, mitocondrias y lisosomas (Sassen, 2006). Una fracción de la carga filtrada del antibiótico se une a la megalina, un receptor situado en el borde del cepillo de los segmentos S1 y S2 del túbulo proximal, que a continuación lo transportan al interior de las células tubulares. El daño renal puede ocurrir en un número sustancial de pacientes que reciben aminoglicósidos, y si el fallo renal agudo ocurre o no, depende de la condición clínica del paciente y las interacciones con otros fármacos nefrotóxicos que se puedan administrar simultáneamente (Oliveira, 2006). Después de la filtración glomerular, los aminoglicósidos son selectivamente retenidos en las células epiteliales de los túbulos proximales, específicamente en los segmentos S1 y S2 del túbulo proximal, pero no en las partes distales de la nefrona (Sassen, 2006). Los aminoglicósidos interfieren con la síntesis de moléculas de energía, incrementando el riesgo de daño durante la isquemia renal. Sobre todo, la isquemia altera los lípidos de la membrana, reforzando la acumulación de los aminoglicósidos en las células de los túbulos proximales (Oliveira, 2006). La nefrotoxicidad inducida por los aminoglicósidos tiende a estar relacionada con la duración de exposición al antibiótico. Es- ta nefrotoxicidad se debe a que los aminoglicósidos se acumulan activamente en las células tubulares renales y en los lisosomas, en los que causan disrupción lisosomal (Merton, 2006). La gentamicina es el antibiótico más nefrotóxico de todos los aminoglicósidos, seguido en orden descendiente por latobramicina, amikacina, netilmicina y estreptomicina. Todos los aminoglicósidos pueden ser nefrotóxicos. La monitorización cuidadosa de los niveles séricos del antibiótico ayuda a evitar la nefrotoxicidad, aunque la nefrotoxicidad por los aminoglicósidos pueden ocurrir aun cuando se realice una adecuada monitorización (Sassen, 2006). Mientras que la gentamicina puede ser más nefrotóxico que otros aminoglicósidos, la incidencia de nefrotoxicidad con todos estos agentes requiere igualmente de cuidado y monitorización (Plumb, 2005). El mecanismo de nefrotoxicidad de este tipo de antibióticos es el daño tubular proximal, lo que origina la necrosis celular (Xiaoqing, 2002). Se han identificado los factores de riesgo de la nefrotoxicidad asociada con los aminoglicósidos. Estos incluyen la depleción de volumen, la disfunción renal, la edad avanzada, la terapia prolongada, la frecuencia de dosificación de los aminoglicósidos, la elevada concentración sérica de los aminoglicósidos y la interacción con otros posibles fármacos nefrotóxicos (Oliveira, 2006). La depleción de volumen conlleva a la disminución en el volumen de distribución de los fármacos nefrotóxicos y al menor flujo del fluido tubular. Un menor flujo tubular potencia la reabsorción tubular, el cual puede incrementar la concentración intratubular e intracelular de nefrotoxinas (Grauer, 1996). La nefrotoxicidad inducida por los aminoglicósidos se manifiesta clínicamente después de varios días de administración por un fallo renal no oligúrico con aumento progresivo de los niveles séricos de creatinina y disminución en la concentración urinaria. Sobre todo, los aminoglicósidos pueden causar aminoaciduria, glucosuria y aumento en la excreción urinaria de sodio, potasio, magnesio y calcio. En particular, se conoce que la hipermagnesuria dosis-dependiente ocurre rápidamente después de empezar la terapia, haciéndose reversible si esta se suspende. Sin embargo, no se han definido los mecanismos moleculares subyacentes que conllevan gasto de sodio, potasio, magnesio y calcio como respuesta al tratamiento con la gentamicina. El principal lugar de reabsorción tubular de sodio, son los túbulos proximales, reabsorbiendo aproximadamente dos tercios de la carga de sodio filtrada (Sassen, 2006). En ratas, la hiponatremia exacerba la nefrotoxicidad por gentamicina. La administración oral de sodio a estos animales tratados con gentamicina reduce las concentraciones de gentamicina en la corteza renal y la mortalidad. Los beneficios de la administración de sodio podrían deberse a la supresión de la actividad intra-renal y plasmática de la renina, la atenuación de la respuesta precoz de la renina-angiotensina y/o el incremento del volumen de distribución del fármaco nefrotóxico (Grauer, 1996). Por otro lado, el calcio y el magnesio compiten con la gentamicina por los lugares de unión de la membrana de fosfolipidos aniónicos, así que la unión y captación de la gentamicina en varios tejidos es proporcionalmente inversa a la concentración local de estos cationes divalentes. Los cationes divalentes también tienden a suprimir la producción y liberación de la hormona paratiroidea, lo que conlleva a una producción disminuida de fosfolipidos de membrana y, por lo tanto, al descenso en la unión de la gentamicina con las membranas celulares. De hecho, en ratas la suplementación dietética con calcio y magnesio protegen de la nefrotoxicidad inducida por la gentamicina (Grauer, 1996). Estudios en perros han demostrado que la restricción dietética de potasio exacerba la nefrotoxicidad por gentamicinca, posiblemente debido a que las células con depleción de potasio son más susceptibles a la necrosis. Un hecho importante es que el efecto adverso originado por la administración de dosis elevadas de gentamicina se caracteriza por el aumento en la excreción urinaria de potasio. Una mayor excreción urinaria de potasio puede dar lugar a la depleción de potasio (especialmente combinado con anorexia y/o vómito), e incrementar el riesgo de nefrotoxicidad por gentamicina (Grauer, 1996) El uso simultáneo de aminoglicósidos y otros fármacos potencialmente nefrotóxicos, ha demostrado incrementar el riesgo del 18 FARMACOLOGÍA daño renal asociado a los aminoglicósidos. De hecho, se han demostrado sinergias en estudios con humanos y animales. Los estudios clínicos han implicado en esta sinergia a una variedad de fármacos tales como cefalosporinas, anfotericina B, inhibidores de la ECA y cisplatino, entre otros (Oliveira, 2006). Los aminoglicósidos deben ser utilizados con precaución cuando se administran conjuntamente con otros agentes nefrotóxicos, entre los que se incluyen la anfotericina B, otros aminoglicósidos, cisplatino y vancomicina. Existe controversia acerca del uso concurrente de aminoglicósidos y cefalosporinas (Plumb, 2005). En perros, el uso concomitante de furosemida y gentamicina está asociado con una mayor severidad y riesgo de un fallo renal agudo. Probablemente, la furosemida potencia la nefrotoxicidad inducida por la gentamicina al generar deshidratación, reduciendo así su volumen de distribución, e incrementando su captación por la corteza renal (Grauer, 1996). La terapia inicial en la necrosis tubular aguda por los aminoglicósidos es básicamente de soporte, y consiste en suspender la administración del fármaco causante y de otros agentes nefrotóxicos, así como mantener el balance de los fluidos y electrolitos (Xiaoqing, 2002). Antineoplásicos La nefrotoxicidad constituye un efecto adverso inherente de algunos fármacos antineoplásicos. El cisplatino y carboplatino causan disfunción renal dosis-dependiente. Adicionalmente a los niveles elevados de creatinina y nitrógeno ureico en sangre, se presentan como efectos adversos comúnmente reportados, las anormalidades electrolíticas (hipomagnesemia e hipokalemia) (Kintzel, 2001). El fallo renal en pacientes oncológicos es un problema frecuente, y es de origen multifactorial. Muchos agentes antineoplásicos son potencialmente nefrotóxicos, y si hay daño renal subyacente o se emplean otros fármacos nefrotóxicos, puede aumentar el riesgo de aparición de nefrotoxicidad durante la quimioterapia. La nefrotoxicidad del cisplatino está claramente relacionada con la dosis. La insuficiencia renal puede prevenirse mediante la hidratación y la diuresis forzada (Ries, 1986). Referencias para consultorio MV x Ed. 39 - 10/2014 Ed. 39 - 10/2014 Referencias para consultorio MV x Cisplatino La nefrotoxicidad es el principal efecto tóxico dosis-limitante del cisplatino; la nefrotoxicidad se prolonga y es más severa con la dosificación repetida del fármaco. Su severidad ha llevado casi a abandonar el compuesto hasta que se descubrió que se podía manejar la nefrotoxicidad siempre que los animales se sometieran a la hidratación. La hidratación pre y post-tratamiento con solución salina intravenosa y la diuresis con manitol, reducen eficazmente la nefrotoxicidad del cisplatino, aunque puede aparecer toxicidad renal incluso después de la hidratación adecuada (Piccart, 2001). Los efectos adversos que aparecen en tejidos y órganos, principalmente la nefrotoxicidad, limitan su uso. En el cáncer testicular el cisplatino ha demostrado una de los mayores índices de curación (superior al 90%) (Pabla, 2008). El cisplatino es un agente quimioterapéutico que se emplea para tratar una variedad de procesos tumorales malignos. La nefrotoxicidad, es la toxicidad mejor conocida de este medicamento. Desafortunadamente, el mecanismo de nefrotoxicidad no está bien comprendido, aunque se han reportado muchas teorías (Barabas, 2008). El mecanismo de actividad antineoplásica del cisplatino no está completamente comprendido, pero se sabe que el cisplatino se une al ADN, originando la formación de enlaces cruzados inter e intracatenarios. Estos enlaces cruzados originan en el ADN alterado, la detención de su síntesis y replicación. En las células en división rápida, como las células cancerosas, la formación de enlaces cruzados puede inducir daño en el ADN. El ADN dañado levemente puede ser reparado, pero el daño in extenso del ADN lleva a la lesión irreversible y a la muerte celular. Algunos análogos del cisplatino, como el carboplatino, se han identificado con efectos adversos leves (Pabla, 2008). Actualmente, la diuresis salina es la forma mejor aceptada para prevenir esta nefrotoxicidad. En el perro, el cisplatino ha mostrado actividad frente al osteosarcoma, carcinoma de las células transicionales, carcinoma de las células escamosas, melanoma, mesotelioma, carcinomatosis y tumores de las células germinales. En el gato, el cisplatino no puede ser empleado, ya que produce edema pulmonar fulminante con las dosis estándar de uso. La parte recta del túbulo proximal es el lugar más activo de la secreción y también el más afectado durante el desarrollo de la nefrotoxicidad. En el perro, el cisplatino se distribuye inicialmente en todos los tejidos, aunque en la primera hora tiende a acumularse en el riñón, el hígado, el músculo y la piel. La localización hepática y renal es prolongada, con concentraciones elevadas en el tejido renal hasta los 12 días después del tratamiento. El efecto primario producido por el cisplatino en las células cancerosas, es la inhibición de la síntesis de ADN. Estudios in vitro han indicado que la interacción entre la molécula del cisplatino y el ADN, puede contribuir a la generación de radicales superóxido, causando toxicidad en las células cancerosas. La toxicidad por cisplatino ocurre en diferentes especies, incluyendo roedores (ratón y rata), perros y humanos. Esta nefrotoxicidad depende de la dosis y la duración del tratamiento, y es potenciada por el uso de nefrotoxinas tales como los antibióticos aminoglicósidos. En un estudio en pacientes humanos tratados con cisplatino en los que se evaluaron los efectos renales a largo plazo, se demostró que la disfunción renal podía ser no progresiva si no se administraba el agente. En este estudio, hubo aumento inicial de la creatinina y disminución de la tasa de filtración glomerular y del flujo renal plasmático tras el tratamiento, pero estos niveles se estabilizaron a los 12-24 meses después de suspender el tratamiento con cisplatino. Los cambios histológicos observados incluían la apoptosis y la necrosis. Esta toxicidad ocurre como resultado de la unión del cisplatino a grupos sulfidrilos en riñón, necesarios para la función enzimática y la depleción del glutatión intracelular. Las alteraciones fisiológicas que se han observado con el cisplatino son relativamente consistentes. El fallo renal es gradual y normalmente ocurre a los 3-5 días después de su administración. La tasa de filtración glomerular y el flujo plasmático renal disminuyen después de la administración del cisplatino (Barabas, 2008). Se reconoce que la prevalencia de la nefrotoxicidad del cisplatino es alta, y ocurre en aproximadamente un tercio de los pacientes sometidos al tratamiento con cisplatino. Clínicamente, la nefrotoxicidad del cispla- 19 FARMACOLOGÍA tino, con frecuencia se ve después de los 10 días de su administración, y se manifiesta con la reducción de la tasa de filtración glomerular, la elevación de la creatinina sérica y la reducción de los niveles séricos de potasio y magnesio. Por otro lado, no se entienden bien los efectos del cisplatino a largo plazo sobre la función renal, pero se cree que el tratamiento con cisplatino puede llevar a la reducción subclínica pero permanente de la tasa de filtración glomerular. La exposición de las células tubulares al cisplatino activa el complejo de las vías de señalización que conducen al daño de las células tubulares y a la muerte. Parece que se estimula la elevación de la respuesta inflamatoria, lo que conduce a continuación al daño exacerbado del tejido renal. El cisplatino también podría inducir daño en la vasculatura renal, que conduciria a la disminución del flujo renal y a la isquemia renal, contribuyendo así a la disminución de la tasa de filtración glomerular. Estos eventos juntos, culminan con la pérdida de la función renal durante el proceso de nefrotoxicidad que aparece con el tratamiento con cisplatino, desencadenando así el fallo renal agudo (Pabla, 2008). El daño del tejido renal en la nefrotoxicidad por el cisplatino, se caracteriza por la muerte de las células tubulares, siendo un rasgo histopatológico común. Bajo esta condición, la muerte celular se identifica en forma de apoptosis y necrosis. Es bien sabido que los túbulos renales son los lugares celulares de daño y muerte en la nefrotoxicidad por cisplatino. Investigaciones llevadas a cabo hace algunos años sugieren que los túbulos distales son el lugar primario de la apoptosis. Sin embargo, estudios recientes indican que las células de los túbulos proximales también sufren apoptosis en la nefrotoxicidad por el cisplatino (Pabla, 2008). El daño renal agudo está relacionado con una importante respuesta inflamatoria. En el caso de la nefrotoxicidad por cisplatino, se inducen citoquinas pro-inflamatorias y quimioquinas. De manera importante, la inflamación contribuye al desarrollo de daño del tejido renal y al fallo renal (Pabla, 2008). Otros antineoplásicos derivados del platino Carboplatino El carboplatino es un compuesto de platino de segunda generación que se desarrolló en un intento de neutralizar los efec- tos adversos del cisplatino, como son el daño renal, la neuropatía periférica y la ototoxicidad (English, 1999). El carboplatino es la alternativa más frecuente al cisplatino. Se ha demostrado que es menos nefrotóxico que el cisplatino y se puede administrar sin usar diuréticos salinos (Barabas, 2008). Otros fármacos antineoplásicos Metotrexato El metotrexato es un ácido antifólico que se ha usado en dosis altas, en el tratamiento de la leucemia linfocítica aguda y en dosis relativamente bajas en la artritis reumatoidea. Debido a que la excreción urinaria representa la vía principal de excreción a partir del organismo del metotrexato, este fármaco alcanza concentraciones elevadas en los túbulos renales hasta causar nefrotoxicidad. Diferentes estudios han reportado la farmacocinética y/o toxicocinética del metotrexato durante la disfunción renal, y ha mostrado que la nefrotoxicidad del metotrexato es causada por la exposición prolongada, más que por los niveles séricos alcanzados (Takeuchi, 2001). En la disfunción renal, el régimen de dosificación de los fármacos debe modificarse debido a que el fallo renal tiene influencias variadas en la farmacocinética y farmacodinámica. En general, la dosis del metotrexato disminuye proporcionalmente con el descenso de la depuración de creatinina, pero con cierta frecuencia se observan efectos adversos inesperados, tales como el incremento excesivo en su concentración plasmática y la nefrotoxicidad (Takeuchi, 2001). Debido a que el metotrexato se excreta principalmente por la orina, estos efectos pueden originar una alteración en el manejo renal. Entre los factores que posiblemente afectan el manejo renal del metotrexato, se han estudiado el cambio en los niveles de expresión de los transportadores que median el transporte tubular del metotrexato (Takeuchi, 2001). Por otro lado, el metotrexato puede producir fallo renal obstructivo, que puede ser reversible si se suspende la administración del fármaco, se realiza una adecuada hidratación del paciente y se alcaliniza la orina. En pacientes tratados con metotrexato, la alcalinización de la orina con bicarbonato sódico ayuda a prevenir la cristaluria y el fallo renal agudo (Xiaoqing, 2002). Antifúngicos La anfotericina B es considerada como el fármaco de elección en las infecciones fúngicas. A pesar de su espectro de actividad y el amplio uso clínico, con frecuencia aparece también nefrotoxicidad (Luber, 1999). La nefrotoxicidad asociada con la anfotericina B se caracteriza por el fallo renal agudo no oligúrico debido a la necrosis tubular aguda. Frecuentemente se acompaña de hipokalemia, hipomagnesemia y con menos frecuencia de hipernatremia, debido a la diabetes insípida nefrogénica (Bates, 2001). La anfotericina B produce daño renal probablemente debido a diferentes mecanismos. En la terapia con este fármaco, aparece de forma anticipada un incremento en la creatinina. Esto suele ser secundario a una vasoconstricción renal de la arteriola aferente. Adicionalmente, al daño tubular se produce hipokalemia e hipomagnesemia, y, probablemente la pérdida menos significativa de bicarbonato y aminoácidos. Investigaciones en perros, han sugerido que la nefrotoxicidad de la anfotericina B es causada por el aumento de la retroalimentación túbulo-glomerular. La retroalimentación tubulo-glomerular es un mecanismo intra-renal mediante el cual existe un aumento en el paso de solutos al túbulo distal, lo que origina la vasoconstricción de la arteriola aferente. La anfotericina B, posiblemente debido a sus efectos a nivel de las membranas biológicas, aumenta el paso de iones monovalentes al túbulo distal, causando vasoconstricción arteriolar aferente, o la liberación local de adenosina. Otros mecanismos sugeridos de nefrotoxicidad atribuidos a la anfotericina B son los efectos tóxicos directos a nivel de las arteriolas aferentes y los túbulos, y la vasoconstricción renal directa y sistémica. A los pocos minutos después de la administración intravenosa de la anfotericina B, se reduce el flujo sanguíneo renal y la producción de orina, a pesar de mantenerse la presión sanguínea sistémica. La hipoperfusión renal tiene un impacto en la médula renal, que está relativamente poco vascularizada. Eventualmente hay una pérdida de nefronas funcionales, y en individuos tratados con dosis elevadas durante un tiempo prolongado, puede ocurrir fallo renal significativo que requiere hemodiálisis. Sin embargo, debe tenerse en cuenta que puede existir una recuperación significativa de la función renal, hecho que se ha constatado desde los primeros días del tratamiento (Leniado, 2009). 20 FARMACOLOGÍA Los factores del riesgo de la anfotericina B incluyen el sexo, especialmente el masculino, las dosis diarias elevadas medias, el uso de diuréticos, de fármacos nefrotóxicos concomitantes (aminoglicósidos y ciclosporina), y la función renal anormal (Leniado, 2009). La manifestaciones clínicas de la nefrotoxicidad por anfotericina B incluyen la insuficiencia renal, la perdida de potasio urinario e hipokalemia, la perdida de magnesio e hipomagnesemia, la acidemia metabólica debido a la acidosis tubular renal tipo 1 (o distal), y la poliuria debido a la diabetes insípida nefrogénica. La azoemia secundaria a la anfotericina B es considerada como reversible, pero la incidencia de daño persistente es dosis-dependiente. Se ha documentado con claridad que la anfotericina B, induce pérdida de potasio renal y déficit de potasio relevante. El potasio y el magnesio deben ser monitorizados de forma rutinaria durante la terapia con anfotericina B ya que la depleción de estos electrolitos puede predisponer al paciente a reacciones adversas (debilidad generalizada, parálisis ascendente, disfunción neurológica y arritmias que amenazan la vida del animal). La acidosis tubular renal producida por anfotericina B es una manifestación común relacionada con su dosis, y generalmente es reversible a los pocos meses de terminar la terapia. Se presentan en todos los pacientes de manera casi invariable defectos en la concentración renal y poliuria y, ocurre precozmente en el transcurso de la terapia. Esta es generalmente reversible a los pocos meses de suspender la terapia (Leniado, 2009). Estudios en humanos y en animales muestran de manera convincente que la ingesta excesiva de sodio en la ingesta dietaría diaria, reducen notablemente la incidencia y la severidad de la nefrotoxicidad inducida por anfotericina B. En un estudio realizado en ratas alimentadas con sal, se demostró que se preservaba la perfusión renal y la tasa de filtración glomerular en comparación con las ratas alimentadas con agua. De todas formas, la carga con sal no previno el desarrollo de defectos tubulares, incluyendo la disminución de la capacidad para concentrar, la disminución de la acidificación y la pérdida de potasio en la orina. El mecanismo exacto por el que ocurre este efecto beneficioso, aún no ha sido esclarecido. En pacientes de bajo riesgo, el uso de la anfotericina B con carga profiláctica de cloruro de sodio se asocia con la disminución pequeña y reversible de la función renal. Teniendo en cuenta que los efectos Referencias para consultorio MV x Ed. 39 - 10/2014 Ed. 39 - 10/2014 Referencias para consultorio MV x Tabla 1.- Medicamentos potencialmente nefrotóxicos. Mecanismos de acción y de nefrotoxicidad. Mecanismo de acción Mecanismo de acción Fármaco Mecanismo de nefrotoxicidad Mecanismo de nefrotoxicidad AINES Inhiben la síntesis de COX-1 y COX-2 Inhiben la síntesis de COX-1 y COX-2, por lo que disminuyen la síntesis de prostaglandinas vasodilatadoras a nivel de la arteriola aferente Inhibidores de la ECA Bloquean la conversión de angiotensina I en angiotensina II Pérdida del tono vascular arteriolar eferente post-glomerular. La angiotensina II tiene un efecto vasoconstrictor en la arteriola eferente Antibióticos aminoglicósidos Efecto bactericida frente a bacterias gram-negativas. Se une de forma irreversible a la subunidad 30S ribosomal y se inhibe la síntesis proteica Necrosis tubular aguda Antineoplásico: Cisplatino Complejo del platino. Se une al ADN, originando la formación de enlaces cruzados inter e intracatenarios, que originan en el ADN alterado, la detención de su síntesis y replicación Necrosis tubular aguda y posible daño en la vasculatura renal, que genera isquemia renal Antineoplásico: Carboplatino Complejo del platino. Similar al cisplatino, genera enlaces cruzados en las hélices del ADN Fármaco mucho menos nefrotóxico que el cisplatino Antineoplásico: Metotrexato Fármaco antimetabolito. Antineoplásico e inmunosupresor antagonista del ácido fólico. Interfiere con los procesos de síntesis del ADN y ARN al inhibir la enzima folato-reductasa. También interfiere con la reparación y replicación del ADN. Fallo renal obstructivo por la posible formación de cristales Anfotericina B Se une al ergosterol de la membrana celular de los hongos, lo que origina poros que la hacen permeable a los componentes intracelulares esenciales Necrosis tubular aguda y vasoconstricción de la arteriola aferente vasoconstrictores de la anfotericina B son claramente dependientes de calcio, tiene sentido considerar como hipótesis que los antagonistas de los canales de calcio podrían reducir la nefrotoxicidad de la anfotericina B (Leniado, 2009). En un estudio realizado justo en el momento en que ocurría la nefrotoxicidad severa, se observó que esta estaba asociada con otros factores múltiples de riesgo tales como el incremento de la dosis acumulativa de an- fotericina B o la aplicación concomitante de un mayor número de agentes nefrotóxicos. Aquellos pacientes que recibieron terapia concomitante con ciclosporina estuvieron con un mayor riesgo (Luber, 1999). En algunas instancias, aparecía un aumento de la creatinina durante los primeros días de la terapia, mientras que en otros, esto tuvo lugar mucho tiempo después. Estos hallazgos pueden reflejar los dos mecanismos de nefrotoxicidad asociados a la anfo- tericina B, denominados vasoconstricción aguda temprana y efecto tubular agudo tardío (Luber et al, 1999.) En un estudio realizado por Luberet al (1999), se encontró que dosis elevadas y acumulativas de anfotericina B, y el uso concomitante de nefrotoxinas (aciclovir, aminoglicósidos, carboplatino, cisplatino, ciclosporina, furosemida y AINES, entre otros) estaban asociados con un riesgo mayor de nefrotoxicidad (Bates, 2001). CONCLUSIONES La presentación de casos de nefrotoxicidad asociada a fármacos o a sus interacciones entre ellos, es de relativa baja frecuencia, pero es importante conocer cuáles son los fármacos de riesgo para efectuar una adecuada terapia de soporte que permita mantener una apropiada perfusión renal. Es pertinente conocer la condición clínica del paciente al que se le va a administrar el fármaco o nefrotóxico, para determinar que no existan condiciones que lo predispongan a sufrir de daño renal. Los exámenes laboratoriales que nos indican el funcionamiento renal, son indispensables para determinar que no exista ningún tipo de fallo renal preexistente. Estos exámenes deberían incluir la medida de la úrea plasmática y de la creatinina. Es importante tener en cuenta, que en algunas ocasiones se debería optar por otra alternativa terapéutica cuando la funcionalidad renal está alterada y no permita la administración segura de los fármacos potencialmente nefrotóxicos. Es preciso monitorizar la función renal de manera cercana cuando comienza la terapia con fármacos potencialmente nefrotóxicos, para que dado el caso de que se presente el daño renal, este pueda ser reconocido de forma precoz y por ende, se pueda actuar inmediatamente y así evitar que el daño renal progrese. Se debe evitar el sobredosificar a los pacientes con fármacos potencialmente nefrotóxicos, así como prolongar la duración de la terapia, y administrar fármacos que puedan interactuar entre si y causar daño renal, o cuya administración concomitante aumente el riesgo de nefrotoxicidad. La presente revisión la integran 30 referencias. 21 FARMACOLOGÍA DERMATOFITOSIS EN PEQUEÑOS ANIMALES REVISIÓN DE LITERATURA Wendie Oriana Roldán Villalobos - DMV, Esp, MSc RESUMEN La dermatofitosis es una patología de la piel causada por hongos filamentosos y queratinofílicos denominados dermatofitos, que afectan a diversidad de mamíferos, incluyendo a humanos. Se dividen en tres géneros: Trichophyton, Microsporum y Epidermophyton. En perros y gatos se presentan con mayor frecuencia Microsporum canis, Microsporum gypseum y Trichophyton mentagrophytes. La transmisión ocurre cuando los animales entran en contacto con las artroconidias del hongo, presentes en los organismos infectados o en el suelo. Los signos clínicos se observan generalmente como zonas alopécicas circunscritas, con descamación y no pruriginosas. Felinos y caninos jóvenes suelen ser más sensibles. El examen microscópico directo de pelos y escamas, así como los cultivos fúngicos, son las pruebas diagnósticas de elección. El tratamiento instaurado debe incluir alternativas tópicas y sistémicas que garanticen una resolución exitosa del cuadro. INTRODUCCIÓN La dermatofitosis es una infección fúngica superficial, relativamente común en mamíferos, causada por hongos queratinofílicos de los géneros Mycrosporum, Trichophyton y Epidermophyton, siendo Microsporum canis el que se aísla con mayor frecuencia tanto en caninos como en felinos, en diversos lugares del mundo. La importancia de esta dermatopatía radica no sólo en su diagnóstico relativamente habitual, sino también en el hecho de ser una zoonosis relevante (Balda et al., 2007). La transmisión ocurre por contacto directo con pelos y costras contaminados, o a través de formas libres en el ambiente o en fómites (Ramadinha et al., 2010). En condiciones normales, la enfermedad se resuelve espontáneamente en 1-3 meses (Menelaos, 2006). Las infecciones suelen ser más frecuentes en animales jóvenes que en adultos, debido a que en estos últimos se desarrollan niveles de inmunidad más fuertes, resultado de las múltiples exposiciones al hongo (Chermette et al., 2008). Los signos clínicos se presentan como áreas alopécicas, regulares, circulares, con una fina descamación y tricorrexis en la periferia (Chermette et al., 2008). El grado de prurito es bajo o ausente. Gatos Persa y Angora y perros Yorkshire Terrier parecen ser más susceptibles a la dermatofitosis que otras razas (Cafarchia et al., 2004). El diagnóstico basado exclusivamente en los signos clínicos es poco fiable, teniendo en cuenta la variabilidad de los hallazgos dermatológicos y el riesgo de confusión con otras dermatopatías (Copetti et al., 2006). Técnicas como la Lámpara de Wood, el tricograma, los cultivos para identificar la especie del dermatofito y los exámenes histopatológicos son las que finalmente confirmarán el diagnóstico (Ramadinha et al., 2010). El tratamiento puede ser sistémico, tópico o una combinación de ambos. Como terapia tópica se recomienda el uso de enilconazol al 0,2%, miconazol al 2% y clorhexidina a concentraciones superiores al 2% (Menelaos, 2006). Antifúngicos sistémicos como griseofulvina, ketoconazol, itraconazol y terbinafina han demostrado ser útiles como opción terapéutica (Chermette et al., 2008). El lufenuron también ha sido reportado como posible tratamiento para la dermatofitosis (Ramadinha et al., 2010). GENERALIDADES La dermatofitosis es una micosis cutánea contagiosa, que afecta a gran variedad de mamíferos, incluyendo al hombre (Chermette et al., 2008). Es causada por hongos filamentosos denominados dermatofitos, los cuales se clasifican en tres géneros: Trichophyton, Microsporum y Epidermophyton, de acuerdo con la formación y morfología de sus conidias (estructuras de reproducción asexual). Estas especies se dividen a su vez en zoofí- licas, geofílicas y antropofílicas, dependiendo de su hábitat primario (animales, suelo o humanos, respectivamente) (Peres et al., 2010). Del género Microsporum, la especie M. canis es zoofílica, afectando principalmente a felinos, caninos, equinos, roedores y humanos. M. equinum es también zoofílico (equinos, felinos y caninos) al igual que M. nanum (porcinos y humanos) y M. persicolor (caninos, felinos y roedores). M. gypseum es geofílico y sus huéspedes son felinos, caninos, equinos y humanos (Menelaos, 2006). 23 PEQUEÑOS ANIMALES Microsporum canis es altamente predominante en gatos (90%), y menos frecuente en perros (70-80%) (Chermette et al., 2008). En lo que respecta al género Trichophyton, las especies T. equinum (equinos, caninos, felinos y humanos), T. erinacei (erizos, caninos, felinos y humanos), T. mentagrophytes (caninos, felinos, roedores y humanos) y T. verrucosum (bovinos, ovinos y humanos), son todas de tipo zoofílico (Menelaos, 2006). Referencias para consultorio MV x Ed. 39 - 10/2014 Ed. 39 - 10/2014 Referencias para consultorio MV x Las zoonosis más frecuentes son causadas por M. canis, T. mentagrophytes y T. verrucosum, y en menor medida por M. gypseum y M. persicolor (Chermette et al., 2008). La aparición de dermatofitosis puede variar dependiendo de las condiciones ambientales, siendo más recurrente en climas cálidos y húmedos (Scott et al., 2001). Variables como: (1) la composición y estructura de las queratinas, (2) los requerimientos y mecanismos enzimáticos de los diferentes dermatofitos o (3) la existencia de genes específicos responsables de la patogenicidad y los sistemas de defensa de los hospederos, podrían explicar las diversas presentaciones de esta micosis entre especies, así como la distribución de las lesiones en los organismos afectados (Chermette et al., 2008). PATOGÉNESIS Los animales adquieren la dermatofitosis al entrar en contacto con las artroconidias del hongo, presentes en los organismos infectados o en el suelo. Estas se adhieren a las células del estrato córneo, formando hifas que lo invaden (Menelaos, 2006). Las hifas penetran el pelo en fase anágena, y se extienden a lo largo del tallo piloso (invasión endotrix), hasta alcanzar la queratina ubicada en la base, sin afectar la actividad mitótica (Menelaos, 2006). Las queratinasas y otras enzimas digieren la queratina, lo que permite que el hongo excave profundo en el estrato córneo (Copetti et al., 2006). La invasión se detiene cuando el pelo entra en fase telógena. Posteriormente, se produce la formación de masas de artroconidias esféricas e infectivas, que se ubican en la superficie del pelo (producción ectotrix), desencadenando una respuesta inflamatoria. En condiciones normales, la enfermedad se resuelve espontáneamente en 1-3 meses (Menelaos, 2006). El animal responde a la infección a través de respuesta inmune humoral y mediada por células (De boer et al., 1994; Sparkes et al., 1993). Los casos crónicos ocurren cuando el huésped es incapaz de generar una respuesta inmune apropiada, la cual depende del estado general del animal. Las enfermedades concomitantes como hiperadreno- Fig. 1. Artroconidias de M. canis. corticismo, leucemia felina o VIF, y el uso de algunos tratamientos, principalmente corticoides, pueden favorecer la aparición de la micosis o empeorar el cuadro ya existente, consecuencia del deterioro de los niveles de inmunidad (Chermette et al., 2008). Las esporas de M. canis en lugares contaminados pueden sobrevivir hasta por un año (Menelaos, 2006) Perros Yorkshire Terrier y gatos Persa y Angora, parecen ser más susceptibles a la dermatofitosis que otras razas (Cafarchia et al., 2004). La alta incidencia de micetomas dermatofíticos en gatos Persa, sugiere una posible predisposición genética (Zimmerman et al., 2003). Las infecciones por dermatofitos suelen ser más frecuentes en animales jóvenes que en adultos, debido a que en estos últimos se desarrollan niveles de inmunidad más fuertes, resultado de las múltiples exposiciones al hongo, más que por la edad en sí (Chermette et al., 2008). La valoración de los niveles de antígenos contra M. canis es importante para evaluar el estado del sistema inmune en casos crónicos, teniendo en cuenta que la respuesta inmune mediada por células, es esencial para la resolución del cuadro clínico y la adquisición de resistencia (Descamps et al., 2003; Moriello et al., 2003). Los gatos pueden desarrollar un estado de portadores, con ausencia de signos clínicos aparentes, lo que representa una fuente de contaminación considerable para los caninos (Menelaos, 2006). SIGNOS CLÍNICOS La dermatofitosis se manifiesta generalmente como áreas alopécicas (focales o multifocales) regulares, circulares, con una fina descamación, tricorrexis en la periferia y un patrón de propagación centrífugo (Chermette et al., 2008). El grado de prurito es bajo o ausente. Pueden observarse 24 PEQUEÑOS ANIMALES otras lesiones como foliculitis y furunculosis, semejantes a enfermedades autoinmunes, o lesiones tipo querion (profundas, nodulares, inflamatorias, supurativas, con o sin margen eritematoso). El diámetro generalmente es de 1-3 cm (Menelaos, 2006) y su ubicación típica es cara, cabeza y miembros (Wright, 1989). En la fase de curación, las lesiones se tornan suaves y brillantes, particularmente en las infecciones por Trichophyton. La onicomicosis es otra forma de presentación que afecta a las uñas, en la cual se observa paroniquia y onicodistrofia. Las contaminaciones bacterianas secundarias son bastante frecuentes. Los dermatofitos pueden ser aislados de piel y pelo de gatos aparentemente normales (Menelaos, 2006). Felinos En gatos, el M. canis es el responsable de más del 90% de los casos de dermatofitosis. Otras especies incluyen M. gypseum, M. persicolor, T. mentagrophytes y T. equinum (Richard et al., 1994). Las infecciones son más frecuentes en criaderos, por la alta densidad poblacional que dificulta el control del hongo, en intercambios de ejemplares para reproducción y exposiciones, y en gatos que permanecen en las calles. Las lesiones se expresan con más frecuencia en gatos jóvenes, localizándose en primera instancia en el puente nasal, márgenes auriculares externos, parte distal de los miembros posteriores y cola. Lesiones más extendidas y generalizadas se asocian a cuadros crónicos en animales débiles. En estos casos se observan amplias áreas alopécicas con exudación, prurito y costras. Otras manifestaciones clínicas incluyen la dermatitis miliar, un síndrome acompañado de inflamación, prurito y costras, localizadas usualmente en la parte dorsal del cuerpo, cabeza y cuello (Chermette et al., 2008), y los micetomas dermatofíticos (Black et al., 2001), una rara infección subcutánea en la cual la reacción granulomatosa involucra las hifas del dermatofito (Abramo et al., 2001). La raza Persa posee una clara predisposición (Abramo et al., 2001; Black et al., 2001). Las lesiones incluyen nódulos firmes (solitarios o múltiples), sin dolor a la palpación, situados en dorso y cuello. La piel que recubre los nódulos es oscura, sin alopecia ni eritema; puede ocurrir fistulización. La especie que se aisla con mayor frecuencia en los micetomas es M. canis (Chermette et al., 2008). Fig. 2. En gatos, el M. canis es el responsable de más del 90% de los casos de dermatofitosis. Caninos En caninos también predomina la especie M. canis como principal causante de dermatofitosis. Las lesiones son circunscritas, alopécicas, no pruriginosas y oscilan entre 10-40 mm (aisladas o múltiples). En perros jóvenes, pueden confundirse con foliculitis o demodicosis localizada, aunque la presencia de Demodex canis no debería descartar una infección concomitante con dermatofitos. En ocasiones pueden encontrarse queriones causados por T. mentagrophytes, M.canis, y menos frecuente por M. gypseum. La localización incluye puente nasal, márgenes auriculares y zona periocular. En casos más avanzados ocurre foliculitis supurativa. Pueden existir prurito y dolor a la palpación. La ubicación y el aspecto de las lesiones podría llevar a pensar en patologías autoinmunes, como el pénfigo foliáceo (Peters et al., 2007). Las infecciones crónicas pueden cursar con inflamación severa, prurito y alopecia generalizada (Chermette et al., 2008). sugestivas de dermatofitos. El uso de pruebas diagnósticas confirmará la presencia de dermatofitos. La lámpara de Wood es una herramienta útil, principalmente si se intenta determinar la presencia de Microsporum canis, aunque es de resaltar que sólo el 50% de estas infecciones fluorescen (Verde, 2005). Los pelos infectados con M. canis toman un color verde manzana bajo la lámpara. La fluorescencia acontece por una interacción entre la luz UV y el metabolito de M. canis presente en el pelo; esta reacción no ocurre con los elementos fúngicos presentes en las escamas. En etapas tempranas, se observa fluorescencia a lo largo de todo el pelo, y a medida que el proceso avanza, el color verde se observa más hacia la parte distal. Los pelos que se muestran fluorescentes deberían ser colectados para evaluación microscópica y cultivos que confirmen el diagnóstico. Entre las desventajas de la lámpara de Wood, se encuentran: (1) que las escamas contaminadas no muestran fluorescencia, (2) que algunos tratamientos tópicos destruyen la fluorescencia y (3) que las infecciones causadas por otros dermatofitos diferentes a M. canis no exhiben coloración (Chermette et al., 2008). Esta técnica no debe utilizarse para confirmar el diagnóstico (Menelaos, 2006). canis), una tracción directa (en dirección al crecimiento) de pelos fluorescentes bajo la lámpara de Wood, o un cepillado con cepillo de dientes estéril, en lesiones individuales o en animales sospechosos de ser subclínicos infectados (en los que debe cepillarse todo el cuerpo). En el examen microscópico se observa tricorrexis y racimos o cadenas de artroconidias. El tamaño de estas depende de la especie del dermatofito. El cultivo es la técnica ideal, ya que ofrece un diagnóstico definitivo y permite identificar la especie del dermatofito involucrado. Existen diversos medios de cultivo, pero el agar Sabouraud dextrosa suplementado con cicloheximida (para evitar contaminaciones), es el más recomendado para cultivos primarios (Chermette et al., 2008). La toma de biopsias cutáneas para estudio histopatológico es una herramienta extra para el diagnóstico de la dermatofitosis. Los hallazgos más comunes incluyen: (1) foliculitis y forunculosis (2) dermatitis hiperplásica intersticial o perivascular y (3) dermatitis pustular intraepidérmica (Chermette et al., 2008). En perros con cuadros clínicos por Trichophyton, puede encontrarse además acantolisis folicular, lo que se confundiría con pénfigo foliáceo (Peters et al., 2007). TRATAMIENTO La dermatofitosis es una enfermedad que requiere de la implementación de terapias prolongadas, además de un control adecuado de aspectos que tienen que ver con el paciente, otros animales involucrados, el ambiente y la cooperación de los propietarios (Verde, 2005). DIAGNÓSTICO Fig. 3. Los perros pueden sufrir de dermatofi-tosis a cualquier edad, pero es más frecuente en animales jóvenes. El diagnóstico de dermatofitosis basado exclusivamente en los signos clínicos es poco fiable, no sólo por la variabilidad en los hallazgos dermatológicos, sino porque existen una gran variedad de dermatopatías que asemejan las lesiones típicas de esta micosis, como la demodicosis y la foliculitis superficial (Copetti et al., 2006). La evidencia de contagio de otros animales y la presencia de lesiones en los propietarios (descamación, enrojecimiento, ocasionalmente vesículas y/o fisuras) (Menelaos, 2006), pueden ser El examen microscópico directo de pelos y escamas, así como los cultivos son pruebas diagnósticas fiables. La zona de la cual se va a obtener la muestra debe desinfectarse con alcohol al 70%, con el fin de eliminar detritus y disminuir el crecimiento de otros microorganismos contaminantes en el cultivo. La toma de la muestra va a depender en gran medida del aspecto y la localización de las lesiones. Puede efectuarse un raspado profundo de piel (útil también para descartar la presencia de Demo-dex 25 PEQUEÑOS ANIMALES Uno de los puntos más importantes a tener en cuenta es la duración total de las medidas terapéuticas. Se recomienda realizar cultivos mensuales durante el tratamiento y no detenerlo antes de obtener dos o tres cultivos negativos consecutivos. En caninos y felinos, la terapia tópica y sistémica debe mantenerse por al menos 10 semanas (Chermette et al., 2008). Los fracasos terapéuticos y las recidivas frecuentes suelen deberse a factores tales como: (1) un diagnóstico incorrecto, en casos en los que este se basa únicamente en los signos clínicos o la Lámpara deWood, sin efectuar pruebas definitivas como cultivos, Referencias para consultorio MV x Ed. 39 - 10/2014 Ed. 39 - 10/2014 Referencias para consultorio MV x (2) tratamientos inadecuados en cuanto a dosis, frecuencias de administración y duración total, (3) desinfección inapro-piada de los ambientes contaminados y (4) respuesta inmune deficiente por enfermedades debilitantes (Verde, 2005). Los tratamientos tópicos incluyen soluciones de enilconazol al 0,2% cada 3 días y champús de clorhexidina en concentraciones superiores al 2%, que son bastante efectivos contra los dermatofitos (Menelaos, 2006). En gatos se ha reportado el éxito de una combinación de miconazol al 2% y clorhexidina al 2%, utilizados vía tópica dos veces a la semana (Moriello, 2004). Para garantizar una buena penetración de los productos tópicos, es recomendable rasurar al paciente, en especial en casos muy severos, generalizados, en gatos o perros de pelo largo, o en sitios donde conviven varios animales. Es fundamental efectuar una correcta desinfección del lugar y los elementos utilizados luego del rasurado (Chermette et al., 2008) Entre las opciones de tratamiento sistémico, la griseofulvina es el fármaco de elección. En perros y gatos, la griseofulvina micronizada debe utilizarse a dosis de 25 mg/Kg vía oral, dos veces al día, con comidas de alto contenido graso. Su uso es contraindicado en animales gestantes, debido a su teratogenicidad, particularmente durante las primeras semanas de preñez. Los efectos secundarios incluyen vómito, diarrea y anorexia (Chermette et al., 2008). Existen algunos reportes que sugieren que los gatos infectados con virus de inmunodeficiencia felina (VIF), están predispuestos a desarrollar una supresión de la médula ósea inducida por griseofulvina (Shelton et al., 1990). El ketoconazole puede utilizarse a una dosis de 2,5-5 mg/Kg, vía oral, una vez al día. Su uso es más recomendado en caninos que en felinos, debido a la alta susceptibilidad de estos últimos a los efectos adversosdel fármaco (diarrea, vómito, anorexia). Es recomendable un control mensual de la función hepática durante la terapia. El keto-conazol es también contraindicado en animales gestantes (Chermette et al., 2008) El itraconazol posee un amplio espectro de actividad y puede ser usado en perros y gatos (Chermette et al., 2008). La dosis indicada para micosis superficiales en perros es de 5 mg/Kg/día y en gatos de 1,5-3 mg/Kg/día (Jaham et al., 2000). En dermatofitosis felina, se ha demostrado la eficacia de un protocolo de terapia de pulsos a una dosis de 5 mg/Kg/día por una semana, cada dos semanas, para una duración total de tratamiento de 6 semanas (Colombo et al., 2001). La tolerancia al itraconazol es mucho mejor que al ketoconazol en caninos y felinos, reportándose ocasionalmente anorexia como efecto secundario. Aunque su teratogenicidad ha sido reportada a dosis muy altas, no es recomendable su uso en gestantes (Chermette et al., 2008). La terbinafina es un antifúngico perteneciente al grupo de las alilaminas y posee actividad fungistática y fungicida contra dermatofitos. Sus efectos colaterales son leves a moderados, incluyendo reacciones gastrointestinales o cutáneas sin gravedad (Richardson et al., 1993). Aunque las dosis reportadas varían entre 10-30 mg/Kg/día durante 7-8 semanas (Chen, 2000), estudios más recientes reportan la misma efectividad en un tiempo menor a dosis de 5 mg/Kg/día durante 22 días (Balda et al., 2007). El lufenuron es un inhibidor de la síntesis de quitina, utilizado comúnmente para el control de ectoparásitos en perros y gatos (Chermette et al., 2008). Estudios sugieren que el lufenuron podría perturbar la producción de quitina como componente de la pared celular de los dermatofitos, llevando a la muerte del hongo (Dean et al., 1999). No se reportan efectos teratogénicos, lo cual permite su uso durante la gestación. La administración de 4 dosis de 120 mg/Kg, vía oral, cada 21 días, ha mostrado resultados positivos, sin efectos adversos considerables (Ramadinha et al., 2010). PREVENCIÓN Se ha propuesto el uso de fármacos antifúngicos como medida preventiva, sin embargo, el uso de estos vía oral parece no ser apropiado. Estudios controlados en humanos muestran que la griseofulvina oral no posee acción profiláctica (Chermette et al., 2008). Otras investigaciones sugieren que el lufenuron vía oral podría retrasar el inicio o el establecimiento de la dermatofitosis en gatos, teniendo cierto efecto inhibitorio, pero sin efecto preventivo de la infección (Moriello et al., 2004). Los tratamientos tópicos representan una utilidad mayor y en términos generales, la recomendación es aplicar champús antifúngicos en todo animal que haya estado en contacto con ambientes u otros animales infectados (Chermette et al., 2008). CONCLUSIONES La dermatofitosis es una micosis cutánea importante, debido a su frecuencia considerable de aparición en animales domésticos y particularmente por su potencial zoonótico. El diagnóstico definitivo de esta dermatopatía debe basarse en cultivos fúngicos que identifiquen la especie del dermatofito involucrado. Aspectos claves como dosis, frecuencias de administración, duración total del tratamiento y manejo de enfermedades concomitantes son fundamentales para alcanzar los resultados terapéuticos deseados. En animales expuestos a ambientes contaminados, se sugiere implementar medidas preventivas con el uso de productos tópicos, ya que los fármacos sistémicos vía oral no han demostrado ser eficaces como profilácticos. La presente revisión la integran 27 referencias. 26 PEQUEÑOS ANIMALES ALOPECIA EN CANINOS REVISIÓN DE LITERATURA Iovana Clarena Castellanos Londoño - DMV, MSc, Esp.1 RESUMEN La alopecia es una de las lesiones de piel más frecuentes en pequeños animales y se caracteriza por la pérdida de pelo o su diminución, en áreas donde normalmente está presente. La alopecia puede ser de origen inflamatorio o no inflamatorio. Las alopecias inflamatorias ocurren por la presencia de bacterias, ácaros o parásitos, y su relación con el folículo. Las alopecias no inflamatorias pueden ser de origen congénito, endocrino o de etiología desconocida. Dentro de las alopecias de origen endocrino debe considerarse el hipotiroidismo, el hiperadrenocorticismo, el hiperestrogenismo y el hiperandrogenismo; entre las alopecias no inflamatorias de etiología desconocida, debe considerarse la alopecia cíclica de los flancos, alopecia en patrón, efluvio telogénico, alopecia postrasurado (arresto folicular), alopecia por tracción y la displasia folicular. La biopsia de piel es la principal herramienta diagnóstica para establecer la naturaleza de esta lesión, para determinar el tratamiento adecuado. INTRODUCCIÓN La alopecia es una condición de la piel que se presenta en todas las especies incluido el hombre. Viene del griego "alopex" que significa "zorro"; este término fue acuñado por el dermatólogo francés Raymond Saboreau, debido a que este animal cambia de pelo dos veces por año. La alopecia se define como la falta de pelo en un área donde normalmente están presentes y puede ser total o parcial, anular, difusa, regional o universal (Mecklenburg et al., 2011). CLASIFICACIÓN DE LAS ALOPECIAS Anatomía y fisiología de los folículos pilosos Las alopecias se pueden clasificar desde diferentes puntos de vista: El pelo es un anexo de la piel, presente en la mayoría de los mamíferos y cumple importantes funciones relacionadas con el aislamiento térmico, la protección a las agresiones físicas, químicas, térmicas y microbianas, fotoprotección, y en algunos casos estímulo visual para la atracción sexual. Las unidades pilosebáceas están formadas por el folículo piloso, la glándula sebácea, la glándula apocrina y el músculo piloerector (Pater y Forsythe, 2010). a. De acuerdo con la causa 1. Por pérdida de pelo en casos de alopecia autoinfringida, alopecia psicogénica felina y foliculitis. 2. Trastornos en el crecimiento por alteración folicular. 3. Ausencia de folículos en los casos de alopecia congénita o alopecia cicatrizal. b. Por el origen 1. Alopecia congénita o hereditaria (alopecia racial del perro y el gato, hipotricosis congénita, displasia folicular con dilución de color, alopecia en patrón (idiopática)). 2. Alopecias adquiridas (alopecia cíclica de los flancos, alopecia post-razurado, efluvio telógeno, alopecia psicogénica felina) (Machicote, 2011). c. Por la etiología 1. Alopecias inflamatorias (bacterianas, micóticas, parasitarias, inmunomediadas y autoinmunes). 2. Alopecias no inflamatorias (endocrinas, no endocrinas y displasias foliculares). 1 Folículos Pilosos: Son las unidades básicas de producción de pelo y están formados por una porción periférica de tejido conjuntivo, derivada de la dermis y una parte interna epitelial o vaina radicular, que tiene origen epidérmico. La porción epitelial se divide en una vaina radicular externa, que es la continuación de la capa celular basal de la epidermis y una vaina radicular interna que crece hacia arriba con el pelo desde el bulbo capilar. La porción dérmica consiste en una papila dérmica y una matriz del pelo (Nesbitt y Ackerman, 2001). El folículo esta formado por un segmento alto (permanente), que corresponde al istmo, y un segmento bajo (transitorio), que Universidad de La Salle. Coordinadora Docente Laboratorio de Histopatología 28 PEQUEÑOS ANIMALES corresponde al tallo y al bulbo del pelo. Este folículo se comunica al exterior a través del infundíbulo que corresponde a una invaginación de la epidermis, que sirve como canal entre la superficie de la piel y el producto final producido por el epitelio de las células foliculares, sebáceas y apocrinas, llamados, tallo piloso, secreción sebácea y secreción apocrina, respectivamente. El epitelio infundibular se considera una continuación de la epidermis (Ackerman et al., 2001). Los perros y los gatos tienen folículos pilosos compuestos o en grupos, que consisten en 2 a 5 pelos primarios rodeados por grupos de pequeños pelos secundarios. Uno de los pelos primarios es largo (pelo primario central) y los restantes pelos primarios son pequeños (pelos primarios laterales). Cada pelo primario tiene glándulas sebáceas; sudoríparas y músculo piloerector, hallándose profundamente enraizado en la dermis. Los pelos secundarios pueden estar acompañados solamente por glándulas sebáceas; la raíz se halla cerca de la superficie. Los pelos primarios generalmente emergen a través de poros separados (folículos simples); los pelos secundarios emergen a través de un poro común. De 5 a 20 pelos secundarios pueden estar acompañando cada pelo primario. Los pelos están presentes en gru- Referencias para consultorio MV x Ed. 39 - 10/2014 Ed. 39 - 10/2014 Referencias para consultorio MV x pos, en el perro son 2 a 15 pelos por grupo. En gatos, son 10 a 20 pelos por grupo (Scott et al., 2001). El folículo piloso tiene cinco componentes: la papila dérmica folicular, la matriz pilosa, el pelo mismo, la vaina radicular interna formada por la cutícula interna, la capa epitelial granular media (capa de Huxley) y la capa epitelial externa (capa de Henle); y la vaina radicular externa (Dellmann, 1993; Scott et al., 2001). En los pelos táctiles, los "pelos sinusales" son folículos simples muy grandes, caracterizados por un seno sanguíneo anular, no trabeculado, tapizado por endotelio, el cual se encuentra entre las capas interna y externa de la vaina dérmica (Dellmann,1993). Los "pelos tilótricos" son folículos primarios largos que tienen un anillo de tejido neurovascular a nivel de la glándula sebácea. El músculo piloerector está formado por haces de fibras musculares lisas que se insertan en la vaina de tejido conjuntivo del folículo piloso y se extienden hacia la epidermis, donde se fijan a la capa superficial de la dermis. Están particularmente desarrollados en el lomo del perro donde determinan su "erizamiento" cuando se contraen y permiten vaciar el contenido de las glándulas sebáceas (Dellmann, 1993) Ciclo del crecimiento del pelo Los pelos no crecen continuamente, lo hacen en ciclos. Cada ciclo consiste en períodos de crecimiento (anágeno), durante el cual el folículo produce activamente pelo; una fase de involución del folículo piloso (catágeno), seguido de una fase de reposo (telógeno) durante el cual el pelo es retenido en el folículo y luego es descamado para continuar nuevamente con un periodo anágeno. El tiempo de duración de cada una de estas fases en el perro, se encuentra pobremente estudiado. Existen razas de perros como los Poodle, Schnauzer y Viejo Pastor Inglés, que tienen crecimiento contínuo del pelo. El ciclo del pelo está controlado por el fotoperiodo, la temperatura ambiente, la nutrición, las hormonas, el estado general de salud, los genes y factores intrínsecos pobremente entendidos (Scott et al., 2001). Factores que controlan el ciclo del crecimiento del pelo Dentro de estos factores encontramos factores intrínsecos (citoquinas, hormonas paracrinas y autocrinas, neuropéptidos, moléculas de adhesión, oncogenes y genes supresores tumorales); factores extrínsecos como son las hormonas (tiroideas, sexuales, cortisol, melatonina, prolactina); estimuladores de anagen (hormonas tiroideas y ACTH); inhibidores de anagen (glucocorticoides y estrógenos), neurales (neuropéptidos y catecolaminas), inmunológicos, estado nutricional y estados patológicos; y factores externos (fotoperiodo, temperatura, fricción, farmacoterapia) (Pater y Forsythe, 2010). ASPECTOS CLÍNICOS La alopecia es un cambio dermatológico que identifica el propietario en los estadios tempranos de la enfermedad. En el estudio clínico debe siempre considerarse: 1. Raza: La alopecia congénita o hereditaria se observa en razas de perros como el Crestado de China, Mexicano, Inca y Peruano sin pelo. La lipidosis folicular solo se ha descrito en el Rottweiler; la alopecia por dilución de color se observa en el Doberman; la displasia del folículo piloso negro ocurre en el Yorkshire terrier. El hiperadrenocorticismo ocurre con mayor frecuencia en razas pequeñas, mientras que el hipotiroidismo es más común en razas grandes; la alopecia X se observa en perros de manto afelpado (Pomerania, Chow chow); la alopecia en patrón adquirida se observa en Pinscher, Terrier de Boston, Dachshund, Greyhound y Whippet. Las alopecias inflamatorias como la demodicosis es más frecuente en perros de pelo corto, como Pug, Bóxer y Terrier. 2. Edad: En muchos casos, la edad del inicio de la alopecia puede ser importante. En el primer año de vida, una alopecia bilateral simétrica sugiere displasia folicular o endocrinopatía congénita; el hipotiroidismo adquirido se presenta en perros jóvenes o de edad mediana; el hiperadrenocorticismo ocurre en perros de edad mediana o avanzada y las 29 PEQUEÑOS ANIMALES alopecias inflamatorias pueden ocurrir en cualquier etapa de la vida. 3. Sexo e historia reproductiva: En los machos, se debe considerar la presencia de tumores testiculares y los síndromes de feminización de los machos (ginecomastia, alopecia, prepucio péndulo, atracción de otros machos); en la hembra, los estros prolongados se asocian a hiperestrogenismo y los anestros a hipotiroidismo e hiperadrenocorticismo. 4. Signos de enfermedad interna: Es importante tener en cuenta que las endocrinopatías siempre van asociadas a signos de enfermedad interna como es el caso de poliuria, polidipsia, polifagia en casos de hiperadrenocorticismo, o letargia y aumento de peso en el caso del hipotiroidismo. 5. Progresión de la alopecia: Algunas alopecias pueden ser estacionales como es el caso de la alopecia recurrente de los flancos, mientras que la mayoría de endocrinopatías son progresivas, sin remisión intermitente. 6. Uso de medicamentos y respuesta al tratamiento: Debe tenerse en cuenta que el uso prolongado de glucocorticoides, los estrógenos y algunos quimioterapéuticos citotóxicos, pueden interferir con el crecimiento del pelo. Los acaricidas y químicos tópicos pueden inducir alopecia irritante; con la vacunación antirrábica se ha descrito alopecia focal, y la falta de respuesta al tratamiento con tiroxina luego de tres meses, descarta la posibilidad de hipotiroidismo en un perro. 7. Nutrición: El uso de alimentos concentrados ha mejorado la calidad del pelaje en los perros; por esta razón lasalopecias por deficiencias nutricionales son escasas y se reportan solo en grandes animales. Sin embargo, la calidad de los nutrientes tiene influencia, principalmente en la calidad del manto y el color. Dentro de los exámenes de laboratorio que deben practicarse, están el tricograma, el raspado cutáneo superficial y profundo, el examen con lámpara de Wood, la citología (en casos de alopecia inflamatoria), la hematología, la química clínica y el parcial de orina en caso de sospecha de endocri- nopatías, la biopsia de piel y el cultivo microbiológico. ASPECTOS HISTOPATOLÓGICOS La biopsia de piel es una herramienta diagnóstica de gran valor para el diagnóstico de las lesiones alopécicas. Para obtener el mejor resultado se requiere la toma adecuada de la muestra que incluya las lesiones a estudiar, la fijación y el procesamiento adecuado de la muestra, el análisis preciso del espécimen y la interpretación adecuada por parte del médico veterinario; por esta razón, se requiere un trabajo en equipo entre el clínico y el dermatopatólogo. Las muestras deben tener un tamaño adecuado para su estudio, razón por la cual se requiere el uso de sacabocados con un diámetro de 6 a 8 mm; en caso de ser tomadas con bisturí, deben medir 15 mm de largo por 10 mm de ancho. Se recomienda tomar dos o tres muestras que deben ser tomadas del centro y de la periferia de la lesión (Mecklenburg et al., 2011). ALOPECIAS NO INFLAMATORIAS Dentro de este tipo de alopecias se deben tener en cuenta las alopecias de origen endocrino, alopecias no endocrinas y la displasia folicular. Alopecias endocrinas Se presentan en forma simétrica, no son pruriginosas y se caracterizan por la alteración del ciclo folicular y la presentación de signos sistémicos de enfermedad. Dentro de este grupo encontramos: 1. Hipotiroidismo Es la endocrinopatía más frecuente en el perro, de origen congénito o adquirido. El hipotiroidismo adquirido puede ser primario (por insuficiente producción de hormonas por la glándula tiroides) o secundario (por falta de ATH) (Rijnberk et al., 2003). En el hipotiroidismo primario la principal causa es la tiroiditis autoinmune, seguido por la degeneración tiroidea idiopática. Se observa en caninos entre 4 y 6 años de edad (Frank, 2006). El hipotiroidismo secundario generalmente se asocia a neoplasia tiroidea, por lo cual generalmente se acompaña de enfermedad de Addison, diabetes in- sípida o disfunción reproductiva. El 6080% de los perros muestran alteraciones dermatológicas como son dermatitis descamativa con queratosis folicular, hiperpigmentación, otitis externa ceruminosa, hipotricosis, alopecia, comedones y mixedema, dando la apariencia de una "expresión facial trágica". Los signos sistémicos que acompañan esta alteración son: ginecomastia, anestro, anemia no regenerativa y queratoconjuntivitis (Scarampella, 2011). 2. Hipercortisolismo Los receptores de corticoides se encuentran en el epitelio folicular y en las células basales de los folículos pilosos. Esta afección puede ocurrir por excesiva producción de corticoides por la glándula adrenal debido a neoplasias en la hipófisis o en la glándula adrenal (forma espontánea), o por la administración exógena de corticoides (forma iatrogénica) (Scarampella, 2011). La poliuria y la polidipsia son los signos más evidentes de este tipo de endocrinopatía; los signos cutáneos incluyen calcinosis cutis en el cuello, las axilas y la región inguinal; la piel es delgada, hipotónica y pierde elasticidad. Las complicaciones frecuentes son la demodicosis y el pioderma. 3. Hiperestrogenismo Los estrógenos son producidos en el ovario, y en ambos sexos en la corteza adrenal, el hígado y la glándula mamaria. Los folículos son capaces de sintetizar estrógenos a partir de andrógenos por acción enzimática. Los estrógenos son potentes moduladores del crecimiento folicular y tienden a mantener el folículo en anagen. El hiperestrogenismo como causa de alopecia en perros, resulta comúnmente de quistes ováricos principalmente en el British Bulldog y se manifiesta en adultos (2-7 años). Las lesiones típicas dermatológicas se presentan en machos y hembras en el perineo y en la región inguinal, ocasionalmente en puntos de presión, el cuello y el tronco. Las hembras presentan anormalidades del ciclo estral, ginecomastia y aumento de tamaño de la vul- 30 PEQUEÑOS ANIMALES va. En los machos, el tumor de células de Sertoli en el testículo, induce la presentación de alopecia y feminización, hipertrofia prostática, trombocitopenia y anemia (Scarampella, 2011). 4. Hiperandrogenismo Es una condición rara en el perro y ocurre por un exceso en la producción de andrógenos a partir de tumores testiculares o desde la glándula adrenal. Las manifestaciones cutáneas ocurren en machos enteros y se asocian con la hiperplasia y sobreproducción de las glándulas sebáceas, circumanales o hepatoides y en la glándula supracaudal de la cola; además se puede observar seborrea oleosa (Frank, 2006). Alopecias no endocrinas Son apruriginosas; casi siempre presentan un patrón de alopecia distribuido en dorso, lomo y flancos, muy similar a las de origen endocrino (Fogel y Manzuc, 2009). El diagnóstico se realiza por biopsia de piel. Dentro de estas patologías encontramos: 1. Alopecia canina en patrón Es un tipo de alopecia que se caracteriza por alopecia progresiva, que ocurre en el cuello, el tórax y el abdomen, la cara caudomedial de los muslos, el perineo y la región auricular posterior. Se observa casi siempre en hembras de razas de pelo corto como Pinscher, Chihuahua, Boston Terrier y Bóxer, entre otros. Existe la forma que se restringe su presentación al pabellón auricular de las orejas y en el puente de la nariz, que se presenta en Dachshaund. La biopsia de piel permite descartar otros desórdenes, ya que su patrón no está bien definido. El hallazgo más característico es la miniaturización de los folículos pilosos anágenos. En el tratamiento se ha sugerido el uso de los estrógenos, la melatonina y la finasterida. 2. Efluvio telógeno Es una condición que se caracteriza por la excesiva caída de pelo en estadío telógeno. Está asociada con eventos estresantes como la preñez, el parto, la lactancia, las enfermedades sistémicas, los episodios de fiebre marcada, ciru- Referencias para consultorio MV x Ed. 39 - 10/2014 Ed. 39 - 10/2014 Referencias para consultorio MV x gía y algunos fármacos. Este tipo de alopecia se manifiesta en forma de parches o en forma difusa; por lo general afecta el tronco. El diagnóstico diferencial incluye la alopecia endocrina y la alopecia inducida por quimioterapia. El diagnóstico se realiza por tricograma, donde se observa la presencia de pelo en fase telógena con pigmentación mínima o ausente. No se necesita tratamiento, ya que el pelo renace en pocos meses. 3. Alopecia posterior al rasurado Ocurre luego del corte del pelo y afecta las razas nórdicas como el Alaska, el Samoyedo, el Chow Chow, el Pomerania y el Husky Siberiano. En ocasiones se acompaña por una escasa descamación. Se diagnostica de acuerdo con la reseña, la historia y la presentación clínica. Se deben realizar exámenes complementarios descartando endocrinopatías. Las biopsias de piel se deben tomar de las áreas alopécicas donde se observarán folículos en telógen e hiperplasia epidérmica. No se requiere tratamiento, el pelo crece en 6-12 meses. 4. Alopecia X Es una alopecia bilateral, simétrica e hiperpigmentada, que ocurre en perros de manto denso como el Pomerania, el Caniche, Alaska Malamute, Chow Chow, entre otros, y del cual se desconoce su origen, pero se asegura que no es de origen hormonal. Es independiente del estado reproductivo y ocurre en perros entre 1 y 10 años. El diagnóstico se hace por descarte de otras condiciones inflamatorias, endocrinas o heredadas. La castración es el tratamiento inicial de elección, aunque en algunos casos no responde con este tratamiento; se han utilizado medicamentos como la suplementación con hormona del crecimiento, mitotano y trilostano, aunque algunos autores recomiendan no implementar ningún tratamiento debido a lo desconocido de su etiología. Displasias foliculares Alopecia cíclica estacional de los flancos Es un desorden cutáneo de etiología desconocida que se caracteriza por pérdida del pelo en el flanco, en forma recurrente en forma anual. Su etiología es desconocida, aunque se atribuye a un desorden en la producción de la melatonina relacionada con el fotoperiodo. La exposición diaria a la luz artificial puede disminuir la producción endógena de melatonina, la cual puede relacionarse con la alopecia en los animales predispuestos genéticamente. Se presenta en razas como son el Bóxer , Airdale Terrier, Pinscher y Bearded Collie (Mecklenburg et al., 2011). ALOPECIAS INFLAMATORIAS Las alopecias inflamatorias se deben a la presencia de bacterias, hongos y ácaros del género Demodex spp. En cualquiera de estas tres patologías, las lesiones macroscópicas corresponden a áreas alopécicas multifocales o localizadas en cualquier parte del cuerpo. Microscópicamente se caracterizan por la presencia de infiltrados de células inflamatorias de tipo PMN, linfocitos y células plasmáticas en áreas foliculares, perifoliculares y algunas veces con ruptura de los folículos pilosos (forunculosis), lo que lleva a la pérdida de tallo piloso y la presentación de alopecia (Scott et al., 2001). CONCLUSIONES Las alopecias son lesiones frecuentes y de etiología variada, por tal razón es importante tratar de establecer el diagnóstico con el uso de la histopatología, que es la herramienta diagnóstica de elección, con el fin de realizar el tratamiento adecuado. Es importante continuar estudiando las alopecias inflamatorias no endocrinas, de las cuales se cuenta con poca información acerca de su origen. BIBLIOGRAFÍA 1. Bratka-Robia CB., Egerbacher M, Helmreich M, Mitteregger G, Bamberg E. (2002). Inmunohistochemical localization of androgen and estrogen receptors in canine hair follicles. Veterinary dermatology 2002, 13, 113-118. 2. Fogel, F; Manzuc P. (2009). Dermatología canina para la práctica clínica diaria. Argentina. Editorial Intermédica. 3. Machicote, G. (2011). Dermatología canina y felina. Zaragoza, Servet editorial. Pp: 313-326. 4. Meckelenburg L., Linek M, Tobin DJ. (2011). Pérdida de pelo en los animales domésticos. Buenos Aires, Argentina. Editorial Intermédica. 4. Patel, A; Forsythe, P. (2010). Dermatología de pequeños animales. Soluciones Saunders en la práctica veterinaria. Elsevier, España. 5. Scarampella, F. (2011). Endocrine alopecia in dogs. Veterinary Focus. 21;1: 40-46. 6. Frank, L.A. (2006). Comparative dermatology canine endocrine dermatoses. Clinics in Dermatology. 24, 317-325. 7. Rijnberk A; Kooistra H,S; Mol JA (2003). Endocrine diseases in dogs and cats: Similarities and differences with endocrine diseases in humans. Science direct. S158-S164 doi:10.1016/S1096-6374(03)00076-5 8. Nesbitt G, Ackerman L. (2001). Dermatología Canina y Felina: Diagnóstico y tratamiento. Buenos Aires: Editorial Intermédica, 2001. 472 p. 9. Scott D, Miller W, Griffin C. (2001). Small Animal Dermatology. 6a ed. Philadelphia: W.B Saunders Co, 1528 p. 10. Yager J, Scott D. (1993). The skin and appendages. En: Jubb KV, Kennedy PC, Palmer N. Pathology of Domestic Animals. 4a. ed. California: Academic Press, Inc, p. 531-706 31 PEQUEÑOS ANIMALES