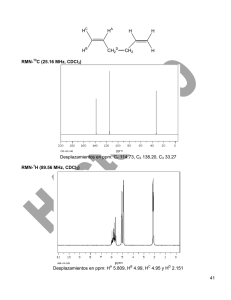
SISTEMAS
CONJUGADOS
Ejemplos de Dienos Conjugados
dobles enlaces conjugados
Pentano-1,3-dieno
más estable que los dobles enlaces aislados
dobles enlaces aislados
Pentano-1,4-dieno
Conjugated Diene
Non-Conjugated Diene
ESTABILIDAD DE LOS SISTEMAS CONJUGADOS
pent-1-eno
pent-2-eno
valor real
trans-penta-1,3-dieno
más estable por
predicción
DIENOS ACUMULADOS
H
H
H
C C C
C C C
H
H
ALENO
CH3
H
H
METILALENO
Energías relativas de alquinos y dienos
Dieno
acumulado
pentano-1,2-dieno
Alquino
terminal
pent-1-ino
Alquino
interno
energía
pent-2-ino
Dieno
aislado
pentano-1,4-dieno
Dieno
aislado
trans-hexano-1,4-dieno
Dieno
conjugado
trans-pentano-1,3-dieno
alcano (pentano o hexano)
Estructura del butano-1,3-dieno
Pequeña cantidad
de traslapo
doble enlace
parcial
ORBITAL DE ENLACE DEL ETILENO
nodo
Orbital *
de antienlace =
Traslapo
destructivo
energía de los orbitales
p aislados en C1 y C2
Orbital de enlace =
energía
Traslapo
constructivo
ORBITAL MOLECULAR PARA EL BUTANO-1,3-DIENO Y EL ETILENO
butano-1,3-dieno
etileno
antienlace
enlace
energía
del orbital
p aislado
CATIÓN ALÍLICO
bromuro de alilo
catión alilo
cationes alílicos sustituídos
ESTABILIDAD DE LOS CARBOCATIONES
alilo
alílico sustituido
es tan estable como
es tan estable como
Importancia de los
dienos conjugados
Química de la visión
Enzimas
del hígado
(reductasa)
Enzimas del hígado
(isomerasa y oxidasa)
Metarodopsina II
(más impulso nervioso, bastones
de la retina)
Rodopsina
Preparación de Dienos Conjugados
Deshidratación de alcoholes
3-metil-1,3-butanodiol
Isopreno
(2-metil-1,3-butanodieno)
Eliminación de deshidrógenación
Butano
catalizador
1,3-butanodieno
calor
calor
calor
1-buteno
Bromación alílica
Eliminación (E2)
calor
1-buteno
Bromación alílica
Eliminación (E2)
calor
Bromación
Eliminación (E2)
ó
ter-butóxido
ADICIÓN-1,2 y ADICIÓN-1,4 A DIENOS CONJUGADOS
3-bromo-1-buteno
1-bromo-2-buteno
adición-1,2
adición-1,2
adición-1,4
adición-1,4
MECANISMO DE LA ADICIÓN-1,2 y ADICIÓN-1,4
A DIENOS CONJUGADOS
Paso 1: La protonación forma un catión alílico estabilizado por resonancia
catión alílico
Paso 2: Un nucleófilo ataca a cualquiera de los carbonos eslectrofílicos
y
adición-1,2
adición-1,4
CONTROL CINÉTICO CONTRA CONTROL TERMODINÁMICO
producto-1,2
producto-1,4
producto-1,2
producto-1,4
energia
DIAGRAMA DE ENERGÍA PARA LA FORMACIÓN DE PRODUCTOS
DE ADICIÓN-1,2 y DE ADICIÓN-1,4
intermediario
producto-1,2
(se forma más rápido)
producto-1,4
(más estable)
coordenada de reacción
Baja temperatura: producto cinético
producto-1,2
1,2-dibromuro
Alta temperatura: producto termodinámico
producto-1,4
1,4-dibromuro
Predicción de los Productos de la adición Electrofílica sobre un dieno conjugado
2-metilciclohexa-1,3-dieno
1,2- y 1,4-
3-cloro-3-metilciclohexeno
3-cloro-1-metilciclohexeno
6-cloro-1-metilciclohexeno
BROMACIÓN ALÍLICA POR RADICALES LIBRES
Paso de iniciación
Pasos de propagación
ciclohexeno
un radical alílico
continua
la cadena
un radical alílico
bromuro alílico
ORBITALES MOLECULARES DEL SISTEMA ALÍLICO
Orbitales de enlace
orbitales de enlace
ESTADO DE TRANSICIÓN PARA UNA REACCIÓN SN2 EN BROMUROS DE ALILO
Reacción SN2 en bromuro de n-propilo
estado de transición
Reacción SN2 en bromuro de alilo
estado de transición
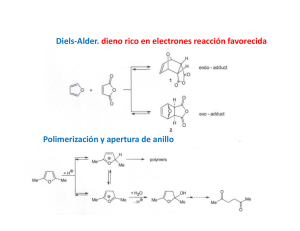
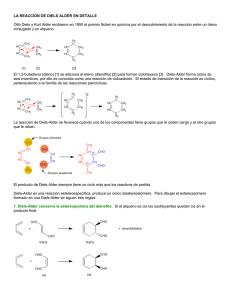
REACCIÓN DE DIELS-ALDER
(calor)
dieno
alta densidad
electrónica
dieno
dienofilo
baja densidad
electrónica
dienofilo
Otto Paul Hermann Diels
Kurt Alder
1876-1954
1902-1958
EL DESCUBRIMIENTO DE LA REACCIÓN DE
DIELS-ALDER
Benceno, 10
oC
BUENOS DIENÓFILOS
TRASLAPO DE ORBITALES EN LA REACCIÓN DE DIELS-ALDER
el traslapo
comienza
conforme
se acercan
estos orbitales
producto
reactivos
estado de transición
Dienofilo
Dieno
Plano del Dieno
Plano del
Dienofilo
Aducto
RAPIDEZ DE DIENOS EN LA REACCIÓN DE DIELS-ALDER
Rapidez de diferentes dienos comparada con el butano-1,3-dieno
más
lenta
No hay reacción
similar al
butano-1,3-dieno
más
rápida
MÉTODO CUBO
Es una buena manera de visualizar la estereoquímica relativa
Dibujar un
cubo
Adicionar el
dieno
Hacer la reacción
(formar los nuevos
enlaces)
Adicionar el dienofilo
(el sustituyente endo tiene
sustituyentes directamente
abajo del dieno)
Tomar en cuenta
otros sustituyentes
presentes
Deberá ser capaz de ver la
estereoquímica relativa
Aquí la reacción de Diels-Alder es apropiada debido a que es una reacción
estereoespecífica
Dieno
conjugado
Dienófilo
Doble enlace-cis
Reacción
antitética
IGF
(FGI)
IGF
(FGI)
TRANSFORMADA
DIELS-ALDER
+
1-fenil1,3-butadieno
Anhídrido
maleíco
ESTEREOQUÍMICA DE LA REACCIÓN DE DIELS-ALDER
(racémico)
(racémico)
REGLA ENDO
traslapo
secundario
Formación
de nuevos
enlaces
exo
endo
exo
endo
estado de transición
REGLA ENDO
RÁPIDO
APROXIMACIÓN
ENDO
PRODUCTO
ENDO
LENTO
APROXIMACIÓN
EXO
PRODUCTO
EXO
REGLA ENDO
ESTEREOQUÍMICA
INSATURADO
INSAT
INSAT
INSATURADO
APROXIMACIÓN
ENDO
APROXIMACIÓN
EXO
REACCIONES DE DIELS-ALDER USANDO REACTIVOS ASIMÉTRICOS: PRODUCTOS-1,4
FORMACIÓN DE PRODUCTOS-1,4
pero no se obtiene
PRODUCTO-1,4
PREDICCIONES
dieno
dienofilo
PRODUCTO-1,3
LA CARGA
NEGATIVA
REACCIONA
CON LA POSITIVA
FORMAS RESONANTES:
SEPARACIÓN DE CARGA
PRODUCTO-1,4
REACCIONES DE DIELS-ALDER USANDO REACTIVOS ASIMÉTRICOS: PRODUCTOS-1,2
FORMACIÓN DE PRODUCTOS-1,2
pero no se
obtiene
dieno
dienofilo
PRODUCTO-1,2
PREDICCIONES
dieno
dienofilo
PRODUCTO-1,3
LA CARGA NEGATIVA
REACCIONA
CON LA POSITIVA
FORMAS RESONANTES:
SEPARACIÓN DE CARGA
Limitaciones de la reacción de Diels-Alder
No hay reacción
con dienos con la
configuración
s-trans
No hay reacción
con dienofilos con
grupos
electrodonadores
CATALIZADOR:
energía
LA TRANSICIÓN p - p* EN EL ETILENO
estado basal
estado excitado
energía
LA TRANSICIÓN p - p * EN EL BUTANO-1,3-DIENO
etileno
estado basal estado excitado
butano-1,3-dieno
El Aldrin se nombra así por el químico alemán Kurt Alder, uno de los
coinventores de esta reacción
Isopreno
Pirofosfato de dimetilalilo
Pirofosfato de Isopentenilo
RUZICKA EN 1953 PROPUSO
LA REGLA ISOPRENICA BIOGENETICA
PARA LOS TERPENOS Y TERPENOIDES
Terpenos y
terpenoides
Piruvato
Pirofosfato de Isopentenilo
cola
cabeza
Dos isoprenos
mirceno
Nuevo enlace
cabeza
cola
cola
Nuevo enlace
cabeza
mentol
Los terpenos de clasifican en:
a) Hemiterpenos (C5 = 1 x C5)
b) Monoterpenos (C10 = 2 x C5)
c) Sesquiterpenos (C15 = 3 x C5)
d) Diterpenos (C20 = 4 x C5)
e) Sesterterpenos (C25 = 5 x C5)
f) Triterpenos (C30 = 6 x C5)
h) Politerpenos (C>40 = >8 x C5)
Hemiterpenos consisten de una sola unidad de isopreno. El propio isopreno
es considerado como un hemiterpeno, pero los derivados de oxígeno como el
prenol y el ácido isovalérico son hemiterpenoides
prenol
ácido isovalérico
Monoterpenos consisten de dos unidades de isopreno y tienen la fórmula
molecular C10H16. Ejemplos de monoterpenos son: geranial, limoneno y el
terpineol.
geraniol
limoneno
terpineol
Sesquiterpenos consisten de tres unidades de isopreno y tienen la fórmula
molecular
C15H24.aEjemplos
de sesquiterpenos son: farnesenos, farnesol. El
Uniendo
las
unidades
de isopreno
prefijo
sesqui-significa
uno y una mitad .
(E,E)-α-Farneseno
Farneseno
Diterpenos están compuestos por cuatro unidades de isopreno y tienen la
fórmula molecular C20H32. Estos compuestos se derivan del pirofosfato de
geranil-geranilo.
Pirofosfato de geranil-geranilo
Ejemplos de diterpenos son el cafestol, kahweol y el cembreno
KAHWEOL
CAFESTOL
CEMBRENO
Los Diterpenos también forman las bases de compuestos biológicos
importantes como el retinol, el retinal, y el fitol. Son conocidos por su actividad
como antimicrobianos y antiinflamatorios
RETINOL
RETINAL
FITOL
Sesterterpenos, son terpenes que tienen 25 carbonos y cinco unidads de
isopreno , y son relativamente raros con relación a otros terpenos. El pefijo
serter- significa la mitad antes de tres, esto es, dos y medio. Un ejemplo de un
seterterpeno es el geranilfarnesol.
Triterpenos consisten de seis unidades de isopreno y tienen la formula
molecular C30H48. El triterpeno lineal escualeno, es el componente principal del
del aceite de higado de tiburón, es un derivado del acoplamiento reductivo de
dos moléculas del pirofosfato de farnesilo. Entonces el escualeno es procesado
biosinteticamente para generar tanto el lanosterol como el cicloarterol, los
precursores de todos los estreoides.
ESQUALENO
Entonces el escualeno es procesado biosinteticamente para generar tanto el
lanosterol como el cicloarterol, los cuales son los precursores de todos los
esteroides
LANOSTEROL
CICLOARTEROL,
Tetraterpenos contiene ocho unidades de isopreno y tienen la formula molecular
C40H64. La importancia biológica de los tetraterpenos es que se encuentran dentro de
ellos el compuesto aciclico licopeno, el compuesto monocíclico gama-caroteno y los
compuestos bicíclicos alfa - y beta-carotenos.
LICOPENO
gama-CAROTENO
beta-CAROTENO
Politerpenos consisten de cadenas largas de muchas unidades de isopreno. El hule
natural consiste de poliisopreno en el cual los dobles enlaces son cis
Poliisopreno
(Hule natural)
Azufre
Poliisopreno entrecruzado
Algunas plantas producen un poliisopreno con dobles enlaces trans, conocido como
guta-percha.
GUTA-PERCHA.
Formación de
pirofosfato de
isopentenilo
Uniendo a las
unidades de isopreno
(E,E)-α-Farneseno
1) O3, -78 C, CH2Cl2
2) (CH3)2S
 0
0