ALQUENOS Y ALQUINOS: ESTRUCTURA Y NOMENCLATURA
Anuncio

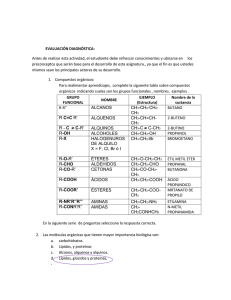
ALQUENOS Y ALQUINOS: ESTRUCTURA Y NOMENCLATURA Introducción a los alquenos y alquinos alcano compuesto formado sólo por carbono, hidrógeno y enlaces sencillos alqueno hidrocarburo con al menos un doble enlace carbonocarbono alquino En el capítulo 2 estudiamos la estructura y nomenclatura de los alcanos. Como tcl dos los hidrocarburos, los alcanos se componen sólo de carbono e hidrógeno. Sin embargo, a diferencia de otros hidrocarburos, los alcanos tienen únicamente enlaces carbono-carbono sencillos. En contraste, los alquenos tienen al menos un doble enlace carbono-carbono, y los alquinos, al menos un triple enlace carbono-carbono. Los ejemplos más sencillos de alquenos y alquinos son el eteno (conocido ccl múnmente como etileno, el precursor del plástico polietileno) y el etino (acetileno, que se usa en soldadura). Compárense éstos con el etano: hidrocarburo con al menos un triple enlace carbonocarbono Etano saturado una molécula saturada tiene sólo enlaces sencillos; cada átomo tiene el número máximo posible de átomos unidos a él no saturado una molécula no saturada tiene al menos un doble o triple enlace Eteno Etino C2H6 C2H4 C2H2 CnH2n+2 saturado Alcano CnH2n no saturado Alqueno CnH2n-2 no saturado Alquino Adviértase que el etano tiene el número máximo de hidrógenos al que pueden dar cabida dos carbonos en una molécula, seis, mientras que el eteno y el etino tienen menos. Al etano y los otros alcanos se les llama hidrocarburos saturados porque todos los carbonos tienen cuatro átomos unidos a ellos. El término no saturado se aplica a los alquenos y alquinos porque no todos sus carbonos tienen el número máximo de átomos enlazados. Un carbono que participa en un doble enlace carbono-carbono sólo tiene tres átomos unidos a él, y uno que toma parte en un triple enlace carbono-carbono sólo tiene dos. Aunque cada carbono tiene cuatro enlaces (uno doble y dos sencillos en el primer caso y uno triple y uno sencillo en el segundo), estos carbonos tienen menos de cuatro átomos enlazados, el máximo posible. L 3.2 Nomenclatura de alquenos y alquinos r t 1 71 Como ya se vio en el capítulo 2, los alcanos tienen la fórmula general CnH2,+2; es decir, tienen el doble de hidrógenos que de carbonos, más dos. Esto es patente en las fórmulas moleculares de los primeros alcanos, CH,, C2H6,CYH8,y C4Hlo (componentes de la fracción gaseosa del petróleo). Para insertar un doble enlace entre dos carbonos de un alcano (como se muestra al comparar el etano con el eteno) es necesario quitar dos hidrógenos de carbonos adyacentes. La fórmula general de los alquenos es, por tanto, CnH2,. Puesto que se deben quitar cuatro hidrógenos de carbonos adyacentes para convertir un alcano en un alquino (o quitar dos hidrógenos más del doble enlace de un alqueno), la fórmula general para alquinos es CnH2,4. Convénzase usted mismo de esto con las estructuras de etano, eteno y etino ya mostradas. Dibyje un ejemplo de alcatrieno sencillo, un hidrocarburo con tres dobles enlaces, y un cicloalcadieno, un hidrocarburo cíclico con dos dobles enlaces. Determine las fórmulas moleculares generales para cada uno. H H\ /C=C H\ ,C=C \H \H /H \ H H \ f -c, H-C \C/C H/ H ' / -H En ambas fórmulas hay cuatro hidrógenos menos que el doble del número de carbonos. La fórmula molecular general es CnH2,-4 e3.2 Nomenclatura de alquenos y alquinos A. Nomenclatura IUPAC Los nombres de los hidrocarburos no saturados, y de los compuestos orgánicos en general, siguen las mismas convenciones que vimos en el caso de los alcanos. El número de carbonos de la cadena continua de carbono más larga se indica por medio de prefdos derivados del griego. Si la cadena de carbono tiene sólo enlaces carbono-carbono sencillos, se agrega el sufUo -ano a la raíz griega que indica el número de carbonos. Si hay un doble enlace, se usa el sufijo -my, si hay triple enlace, se emplea el sufdo -ino.Para indicar más de un doble o triple enlace, se incluye di, tri, tetra, etc., antes de -en0o -im. Los enlaces dobles o triples se deben identificar específicamente y también determinar sus posiciones para dar nombre a un compuesto. Se supone que todos los demás enlaces carbono-carbono son sencillos. Los ejemplos siguientes ilustran estos puntos. 74 1 CAP~TUU) 3 Alquenos y alquinos estructura y nomenclatura B. Nomenclatura común Es común hacer referencia a ciertos aiquenos por medio de una nomencl tipo "aiquileno", como en el etileno y el propileno, a partir de los cuales se los plásticos polietileno y polipropileno. El alquino más sencillo se conoce co mente como acetileno (como en los sopletes oxiacetilénicos de soldadura), y alquinos más complejos se designan a veces como derivados del acetileno. vinilo CH2=CHes el grupo vinilo H2C=CH2 CH3CH =CH2 HC = CH E tileno Propileno Acetileno Metilacetileno Qli10 En ocasiones, se hace referencia a los grupos etileno y propileno con las palabras vinilo y alilo, respectivamente (el plástico PVC se hace a partir de cloruro de vies e!grupo dilo nilo). CH2 =CHcH2- CH2=CHC1 Cloruro de vinilo Problema 3.3 Ciertos derivados pie& del estradiol y - CH2 CHCH2Br Bromuro de alilo 76 1 CAP~TULO 3 Nquenos y alquinos: estructura y nomenclatura 3 . 3 Isomeria de esqueleto, de posición y funcional en alquenos y alquinos isómeros compuestos con la misma fórmula molecular pero diferentes fórmulas estructutales isómeros de esqueleto isómeros que difieren en la disposición de la cadena de carbono isómeros d e r l i ó n isómeros que ifieren en la ubicación de un jrupo sin carbono o u n oble o triple enlace Los isómeros son compuestos diferentes con la misma fórmula molecular. En capítulo anterior aprendimos que la isomería de esqueleto implica diferencias I la disposición de átomos de carbono, en tanto que la isomería de posición cons te en variaciones en la posición de un átomo o grupo distinto del carbono. Los is meros funcionales exhiben variaciones estructurales que los colocan en clas diferentes de compuestos orgánicos, como alcanos, alquenos o alquinos. Estos tres tipos de isomena se ilustran en el ejemplo 3.6 y con los ejemplos, guientes. Los dos primeros compuestos son isómeros de posición, el tercero es I isómero de esqueleto y el Último es un isómero funcional. Dibuje los cinco compuestos de fórmula C4Hs.Identifique los isómeros de esque leto, de posición y funcionales. isómeros funcionales isómeros con diferencias estructurales que los colocan en clases distintas de compuestos orgánicos Solución Dibujemos primero compuestos con cuatro carbonos en la cadena más larga. Para satisfz cer la valencia de los carbonos, se debe incluir un doble enlace entre los dos primeros cai bonos o entre los dos carbonos intermedios. Estos compuestos difieren en la posición dt doble enlace carbono-carbonoy son isómeros de posición. Ahora cambiemos el esqueleto de carbono por el ramificado. Hay un solo isómero posibl con este esqueleto; es un isómero de esqueleto tanto del 1-buteno como del 2-buteno. CH3 I 1 CH3C = CH2 Metilpropeno Hay dos compuestos cíclicos de fórmula C4H8, el ciclobutano y el metilciclopropano. 1 CH2 -CH2 1 1 CH2 -CH2 CH Ciclobutano / \ CH2 -CH2 Metilciclopropano Estas dos moléculas pertenecen a la clase de compuestos llamados cicloalcanos (seccii 2.8) y son isómeros funcionales de los tres alquenos. Prob1- 9.4 ExWen tiies isámem de Ca)b, un alquiRo, un dieno y un cicloalqueno. Cada w ers técnicamente un Mmem furicionai de los o ú m Dibyfe y dé nombre a e& 3.4 La isomería funcional en química orgánica . 3.4 1 77 La isomería funcional en química orgánica Examinemos ahora con más amplitud la isomería funcional con el propósito de apreciar la diversidad de compuestos que es posible en química orgánica. Los isómeros funcionales pertenecen a diferentes clases orgánicas porque po, CH3CHzOH CH30CH3 Un éter compuestos orgánicos y Un alcohol hace que la molécula (alcohol de bebidas) exhiba las propiedades químicas y físicas Cada miembro de la clase de compuestos llamados alcoholes posee un carbono satucaracterísticas de esa rado unido a un grupo hidroxiio (C -O - H), mientras que los éteres poseen una clase de compuestos unidad de dos carbonos saturados separada por un oxígeno (C -O - C). Estas uni- dades estructurales características son los grupos funcionales de los compuestos respectivos e ilustran un tipo importante de isomería. Los compuestos diferentes que tienen el mismo grupo funcional tienen propiedades químicas similares; los que tienen grupos funcionales diferentes suelen sufrir reacciones químicas marcadamente distintas. El grupo funcional suele ser la base para dar nombre a un compuesto orgánico. La tabla 3.1 sintetiza algunas de las clases principales de compuestos orgánicos. En la parte interior de la portada aparece una lista más completa Los que siguen son ejemplos de isómeros funcionales de fórmula C4H80(no se muestran todos los isómeros): Aldehído Alqueno-éter Cetona Alcohol Éter 78 1 C A P ~ ~3 LAlquenos O y alquinos: estructura y nomenclatura TABLA 3.1 + Clases de principales compuestos orgánicos Nombre del grupo funcional Estructura del grupo funcional Ejemplo Nombre y aplicación Alcano CH3CH2CH3 Alqueno CH, =CH, Eteno @recursor del polietüeno) Alquino HCECH Acetileno (se usa en sopletes oxiacetüénicos) Hidrocarburo aromático Ácido carboxíüco Aldehído Propano (gas rural o de campamento) Tolueno (componente de la gasolina de alto octanaje) O 11 CH3COH Ácido acético (ácido del vinagre) o Formaldehído (conservador HCH biológico) ll O Cetona CH,CCH3 ll Acetona (removedor de esmalte de uñas) Alcohol CH3CH,0H Etanol (alcohol de bebidas) CH,CH,OCH,CH, Éter dietíiico (anestésico general) CH,NH2 Metilamina (olor a pescado de la salmuera de arenques) Éter 80 1 CAP~TULO 3 Alquenos y alquinos:estructurá y nomenclatura BONEXION 3.2 (CONT.) insecticidas rociadas en el aire pueden provocar tanta canfmidn en los insectos macho que les resulta imposible localizsr hembras con las cuales aparearse. as usadas comercialmente como insxtici*. Qe- plantas e imectos se protegen a sf mismos produciendo stwtanciasquímicas que son de desagradable para los depredadores. Otros insec- 3.5 Isomería geométrica en alquenos Un enlace carbono-carbono sencillo se compone de un orbital molecular u en el cual hay una sola posición de traslape. Como consecuencia, hay una rotación más o menos libre en torno a los enlaces sencillos, y esta rotación es capaz de producir un número infinito de isómeros de conformación (sección 2.7). Por ejemplo, en el 1,2dibromoetano, podemos visualizar los dos bromos en el mismo lado de la cadena de carbono (eclipsados) o en lados opuestos (escalonados) como posibles conformaciones. Sin embargo, la rotación en torno al enlace carbonocarbono sencillo no tiene restricciones y, por tanto, éstos y otros confórmeros del 1,Bdibromoetanono se pueden separar ni aislar porque se están interconvirtiendode manera constante. Br Eclipsada 1 H\ /H Escalonada En contraste, no es posible la libre rotación en torno a dobles enlaces carbonocarbono, porque un doble enlace se compone a la vez de un enlace u y un enlace IT. Aunque puede haber rotación en torno a un enlace o sin disminuir el traslape de or- i I 3.5 Isomería geométrico en alquenos Un enlace carbono-carbono sencillo se compone de un orbital molecular a en el cual hay una sola posición de traslape. Como consecuencia, hay una rotación más o menos libre en torno a los enlaces senciilos, y esta rotación es capaz de producir un número infinito de isómeros de conformación (sección 2.7). Por ejemplo, en el 1,2dibromoetano, podemos visualizar los dos bromos en el mismo lado de la cadena de carbono (eclipsados) o en lados opuestos (escalonados) como posibles conformaciones. Sin embargo, la rotación en tomo al enlace carbonocarbono sencillo no tiene restricciones y, por tanto, éstos y otros confórmeros del 1,2-dibromoetanono se pueden separar ni aislar porque se están interconvirtiendo de manera constante. Br Eclipsada H\ /H Escalonada En contraste, no es posible la libre rotación en torno a dobles enlaces carbonocarbono, porque un doble enlace se compone a la vez de un enlace o y un enlace T. Aunque puede haber rotación en tomo a un enlace o sin disminuir el traslape de or- 82 1 C ~ L3 Alquenos O y aiquinos: estructura y nomenclatura isómemsc;s isómero geométrico en el cual 10s grupos están en el mismo ladode un anillo o doble enlace bitales, esto no es posible en el caso de un enlace p porque se forma por el t r a de orbitales x paralelos en dos posiciones. Para que haya rotación, el enlace tendría que romper, lo cual es un proceso energéticamente no favorable (fi 3.1). Como consecuencia, un compuesto como el 1,2-dibromoeteno tiene doe meros definidos que se pueden separar y aislar y que no se interconyierten en diciones normales. Un isómero, en el cual los dos átomos de bromo estár mismo lado, se designa como cis (en latín, "mismo lado"), y el otro, donde los mos de bromo están en lados opuestos, es trans (en latín, "a través den). isómeros trans isómero geométrico en el cual los grupos están en lados opuestos de un anillo o de un doble enlace isómeros geométricos isórneros cis y trans; un tipo de esteroisomería en la cual los átomos o gru os exhiben dikrencias de orientación en torno a un doble enlace o anillo cis trans 1,Zdibromoeteno 1,l-dibromoeteno Estos isómeros cisltrans se liman isómeros geométricos porque difieren er la orientación geométrica de los átomos, no en la disposición estructural (de átomc con átomo). Para que sea posible la isomería geométrica (cisltrans), cada carbonc que participa en el doble enlace carbono-carbono debe tener dos grupos distinta unidos a él. Por ejemplo, el 1,2-dibromoetenoexhibe isomería cis-trans, como sc ilustra, pero no así el 1,l-dibromoeteno (CH2=CBr2). En compuestos como los isómeros geométricos que se ilustran en el ejempk 3.7, la designación cis-trans se refiere a la configuración de los dobles enlaces el relación con la cadena continua de carbono más larga, es decir, a si la cadena conti núa a través del doble enlace de manera cis o trans. la rotación FIGURA 3.1 Ordinariamente, la rotación en tomo a un doble enlace no es p@ sible, puesto que se tiene que romper el enlace x, que tiene dos posiciones de traslape. La diferencia entre rotación en tomo a un enlace carbono-carbonosencillo y la rotación alrededor de un doble enlace carbono-carbono es análoga a la diferencia en la capacidad para girar de (a) dos trozos de madera conectados por un clavo contra @) dos trozos conectados por dos clavos. 3.5 Isomería geométrica en aiquenos 1 83 Dibyje los dos isómeros geométricos del CH3CH= CBrCH2CH3. Solución Aísle visualmente los carbonos unidos por el doble enlace e identifique los dos grupos conectados a cada carbono: CH3 y H; Br y CH2CH3.Para obtener el primer isórnero, coloque dos grupos en cada carbono al azar pero orientados hacia los vértices de un triángulo. Intercambie los dos grupos de uno de los carbonos para obtener el otro isómero. trans cis En la sección 2.8.E vimos que la rotación en torno a enlaces carbono-carbono sencillos está restringida en los compuestos cíclicos debido a la falta de flexibilidad del anillo. Por esta razón, los compuestos cíclicos pueden exhibir isomería geométrica o cis-trans, de forma similar a los alquenos. En las estructuras que siguen, se puede ver que tanto el 1,2-dibromociclopropanocomo el 1,2-dibromoeteno tienen formas cis y trans. isómero cis isómero trans 1,2-dibromociclopropano isómero cis isómero trans 1,2-dibromoeteno 84 1 C*anito 3 Alquenos y alquinos:estructura y nomenclatura 3.6 unidades de insaturación una unidad de insaturación se como un anillo o un doble enlace. Un triple enlace a dos unidades de insaturoción Unidades de insaturación . A lo largo de este capítulo hemos visto compuestos con dobles enlaces, triples enlaces y anillos, así como los enlaces senciilos, más comunes. Hemos desarrollado fórmulas moleculares generales para hidrocarburossaturados y no saturados. Pero, ¿cómo podemos saber, viendo una fórmula molecular específica, si los isómeros posibles tienen dobles enlaces, triples enlaces o anillos, y cuántos de cada uno? La respuesta se hace evidente una vez que determinamos el número de unidades de 3.6 Unidades de insaturación 1 85 insaturación presentes en una fórmula molecular. En esta sección veremos que las unidades de insaturación se pueden expresar como sigue: doble enlace: una unidad de insaturación triple enlace: dos unidades de insaturación anillo: una unidad de insaturación Primero, consideremos las fórmulas para las que no puede haber enlaces múltiples. Esta clase mas simple de compuestos orgánicos es la de los alcanos que, como hemos visto, se componen enteramente de carbono e hidrógeno y contienen sólo enlaces ~encillos.La fórmula general, CnH2n+2, les permite tener el máximo número posible de hidrógenos en una molécula con n carbonos y, por tanto, se dice que estos compuestos están saturados. Consideremos el propano, por ejemplo, el único compuesto de fórmula C3H8. H H H I I I H-C-C-C-H 1 1 1 H H Propano H No hay forma de asociar más de ocho hidrógenos con tres carbonos; este compuesto está saturado de hidrógenos. Existen formas de asociar menos de ocho hidrógenos con tres carbonos. Si quitamos hidrógenos del propano por pares, obtenemos otras estructuras posibles. Por ejemplo, al dibujar C3H8,podemos quitar un hidrógeno de cada dos carbonos adyacentes. Para satisfacer la covalencia del carbono, debemos insertar un doble enlace, lo que da propeno. H H H I I I H-C-C-C-H 1 . . H H H H I I I H-C-C=C-H l Propeno H O bien, podemos quitar un hidrógeno de cada carbono extremo del propano. Para satisfacer la covalencia de estos carbonos, debemos conectarlos y hacer ciclopropano, un compuesto anular. H H \ / H H H C I I I / \ .C-C-C. H- C- C-H Ciclopropano I H H H I H l H Tanto el propeno como el ciclopropano tienen dos hidrógenos menos del máximo posible con tres carbonos; se considera que tienen una unidad de insaturación. Una unidad individual de insaturación se puede expresar ya sea como un doble enlace o como un anillo. Consideremos ahora la fórmula molecular C4H6.Los hidrocarburos saturados con cuatro carbonos tienen la fórmula C4H10(CnH2n+2). C4H6tiene cuatro hidrógenos menos o dos unidades de insaturación (hay una unidad de insaturación por cada dos hidrógenos menos que el máximo). I l I 86 1 CAP~TLJLO 3 Aiquenos y alquinos: estructura y nomenclatura H H H Las dos unidades de insaturación se pueden expresar como: 1. Un triple eniace CHBCHzC CH CHBC5 CCHB 2. Dos dobles enlaces CH3CH=C=CH2 .CH2=CH- CHZCH2 3. U n doble enlace y un anillo 4. Dos anillos ¿Cómo se manejan los compuestos que tienen otros elementos además de car bono e hidrógeno? Primero, los elementos monovalentes (F, C1, Br, 1) se deben cor siderar como equivalentes al hidrógeno. Por ejemplo, C3H6Br2tiene ocho elementa monovalentes, dos veces más dos (2n + 2) tantos átomos monovalentes como I número de carbonos. No hay unidades de insaturación. El oxígeno no tiene efecto alguno sobre el cálculo de unidades de insatwaciC puesto que es divalente y se puede insertar sin perturbar la proporción carbono : 1 drógeno. Compare los isómeros de C2H60con el etano (CH3CH3). Sin tomar en cuenta el oxígeno, C2H60tiene dos veces más dos elementos mono. lentes (hidrógenos) que carbonos y ninguna unidad de insaturación. El nitrógeno, sin embargo, es trivalente y tiene el efecto de agregar un hidró no. Inserte un átomo de hidrógeno entre el enlace C- H o C- C del etano. Compare las fórmulas moleculares CzH6y C2H7N.Para satisfacer la covaiencia nitrógeno, tenemos que agregar un hidrógeno. Por tanto, en los cálculos debe pasar por alto el nitrógeno y un hidrógeno. Podemos resumir el cálculo de unidades de insaturación en forma muy con Una unidad de insaturación se puede expresar como un enlace múltiple (un d enlace es una unidad; un triple enlace, dos) o como un anillo (una). Para calcu! número de unidades de insaturación, compare el número de átomos monovalt (H, F, C1, Br, 1) con el número de carbonos. No tome en cuenta el oxígeno. No Comprobación de habilidades 1 87 en cuenta el nitrógeno, pero reste un hidrógeno o átomo monovalente de la fórmula por cada nitrógeno. Si hay dos veces más dos átomos monovalentes como carbonos (C,X2,+2), entonces no hay unidades de insaturación. Por cada dos átomos monovalentes menos que 2n + 2, hay una unidad de insaturación. El ejemplo 3.8 ilustra esto y dos métodos adicionales para determinar unidades de insaturación. Calcule el número de unidades de insaturación que hay en C4H4BrClN202. Solución (a) Hay cuatro carbonos y, para que el compuesto sea saturado, debe haber 2n + 2 o diez elementos monovalentes. No tome en cuenta los dos oxígenos. No tome en cuenta los nitrógenos y un elemento monovalente por cada uno (digamos dos de los hidrógenos). La fórmula es entonces C4H2BrC1.Hay cuatro elementos monovalentes, seis menos que los diez que se necesitan para la saturación. Por tanto, hay tres unidades de insaturación (6/2 = 3). (b) Otro método consiste en unir todos los átomos polivalentes con enlaces sencillos y luego contar el número de átomos monovalentes que se requieren para satisfacer las vaiencias. I I I I l I I I l l -C-C-C-C-N-N-0-0 En este caso, 12 átomos monovalentes producirían saturación, pero sólo se dispone de seis de estos átomos. Cada unidad de insaturación se consigue quitando dos átomos monovalentes. A este sistema le faltan seis átomos monovalentes para ser saturado. Por tanto, hay tres unidades de insaturación [(12 - 6)íZ = 31. (c) Una tercera alternativa es unir entre sí los átomos polivalentes con enlaces sencillos y luego cambiar algunos de los enlaces sencillos a enlaces dobles o triples hasta que se puedan satisfacer las valencias con los átomos monovalentes disponibles. En este caso, se requieren tres dobles enlaces (o un triple enlace y un doble enlace) para conseguir esto; por consiguiente, hay tres unidades de insaturación. C l H H H I I I I Br-C=C-C=C-N=N-O-O-H ova- Habilidades ReferenciasfProblemas Habilidades 1. escribir fórmulas generales de hidrocarburos 2. dar nombre a alquenos y alquinos según el sistema de nomenclatura IUPAC Sección 3.1; ejemplo 3.1; problema 3.1 Sección 3.2; ejemplos 3.2-3.5; problemas 3.2, 3.13-3.17. 3. dibyjar isómeros de esqueleto, de posición y funcionales de alquenos y alquinos ReferenciadProblemas Sección 3.3; ejemplo 3.6; problemas 3.4-3.6,3.12. 88 I CAP~TULO 3 Aiquenos y alquinos: estructuay nomenclatura Habilidades ReferenciaslProblemas 7. determinar las unidades de insaturación en una fórmula molecular y expresar las mismas como dobles enlaces, triples enlaces y anillos en isómeros 8. exponer los conceptos y términos presentados en este capítulo Sección 3.6; ejempb 3.8; problemas 3.11,3.27-3.30. Habilidades 4. identificar los principales grupos funcionales presentes en compuestos orgánicos 5. dibujar isómeros de esqueleto, de posición y funcionales de compuestos orgánicos con diversas grupos funcionales 6. dibujar isómeros geométricos (cis-trans) de alquenos y cicloalcanos Sección 3.4; tabla 3.1; problemas 3.34-3.35. Secciones 3.3-3.4; problemas 3.18-3.22. Sección 3.5; ejemplo 3.7; problemas 3.93.10, 3.23-3.26. Use las definiciones de los márgenes y los títulos de sección como guías de estudio, y repase los ejemplos y problemas apropiados. 3-12 Isomería de esqueleto y de posición: Dibqje los isómeros de esqueleto y de posición que se describen. Puede ser conveniente hacer este ejercicio junto con el problema 3.13. (a) los 13 alquenos de fórmula C6HI2 (b) los 12 cicloalcanos de fórmula C6HI2(no tome en cuenta la isomería geométrica) (c) los seis alquinos de fórmula C6HI0 (f) CH3CH2C=CHCHCH2CH2CHCH3 (g) CH3CH2CH2CH=CH - CH =CHCH3 3-13 Nomenclatura de alquenos, alquinos y cicloalcanos: Dé nombre a los compuestos que dibqjó en el problema 3.12 según el sistema de nomenclatura IUPAC. (i) CH3C =CH - C =C - CH =CHCH2CH3 3.14 Nomenclatura de alquenos: Dé nombre a los compuestos siguientes según el sistema de nomenclatura ILTPAC. (a) CH3(CH2)4CH =CH2 CH3 CH3 I I 3-15 Nomenclatura de alquinos: Dé nombre a los compuestos siguientes según el sistema de n o menclatura IUPAC. (a) CH3CH2C CH - (b) CH3CBr2C5CCH2CH2CH(CH3)2 CH3 I (b) C H ~ C H ~ C H= ~C C H ~ C H ~ (c) CH3CHC =CCH3 (c) CH3CCH= CHCH3 (d) HC l CCCH~CH~ CH2CH3 CH3 Y - CH2CH2CH3 l (e) CH3CHCH =CHCHCH2CH2CH3 - (f) CH3CHCH2C C-C C-C CCH3