UNIDAD I. INTRODUCCIÓN A LA QUÍMICA
Anuncio
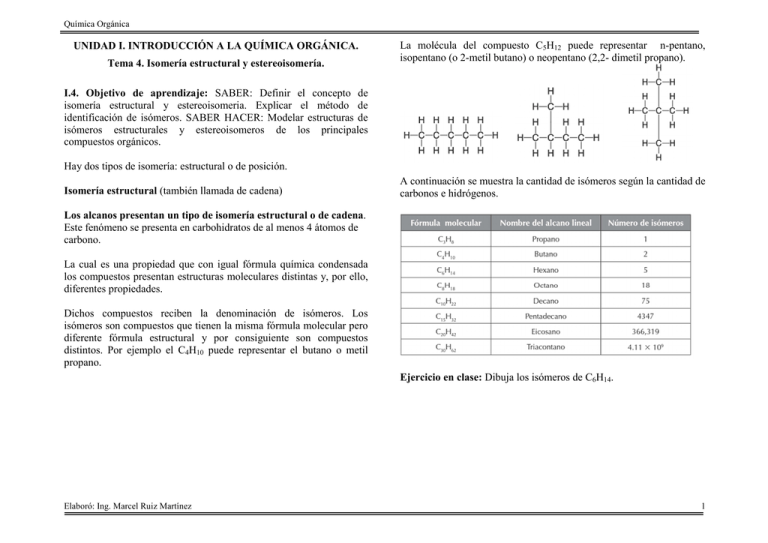
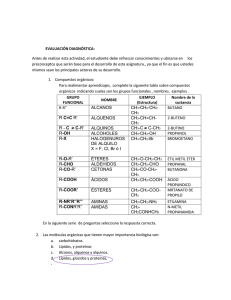
Química Orgánica UNIDAD I. INTRODUCCIÓN A LA QUÍMICA ORGÁNICA. Tema 4. Isomería estructural y estereoisomería. La molécula del compuesto C5H12 puede representar n-pentano, isopentano (o 2-metil butano) o neopentano (2,2- dimetil propano). I.4. Objetivo de aprendizaje: SABER: Definir el concepto de isomería estructural y estereoisomeria. Explicar el método de identificación de isómeros. SABER HACER: Modelar estructuras de isómeros estructurales y estereoisomeros de los principales compuestos orgánicos. Hay dos tipos de isomería: estructural o de posición. Isomería estructural (también llamada de cadena) A continuación se muestra la cantidad de isómeros según la cantidad de carbonos e hidrógenos. Los alcanos presentan un tipo de isomería estructural o de cadena. Este fenómeno se presenta en carbohidratos de al menos 4 átomos de carbono. La cual es una propiedad que con igual fórmula química condensada los compuestos presentan estructuras moleculares distintas y, por ello, diferentes propiedades. Dichos compuestos reciben la denominación de isómeros. Los isómeros son compuestos que tienen la misma fórmula molecular pero diferente fórmula estructural y por consiguiente son compuestos distintos. Por ejemplo el C4H10 puede representar el butano o metil propano. Ejercicio en clase: Dibuja los isómeros de C6H14. Elaboró: Ing. Marcel Ruiz Martínez 1 Química Orgánica Isomería de posición. Entre los siguientes dos compuestos solo difiere la posición del grupo C=O y ambos compuestos pertenecen al grupo de las cetonas. Anteriormente vimos que los isómeros de cadena difieren en la posición de los átomos de carbono. Los isómeros de posición, difieren en cuanto a la posición del grupo funcional; pero el esqueleto de carbono no sufre modificaciones. Por ejemplo el compuesto C4H9Cl: Estos dos isómeros tiene 4 átomos de carbono, solo difiere la posición del átomo de cloro. Para la misma fórmula condensada anterior podemos definir los siguientes dos isómeros: Nuevamente se puede revisar que entre estos dos compuestos solo difiere la posición del átomo de cloro, pero no la estructura de la cadena de carbonos. Pero si queremos definir como isómeros a los 4 compuestos anteriores de la fórmula condensada C4H9Cl podemos decir que son isómeros de cadena ya que varía la cadena de átomos entre ellos. Al ser isómeros de posición los definidos por la ubicación distinta del grupo funcional teniendo la misma cadena de carbonos podemos distinguir los siguientes ejemplos: Elaboró: Ing. Marcel Ruiz Martínez Para los siguientes alquenos, hay una diferencia en cuanto al doble enlace: Ejercicio en clase: Dibuja los isómeros de posición para los compuestos C3H6BrF. Ejercicio en clase: Dibuja los isómeros de posición para el siguiente compuesto: Actividad 1.5. Isómeros estructurales y de posición. Realiza los siguientes ejercicios: 1.- Dibuja tres isómeros estructurales del compuesto C4H8O. 2.- Dibuja tres isómeros de posición del compuesto C3H6BrF Realiza una PRÁCTICA DE EJERCICIOS, las rubricas de dicho producto se puede consultar en la siguiente liga: http://marcelrzm.comxa.com/Rubricas/Rubricas.htm Enviar el trabajo a los siguientes correos: [email protected]; [email protected]; [email protected]; [email protected] También enviar copia del correo a sus compañeros de equipo y a usted mismo. Colocar en ASUNTO: “Actividad 1.5. Isómeros estructurales y de posición” 2 Química Orgánica Estereoisomería. Para introducir este concepto debemos comprender que es la estereoquímica: La estereoquímica es la química en tres dimensiones. Una consecuencia de un arreglo tetraédrico de los enlaces del carbono es que dos compuestos pueden ser diferentes debido a que el arreglo de sus átomos en el espacio es diferente. Los isómeros que tienen la misma constitución pero difieren en el arreglo espacial de sus átomos son llamados estereoisómeros. Ya se tiene experiencia considerable con ciertos tipos de estereoisómeros, aquellos que implican patrones de sustitución cis y trans en alquenos y en cicloalcanos. Todo tiene una imagen especular, pero no todas las cosas son superponibles con ella. La superpo-nibilidad caracteriza a muchos objetos que se usan en forma cotidiana. Tazas y platos, tenedores y cucharas, sillas y camas son todos idénticos a sus imágenes especulares. Sin embargo, muchos otros objetos, y esto es lo más interesante, no lo son. Su mano izquierda y su mano derecha, por ejemplo, son imágenes especulares entre sí pero no pueden hacerse coincidir punto por punto, palma a palma, nudillo a nudillo, en tres dimensiones. En 1894, William Thomson (lord Kelvin) acuñó una palabra para esta propiedad. Estableció que un objeto es quiral si no es superponible con su imagen especular. Aplicando el término de Thomson a la química, se dice que una molécula es quiral si sus dos formas de imagen especular no son superponibles en tres dimensiones. La palabra quiral se deriva de la palabra griega cheir, que significa “mano”, y es apropiada para hablar de la “lateralidad” de las moléculas. Lo opuesto de quiral es aquiral. Una molécula que es superponible en su imagen especular es aquiral. Elaboró: Ing. Marcel Ruiz Martínez En química orgánica, la quiralidad ocurre con más frecuencia en moléculas que contienen un carbono unido a cuatro grupos diferentes. Un ejemplo es el bromoclorofluorometano (BrClFCH). Las estructuras A y B bromoclorofluorometano (BrClFCH) son representaciones de Para probar superponibilidad, girar “B” 180° Comparando nuevamente A y B girado 180° nos damos cuenta que no coinciden, son dos compuestos diferentes. 3 Química Orgánica Las dos imágenes especulares del bromoclorofluorometano no pueden superponerse entre sí. Debido a que las dos imágenes especulares del bromoclorofluorometano no son superponibles, el BrClFCH es quiral. La imagen especular del clorodifluo-rometano son superponibles entre sí. El clorodifluorometano es aquiral. Notar la presencia de un centro de quiralidad (pero no más de uno) es una forma simple y rápida de determinar si una molécula es quiral. Por ejemplo, C-2 es un centro de quiralidad en el 2-butanol; está unido a H, OH, CH3 y CH3CH2 como sus cuatro grupos diferentes. De forma contrastante, ninguno de los átomos de carbono tiene cuatro grupos diferentes en el alcohol 2-propanol, que es aquiral. Ejercicio en clase: observe las siguientes moléculas indique cual puede tener estereoisómeros. Como se acaba de ver, las moléculas del tipo general Son quirales cuando w, x, y y z son diferentes. En 1996, la IUPAC recomendó que un átomo de carbono tetraédrico que lleva cuatro átomos o grupos diferentes fuera llamado centro de quiralidad. Elaboró: Ing. Marcel Ruiz Martínez 4 Química Orgánica Un átomo de carbono en un anillo puede ser un centro de quiralidad si tiene dos grupos diferentes, y si la ruta trazada alrededor del anillo, a partir de ese carbono, en una dirección es diferente de la trazada en la otra. El átomo de carbono que tiene el grupo metilo en el 1,2epoxipropano, por ejemplo, es un centro de quiralidad. La secuencia de grupos es O—CH2 conforme se procede en dirección de las manecillas del reloj alrededor del anillo a partir de ese átomo, pero es H2C—O en dirección contraria a la de las manecillas del reloj. Del mismo modo, C-4 es un centro de quiralidad en el limoneno. Actividad 1.6. Estereoisomeria. Resuelva los siguientes ejercicios. En cada uno de los siguientes pares de compuestos uno es quiral y el otro es aquiral. Identifique cada compuesto como quiral o aquiral, según sea apropiado. Realiza una PRÁCTICA DE EJERCICIOS, las rubricas de dicho producto se puede consultar en la siguiente liga: http://marcelrzm.comxa.com/Rubricas/Rubricas.htm Enviar el trabajo a los siguientes correos: [email protected]; [email protected]; [email protected]; [email protected] También enviar copia del correo a sus compañeros de equipo y a usted mismo. Colocar en ASUNTO: “Actividad 1.6. Estereoisomeria” Elaboró: Ing. Marcel Ruiz Martínez 5