Ejercicios ácido-base (Semestre 2011
Anuncio

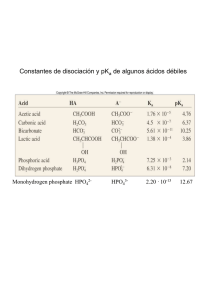
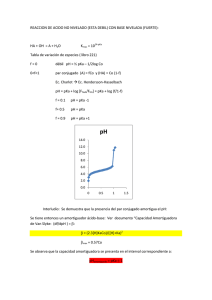
Ejercicios ácido-base (Semestre 2011-2) 1. Suponga que tiene una disolución equimolar de NH4Cl y NaF. a) Determine si esta disolución es ácida o básica. b) Considere si es posible tener un pH neutro mediante el ajuste de las concentraciones de estas dos sales y explique su razonamiento. Suponga ahora que [NaF] = 0.1 M y calcule la concentración de NH4Cl para que el pH sea neutro. 2. Calcule el volumen de NaOH 1 M que se debe agregar a 100 mL de una disolución amortiguadora que contiene ácido ftalico (C6H4(COOH)2) 0.1 M y monohidrogenftalato de sodio 0.05 M con tal de obtener una disolución amortiguadora de pH = 3.1 3. Calcule el cambio de pH provocado por una dilución de 10 veces de las siguientes disoluciones: a) HCl 0.1 M b) CH3COOH 0.1 M + CH3COONa 0.1 M c) NaHSO4 0.1 M d) NaHSO4 0.1 M + Na2SO4 0.1 M 4. Calcule el pH de las disoluciones siguientes y la concentración de todas las especies al equilibrio: a) H2C2O4 0.1 M + C6H5OH 0.1 M + NaOH 0.15 M b) NaF 0.01 M + NH2OH 0.01 M + CH3COOH 0.01 M c) CH3COOH 0.1 M + NH4Cl 0.1 M + NaOH 0.1 M 5. Prediga el orden en el que ocurren las reacciones cuando se agrega el reactivo propuesto en las disoluciones siguientes: Disoluciones Reactivo agregado NH3 + NH2OH CH3COOH HBO2 + HCN NH3 NaH2PO4 + BO2- HCl 6. Se valoran 25 mL de KOH 0.05 M con H2SO4 0.05 M. Calcule los puntos que corresponden a la adicion de: 5 mL, 12.5 mL, 20 mL, 22.5 mL, 24.75 mL, 24.98 mL, 25 mL, 25.02 mL. Trace la curva de titulacion siguiendo estos puntos. Datos: HBO2 (pKa = 9.2); HCN (pKa = 9.2); CH3COOH (pKa = 4.7); C6H5OH (pKa = 9.8); H2SO4 (pKa1 = -3.0, pKa2 =1.8); H2C2O4 (pKa1 = 1.1, pKa2 = 4.0); HF (pKa = 3.1); C6H4(COOH)2 (pKa1 = 2.8, pKa2 = 5.1); NH2OH (pKa = 6.0); NH3 (pKa = 9.2); NaOH (pKa = Base fuerte); KOH (pKa = Base fuerte); HCl (pKa = Acido fuerte)