Preparación de alcanos y cicloalcanos
Anuncio
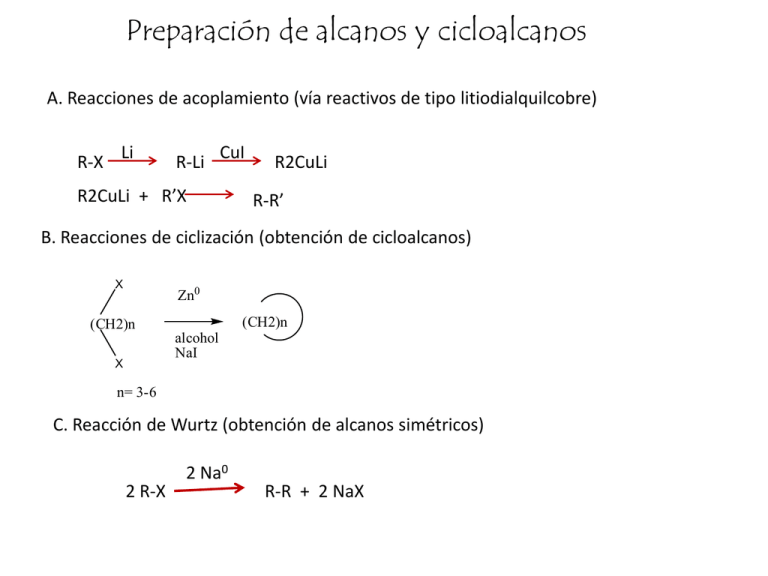
Preparación de alcanos y cicloalcanos A. Reacciones de acoplamiento (vía reactivos de tipo litiodialquilcobre) R-X Li R-Li CuI R2CuLi + R’X R2CuLi R-R’ B. Reacciones de ciclización (obtención de cicloalcanos) X Zn0 (CH2)n (CH2)n alcohol NaI X n= 3-6 C. Reacción de Wurtz (obtención de alcanos simétricos) 2 R-X 2 Na0 R-R + 2 NaX D. Reacciones de reducción D1. Reducción con metales en medio ácido Zn0, H+ R-X R-H Mg0 R-X R-MgX éter O R-C-H R-H (reacción de Clemmensen) HCl D2. Reducción de Wolff-Kishner O R-C-H R-H Reactivo de Grignard Zn(Hg) H2O NH2NH2 KOH R-H D3. Hidrogenación de alquenos C C + H2 Pt, Ni ó Pd D4. Hidrogenación de alquinos R-CC-H 2 H2, Ni R-CH2-CH3 C C H H Cicloalcanos. Compuestos cíclicos con átomos de carbono sp3 Nomenclatura: Se agrega el prefijo “ciclo” y se conserva el nombre del alcano de origen. Fórmula general: CnH2n H 2C ciclopropano H 2C CH2 ó H 2C H2 C CH 2 H 2C CH 2 CH 2 H H Hexano C6H14 remoción de dos hidrógenos H2 C CH2 CH 2 H 2C H 2C CH2 Ciclohexano C6H12 ciclobutano ciclopentano H 2C CH 2 H 2C CH 2 H 2C ó H2 C ó CH2 H 2C C H2 ciclohexano Ejemplos CH 3 Cl 5 H 3C 1 Cl 1 2 5 3 1,1-diclorociclobutano 6 4 1 3 2 4 1,2-Dimetilciclopentano 3-Etil-1,1-Dimetilciclohexano 2 1 6 1-Etil-2-metilciclobutano 5 3 4 1 3-ciclohexilhexano 1 4 3 1,2-dimetilpropilciclohexano Ter-butilcicloheptano 2 1,1,3-trimetilciclopentano 1 1,1-dietil-4-isopropilciclohexano 1 5 1 3 4 5-ciclobutil-1-pentino 4-ciclopropil-3-metiloctano ciclopentilciclohexano ejercicios Propiedades físicas de cicloalcanos Los puntos de ebullición, puntos de fusión y densidades de los cicloalcanos dependen de su masa molecular, y en general son mayores, en comparación con los alcanos del mismo número de carbonos: Ej. Propano (p. eb. -42.2; p. f. -187.1) y ciclopropano (p.eb. -33, p.f. -127) Hexano (p. eb. 68.7; p. f. -94) y ciclohexano (p. eb. 81; p. f. 6.4). Principal razón: SIMETRÍA Al igual que los alcanos de cadena abierta, los cicloalcanos son NO POLARES Estructura En un compuesto cíclico, los átomos de carbono están confinados a un anillo, y el enlace C-C no puede rotar libremente sin romperse; sin embargo, es posible tener rotaciones parciales. La estructura de los cicloalcanos se representa mediante figuras geométricas simples: Con excepción del ciclopropano, los cicloalcanos NO SON PLANOS. (porque debe conservarse la forma tridimensional tetraédrica) Teoría de tensión de Baeyer Predicción: Los cicloalcanos más allá del ciclopentano deberían ser cada vez más tensionados y, por lo tanto, menos estables. Los ángulos de un hexágono regular son de 120º, y los ángulos de polígonos mas grandes se desvían más y más del ángulo de un tetraedro ideal. Tensión de Pitzer (tensión torsional): Es la tensión que surge de las interacciones presentes en conformaciones eclipsadas de los cicloalcanos. H H HH H HH H Proyección de Newman de ciclobutano Tensión torsional + tensión angular = tensión de anillo (tensión de Pitzer) (tensión de Baeyer) Para cuantificar la magnitud de tensión de anillo, se han utilizado los calores de combustión de los cicloalcanos. CH2 CH2 + nO2 CH2 nCO2 + nH2O + n(energía por CH2) calor de combustión (CH2)n Estabilidad relativa de cicloalcanos= calor de combustión/No. de CH2s Calores de combustión (-H0) de cicloalcanos Inconsistencias con la teoría de Baeyer Referencia: para un alcano de cadena abierta, cada CH2 adicional contribuye con 157.4 kcal/mol al calor de combustión de la molécula. Los ángulos de enlace en cicloalcanos más allá de hexano no son muy diferentes a los presentes en los correspondientes alcanos. Cicloalcano Ciclopropano Ciclobutano Ciclopentano Ciclohexano Cicloheptano Ciclooctano Ciclononano Ciclodecano Cicloundecano Ciclododecano Ciclotridecano Ciclotetradecano Energías totales de tensión (kcal/mol) 27.6 26.4 6.5 0.0 6.3 9.6 11.2 12.0 11.0 2.4 5.2 0.0 La dificultad de sintetizar cicloalcanos superiores, claramente proviene de la baja probabilidad de que dos extremos se encuentren para cerrar el anillo, y no de la tensión que pueda estar involucrada. Análisis Conformacional del ciclohexano 3 4 2 5 OJO 1 6 silla bote Más estable por 6.4 kcal/mol 4 5 6 1 3 2 Proyecciones de Newman H H H H H H HH Enlaces axiales y ecuatoriales en ciclohexano Interconversión silla-silla La inversión del anillo de ciclohexano tiene una energía de activación de 10.8 kcal/mol y es un proceso muy rápido (10-5 s a 25°C). Como resultado de la conversión del anillo, los sustituyentes en posición axial pasan a la posición ecuatorial y viceversa. Análisis conformacional de ciclohexano monosustituido Menor tensión de van der Waals Tensión de van der Waals (mayor impedimento estérico) CH3 H H3 C H gauche H CH 3 H CH 2 H H 3C H CH2 H H H H H H H 2C H CH 2 H anti H H Relación entre sustituyentes Los sustituyentes A y B están en posición anti, y las otras combinaciones: A-X, X-Y, X-B, están en posición gauche (60°). Problema: Dada la siguiente estructura, poner un sustituyente X sobre el carbono 1 para satisfacer las siguientes posiciones: a) Anti a A; b) Gauche a A; c) Anti a C-3, d) Gauche a C-3 Ciclopentano Plano sobre Media silla 105º Menos estable Ángulos de enlace: 108º (muy cercano a 109º de un tetraedro ideal tensión de Baeyer muy baja, pero tensión de Pitzer muy alta ) Más estable El alivio de la tensión torsional es más importante que el incremento en la tensión de Baeyer (angular). Cicloalcanos disustituidos Isomería cis-trans (isómeros geométricos) estereoisómeros cis: del mismo lado trans: de lados cruzados cis-1,2-Dimetilciclopropano cis-1,4-Dimetilciclohexano trans-1,2-Dimetilciclopropano (1.2 kcal/mol mas estable) trans-1,4-Dimetilciclohexano (1.6 kcal/mol más estable) Calores de combustión Interconversión del anillo en posición cis: Un CH3 esta axial y otro ecuatorial Un CH3 esta axial y otro ecuatorial Ambos CH3 están hacia arriba Interconversión del anillo en posición trans: Ambos CH3 están axiales (menos estable) Ambos CH3 están ecuatoriales (más estable) Un CH3 esta arriba y otro abajo cis-1,3-diemtilciclohexano Ambos metilos están en posición axial: conformación menos estable Ambos metilos están en posición ecuatorial: conformación más estable trans-1,3-dimetilciclohexano Un metilo está en posición axial, y el otro ecuatorial Un metilo está axial y el otro ecuatorial En este caso excepcional, el isómero cis es más estable que el trans.