do debido a la buena respuesta clínica (paciente consciente
Anuncio
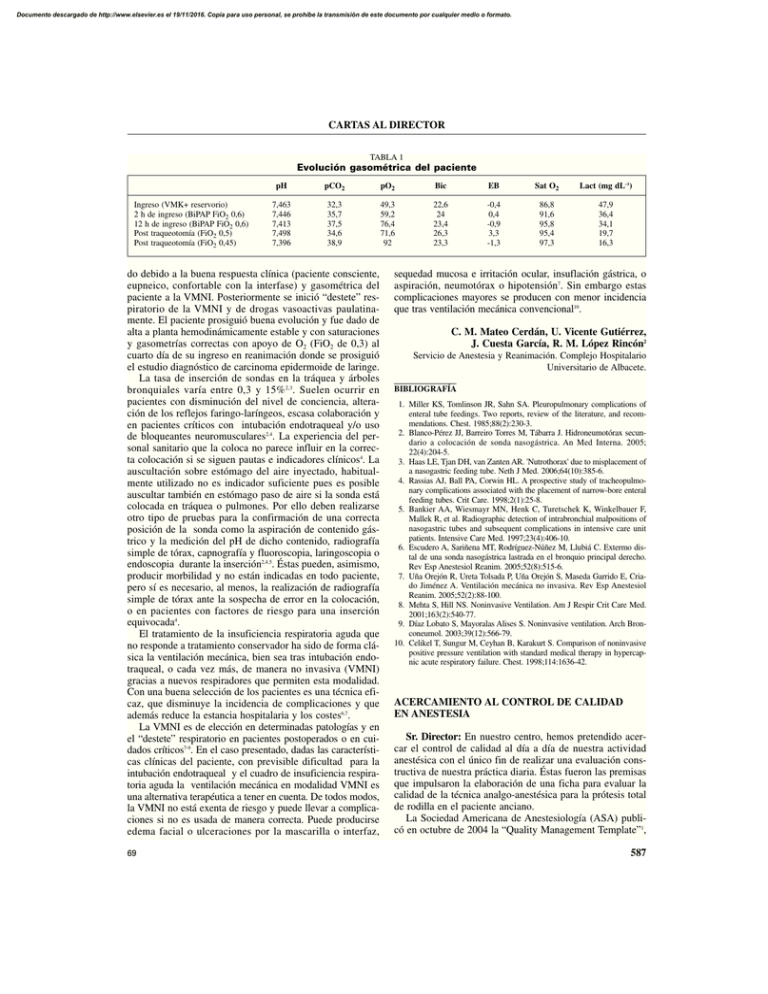
Documento descargado de http://www.elsevier.es el 19/11/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. CARTAS AL DIRECTOR TABLA 1 Evolución gasométrica del paciente Ingreso (VMK+ reservorio) 2 h de ingreso (BiPAP FiO2 0,6) 12 h de ingreso (BiPAP FiO2 0,6) Post traqueotomía (FiO2 0,5) Post traqueotomía (FiO2 0,45) pH pCO2 pO2 Bic EB Sat O2 Lact (mg dL–1) 7,463 7,446 7,413 7,498 7,396 32,3 35,7 37,5 34,6 38,9 49,3 59,2 76,4 71,6 92 22,6 24 23,4 26,3 23,3 -0,4 0,4 -0,9 3,3 -1,3 86,8 91,6 95,8 95,4 97,3 47,9 36,4 34,1 19,7 16,3 do debido a la buena respuesta clínica (paciente consciente, eupneico, confortable con la interfase) y gasométrica del paciente a la VMNI. Posteriormente se inició “destete” respiratorio de la VMNI y de drogas vasoactivas paulatinamente. El paciente prosiguió buena evolución y fue dado de alta a planta hemodinámicamente estable y con saturaciones y gasometrías correctas con apoyo de O2 (FiO2 de 0,3) al cuarto día de su ingreso en reanimación donde se prosiguió el estudio diagnóstico de carcinoma epidermoide de laringe. La tasa de inserción de sondas en la tráquea y árboles bronquiales varía entre 0,3 y 15% 2,3. Suelen ocurrir en pacientes con disminución del nivel de conciencia, alteración de los reflejos faringo-laríngeos, escasa colaboración y en pacientes críticos con intubación endotraqueal y/o uso de bloqueantes neuromusculares2,4. La experiencia del personal sanitario que la coloca no parece influir en la correcta colocación si se siguen pautas e indicadores clínicos4. La auscultación sobre estómago del aire inyectado, habitualmente utilizado no es indicador suficiente pues es posible auscultar también en estómago paso de aire si la sonda está colocada en tráquea o pulmones. Por ello deben realizarse otro tipo de pruebas para la confirmación de una correcta posición de la sonda como la aspiración de contenido gástrico y la medición del pH de dicho contenido, radiografía simple de tórax, capnografía y fluoroscopia, laringoscopia o endoscopia durante la inserción2,4,5. Éstas pueden, asimismo, producir morbilidad y no están indicadas en todo paciente, pero sí es necesario, al menos, la realización de radiografía simple de tórax ante la sospecha de error en la colocación, o en pacientes con factores de riesgo para una inserción equivocada4. El tratamiento de la insuficiencia respiratoria aguda que no responde a tratamiento conservador ha sido de forma clásica la ventilación mecánica, bien sea tras intubación endotraqueal, o cada vez más, de manera no invasiva (VMNI) gracias a nuevos respiradores que permiten esta modalidad. Con una buena selección de los pacientes es una técnica eficaz, que disminuye la incidencia de complicaciones y que además reduce la estancia hospitalaria y los costes6,7. La VMNI es de elección en determinadas patologías y en el “destete” respiratorio en pacientes postoperados o en cuidados críticos7-9. En el caso presentado, dadas las características clínicas del paciente, con previsible dificultad para la intubación endotraqueal y el cuadro de insuficiencia respiratoria aguda la ventilación mecánica en modalidad VMNI es una alternativa terapéutica a tener en cuenta. De todos modos, la VMNI no está exenta de riesgo y puede llevar a complicaciones si no es usada de manera correcta. Puede producirse edema facial o ulceraciones por la mascarilla o interfaz, 69 sequedad mucosa e irritación ocular, insuflación gástrica, o aspiración, neumotórax o hipotensión7. Sin embargo estas complicaciones mayores se producen con menor incidencia que tras ventilación mecánica convencional10. C. M. Mateo Cerdán, U. Vicente Gutiérrez, J. Cuesta García, R. M. López Rincón2 Servicio de Anestesia y Reanimación. Complejo Hospitalario Universitario de Albacete. BIBLIOGRAFÍA 1. Miller KS, Tomlinson JR, Sahn SA. Pleuropulmonary complications of enteral tube feedings. Two reports, review of the literature, and recommendations. Chest. 1985;88(2):230-3. 2. Blanco-Pérez JJ, Barreiro Torres M, Tábarra J. Hidroneumotórax secundario a colocación de sonda nasogástrica. An Med Interna. 2005; 22(4):204-5. 3. Haas LE, Tjan DH, van Zanten AR. 'Nutrothorax' due to misplacement of a nasogastric feeding tube. Neth J Med. 2006;64(10):385-6. 4. Rassias AJ, Ball PA, Corwin HL. A prospective study of tracheopulmonary complications associated with the placement of narrow-bore enteral feeding tubes. Crit Care. 1998;2(1):25-8. 5. Bankier AA, Wiesmayr MN, Henk C, Turetschek K, Winkelbauer F, Mallek R, et al. Radiographic detection of intrabronchial malpositions of nasogastric tubes and subsequent complications in intensive care unit patients. Intensive Care Med. 1997;23(4):406-10. 6. Escudero A, Sariñena MT, Rodríguez-Núñez M, Llubiá C. Extermo distal de una sonda nasogástrica lastrada en el bronquio principal derecho. Rev Esp Anestesiol Reanim. 2005;52(8):515-6. 7. Uña Orejón R, Ureta Tolsada P, Uña Orejón S, Maseda Garrido E, Criado Jiménez A. Ventilación mecánica no invasiva. Rev Esp Anestesiol Reanim. 2005;52(2):88-100. 8. Mehta S, Hill NS. Noninvasive Ventilation. Am J Respir Crit Care Med. 2001;163(2):540-77. 9. Díaz Lobato S, Mayoralas Alises S. Noninvasive ventilation. Arch Bronconeumol. 2003;39(12):566-79. 10. Celikel T, Sungur M, Ceyhan B, Karakurt S. Comparison of noninvasive positive pressure ventilation with standard medical therapy in hypercapnic acute respiratory failure. Chest. 1998;114:1636-42. ACERCAMIENTO AL CONTROL DE CALIDAD EN ANESTESIA Sr. Director: En nuestro centro, hemos pretendido acercar el control de calidad al día a día de nuestra actividad anestésica con el único fin de realizar una evaluación constructiva de nuestra práctica diaria. Éstas fueron las premisas que impulsaron la elaboración de una ficha para evaluar la calidad de la técnica analgo-anestésica para la prótesis total de rodilla en el paciente anciano. La Sociedad Americana de Anestesiología (ASA) publicó en octubre de 2004 la “Quality Management Template”1, 587 Documento descargado de http://www.elsevier.es el 19/11/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. CARTAS AL DIRECTOR TABLA 1 Ficha de control de calidad Conocimiento del estudio preoperatorio Presencia de todos los datos relevantes Presencia de la indicación quirúrgica Presencia de todos los informes complementarios Sedación en quirófano Sedación dPA y dFC < 20% de los valores preoperatorios Dominio de la inducción Éxito de la técnica empleada Tiempo desde entrada hasta inducción ⱕ 15 minutosi Tiempo de la inducción a la incisión ⱕ 30 minutos dPA y dFCii < 20% de los valores preinducción SpO2 > 95% Adecuación a las necesidades de la IQ Picos de dPA y de dFC < 30% Calidad del despertar EVA ⱕ 4 Ausencia de náuseas Ausencia de otras molestias Tiempo en URPA ⱕ al previstoiii Calidad del postoperatorio inmediato Analgesia adecuada (EVA ⱕ 4)iv Ausencia de náuseas o vómitos SatO2 ⱖ 95% Diuresis ⱖ 0,5 mL x kg–1 x min–1 Ausencia de otras complicacionesv Ingreso ⱕ al previsto Satisfacción del paciente Satisfacción con los cuidados anestésicos SÍ/NO SÍ/NO SÍ/NO SÍ/NO SÍ/NO SÍ/NO SÍ/NO SÍ/NO SÍ/NO SÍ/NO SÍ/NO SÍ/NO SÍ/NO SÍ/NO SÍ/NO SÍ/NO SÍ/NO SÍ/NO SÍ/NO SÍ/NO SÍ/NO SÍ/NO Son los tiempos considerados óptimos por los cirujanos y los anestesiólogos de nuestro centro. iidPA o dFc: variación de presión arterial o de frecuencia cardiaca. iiiDe manera habitual, se espera poder derivar al paciente a la URPA de 24 horas a las 2 horas de su llegada a la URPA de quirófano, tras haber realizado un hemograma una vez que se ha revertido el bloqueo motor y sensitivo. ivUn EVA mayor de 4 se asocia con una interferencia en la recuperación postoperatoria. vEntre estas posibles complicaciones se incluyen: edema agudo de pulmón no cardiogénico, trastornos neurológicos (ACV o déficit de nervio periférico), insuficiencia renal, insuficiencia cardiaca, angina o infarto de miocardio, reacción adversa transfusional o medicamentosa, la cefalea postpunción dural, el trastorno cognitivo y la defunción en las 48 horas post-cirugía. i donde se resumen las bases para implantar un sistema global de calidad. Sin ser tan ambiciosos ni recurrir a grandes inversiones, como se deduce de este trabajo y de otros publicados en Europa como el de Stieglitz de 19962, existe un primer paso que puede darse en cualquier centro y con una inversión mínima de tiempo y recursos materiales. Se trata de elaborar una “check-list” o ficha con indicadores de una buena práctica anestésica. Los dos principales modelos para su elaboración son los de Vitez y Lagasse3-4 (en los que se basan los trabajos tanto de la ASA1 como de Stieglitz2). En ambos modelos se enfatiza el hecho de que la mentalidad de recuento de números de defunciones, de grado de incapacidad o de prolongación del ingreso hospitalario etc., se queda un poco escaso5; proponen analizar todos los acontecimientos menores relacionados con la anestesia y la satisfacción del paciente como indicadores de calidad. Si se compara la tabla de indicadores propuesta por la ASA1 y la propuesta por Stieglitz2, la diferencia fundamental es la actitud ante la evaluación de la calidad. La ASA “busca los fallos”, mientras que en el trabajo de Stieglitz “se buscan” los éxitos, lo que no deja de ser algo más motivante6. 588 Por otro lado, la única manera de poder detectar puntos de mejora en un acto anestésico es que éste sea constante para una cirugía determinada, y, por supuesto, acorde con la evidencia científica sobre el tema7. Un sistema de producción sólo es mejorable si es estable, y lo mismo puede decirse de la práctica anestésica. El siguiente problema para implantar un control de calidad “interno” es siempre la declaración de los hechos. Para muestra de ello puede mencionarse el estudio recogido por Sanborn et al8 sobre las complicaciones postoperatorias en un servicio de anestesia, donde sólo logró que se declararan 1 de cada 20 incidentes. Sin embargo, esto puede mejorar con la implantación de un sistema de control total de calidad basado en la confianza de los médicos y su cooperación, como demostraron Lagasse et al4 que lograron que las declaraciones voluntarias pasaran del 45% al 88%. Siguiendo la línea de la auto-declaración, Edsall et al9 estiman que la declaración de los incidentes es más exacta y constante, por parte de los anestesiólogos que siguen el postoperatorio, si deben rellenar unas plantillas predefinidas que si deben rellenar un texto explicativo. En cualquier caso, la manera más fiable de recoger los datos sería el registro informático automático de los mismos8. Teniendo en cuenta estas premisas se diseñó la ficha de control de calidad (Tabla 1) para valorar la calidad de la técnica analgo-anestésica empleada en nuestro centro para la colocación de una PTR en el paciente anciano. Esta ficha consta de 7 bloques con varios subapartados cada uno, que deben rellenarse en quirófano y en la URPA. En los estudios de calidad, los resultados se presentan mediante el índice de calidad y su intervalo de confianza del 95%. El índice de calidad es el porcentaje de respuestas afirmativas sobre el total de respuestas posibles. En el caso del índice global de calidad (IGQ), propuesto por Ausset et al10 en 2002, si se evalúan 100 sujetos, el máximo de respuestas sí posibles sería 2.200 (22 preguntas x 100 pacientes). El rellenar la ficha es fácil y no supone una carga excesiva de trabajo para el anestesiólogo. Su interpretación no requiere grandes conocimientos estadísticos y permitiría comparar índices de calidad parciales y globales entre diversas técnicas tanto dentro de un mismo equipo de anestesiólogos como entre diferentes centros. Es el primer paso para la implantación de un sistema de control de calidad total, fundamental para la mejora continua de la especialidad. M. Perepérez, J. M. Rodríguez del Río, B. Bermejo, J. Catalán Servicio de Anestesiología y Reanimación. Clínica Ubarmin. Navarra. BIBLIOGRAFÍA 1. American Society of Anesthesiologists (ASA). Quality Management Template. Committee on Performance and Outcomes Measurement (CPOM). Committee on Quality Management and departmental Administration (QMDA). October 2004.[ Citado el 24 de Octubre 2004]Disponible en: http://www.sfar.org/sfar_actu/ca96/html/ca96_024/96_24.htm www.asahq.org/quality/qmtemplate013105.pdf 2. Stieglitz P, Payen JF, Jacquot C. Comment juger d’une bonne 70 Documento descargado de http://www.elsevier.es el 19/11/2016. Copia para uso personal, se prohíbe la transmisión de este documento por cualquier medio o formato. CARTAS AL DIRECTOR 3. 4. 5. 6. 7. 8. 9. 10. anesthésie? Conférences d’actualisation 1996: 329-40. Elsevier, Paris et SFAR[Citado en noviembre de 1996] Disponible en:http://www.sfar.org/sfar_actu/ca96/html/ca96_024/96_24.htm Vitez TS. A model for quality assurance in anaesthesiology. J Clin Anesth. 1990;2(4):280-7. Lagasse RS, Steinberg ES, Katz RI, Saubermann AJ. Defining quality of perioperative care by statistical process control of adverse outcomes. Anesthesiology. May 1995;82(5):1181-8. Cohen MM, Duncan PG, Pope WD, Biehl D, Tweed WA, McWilliam et al. The Canadian four-centre study of anaesthetic outcomes: II. Can outcomes be used to assess the quality of anaesthesia care? Can J Anaesth. 1992;39(5):430-9. Dixon N. Quality in Medical audit. In: Walker JS ed. Quality and safety in anaesthesia. London, British medical Journal Publishing Group, 1994:65-86. Kupperwasseur B. Evaluation de la Qualité des soins en anesthésie. Ann Fr Anesth Reanim. 1996;15(1):57-70. Sanborn KV, Castro J, Kuroda M, Thys DM. Voluntary reporting of QA incidents detected by electronic scanning of computerized anesthesia records. Anesthesiology 1995;83(suppl)A1075. Edsall DW, Jones BR, Smith NT. The anesthesia database, the automated record, and the quality assurance process. Int Anesthesiol Clin. 1992;30(2):71-92. Ausset S, Bouaziz H, Brosseau M, kinirons b and Benhamou D. Improvement of information gained from the pre-anaesthetic visit through a quality assurance programme. Br J Anaesth. 2002;88(2):280-3. REMIFENTANILO EN BOLUS Y ANESTESIA PEDIÁTRICA Sr. Director: Con motivo de la lectura de la carta de réplica del Dr. González1 a la carta al director “Anestesia con remifentanilo para timectomía toracoscópica en paciente pediátrico con miastenia gravis”2 nos gustaría realizar algunos comentarios. Por un lado agradecerle la brillante exposición de una aplicación práctica de un modelo farmacocinético a un fármaco tan interesante como el remifentanilo. Por otro intentar matizar el posible mensaje, desde nuestro punto de vista algo confuso, que se puede extrapolar tras su lectura. Frases como “Gran parte de esta controversia se sustenta posiblemente en los numerosos casos publicados de efectos secundarios derivados de este método de administración, tanto en pacientes adultos como pediátricos” o “…muy próximos a los 9 ng mL-1 en los cuales la rigidez torácica es ya muy manifiesta…” nos parecen demasiado categóricas. Creemos que pueden llevar a un estado de confusión sobre un fármaco que, según nuestra experiencia, presenta cuantitativamente menos efectos secundarios (rigidez, hipotensión y bradicardias) con repercusión clínica de los que se traduce tras leer la réplica. Además, se basa en la falta de seguridad de los bolus de remifentanilo para proponer otro modelo de administración del fármaco que por otra parte y como comentan el Dr. De Vicente et al2. puede ser igualmente válido. Esto puede provocar que cualquier anestesiólogo que no se dedique habitualmente a la anestesia pediátrica pueda “intimidarse” a la hora de emplear bolus de remifentanilo. Creemos que en situaciones como es el caso de la miastenia gravis presentado, o cualquier otra patología neuromuscular donde pueda estar contraindicado el uso de relajantes neuromusculares, el remifentanilo nos ayuda al control y tolerancia de la vía aérea y sus dispositivos. Se pueden utilizar bolus para disminuir la actividad 71 reflexógena de la vía aérea ante dispositivos como la mascarilla laríngea, bolus para un mejor control hemodinámico ante situaciones especialmente dolorosas o de gran estímulo adrenérgico3, o bolus para técnicas de corta duración y con estímulo doloroso donde la inmovilidad puede ser conveniente como por ejemplo son los procedimientos dolorosos que acompañan al diagnóstico y tratamiento de los enfermos oncológicos4. Queremos aportar, nuestra experiencia desde un punto de vista “clínico-epidemiológico”. En el “Internacional Society of paediatric oncology. SIOP XXXIII meeting” del año 2001 presentamos un póster5, exponiendo un protocolo de sedación para procedimientos dolorosos en oncología pediátrica. Dicho protocolo consistía en atropina a 0,01 mg Kg-1, propofol a 4 mg Kg-1 y remifentanilo a 3 µg Kg-1 en bolus administrados en menos de 30 seg. Incluímos 84 niños en edades comprendidas entre 5 meses y 14 años sometidos a medulogramas, biopsias óseas y punciones lumbares. Los niños se quedaban en apnea y se debía controlar la ventilación mientras fuera necesario. En el 90% de los casos no se produjo ningún movimiento durante el procedimiento y cuando se movieron no interfirieron en la técnica. La frecuencia cardiaca media previa a la anestesia fue de 108,4 latidos por minuto (lpm) y bajo anestesia de 93,7 lpm, encontrándose una significación estadística para una p<0,05 pero ninguna repercusión clínica. La saturación periférica de oxígeno se mantuvo dentro de los parámetros de normalidad. No observamos rigidez que impidiera la adecuada ventilación de los pacientes y el tiempo medio de apnea hasta la recuperación de la ventilación espontánea fue de 5 minutos y hasta la apertura espontánea de los ojos de 9,9 minutos. Ningún niño requirió intubación orotraqueal y el único efecto secundario observado fue prurito (45%) autolimitado en pocos minutos. Las condiciones para poder realizar el proceso eran que estuviesen en ayunas, hemodinámicamente estables y que no presentasen una masa mediastínica que pudiese comprometer la ventilación o la hemodinámica. Hemos adoptado este procedimiento como rutinario por su sencillez, eficacia y satisfacción tanto del paciente como de los padres, oncólogos pediátricos y anestesiólogos pediátricos y desde el año 2000 lo hemos puesto en práctica en 860 procedimientos oncológicos siendo una técnica satisfactoria para los 4 profesionales que nos dedicamos a la anestesia pediátrica. También nos ha permitido conocer mejor el fármaco para poder emplearlo tanto en bolus como en infusiones continuas en diversas especialidades (muy útil en procedimientos cortos como endoscopias digestivas, broncoscopios…) y en distintos grupos de edad (incluidos los neonatos). Podemos aportar algún caso extraordinario como un niño de 14 años afecto de una enfermedad de Duchenne evolucionada que ingresó de urgencias para un apendicitis realizándose una inducción (con bolus) y mantenimiento de propofol y remifentanilo y pudiendo extubar al enfermo al final de la intervención sin haber empleado relajantes musculares. También de los errores se puede aprender. Así, Bakan et al.6 presentan un caso de una administración intravenosa errónea de 25 µg kg-1 de remifentanilo en bolus en una niña 589










