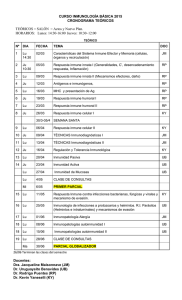
ESTRÉS, FACTORES PSICOSOCIALES Y SISTEMA INMUNE.
Anuncio

ESTRÉS, FACTORES PSICOSOCIALES Y SISTEMA INMUNE. (Stress, psychosocial factors, and immune system.) Cristina Vargas Pecino; Eugenia Oviedo Joekes; Humberto M. Trujillo Mendoza. Departamento de Psicología Social y Metodología de la Investigación, Universidad de Granada, España [email protected] PALABRAS CLAVE: Psiconeuroinmunología, Estrés, Factores psicosociales. KEYWORDS: Psychoneuroimmunology, Stress, Psychosocial factors. RESUMEN: El objetivo del presente trabajo es examinar las evidencias empíricas que vinculan el estrés y el sistema inmune, así como los distintos factores psicosociales que pueden modular esta relación. Estas investigaciones son desarrolladas en el marco de la Psiconeuroinmunología: disciplina que estudia la relación entre la conducta, el sistema nervioso y el sistema inmune, y cómo estas interacciones modulan la susceptibilidad y progresión de enfermedades inmunodependientes (p. ej. infecciones respiratorias y SIDA). En un primer momento analizaremos las interconexiones entre los sistemas involucrados, que se apoyan principalmente en estudios con animales. Posteriormente, revisaremos una amplia tipología de estresores psicológicos asociados con la modulación de la respuesta inmune en humanos. Examinaremos tanto estresores de gran magnitud (p. ej. duelo) como estresores crónicos (p. ej. cuidadores de enfermos de Alzheimer) o estresores en apariencia triviales (p. ej. situaciones de exámenes). En términos generales, el estrés se asocia con un deterioro de la función inmune, no obstante los estudios de estrés agudo reportan sistemáticamente un aumento en algunos parámetros. La influencia que ejercería el estrés sobre el sistema inmune no es homogénea, por lo cual las investigaciones han incluido la valoración de factores psicosociales como posible explicación a la discrepancia de los resultados. Entre estos mediadores destacan el afrontamiento y el apoyo social. Ambos moduladores han sido asociados con efectos beneficiosos sobre el sistema inmune. Evidencias menos consistente se han encontrado entre despresión y actividad del sistema inmune. Datos similares caracterizan las investigaciones que relacionan estrés con el inicio y progresión del SIDA y cáncer. Así mismo, se Congreso Virtual de Psiquiatría. Interpsiquis Enero 1970. Psiquiatria.com -1- considerarán distintos estudios que han comprobado cómo técnicas de tipo cognitivo-conductual para el tratamiento del estrés modulan la respuesta del sistema inmune. Para finalizar, expondremos diversas estimaciones teóricas y metodológicas sobre los resultados exhibidos, y futuras direcciones son sugeridas. Abstract The aim of this work is to investigate the empirical evidences about the association between stress and the immune system, as well as the different psychosocial factors that can modulate this relation. Most studies linking the immune system with psychosocial factors are developed in the field of Psychoneuroimmunology, PNI. PNI investigates the relation between brain, behavior and the immune system, and how these interactions can modulate the onset and progression of inmunodependent diseases (e. g. colds, AIDS). First, we analyze the interconnections between the nervous, endocrine, and immune systems, in which the main findings were obtained in studies with animals (mice, monkeys, etc.). Following, we review different types of stressors associated with the modulation of the immune response in humans. We consider major stressors (e. g. bereavement), chronic stressors (e. g. Alzheimer's caregivers) and minor stressors (e. g. academic exams). Usually, stress is associated with a downregulation of the immune function; nevertheless, some studies applying acute stress systematically report an increase in some parameters. Since the results obtained in the research of stress and the immune system is controversial, the investigations take account of psychosocial factors as a possible explanation of the disagreement. Psychosocial mediators like coping, social support, or optimism, have been associated with a better performance of the immune system. Less consistent have been the evidences linking depression and the immune system, nor is there evidence of the relation between psychosocial factors, including stress, in the onset and progression of some types of cancer, human immune virus (HIV) infection and AIDS. However, data from psychological interventions, such as cognitive-behavioral stress management or relaxation, renders hard evidence of immune modulation. To conclude, theoretical and methodological considerations are outlined and future directions are suggested. Introducción En las últimas décadas se han llevado a cabo investigaciones que proporcionan datos consistentes para aceptar una asociación entre factores psicosociales y enfermedades inmunodependientes (ej. 1-3). Estos primeros estudios científicos, y los adelantos en inmunología han contribuido al avance en el esclarecimiento de la relación entre los factores psicosociales y la salud. En las últimas dos décadas ayudados por los avances en técnicas moleculares, los investigadores de las diferentes disciplinas implicadas en esta red, han comenzado a reunir evidencias experimentales para comprender la relación entre el cerebro, la conducta y el sistema inmune (4). La psiconeuroinmunología (PNI) estudia la relación entre la conducta, el sistema nervioso y el sistema inmune. Es decir, estudia las interacciones entre estos sistemas, que modulan la susceptibilidad a enfermedades inmunodependientes o que afectan su proceso. Cuando un microorganismo intenta invadir el cuerpo, las reacciones de la función inmune que se pongan en marcha son un elemento crucial para determinar el resultado. Cuán susceptibles o resistentes sean los individuos a las infecciones o enfermedades inmunodependientes, parece estar relacionado con el estrés, los estados emocionales, y otros factores psicosociales. La psiconeuroinmunología intenta clarificar las bases científicas para una medicina humanista, y Congreso Virtual de Psiquiatría. Interpsiquis Enero 1970. Psiquiatria.com -2- desarrollar nuevos modelos de salud y enfermedad (5). Interconexiones entre el cerebro, la conducta y el sistema inmune El número de investigaciones que evalúan las conexiones entre el cerebro y el sistema inmune se han incrementado en las décadas recientes (6-10). Estos trabajos nos confirman la existencia de vías de comunicación bidireccional entre el cerebro y el sistema inmune. Ello ha provocado un cambio conceptual desde una visión disgregada de los distintos sistemas (nervioso, endocrino e inmune) hasta una concepción integradora donde cada componente tiene una función en las defensas del organismo (7). Las implicaciones de esta red para la conducta son enfatizadas por la psiconeuroinmunología (10). Estas interacciones bidireccionales entre los distintos sistemas, serían: Interacciones entre los sistemas nervioso e inmune Diferentes estudios han corroborado cómo el sistema nervioso central (SNC) es capaz de modular la respuesta inmune como consecuencia a lesiones específicas en el cerebro o mecanismos de inmunomodulación condicionada (12-14). Empleando como técnica de medida un tomógrafo por emisión de positrones (PET) se han obtenido correlaciones entre el flujo sanguíneo en ciertas regiones del cerebro y distintos parámetros inmunes. La actividad de las células asesinas naturales (natural killer, NK) correlacionan negativamente con la actividad bilateral en la corteza sensorial secundaria. Las respuestas al mitógeno concanavalina (Con A) correlacionan positivamente con actividad bilateral en la corteza sensorial, motora y visual secundaria, el tálamo, el putámen y el hipocampo izquierdo (15). Además, se ha encontrado una fuerte asociación entre parámetros inmunes implicados en la fibromialgia y actividad en las áreas sensorio motoras; estas áreas están relacionadas con la percepción del dolor, emoción y atención (16). Las vías de conexión más relevantes en esta comunicación son dos. Una hace referencia a la inervación directa de los tejidos linfoides primario y secundario por fibras nerviosas autonómicas y sensoriales. La segunda vía está mediada por hormonas de la pituitaria (17). Una vagotomía subdiafragmática atenúa los efectos depresivos del lipopolisacárido (LPS) y una clase de interleucina (IL), la IL-1, sobre conductas de ingerir. Estos resultados nos proporcionan un camino de comunicación desde el sistema inmune al cerebro mediante fibras aferentes vagales (18). Recientemente, se ha descubierto que el nervio glosofaríngeo constituye otra vía de interconexión. Este nervio se encargaría de transmitir las modificaciones inmunes producidas en la cavidad oral posterior al cerebro (19). Las células inmunes poseen receptores para neuropéptidos (por ejemplo, sustancia P, somatostatina y péptido intestinal vasoactivo; (20). Las catecolaminas inducen la linfocitosis (21) y pueden alterar los patrones de migración de los linfocitos (22). El incremento de subtipos de linfocitos afecta particularmente a las células NK; mecanismo Congreso Virtual de Psiquiatría. Interpsiquis Enero 1970. Psiquiatria.com -3- mediado por 2-adrenorreceptores (23). Por lo tanto, la estimulación de los adrenorreceptores altera la circulación y adhesión de las NK (24). Subtipos de receptores de serotonina han sido descubiertos en el tejido linfoide. Resultados que podrían explicar los efectos inmunoregulatorios incoherentes encontrados con la serotonina (25). El SNC juega un papel importante en la respuesta anti-inflamatoria sistémica, la cual surge como consecuencia ante la circulación de citocinas y procesos inflamatorios en el cerebro (26). Las citocinas son células inmunes que comunican el SNC con el sistema inmune a través de diferentes mecanismos de interacción (27). Poseen receptores en el cerebro, y además pueden ser segregadas por células cerebrales como astrocitos y/o microglias (28). En el hipocampo, los receptores de la IL-1 son abundantes. Una estimulación periférica de la función inmune incrementa el número de IL-1 en el hipocampo (11). Por otro lado, una administración central de IL-1ra (antagonista de la IL-1) atenúa la respuesta del SNC ante una inflamación periférica (29). Interacciones entre el sistema endocrino e inmune Ciertos órganos y células inmunes contienen receptores para hormonas liberadas en la hipófisis lo cual favorece la regulación conjunta (11). Así mismo, se ha encontrado receptores en los linfocitos B para una hormona de la hipófisis, concretamente, la hormona del crecimiento (growth hormone, GH) (30). Además, se ha observado como disminuciones en la GH se asocia con anormalidades en distintas medidas inmunes: células de la médula y el timo, función de las células T, actividad de las NK y respuestas de los anticuerpos (31). Otra hormona de la hipófesis, la prolactina (PRL), está vinculada con la regulación de los linfocitos T (32). La IL-1, IL-6 y el factor de necrosis tumoral alfa (tumor necroses factor, TNF activan el eje hipotálamo-hipófesis-adrenal (HPA) en respuesta a diferentes amenazas a la homeostasis. Los receptores de estas citocinas están presentes en los tejidos asociados con el eje HPA. Algunos de estos tejidos son capaces de sintetizarlas. Por consiguiente, los caminos que median la influencia de las citocinas sobre el eje HPA son diversos (33). La activación del eje HPA interviene de forma decisiva en la respuesta antiinflamatoria sistémica (26). La liberación de la hormona adrenocorticotropa (ACTH) incrementa la salida de glucocorticoides. Este aumento de glucocorticoides produce acciones inmunosupresivas y respuestas antiinflamatorias (34). Además, los glucocorticoides suprimen el número de monocitos en circulación, la actividad de las células NK y la producción de citocinas (35). La IL-2 estimula la secreción de la hormona liberadora de corticotropina (CRH). Esta asociación es potenciada por la acción conjunta de la IL-1 y IL-2. El efecto, en ambos casos, es inhibido por los glucocoricoides (36). Interacciones entre el sistema inmune y la conducta La liberación de citocinas proinflamatorias en el organismo en general, y en el cerebro y/o médula espinal en particular, conduce a una hiperalgesia (37). El incremento de citocinas en el organismo Congreso Virtual de Psiquiatría. Interpsiquis Enero 1970. Psiquiatria.com -4- es inducido por agentes patógenos a través de un neurocircuito (38). Las citocinas proinflamatorias provocan respuestas de enfermedad consistentes en cambios fisiológicos (fiebre, aumento de sueño y alteraciones en la química de la sangre) y conductuales, como disminución en locomoción, conductas sexuales, exploración, agresión y consumo de comida y agua (28, 37, 39). Estas respuestas pueden ser provocadas por la administración periférica de LPS y disminuidas con IL-1ra (40). Las citocinas rhTNF y rhIL-1; suprimen la conducta de ingerir a nivel central (41), mientras que la administración de LPS y IL-1 son las encargadas de inhibir la ingesta a nivel periférico (18). En la actualidad se están empleando tratamientos con citocinas. Se ha observado como las citocinas pueden repercutir en efectos psiquiátricos negativos (28). Como veremos posteriormente, investigaciones realizadas con humanos y animales han confirmado el efecto inmunosupresor del estrés (12, 42, 43). No obstante, los estudios más recientes indican que el efecto del estrés modula el sistema inmune en una doble dirección. El estrés agudo aumenta ciertos aspectos inmunes y el estrés crónico disminuye determinadas células inmunes (44). Por otro lado, el efecto que un estresor puede producir en el sistema inmune cambia en función de las células objeto de examen. Por ejemplo, un estresor agudo puede producir aumentos en la inmunidad innata (óxido nítrico) y una supresión en la inmunidad adquirida, en concreto, en las células T específicas al antígeno (46). Uno de los campos que aportan datos fundamentales para intentar esclarecer los mecanismos que subyacen a la relación entre el sistema inmune y la conducta es el condicionamiento clásico de respuestas fisiológicas y conductuales. El condicionamiento clásico es un proceso mediante el cual una sustancia, objeto o evento, inicialmente neutros, denominado estímulo condicionado (EC), es asociado a una sustancia, objeto o evento que no es neutro, denominado estímulo incondicionado (EI), con el resultado que el EC, por sí mismo, adquiere la capacidad de suscitar una respuesta semejante a la que provoca el EI. En estudios con animales, tanto las investigaciones sobre inmunosupresión por condicionamiento clásico (46-51), así como las que indican un aumento de la respuesta inmune (52-55), o respuestas compensatorias (56-59) confirman la participación de variables conductuales en la modulación del sistema inmune. También se han realizado algunos estudios de condicionamiento en humanos, por ejemplo, se ha conseguido reducir la respuesta de hipersensibilidad retardada a la tuberculina (60). Utilizando ya un protocolo menos ingenuo, Buske-Kirschbaum, Kirschbaum, Stierle, Lehnert, y Hellhammer (61) consiguieron aumentar por condicionamiento la actividad de las células NK en estudiantes sanos, resultados que se confirmaron en un siguiente estudio (62). Las drogas citotóxicas usadas en quimioterapia contra el cáncer tienen dos importantes efectos secundarios: náuseas e inmunosupresión. Se ha considerado que las náuseas anticipatorias pueden ser el resultado de un condicionamiento clásico, donde las náuseas serían la respuesta condicionada, que se evoca tras la exposición al ambiente del hospital (EC), el que ha sido asociado con la droga citotóxica (EI), la cual tiene un efecto emético (RI). Dado que la Congreso Virtual de Psiquiatría. Interpsiquis Enero 1970. Psiquiatria.com -5- quimioterapia produce tanto emesis como inmunosupresión, cabe la posibilidad de que los pacientes desarrollen supresión inmune condicionada a la par de las náuseas y vómitos condicionados (63). Para investigar esta hipótesis, Bovbjerg et al. (63) llevaron a cabo un estudio con mujeres bajo quimioterapia (principalmente ciclofosfamida), a quienes se les tomaba primero una muestra de sangre en sus hogares, y algunos días después, otra muestra en el hospital, antes del inicio de la sesión de quimioterapia. Las medidas obtenidas en el hospital reflejan una respuesta linfocitaria ante la fitohemaglutinina (PHA) y la Con A (mitógenos de células T) menor que las recogidas en los hogares, así como más náuseas y vómitos. No obstante Fredikson et al. (64) no consiguieron replicar estos resultados, observando un aumento general de granulocitos en el momento previo a la sesión de quimioterapia. Sin embargo encuentran inmunosupresión condicionada en pacientes con mayor ansiedad en comparación con los de ansiedad más baja, tanto en el hospital como en el hogar. En otros dos estudios se encuentran también aumentos de la respuesta inmune ante estímulos condicionados en las medidas obtenidas en el hospital en comparación con las recogidas en los hogares de los pacientes: Incremento en la actividad citotóxica de las células NK (65); y un mayor porcentaje de granulocitos e incremento de la respuesta proliferativa ante el mitógeno Con A (66). Con una muestra pediátrica, Stockhorst et al. (14) registran también un aumento de la respuesta inmune por condicionamiento, incremento que fue especialmente mayor en los pacientes que también mostraban vómitos y náuseas anticipatorios. La disparidad de los resultados (aumento y disminución de la respuesta inmune) podría explicarse en razón de la intensidad del EI, la duración de la reexposición al EC, y las características de las drogas anticancerígenas (14). Estrés y el sistema inmune El estudio de factores conductuales que contribuyen a la inmunomodulación asociada a estresores físicos y sociales es, en general, impracticable en humanos por la clase de procedimientos necesarios para indagar en los mecanismos subyacentes. Por esta razón dichos estudios se realizan principalmente con animales. Modelos animales en el estudio del estrés y el sistema inmune Numerosas investigaciones han surgido, que indican que diferentes aspectos de la función inmune pueden ser influidos por eventos estresores. El impacto de los estresores en el funcionamiento inmune puede depender de las características del estresor utilizado (severidad, cronicidad, predictibilidad y controlabilidad), de factores históricos (experiencia previa con estresores agudos o crónicos) y de factores organísmicos (edad, sexo, especie y variedad de los animales) (67, 68). Además, el efecto de todos estos factores puede variar en función del lugar (bazo, torrente sanguíneo, etc.) y el tipo de medida inmunológica (celular o humoral) que haya sido estimada. De manera general podemos dividir los estudios del estrés y el funcionamiento inmune en animales, en aquellos que han utilizado estresores físicos y los que han utilizado estresores sociales o psicológicos. Entre los estresores físicos, los más utilizados son la descarga eléctrica y la inmovilización, aunque también se han utilizados otros como la exposición al agua fría. Entre los estresores psicológicos o sociales, se han estudiado la separación de la madre o del grupo de pares, las relaciones entre residentes e intrusos, el aislamiento, y la densidad demográfica, entre otros. Congreso Virtual de Psiquiatría. Interpsiquis Enero 1970. Psiquiatria.com -6- En general, la descarga eléctrica produce un detrimento de la función inmune (69-71). No obstante, algunos autores destacan que no es la descarga eléctrica en sí la que causa una disminución de la respuesta inmune, sino una situación conflictiva o ambigua (72), un estímulo aversivo condicionado (73), el número de descargas (74), o la controlabilidad del estresor (75, 76). Los estudios que han utilizado como estresor la inmovilización del animal, encuentran una supresión generalizada, tanto celular como humoral (77-79). En otros estudios se han registrado también aumentos de la respuesta inmune tras estrés por inmovilización (44, 68, 80, 81). Los modelos de estrés social o psicológico y su relación con la respuesta inmune estudiados en animales, se han versado sobre la densidad de población, relación entre los miembros del grupo con respecto a su posición social, el aislamiento, la separación materna o del grupo de pertenencia, y las relaciones diádicas. Por ejemplo, la confrontación y derrota social de intrusos se ha asociado a una disminución significativa algunos parámetros inmunes (82), variando los valores en relación con el tiempo de exposición (83). Algunos autores señalan que es la naturaleza de la interacción más que el ser sometido por el residente y expuesto a un lugar novedoso, lo que tendría mayor influencia en el sistema inmune (82, 83). Dentro del modelo de estrés psicológico por separación materna o del grupo de pertenencia, la deprivación materna temprana se asocia con una disminución significativa de la respuesta inmune (84), y con diferencias en la respuesta ante estresores en ratas jóvenes en relación con el tipo de cuidado materno que recibieron en edad temprana (85). Algunos estudios sugieren que no es la separación de la madre, sino la separación de un ambiente familiar lo que reduce significativamente la respuesta inmune (86, 87). Estrés y función inmune en humanos Las investigaciones realizadas recientemente han proporcionado evidencias empíricas sobre la asociación entre eventos estresantes de la vida y modulaciones en el sistema inmune (88-91). En la literatura científica no prevalece un consenso con respecto la definición de estrés. Este término, stress, aparece publicado por primera vez en la revista Nature. Hans Selye fue quien introdujo este vocablo en el ámbito de la salud. Él define el estrés como la respuesta general del organismo ante cualquier estímulo o situación estresante. Esta reacción fisiológica ante un estímulo nocivo inespecífico manifiesta un patrón de respuesta común ante todo tipo de estresores. Este modelo de respuesta fue denominado por Selye como "Síndrome General de Adaptación" (92-94). Posteriormente, el término se ha utilizado con múltiples significados. El estrés se ha abordado desde tres perspectivas distintas: ambiental, biológica y psicológica. En la valoración ambiental se centran en los sucesos externos o experiencias objetivas. La orientación biológica se caracteriza por su análisis de la activación de los sistemas fisiológicos específicos. Por último, la tradición psicológica se centra en las evaluaciones de los individuos sobre las demandas externas y los recursos que poseen para afrontar dichas demandas (95-97). No obstante, el modelo teórico transaccional de estrés y afrontamiento (98) es el habitualmente Congreso Virtual de Psiquiatría. Interpsiquis Enero 1970. Psiquiatria.com -7- empleado en psicología. Este modelo no considera el estrés como un estímulo ni como una respuesta, sino el resultado de la relación dinámica entre el individuo y el entorno. Las personas evalúan el entorno como gravoso o excedente de sus recursos, lo cual, constituye una amenaza para su bienestar (92, 99, 100). Los estímulos que han sido investigados como originarios de estrés en los individuos conforman una tipología muy amplia (por ejemplo, los físicos y sociales). En el presente, prevalecen los estresores de carácter psicológico tanto en los estudios de campo como de laboratorio (101-109). Entre otros posibles, en este trabajo se atienden a los siguientes: situación de duelo, divorcio, cuidado de familiares con enfermedades crónicas, estrés académico, situaciones traumáticas, desastres naturales y estresores de laboratorio. A) Duelo Son diversos los estudios que han analizado el duelo posterior a la pérdida del cónyuge (88, 107, 110, 111). Este acontecimiento constituye probablemente el estresor más severo en la vida de los humanos. Los datos epidemiológicos nos informan que los viudas/os sufren mayor morbidez y mortalidad durante el año siguiente al fallecimiento de su pareja en comparación con sujetos que no experimentan dicho suceso (43). Una investigación pionera es la realizada a finales de la década de los 70 (88). Este estudio descubrió una respuesta deprimida de los linfocitos T a la estimulación de los mitógenos Con A y PHA 6 semanas después del fallecimiento del cónyuge. En cambio, no se observó anormalidades en otros parámetros inmunes: número de linfocitos T y B, y concentraciones de inmunoglobulinas (Ig) séricas de las subclases G, A y M. Una investigación posterior, confirmó como una repuesta disminuida de los linfocitos T a los mitógenos Con A y PHA, además de al mitógeno pokeweed (PWM), se producía tras los primeros meses de duelo (111). Las células NK juegan un papel importante en la respuesta inmune innata. Determinados autores observaron como estas células manifiestan una actividad inferior en un grupo de mujeres cuyos maridos habían fallecido recientemente (107). En cambio, estos resultados no fueron confirmados posteriormente (112). Por otro lado, cambios adversos en el desarrollo del virus de inmunodeficiencia humano (HIV) clase 1, han sido hallados en hombres homosexuales cero positivos quienes habían experimentado el fallecimiento de su pareja (110). Estas modificaciones hacen referencia a una disminución en la respuesta proliferativa al mitógeno PHA y un aumento en la medida de suero de la activación inmune. Empleando una muestra de características similares se ha observado una disminución de la citotoxicidad de las células NK y de la respuesta de los linfocitos T al mitógeno PHA en aquellos sujetos que han experimentado un duelo (113). En una investigación comparable a las anteriores, se encontró como el afrontamiento modula la relación entre este estresor y el deterioro en el sistema inmune (114). Los sujetos que mejor afrontaban el duelo tras el fallecimiento de una pareja o amigo manifestaban aspectos inmunes más positivos frente aquellos que no afrontaban ese estresor. Por lo tanto, un afrontamiento adecuado modula los efectos negativos que puede causar el duelo, presentando un menor declive de las células T CD4 en el periodo de 2 a 3 años siguientes y un promedio menor de mortalidad relativa al síndrome de inmunodeficiencia adquirida (SIDA), en el periodo de 4 a 9 años siguientes. Congreso Virtual de Psiquiatría. Interpsiquis Enero 1970. Psiquiatria.com -8- B) Divorcio y calidad de las interacciones en la relación matrimonial. El divorcio o separación son contecimientos valorados como muy estresantes. Los estudios epidemiológicos nos muestran que estas situaciones están asociadas a tasas altas de trastornos físicos y emocionales (43). Asimismo, la calidad de las interacciones en la pareja influye en la salud: consecuencias endocrinas, inmunes y cardiovasculares, etc. (109). En este ámbito destacan dos estudios precursores realizados por Kiecolt-Glaser y colaboradores. Su primera investigación mostró una relación positiva entre divorcio y deterioro en el sistema inmune. El grupo de mujeres divorciadas presentaba un funcionamiento más desfavorable del sistema inmune en 5 de las 6 medidas valoradas (menor respuesta a los mitógenos PHA y Con A, porcentajes inferiores de las células Tc, y NK y título de anticuerpos al virus Epstein-Barr (EBV) más altos con respecto a mujeres casadas (116). Seguidamente, realizaron otro experimento con igual discurso aunque en esta ocasión emplean una muestra de hombres. Aquellos sujetos separados o divorciados mostraban títulos de anticuerpos más elevados al virus del herpes simple (HSV), al citomegalovirus (VCA) y al EBV frente al grupo de casados (117). Estos dos estudios referidos muestran la necesidad de analizar otra variable: calidad de la relación. Aquellas parejas que manifestaban una menor cordialidad presentaban modulaciones inmunes adversas. Para ello, estos autores diseñaron una serie de investigaciones para examinar esta hipótesis y los mecanismos subyacentes (118-120). En esta sucesión de experimentos recurrían a muestras de recién casados. Estos exámenes se realizaban en el laboratorio. Las parejas discutían durante 30 minutos problemas relacionados con el matrimonio. Los investigadores observaban las conductas manifestadas durante la disputa. Las parejas que expresaban conductas más negativas u hostiles durante la discusión, mostraban una disminución superior de parámetros inmunes (lisis de las células NK, las respuestas de los linfocitos a los mitógenos Con A y PHA y la respuesta a un anticuerpo monoclonal al receptor T3) 24 horas después. También presentaban una mayor reducción en el porcentaje de los macrófagos y título de anticuerpos al EBV latente. En cambio, estos sujetos mostraban un mayor incremento sobre aspectos cuantitativos del sistema inmune (número absoluto de linfocitos T3 y T4 y más neutrófilos). Asimismo, se observó una interacción entre la variable sexo y respuesta inmune. Las mujeres mostraron mayores cambios inmunes negativos que los hombres (119). Estas diferencias de género son observadas posteriormente (120, 121). En un estudio sucesivo, emplearon una muestra de ancianos para averiguar sí esta relación se mantiene en este grupo de edad. Estos autores encontraron resultados muy similares. Aquellas personas que se caracterizaban por un incremento de conductas negativas y baja satisfacción matrimonial, mostraban una pobre respuesta inmune: respuesta de los linfocitos a los mitógenos Con A y PHA y títulos de anticuerpos al EBV (91). Igualmente, en una investigación reciente se han examinado las consecuencias del conflicto matrimonial utilizando un modelo de laboratorio. Descubrieron una movilización selectiva de subtipos específicos de linfocitos (T CD8+ , NK, CD62L- NK y aumento en la citotoxicidad de las NK) frente a otros subtipos que permanecían inamovibles, concretamente, CD62L+ NK y T CD4+ (122). Congreso Virtual de Psiquiatría. Interpsiquis Enero 1970. Psiquiatria.com -9- Los análisis realizados para averiguar los mecanismos que subyacen entre las relaciones personales y salud, destaca el sistema endocrino como modulador de dichos vínculos (123). C) Personas que tienen a su cargo el cuidado de familiares enfermos crónicos. Abundantes investigaciones se han interesado por aquellos individuos encargados de cuidar a un familiar con una enfermedad crónica (por ejemplo, Alzheimer). Estas situaciones de asistencia continua son englobadas dentro del grupo de estresores crónicos. Las personas sometidas a este tipo de responsabilidad pueden presentar problemas serios de salud (124). Al igual que ha sucedido en el apartado anterior, Kiecolt-Glaser y colaboradores efectúan diversos estudios para averiguar la relación entre cuidadores de enfermos de Alzheimer y sistema inmune (105, 108, 125, 126). En una primera aproximación, encontraron que estos cuidadores mostraban porcentajes más bajos en varios parámetros inmunes: linfocitos T totales, Th, cocientes de T4 :T 8 y elevados títulos de anticuerpos al EBV (108). Posteriormente, este grupo de investigación analizó las consecuencias de este estresor en otros aspectos inmunes. En este estudio encontraron que los cuidadores mostraban una respuesta funcional disminuida (deterioro de la respuesta linfocitaria a los mitógenos Con A y PHA) e informaban de un porcentaje superior de enfermedades infecciosas, predominando las infecciones leves del tracto respiratorio (125). De igual forma se ha comprobado como una citocina puede ser modulada. La IL-1 responde con deficiencia a la estimulación de un LPS (127). En los últimos años, estos resultados han sido confirmados (128). En esta circunstancia se examinó al grupo de cuidadores bajo condiciones de descanso y después de un periodo de estrés psicológico agudo. Los individuos fueron divididos en dos agrupaciones: vulnerables y no-vulnerables. Los sujetos vulnerables manifestaban un 60% menos de CD62L- sobre linfocitos Tc CD8+ pero no diferían en células CD62L+ sobre CD8+. Además, estos individuos presentaban niveles pobres de linfocitos T CD62- los linfocitos Th CD4+, aunque no discrepaban en las células CD62L+ sobre CD4+. En referencia a los estresores agudos, el incremento en la circulación de los niveles de linfocitos CD62L- sobre CD8+ y CD62L+ sobre CD8+ se produjo en ambos grupos. Otros autores han observado como los cuidadores mostraban una pobre respuesta de los anticuerpos a la vacuna de la gripe. Este déficit expone a una mayor vulnerabilidad a los individuos que componen esta muestra, pues son incapaces de desarrollar una respuesta inmune adecuada (129). Asimismo, el grupo de cuidadores ha manifestado una respuesta inmune disminuida en diferentes parámetros: menor producción de IL-2 y deficiente respuesta linfocitaria al mitógeno PHA (102). La línea de investigación de Kiecolt-Glaser y colaboradores se plantearon sí las consecuencias negativas del cuidado desaparecían tras el fallecimiento del enfermo. En un primer estudio, este grupo de trabajo comprobaron que aunque haya pasado en general dos años desde la defunción del paciente con Alzheimer, tanto el grupo de cuidadores anteriores como actuales manifiestan un respuesta inmune deteriorada. Estos sujetos presentaban una capacidad disminuida de las células Congreso Virtual de Psiquiatría. Interpsiquis Enero 1970. Psiquiatria.com -10- NK al responder a rIFN- o rIL-2 in vitro (105). Un par de años después, se corrobora como ambos grupos manifiestan déficit semejantes. Los cuidadores anteriores y actuales manifiestan una respuesta de las células NK que eran enriquecidas (E-NK) a rIFN- o al rIL-2 deficitaria (130). Una posible vía de comunicación entre el estrés crónico y sistema inmune es el aumento en la sensibilidad de los receptores -adrenérgicos de los linfocitos. Mills y colaboradores (131) encontraron que el grupo de cuidadores altamente estresados mostraban esta pauta. Por último, la inmunosupresión que presentan los cuidadores podría tener consecuencias mayores en función de la edad. Las diferencias entre los cuidadores y grupos controles aumentan en individuos más jóvenes (132). D) Estrés académico. Hasta ahora hemos presentado estresores cuya magnitud es considerada, por lo cual era de esperar sus efectos inmunosupresores. La pregunta es sí estresores de menor magnitud (por jemplo, estrés académico) inducen a consecuencias similares a las observadas con estresores de dimensiones trascendentales. Un estresor de tales características prontamente examinado ha sido el estrés que provoca los exámenes académicos (90, 133-136). En un estudio pionero en este ámbito, se empleó como variable dependiente una medida inmune que puede obtenerse sin recurrir a métodos invasivos: la Ig A secretada (s-IgA). Los estudiantes participantes del estudio manifestaban un promedio de s-IgA en saliva inferior en los periodos de exámenes (mayor estrés) frente a aquellos más relajados, etapas no coincidente con épocas de exámenes (135). En cambio, estos resultados no fueron confirmados por otros autores (136). Sí obtuvieron cambios significativos en otros parámetros inmunes: actividad de las NK e incrementos en plasma total de Ig A. Posteriormente, otras investigaciones han corroborado que el estrés académico puede disminuir las concentraciones de s-IgA (90, 137). En el grupo de las evaluaciones de parámetros inmunes in vivo, un tipo de medida indirecta es la cuantificación de los anticuerpos a los herpes virus. Este tipo de medida ha sido empleada en numerosas ocasiones para valorar el estrés académico. Los estudiantes que se encontraban en períodos de exámenes presentaban incrementos en los títulos de anticuerpos a EBV, HSV-1 y CMV pero no al polivirus tipo 2 (133). Posteriormente, se han examinado los anticuerpos implicados y se ha valorado la activación del herpevirus latente. En una estudio temprano se descubrió un incremento del título de anticuerpo IgG a EBV (138). Igualmente, otros autores obtuvieron aumentos de los títulos de anticuerpos Ig G, además de los de s-IgA, ante el EBV en periodos de exámenes (139). En otro estudio de estrés académico se utilizaba una muestra con características peculiares (cadetes de West Point) que experimentaban dos estresores diferentes. Los investigadores observaron que en el primer estresor (Entrenamiento Básico de los Cadetes) no se produjeron cambios significativos en la reacción a los distintos herpes virus: EBV, virus del herpes simple tipo 1 (HSV-1) y herpesvirus humano 6 (HHV-6). En el segundo estresor (exámenes finales) los títulos de anticuerpos del EBV eran más altos, aunque no en el HSV-1 y HHV-6 (140). Congreso Virtual de Psiquiatría. Interpsiquis Enero 1970. Psiquiatria.com -11- Con respectos otras medidas inmunes, también se han encontrado un déficit en época de exámenes. La producción de interferones por los leucocitos ante la estimulación de Con A y las NK disminuyen durante la etapa de exámenes (134). Igualmente, la respuesta de los linfocitos a los mitógenos ConA y PWN y la producción de IFN desciende. Contrario a las expectativas, se produjo un aumento de las IL-1 después del examen (104). Los resultados muestran una paradójica disociación entre la producción de IFN y IL-1, lo cual sugiere que el estrés afecta a células que producen IL-1, como lo son los monocitos, de forma diferente a la que afecta a los linfocitos productores de IFN. Las consecuencias de estas modulaciones del estrés académico sobre el sistema inmune pueden ser diversas. Por ejemplo, la capacidad del sujeto para desarrollar la seroconversión ante la administración de una vacuna de hepatitis B puede ser influenciada por el estrés. Los estudiantes que eran más ansiosos y más estresantes mostraban un retraso en la serocorversión (89). La disposición del organismo para la recuperación del tejido ante heridas, puede ser modificado por el estrés. Los estudiantes manifiestan un promedio de tres días más para completar la curación de sus heridas en el paladar durante la época de exámenes frente al periodo de vacaciones. La producción de IL-1 disminuye durante el período de estrés, ello puede proporcionar evidencias de un posible mecanismo inmunológico en el retraso de la curación de las heridas (141). En general, estos datos sugieren que el estrés académico, considerado un estresor leve, puede modular la actividad inmunológica. Estos cambios inmunes afectarían a diferentes componentes del sistema inmune, lo cual podría repercutir en la salud de los individuos. E) Situaciones traumáticas y catastróficas. Los sucesos traumáticos y los desastres forman parte de nuestra vida diaria. El número de sujetos que sufren los estragos psicológicos y orgánicos producidos por los traumas o desastres son muy amplios. Estas situaciones pueden ocasionar un devastador impacto sobre la salud física y psíquica de los individuos, siendo además la respuesta a este tipo de acontecimiento muy variada (142). Un acontecimiento trágico que ha sido examinado en numerosas ocasiones es el accidente nuclear de Three Mile Island (TMI) acaecido en marzo de 1979. Este suceso ha suscitado aumentos en la morbilidad física y psíquicas de los residentes de la zona (143, 144). Una década posterior al accidente nuclear, el grupo de residentes presentaban alteraciones inmunes: aumentos en neutrófilos y títulos de anticuerpos a HVS y CMV, así como una disminución de células B, Ts, Tc y NK (145). Otro evento que ocasiona enormes consecuencias materiales y humanas son los terremotos. Ello ha originado el desarrollo de diversas investigaciones tras un seísmo (146-148). Una vez acaecido el terremoto de Northridge, los empleados de un centro médico fueron examinados en diversas ocasiones. Los sujetos con niveles altos de distrés en la primera medida tenían menos células CD8+ y CD3+ que aquellos sujetos con niveles bajos de distrés. Estas diferencias no eran muy grandes en la tercera medida. Por otro lado, los sujetos con niveles altos de distrés específico al terremoto mostraban aumentos en las células CD4+, CD3+ y CD19+ y una repuesta de los linfocitos al mitógeno PHA disminuida. Estos últimos datos se mantenían constantes en las Congreso Virtual de Psiquiatría. Interpsiquis Enero 1970. Psiquiatria.com -12- distintas medidas (148). Los efectos del terremoto Hanshin-Awaji fueron examinados en una muestra de trabajadores después de transcurrir de 12 a 16 meses. Los sujetos que presentaban síntomas de estrés post-traumático (post traumatic stress disorder, PTSD) mostraban una actividad disminuida de las células NK (146). Recientemente, un estudio se ha centrado en el seísmo producido en Armenia. Aquellos individuos que habían sufrido el terremoto manifestaban aumentos de cromosomas anómalos en los linfocitos (147). Una vez sucedido los desastres, el proceso de recuperación requiere un intenso trabajo tanto físico como psíquico. Por ello, determinados autores examinaron el impacto que producía en los trabajadores sus labores de rescate y limpieza de la zona donde se ha había originado un desastre aéreo (Vuelo 427 de USAir). Los empleados que eran expuestos a cuerpos o partes de los mismo pero no se encontraban en el depósito de cadáveres, mostraban una actividad de las NK elevada en la primera medida. En cambio, los niveles de NK eran inferiores en el segundo período de medida. El incremento hallado de la actividad de las NK no es coherente con las situaciones de estrés crónico. Estos resultados pueden deberse a que los sujetos experimentaban nuevamente el estrés agudo, ya que estos eran entrevistados para conversar sobre el accidente (149). Los huracanes constituyen otro suceso devastador que azota con mayor frecuencia a determinadas zonas de la tierra. Un estudio evaluó el impacto a corto plazo ocasionado por el huracán Andrew. Con este objetivo, examinaron una muestra de 180 voluntarios. Aquellos individuos que presentan índices superiores de síntomas post-traumáticos e indican una mayor experiencia con el huracán, manifiestan medidas inmunes más deficiente, en particular, bajos niveles de células NK (150). Los estragos que producen los eventos bélicos son numerosos. En un grupo de veteranos de Vietnam, un porcentaje elevado de sujetos manifestaban PTSD como consecuencia de las exposiciones a los combates desencadenados en Vietnam. Además, el PTSD actual estaba asociado con diversas medidas inmunes: niveles elevados de células blancas, linfocitos totales, células T, CD4 y CD8 (151). La asociación entre PTSD e inmunosupresión ha sido mostrada por otros autores (152). F) Estudios en laboratorio Como hemos visto, los estímulos que desencadenan estrés en los individuos componen una tipología extensa (por ejemplo, calidad en las relaciones de pareja). Estas investigaciones han sido desarrolladas en contextos donde el control de variables es inferior al registrado en los laboratorios. Este último ámbito de estudio se caracteriza por un examen más exhaustivo sobre las variables dependientes, independientes y extrañas. Estas cualidades facilitan el esclarecimiento de las complejas relaciones objeto de nuestro estudio. Los estresores psicológicos empleados esencialmente en los laboratorios son: tarea de Stroop, de aritmética, de videojuegos, de resolución de problemas, de tiempo de reacción y tareas de hablar en público (153). En general, los resultados en el laboratorio confirman una asociación entre los distintos estresores psicológicos y el sistema inmune (103, 154-158). Consiguientemente, los datos corroboran cómo el estrés de laboratorio afecta a diferentes células inmunes como las NK, CD4, macrófagos o s-IgA. Congreso Virtual de Psiquiatría. Interpsiquis Enero 1970. Psiquiatria.com -13- Las tareas aritméticas constituyen un estresor ampliamente empleado en el laboratorio. Estas tareas se basan en la aplicación de diversas operaciones (por ejemplo, la adición) para producir efectos estresantes (159-162). Aplicando las tareas aritméticas como estresor se ha hallado un efecto de la edad sobre los parámetros inmunes. El grupo de jóvenes (entre 21 y 41 años) y ancianos (entre 65 y 85 años) presentaban un aumento en la cantidad de CD8 y células NK; en cambio, sólo el conjunto formado por jóvenes mostraba una elevación en la actividad de las NK. Diferencias que pueden deberse al deterioro del sistema inmune con el transcurrir del tiempo (158). Las condiciones de control que proporciona el laboratorio ha permitido averiguar si la relación entre estrés y células NK cambia en función del período del día (mañana y tarde). Durante la ejecutción de la tarea aritmética no se manifestaron diferencias entre las distintas etapas del día (en ambas se produce una elevación de la cuantía de NK). Una vez finalizada la tarea, el grupo de mañana sigue con los niveles aumentados de NK y los individuos que participan por la tarde exhiben un descenso. Esta relación es idéntica a la obtenida entre estresor y actividad de las NK (155). Las características de un estresor, en este caso la tarea aritmética, pueden modular el sistema inmune de forma diferente. La manipulación de la dificultad de la tarea no afecta a los niveles de s-IgA. No obstante, el orden de la tarea sí tiene consecuencias sobre la concentración de s-IgA. La primera presentación se asocia con niveles superiores de s-IgA (163). El grupo de tareas de "hablar en público" está constituido por diversas alternativas: entrevistas estresantes, discusiones sobre problemas de la vida diaria, etc. Estos estresores han sido asociados con parámetros inmunes: aumentos en células NK, disminución en las CD4, deterioro de la respuesta proliferativa de los linfocitos T al mitógeno PHA (156), así como una disminución de la respuesta proliferativa al mitógeno Con A, una elevación en CD8 y un descenso en linfocitos B (109). Otros autores combinan dos tareas estresantes en una mismo sesión experimental: hablar en público y ejercicio físico (157, 164). Con ello, pretenden delimitar el efecto de diferentes estresores sobre el sistema inmune. Por ejemplo, la producción de interleucina 6 (IL-6) y del factor de necrosis tumoral (TNF-) difiere en función del estímulo estresante. Ambos estresores (hablar en público y el ejercicio físico) provocan un aumento en IL-6. En cambio, sólo el ejercicio físico produce un incremento en TNF-, resultado que es moderado por la infusión de isoproterenol (164). No obstante, en otro estudio se observó que ambos estresores afectaban a idénticos parámetros inmunes (granulocitos, monocitos y subtipos de linfocitos). La diferencia se centraba en la intensidad, es decir, el efecto es más prominente en la tarea de ejercicio exhaustivo (157). El test "Stroop" es otro potente estresor de laboratorio. La tarea consiste en la presentación simultánea de dos estímulos donde los individuos deben concentrarse en uno de ellos e ignorar el otro. Los resultados encontrados con el test Stroop son similares a los observados con otros estresores de laboratorio: aumentos en la cuantía de células NK y CD8, y un descenso de la respuesta proliferativa de los linfocitos T al mitógeno PHA (106). Finalmente, mediante dos estresores de laboratorio (test de memoria y un vídeo con imágenes de Congreso Virtual de Psiquiatría. Interpsiquis Enero 1970. Psiquiatria.com -14- una intervención quirúrgica) se ha examinado sí el estilo de afrontamiento amortigua el efecto de los estresores. Como veremos en un apartado posterior, esta variable ha sido vinculada con parámetros inmunes. Las tareas incluidas en el experimento estimulaban distinto estilo de afrontamiento (afrontamiento activo o afrontamiento pasivo). La concentración de s-IgA aumentaba en el test de memoria el cual requería un afrontamiento activo. No obstante, el vídeo no producía modificaciones de forma inmediata en las concentraciones de s-IgA. Este estresor disminuía la concentración de s-IgA durante el periodo de recuperación (165). Factores psicológicos y psicosociales que modulan el efecto del estrés en el sistema inmune Las personas no son afectadas de la misma manera ante un mismo estresor, por lo que el impacto del estrés en la salud no siempre es el mismo. Los factores genéticos no dan cuenta de toda la variabilidad individual en la sensibilidad ante el estrés (166), lo que ha llevado a investigar el papel de los factores psicosociales como moduladores (mediadores) de su efecto en la salud. Disposiciones Personales La idea de que las personas tenemos (o carecemos) de ciertas disposiciones personales que implicarían una tendencia a adquirir (o no) algunas enfermedades, afectando así mismo a su desarrollo y desenlace, ha estado presente en la explicación de enfermedades, principalmente las idiopáticas. Algunas de las disposiciones personales investigadas en las últimas décadas se han considerado moderadoras del efecto del estrés en la salud en relación con variables de corte inmunológico. A partir de la publicación de Kobasa (167) el constructo de resistencia (hardiness) ha recibido una atención considerable como variable psicosocial posible moderadora del efecto del estrés en la salud (168). Este concepto se refiere a características personales que cumplen una función de fuente de resistencia ante eventos estresantes. Las disposiciones de la personalidad resistente serían tres: compromiso, control y desafío. Dentro del estudio de la respuesta inmune, Okun, Zautra y Robinson (169) investigaron la relación entre la personalidad resistente y la salud percibida y objetiva, medida ésta última en porcentajes de células B y T en 33 mujeres con artritis reumatoidea. El análisis de los resultados sugiere una asociación entre la resistencia y el estado de salud percibido por los sujetos. Así mismo, un componente de la personalidad resistente, el control, correlacionó significativamente con el porcentaje de células T, por lo que los autores sugieren que tal vez pacientes con poca resistencia desarrollan sentimientos de indefensión y desesperanza, lo cual a su vez disminuye la capacidad del sistema inmune de responder a los virus. El deseo de tener impacto sobre otros, ya sea influenciándolos, persuadiéndolos, ayudándolos, peleándolos o atacándolos, se ha definido como Motivación de Poder o necesidad de poder. Por el contrario, la motivación de afiliación o necesidad de afiliación es el deseo de establecer, mantener o reanudar relaciones cálidas con otras personas, no como un medio para algo, sino como un fin en sí misma. La motivación de poder estaría asociada con mayor susceptibilidad a enfermedades, y la motivación de afiliación, por el contrario, se vería como una disminución de la susceptibilidad a enfermedades (170-172), así como bajas concentraciones de s-IgA (173) y menor actividad de las células NK (174). Congreso Virtual de Psiquiatría. Interpsiquis Enero 1970. Psiquiatria.com -15- Otro mecanismo cognitivo que se ha estudiado como modulador del estrés es la autoeficacia o controlabilidad (175, 176). La autoeficacia opera como un mecanismo cognitivo a través del cual la controlabilidad reduce las reacciones ante el estrés. Un sentido cognitivo de controlabilidad implica que una persona cree que podrá manipular amenazas externas que pudieran surgir. Wiedenfeld et al. (177) estudiaron los efectos en la función inmune de diferentes niveles de autoeficacia percibida, usando un estresor fóbico (serpientes) y un proceso de inducción e instalación de afrontamiento eficaz y controlabilidad. El estudio mostró que la creciente autoeficacia percibida elevó el número de linfocitos, células T, T colaboradoras y supresoras sin alterar el balance entre ellas. El tipo de explicación que damos sobre las causas de los eventos negativos que no podemos controlar puede estar relacionado con la función inmune. Se denomina estilo atribucional o explicativo a la causalidad que las personas dan a los eventos negativos incontrolables (178). El concepto de estilo atribucional depresivo o pesimista es una reformulación de la hipótesis de indefensión aprendida, para adecuarla a la indefensión humana (178, 179). Las explicaciones causales de los eventos negativos pueden hacerse en tres dimensiones: la causa puede ser interna (uno mismo es la causa) o externa (otras personas o circunstancias), estable (es la manera en que siempre suceden las cosas) o inestable (ha sucedido esta vez) y global (esto influirá en todos los ámbitos de mi vida) o específica (se circunscribe el efecto al momento). El estilo atribucional pesimista, es decir atribuir las causas de un evento negativo incontrolable a cuestiones internas, estables y globales, se ha asociado con un mayor riesgo de padecer enfermedades físicas y un detrimento en la función inmune (180, 181). En dirección contraria, una disposición a "ver el lado bueno de las cosas" podría actuar como un moderador entre el estrés agudo y los cambios inmunes. Así lo sugieren Cohen et al. (182) en su estudio, en el cual comparan los efectos moderadores de una disposición optimista (183, 184) frente a una pesimista, en la función inmune. Los resultados obtenidos por estos autores, en una muestra de 42 mujeres, revelan una interacción entre el estrés y el optimismo pero con diferentes efectos según se trate de estrés agudo o estrés persistente. La disposición optimista serviría de moderadora entre el estrés agudo y los cambios inmunes, medidos éstos en porcentaje de células CD8+CD11b+. No obstante, ante un estresor persistente los sujetos optimistas mostraron un detrimento de la función inmune que los sujetos de disposición pesimista no mostraban. Segerstrom, Taylor, Kemeny y Fahey (185) también examinaron el grado en que el optimismo se asociaba a cambios inmunes en una situación de estrés. Habiendo controlado el estado de ánimo, el estilo de afrontamiento y los comportamientos asociados a la salud, el análisis de los resultados muestra que los sujetos optimistas presentan más linfocitos T colaboradores y mayor citotoxicicidad de las células NK. La tendencia a la preocupación también se ha estudiado en relación con el estrés y la función inmune. La preocupación es una actividad cognitiva en la cual los problemas potenciales se anticipan y enumeran, en un intento de controlar el futuro. Este intento de controlar el futuro sería un medio de mitigar el impacto emocional de los eventos negativos, pero al contrario de ello, muchas veces puede significar un incremento en los niveles de ansiedad más que una reducción. Segerstrom, Solomon, Kemeny y Fahey (186) investigaron la relación entre la preocupación y la función inmune donde los análisis mostraron que personas muy preocupadas presentaban un menor número de células NK que personas con menor preocupación. En otro estudio, utilizando un estresor agudo, el grupo de preocupación normal tuvo un incremento significativo en el porcentaje de las células NK con relación al grupo control y al grupo de alto grado de preocupación el cual Congreso Virtual de Psiquiatría. Interpsiquis Enero 1970. Psiquiatria.com -16- presentó los valores más bajos, en relación con la línea de base (187). El concepto de Locus de Control ha recibido bastante atención en el ámbito de la salud, adaptando incluso la escala a situaciones específicas de salud (188). Un locus de control externo implica un refuerzo percibido por el sujeto como no contingente con su acción, como el resultado del azar, como si estuviesen bajo el control de personas más poderosas o como si fuese causado por algunas de las tantas fuerzas que lo rodean. Cuando una persona interpreta el refuerzo de esta manera hablamos de una persona con una creencia en el control externo. Un locus de control interno implica la percepción del refuerzo como contingente de la acción del sujeto. Cuando una persona percibe que el refuerzo es contingente con su propia conducta o con sus características relativamente estables hablamos de una persona con una creencia en el control interno (189). Algunas investigaciones sugieren que el locus de control puede ser un moderador del estrés influenciando la relación entre éste y la salud tanto física como psicológica (167, 168, 190, 191). Los resultados en general apuntan a que los sujetos con locus de control externo muestran una correlación positiva con medidas de estresores vitales y síntomas físicos. En otros trabajos, se ha asociado el locus externo con una merma en el número de las células NK (192) y en su actividad (191). Kubitz, Peavey y Moore (193) examinaron el nivel de s-IgA en la saliva y el locus de control en sujetos con alto y bajo nivel de estrés. Los resultados no mostraron diferencias en los niveles de s-IgA entre los grupos. Contrariamente a lo indicado por estudios anteriores, se encontró una correlación negativa entre el locus de control interno y la s-IgA. Los autores sugieren que individuos con locus de control interno serían más vulnerables a altos niveles de estrés, particularmente aquél estrés que no pueden controlar. Estudios con estresores de laboratorio encuentran una merma en variables inmunes (e.g. IL-6, células NK) sólo en los grupos que no podían ejercer ningún control sobre el estresor (159, 194). Afrontamiento El afrontamiento se define como los esfuerzos cognitivos y conductuales constantemente cambiantes que se desarrollan para manejar las demandas específicas externas y/o internas que son evaluadas como excedentes o desbordantes de los recursos del individuo (98). Si los individuos afrontan efectivamente los problemas que se le presentan, deberían ser capaces de reducir las consecuencias nocivas del estrés (195). Las estrategias de afrontamiento que entran dentro de la clasificación general de orientadas al problema o de abordaje activo, suelen ir asociadas a un menor numero de síntomas físicos. A la inversa, las orientadas a la evitación y menos claramente las orientadas al manejo de las emociones, se relacionan en general a un mayor numero de afecciones relatadas por los sujetos (196-201). Dentro de los trabajos que han investigado la relación entre el afrontamiento y el desarrollo del cáncer encontramos, básicamente, mejores resultados clínicos asociados al afrontamiento activo, orientado al problema, siendo a la inversa para el uso de estrategias de evitación, concretamente la negación y el afrontamiento represivo (202-204). Fawzy et al. (203) llevan a cabo una investigación con 68 pacientes con melanoma maligno, una forma virulenta de cáncer de piel, evaluando predictores del progreso del cáncer, tales como el estado afectivo, el afrontamiento y la respuesta inmunitaria.. Los resultados muestran que los puntajes de partida obtenidos en la escala de Congreso Virtual de Psiquiatría. Interpsiquis Enero 1970. Psiquiatria.com -17- afrontamiento activo-conductual de los sujetos que habían sobrevivido eran significativamente mayores que los de aquellas personas que no sobrevivieron, en un plazo de cinco a seis años. Personas resistentes al estrés utilizan mucho menos la evitación como estrategia de afrontamiento, en comparación con personas afectadas por el estrés (198). El uso de la evitación y la negación se ha asociado con un detrimento de variables inmunes en personas seropositivas (205, 206), con una progresión más rápida del SIDA en un lapso de mas de siete años (207) y con un mayor avance de la enfermedad (208). No obstante, en un estudio anterior, Antoni et al. (209) obtuvieron asociaciones significativas entre el uso de la negación y una menor disminución de la respuesta inmune. Contrariamente a estos resultados, otros estudios indican que la negación o evitación pueden asociarse positivamente con parámetros de salud. Por ejemplo, se ha encontrado que la aceptación realista disminuye la supervivencia en sujetos con SIDA (210), y que la evitación puede ir asociada a una menor progresión de la infección de HIV-1 (211). El estilo de afrontamiento represivo o defensivo (212), da cuenta de personas que niegan tener niveles altos de ansiedad, siendo que no-verbalmente responden como si fueran altamente ansiosos. Utilizan mecanismos de negación, minimización del estrés y de las emociones negativas, y reportan una baja tendencia a la ansiedad manteniendo una alta disposición defensiva (212, 213). Algunos estudios sugieren que personas que exhiben un estilo de afrontamiento represivo presentan niveles de medidas inmunes más bajas que los no-represivos (199, 213-216). Jamner et al.(215) estudiaron la relación entre los estilos de afrontamiento represivo y defensivo y niveles inmunitarios en una muestra de estudiantes. Para una muestra de 312 sujetos se encontró un efecto principal del estilo de afrontamiento sobre los niveles de monocitos, de eosinófilos, de glucosa y sobre los autoinformes de reacciones alérgicas a los medicamentos. Los sujetos represivos y defensivos muestran un nivel significativamente menor de monocitos que los sujetos de baja y alta ansiedad. Además los sujetos represivos presentan mayor numero de eosinófilos y glucosas y de alergia a los medicamentos. Apoyo social Diferentes estudios han demostrado que el apoyo social puede modular la respuesta inmune. Esta relación se ha estudiado en diferentes poblaciones, y con respecto a estresores específicos. Por ejemplo, estudiantes que puntúan más alto en cuestionarios de soledad durante los exámenes, presentan niveles más bajos de actividad de las células NK (217), y niveles superiores de títulos de anticuerpos al Epstein-Barr virus (EBV) (133) en comparación con los alumnos que obtuvieron puntuaciones más bajas. Estudiantes con un apoyo social más adecuado, presentaban concentraciones más elevadas de inmunoglobulina A secretada en saliva (90). Tras inocular con hepatitis B a un grupo de estudiantes durante el período de exámenes, se observó que la respuesta inmune ante dicha inoculación antigénica (medida a través de los títulos de anticuerpos específicos) fue mayor en aquellos estudiantes que reportaban un gran apoyo social (89). En otro estudio se ha observado una reducción en las células NK durante los exámenes, siendo que los estudiantes con mayor apoyo social presentaban atenuada dicha reducción (218). Congreso Virtual de Psiquiatría. Interpsiquis Enero 1970. Psiquiatria.com -18- El respaldo que puede proveer la familia es una fuente de apoyo social crucial en la vida de las personas. Algunas relaciones interpersonales y/o familiares son más decisivas que otras. Así, cabe esperar que desavenencias y dificultades en dichas relaciones impliquen un menoscabo en el apoyo que el sujeto percibe. La pérdida del cónyuge, por divorcio o viudez, se ha asociado a un detrimento en la función inmune (116, 117). En sus experimentos utilizaban muestras de recién casados, quienes durante 30 minutos discutían problemas relacionados con el matrimonio y observaban las conductas manifestadas (119). Las parejas que expresaban conductas más negativas u hostiles durante la discusión, mostraban una disminución mayor, 24 horas después, en algunos valores de la función inmune (actividad de las células NK, respuesta proliferativa ante mitógenos, porcentaje de macrófagos), así como un incremento en el número total de linfocitos T y T colaboradores. Por último, las mujeres mostraran un mayor número de cambios inmunológicos negativos que los hombres, diferencia que también se ha encontrado en otros estudios (118). Similares resultados se obtuvieron utilizando una muestra de ancianos (media de 67 años), donde tanto los hombres como las mujeres con más conductas negativas y baja satisfacción matrimonial, mostraron una pobre respuesta inmune, expresada en una baja respuesta linfocitaria ante mitógenos y en elevados títulos de anticuerpo al EBV (91). Utilizando un modelo de conflicto marital en laboratorio, también se han observado cambios significativos, con una modificación selectiva en diferentes sub-tipos de linfocitos (122). Ser el apoyo principal de familiares que presenten enfermedades serias y crónicas puede ir asociado a un detrimento en la función inmune. Tal es el caso, por ejemplo, de los cuidadores de enfermos de Alzheimer. Kiecolt-Glaser y colaboradores (108) encontraron que los cuidadores de enfermos de Alzheimer mostraban porcentajes más bajos de linfocitos T totales y T colaboradores y títulos de anticuerpos al EBV más altos. En otro estudio, en los cuidadores que informaban de niveles de apoyo social más bajos y más estrés, se encontró una disminución en aspectos funcionales del sistema inmunitario (una menor respuesta a mitógenos) y un porcentaje mayor de enfermedades infecciosas, principalmente infecciones leves del tracto respiratorio (125). En dos estudios correlacionales, se agregó un grupo adicional a la muestra: cuidadores cuyas parejas habían fallecido. Ciertos cambios inmunes observados en cuidadores de enfermos de demencia, dos años después del fallecimiento del familiar, no presentaron diferencias en relación con actuales cuidadores (105, 130). La respuesta inmune empobrecida en cuidadores de familiares con demencia se ha observado también en otros estudios (102, 219) y en relación con otras medidas inmunitarias, reforzando la hipótesis de una asociación entre los cambios en el sistema inmune y el soporte proporcionado por los vínculos interpersonales. El síndrome de inmunodeficiencia adquirida presenta especial interés en psiconeuroinmunología. Este interés reside, principalmente, en dos razones: se tiene un amplio conocimiento a cerca del HIV, su interacción con el sistema inmune y el desarrollo de la enfermedad, y a su vez el progreso de la enfermedad y su desenlace no pueden predecirse totalmente a partir de los parámetros inmunológicos. Esto permite indagar variables de corte psicosocial, asociándolas con parámetros inmunes inequívocos del HIV. No obstante, las investigaciones en este ámbito no siempre arrojan resultados de fácil interpretación, y por lo general se superponen demasiadas variables, haciendo Congreso Virtual de Psiquiatría. Interpsiquis Enero 1970. Psiquiatria.com -19- difícil una identificación clara. Jane Leserman trabaja desde hace varios años con pacientes seropositivos desde la perspectiva de la PNI. En un estudio prospectivo que abarca un periodo de unos 5,5 años, la última evaluación reveló que los sujetos que estaban por encima de la media de satisfacción en apoyo social, presentaban una probabilidad del 40% de no desarrollar el SIDA (220). Consiguientemente, aumentar un punto en satisfacción del apoyo social disminuye el riesgo de SIDA en 63%. Por consecuencia, la probabilidad de desarrollar SIDA era 2 o 3 veces mayor entre aquellos sujetos que puntuaban por encima de la media de estrés o por debajo de la media de apoyo social. Sin embargo en otro estudio no se obtuvo tal asociación entre apoyo social y sistema inmune (221). Al igual que Leserman, Perry en su estudio utiliza medidas inmunes cuantitativas, pero el intervalo del estudio es de 12 meses aproximadamente. El periodo de tiempo evaluado podría ser insuficiente para captar la influencia del apoyo social sobre la infección HIV-1 (222). Las asociaciones entre apoyo social y progresión de la infección con HIV-1 del SIDA se han confirmado en otros trabajos de Leserman (207, 223). Dada la evidencia sobre una posible contribución de factores psicosociales en la instauración y/o progresión del cáncer, pacientes que padecen ciertos tipos de cáncer, conforman también una población de gran interés en PNI. En pacientes con cáncer, un mayor acceso al apoyo social se asocia a un mejor pronóstico de la enfermedad (224), así como que sujetos más aislados socialmente o con sentimientos de soledad, tienen un mayor riesgo de mortalidad (225). En las defensas del cuerpo contra el cáncer es posible que componentes inmunes cumplan un papel significativo. Dado que se cree que las células NK representan una primera línea de defensa contra infecciones virales y clones malignos de células, así como contra cepas metastásicas de cáncer, su modulación se investiga como un abordaje potencial para la prevención y/o terapia contra el cáncer. En una muestra de mujeres con cáncer de mama, se observó que la percepción de la calidad de sus redes sociales más significativas era un importante predictor de la actividad de las células NK (224). La asociación entre el apoyo social y las células NK se ha observado en varios estudios, no sólo con poblaciones que padecen cáncer. Familiares de enfermos de cáncer con niveles más altos de apoyo social presentan una actividad mayor de las células NK comparados con los sujetos con puntuaciones más bajas (226). En otro trabajo, Goodkin (227) encuentra que el apoyo social se asocia positivamente con la actividad de las células NK en sujetos con niveles de estrés vital más bajos. DEPRESIÓN Y SISTEMA INMUNE Si bien se ha podido establecer una relación entre el sistema inmune y la depresión, los resultados de los estudios revelan que esta relación es compleja y variable (228). En una revisión meta-analítica, Herbert y Cohen (229), a través de examinar 35 estudios e integrar sus resultados, concluyen que existe evidencia suficiente como para hablar de la existencia de una relación entre la depresión y la función inmune. Weiss (230) llega a conclusiones semejantes. No obstante, en su revisión, Stein, Miller y Trestman (231) sugieren que los cambios inmunitarios en la depresión no son muy claros. Es importante reconocer que en la investigación de la depresión y el sistema inmune, el estado depresivo puede ir desde un ánimo deprimido hasta un claro y definido cuadro de depresión y las concomitantes biológicas pueden ir variando también acorde a esto. Congreso Virtual de Psiquiatría. Interpsiquis Enero 1970. Psiquiatria.com -20- Algunos autores sugieren que las alteraciones del sistema inmune en la depresión no se deben al desorden depresivo en sí mismo, sino que se deben a características específicas del cuadro, como la edad, la severidad del síntoma o los trastornos del sueño (232). Con respecto a las medidas cuantitativas o enumerativas del sistema inmune, los pacientes depresivos muestran un alto número de células blancas, entre ellas, un alto porcentaje de neutrófilos. El número de linfocitos es menor, dentro de éstos, un número mas bajo de células T tanto cooperadoras como citotóxicas y supresoras (228-230). Algunos estudios indican que en pacientes depresivos la respuesta a mitógenos es más baja que en los sujetos control (233, 234). Kronfol et al. (235), estudiando un grupo de 26 pacientes depresivos y 20 sujetos control de equivalente edad y sexo, observaron un generalizado y marcado detrimento en la respuesta linfocitaria a mitógenos en el grupo de pacientes depresivos. Ciertos estudios sugieren que la actividad de las células NK es menor entre los pacientes clínicamente depresivos. Irwin, Smith y Gillin (236) estudiaron 19 hombres depresivos, hospitalizados, libres de medicamentos, con un grupo control equivalente en edad y sexo. El análisis demostró que los pacientes depresivos tenían una actividad significativamente reducida de las células NK en comparación a los sujetos control. En un estudio similar, Irwin et al.(237), encuentran una merma en la citotoxicidad de las células NK asociada a síntomas depresivos e independientes de la edad, consumo de alcohol y tabaco. La depresión se ha relacionado con elevados niveles de cortisol en plasma en algunos pacientes (238). El factor liberador de adrenocorticotrofina (CRF) es hipersecretado en pacientes deprimidos y se ha encontrado una regulación disminuida de los receptores de CRF en el córtex de pacientes depresivos y suicidas. Además, la administración de CRF causa una alteración del sistema inmune similar a la observada ante el estrés y la depresión (238). Algunos estudios han tenido en cuenta los niveles de cortisol en pacientes depresivos, pero no se han encontrado diferencias significativas con respecto a los sujetos control (231). No obstante, Weiss (230) reporta estudios en los que sí se han encontrado correlaciones entre los niveles de cortisol y la depresión, sugiriendo que los subtipos de depresión que presentan elevados niveles de cortisol son los mismos que detentan alteraciones en las poblaciones de linfocitos. También se propone que la hipercortisolemia observada en algunos pacientes depresivos puede resultar de una hipersecreción de CRF inducida por citocinas pro-inflamatorias, tales como la IL-1 o la IL-6, cuya concentración en plasma es elevada en dichos pacientes (239). Connor y Leonard (239) destacan que se han reportado en pacientes depresivos incrementos en la concentración en plasma de citocinas, principalmente IL-1, IL-6 e INF. Estas citocinas, en experimentos con ratas, han mostrado suprimir la actividad de las células NK, la respuesta ante mitógenos (PHA) y la producción de IL-2. Como Ader y Cohen (240) muchos autores resaltan que no es posible establecer relaciones causales directas para la relación entre la modificación de la respuesta inmune por condicionamiento y los factores endocrinos. Si bien los corticosteroides son inmunosupresores, muy distintos son los estudios in vitro que los estudios in vivo, donde las interacciones entre los diferentes sistemas que intervienen son complejas y oscuras. Además no resulta fácil evaluar las diferentes conclusiones como "controversias" en tanto y en cuanto se han medido diferentes niveles de la respuesta inmune, esto es, respuesta celular, humoral y dentro de cada una de ellas diferentes procesos. Congreso Virtual de Psiquiatría. Interpsiquis Enero 1970. Psiquiatria.com -21- ESTRÉS Y CÁNCER Los resultados obtenidos en diversas investigaciones sugieren que los estresores pueden contribuir en el inicio y progresión de algunos tipos de cáncer (241-243). En este ámbito, el sistema inmune juega un papel importante en la prevención y desarrollo del mismo (244). La actividad de las células NK y otras células del sistema inmune pueden disminuir como consecuencia de una situación de duelo (111), un divorcio (117) o soledad del individuo (133). Como hemos mencionado anteriormente, el cáncer es considerado un grupo heterogéneo de enfermedades, por lo tanto, los factores inmunes y psicológicos pueden jugar un rol en algunos pero no en otros. Otro aspecto a tener en cuenta es la no-uniformidad de los efectos de estos factores en el desarrollo del cáncer. Los procesos inmunes y psicológicos influyen de diversas formas a lo largo de las distintas fases del tumor. El estrés social es un estresor psicológico ampliamente vinculado a la modulación del sistema inmune (244). Pacientes con apoyo social presentan un mejor pronóstico en el desarrollo de su cáncer (224). En cambio, los individuos más aislados socialmente o con sentimientos de soledad están expuestos a una probabilidad superior de fallecer (225). Otros autores señalan la importancia de la percepción de la calidad de sus redes sociales más significativas. En mujeres con cáncer de mama esta percepción constituía un importante predictor de la actividad de las células NK (245). Los acontecimientos de la vida han sido, igualmente, vinculados con el origen y progreso de distintos cáncer. Por ejemplo, enfermos de cáncer gástrico mostraban un aumento significativo de cambios en sus vidas durante los dos años precedentes al inicio del primer síntoma de su enfermedad (246). Esta asociación es más específica en un estudio posterior: sólo se encontró vínculos entre el volumen del tumor y una incidencia más elevada de sucesos de la vida en los 6 meses precedentes al diagnóstico (247). Otros autores no han obtenido una asociación entre estrés psicológico y un aumento en las recaídas de cáncer de mama (248). En este estudio, el afrontamiento no fue valorado. Rabin (249) opina que en la evaluación del efecto del estrés sobre la función inmune hay que considerar más aspectos que el simple aumento de estrés. Por lo tanto, él aconseja la necesidad de determinar las estrategias empleadas durante la situación estresante. Estas tácticas de afrontamiento pueden amortiguan el efecto del estrés sobre el sistema inmune. Hay estresores como una intervención quirúrgica que pueden tener graves consecuencias en enfermos de cáncer: personas con cáncer gastrointestinal en el estadio I mostraban un inmunosupresión celular ante la operación. Estos niveles inmunes se mantenían deprimidos durante dos semanas posteriores a la intervención quirúrgica (250). Por último, determinados autores consideran que el estrés podría contribuir a la activación de la neoplasia latente y/o deteriorar la vigilancia inmune durante una fase crítica de la vida. Así que, ante el mismo riesgo biológico, el estrés emocional severo podría aumentar el riesgo general de cáncer (251). Congreso Virtual de Psiquiatría. Interpsiquis Enero 1970. Psiquiatria.com -22- Estrés y sida A lo largo de la literatura se ha podido comprobar como el curso clínico de la infección con HIV-1 no es predecible, al menos por el momento. Algunos individuos con HIV- 1 positivo persisten sin síntomas durante años después de la infección. Otros sujetos desarrollan la sintomatología relacionada con el SIDA o también de forma acelerada se adquiere el SIDA (252). Estas discrepancias en la evolución de la infección pueden deberse a ciertos factores psicosociales. Estos factores podrían contribuir a la progresión de la infección HIV-1, morbilidad y mortalidad de los afectados (253). En el ámbito de la psiconeuroinmunología se examina como determinadas experiencias estresantes modulan el sistema inmune, así como la influencia de esta relación en la salud de los individuos (1, 43, 102, 216, 247, 254). Por lo tanto, esta disciplina ha investigado como el estrés puede modular el curso de la infección HIV-1 (110, 220, 255). Como hemos analizado en un apartado anterior, numerosos hombres homosexuales han experimentado de forma reiterada el duelo ante el fallecimiento de un amigo o pareja. En un estudio longitudinal, los sujetos que se encontraban en una situación de duelo manifestaban cambios en parámetros inmunes consistentes con un curso de la enfermedad más negativo al año siguiente de la defunción de su pareja (110). Igualmente, estos cambios inmunes han sido obtenido en otro estudio: disminución en la citotoxidad de las células NK (NKCC) y en la respuesta de los linfocitos T al mitógeno PHA (256). Otros autores no obtuvieron relación entre duelo y parámetros relevantes a la progresión HIV-1 (257). El estilo de afrontamiento es una variable que ha demostrado modular la relación estrés y sistema inmune (202, 205, 207, 211, 213). Así, aquellos sujetos que afrontaban mejor la experiencia del duelo mostraban valores inmunes más positivos que aquellos que no afrontaban adecuadamente el estresor. Estos índices inmunes son: no mostraban una disminución de las células CD4 y presentaban un bajo promedio de mortalidad relativo al SIDA (114). Por otro lado, la interacción de expectativas negativas sobre HIV-1, sin aceptar la realidad de la enfermedad, y experimentar una situación de duelo predicen el desarrollo de los síntomas de HIV-1 (258) No obstante, la asociación entre estresores y estrategias de afrontamiento pasivas (estrategias no adaptativas) se vincula con un número inferior de linfocitos totales y células T4 (259). Distintos estudios han observado como aquellos sujetos que han experimentado diversos estresores, manifiestan deterioro en parámetros inmunes y un ritmo más acelerado en la evolución del HIV-1 (207, 220, 255). Otro estresor importante que se ha estudiado en esta población ha sido la notificación de su status HIV-1 positivo. Sujetos que usaban estrategias de afrontamiento negativas ante la notificación (estresor) muestran una respuesta disminuida de los linfocitos T al mitógeno PHA (209). Asimismo, los individuos que emplean la desconexión mental como estrategia de afrontamiento ante la notificación, presentaban una respuesta más pobre de los linfocitos T al mitógeno PWM, porcentajes inferiores de linfocitos B y promedios irregulares de CD4/CD8 (205). En cambio, no se han observado cambios en la respuesta de linfocitos T a los mitógenos PHA y PWM tras la notificación (260). Congreso Virtual de Psiquiatría. Interpsiquis Enero 1970. Psiquiatria.com -23- Así que, la sensibilidad que los sujetos muestran ante un estresor nos hace pensar que es una importante variable que contribuye en el desarrollo y progresión del HIV-1 y/o SIDA. Por lo tanto, interviniendo en este factor quizás podríamos ayudar al mantenimiento de la salud y a una mayor supervivencia en aquellos sujetos con HIV-1 y/o SIDA (261). Intervenciones psicológicas y sistema inmune A lo largo de esta exposición, hemos observado que el estrés, directa e indirectamente, puede influenciar el sistema inmune. Esto implicaría que aquellas intervenciones dirigidas a manipular el estrés deberían asociarse a cambios inmunes. Los beneficios resultantes de dichas intervenciones son fáciles de especular, no obstante dos cuestiones deberán ser aclaradas en futuras investigaciones para que podamos hablar de "intervenciones psicoterapéuticas que mejorarían la función inmune". La primera cuestión es que a pesar de las numerosas investigaciones que se están desarrollando en el área de la Psiconeuroinmunología, poco sabemos del alcance clínico de las variaciones observadas en las medidas inmunes (ej. 4, 263). En otras palabras, la merma o aumento de ciertos parámetros inmunológicos no está directamente relacionado con contraer o no determinadas dolencias. En segundo lugar, es importante tener en cuenta que si bien la evidencia empírica de una asociación entre el estrés y la función inmune es amplia, los procesos subyacentes a dichas asociaciones quedan por clarificar. Las intervenciones psicosociales en pacientes con cáncer obtienen en general un efecto positivo sobre el ajuste emocional, funcional y en la sintomatología de los pacientes (263, 264). En el ya citado estudio de Fawzy (203), con pacientes con melanoma maligno, el grupo de participantes que recibió intervención psicoterapéutica mostró una disminución en el estrés percibido, un incremento en la actividad de las células NK y una disminución en la reaparición del cáncer, en comparación al grupo control. En otro trabajo con diseño entre grupos, la supervivencia de mujeres con metástasis en el pecho fue mayor en el grupo que había recibido intervención psicoterapéutica (265). Las intervenciones dirigidas a controlar el estrés pueden además modular algunos componentes de la función inmune en personas infectadas con el virus de inmunodeficiencia adquirida (266-268). Antoni et al. (269), examinaron los efectos de un programa cognitivo-conductual para el manejo del estrés en un grupo de hombres homosexuales seropositivos. El grupo que participó en el programa, en comparación con el grupo control, obtuvo un incremento significativo en el número de células T CD4 y NK, así como un ligero aumento en la respuesta proliferativa al mitógeno PHA, comparando antes y después de la notificación de la seropositividad. En estudios con hombres homosexuales HIV-1 +, aquellos que habían participado en un programa de manejo del estrés, mostraron un mayor número de CD3+ y CD8+ seis y doce meses después de la intervención (267). Goodkin (256) informaba en una conferencia, que en los sujetos con HIV-1 positivo, las estrategias de intervención conductual, tales como grupo de apoyo ante el duelo o el uso de estrategias de afrontamiento tienen un efecto beneficioso para el sujeto ante el deterioro que provoca los sucesos estresantes. Mediante un análisis, encuentra que niveles bajos de estresores y frecuencias altas de actividad de afrontamiento era asociado con aumento en los niveles de los linfocitos T CD4. Las técnicas de relajación también se han utilizado para tratar el estrés, evaluando su efecto en el sistema inmune (268, 270-280). Pacientes con cáncer de ovarios, después de dos meses de entrenamiento en relajación con un psicoterapeuta, mostraron un mayor número de linfocitos y una tendencia a un mayor número total de células blancas en relación con el grupo control, dos días Congreso Virtual de Psiquiatría. Interpsiquis Enero 1970. Psiquiatria.com -24- antes del tratamiento de quimioterapia (274). En sujetos sanos, la práctica cotidiana de técnicas de relajación durante tres semanas elevó el número de inmunoglobulinas (A; G y M) en sangre y la tasa de secreción de la s-IgA, en comparación con sujetos que realizaban la técnica por primera vez (272). La s-IgA puede considerarse con un marcador de estrés (281), por lo que técnicas destinadas a tratar el estrés podrían influir en sus parámetros. Una investigación con mujeres en período de lactancia mostró que un elevado estrés percibido se asociaba a niveles incrementados de s-IgA en leche materna, niveles que descendían en aquellas mujeres que habían practicado la relajación al menos una vez por día durante dos semanas (276). En general los trabajos con hipnosis generan resultados consistentes en lo que se refiere a la modificación de la respuesta inmune (280, 282-284). Por ejemplo, la práctica frecuente de técnicas hipnóticas y de relajación elevó significativamente el número de células CD3+, CD4+ y linfocitos T, en comparación al grupo control, en estudiantes universitarios bajo estrés académico (285). Conclusiones Los estudios revisados sugieren una relación entre el estrés y el sistema inmune. No obstante no es posible establecer una relación causal directa entre los factores psicológicos sobre el sistema inmune, y tampoco establecer la significación clínica de estos cambios producidos en la función inmune (240, 286). En general el estrés crónico se asocia con un detrimento en la función inmune, mientras que estresores agudos de laboratorio pueden activarla transitoriamente (287). Por otra parte, altos niveles de estrés percibido, bajo apoyo social, estrategias de afrontamiento inapropiadas y síntomas depresivos se asocian con un mayor riesgo de alteraciones en la función inmune. Los estudios versados sobre disposiciones personales, si bien muestran asociaciones entre éstas y el sistema inmune, no permiten hacer conclusiones al respecto dada su variabilidad y la falta de consenso en los conceptos e instrumentos de medida. A pesar de ello, investigaciones futuras con diseños e instrumentos apropiados posiblemente consigan dar coherencia a tales hallazgos. Las investigaciones con pacientes HIV positivos tienden a concluir que variables moderadoras del estrés (apoyo social, afrontamiento) influyen en el progreso de la infección (223). Por el contrario, las investigaciones con cáncer no permiten aún aclarar el papel que juega el estrés en su progresión, aunque no podemos descartar del todo la posibilidad de su influencia (287). La posibilidad de modificar el sistema inmune mediante intervenciones terapéuticas destinadas a tratar el estrés presenta las dificultades propias de la investigación en PNI, como son la diversidad de parámetros inmunes analizados, la dificultad de establecer el alcance clínico de los cambios inmunes, además de la heterogeneidad de las intervenciones utilizadas, y de los métodos de evaluación de la efectividad de dichas intervenciones. Empero, las investigaciones realizadas en el ámbito de la hipnosis arrojan resultados bastante consistentes (285, 288), modificando el sistema inmune a través de intervenciones psicológicas. Estos trabajos, si bien presentan problemas metodológicos, permiten contemplar la posibilidad de concretar en el futuro las bases para una psicoterapia psiconeuroinmunológica. Congreso Virtual de Psiquiatría. Interpsiquis Enero 1970. Psiquiatria.com -25- Bibliografía Cohen S, Williamson GM. Stress and infectious disease in humans. Psychol Bull 1991;109(1):5-24. 2. Kiecolt-Glaser JK, Glaser R. Psychological influences on immunity. Psychosomatics 1986;27(9):621-4. 3. Solomon GF. Emotional and personality factors in the onset and course of autoimmune disease, particularly rheumatoid arthritis. In: Ader RA, editor. Psychoneuroimmunology. New York: Academic Press; 1981. 4. Benowitz S. Psychoneuroimmunology finds acceptance as science adds evidence. Scientist 1996;10(16):14-15. 5. Solomon GF. Immune and nervous system interactions: An analytic bibliography supporting postulates on communication links, similarities, and implications. The Fund for Psychoneuroimmunology. 1999. 6. Ader R, Felten D, Cohen N. Interactions between the brain and the immune system. Annu Rev Pharmacol Toxicol 1990;30:561-602. 7. Ader R, Cohen N, Felten D. Psychoneuroimmunology: interactions between the nervous system and the immune system. Lancet 1995;345(8942):99-103. 8. Aller MA, Lorente L, Arias JL, Rodríguez-Fabián G, Alonso MS, Begega A, et al. The psycho-neuro-immune-endocrine response: a physiological and pathological way of life. Psicothema 1996;8(2):375-381. 9. Maier SF, Watkins LR, Fleshner M. Psychoneuroimmunology. The interface between behavior, brain, and immunity. Am Psychol 1994;49(12):1004-17. 10. Pennisi E. Neuroimmunology. Tracing molecules that make the brain-body connection. Science 1997;275(5302):930-1. 11. Maier SF, Watkins LR. Cytokines for psychologists: implications of bidirectional immune-tobrain communication for understanding behavior, mood, and cognition. Psychol Rev 1998;105(1):83-107. 12. Ader R, Cohen N. Psychoneuroimmunology: conditioning and stress. Annu Rev Psychol 1993;44:53-85. 13. Felten DL, Cohen N, Ader R, Felten SY, Calson SL, Roszman TL. Central neural circuits involved in neural-immune interactions. In: R. Ader R, Felten DL, Cohen N, editors. Psychoneuroimmunology. Second Edition ed. New York: Academic Press; 1991. p. 3-25. 14. Stockhorst U, Spennes-Saleh S, Korholz D, Gobel U, Schneider ME, Steingruber HJ, et al. Anticipatory symptoms and anticipatory immune responses in pediatric cancer patients receiving chemotherapy: features of a classically conditioned response? Brain Behav Immun 2000;14(3):198-218. 15. Wik G, Lekander M, Fredrikson M. Human brain-immune relationships: a PET study. Brain Behav Immun 1998;12(3):242-6. 16. Lekander M, Fredrikson M, Wik G. Neuroimmune relations in patients with fibromyalgia: a positron emission tomography study. Neurosci Lett 2000;282(3):193-6. 17. Felten SY, Felten DL. Innervation of lymphoid tissue. In: Ader R, Felten DL, Cohen N, editors. Psychoneuroimmunology. Second Edition ed. New York: Academic Press; 1991. p. 27--69. 18. Bret-Dibat JL, Bluthe RM, Kent S, Kelley KW, Dantzer R. Lipopolysaccharide and interleukin-1 depress food-motivated behavior in mice by a vagal-mediated mechanism. Brain Behav Immun 1995;9(3):242-6. 19. Romeo HE, Tio DL, Rahman SU, Chiappelli F, Taylor AN. The glossopharyngeal nerve as a novel pathway in immune-to-brain communication: relevance to neuroimmune surveillance of the oral cavity. J Neuroimmunol 2001;115(1-2):91-100. 20. Goetzl EJ, Turck CW, Sreedharan SP. Production and recognition of neuropeptides by cells of Congreso Virtual de Psiquiatría. Interpsiquis Enero 1970. Psiquiatria.com -26- the immune system. In: Ader R, Felten DL, Cohen N, editors. Psychoneuroimmunology. Second Edition ed. New York: Academic Press; 1991. p. 263-282. 21. Benschop RJ, Rodriguez-Feuerhahn M, Schedlowski M. Catecholamine-induced leukocytosis: early observations, current research, and future directions. Brain Behav Immun 1996;10(2):77-91. 22. Carlson SL, Fox S, Abell KM. Catecholamine modulation of lymphocyte homing to lymphoid tissues. Brain Behav Immun 1997;11(4):307-20. 23. Schedlowski M, Hosch W, Oberbeck R, Benschop RJ, Jacobs R, Raab HR, et al. Catecholamines modulate human NK cell circulation and function via spleen-independent beta 2-adrenergic mechanisms. J Immunol 1996;156(1):93-9. 24. Benschop RJ, Schedlowski M, Wienecke H, Jacobs R, Schmidt RE. Adrenergic control of natural killer cell circulation and adhesion. Brain Behav Immun 1997;11(4):321-32. 25. Stefulj J, Jernej B, Cicin-Sain L, Rinner I, Schauenstein K. mRNA expression of serotonin receptors in cells of the immune tissues of the rat. Brain Behav Immun 2000;14(3):219-24. 26. Woiciechowsky C, Schoning B, Daberkow N, Asche K, Stoltenburg G, Lanksch WR, et al. Brain-IL-1beta induces local inflammation but systemic anti- inflammatory response through stimulation of both hypothalamic- pituitary-adrenal axis and sympathetic nervous system. Brain Res 1999;816(2):563-71. 27. Watkins LR, Maier SF, Goehler LE. Cytokine-to-brain communication: a review & analysis of alternative mechanisms. Life Sci 1995;57(11):1011-26. 28. Kronfol Z, Remick DG. Cytokines and the brain: implications for clinical psychiatry. Am J Psychiatry 2000;157(5):683-94. 29. Licinio J, Frost P. The neuroimmune-endocrine axis: pathophysiological implications for the central nervous system cytokines and hypothalamus-pituitary-adrenal hormone dynamics. Braz J Med Biol Res 2000;33(10):1141-8. 30. Hattori N, Saito T, Yagyu T, Jiang BH, Kitagawa K, Inagaki C. GH, GH receptor, GH secretagogue receptor, and ghrelin expression in human T cells, B cells, and neutrophils. J Clin Endocrinol Metab 2001;86(9):4284-91. 31. Kelley KW. Growth hormone in immunobiology. In: Ader RA, Cohen N, Felten DL, editors. Psychoneuroimmunology. Second Edition ed. New York: Academic Press; 1991. p. 377-402. 32. Yu-Lee L. Stimulation of interferon regulatory factor-1 by prolactin. Lupus 2001;10(10):691-9. 33. Turnbull AV, Rivier C. Regulation of the HPA axis by cytokines. Brain Behav Immun 1995;9(4):253-75. 34. Auphan N, DiDonato JA, Rosette C, Helmberg A, Karin M. Immunosuppression by glucocorticoids: inhibition of NF-kappa B activity through induction of I kappa B synthesis. Science 1995;270(5234):286-90. 35. Munck A, Guyre PM. Glucocorticoids and immune function. In: Ader RA, Felten DL, Cohen N, editors. Psychoneuroimmunology. Second Edition ed. New York: Academic Press; 1991. p. 447-474. 36. Cambronero JC, Rivas FJ, Borrell J, Guaza C. Interleukin-2 induces corticotropin-releasing hormone release from superfused rat hypothalami: influence of glucocorticoids. Endocrinology 1992;131(2):677-83. 37. Watkins LR, Maier SF. The pain of being sick: implications of immune-to-brain communication for understanding pain. Annu Rev Psychol 2000;51:29-57. 38. Watkins LR, Wiertelak EP, Goehler LE, Mooney-Heiberger K, Martinez J, Furness L, et al. Neurocircuitry of illness-induced hyperalgesia. Brain Res 1994;639(2):283-99. 39. Sheng WS, Hu S, Ding JM, Chao CC, Peterson PK. Cytokine expression in the mouse brain in response to immune activation by Corynebacterium parvum. Clin Diagn Lab Immunol 2001;8(2):446-8. Congreso Virtual de Psiquiatría. Interpsiquis Enero 1970. Psiquiatria.com -27- 40. Bluthe RM, Dantzer R, Kelley KW. Effects of interleukin-1 receptor antagonist on the behavioral effects of lipopolysaccharide in rat. Brain Res 1992;573(2):318-20. 41. Plata-Salaman CR, Oomura Y, Kai Y. Tumor necrosis factor and interleukin-1 beta: suppression of food intake by direct action in the central nervous system. Brain Res 1988;448(1):106-14. 42. Glaser R, Kiecolt-Glaser JK. Handbook of human stress and immunity: Academic Press; 1994. 43. Kiecolt-Glaser JK, Glaser R. Stress and immune function in humans. In: Ader RA, Felten DL, Cohen N, editors. Psychoneuroimmunology. Second Edition ed. New York: Academic Press; 1991. p. 849-867. 44. Dhabhar FS, McEwen BS. Enhancing versus suppressive effects of stress hormones on skin immune function. Proc Natl Acad Sci U S A 1999;96(3):1059-64. 45. Fleshner M, Nguyen KT, Cotter CS, Watkins LR, Maier SF. Acute stressor exposure both suppresses acquired immunity and potentiates innate immunity. Am J Physiol 1998;275(3 Pt 2):R870-8. 46. Ader R, Cohen N. Behaviorally conditioned immunosuppression. Psychosom Med 1975;37(4):333-40. 47. Exton MS, Von Horsten S, Voge J, Westermann J, Schult M, Nagel E, et al. Conditioned taste aversion produced by cyclosporine A: concomitant reduction in lymphoid organ weight and splenocyte proliferation. Physiol Behav 1998;63(2):241-7. 48. Exton MS, von Horsten S, Strubel T, Donath S, Schedlowski M, Westermann J. Conditioned alterations of specific blood leukocyte subsets are reconditionable. Neuroimmunomodulation 2000;7(2):106-14. 49. Gorczynski RM, Kennedy M, Ciampi A. Cimetidine reverses tumor growth enhancement of plasmacytoma tumors in mice demonstrating conditioned immunosuppression. J Immunol 1985;134(6):4261-6. 50. Gorczynski RM. Analysis of lymphocytes in, and host environment of, mice showing conditioned immunosuppression to cyclophosphamide. Brain Behav Immun 1987;1(1):21-35. 51. Napolitano F, De Rosa G, Grasso F, Migliori G, Bordi A. Conditioned inhibition of antibody response and CD4 positive cells. Physiol Behav 1998;64(3):395-8. 52. Ghanta VK, Hiramoto RN, Solvason HB, Spector NH. Neural and environmental influences on neoplasia and conditioning of NK activity. J Immunol 1985;135(2 Suppl):848s-852s. 53. Gorczynski RM, Macrae S, Kennedy M. Conditioned immune response associated with allogeneic skin grafts in mice. J Immunol 1982;129(2):704-9. 54. Solvason HB, Ghanta VK, Hiramoto RN. Conditioned augmentation of natural killer cell activity. Independence from nociceptive effects and dependence on interferon-beta. J Immunol 1988;140(2):661-5. 55. Solvason HB, Ghanta VK, Soong SJ, Rogers CF, Hsueh CM, Hiramoto NS, et al. A simple, single, trial-learning paradigm for conditioned increase in natural killer cell activity. Proc Soc Exp Biol Med 1992;199(2):199-203. 56. Dick D. Tolerance to drug-induced (Poly I:C) natural killer cell activation: congruence with a pavlovian conditioning model. Journal of Experimental Psychology. 1986;12(1):25-31. 57. Krank M, MacQueen G. Conditioned compensatory responses elicited by environmental signals for cyclophosphamide-induced suppression of antibody production on mice. Psychobiology 1988;6(3):229-235. 58. MacQueen GM, Siegel S. Conditional immunomodulation following training with cyclophosphamide. Behav Neurosci 1989;103(3):638-47. 59. MacQueen G, Siegel S, Landry J. Acquisition and extinction of conditional immunoenhacement following training with cyclophosphamide. Psychobiology 1990;18(3):287-292. 60. Smith GR, Jr., McDaniel SM. Psychologically mediated effect on the delayed hypersensitivity reaction to tuberculin in humans. Psychosom Med 1983;45(1):65-70. 61. Buske-Kirschbaum A, Kirschbaum C, Stierle H, Lehnert H, Hellhammer D. Conditioned increase of natural killer cell activity (NKCA) in humans. Psychosom Med 1992;54(2):123-32. Congreso Virtual de Psiquiatría. Interpsiquis Enero 1970. Psiquiatria.com -28- 62. Buske-Kirschbaum A, Kirschbaum C, Stierle H, Jabaij L, Hellhammer D. Conditioned manipulation of natural killer (NK) cells in humans using a discriminative learning protocol. Biol Psychol 1994;38(2-3):143-55. 63. Bovbjerg DH, Redd WH, Maier LA, Holland JC, Lesko LM, Niedzwiecki D, et al. Anticipatory immune suppression and nausea in women receiving cyclic chemotherapy for ovarian cancer. J Consult Clin Psychol 1990;58(2):153-7. 64. Fredrikson M, Furst CJ, Lekander M, Rotstein S, Blomgren H. Trait anxiety and anticipatory immune reactions in women receiving adjuvant chemotherapy for breast cancer. Brain Behav Immun 1993;7(1):79-90. 65. Lekander M, Fürst CJ, Rotstein S, Blomgren H, Fredrikson M. Does informed adjuvan placebo chemotherapy for breas cancer elicit immune changes? Oncol Rep 1994;1:699-703. 66. Lekander M, Fürst CJ, Rotstein S, Blomgren H, Fredrikson M. Anticipatory immune changes in women treated with chemotherapy for ovarian cancer. International Journal of Behavioral Medicine 1995;2:1-12. 67. Moynihan JA, Ader R. Psychoneuroimmunology: animal models of disease. Psychosom Med 1996;58(6):546-58. 68. Anisman H, Lu ZW, Song C, Kent P, McIntyre DC, Merali Z. Influence of psychogenic and neurogenic stressors on endocrine and immune activity: differential effects in fast and slow seizing rat strains. Brain Behav Immun 1997;11(1):63-74. 69. Keller SE, Weiss JM, Schleifer SJ, Miller NE, Stein M. Suppression of immunity by stress: effect of a graded series of stressors on lymphocyte stimulation in the rat. Science 1981;213(4514):1397-400. 70. Keller SE, Weiss JM, Schleifer SJ, Miller NE, Stein M. Stress-induced suppression of immunity in adrenalectomized rats. Science 1983;221(4617):1301-4. 71. Brenner GJ, Moynihan JA. Stressor-induced alterations in immune response and viral clearance following infection with herpes simplex virus-type 1 in BALB/c and C57B1/6 mice. Brain Behav Immun 1997;11(1):9-23. 72. Croiset G, Heijnen CJ, Veldhuis HD, de Wied D, Ballieux RE. Modulation of the immune response by emotional stress. Life Sci 1987;40(8):775-82. 73. Lysle DT, Cunnick JE, Fowler H, Rabin BS. Pavlovian conditioning of shock-induced suppression of lymphocyte reactivity: acquisition, extinction, and preexposure effects. Life Sci 1988;42(22):2185-94. 74. Lysle DT, Lyte M, Fowler H, Rabin BS. Shock-induced modulation of lymphocyte reactivity: suppression, habituation, and recovery. Life Sci 1987;41(15):1805-14. 75. Laudenslager ML, Ryan SM, Drugan RC, Hyson RL, Maier SF. Coping and immunosuppression: inescapable but not escapable shock suppresses lymphocyte proliferation. Science 1983;221(4610):568-70. 76. Visintainer M, Volpicelli J, Seligman M. Tumor rejection in rats after inescapable or escapable shock. Science 1982;216(April):437-439. 77. Zha H, Ding G, Fan S. Serum factor(s) induced by restraint stress in mice and rats suppresses lymphocyte proliferation. Brain Behav Immun 1992;6(1):18-31. 78. Steplewski Z, Vogel WH. Total leukocytes, T cell subpopulation and natural killer (NK) cell activity in rats exposed to restraint stress. Life Sci 1986;38(26):2419-27. 79. Padgett DA, MacCallum RC, Sheridan JF. Stress exacerbates age-related decrements in the immune response to an experimental influenza viral infection. J Gerontol A Biol Sci Med Sci 1998;53(5):B347-53. 80. Beerda B, Schilder MB, van Hooff JA, de Vries HW, Mol JA. Chronic stress in dogs subjected to social and spatial restriction. I. Behavioral responses. Physiol Behav 1999;66(2):233-42. Congreso Virtual de Psiquiatría. Interpsiquis Enero 1970. Psiquiatria.com -29- 81. Dhabhar FS, Satoskar AR, Bluethmann H, David JR, McEwen BS. Stress-induced enhancement of skin immune function: A role for gamma interferon. Proc Natl Acad Sci U S A 2000;97(6):2846-51. 82. Stefanski V, Ben-Eliyahu S. Social confrontation and tumor metastasis in rats: defeat and betaadrenergic mechanisms. Physiol Behav 1996;60(1):277-82. 83. Stefanski V, Engler H. Effects of acute and chronic social stress on blood cellular immunity in rats. Physiol Behav 1998;64(5):733-41. 84. Michaut RJ, Dechambre RP, Doumerc S, Lesourd B, Devillechabrolle A, Moulias R. Influence of early maternal deprivation on adult humoral immune response in mice. Physiol Behav 1981;26(2):189-91. 85. Francis D, Diorio J, Liu D, Meaney MJ. Nongenomic transmission across generations of maternal behavior and stress responses in the rat. Science 1999;286(5442):1155-8. 86. Boccia ML, Reite M, Kaemingk K, Held P, Laudenslager M. Behavioral and autonomic responses to peer separation in pigtail macaque monkey infants. Dev Psychobiol 1989;22(5):447-61. 87. Coe CL, Rosenberg LT, Fischer M, Levine S. Psychological factors capable of preventing the inhibition of antibody responses in separated infant monkeys. Child Dev 1987;58(6):1420-30. 88. Bartrop RW, Luckhurst E, Lazarus L, Kiloh LG, Penny R. Depressed lymphocyte function after bereavement. Lancet 1977;1(8016):834-6. 89. Glaser R, Kiecolt-Glaser JK, Bonneau RH, Malarkey W, Kennedy S, Hughes J. Stress-induced modulation of the immune response to recombinant hepatitis B vaccine. Psychosom Med 1992;54(1):22-9. 90. Jemmott JBI, Magloire K. Academic stress, social support, and secretory immunoglobulin A. J Pers Soc Psychol 1988;55(5):803-10. 91. Kiecolt-Glaser JK, Glaser R, Cacioppo JT, MacCallum RC, Snydersmith M, Kim C, et al. Marital conflict in older adults: endocrinological and immunological correlates. Psychosom Med 1997;59(4):339-49. 92. Lazarus RS, Folkman S. Estrés y procesos cognitivos. Barcelona: Martínez Roca; 1986. 93. Selye H. A syndrome produced by diverse nocuous agents. Nature 1936;138:32. 94. Selye H. History and present status of the stress concept. In: Monat A, Lazarus RS, editors. Stress and coping: an anthology. Second Edition ed. New York: Columbia University Press; 1985. p. 17-29. 95. Cohen S. Measures of psychological stress; 2001. 96. Davies MNO, Underwood G. Cognition and stress. In: Fink G, editor. Encyclopedia of stress. San Diego, CA: Academic Press; 2000. p. 478-483. 97. Monat A, Lazarus RS. Stress and coping -some current issues and controversies. In: Monat A, Lazarus RS, editors. Stress and coping: an anthology. 2ª ed. New York: Columbia University Press; 1985. p. 1-12. 98. Lazarus R, Folkman S. Stress, Appraisal, and Coping. New York: Springer Publishing; 1984. 99. Folkman S. Personal control and stress and coping processes: a theoretical analysis. J Pers Soc Psychol 1984;46(4):839-52. 100. Folkman S, Lazarus RS. If it changes it must be a process: study of emotion and coping during three stages of a college examination. J Pers Soc Psychol 1985;48(1):150-70. 101. Bachen EA, Manuck SB, Cohen S, Muldoon MF, Raible R, Herbert TB, et al. Adrenergic blockade ameliorates cellular immune responses to mental stress in humans. Psychosom Med 1995;57(4):366-72. 102. Bauer ME, Vedhara K, Perks P, Wilcock GK, Lightman SL, Shanks N. Chronic stress in caregivers of dementia patients is associated with reduced lymphocyte sensitivity to glucocorticoids. J Neuroimmunol 2000;103(1):84-92. Congreso Virtual de Psiquiatría. Interpsiquis Enero 1970. Psiquiatria.com -30- 103. Bosch JA, de Geus EJ, Ligtenberg TJ, Nazmi K, Veerman EC, Hoogstraten J, et al. Salivary MUC5B-mediated adherence (ex vivo) of Helicobacter pylori during acute stress. Psychosom Med 2000;62(1):40-9. 104. Dobbin JP, Harth M, McCain GA, Martin RA, Cousin K. Cytokine production and lymphocyte transformation during stress. Brain Behav Immun 1991;5(4):339-48. 105. Esterling BA, Kiecolt-Glaser JK, Bodnar JC, Glaser R. Chronic stress, social support, and persistent alterations in the natural killer cell response to cytokines in older adults. Health Psychol 1994;13(4):291-8. 106. Herbert TB, Cohen S, Marsland AL, Bachen EA, Rabin BS, Muldoon MF, et al. Cardiovascular reactivity and the course of immune response to an acute psychological stressor. Psychosom Med 1994;56(4):337-44. 107. Irwin M, Daniels M, Smith TL, Bloom E, Weiner H. Impaired natural killer cell activity during bereavement. Brain Behav Immun 1987;1(1):98-104. 108. Kiecolt-Glaser JK, Glaser R, Shuttleworth EC, Dyer CS, Ogrocki P, Speicher CE. Chronic stress and immunity in family caregivers of Alzheimer's disease victims. Psychosom Med 1987;49(5):523-35. 109. Marsland AL, Manuck SB, Fazzari TV, Stewart CJ, Rabin BS. Stability of individual differences in cellular immune responses to acute psychological stress. Psychosom Med 1995;57(3):295-8. 110. Kemeny ME, Weiner H, Duran R, Taylor SE, Visscher B, Fahey JL. Immune system changes after the death of a partner in HIV-positive gay men. Psychosom Med 1995;57(6):547-54. 111. Schleifer SJ, Keller SE, Camerino M, Thornton JC, Stein M. Suppression of lymphocyte stimulation following bereavement. JAMA 1983;250(3):374-7. 112. Beem EE, Hooijkaas H, Cleiren MH, Schut HA, Garssen B, Croon MA, et al. The immunological and psychological effects of bereavement: does grief counseling really make a difference? A pilot study. Psychiatry Res 1999;85(1):81-93. 113. Goodkin K, Feaster DJ, Tuttle R, Blaney NT, Kumar M, Baum MK, et al. Bereavement is associated with time-dependent decrements in cellular immune function in asymptomatic human immunodeficiency virus type 1- seropositive homosexual men. Clin Diagn Lab Immunol 1996;3(1):109-18. 114. Bower JE, Kemeny ME, Taylor SE, Fahey JL. Cognitive processing, discovery of meaning, CD4 decline, and AIDS- related mortality among bereaved HIV-seropositive men. J Consult Clin Psychol 1998;66(6):979-86. 115. Kiecolt-Glaser JK, Newton TL. Marriage and health: his and hers. Psychol Bull 2001;127(4):472-503. 116. Kiecolt-Glaser JK, Fisher LD, Ogrocki P, Stout JC, Speicher CE, Glaser R. Marital quality, marital disruption, and immune function. Psychosom Med 1987;49(1):13-34. 117. Kiecolt-Glaser JK, Kennedy S, Malkoff S, Fisher L, Speicher CE, Glaser R. Marital discord and immunity in males. Psychosom Med 1988;50(3):213-29. 118. Kiecolt-Glaser JK, Glaser R, Cacioppo JT, Malarkey WB. Marital stress: immunologic, neuroendocrine, and autonomic correlates. Ann N Y Acad Sci 1998;840:656-63. 119. Kiecolt-Glaser JK, Malarkey WB, Chee M, Newton T, Cacioppo JT, Mao HY, et al. Negative behavior during marital conflict is associated with immunological down-regulation. Psychosom Med 1993;55(5):395-409. 120. Kiecolt-Glaser JK, Newton T, Cacioppo JT, MacCallum RC, Glaser R, Malarkey WB. Marital conflict and endocrine function: are men really more physiologically affected than women? J Consult Clin Psychol 1996;64(2):324-32. 121. Kiecolt-Glaser JK, Malarkey W, Cacioppo JT, Glaser R. Stressful personal relationships: Endocrine and immune function. In: Glaser R, Kiecolt-Glaser JK, editors. Handbook of human stress and immunity. San Diego: Academic Press; 1994. p. 321-339. 122. Dopp JM, Miller GE, Myers HF, Fahey JL. Increased natural killer-cell mobilization and cytotoxicity during marital conflict. Brain Behav Immun 2000;14(1):10-26. Congreso Virtual de Psiquiatría. Interpsiquis Enero 1970. Psiquiatria.com -31- 123. Malarkey WB, Kiecolt-Glaser JK, Pearl D, Glaser R. Hostile behavior during marital conflict alters pituitary and adrenal hormones. Psychosom Med 1994;56(1):41-51. 124. Grant I. Caregiving may be hazardous to your health. Psychosom Med 1999;61(4):420-3. 125. Kiecolt-Glaser JK, Dura JR, Speicher CE, Trask OJ, Glaser R. Spousal caregivers of dementia victims: longitudinal changes in immunity and health. Psychosom Med 1991;53(4):345-62. 126. Kiecolt-Glaser JK, Glaser R, Gravenstein S, Malarkey WB, Sheridan J. Chronic stress alters the immune response to influenza virus vaccine in older adults. Proc Natl Acad Sci U S A 1996;93(7):3043-7. 127. Kiecolt-Glaser JK, Marucha PT, Malarkey WB, Mercado AM, Glaser R. Slowing of wound healing by psychological stress. Lancet 1995;346(8984):1194-6. 128. Mills PJ, Yu H, Ziegler MG, Patterson T, Grant I. Vulnerable caregivers of patients with Alzheimer's disease have a deficit in circulating CD62L- T lymphocytes. Psychosom Med 1999;61(2):168-74. 129. Vedhara K, Cox NK, Wilcock GK, Perks P, Hunt M, Anderson S, et al. Chronic stress in elderly carers of dementia patients and antibody response to influenza vaccination. Lancet 1999;353(9153):627-31. 130. Esterling BA, Kiecolt-Glaser JK, Glaser R. Psychosocial modulation of cytokine-induced natural killer cell activity in older adults. Psychosom Med 1996;58(3):264-72. 131. Mills PJ, Ziegler MG, Patterson T, Dimsdale JE, Hauger R, Irwin M, et al. Plasma catecholamine and lymphocyte beta 2-adrenergic receptor alterations in elderly Alzheimer caregivers under stress. Psychosom Med 1997;59(3):251-6. 132. Glaser R, MacCallum RC, Laskowski BF, Malarkey WB, Sheridan JF, Kiecolt-Glaser JK. Evidence for a shift in the Th-1 to Th-2 cytokine response associated with chronic stress and aging. J Gerontol A Biol Sci Med Sci 2001;56(8):M477-82. 133. Glaser R, Kiecolt-Glaser JK, Speicher CE, Holliday JE. Stress, loneliness, and changes in herpesvirus latency. J Behav Med 1985;8(3):249-60. 134. Glaser R, Rice J, Speicher CE, Stout JC, Kiecolt-Glaser JK. Stress depresses interferon production by leukocytes concomitant with a decrease in natural killer cell activity. Behav Neurosci 1986;100(5):675-8. 135. Jemmott JBI, Borysenko JZ, Borysenko M, McClelland DC, Chapman R, Meyer D, et al. Academic stress, power motivation, and decrease in secretion rate of salivary secretory immunoglobulin A. Lancet 1983;1(8339):1400-2. 136. Kiecolt-Glaser JK, Garner W, Speicher C, Penn GM, Holliday J, Glaser R. Psychosocial modifiers of immunocompetence in medical students. Psychosom Med 1984;46(1):7-14. 137. Deinzer R, Kleineidam C, Stiller-Winkler R, Idel H, Bachg D. Prolonged reduction of salivary immunoglobulin A (sIgA) after a major academic exam. Int J Psychophysiol 2000;37(3):219-32. 138. Glaser R, Pearson GR, Jones JF, Hillhouse J, Kennedy S, Mao HY, et al. Stress-related activation of Epstein-Barr virus. Brain Behav Immun 1991;5(2):219-32. 139. Sarid O, Anson O, Yaari A, Margalith M. Epstein-Barr virus specific salivary antibodies as related to stress caused by examinations. J Med Virol 2001;64(2):149-56. 140. Glaser R, Friedman SB, Smyth J, Ader R, Bijur P, Brunell P, et al. The differential impact of training stress and final examination stress on herpesvirus latency at the United States Military Academy at West Point. Brain Behav Immun 1999;13(3):240-51. 141. Marucha PT, Kiecolt-Glaser JK, Favagehi M. Mucosal wound healing is impaired by examination stress. Psychosom Med 1998;60(3):362-5. 142. Ursano RJ. Disaster: stress, immunologic function, and health behavior. Psychosom Med 1997;59(2):142-3. 143. Baum A, Gatchel RJ, Schaeffer MA. Emotional, behavioral, and physiological effects of chronic Congreso Virtual de Psiquiatría. Interpsiquis Enero 1970. Psiquiatria.com -32- stress at Three Mile Island. J Consult Clin Psychol 1983;51(4):565-72. 144. Davidson LM, Baum A. Chronic stress and posttraumatic stress disorders. J Consult Clin Psychol 1986;54(3):303-8. 145. McKinnon W, Weisse CS, Reynolds CP, Bowles CA, Baum A. Chronic stress, leukocyte subpopulations, and humoral response to latent viruses. Health Psychol 1989;8(4):389-402. 146. Inoue-Sakurai C, Maruyama S, Morimoto K. Posttraumatic stress and lifestyles are associated with natural killer cell activity in victims of the Hanshin-Awaji earthquake in Japan. Prev Med 2000;31(5):467-73. 147. Nersesyan AK, Boffetta P, Sarkisyan TF, Zalinyan GG, Arutyunyan RM. Chromosome aberrations in lymphocytes of persons exposed to an earthquake in Armenia. Scand J Work Environ Health 2001;27(2):120-4. 148. Solomon GF, Segerstrom SC, Grohr P, Kemeny M, Fahey J. Shaking up immunity: psychological and immunologic changes after a natural disaster. Psychosom Med 1997;59(2):114-27. 149. Delahanty DL, Dougall AL, Craig KJ, Jenkins FJ, Baum A. Chronic stress and natural killer cell activity after exposure to traumatic death. Psychosom Med 1997;59(5):467-76. 150. Ironson G, Wynings C, Schneiderman N, Baum A, Rodriguez M, Greenwood D, et al. Posttraumatic stress symptoms, intrusive thoughts, loss, and immune function after Hurricane Andrew. Psychosom Med 1997;59(2):128-41. 151. Boscarino JA, Chang J. Higher Abnormal Leukocyte and Lymphocyte Counts 20 Years After Exposure to Severe Stress: Research and Clinical Implications. Psychosom Med 1999;61(3):378-272. 152. Kawamura N, Kim Y, Asukai N. Suppression of cellular immunity in men with a past history of posttraumatic stress disorder. Am J Psychiatry 2001;158(3):484-6. 153. Moya-Albiol L, Salvador A. Empleo de estresores psicológicos de laboratorio en el estudio de la respuesta psicofisiológica al estrés. Anales de Psicología 2001;17(1):69-81. 154. Brosschot JF, Benschop RJ, Godaert GL, de Smet MB, Olff M, Heijnen CJ, et al. Effects of experimental psychological stress on distribution and function of peripheral blood cells. Psychosom Med 1992;54(4):394-406. 155. Delahanty DL, Wang T, Maravich C, Forlenza M, Baum A. Time-of-day effects on response of natural killer cells to acute stress in men and women. Health Psychol 2000;19(1):39-45. 156. Gerritsen W, Heijnen CJ, Wiegant VM, Bermond B, Frijda NH. Experimental social fear: immunological, hormonal, and autonomic concomitants. Psychosom Med 1996;58(3):273-86. 157. Goebel MU, Mills PJ. Acute psychological stress and exercise and changes in peripheral leukocyte adhesion molecule expression and density. Psychosom Med 2000;62(5):664-70. 158. Naliboff BD, Benton D, Solomon GF, Morley JE, Fahey JL, Bloom ET, et al. Immunological changes in young and old adults during brief laboratory stress. Psychosom Med 1991;53(2):121-32. 159. Peters ML, Godaert GL, Ballieux RE, Brosschot JF, Sweep FC, Swinkels LM, et al. Immune responses to experimental stress: effects of mental effort and uncontrollability. Psychosom Med 1999;61(4):513-24. 160. Ring C, Carroll D, Willemsen G, Cooke J, Ferraro A, Drayson M. Secretory immunoglobulin A and cardiovascular activity during mental arithmetic and paced breathing. Psychophysiology 1999;36(5):602-9. 161. Ring C, Harrison LK, Winzer A, Carroll D, Drayson M, Kendall M. Secretory immunoglobulin A and cardiovascular reactions to mental arithmetic, cold pressor, and exercise: effects of alpha-adrenergic blockade. Psychophysiology 2000;37(5):634-43. 162. Willemsen G, Ring C, Carroll D, Evans P, Clow A, Hucklebridge F. Secretory immunoglobulin A and cardiovascular reactions to mental arithmetic and cold pressor. Psychophysiology 1998;35(3):252-9. 163. Willemsen G, Ring C, McKeever S, Carroll D. Secretory immunoglobulin A and cardiovascular activity during mental arithmetic: effects of task difficulty and task order. Biol Psychol Congreso Virtual de Psiquiatría. Interpsiquis Enero 1970. Psiquiatria.com -33- 2000;52(2):127-41. 164. Goebel MU, Mills PJ, Irwin MR, Ziegler MG. Interleukin-6 and tumor necrosis factor-alpha production after acute psychological stress, exercise, and infused isoproterenol: differential effects and pathways. Psychosom Med 2000;62(4):591-8. 165. Bosch JA, de Geus EJ, Kelder A, Veerman EC, Hoogstraten J, Amerongen AV. Differential effects of active versus passive coping on secretory immunity. Psychophysiology 2001;38(5):836-46. 166. McEwen BS. Protective and damaging effects of stress mediators. N Engl J Med 1998;338(3):171-9. 167. Kobasa SC. Stressful life events, personality, and health: an inquiry into hardiness. J Pers Soc Psychol 1979;37(1):1-11. 168. Kobasa SC, Maddi SR, Kahn S. Hardiness and health: a prospective study. J Pers Soc Psychol 1982;42(1):168-77. 169. Okun M, Zautra a, Robinson S. hardiness and health among women with rheumatoid arthritis. Pers Individ Differ 1988;9(1):101-107. 170. Jemmott JB, 3rd, Locke SE. Psychosocial factors, immunologic mediation, and human susceptibility to infectious diseases: how much do we know? Psychol Bull 1984;95(1):78-108. 171. Jemmott JB, 3rd. Social motives and susceptibility to disease: stalking individual differences in health risks. J Pers 1987;55(2):267-98. 172. McClelland DC. Motivational factors in health and disease. Am Psychol 1989;44(4):675-83. 173. McClelland DC, Alexander C, Marks E. The need for power, stress, immune function, and illness among male prisoners. J Abnorm Psychol 1982;91(1):61-70. 174. Jemmott JB, 3rd, Hellman C, McClelland DC, Locke SE, Kraus L, Williams RM, et al. Motivational syndromes associated with natural killer cell activity. J Behav Med 1990;13(1):53-73. 175. Bandura A. Self-efficacy: toward a unifying theory of behavioral change. Psychol Rev 1977;84(2):191-215. 176. Bandura A, Taylor CB, Williams SL, Mefford IN, Barchas JD. Catecholamine secretion as a function of perceived coping self-efficacy. J Consult Clin Psychol 1985;53(3):406-14. 177. Wiedenfeld SA, O'Leary A, Bandura A, Brown S, Levine S, Raska K. Impact of perceived self-efficacy in coping with stressors on components of the immune system. J Pers Soc Psychol 1990;59(5):1082-94. 178. Peterson C, Seligman ME. Explanatory style and illness. J Pers 1987;55(2):237-65. 179. Seligman ME, Abramson LY, Semmel A, von Baeyer C. Depressive attributional style. J Abnorm Psychol 1979;88(3):242-7. 180. Peterson C, Seligman ME, Vaillant GE. Pessimistic explanatory style is a risk factor for physical illness: a thirty-five-year longitudinal study. J Pers Soc Psychol 1988;55(1):23-7. 181. Kamen-Siegel L, Rodin J, Seligman ME, Dwyer J. Explanatory style and cell-mediated immunity in elderly men and women. Health Psychol 1991;10(4):229-35. 182. Cohen F, Kearney KA, Zegans LS, Kemeny ME, Neuhaus JM, Stites DP. Differential immune system changes with acute and persistent stress for optimists vs pessimists. Brain Behav Immun 1999;13(2):155-74. 183. Scheier MF, Weintraub JK, Carver CS. Coping with stress: divergent strategies of optimists and pessimists. J Pers Soc Psychol 1986;51(6):1257-64. 184. Scheier MF, Carver CS. Dispositional optimism and physical well-being: the influence of generalized outcome expectancies on health. J Pers 1987;55(2):169-210. 185. Segerstrom SC, Taylor SE, Kemeny ME, Fahey JL. Optimism is associated with mood, coping, and immune change in response to stress. J Pers Soc Psychol 1998;74(6):1646-55. 186. Segerstrom SC, Solomon GF, Kemeny ME, Fahey JL. Relationship of worry to immune Congreso Virtual de Psiquiatría. Interpsiquis Enero 1970. Psiquiatria.com -34- sequelae of the Northridge earthquake. J Behav Med 1998;21(5):433-50. 187. Segerstrom SC, Glover DA, Craske MG, Fahey JL. Worry affects the immune response to phobic fear. Brain Behav Immun 1999;13(2):80-92. 188. Wallston BS, Wallston KA, Kaplan GD, Maides SA. Development and validation of the health locus of control (HLC) scale. J Consult Clin Psychol 1976;44(4):580-5. 189. Conesa J. Locus de Control y Causas de Satisfacción e Insatisfacción en Estudiantes Universitarios. . Madrid: Universidad Complutense de Madrid.; 1993. 190. Sandler IN, Lakey B. Locus of control as a stress moderator: the role of control perceptions and social support. Am J Community Psychol 1982;10(1):65-80. 191. Reynaert C, Janne P, Bosly A, Staquet P, Zdanowicz N, Vause M, et al. From health locus of control to immune control: internal locus of control has a buffering effect on natural killer cell activity decrease in major depression. Acta Psychiatr Scand 1995;92(4):294-300. 192. Gerits P, De Brabander B. Psychosocial predictors of psychological, neurochemical and immunological symptoms of acute stress among breast cancer patients. Psychiatry Res 1999;85(1):95-103. 193. Kubitz KA, Peavey BS, Moore BS. The effect of daily Hassles of humoral immunity: an interaction moderated by locus of control. Biofeedback Self Regul 1986;11(2):115-23. 194. Sieber WJ, Rodin J, Larson L, Ortega S, Cummings N, Levy S, et al. Modulation of human natural killer cell activity by exposure to uncontrollable stress. Brain Behav Immun 1992;6(2):141-56. 195. McCrae RR. Situational determinants of coping responses: loss, threat, and challenge. J Pers Soc Psychol 1984;46(4):919-28. 196. Billings DW, Folkman S, Acree M, Moskowitz JT. Coping and physical health during caregiving: the roles of positive and negative affect. J Pers Soc Psychol 2000;79(1):131-42. 197. Dew MA, Goycoolea JM, Stukas AA, Switzer GE, Simmons RG, Roth LH, et al. Temporal profiles of physical health in family members of heart transplant recipients: predictors of health change during caregiving. Health Psychol 1998;17(2):138-51. 198. Holahan CJ, Moos RH. Life stress and health: personality, coping, and family support in stress resistance. J Pers Soc Psychol 1985;49(3):739-47. 199. Olff M. Stress, depression and immunity: the role of defense and coping styles. Psychiatry Res 1999;85(1):7-15. 200. Rector N, Roger D. Cognitive style and well-being: A prospective examination. Pers Individ Differ 1996;21(5):663-674. 201. Soderstrom M, Dolbier C, Leiferman J, Steinhardt M. The relationship of hardiness, coping strategies, and perceived stress to symptoms of illness. J Behav Med 2000;23(3):311-28. 202. Cooper CL, Faragher EB. Psychosocial stress and breast cancer: the inter-relationship between stress events, coping strategies and personality. Psychol Med 1993;23(3):653-62. 203. Fawzy FI, Fawzy NW, Hyun CS, Elashoff R, Guthrie D, Fahey JL, et al. Malignant melanoma. Effects of an early structured psychiatric intervention, coping, and affective state on recurrence and survival 6 years later. Arch Gen Psychiatry 1993;50(9):681-9. 204. McKenna MC, Zevon MA, Corn B, Rounds J. Psychosocial factors and the development of breast cancer: a meta- analysis. Health Psychol 1999;18(5):520-31. 205. Antoni MH, Goodkin K, Goldstein D, LaPerriere A, Ironson G, Fletcher MA, et al. Coping responses to HIV-1 serostatus notification predict short-term affective distress and one-year follow-up immunologic status in HIV-1 seronegative and seropositive gay men. Psychosom Med 1991;53:227. 206. Antoni MH, Goldstein D, Ironson G, LaPerriere A, Fletcher MA, Schneiderman N. Coping responses to HIV-1 serostatus notification predict concurrent and prospective immunologic status. Clin. Psychol. Psychother. 1995;2:234-248. 207. Leserman J, Petitto JM, Golden RN, Gaynes BN, Gu H, Perkins DO, et al. Impact of stressful life events, depression, social support, coping, and cortisol on progression to AIDS. Am J Psychiatry Congreso Virtual de Psiquiatría. Interpsiquis Enero 1970. Psiquiatria.com -35- 2000;157(8):1221-8. 208. Ironson G, Friedman A, Klimas N, Antoni M, Fletcher MA, LaPerriere A, et al. Distress, denial, and low adherence to behavioral interventions predict faster disease progression in gay men infected with human immunodeficiency virus. Int J Behav Med 1994;1:90-105. 209. Antoni MH, August S, LaPerriere A, Baggett HL, Klimas N, Ironson G, et al. Psychological and neuroendocrine measures related to functional immune changes in anticipation of HIV-1 serostatus notification. Psychosom Med 1990;52(5):496-510. 210. Reed GM, Kemeny ME, Taylor SE, Wang HY, Visscher BR. Realistic acceptance as a predictor of decreased survival time in gay men with AIDS. Health Psychol 1994;13(4):299-307. 211. Mulder CL, de Vroome EM, van Griensven GJ, Antoni MH, Sandfort TG. Avoidance as a predictor of the biological course of HIV infection over a 7-year period in gay men. Health Psychol 1999;18(2):107-13. 212. Weinberger DA, Schwartz GE, Davidson RJ. Low-anxious, high-anxious, and repressive coping styles: psychometric patterns and behavioral and physiological responses to stress. J Abnorm Psychol 1979;88(4):369-80. 213. Esterling BA, Antoni MH, Kumar M, Schneiderman N. Defensiveness, trait anxiety, and Epstein-Barr viral capsid antigen antibody titers in healthy college students. Health Psychol 1993;12(2):132-9. 214. Hall NRS, Anderson JA, O'Grady MP. Stress and immunity in humans: modifying variables. In: Glaser R, Kiecolt-Glaser JK, editors. Handbook of Human Stress and Immunity. San Diego: Academic Press; 1994. p. 183-216. 215. Jamner LD, Schwartz GE, Leigh H. The relationship between repressive and defensive coping styles and monocyte, eosinophile, and serum glucose levels: support for the opioid peptide hypothesis of repression. Psychosom Med 1988;50(6):567-75. 216. O'Leary A. Stress, emotion, and human immune function. Psychol Bull 1990;108(3):363-82. 217. Kiecolt-Glaser JK, Greenberg B. Social support as a moderator of the aftereffects of stress in female psychiatric inpatients. J Abnorm Psychol 1984;93(2):192-9. 218. Kang DH, Coe CL, Karaszewski J, McCarthy DO. Relationship of social support to stress responses and immune function in healthy and asthmatic adolescents. Res Nurs Health 1998;21(2):117-28. 219. Vedhara K, Shanks N, Anderson S, Lightman S. The role of stressors and psychosocial variables in the stress process: a study of chronic caregiver stress. Psychosom Med 2000;62(3):374-85. 220. Leserman J, Jackson ED, Petitto JM, Golden RN, Silva SG, Perkins DO, et al. Progression to AIDS: the effects of stress, depressive symptoms, and social support. Psychosom Med 1999;61(3):397-406. 221. Perry S, Fishman B, Jacobsberg L, Frances A. Relationships over 1 year between lymphocyte subsets and psychosocial variables among adults with infection by human immunodeficiency virus. Arch Gen Psychiatry 1992;49(5):396-401. 222. Uchino BN, Cacioppo JT, Kiecolt-Glaser JK. The relationship between social support and physiological processes: a review with emphasis on underlying mechanisms and implications for health. Psychol Bull 1996;119(3):488-531. 223. Leserman J. The effects of depression, stressful life events, social support, and coping on the progression of hiv infection. Curr Psychiatry Rep 2000;2(6):495-502. 224. Levy SM, Herberman RB, Maluish AM, Schlien B, Lippman M. Prognostic risk assessment in primary breast cancer by behavioral and immunological parameters. Health Psychol 1985;4(2):99-113. 225. Reynolds P, Kaplan GA. Social connections and risk for cancer: prospective evidence from the Congreso Virtual de Psiquiatría. Interpsiquis Enero 1970. Psiquiatria.com -36- Alameda County Study. Behav Med 1990;16(3):101-10. 226. Baron RS, Cutrona CE, Hicklin D, Russell DW, Lubaroff DM. Social support and immune function among spouses of cancer patients. J Pers Soc Psychol 1990;59(2):344-52. 227. Goodkin K, Blaney NT, Feaster D, Fletcher MA, Baum MK, Mantero-Atienza E, et al. Active coping style is associated with natural killer cell cytotoxicity in asymptomatic HIV-1 seropositive homosexual men. J Psychosom Res 1992;36(7):635-50. 228. Irwin M. Immune correlates of depression. Adv Exp Med Biol 1999;461:1-24. 229. Herbert TB, Cohen S. Depression and immunity: a meta-analytic review. Psychol Bull 1993;113(3):472-86. 230. Weiss C. Depression and Immunocompetence: A Review of the Literature. Psychol Bull 1992;111(3):475-489. 231. Stein M, Miller AH, Trestman RL. Depression, the immune system, and health and illness. Findings in search of meaning. Arch Gen Psychiatry 1991;48(2):171-7. 232. Cover H, Irwin M. Immunity and depression: insomnia, retardation, and reduction of natural killer cell activity. J Behav Med 1994;17(2):217-23. 233. Kronfol Z, House JD. Lymphocyte mitogenesis, immunoglobulin and complement levels in depressed patients and normal controls. Acta Psychiatr Scand 1989;80(2):142-7. 234. Schleifer SJ, Keller SE, Meyerson AT, Raskin MJ, Davis KL, Stein M. Lymphocyte function in major depressive disorder. Arch Gen Psychiatry 1984;41(5):484-6. 235. Kronfol Z, Silva J, Jr., Greden J, Dembinski S, Gardner R, Carroll B. Impaired lymphocyte function in depressive illness. Life Sci 1983;33(3):241-7. 236. Irwin M, Smith TL, Gillin JC. Low natural killer cytotoxicity in major depression. Life Sci 1987;41(18):2127-33. 237. Irwin M, Patterson T, Smith TL, Caldwell C, Brown SA, Gillin JC, et al. Reduction of immune function in life stress and depression. Biol Psychiatry 1990;27(1):22-30. 238. Leonard BE, Song C. Stress and the immune system in the etiology of anxiety and depression. Pharmacol Biochem Behav 1996;54(1):299-303. 239. Connor TJ, Leonard BE. Depression, stress and immunological activation: the role of cytokines in depressive disorders. Life Sci 1998;62(7):583-606. 240. Ader RA, Cohen N. CNS-immune system interactions: Conditioning phenomena. Behav Brain Sci 1985;88:379-426. 241. Derogatis LR. Psychology in cancer medicine: a perspective and overview. J Consult Clin Psychol 1986;54(5):632-8. 242. Rosch PJ. Stress and cancer: Disorders of communication, control and civilization. In: Cooper CL, editor. handbook of stress, medicine, and health. Boca Ratón, Florida: CRC Press; 1996. p. 27-60. 243. Sklar LS, Anisman H. Stress and cancer. Psychol Bull 1981;89(3):369-406. 244. Contrada RJ, Leventhal H, O?Leary A. Personality and health. In: Pervin L, editor. Handbook of personality: theory and research. New York: Guilford; 1990. p. 638-669. 245. Levy SM, Herberman RB, Whiteside T, Sanzo K, Lee J, Kirkwood J. Perceived social support and tumor estrogen/progesterone receptor status as predictors of natural killer cell activity in breast cancer patients. Psychosom Med 1990;52(1):73-85. 246. Lehrer S. Life change and gastric cancer. Psychosom Med 1980;42(5):499-502. 247. Giraldi T, Rodani MG, Cartei G, Grassi L. Psychosocial factors and breast cancer: a 6-year Italian follow-up study. Psychother Psychosom 1997;66(5):229-36. 248. Barraclough J, Pinder P, Cruddas M, Osmond C, Taylor I, Perry M. Life events and breast cancer prognosis. Bmj 1992;304(6834):1078-81. 249. Rabin BS. Stress, Immune function and health: Wiley-Liss; 1999. 250. Ogawa K, Hirai M, Katsube T, Murayama M, Hamaguchi K, Shimakawa T, et al. Suppression of cellular immunity by surgical stress. Surgery 2000;127(3):329-36. 251. Biondi M, Costantini A, Parisi A. Can loss and grief activate latent neoplasia? A clinical case of Congreso Virtual de Psiquiatría. Interpsiquis Enero 1970. Psiquiatria.com -37- possible interaction between genetic risk and stress in breast cancer. Psychother Psychosom 1996;65(2):102-5. 252. Solomon GF, Kemeny ME, Temoshok L. Psychoneuroimmunologic aspects of human immunodeficiency virus infection. In: Ader RA, D. L. Felten DL, Cohen N, editors. Psychoneuroimmunology. Second Edition ed. New York: Academic Press; 1991. p. 1081-1113. 253. Balbin EG, Ironson GH, Solomon GF. Stress and coping: the psychoneuroimmunology of HIV/AIDS. Baillieres Best Pract Res Clin Endocrinol Metab 1999;13(4):615-33. 254. Cohen S, Doyle WJ, Skoner DP. Psychological stress, cytokine production, and severity of upper respiratory illness. Psychosom Med 1999;61(2):175-80. 255. Leserman J, Petitto JM, Perkins DO, Folds JD, Golden RN, Evans DL. Severe stress, depressive symptoms, and changes in lymphocyte subsets in human immunodeficiency virus-infected men. A 2-year follow-up study. Arch Gen Psychiatry 1997;54(3):279-85. 256. Goodkin K, Fletcher MA, Cohen N. Clinical aspects of psychoneuroimmunology. Lancet 1995;345(8943):183-4. 257. Kemeny ME, Weiner H, Taylor SE, Schneider S, Visscher B, Fahey JL. Repeated bereavement, depressed mood, and immune parameters in HIV seropositive and seronegative gay men. Health Psychol 1994;13(1):14-24. 258. Reed GM, Kemeny ME, Taylor SE, Visscher BR. Negative HIV-specific expectancies and AIDS-related bereavement as predictors of symptom onset in asymptomatic HIV-positive gay men. Health Psychol 1999;18(4):354-63. 259. Goodkin K, Fuchs I, Feaster D, Leeka J, Rishel DD. Life stressors and coping style are associated with immune measures in HIV-1 infection--a preliminary report. Int J Psychiatry Med 1992;22(2):155-72. 260. Ironson G, LaPerriere A, Antoni M, O'Hearn P, Schneiderman N, Klimas N, et al. Changes in immune and psychological measures as a function of anticipation and reaction to news of HIV-1 antibody status. Psychosom Med 1990;52(3):247-70. 261. Solomon GF, Ironson GH, Balbin EG. Psychoneuroimmunologic and HIV/AIDS: Manuscrito proporcionado por el autor; 2000. 262. Kiecolt-Glaser JK, Glaser R. Psychoneuroimmunology: can psychological interventions modulate immunity? J Consult Clin Psychol 1992;60(4):569-75. 263. Meyer TJ, Mark MM. Effects of psychosocial interventions with adult cancer patients: a meta-analysis of randomized experiments. Health Psychol 1995;14(2):101-8. 264. Helgeson VS, Cohen S, Schulz R, Yasko J. Group support interventions for women with breast cancer: who benefits from what? Health Psychol 2000;19(2):107-14. 265. Spiegel D, Bloom JR, Kraemer HC, Gottheil E. Effect of psychosocial treatment on survival of patients with metastatic breast cancer. Lancet 1989;2(8668):888-91. 266. Antoni MH, Cruess S, Cruess DG, Kumar M, Lutgendorf S, Ironson G, et al. Cognitive-behavioral stress management reduces distress and 24-hour urinary free cortisol output among symptomatic HIV-infected gay men. Ann Behav Med 2000;22(1):29-37. 267. Antoni MH, Cruess DG, Cruess S, Lutgendorf S, Kumar M, Ironson G, et al. Cognitive-behavioral stress management intervention effects on anxiety, 24-hr urinary norepinephrine output, and T-cytotoxic/suppressor cells over time among symptomatic HIV-infected gay men. J Consult Clin Psychol 2000;68(1):31-45. 268. Cruess S, Antoni M, Cruess D, Fletcher MA, Ironson G, Kumar M, et al. Reductions in herpes simplex virus type 2 antibody titers after cognitive behavioral stress management and relationships with neuroendocrine function, relaxation skills, and social support in HIV- positive men. Psychosom Med 2000;62(6):828-37. 269. Antoni MH, Baggett L, Ironson G, LaPerriere A, August S, Klimas N, et al. Cognitive-behavioral Congreso Virtual de Psiquiatría. Interpsiquis Enero 1970. Psiquiatria.com -38- stress management intervention buffers distress responses and immunologic changes following notification of HIV-1 seropositivity. J Consult Clin Psychol 1991;59(6):906-15. 270. Friedman E. Relaxation training and levels of secretory IgA in breast milk. Arch Pediatr Adolesc Med 1999;153(6):654-5. 271. Green RG, Green ML. Relaxation increases salivary immunoglobulin A1. Psychol Rep 1987;61(2):623-9. 272. Green ML, Green RG, Santoro W. Daily relaxation modifies serum and salivary immunoglobulins and psychophysiologic symptom severity. Biofeedback Self Regul 1988;13(3):187-99. 273. Jasnoski ML, Kugler J. Relaxation, imagery, and neuroimmunomodulation. Ann N Y Acad Sci 1987;496:722-30. 274. Lekander M, Furst CJ, Rotstein S, Hursti TJ, Fredrikson M. Immune effects of relaxation during chemotherapy for ovarian cancer. Psychother Psychosom 1997;66(4):185-91. 275. Lutgendorf S, Logan H, Kirchner HL, Rothrock N, Svengalis S, Iverson K, et al. Effects of relaxation and stress on the capsaicin-induced local inflammatory response. Psychosom Med 2000;62(4):524-34. 276. O'Connor ME, Schmidt W, Carroll-Pankhurst C, Olness KN. Relaxation training and breast milk secretory IgA. Arch Pediatr Adolesc Med 1998;152(11):1065-1070. 277. Rood YR, Bogaards M, Goulmy E, Houwelingen HC. The effects of stress and relaxation on the in vitro immune response in man: a meta-analytic study. J Behav Med 1993;16(2):163-81. 278. Scheufele PM. Effects of progressive relaxation and classical music on measurements of attention, relaxation, and stress responses. J Behav Med 2000;23(2):207-28. 279. Sherman JJ, Carlson CR, McCubbin JA, Wilson JF. Effects of stretch-based progressive relaxation training on the secretion of salivary immunoglobulin A in orofacial pain patients. J Orofac Pain 1997;11(2):115-124. 280. Zachariae R, Hansen JB, Andersen M, Jinquan T, Petersen KS, Simonsen C, et al. Changes in cellular immune function after immune specific guided imagery and relaxation in high and low hypnotizable healthy subjects. Psychother Psychosom 1994;61(1-2):74-92. 281. Guhad FA, Hau J. Salivary IgA as a marker of social stress in rats. Neurosci Lett 1996;216(2):137-40. 282. Gruzelier J, Smith F, Nagy A, Henderson D. Cellular and humoral immunity, mood and exam stress: the influences of self-hypnosis and personality predictors. Int J Psychophysiol 2001;42(1):55-71. 283. Laidlaw TM, Booth RJ, Large RG. Reduction in skin reactions to histamine after a hypnotic procedure. Psychosom Med 1996;58(3):242-8. 284. Miller GE, Cohen S. Psychological interventions and the immune system: a meta-analytic review and critique. Health Psychol 2001;20(1):47-63. 285. Kiecolt-Glaser JK, Marucha PT, Atkinson C, Glaser R. Hypnosis as a modulator of cellular immune dysregulation during acute stress. J Consult Clin Psychol 2001;69(4):674-82. 286. Dunn AJ. Psychoneuroimmunology: introduction and general perspectives. In: Leonard B, Miller K, editors. Stress, the immune system and psychiatry: John Wiley & Sons; 1995. p. 1-16. 287. Biondi M. Effects of stress on immune functions: An overview. In: Ader R, Felten D, Cohen N, editors. Psychoneuroimmunology. Third ed: Academic Press; 2001. p. 160- 226. 288. Zachariae R. Hypnosis and Immunity. In: Ader R, Felten D, Cohen N, editors. Psychoneuroimmunology. Third ed: Academic Press; 2001. p. 133-160. Congreso Virtual de Psiquiatría. Interpsiquis Enero 1970. Psiquiatria.com -39- Congreso Virtual de Psiquiatría. Interpsiquis Enero 1970. Psiquiatria.com -40-