Redox
Anuncio

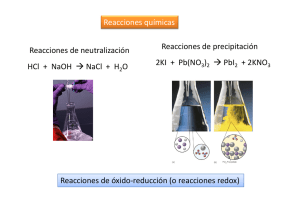
Oxidación Fe + O2 + H2O FeO(OH) + HO- REACCIONES REDOX OXIDACIÓN Incremento en la proporción de átomos de oxígeno en un compuesto. C + O2 CO2 REDUCCIÓN Disminución en la proporción de átomos de oxígeno en un compuesto. CO2 + H2 CO + H2O REACCIONES DE TRANSFERENCIA DE ELECTRONES (Reacciones Redox) OXIDACIÓN: Pérdida de electrones (o aumento en el número de oxidación) Cu → Cu2+ + 2e– REDUCCIÓN: Ganancia de electrones (o disminución en el número de oxidación) Ag+ + 1e– →Ag Siempre que se produce una oxidación debe producirse simultáneamente una reducción. Cada una de estas reacciones se denomina hemirreacción. Estado de oxidación (E.O.) (o número de oxidación) “Es la carga que tendría un átomo si todos sus enlaces fueran iónicos”. En el caso de enlaces covalentes polares habría que suponer que la pareja de electrones compartidos están totalmente desplazados hacia el elemento más electronegativo. El E.O. no tiene porqué ser la carga real que tiene un átomo, aunque a veces coincide. Asignación de estados de oxidación Un elemento no combinado con otros (en estado neutro) tienen E.O. = 0. La suma de los E.O. de todos los átomos en una especie es igual a su carga total. Asignación de estados de oxidación El oxígeno (O) en óxidos, ácidos y sales oxácidas tiene E.O. = –2. Puede formar peróxidos (O22-), superóxidos (O2-) y ozónidos (O3-). El hidrógeno (H) tiene E.O. = –1 en los hidruros metálicos y +1 en el resto de los casos que son la mayoría. Los metales formando parte de moléculas tienen E.O. positivos. Los elementos del grupo 1 y 2 tienen E.O. = 1 y 2 respectivamente. El azufre (S) tiene E.O. = +2, +4 y +6 según comparta 2, 4 o los 6 electrones de valencia con un elemento más electronegativo (por ejemplo O). Si forma un sulfuro tiene E.O. = -2. Ejemplos Calcular los E.O. del todos los átomos en ZnSO4 , SO2 , CO2 , HClO3 , Cr2O72- Cu +AgNO3 Introducimos un electrodo de cobre en una disolución de AgNO3 Espontáneamente el cobre se oxidará pasando a la disolución como Cu2+ y la Ag+ de la misma se reducirá pasando a ser plata metálica: Cu → Cu2+ + 2e– (oxidación) Ag+ + 1e– → Ag (reducción) Zn + Pb(NO3)2 Introducimos una lámina de cinc en una disolución de Pb(NO3)2. La lámina de Zn se recubre de una capa de plomo: Zn →Zn2+ + 2e– (oxidación) Pb2+ + 2e–→ Pb (reducción). Ejemplo Comprobar que la reacción de formación de hierro Fe2O3 + 3 CO → 2 Fe + 3 CO2 es una reacción redox. Indicar los E.O. de todos los elementos antes y después de la reacción. Agentes oxidantes y reductores Haz lo que yo digo pero no lo que yo hago Agente oxidante Sustancia capaz de oxidar a otra. Se reduce. Agente reductor Sustancia capaz de reducir a otra. Se oxida. Ejemplo Zn + 2 Ag+ → Zn2+ + 2 Ag Oxidación: Reducción: Zn (reductor) → Zn2+ + 2e– Ag+ (oxidante) + 1e– → Ag Ejemplos Formule, complete y ajuste las siguientes reacciones, justificando de que tipo son: a) Cloruro de hidrógeno más amoniaco, para dar cloruro de amonio. b) Descomposición térmica del carbonato cálcico en óxido de calcio y dióxido de carbono. c) Cloro más sodio para dar cloruro de sodio. d) Ácido sulfúrico más zinc metal para dar sulfato de zinc e hidrógeno. Ajuste de reacciones redox Método del ion-electrón Conservación de la masa Conservación de la carga Hay que escribir las dos hemirreacciones que tienen lugar y después igualar el nº de e– de ambas, para que al sumarlas los electrones desaparezcan. Etapas en el ajuste redox Zn + AgNO3 → Zn(NO3)2 + Ag 1. Identificar los átomos que cambian su E.O. 2. Escribir hemirreacciones con moléculas o iones que existan realmente en disolución ajustando el nº de átomos. 3. Ajustar el nº de electrones de forma que al sumar las dos hemirreacciones, éstos desaparezcan. 4. Escribir la reacción química completa utilizando los coeficientes hallados y añadiendo las moléculas o iones que no intervienen directamente en la reacción redox. 5. Comprobar que la reacción quede equilibrada. Ajuste de reacciones en disolución acuosa ácida o básica. Si hay iones poliatómicos con O, el ajuste se complica pues aparecen también H+, OH– y H2O. En medio ácido: Los átomos de O que se pierdan en la reducción forman agua (los que se ganen en la oxidación provienen del agua). Los átomos de H provienen del ácido. En medio básico: Los átomos de O que se ganan en la oxidación (o pierdan en la reducción) provienen de los OH–, necesitándose tantas moléculas de H2O como átomos de oxígeno se ganen o pierdan. Ejemplo Ajuste redox en medio ácido KMnO4 + H2SO4 + KI → MnSO4 + I2 + K2SO4 + H2O 1. 2. 3. 4. 5. Identificar los átomos que cambian su E.O. Escribir hemirreacciones con moléculas o iones que existan realmente. Completar con H+ y/o H2O. Ajustar el nº de electrones para que desaparezcan. Escribir la reacción química completa. Comprobar que la reacción quede equilibrada. Ejemplo Ajuste redox en medio básico Cr2(SO4)3 + KClO3 + KOH → K2CrO4 + KCl + K2SO4 + H2O 1. Identificar los átomos que cambian su E.O. 2. Escribir hemirreacciones con moléculas o iones que existan realmente. Completar con HO- y/o H2O. 3. Ajustar el nº de electrones para que desaparezcan. 4. Escribir la reacción química completa. 5. Comprobar que la reacción quede equilibrada. Caso particular La oxidación de tiosulfato (S2O32-) a tetrationato (S4O62-) es más fácil de plantear empezando con el balance de carga. 2 S2O32- S4O62- + 2 eEjercicio: Valoración o titulación redox Es similar a la valoración ácido base. Hay que determinar el número de moles de especie oxidante y reductora que reaccionan entre sí. El nº de moles de e− que pierde el oxidante es igual a los que gana el reductor. Se necesita conocer qué especies químicas son los productos y no sólo los reactivos. Ejemplo Se valoran 50 ml de una disolución de FeSO4 acidulada con H2SO4 con 30 ml de KMnO4 0,25 M. ¿Cuál será la concentración molar de la solución de FeSO4 si el MnO4– pasa a Mn2+? 1. Identificar los átomos que cambian su E.O. 2. Escribir hemirreacciones con moléculas o iones que existan realmente. Completar con H+ y/o H2O. 3. Ajustar el nº de electrones para que desaparezcan. 4. Escribir la reacción química completa. 5. Comprobar que la reacción quede equilibrada. 6. Calcular los moles de MnO4-. 7. Calcular los moles de Fe2+ (según estequiometría) 8. Calcular la concentración de la solución original de FeSO4 Equivalente Químico para reacciones Redox Peso Equivalente (Peq) de un elemento es la masa del elemento capaz de combinarse con 8 g de oxígeno o con 1g de hidrógeno o con un equivalente de otro elemento. Peq REDOX = PM / n° de electrones participantes EQ (oxidante) = EQ (reductor) Para saber cual es la masa equivalente, además de saber de qué sustancia se trata, es necesario conocer en qué sustancia se transforma (hemirreacción). Ejemplo Calcular los pesos equivalentes del oxidante y del reductor de la reacción de FeSO4 acidulada con H2SO4 con KMnO4. 1. 2. 3. Identificar los átomos que cambian su E.O. Escribir hemirreacciones con moléculas o iones que existan realmente. Completar con H+ y/o H2O. Calcular el PeqREDOX = PM / n° de electrones participantes. Ejemplo Se hace reaccionar permanganato de potasio con ácido clorhídrico y se obtienen, entre otros productos, cloruro de manganeso (II) y cloro molecular. (a) Ajuste y complete la reacción. (b) Calcule los pesos equivalentes del oxidante y del reductor. (c) Calcule el volumen de Cl2, medido en CNTP, a obtener a partir de 100 g de KMnO4 con exceso de HCl. 1. Identificar los átomos que cambian su E.O. 2. Escribir hemirreacciones con moléculas o iones que existan realmente. Completar con H+ y/o H2O. 3. Ajustar el nº de electrones para que desaparezcan. 4. Escribir la reacción química completa. OJO con el HCl 5. Comprobar que la reacción quede equilibrada. 6. Calcular el PeqREDOX=PM/n° de electrones participantes. 7. Suponer al Cl2 como un gas ideal (1 mol ocupa 22.4 l en CNTP) Tendencia a oxidarse o reducirse Descripción cualitativa del poder reductor u oxidante MAYOR TENDENCIA A OXIDARSE MAYOR PODER REDUCTOR XRED/XOX YRED/YOX ZRED/ZOX MAYOR TENDENCIA A REDUCIRSE MAYOR PODER OXIDANTE Ejemplo En el A2+ A2+ A + laboratorio + B+ + C2+ C2+ se realizaron los siguientes reacciones: B + A3+ no reacciona C + A2+ Predecir que ocurrirá con las siguientes mezclas: A3+ + A B + C2+ A + C A3+ + C B+ + A3+ 1. Elegir el orden para la respuesta. MAYOR PODER REDUCTOR MAYOR TENDENCIA A OXIDARSE Especie REDUCIDA 2. Identificar las especies presentes A, A2+, A3+, B, B+, C, C2+ 3. Identificar la relaciones entre las especies A A2+ A2+ A3+ B B+ C C2+ 4. Empezar con las reacciones conocidas. A2+ + B+ B + A3+ A2+ puede reducir a B+ B < A2+ A2+ + C2+ no reacciona A2+ NO puede reducir a C2+ A2+ < C A + C2+ C + A2+ A puede reducir a C2+ C < A B < A2+ < C < MAYOR PODER REDUCTOR MAYOR TENDENCIA A OXIDARSE Especie REDUCIDA A B < A2+ < C < A MAYOR PODER REDUCTOR MAYOR TENDENCIA A OXIDARSE Especie REDUCIDA 5. Analizar cada reacción usando el orden anterior A3+ B A A3+ B+ + + + + + A C2+ C C A3+ 2 A2+ NO REACCIONA NO REACCIONA A2+ + C2+ NO REACCIONA