Reacciones químicas Reacciones de neutralización Reacciones de
Anuncio

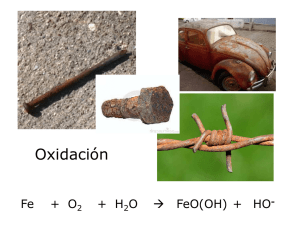
Reacciones químicas Reacciones de neutralización HCl + NaOH Æ NaCl + H2O Reacciones de precipitación 2KI + Pb(NO3)2 Æ PbI2 + 2KNO3 R Reacciones de óxido‐reducción (o reacciones redox) i d ó id d ió ( i d ) Reacciones de óxido‐reducción (o reacciones redox) Reacciones en las que algún elemento de las sustancias intervinientes cambia su número de oxidación. bi ú d id ió M Mg + 2HCl Æ 2HCl Æ MgCl M Cl2 + H H2 Oxidación pérdida de electrones Oxidación: pérdida de electrones Reducción ganancia de electrones Reducción: ganancia de electrones En una reacción redox, una especie se oxida y otra se reduce. •Una especie química se oxida cuando pierde electrones y su estado de oxidación aumenta. •Una especie química se reduce cuando gana electrones y su estado de oxidación disminuye. La sustancia que es oxidada pierde electrones La sustancia que es reducida gana g electrones •Un Un oxidante oxidante es una especie que provoca la oxidación es una especie que provoca la oxidación de otra de otra especie y como consecuencia se reduce. * Un reductor es una especie que provoca la reducción p q p de otra especie y como consecuencia se oxida. Compuesto A reducido Comp esto A red cido (agente reductor) A se oxida, perdiendo electrones Compuesto oxidado A Compuesto B oxidado C B id d (agente oxidante) B se reduce, ganando electrones Compuesto p reducido B Cu° + 2Ag+ Cu2+ + 2Ag° 024_SILVERCRYSTA.mov 023_REDOXREACTS2.mov Zn° + Cu2+ Zn2+ + Cu° Zn2+ + Cu° No reacciona Las reacciones redox pueden separarse en 2 semirreacciones: semirreacción de oxidación de oxidación semirreacción de reducción El reactivo A puede ser: El reactivo A puede ser: un átomo neutro, un ión monoatómico, un ió ión poliatómico li tó i o una molécula Esta especie no Esta especie no puede ser reducida SSemirreacción d de reduccción (aggente oxxidante)) Esta especie no Esta especie no puede ser oxidada estado de t d d oxidación Semirreaacción dee oxidacción (ageente red ductor) Compuesto C t o ión Método del ión‐electrón Método para equilibrar reacciones de óxido reducción en solución acuosa que se llevan a cabo en medio ácido (exceso de H+ en la solución) o en medio alcalino (exceso de OH‐ en la solución) Na2SO3 + KMnO4 + H2SO4 Æ Na2SO4 + K2SO4 + MnSO4 + H2O Na2SO3 + KMnO4 Æ Na2SO4 + MnO2 + KOH 1 Identificar agente oxidante y agente reductor. 1‐ Identificar agente oxidante y agente reductor. 2‐ Escribir los reactivos y los productos para la hro y la hrr. 3‐ Sumar los electrones de lado de la hemirreación 3 Sumar los electrones de lado de la hemirreación que corresponda que corresponda 4‐ Equilibrar masas y cargas usando: H+ y H y H20 cuando la reacción se realiza en medio ácido. 0 cuando la reacción se realiza en medio ácido HO‐ y H20 cuando la reacción se realiza en medio alcalino. 5 Equilibrar las 2 hemirreacciones, de manera que los electrones 5‐ Equilibrar las 2 hemirreacciones de manera que los electrones ganados en la reducción sean iguales a los perdidos en la oxidación. 6‐ Sumar las dos hemirreacciones 6 Sumar las dos hemirreacciones y trasladar los coeficientes y trasladar los coeficientes estequiométricos a la ecuación química global. El método del ión‐electrón permite encontrar los coeficientes q sólo de las especies que participan en la redox. Los p q p p estequiométricos iones “espectadores” deben equilibrarse al tanteo. El carácter oxidante o reductor de una especie depende de la especie con la que reacciona. H2O2 + KMnO4 + H2SO4 Æ O2 + K2SO4 + MnSO4 + H2O H2O2 + KI + H2SO4 Æ I2 + K2SO4 + H2O Reacción de oxidación Reductor fuerte O id t débil Oxidante débil EEstos elementos reaccionan rápidamente t l t i á id t con soluciones acuosas de iones H+ (ácidos) o con H2O líquida para producir H2 gaseoso Estos elementos reaccionan con soluciones acuosas de iones H+ (ácidos) o con vapor de H2O para producir H2 gaseoso Estos elementos reaccionan con soluciones acuosas de iones H+ (ácidos) producir H2 gaseoso Reductor débil Oxidante fuerte Estos elementos no reaccionan con soluciones acuosas de iones H+ (ácidos) producir H2 gaseoso