descargar documento
Anuncio

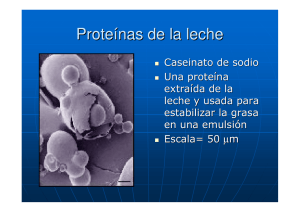
Proteínas de la Leche Debido a la facilidad con que se les puede aislar de la leche cruda, son las proteínas mejor estudiadas e incluso se conoce la estructura primaria de casi su totalidad. Su descripción comparativa es difícil ya que varía mucho con el tipo de especie. La leche de vaca es la mejor conocida, su producción es la más importante, porque se utiliza para reemplazar la leche materna y como alimento proteico esencial de los adultos. Además la leche y sus derivados, entran en la composición de numerosos alimentos domésticos o industriales. El sector además se benefició con el desarrollo de nuevas tecnologías de fraccionamiento y transformación que mejoraron las condiciones del consumo, conservación o incorporación. La leche es un sistema homogéneo formado por varios componentes de diferente función, forma y tamaño. Un ejemplo de separación entre estos componentes es a través de la tecnología de membranas, especialmente en procesos impulsados por diferencia de presión. 10 mm Células somáticas Glóbulos grasos 100 mm Bacterias y esporas MF 100 nm Micelas de caseínas Submicelas de caseínas 10 nm 1 nm UF Proteínas Séricas Lactosa Sales 0.1 nm Agua NF OI Figura 1. Componentes de la leche: tamaño e indicación del proceso de membrana. MF: microfiltración, UF: ultrafiltración, NF: nanofiltración, OI: Osmosis inversa Proteínas de la leche de cabra Además de ser un alimento de origen animal alto en proteínas, también proporciona la mayoría de los aminoácidos esenciales. En comparación con la leche de vaca, la leche de cabra tiene proteínas de menor tamaño, lo que hace que esta leche sea más fácilmente digestiva por nuestro organismo. Por lo tanto, esta leche puede tomarse por personas que tengan algunas alteraciones gástricas o úlceras para los cuales, la leche de vaca podría ser más difícil de asimilar. La leche de cabra también es una alternativa para quienes tengan alergia a las proteínas de la leche de vaca. Además de ser rica en proteínas, la leche de cabra también es rica en vitaminas A, D, B1, B2 y B12 y es un alimento rico en calcio. Composición de las proteínas de la leche En una leche normal el contenido medio de P es de 30-35 g por litro, 95% del nitrógeno total de la leche. Componentes nitrogenados de la leche Caseínas (fracción micelar insoluble, 80%), conteniendo una parte mineral (fosfato de calcio : son fácilmente aislables por centrifugación o precipitación isoeléctrica a pH 4,6 Proteínas solubles o proteínas del lactosuero 20%: Porcentaje de proteína en la leche g/kg proteína p/p Caseína Alfa-s1-caseína 10,0 30,6 Alfa-s2-caseína 2,6 8,0 Beta-caseína Gamma-caseína Caseína total 10,1 3,3 26,0 Proteínas del suero de la leche 30,8 10,1 79,5 Beta-lactoalbúmina 1,2 3,7 Beta-lactoglobulina 3,2 9,8 Albúminas del suero de leche 0,4 1,2 Inmunoglobulinas 0,7 2,1 Misceláneos Proteínas totales del suero de la leche 0,8 2,4 6,3 19,3 0,4 1,2 32,7 100 Proteínas de las membranas de los glóbulos grasos Proteínas total Figura 1. Patrón de electroforésis que se obtiene con las proteínas lácteas procedentes de las especies humana (calle 2) y bovina (calle 3). La calle 1 muestra las proteínas de referencia para los pesos moleculares y la flecha indica el sentido de migración de las proteínas Tabla 1. Contenido proteico y caseínico de la leche de algunas especies animales. componente especie humana bovina ovina caprina proteínas (% del total lácteo) 1,3-1,5 3,2-3,5 5,4-6,0 3,1-4,0 Caseínas (% del total proteico) 44,9 82,5 84,8 81,3 Composición de los diferentes constituyentes Composición de las caseínas (fosfoproteínas) Son proteínas ácidas, por ser ricas en ac. glutámico y aspártico, en la caseína B el contenido de prolina es alto, y está repartido en forma regular a lo largo de la cadena polipeptídica, por lo que hace improbable la presencia de estructuras ordenadas (hélice a o estructuras B), en cantidades apreciables. La composición en AA, le confiere una hidrofobicidad media, ligeramente superior a la de la mayoría de las proteínas globulares, esta propiedad le permite a las caseínas asociarse muy fácilmente en complejos de elevada masa molar. El pH isoeléctrico global está próximo a 4,7, comprende varios tipos de moléculas de los cuales: 50% es as- caseína 30% es b-caseína 15% es k-caseína 5% de g-caseína La caseína as1 e tiene un comportamiento dipolar con un polo globular mucho más hidrófogo y un polo cargado, y presenta una estructura poco ordenada , se encuentra generalmente al estado de monómeros. La caseína as2 es la más hidrófila de todas las caseínas porque es la más fosforilizada y más rica en residuos catiónicos, esta estructura sugiere que las interacciones electrostáticas son muy importantes y dependen del pH, resulta una gran sensibilidad a los iones Ca 2+. La caseína b es la más hidrófoba de las caseínas, las partes cargadas están separadas por una cadena muy larga sin carga. Presenta una estructura poco ordenada: 10% de hélice a, 13% de pliegue b y 77% sin orden estadístico. A bajas temperaturas (4°C) puede perder la estructura micelar y es más sensible a la hidrólisis por proteasas. Las caseínas g provienen de la parte terminal de la caseína b. A pH 7 y 37°C se añade Ca, la as coagula, la b precipita y la k no resulta afectada. caseínas k, tiene un solo residuo foforilado, por lo tanto fija poco Ca y su solubilidad no se afecta por la presencia de este ion, es anfipolar. La acción protectora de la caseína k se ejerce hasta una relación 10 moléculas de a por una de k. Durante la coagulación enzimática de la leche por la quimosina, proteasa presente en el cuajo, la enzima escinde el enlace peptídico fenilaminametionina. Así se liberan: El caseinato glucopéptido, muy polar y soluble La parte N terminal, llamada paracaseína k , cargada +, muy hidrófoga, ordenada y poco soluble. En presencia de Ca los conjuntos miscelares se polimerizan y coagulan, formando un gel, que por sinérisis expulsa el lactosuero. La velocidad y el grado de coagulación y sinéresis son tanto más elevados cuanto mayor sean los contenidos en caseína, calcio y acidez de la leche. Imágenes por Microscopía Electrónica de Barrido (SEM) Micelas de caseína en la leche Micelas de caseína formando cadenas en el yogur http://www.magma.ca/~pavel/science/Foods&bact.htm Micelas de caseína formando cluster o asociaciones en el queso Composición de las proteínas del lactosuero Cuando se coagulan las caseínas, quedan en solución las otras proteínas, conjuntamente con la lactosa y sales minerales para constituir lo que se llama lactosuero. Esta separación entre caseína y proteínas del lactosuero fue llevada a cabo por primera vez por Hammarsten en 1883. La glándula mamaria sintetiza las dos proteínas principales del lactosuero: la b-lactoglobulina y la a-lactoalbúmina. Entre ellas destacan su solubilidad, incluso a pH 4,5, si no se calientan, sus propiedades emulsionantes y espumantes y su capacidad de gelificación. Se recuperan por ultrafiltración o intercambio iónico, con secado a temperaturas lo más bajas posible para evitar su desnaturalización. a-lactoalbúmina La a -lactalbúmina es una proteína que se encuentra en la leche de casi todas las especies, con la excepción de algunas focas. Su misión biológica es la síntesis de la lactosa Es la segunda proteína en concentración en el lactosuero de vaca (entre 1 y 1,5 mg /ml), y la más abundante en el lactosuero humano. Está formada por una sola cadena polipeptídica, de 123 aminoácidos, con un PM de unos 14.200. Su estructura terciaria, muy compacta, globular, está mantenida por cuatro puentes disulfuro, con una zona de hélice a y otra de hojas plegadas b . Es una proteína ácida con un PI de alrededor de 4,8 a 5. En la vaca existen dos variantes genéticas, con distribución desigual según las razas (En la europeas solamente existe la variante B, con arginina en la posición 10. En las indias existe también la variante A, con glutamina en esa posición) Desde el punto de vista nutricional, la a -lactalbúmina es importante dada la abundancia de triptófano. La a -lactalbúmina es una de las proteínas de la leche que pueden causar alergia a este alimento b-lactoglobulina Su composición en AA es diferente a las caseínas contienen menos ácido glutámico y prolina pero son más ricos en AA azufrados,-SH (cistina y metionina) Sus puntos isoeléctricos van de 5,2 a 5,6 Es la proteína más abundante en el lactosuero bovino, en el que alcanza concentraciones de 2 a 4 mg/ml, representando alrededor de la mitad de las proteínas del lactosuero. Está presente también en la leche de otras especies, como la yegua y la cerda, pero no se encuentra en la leche humana. Está formada por una sola cadena de 162 aminoácidos, con un peso molecular de unos 18.400. Su secuencia se conoce desde 1976. Hay por lo menos 4 variantes genéticas (A, B, C y D), siendo las más comunes las llamadas A y B, que difieren en dos aminoácidos. La variante A tiene una valina en la posición 118, y un aspártico en la posición 64, mientras que la variante B tiene, respectivamente, alanina y glicina. La función de la b -lactoglobulina no se ha establecido todavía con seguridad, aunque probablemente, al menos en el caso de los rumiantes, se trata de una proteína transportadora de ácidos grasos, que ejerce su función en el tubo digestivo del lactante. Inmunoglobulinas Las inmunoglobulinas son proteínas que forman parte del sistema de defensa contra microrganismos. La estructura básica, con forma de Y está constituida por dos cadenas ligeras y dos cadenas pesadas. Cada cadena ligera está unida a una cadena pesada por un puente disulfuro, mientras que las dos cadenas pesadas se unen entre sí mediante dos puentes disulfuro. Las cadenas pesadas están glicosiladas. Albúmina La albúmina de la leche es la misma que se encuentra en la sangre, y procede de ella. Es una proteína relativamente grande, con una cadena formada por 528 aminoácidos. En el lactosuero se encuentra en una concentración de alrededor de 0,4 mg/ml. Lactoferrina La lactoferrina es una proteína fijadora de hierro, con una afinidad por el ion muy grande. emparentada estructuralmente con la transferrina de la sangre y con la ovotransferrina del huevo. Tiene carácter básico, con un punto isoeléctrico próximo a 9. Es una glicoproteína que está formada por dos lóbulos, unidos por una hélice de tres vueltas. La lactoferrina es abundante en la leche humana, encontrándose también en concentraciones significativas en la leche de los rumiantes y en la de yegua. En todos los casos, la concentración es mayor en el calostro y en el periodo de secado, pero en la leche humana se mantiene también una concentración significativamente elevada a lo largo de toda la lactación La fase micelar de la leche Aptitud de las caseínas para la asociación Aún en ausencia de iones minerales, las caseínas tienen un nivel de asociación muy elevado, superior al de las proteínas globulares. Esta propiedad está ligada a la desigual repartición de cargas y cadenas laterales apolares a lo largo de las cadenas peptídicas. Así los contituyentes b y k forman en solución micelas como lo hacen “los agentes detergentes” Las micelas se forman a partir de una CMC, es decir cuando se sobrepasa un “umbral” de concentración. Además como la estructura espacial de las caseínas en solución es muy libre, los numerosos grupos hidrófogos, más expuestos al agua se asocian entre si. Las caseínas interaccionan entre sí formando una dispersión coloidal que consiste en partículas esféricas llamadas micelas con un diámetro que suele variar entre 60 a 450nm poseyendo un promedio de 130nm. A pesar de la abundante literatura científica sobre la posible estructura de una micela, no hay consenso sobre el tema. La cantidad de micelas por ml de leche es del orden de 10 12. Estructura propuesta para una micela de caseína Se han propuesto diversos modelos fisicoquímicos de organización de las micelas, en los que estas se encuentran a su vez constituidas por subunidades (submicelas), con un diámetro de entre 10 y 20nm. Se considera que las subunidades se enlazan entre sí gracias a los iones de calcio. Se sugiere que el fosfato de calcio se une a los grupos NH2- de la lisina; el calcio interacciona con el grupo carboxilo ionizado (COO-). Las submicelas se constituyen a partir de la interacción constante entre las caseínas α, β y κ. Hay que resaltar la función de la κcaseína para estabilizar las micelas, especialmente contra la precipitación de las otras fracciones proteínicas por la acción del calcio o de los enzimas. En todos estos las unidades hidrófobas entre las moléculas de proteínas aseguran la estabilidad de la micela. Estructura propuesta para la organización de las micelas de caseína a partir de unas subunidades denominadas submicelas Aptitud de las caseínas para la asociación La masa molar media se eleva medida que aumentan la fuerza iónica, temperatura y concentración de caseína: Fuerza iónica CMC Masa molecular de la micela Grado de polimerización 0,2 0,5 552.000 23 0,05 0,74 321.000 13 La temperatura ejerce una influencia considerable, por debajo de 4°C la caseína b está completamente despolimerizada, lo que se explica por la rotura de numerosas interacciones hidrófogas Efectos de los tratamientos tecnológicos - Efectos de los tratamientos térmicos La caseína micelar y las proteínas de lactosuero sufren en el curso del calentamiento, modificaciones cuya naturaleza e intensidad depende de numerosos factores: pH, temperatura y duración del tratamiento térmico, naturaleza y concentración de los constituyentes minerales y orgánicos presentes, etc. A temperaturas moderadas (inferiores a 100 °C) que corresponden a las que se alcanzan durante la pasteurización y concentración de la leche, se observa, especialmente una desnaturalización de la blactoglobulina. A partir de los 80 °C la proteína se polimeriza y puede formarse un gel. A T < a 100° se pueden encontrar ligadas a las micelas de caseína una gran parte de las proteínas del lactosuero, lo que da una mayor resistencia a las proteasas (quimosina). A partir de 110°C-120°C, la estabilidad de la fase proteica de la leche depende del pH. El comportamiento frente a los tratamientos térmicos esta influenciado por diversos factores: 1. La alteración de la superficie micelar por fijación de las proteínas de lactosuero motiva, probablemente, una modificación del potencial eléctrico zeta y de la hidratación de las micelas. 2. El descenso del pH que se produce durante el calentamiento (hasta 1 unidad de pH) hace la leche más “sensible” a la coagulación térmica; este descenso de pH se debe a la formación de ácidos orgánicos (fórmico, levulínico, etc.) a partir de lactosa, así como a reacciones de hidrólisis del fosfato orgánico de las caseínas 3. Los calentamientos energéticos que modifican las caseínas. Las caseínas que sólo contienen algunas estructuras secundarias y terciarias organizadas, no sufren la desnaturalización propiamente dicha y quedan solubles a alta temperatura. No obstante, se producen reacciones de hidrólisis a partir de 110ºC. La desfosforilización es más rápida que la liberación de nitrógeno no proteico, así, un calentamiento de 5h a 120ºC de una solución de caseinato de sodio, libera 80% del fósforo y 20% del nitrógeno no proteico, una gran parte del fósforo liberado, está bajo la forma mineral. 4. A pesar del alto contenido en agua, la esterilización origina reacciones Maillard y hace no utilizables una parte de los residuos de lisina. También parece que las reacciones de pardeamiento están implicadas en el fenómeno de gelificación de las leches UHT durante el almacenamiento. 5. La concentración en materia seca de la leche también influencia su estabilidad al calor; un aumento de la concentración disminuye considerablemente la estabilidad térmica de la leche y aumenta el riesgo de gelificación durante el almacenamiento. Después de un tratamiento UHT O HTST (alta temperatura-corto tiempo: 140ºC durante algunos segundos) de esterilización de la leche, puede decrecer la estabilidad de las micelas durante el almacenamiento. La gelificación que se observa algunas veces después de varios meses de conservación, podría tener dos causas: a) Una inactividad incompleta de la proteasa de la leche o de las proteasas termorresistentes de las bacterias psicrófilas; b) Una formación incompleta de complejos proteicos protectores de la estabilidad de la micela (condiciones de calentamiento demasiado bajas). Efectos de la refrigeración El almacenamiento de la leche a baja temperatura (2 a 6ºC) motiva fundamentalmente dos tipos de modificaciones: la desestabilización de las micelas y una proteólisis limitada. El frío modifica los equilibrios salinos (P y Ca) entre micelas y la fase soluble: los contenidos del suero en Ca, P y caseína aumentan y el pH se eleva ligeramente (aumento de 0,3 – 0,4 unidades de pH entre 38 y 6ºC). Resultan así modificadas las proteínas (aumento del tiempo de coagulación, modificación de la consistencia de la cuajada y de la sinérisis); la disminución del rendimiento quesero puede alcanzar hasta un 10%. Es posible restaurar las propiedades iniciales por una “prematuración” una adición de CaCl2 o por un ajuste de pH inicial. Parece apropiado un tratamiento térmico (calentamiento a 60ºC durante 30 minutos) para conseguir la reabsorción de la caseína b en las micelas. Además, el frío aumenta la degradación de la caseína b en caseína g. Según la temperatura y la duración del almacenamiento en frío, se observa una gran variabilidad del contenido de la leche en caseínas g (2 a 10%). En efecto, la caseína b, al emigrar en la fase soluble se hace más accesible y más hidrolizables por las proteasas naturales de la leche o por las bacterias psicrófilas. Estas diversas proteólisis limitadas modifican la composición micelar y por lo tanto las propiedades físicas y tecnológicas de la caseína (coagulación enzimática, características de la cuajada y del queso, defectos de sabor que aparecen en el curso del afinado, etc.). Tratamientos mecánicos Los tratamientos mecánicos de homogenización disminuyen la estabilidad de las micelas en la leche entera (sobre todo cuando el tratamiento se realiza a 60ºC) y sólo tienen un efecto mínimo sobre las micelas de la leche descremada. Usos y aplicaciones Además de usarse directamente en la elaboración de productos alimentarios (derivados lácteos y cárnicos, panes y productos de repostería, etc.), la caseína se utiliza en la elaboración de productos no alimentarios: pegamentos y pinturas, cubiertas protectoras, plásticos. Otros usos tecnológicos son la clarificación de vinos o como ingrediente en preparados de biología molecular y microbiología (medios enriquecidos para el cultivo microbiano). En la alimentación especial, la caseína sirve para la elaboración de preparados médicos y concentrados proteicos destinados a la alimentación de los deportistas, especialmente después de su entrenamiento. Así, se ha observado que la digestión de las caseínas es más lenta que la de las lactoproteínas solubles (también denominadas seroproteínas) y, por ello, más apropiada para reparar el anabolismo de los aminoácidos durante el período que sigue a una comida. Tabla 3. Algunos usos tecnológicos de la caseína Producto Propiedad Aplicación Envoltura •Capacidad de formar películas •Adherencia •Pintura •Tinta •Papel •Embalaje •Acabado del cuero •Envoltura textil Adhesivo •Manejabilidad •Fuerza de adhesión •Resistencia al agua •Cola con base acuosa Plástico •Buen procesado •Resistencia mecánica •Resistencia al agua •Plástico rígido •Plástico desechable •Fibra •Película/ lámina de envoltura en embalajes Surfactante •Tensión superficial •Estabilidad de interface •Emulgente, detergente Bibliografía Cheftel, J. C., Cuq, J. L. and Lorient, D., Proteínas alimentarias. 1989, Acribia S.A., España Introducción a la bioquímica y tecnología de los alimentos, Vol I, J.C. Chefter, H. Cheftel, Editorial Acribia, 2000. http://milksci.unizar.es/bioquimica/temas/proteins/lactosuero.html