comunicado formato de cambios
Anuncio

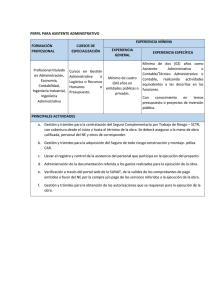
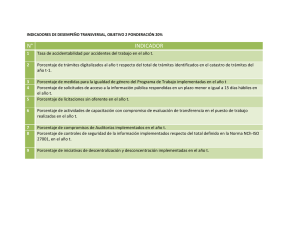
COMUNICADO FORMATO DE CAMBIOS La Dirección de Autorizaciones Sanitarias de DIGEMID, hace de conocimiento a todos los administrados, que a partir del JUEVES 16 DE ABRIL DEL 2015 se deberá comunicar mediante FORMATO DE CAMBIOS SUJETOS A COMUNICACIÓN DE PRODUCTOS FARMACÉUTICOS Formato (disponible en nuestro portal Institucional), los siguientes trámites: 1. Cambio de las Especificaciones técnicas del Ingrediente Farmacéutico Activo del IFA (o sustancia Activa para el caso de medicamentos herbarios) o de un excipiente para cumplir con una actualización de la correspondiente monografía de las farmacopeas de referencia, cuando el cambio se realiza exclusivamente para cumplir con las farmacopeas y se mantiene sin cambio las especificaciones técnicas de las propiedades específicas del producto farmacéutico (literal c) del Artículo 36° del D.S. N° 016-2011-SA). 2. Cambios del Material de envase mediato que no afectan el suministro, el uso, la seguridad ni la estabilidad del producto farmacéutico (Literal d) del Artículo 36° del D.S. N° 016-2011-SA). 3. Cambios relativos al ajuste de límites de especificación (límites con menor rango) siempre que el cambio no debe ser consecuencia de imprevistos acaecidos durante la fabricación (literal e) del Artículo 36° del D.S. N° 016-2013-SA). 4. Cambio en el arte – diseño 5. Cambio de lista de excipientes 6. Retirar o incluir registros sanitarios extranjeros 7. Retirar o incluir logos relacionados al fabricante, licenciante o al titular del registro sanitario 8. Modificación del periodo de validez (vida útil) autorizado, en el inserto 9. Inclusión o modificación de información relacionada a la fecha de expiración 10. Cambio del titular por transferencia del registro sanitario 11. Modificar, retirar o incluir formas de presentación en el inserto 12. Actualización de las especificaciones técnicas de Producto terminado (excepto productos biológicos) para cumplir con los cambios dados en la monografía de una farmacopea de referencia. La actualización solo por edición de farmacopea es opcional. 13. Cambio del sistema de codificación utilizado para identificar el número de lote. Por los trámites antes indicados, no se emitirá documento de respuesta, entendiéndose que se ha tomado conocimiento de la comunicación en el registro sanitario, con la colocación del sticker de trámite. Los trámites de comunicaciones que no se encuentren en el listado precedente, están sujetos a pronunciamiento de esta Dirección. Asimismo, se hace de conocimiento que del LISTADO DE TRÁMITE DE COMUNICACIONES DE PRODUCTOS FARMACEUTICOS Y DROGAS, disponible en nuestro portal Institucional, se han retirado los trámites de comunicaciones de productos farmacéuticos, por cuanto han sido incluidos en el Formato de Cambios, manteniéndose únicamente los trámites del Equipo de Drogas. Dirección de Autorizaciones Sanitarias Dirección General de Medicamentos, Insumos y Drogas Lima, 10 de abril del 2015