Cinética Química
Anuncio

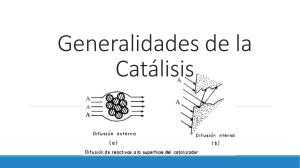
TEMA 5 CINÉTICA QUÍMICA ÍNDICE 1. Cinética Química 2. Orden de reacción 3. Mecanismo de las reacciones químicas 4. Factores que influyen en la velocidad de reacción 5. Teoría de las reacciones químicas 6. Catalizadores 1. Cinética Química La cinética química es el estudio de las velocidades de las reacciones químicas y de los mecanismos mediante los que tienen lugar. Tiene como objetivo encontrar la expresión matemática que relaciona la velocidad química con los diferentes factores de los que depende. La velocidad de reacción es una magnitud positiva que expresa la variación de la concentración de los reactivos con el tiempo N2 + 3 H2 → 2 NH3 Para calcularla hay que tener en cuenta los coeficientes estequiométricos de la reacción v dH2 dNH3 dN2 dt 3 dt 2 dt En la ecuación de la velocidad de reacción aparece la constante de la reacción y la concentración de los reactivos v= k [A] [B] 2. Orden de reacción El orden de reacción es un número entero o fraccionario, que se obtiene experimentalmente, que indica la dependencia de la velocidad de una reacción respecto a la concentración de los reactivos (este número no tiene por que coincidir con los coeficientes estequiométricos de la reacción) aA+b B → cC + dD V= k [A] [B] es el orden de reacción parcial respecto a A. es el orden de reacción parcial respecto a B. + es el orden total de la reacción. La representación de la variación de la concentración de un reactivo frente al tiempo nos indica cuál es el orden de reacción. 2. Orden de reacción Para la reacción a A datos: + b B → c C se obtuvieron los siguientes Exp [A] mol L-1 [B] mol L-1 V. media molL-1s-1 1 0,25 0,25 0,015 2 0,50 0,25 0,030 3 0,25 0,50 0,060 4 0,50 0,50 0,120 Indicar cuáles de la siguientes afirmaciones es correcta y justificar la respuesta: a) La reacción es de primer orden con respecto a A. b) La reacción es de primer orden respecto a B. c) La ecuación de la velocidad de reacción es v= k[A][B]2 d) El orden total de la reacción es 3. e) El valor de la constante de velocidad es k= 0,96 molL2s.1 2. Orden de reacción Solución: a) Al duplicarse la concentración de A permaneciendo B constante, la velocidad se duplica, luego la reacción es de orden 1 respecto a A. b) Al duplicarse la concentración de B permaneciendo constante A, la velocidad se cuadruplica, luego la reacción es de orden 2 respecto a B. c) La expresión de la velocidad de reacción será v= k [A] [B]2 d) El orden total de la reacción es 3. e) Sustituyendo los valores de [A] y [B] en cualquier experiencia. k v 0,030 0,96 mol L2 s 1 2 2 AB 0,50 0,25 3. Mecanismo de las reacciones químicas Las reacciones químicas se suelen producir a nivel molecular a través de una serie de etapas elementales intermedias, la secuencia de estas es lo que se conoce como mecanismo de la reacción. Las etapas elementales intermedias indican que especies moleculares interaccionan entre si, al número de moléculas que interaccionan en una etapa intermedia se llama molecularidad. En la reacción de formación del NO2 a partir del NO se ha detectado la presencia de N2O2 debido a que el proceso se realiza a través de varias etapas. 2 NO (g) + O2 (g) → 2 NO2 (g) NO + NO → N2O2 Etapa elemental N2O2 + O2 → 2 NO 2 NO (g) + O2 (g) → 2 NO2 Etapa elemental (g) Reacción total 4. Factores que influyen en la velocidad de la reacción 1.- Estado físico de los reactivos 2.- Concentración de los reactivos 3.- Temperatura 4.- Catalizadores La velocidad de casi todas las reacciones químicas aumenta con la temperatura duplicándose con un incremento de 10 grados C en la temperatura, cuanta más alta sea la temperatura mayor será la energía cinética de las moléculas. Si la reacción se hace en estado líquido o gaseoso la velocidad suele ser mayor que en estado sólido ya que aumenta la movilidad de las moléculas. 4. Factores que influyen en la velocidad de la reacción Efecto de la temperatura en la velocidad de reacción: Ecuación de Arrhenius La expresión de la ecuación de Arrhenius es: E - a k A e RT Donde A es una constante que es proporcional a la frecuencia de las colisiones, Ea es la energía de activación (J/mol), R es la constante de los gases (8,314 J/mol K) y T es la temperatura absoluta. Representación de la ecuación de Arrhenius 5. Teoría de la reacciones químicas Teoría de las colisiones La teoría de las colisiones relaciona la velocidad de reacción con el número de colisiones eficaces entre las moléculas de los reactivos. Las colisiones eficaces dependen de: 1.- El número total de colisiones. 2.- Que las colisiones se produzcan con una orientación determinada. 3.- Que la energía de la colisión sea suficiente para alterar la estabilidad de las moléculas que reaccionan. No reaccionan No reaccionan 5. Teoría de la reacciones químicas Teoría del estado de transición El estado de transición o complejo activado es un estado intermedio del sistema, al que corresponde la energía máxima. La energía necesaria para pasar desde los reactivos al estado de transición se llama energía de activación Ea. Los reactivos deben superar la barrera de energía de activación para poder convertirse en productos. El máximo de energía corresponde al complejo activado, una especie intermedia inestable que da lugar a los productos. 6. Catalizadores Se define catalizador a la sustancia que modifica la velocidad de reacción. Si disminuye la velocidad de reacción se denomina inhibidor o catalizador negativo. El catalizador no aparece en la ecuación neta de la reacción, ya que se regenera en igual estado. La acción del catalizador se llama catálisis. Los catalizadores modifican la velocidad de reacción debido a que crean un nuevo camino de reacción modificando la energía de activación, Ea. Los valores de las funciones termodinámicas y la espontaneidad de la reacción no se ven alteradas por la presencia del catalizador. 6. Catalizadores La catálisis puede ser homogénea, heterogénea y enzimática. En la catálisis homogénea el catalizador está en la misma fase que los reactivos, en la heterogénea está en distinta fase, suelen ser metales de gran superficie por lo que también se llama catálisis superficial o de contacto, la catálisis enzimática se da en procesos biológicos. Catálisis homogénea Catálisis Heterogénea