ADENOCARCINOMA OCULTO EN PACIENTE CON TROMBOSIS VENOSA
Anuncio

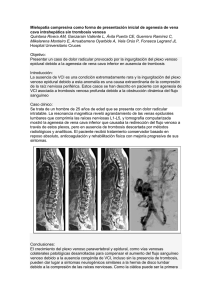
ADENOCARCINOMA OCULTO EN PACIENTE CON TROMBOSIS VENOSA PROFUNDA Y AGENESIA DE VENA CAVA INFERIOR. Isaac Martínez López, Ana María Saiz Jerez, Rodrigo Rial Horcajo, Sara González Sánchez, Manuel Hernando Rydings, Francisco Javier Serrano Hernando Introducción Las malformaciones congénitas de la vena cava inferior (VCI) constituyen una rara entidad. Las más frecuentes son la VCI doble y la VCI izquierda (0’2-3%). La agenesia de la VCI tiene una incidencia inferior al 1% en la población general y se asocia a un drenaje venoso anómalo de la pelvis y los miembros inferiores (MMII), fundamentalmente a expensas de las venas ácigos y hemiácigos1. Aunque algunos estudios relacionan la agenesia/hipoplasia de la VCI con el desarrollo de trombosis venosa profunda2, su asociación no está clara. Presentamos el caso de una TVP de MMII en un varón de 72 años con agenesia de VCI y un adenocarcinoma de pulmón. Caso clínico Varón de 72 años, fumador e hipertenso, sin otros antecedentes de interés, que acude a Urgencias por dolor lumbar y edemas de MMII desde hace 5 días. Historia de síndrome ortostático de MMII de años de evolución. A la anamnesis, refiere un dolor intenso en la región lumbar de 3-4 días de evolución, asociado a edema de ambos MMII. El dolor es de características inespecíficas, no relacionado con movimientos posturales ni con la micción y no ha cedido con la analgesia habitual. Exploración física absolutamente normal salvo ligero edema maleolar bilateral (baja probabilidad clínica de TVP). De igual forma, no presenta ninguna alteración en el estudio analítico, salvo unos dímeros-D elevados (287mcg/l, 0-130). Rx tórax y EKG normal. Ante la sintomatología se realiza un eco-doppler venoso de MMII, que no muestra signos ecográficos de TVP, y un eco-doppler abdominal en el que no se visualiza correctamente la vena cava inferior con abundante circulación colateral venosa en los hilios renales. Ante los hallazgos, se lleva a cabo un TAC abdominal (figuras 1): agenesia/hipoplasia de VCI en su segmento infrahepático, abundante circulación venosa colateral, con un gran desarrollo de los sistema ácigos y hemiácigos. La vena cava intra y suprahepática no muestra alteraciones, al igual que los ejes iliacos. Ante la abundancia de circulación colateral no es posible precisar si existe trombosis de parte de la misma. Como hallazgo se objetiva un aneurisma de aorta infrarrenal de 3’3 cms de diámetro. Ante las dudas en el diagnóstico, se solicita cavografía (figura 2), donde se objetiva agenesia/hipoplasia de VCI, sin aportar más precisión en el diagnóstico de TVP. Dados los hallazgos de agenesia de VCI junto a dolor lumbar, edemas de MMII y el dímero D elevado, se decide tratar al paciente como si se tratase de una TVP oculta y se inicia tratamiento anticoagulante, mejorando el paciente de su sintomatología y normalizándose el Dímero D al mes. A los 6 meses es valorado de nuevo y ante la ausencia de sintomatología, desaparición de los edemas y un estudio de coagulación genético normal (no mutación del factor V de Leyden ni de la protrombina, entre otros), se decide la retirada de la anticoagulación para proceder a completar el estudio de coagulación. A los 7 días de suspender la anticoagulación, el paciente acude a Urgencias por dolor brusco y aumento de volumen de MID de 6 horas de evolución. A la exploración se objetiva edema y eritema hasta tercio medio de muslo, confirmándose el diagnóstico de TVP femoropoplítea mediante eco-doppler. Además en radiografía de tórax se observa nódulo de 7 mm en campo medio de pulmón izquierdo, no presente en estudios previos(radiografía y TAC de tórax) (figura 3), realizados en los 6 meses previos. Se inicia tratamiento con heparina de bajo peso molecular (HBPM) y soporte elástico y se deriva para estudio de nódulo pulmonar. El diagnóstico anatomopatológico es de adenocarcinoma de pulmón. Discusión El desarrollo embriológico de la VCI es un complejo proceso que tiene lugar entre la sexta y la octava semanas de la edad gestacional. La VCI se forma como resultado de la aparición y regresión de tres sistemas venosos pares y simétricos: las venas cardinales posteriores, venas supracardinales y subcardinales. Este complejo origen embrionario da lugar a múltiples posibilidades de malformaciones congénitas. La agenesia de la VCI es infrecuente y suele afectar a los segmentos retrohepático y/o suprarrenal. La afectación aislada de la cava infrarrenal es excepcional3. En estos pacientes el drenaje venoso anómalo por las venas toraco-lumbares, pélvicas y abdominales puede ocasionar sintomatología a diferentes niveles, previo a las clásicas manifestaciones de la TVP4. El papel de la agenesia de la VCI como factor de riesgo de TVP es controvertido. Esta anomalía parece favorecer el éstasis venoso y consecuentemente la aparición de la TVP. En la mayoría de los trabajos publicados, los casos de TVP asociados a agenesia de VCI afecta a pacientes jóvenes. En el año 2001 se publicaron dos estudios de agenesia de VCI en pacientes jóvenes con TVP sin otros factores de riesgo. Así, Ruggeri et al mostraron un 5% de agenesia de VCI del total de pacientes menores de 30 años con TVP5. En la serie publicada por Siragusa et al 2 pacientes de un total de 21 (con edad media inferior a 30 años) presentaban agenesia de VCI, lo que supone un 9’5%6. En 2002, se reportó una serie de 97 casos de TVP, de los cuales 5 presentaban agenesia de VCI, con edades compredidas entre 20 y 35 años7. Estos datos sugieren que la agenesia de VCI puede ser un factor de riesgo de enfermedad tromboembólica, a tener en cuenta en el manejo clínico de estos pacientes, fundamentalmente en pacientes jóvenes con TVP idiopática sin otros factores asociados. No obstante, es conocido que la mayoría de los hallazgos de agenesia/hipoplasia de VCI se dan en pacientes que no han presentado episodios de TVP a lo largo de su vida y la consideración de la etiología de la TVP como multifactorial, abogan a la búsqueda de factores asociados, ya sean congénitos o adquiridos. Así, en nuestro caso, tras la clínica inicial y el periodo de 6 meses de anticoagulación, el paciente presenta una TVP femoropoplítea en el contexto de una agenesia de VCI y un hallazgo de un nódulo pulmonar que posteriormente se confirmó que se trataba de un adenocarcinoma. Existe un fuerte nivel de evidencia acerca de la relación del cáncer y la enfermedad tromboembólica, constituyendo éste unos de los principales factores de riesgo de la misma8. En este caso se trata de un adenocarcinoma de pulmón que ,por sus características secretoras, es uno de los tumores que con mayor frecuencia produce síndromes paraneoplásicos, antes de ser detectado en exploraciones radiológicas rutinarias9. Por tanto, es probable que, dado que el paciente portador de una anomalía congénita de la VCI ha estado asintomático hasta los 72 años, sin episodios trombóticos, sea la patología tumoral el principal factor desencadenante de la TVP. En lo referente al tratamiento de la TVP asociada a agenesia de la VCI, no existe evidencia acerca de cuál debe ser el período de anticoagulación. Hay quien sugiere un tratamiento prolongado, incluso de por vida, dado el riego de la recurrencia de la enfermedad tromboembólica venosa, riesgo que no está completamente establecido. Otros, sin embargo, no han encontrado evidencia en continuar la anticoagulación de modo indefinido10. En cuanto al tratamiento fibrinolítico, en casos con trombosis iliofemoral puede ser una alternativa, aunque esta técnica no ha obtenido buenos resultados, según lo publicado por Yun et al en 2004 (fracaso del tratamiento en 2 de 3 casos)11. Por supuesto, se debe asociar el uso de soporte elástico, medidas posturales, ejercicio y evitar en la medida de lo posible todos los factores de riesgo adicionales. Como conclusión, creemos que la aparición de una TVP en un paciente no joven con una agenesia de VCI, obliga a investigar necesariamente otros factores de riesgo como los tumores y enfermedades que produzcan trombofilias adquiridas. Bibliografía 1. Chuang VP, Mena CE, Hoskins PA. Congenital anomalies of the inferior vena cava. Review of the embriogénesis and presentation of a simplified classification. Br J Radiol 1974; 47: 206-13. 2. (Chee YL, Culligan DJ, Watson HG. Inferior vena cava malformation as a risk factor for deep venous thrombosis in the young. Br J Haematol 2001; 114: 87880). 3. Minniti S, Visentini S, Procacci C. CCongenital anomalies of the vena cava: Embriological origin, imaging features and report of three new variants. Eur Radiol 2002;12:2040-55. 4. Trubac R, Hribernik M, Pac L. Congenital interruption of the inferior vena cava with hemiazigos continuation. Scripta Medica (BRNO) 2002; 75(5): 291-302. 5. Ruggeri M, Tosetto A, Castaman G, Rodeghiero F. Congenital absence of the inferior vena cava: a rare risk factor for idiopathic deep-vein thrombosis. Lancet 2001; 357:441. 6. Siragusa S, Anastasio R, Falaschi F, Bonalumi G, Bressan MA. Congenital abscense of the inferior vena cava. Lancet 2001; 26; 357: 1711. 7. Obernosterer A, Aschauer M, Schnedl W, Rainer WL. Anomalies of the inferior vena cava in patients with iliac venous thrombosis. Ann Intern Med 2002; 136: 37-41. 8. Barón JA, Gridley G, Weiderpass E, Nyren O, Linet M. Venous thromboembolism and cáncer. Lancet 1998; 351 (9109): 1077-80. 9. Jurado Gámez B, García de Lucas MªD, Gudín Rodríguez Mª. Cáncer de pulmón y síndromes paraneoplásicos. An Med Interna (Madrid) 2001; 18: 440446. 10. Jiménez R, Miñano A, Bernabeu F, Sansegundo E. Agenesis of the inferior vena cava associated with lower extremities and pelvis venous thrombosis. J Vasc Surg 2006; 44:114-6. 11. Yun SS, Kim JI, Kim KH, Sung GY, Lee DS, Kim JS et al. Deep venous thrombosis caused by congenital absence of inferior vena cava, combined with hyperhomocysteinemia. Ann Vasc Surg 2004; 18: 124-9. Figura 1.- TAC abdominal: Agenesia de VCI infrahepática. Abundante circulación colateral. Permeabilidad de ambas venas iliacas comunes. Figura 2.- Cavografía: Agenesia de VCI. Abundante circulación colateral. No signos de TVP. Figura 3.- Radiografía de toráx: nódulo en campo pulmonar medio izquierdo de 7 mm.