ACCIDENTE VASCULOCEREBRAL ISQUÉMICO EN MUJER JOVEN
Anuncio

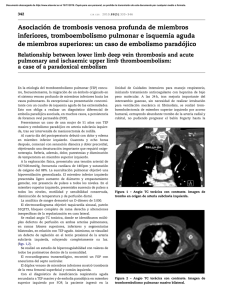
ACCIDENTE VASCULOCEREBRAL ISQUÉMICO EN MUJER JOVEN Autores: M. Sirvent i González, JM Romero Carro, J. Latorre Vilallonga, J. Dilmé Muñoz, S. Llagostera Pujol, JR Escudero Rodríguez Servicio de Angiología, Cirugía Vascular y Endovascular Hospital de la Santa Creu i Sant Pau. ACCIDENTE VASCULOCEREBRAL ISQUÉMICO EN MUJER JOVEN INTRODUCCIÓN: El ictus o el accidente vasculocerebral (AVC) es una patología con una elevada tasa de morbimortalidad al representar la tercera causa de muerte en los países desarrollados, por detrás de las cardiopatías y el cáncer. Por otra parte, es la principal causa de invalidez permanente y de hospitalización prolongada. La mayoría de los AVC son isquémicos. Aproximadamente la mitad de éstos tienen una causa incierta una vez concluido su estudio etiológico y se clasifican como criptogénicos.1 Los ictus isquémicos criptogénicos se caracterizan por detectarse, con gran frecuencia, en pacientes jóvenes sin factores de riesgo cardiovasculares. Lechat et al. Webster et al. y Overell JR et al. analizaron pacientes jóvenes (menores de 55 años) sin factores de riesgo cardiovasculares que padecieron un AVC isquémico de causa indeterminada, hallando una prevalencia de foramen oval permeable (FOP) cercana al 40-50% respecto al 10-15% del grupo control.2-4 De estos resultados se interpreta que la embolia paradójica (EP) juega un papel importante en la etiología de los ictus isquémicos clasificados como criptogénicos. No obstante, el mero hecho de presentar un FOP y establecerse un cortocircuito derechaizquierda no es suficiente para diagnosticar una EP ya que el foramen oval se encuentra permeable hasta en un 27% de la población general.5 De esta forma, el AVC isquémico secundario a embolia paradójica es un diagnóstico por exclusión. CASO CLÍNICO: Mujer de 41 años con alergia a las quinolonas y sin otros antecedentes patológicos de interés que acude a urgencias de nuestro hospital al evidenciar dificultad para la emisión del lenguaje sin otra focalidad neurológica. No refiere cefalea, ni dolor torácico, ni palpitaciones; tampoco fiebre u otros signos de infección. En la exploración física: normocoloración de piel y mucosas con auscultación cardiorespiratoria anodina, al igual que el examen físico abdominal. En las extremidades inferiores (EEII) destaca edema y empastamiento del miembro derecho con pulsos positivos a todos los niveles. Neurológicamente, la paciente se muestra consciente y orientada, muy ansiosa, con pupilas isocóricas y normoreactivas. No presenta déficits sensitivos ni de fuerza. En el examen de los pares craneales no se objetiva alteración alguna. Se constata afasia mixta transcortical (parafasias fonémicas, obedece órdenes simples y semicomplejas, repetición conservada, fluencia disminuida). La paciente, de forma espontánea, presenta progresiva mejora del lenguaje. Como pruebas complementarias se realizan una analítica sanguínea general y un electrocardiograma que resultan normales, así como el estudio de trombofilia. La tomografía computerizada (TC), con y sin contraste, y la resonancia magnética (RM) cerebrales no evidencian hallazgos destacables. También se practica un Döppler transcraneal, un eco-Döppler y una angio-RM de troncos supraórticos (TSA) que no objetivan ninguna anormalidad. El ecocardiograma transesofágico detecta un FOP. El eco-Döppler de la extremidad inferior derecha (EID) objetiva una trombosis venosa profunda (TVP) fémoro-poplítea de características recientes. Ante estos hallazgos se orienta el cuadro clínico como: 1-accidente isquémico transitorio (AIT) criptogénico en territorio de la arteria cerebral media izquierda probablemente secundario a una embolia paradójica; 2-TVP fémoro-poplítea EID. La paciente es tratada con AAS 300 mg/d y simvastatina 20 mg/d de forma indefinida y para la TVP se pauta bemiparina 7500 UI/d durante 10 días con posterior pase a anticoagulantes orales durante 6 meses. DISCUSIÓN: La embolia paradójica (EP) es el paso de material trombótico desde la circulación venosa a la arterial a través de un shunt derecha-izquierda. Según Meister et al. para el diagnóstico de EP se requiere: 1- la presencia de TVP; 2- la presencia de un defecto intracardíaco; 3- un cortocircuito cardíaco con un gradiente de presiones desde las cavidades derechas hacia las izquierdas; 4- evidencia de embolismo arterial.6 La verdadera incidencia de la EP es desconocida pero se estima que en Estados Unidos 70.000 personas al año tienen riesgo de padecer una EP.7 La causa más común de shunt derecha-izquierda es el foramen oval permeable. El foramen oval es una estructura normal del corazón que en la etapa embrionaria se forma por la septación separada de las dos hojas del septum interatrial: el septum primum y el septum secundum; éstos, en la vida intrauterina, permanecen separados para que exista paso de sangre oxigenada desde la aurícula derecha hacia la aurícula izquierda. Al nacer, la presión de la aurícula izquierda aumenta y provoca la unión del septum primum sobre el secundum. Cuando esta unión no es completa y queda una comunicación interauricular hablamos de FOP. El diagnóstico de FOP se realiza por inyección rápida de suero salino agitado en el sistema venoso y detección de microburbujas en la circulación sistémica mediante Döppler transcraneal o ecocardiograma, especialmente el transesofágico (figuras 1, 2 y 3). La prueba es positiva si se contabilizan por lo menos 3 microburbujas dentro de los primeros 15 segundos de la inyección. El grado de cortocircuito se clasifica como pequeño cuando se pueden contabilizar hasta 5 microburbujas en cavidades izquierdas, mediano de 6 a 20 y grande más de 20 microburbujas. Los destinos más habituales de la EP son: 1- la circulación cerebral (37-50%); 2las extremidades inferiores (30%); 3- las extremidades superiores (25%); 4- otros lugares (6-9%).8 Varios estudios encuentran un aumento de prevalencia de FOP en el ictus criptogénico respecto a la población general (40-56% vs 10-18%) y respecto a los AVC con causa conocida (45% vs 23%). Incluso hay grupos que aseguran que hasta un 12% de todos los ictus isquémicos se explican por una EP.9 El mayor problema de un evento cerebrovascular asociado a un FOP es su tasa de recurrencia. Sacco et al. recogen una recidiva que oscila entre el 1.5% al 12%.5 En lo que se refiere al tratamiento del FOP aún existe controversia. La American Heart Association (AHA) recomienda: 1- para prevenir la recurrencia del AVC isquémico o del AIT en pacientes con FOP, el tratamiento más razonable sería la antiagregación (clase IIa, nivel de evidencia B); 2- la warfarina es razonable en pacientes con alto riesgo que tengan otras indicaciones para descoagulación (IIa, C); 3en cuanto al cierre del FOP concluye que no existe suficiente evidencia para recomendarlo, aunque podría estar indicado en pacientes con recidivas a pesar de seguir un tratamiento médico correcto (IIb, C). En resumen, una de las causas destacables de ictus isquémico es la EP, que se asocia de manera casi exclusiva a un FOP. La apoplejía secundaria a EP se trata de una entidad característica de pacientes jóvenes (menores de 55 años) sin factores de riesgo cardiovasculares que se diagnostica mediante una alta sospecha clínica y básicamente por exclusión por lo que a menudo requiere un gran número de pruebas complementarias para descartar todas las otras posibles etiologías. Ante su sospecha es preciso investigar la presencia de TVP, aún sin clínica aparente, porque según Stöllberger et al. ésta se observa en el 57% de los casos.10 En cuanto al tratamiento de la recurrencia del ictus asociado a FOP no existe consenso; parece que la estrategia más aceptada es la antiagregación, reservando el cierre del FOP para aquellos casos en los que existe recidiva a pesar del tratamiento correcto. BIBLIOGRAFÍA: 1- Desai A, Fuller C, Jesurum J et al. Patent foramen ovale and cerebrovascular diseases. Nature Clinical Practice Cardiovascular Medicine 2006; 3 (8): 446-455. 2- Lechat P, Mas JL, Lascault G et al. Prevalence of patent foramen ovale in patients with stroke. N Engl J Med 1988; 318:1148-1152. 3- Webster MWI, Smith HJ, Sharpe DN et al. Patent foramen ovale in young stroke patients. Lancet 1988; 2: 11-12. 4- Overell JR, Bone I, Lees KR. Interatrial septal abnormalities and stroke: a metaanalysis of case-control studies. Neurology 2000; 55: 1172-9. 5- Sacco RL, Adams R, Albers G et al. Guidelines for prevention of stroke in patients with ischemic stroke or transient ischemic attack. Circulation 2006; 10: e409-49. 6- Meister SG, Grossman W, Dexter L et al. Paradoxical embolism. Am J Med 1972; 53: 292-298. 7- D’Audiffret, Pillai L, Dryjski M. Paradoxical emboli: the relationship between patent foramen ovale, deep vein thrombosis and ischaemic stroke. Eur J Vasc Endovasc Surg 1999; 17: 468-471. 8- Ward R, Jones D, Haponik EF. Paradoxical embolism: an underecognised problem. Chest 1995; 108: 549-558. 9- Caplan LR, Hier HB, D’Cruz I. Cerebral embolism in the Michael Reese stroke registry. Stroke 1983; 14: 530-536. 10- Stöllberger C, Slany J, Schuster I et al. The prevalence of deep venous thrombosis in patients with suspected paradoxical embolism. Ann Int Med 1933; 119 (6): 461-465. Figura 1. Ecografía transesofágica: elevación de la membrana de la fosa oval durante una maniobra de Valsalva, signo indicativo de FOP (flecha). Figura 2. Ecografía transesofágica: microburbujas en la aurícula derecha después de la inyección en una vena antebraquial de suero fisiológico agitado (flecha). Figura 3. Ecografía transesofágica: Paso de microburbujas desde la aurícula derecha hacia la aurícula izquierda durante una maniobra de Valsalva (flecha).