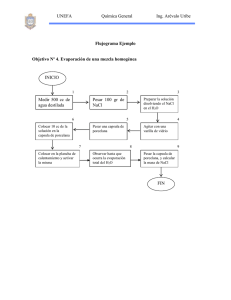
Ajuste de Isotonía de preparados inyectables
Anuncio

Ms.C. Q.F. Alfredo Bernard Claudio Delgado Ajuste de Isotonía de preparados inyectables Es conocido que la presencia de sales en una solución da lugar a una disminución de su punto de congelación. Esto se denomina Descenso Crioscópico y depende de la concentración de solutos disueltos. Actualmente está admitido que el valor del descenso crioscópico del plasma, al igual que el de una solución de NaCl al 0,9% p/v, que es igual a -0,52°C con respecto al agua. La disminución del punto de congelación se expresa como: [1] Donde es la variación del punto de congelación, la constante dependiente del disolvente, que para el agua es de 18,6°C osmol/100g de disolvente; es el coeficiente de disociación; la concentración en gramos de soluto por 100 g de disolvente y el peso molecular de la sustancia disuelta. Esta fórmula se puede simplificar en [2] Donde es la molaridad . Para una solución diluida de NaCl la disociación es total y el coeficiente de disociación i es igual a 2 (dos iones, revisar Osmolaridad). Sin embargo, a concentración isotónica, la disociación no es completa y el valor de i es igual a 1,85. Como unidades de concentración se utilizan el OSmol o Miliosmol. En el caso de la una solución de un no-electrolito (i=1), la osmolaridad coincidirá con la molaridad. Si el soluto es un electrolito (i distinto de la unidad), la osmolaridad equivaldrá a la molaridad multiplicada por el coeficiente de disociación del mismo. 1. Método basado en la determinación de la concentración molecular Una solución acuosa que contenga un osmol/Kg tendrá un descenso crioscópico de 1,86 °C (datos establecidos). En consecuencia la osmolaridad del plasma será (aplicando la Ec. 2) ( ) Da lo mismo expresar 0,028 osmoles/100 mL. En el caso de que la osmolaridad de nuestra preparación sea inferior a ese valor, se deben añadir los osmoles necesarios de un agente ionizante, generalmente cloruro sódico o glucosa para obtener una concentración iso osmótica con la sangre o plasma. a) Caso de sustancias no ionizables La concentración u osmolaridad del plasma debe ser igual a la osmolaridad del inyectable [3] Ms.C. Q.F. Alfredo Bernard Claudio Delgado Ejemplo 1: Calcular la cantidad de glucosa que será necesaria para isotonizar 1 litro de agua. Usando la Ec. 3: Así, considerando que el dato de osmolaridad está dado para 100 ml de agua, tenemos que se requiere 5 g de glucosa para 100 mL de agua. Para un litro de preparación: 50 g glucosa /litro. b) Caso de sustancias ionizables Se introduce el coeficiente de disociación (i) [4] Ejemplo 2: Calcular la cantidad de NaCl que será necesario para isotonizar 1 litro de agua. El coeficiente de disociación de una solución isotónica de NaCl es 1,85. Usando la Ec. 4: Para un volumen de 100 ml se requier 0,882 g de NaCl. En la práctica se considera 0,9 g de NaCl /100 mL. Ejemplo 3: ¿Qué cantidad de NaCl se requiere para isotonizar la fórmula siguiente?: KCl Sol. Lactato Sódico 5% p/v NaCl Agua p.i. 14 mg 5 mL c.s c.s.p. 100 mL Datos: Lactato Sodico P.M.= 112,1; i= 1,7; KCl P.M.= 74,6; i= 1,9; NaCl P.M.= 74,6; i= 1,85 5 mL de solución de lactate sódico al 5% p/v equivalen a 0,25 g en 100 mL. Usamos la Ec. 4, aplicando la propiedad aditiva de la presión osmótica (sumamos el valor de cada componente) y considerando que todos los componentes son ionizables: Despejando X= 0,754 g NaCl/100 mL. Es decir, se requieren 0,754 g de NaCl para isotonizar 100 mL de Formulación. Ms.C. Q.F. Alfredo Bernard Claudio Delgado Resolver: 1. ¿Cuántos gramos de NaCl serán necesarios para isotonizar 500 mL de la solución inyectable siguiente? KCl....................................................14 mg (%p/v) Sol. de lactato Na al 1%....................5 mL (%p/v) Datos: KCl Lactato Na NaCl Pm=74,6 Pm=112,1 Pm=58,5 i=1,9 i=1,7 i=1,9 Concentración del suero sanguíneo=0,028 moles/100 mL 2. ¿Cuántos mg de NaCl habrá que emplear para isotonizar la fórmula siguiente? Pm i Nitrato de pilocarpina.......................................0,25 245 1,8 NaCl...................................................................c.s. 58,5 1,9 Agua purificada c.s.p.......................................30 mL Concentración de las lágrimas=0,028 moles/100 mL 3. Se desea preparar 1500 mL de una sol. inyectable isotónica de uabaina al 0,025% p/v, que contenga además, 80 mg de clorhidrato de procaina por cada mg de glucósido cardiotónico. Calcular la cantidad de NaCl necesaria. Datos: Uabaina Clorhidrato de procaina NaCl Pm 728,8 272,8 58,5 i 1,0 1,5 1,9 Se evaluará ejercicios básicos de ajuste de isotonía en su examen práctico, similares a los propuestos. Referencias. 1. Vila, J: Tecnología Farmacéutica. Vol II. Formas Farmacéuticas. 1ra. Edición. Ed. Síntesis. pp. 170 – 173 2. Ejercicios propuestos por el docente.