Calor y trabajo. Primer principio de la Termodinámica
Anuncio

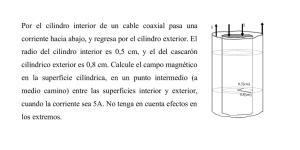
Calor y trabajo. Primer principio de la Termodinámica 1. A temperaturas muy bajas, la capacidad calorífica molar de la sal gema varía con la temperatura de acuerdo con la ley de Debye, cuya expresión es: Cn = KT 3 3 donde K=1940 J/(mol°K) , = 281°K. Teniendo esto en cuenta calcular: a) Cuánto calor es necesario para elevar desde 10°K hasta 50°K la temperatura de 2 moles de sal gema. b) Cuál es la capacidad calorífica molar media en este intervalo de temperaturas. c) Cuál será la capacidad calorífica molar verdadera a 50°K. 2. Un calorímetro de cobre cuya masa es 300 g contiene 500 g de agua a la temperatura de 15°C. Se deja caer un bloque de cobre de 560 g a la temperatura de 100°C, observándose que la temperatura del agua sube hasta 22.5°C. Despreciando las pérdidas de calor calcular el calor específico del cobre. 3. Un cilindro con paredes térmicamente aislantes tiene situado en su interior una pared móvil y rígida, también de material aislante, que puede desplazarse sin rozamiento, a cada lado de esta pared móvil existe inicialmente un volumen de 54 l de un gas perfecto, cuyo calor específico a presión constante es 4 cal/(mol°K), a una presión de 1 atm y a 0°C de temperatura. Si suministramos calor al reservorio de la izquierda mediante una resistencia eléctrica, el gas de este recinto se expande comprimiendo al que se halla en el recinto contiguo, hasta que se alcanza una presión en todo el cilindro de 7.29 atm. Calcular: a) Temperatura final del gas encerrado en el recinto de la derecha. b) Trabajo realizado sobre el gas de la derecha. c) Calor suministrado al gas de la izquierda. 4. Cuando un sistema pasa del estado (a) al estado (b) a lo largo de la trayectoria acb, tal como se indica en la figura 1(a), recibe 80 J de calor y realiza 30 J de trabajo. Hallar : a) Cuánto calor recibe el sistema a lo largo de la trayectoria adb, sabiendo que el trabajo intercambiado por éste es 10 J. b) Cuánto calor intercambia el sistema cuando realiza el proceso ba siguiendo la trayectoria curvilínea, sabiendo que el trabajo intercambiado es 20 J. c) Cuál es el calor intercambiado por el sistema en los procesos ad y db, si la energía interna en los estados (a) y (d) es 0 y 40 J, respectivamente. 5. Calcúlese el trabajo realizado cuando un gas se dilata desde el volumen V1 hasta el volumen V2, si la relación que existe entre presión y volumen es la siguiente : (P + a/ V2 )(V - b)=K donde a, b y K son constantes. Fig. 1. Problemas números 4 y 7. 6. Un gas perfecto experimenta una expansión adiabática durante la cual su temperatura desciende de T1 a T2. Demostrar que el trabajo realizado por este gas viene dado por: W = nCv(T1-T2) donde n es el número de moles y Cv es la capacidad calorífica molar a volumen constante. 7. La figura 1(b) muestra en un diagrama de Clapeyron el ciclo termodinámico que experimenta un sistema en un motor térmico. Si este sistema está constituido por 0.1 mol de gas ideal, siendo el valor del índice de adiabaticidad de este gas 5/3. Hallar: a) La presión y el volumen en los estados 1,2 y 3, sabiendo que P1=1 atm. b) El trabajo que realiza el sistema durante este ciclo. Fig. 2. Problemas números 8, 9 y 10. 8. Un mol de gas diatómico para el cual Cv = 5R/2, puede evolucionar del estado A al estado B siguiendo las trayectorias ACB y ADB, tal como se indica en la figura 2(a), donde P2 = 2P1 y V2 = 2V1. Hallar el calor suministrado al gas en cada uno de los trayectos antes mencionados, expresando el resultado en función de R y T1. 9. Calcular el trabajo realizado en cada uno de los procesos indicados en la figura 2(b), sabiendo que el sistema activo es un gas perfecto. Hallar también la energía interna en los estados A, B y C en función de la energía interna en el estado D, y de los valores de las variables P y V en estos estados. 10. Sabiendo que el índice de adiabaticidad de cierto gas es 5/3, calcular el trabajo y el calor intercambiado por este sistema, cuando el mismo es asiento de los procesos representados en la figura 2(c). 11. La temperatura de un lingote de metal de 0.05 kg se eleva hasta 200 ºC. El lingote se introduce en un recipiente aislado y de masa despreciable que contiene 0.4 kg de agua, que inicialmente está a 20 ºC. Sabiendo que la temperatura final del sistema es 22.4 ºC. Calcúlese el calor específico del metal. 12. Un sistema cerrado sufre un proceso politrópico cuasiestático que le lleva del estado 1 al estado 2. El sistema es un gas que puede considerarse ideal y se halla inicialmente a 3 100 kPa y 300º K. El volumen de este sistema se reduce de 2 a 1 m , siendo el índice politrópico para este proceso igual 1.3. Se supone que el valor de cV es constante para este gas, siendo este valor 0.718 kJ/(kgºK)(R = 0.287 kJ/(kgºK)). En esta situación hállese: (a) La presión y la temperatura en el estado 2. (b) El trabajo realizado por el sistema. (c) El calor agregado al sistema. 13. Un pistón comprime el gas en un cilindro durante un proceso cuasiestático, en el que la 1.4 = constante. La presión inicial en el presión varía de acuerdo con la relación pV cilindro es de 101325 N/m2 y el volumen inicial del cilindro es de 0.01 m3. Calcule el trabajo realizado al comprimir el gas a un volumen final de 0.005 m3. 14. Un gas supuesto ideal se somete a dos procesos 5 3 5 en los que Pf = 10 Pa, Vf = 2 m , Pi = 0.2 x 10 3 Pa y Vi = 10 m ; son las presiones y volúmenes de los estados inicial y final. El primer proceso es a temperatura constante y el segundo esta formado por dos procesos uno a presión constante y otro a volumen constante, tal como se ilustra en la figura 3. Hállese cuál es la relación entre los trabajos realizados en estos dos procesos, que nos llevan del mismo estado inicial al mismo estado final, ambos mostrados en la figura 3. Fig. 3. Problema número 14. 15. Un sistema cerrado sufre un proceso cuasiestático a temperatura constante, que lo lleva del estado 1 al 2. El sistema es un gas ideal que se halla inicialmente a 200 kPa y 300 3 3 ºK. El volumen del sistema se duplica pasando de 2 m a 4 m , durante este proceso. Con estos datos calcúlese el trabajo realizado y el calor agregado durante dicho proceso. 16. Un mol de gas ideal que se encuentra inicialmente a una presión de 5 atm y una temperatura de 373 °K, es sometido al ciclo de procesos indicado en la figura 4 (el proceso 31 es adiabático). Sabiendo que el índice de adiabaticidad es 1.4 y que el volumen V2 = 2V1, hallar: a) Presión y temperatura en el estado 3. b) Trabajo realizado en cada proceso del ciclo. Fig. 4. Problema número 16. 17. Un cilindro de un motor diesel realiza la compresión de un gas supuesto ideal, en un 3 proceso adiabático mediante el cual dicho gas pasa de un volumen inicial de 800 cm a 3 un volumen final de 60 cm . Si la temperatura inicial del gas es de 20 ºC y su presión es de 1 atm, hállese la temperatura y presión finales. Considérese el valor 1.4 como el índice de adiabaticidad. 3 18. Un gas supuesto ideal se expande desde el volumen inicial de 1 m al volumen final de 3 2 m . Si el proceso se realiza a presión constante, hállese la variación de la energía interna, sabiendo que la presión inicial era de 101.3 kPa y el calor intercambiado 200 kJ. 19. Un gas supuesto ideal se calienta dentro de un cilindro desde la temperatura inicial de 300 ºK, hasta la temperatura final de 500 ºK. Si el proceso se realiza a volumen constante, hállese la variación de la energía interna y el calor intercambiado, sabiendo que el cilindro contiene 3 moles de gas. Es conocido para este gas que cV = 3R/2, siendo R = 8.31 J/molºK. 20. Dos paredes de distinto grosor están colocadas en contacto térmico, tal como se indica en la figura 5. Las temperaturas de sus superficies exteriores y sus grosores son conocidos. En situación de estado estacionario determínese: (a) La temperatura T entre dichas paredes. (b) La potencia calorífica transferida a través de las mismas. 21. Una muestra de 1 mol de gas ideal es mantenida a 0 ºC, durante una expansión desde un volumen de 3 a 10 litros. Hállese el trabajo realizado y el calor agregado durante dicho proceso. Si dicho gas es devuelto a su volumen original mediante un proceso a presión constante. Hállese cuánto trabajo hay que realizar sobre este gas. Fig. 5. Problema número 20.