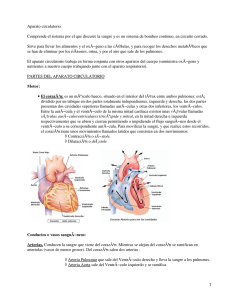
moleculas de inmunoglobulina hibridas recombinantes y su
Anuncio

k OFICINA ESPAÑOLA DE PATENTES Y MARCAS 19 k ES 2 054 688 kInt. Cl. : C12N 15/66 11 N.◦ de publicación: 5 51 ESPAÑA A61K 39/395 //C12N 9/72 C07K 15/00 G01N 33/66 k TRADUCCION DE PATENTE EUROPEA 12 kNúmero de solicitud europea: 87310006.9 kFecha de presentación : 12.11.87 kNúmero de publicación de la solicitud: 0 271 227 kFecha de publicación de la solicitud: 15.06.88 T3 86 86 87 87 k 54 Tı́tulo: Moléculas hı́bridas recombinantes de inmunoglobulina y su uso. k 73 Titular/es: The General Hospital Corporation k 72 Inventor/es: Haber, Edgar y k 74 Agente: Gómez-Acebo Pombo, J. Miguel 30 Prioridad: 12.11.86 US 929581 55 Fruit Street Boston, MA 02114, US 45 Fecha de la publicación de la mención BOPI: 16.08.94 45 Fecha de la publicación del folleto de patente: 16.08.94 Aviso: k k Quertermous, Thomas k En el plazo de nueve meses a contar desde la fecha de publicación en el Boletı́n europeo de patentes, de la mención de concesión de la patente europea, cualquier persona podrá oponerse ante la Oficina Europea de Patentes a la patente concedida. La oposición deberá formularse por escrito y estar motivada; sólo se considerará como formulada una vez que se haya realizado el pago de la tasa de oposición (art◦ 99.1 del Convenio sobre concesión de Patentes Europeas). Venta de fascı́culos: Oficina Española de Patentes y Marcas. C/Panamá, 1 – 28036 Madrid 1 2 054 688 DESCRIPCION Esta invención se relaciona con una molécula hı́brida recombinante de inmunoglobulina que tiene un punto de ligación de antı́geno especı́fico para fibrina enlazada a una segunda proteı́na que comprende la porción activa de un activador de plasminógeno. Esta invención se relaciona también con la clonación y producción de estas nuevas moléculas hı́bridas de inmunoglobulina. La invención se relaciona además con un método de uso de estas moléculas hı́bridas de inmunoglobulina en procesos de inmunodiagnóstico e inmunoterapéuticos. La mayor parte de los infartos de miocardio son causados por trombosis coronaria (DeWood et al., N. Eng. J. Med., 303:897 (1983). La trombosis coronaria causante del infarto de miocardio puede ser lisada por agente trombolı́ticos. Estos agentes trombolı́ticos son activadores de plasminógeno que activan la conversión de plasminógeno al enzima fibrinolı́tico plasmina. La plasmina lisará entonces la fibrina presente en el trombo. Este tratamiento con activadores de plasminógeno no está libre de efectos secundarios. La plasmina actúa de forma no selectiva y, por tanto, no solo lisa la fibrina del trombo, sino que también ataca al fibrinógeno y factores de coagulación, traduciéndose ello frecuentemente en una severa diátesis de sangrı́a. Las moléculas estreptoquinasa, uroquinasa, prouroquinasa y activador de plasminógeno de tipo tisular (tPA) son activadores de plasminógeno conocidos para lisis de trombos. Estos activadores están indicados en el tratamiento de enfermedades cardiovasculares agudas tales como infarto, apoplejı́a, embolismo pulmonar, trombosis venosa profunda, oclusión arterial periférica y otras trombosis venosas. Sin embargo, tanto la estreptoquinasa como la uroquinasa tienen severas limitaciones. Debido a la baja afinidad por fibrina, ambos activadores activarán la circulación y el plasminógeno ligado a fibrina de forma indiscriminada. La plasmina formada en la sangre en circulación es neutralizada antes de que pueda usarse en la trombolisis. La plasmina residual degradará varias proteı́nas de factores de coagulación, por ejemplo, fibrinógeno, Factor V y Factor VIII, causando un potencial hemorrágico. Por otro lado, la estreptoquinasa es fuertemente antigénica y los pacientes con altos tı́tulos de anticuerpos responden de manera ineficaz al tratamiento y no pueden permanecer en tratamiento continuo. El activador de plasminógeno de tipo tisular humano puede ligarse a fibrina y, por tanto, favorece la activación de plasminógeno en estrecha proximidad al trombo, conservando potencialmente fibrinógeno en otra parte de la circulación. Sin embargo, a las dosis requeridas para la lisis rápida de trombos coronarios, el uso de activador de plasminógeno de tipo tisular puede traducirse también en hemorragias. Con el fin de aumentar la especificidad de los agentes tromboliticos con respecto al trombo, se ha comprobado que el enlace covalente de uroquinasa a un anticuerpo especı́fico a fibrina se traduce en un notable incremento de la potencia 2 5 10 15 20 25 30 35 40 45 50 55 60 65 2 y especı́ficidad fibrinoliticas Bode et al., Science, 229:765 - 767 (1985). Una función caracterı́stica de cada molécula de anticuerpo es la ligación especı́fica a un determinante antigénico. Los anticuerpos in vivo son bivalentes y monoespecificos, conteniendo dos puntos de ligación de antı́geno idénticos. La ligación especı́fica de antı́geno por una molécula de anticuerpo se determina por la estructura del anticuerpo de las regiones variables (Fab ) de ambas cadenas pesada y ligera. Se han preparado anticuerpos que tienen dobles especificidades sometiendo anticuerpos de distintas especificidades a una rotura selectiva de los puentes disulfuro que enlazan las dos cadenas pesadas entre sı́. Las semi - moléculas de anticuerpo son reasociadas entonces bajo pH neutro para producir los anticuerpos hı́bridos que tienen dobles especificidades. Véase Nisonhoff et al., Nature (London), 194:355 (1962); Brennan et al., Science, 229:31 (1985); Liu et al., Proc. Nat’l. Acad. Sci. USA, 82:8648 (1985); y la solicitud de patente USA copendiente, n◦ de serie 851. 554, presentada el 14 de Abril de 1986 (correspondiente a la publicación EP - A - 0241907). Se han producido también anticuerpos biespecı́ficos a partir de hibridomas. La preparación de anticuerpos monoclonales biespecı́ficos mediante fusión de células hibridomas productoras de anticuerpos se describe en Milstein y Cuello, Nature (London), 305:537 (1983) y en la solicitud PCT, WO83 103679. Los anticuerpos han sido también clonados y producidos mediante técnicas del ADN recombinante. Genes para las cadenas pesadas y ligeras han sido introducidos en huéspedes adecuados y expresados, seguido por reagregación de estas cadenas individuales a moléculas de anticuerpos funcionales (véase, por ejemplo, Munro, Nature, 312:597 (1984); Morrison, S.L. Science 229:1202 (1985); Oi et al., BioTechniques 4:214 (1986)); Wood et al, Nature, 314U:446 - 449 (1985)). Regiones variables de cadena ligera y cadena pesada han sido clonadas y expresadas en huéspedes foráneos, manteniendo su capacidad de ligación (Moore et al., publicación de patente europea 0088994 (publicada el 21 de Septiembre de 1983)). También se han preparado anticuerpos quiméricos o hı́bridos mediante técnicas del ADN recombinante. Oi y Morrison, BioTechniques, 4:214 (1986) describen una estrategia para la producción de anticuerpos quiméricos. En las páginas 218 - 220 se describe un anticuerpo quiméricos anti - Leu3 de IgG humana. Los autores establecen que se ha preparado un anticuerpo quimérico anti - dansilo de ratón:humano. Este artı́culo indica, sin expresarlo concretamente, que la especificidad de ligación de Leu3 y la especificidad de ligación anti - dansilo han sido clonadas conjuntamente en una sola molécula de inmunoglobulina. Morrison, Science, 229:1202 (1985), en la Tabla 1, establece que las regiones de cadena ligera variable o de cadena pesada variable pueden unirse a una secuencia no - Ig para crear proteı́nas de fusión. Este artı́culo establece que los usos potenciales para las proteı́nas de fusión son tres: (1) para unir especificidad de anticuer- 3 2 054 688 pos a enzimas para utilizarse en análisis; (2) para aislar proteı́nas no - Ig mediante columnas de antı́genos; y (3) para suministrar especificamente agente tóxicos. En esta referencia no existe des - crip - ción alguna en cuanto a moléculas de inmunoglobulina quiméricas especı́ficas. Neuberger et al, Nature, 314:268 (1985) describen un anticuerpo quimérico cuya cadena pesada es una región constante humana fusionada a una región variable de ratón que es especı́fica para el hapteno, 4 - hidroxi - 3 - nitrofenil - acetilo. La solicitud de patente europea 120.694 describe la construcción genética de las regiones variable y constante de una molécula de inmunoglobulina que se expresa en células huésped de E. coli. En la página 10 de dicha solicitud, se indica que la molécula de inmunoglobulina puede ser sintetizada por una célula huésped con otra mitad péptido unida a uno de los dominios constante. Esta mitad péptido se describe como citotóxica o como enzimática. Igualmente, en la página 10 de dicha solicitud se establece que la molécula de inmunoglobulina puede comprender también un agente terapéutico. La memoria descriptiva de dicha solicitud y los ejemplos de la misma ofrecen el uso de una cadena de tipo lamda derivada de un anticuerpo monoclonal que se liga a haptenos de 4 - hidroxi - 3 - nitrofenilacetal (NP). La solicitud de patente europea 125.023 se relaciona con el uso de técnicas de ADN recombinante para producir moléculas de inmunoglobulina que son quiméricas o que están modificadas de otro modo. Uno de los usos descritos en las páginas 3 - 4 para estas moléculas de inmunoglobulina reside en la diagnosis y tratamiento de todo el cuerpo mediante la inyección, en un paciente, de los anticuerpos dirigidos a tejidos enfermos especı́ficos. La presencia de la enfermedad puede ser determinada uniendo un marcador adecuado a los anticuerpos, o bien el tejido enfermo puede ser atacado mediante el transporte de un fármaco adecuado con anticuerpos. La solicitud describe anticuerpos construidos para facilitar el suministro especifico de un agente como “anticuerpos alterados”. La solicitud PCT WO83/03971 se relaciona con una proteı́na hı́brida que comprende anticuerpos - toxinas enzimáticamente activas. La solicitud PCT WO83101533 describe, en la página 5, anticuerpos quiméricos con la región variable de una molécula de inmunoglobulina enlazada a una porción de una segunda proteı́na que puede comprender la porción activa de un enzima. Boulianne et al., Nature, 312:643 (1984) construyeron un gen de inmunoglobulina en donde los segmentos de ADN que codifican regiones variables de ratón especı́ficas para el hapteno trinitrofenilo están unidos a segmentos que codifican regiones constantes mu y kappa humanas. Estos genes quiméricos fueron expresados como IgM quimérica de ligación a TNP funcional. Morrison et al., Proc. Nat’l Acad. Sci. USA, 81:6851 (1984) crearon una molécula quimérica utilizando los exones de la región variable de cadena pesada de un gen de proteı́na de mieloma anti - fosforilcolina, los cuales fueron unidos a los exones de cualquier gen de cadena ligera kappa humano. Los genes fueron transfectados 5 10 15 20 25 30 35 40 45 50 55 60 65 4 en lı́neas de células de mieloma de ratón, generando células transformadas que produjeron IgG quimérica de ratón - humana con función de ligación de antı́genos. Sharon et al., Nature, 309:604 (1984) fusionaron un gen codificador de una región variable de cadena pesada de ratón especı́fica para azofenilarsonato con el gen de la región constante de cadena ligera kappa de ratón. Esta construcción se tradujo en una cadena polipéptido que dimerizó con la correspondiente cadena polipéptido VL - Kappa cuando se introdujo en la lı́nea celular de mieloma adecuada. La molécula VHkappa VL Ckappa se ligó al hapteno azofenilarsonato. Neuberger et al., Nature, 312:604 (1984) unieron el gen de la región variable de cadena pesada de un anticuerpo especı́fico a un hapteno a un gen que especifica la sı́ntesis de nucleasa micrococal, y obtuvieron una molécula hı́brida que tenı́a tanto actividad de, ligación de antigenos como actividad enzimática. Serı́a conveniente poder disponer de un activador de plasminógeno selectivo que se caracterice por una alta afinidad y especificidad por fibrina en relación a fibrinógeno y que efectuara la activación de plasminógeno únicamente en el medio ambiente inmediato de un trombo que contiene fibrina. Esta invención se relaciona con una molécula hı́brida recombinante de inmunoglobulina que tiene un punto de ligación de antı́geno especı́fico por fibrina enlazada a una segunda proteı́na que comprende la porción activa de un activador de plasminógeno. La invención está dirigida también a la clonación y producción de estas nuevas moléculas hı́bridas de inmunoglobulina. La invención se refiere además a un método de uso de estas moléculas hı́bridas recombinantes de inmunoglobulı́na en procesos de inmunodiagnóstico e inmunoterapéuticos. La invención comprende también secuencias genéticas codificadoras de las moléculas hı́bridas de inmunoglobulina, vectores de clonación g expresión que contienen dichas secuencias genéticas, huéspedes transformados con dichos vectores y métodos de producción de dichas moléculas hı́bridas mediante expresión de las secuencias genéticas subyacentes en dichos huéspedes. El resto de la des - crip - ción se refiere a modalidades preferidas de la invención, con referencia a los dibujos adjuntos, en donde: La figura 1 muestra la estructura del plasmido de expresión pSVD8t que codifica la proteı́na de fusión de t - PA de cadena pesada. Las secuencias codificadoras están indicadas por rótulos fuera del cı́rculo; los puntos de restricción usados en la construcción están indicados dentro del cı́rculo. Abreviaturas: VDJ, transposición productiva de cadena pesada de 59D8; 2b - CH secuencia genómica de la región constante de cadena pesada 2b murı́nica; t - PA - , secuencia de CADN codificadora de la cadena de t - PA humano; 3’ - UT, secuencia 3’ - no traducida del CADN de t - PA humano; Ampr , gen de resistencia a ampicilina pBR322; gpt, gen de guuanina fosforribosil transferasa de E. coli impulsado por el promotor SV40; R1, Eco R1. 3 5 2 054 688 La figura 2 muestra el ensayo con substrato cromogénico que compara la actividad catalı́tica de la proteı́na recombinante con la del t - PA de melanoma. Figura 2A: Como se muestra por las lı́neas discontinuas, el ensayo S - 2288 se llevó a cabo con 105 ng (cı́rculos blancos) o 70 ng (cuadrados blancos) de proteı́na recombinante. Las lı́neas sólidas representan la actividad catalı́tica de 50 ng (cı́rculos negros), 40 ng (cuadrados negros) o 30 ng (triángulos negros) de t - PA de melanoma, usados como referencias. La actividad molar relativa de la proteı́na recombinante se determinó por comparación con referencias de t - PA con proporciones de catálisis similares. Figura 2B: El ensayo S - 2251 se llevó a cabo con actividades variables de la referencia de t - PA de melanoma (cı́rculos blancos), proteı́na recombinante (cı́rculos negros) y tripsina bovina (triángulos blancos). Las unidades de actividad de cada proteı́na se determinaron en el ensayo S - 2288. La figura 3 ofrece una comparación del comportamiento de ligación de anticuerpo anti - fibrina 59D8 y proteı́na recombinante. Las curvas representan la inhibición de ligación de anticuerpo a monómero de fibrina en fase sólida mediante competición con diversas concentraciones de monómero de fibrina soluble. El anticuerpo recombinante (lı́neas discontinuas) requiere una concentración de fibrina soluble, para una inhibición del 50%, ligeramente mayor que la del anticuerpo (lı́neas continuas) y de este modo liga fibrina con algo menos de avidez. Esta diferencia es inferior a 10 veces. Esta invención está dirigida a una molécula hı́brida de inmunoglobulina que tiene tanto actividad de ligación de antigeno como actividad enzimática. Más concretamente, esta invención está dirigida a una molécula hı́brida recombinante de inmunoglobulina que tiene un punto de ligación de antigeno especı́fico por fibrina enlazada a una segunda proteı́na que comprende la porción activa de activador de plasminógeno. Esta invención está dirigida también a la clonación y producción de estas nuevas moléculas hı́bridas de inmunoglobulina. En toda esta des - crip - ción, se emplea el término “molécula hı́brida de inmunoglobulina” para designar una sola molécula producida por técnicas de ADN recombinante y que comprende la totalidad o una porción de un anticuerpo especı́fico por fibrina y la totalidad o una porción de un activador de plasminógeno. Los términos anticuerpo heterobifuncional, heteroanticuerpo, anticuerpo biespecı́fico, anticuerpo de heteroligación, duplex de anticuerpo y heterodı́mero, se refieren todos ellos más especı́ficamente a un anticuerpo de doble especificidad, es decir, dos puntos de combinación de anticuerpos en una molécula. El término “especificidad por fibrina” tal y como aquı́ se emplea se refiere a anticuerpos dirigidos contra fibrina. Cuando la sangre escapa de la vasculatura, una cascada intrincada de reacciones enzimáticas convierte fibrinógeno a fibrina, la proteı́na estructural de la sangre coagulada. El fibrinógeno mismo es el menos soluble de las proteı́nas del plasma. Con un peso molecular de 340. 000 kd, posee una simetrı́a 4 5 10 15 20 25 30 35 40 45 50 55 60 65 6 de dos veces que surge de tres pares de cadenas polipéptidas no idénticas denominadas A alfa, B - beta y gamma. En el punto de trombosis, la cascada de coagulación se activa para generar trombina, la cual rompe enzimáticamente péptidos polares (Fibrinopéptido A a partir A alfa y Fibrinopéptido B a partir B - beta), y se traduce en la formación de monómero de fibrina. Los monómeros de fibrina, que son mucho menos solubles, se polimerizan espontáneamente a una red gelificada. Después de la polimerización, el coágulo de fibrina es estabilizado por Factor XIIIa, el cual introduce enlaces covalentes de e (g - glutamil) lisina en la cadena. El fibrinógeno y la fibrina son idénticos en más del 98% de su estructura y únicamente se diferencian en dos terminales amino recientemente expuestos, los de las cadenas alfa y beta de fibrina. Ya se conoce la secuencia de aminoácidos de estos terminales amino de fibrina. Doolittle, R.F., “Fibrinogen and Fibrin”, en Putnam, F.W., ed. The Plasma Proteins: Structure Function, and Genetic Control, 3d ed., Vol. 2, New Tork: Academic Press, 1975; 109 - 156. Los epitopos de fibrina que pueden ser usados en esta invención incluyen el terminal amino de la cadena beta de fibrina, el terminal amino de la cadena alfa de fibrina, las secuencias de aminoácidos de beta (43 - 49), que son carboxi - terminales respecto a un punto de disociación de plasmina, y el punto de reticulación de la cadena gamma. Anticuerpos con especificidad a fibrina han sido descritos en Hui et al., Science, 222: 1129 (1983). Otra des - crip - ción del mismo tipo de anticuerpos puede encontrarse en la solicitud de patente USA copendiente n◦ 2 de serie 824.228, presentada el 30 de Enero de 1986 (USA - 4927916) para “Fibrin - Specific Monoclonal Antibodies Lacking Fibrinogen Cross - Reactivity”. Anticuerpos monoclonales especı́ficos por fibrina con prácticamente ninguna reactividad cruzada con fibrinógeno, han sido descritos también en la solicitud de patente USA copendiente n◦ de serie 851.514, presentada el 14 de Abril de 1986. Otros ejemplos de anticuerpos con especificidad contra fibrina incluyen Kudryk et al., Mol. Imm., 21:89 (1984); solicitud de patente europea 146.050 de Callewaert, publicada el 26 de Junio de 1985, para “Site Selective Plasminogen Activator and Method of Making and Using Same” y solicitud de patente australiana AU - A - 25387/84 de Bundesen et al., para “Monoclonal Antibodies with Specificity for Crosslinked Fibrin and Their Diagnostic Uses”. En la preparación de las moléculas hı́bridas de inmunoglobulina de esta invención, la totalidad del anticuerpo especı́fico por fibrina puede ser clonado y comprende una porción de la molécula hı́brida. Sin embargo, con el fin de reducir el tamaño de la molécula hı́brida de inmunoglobulina, ası́ como para reducir la antigenicidad, es preferible usar solo aquella región del anticuerpo que reconocerá fibrina y se ligará a la misma. La clonación de esta región del anticuerpo especı́fico por fibrina requiere el conocimiento de la estructura y función de los anticuerpos. De forma breve, los anticuerpos son inmunoglobulinas tetraméricas consistentes en dos cadenas li- 7 2 054 688 geras (L) idénticas y dos cadenas pesadas (H) idénticas. Cada cadena de proteı́na consiste en dos regiones principales: la región variable (V) N - terminal y la región constante (C) C - terminal. Las cadenas ligera (VL ) y pesada (VH ) variables forman el dominio de región variable. El dominio variable determina el reconocimiento y especificidad a un antı́geno particular. Los dominios de región constante de las cadenas ligera (CL ) y pesada (CH ) mediatizan la función efectora responsable de ejecutar la inmunorrespuesta. La región de bisagra (J) de la molécula de anticuerpo conecta el fragmento Fab con el fragmento Fc del anticuerpo. Dentro de la región variable pueden existir regiones hipervariables conocidas como dominios de diversidad (D). Estos dominios de diversidad están relacionados con exones observados en los genes codificadores de las regiones variables. El dominio variable de un anticuerpo, una definición estructural de proteı́na, consiste en ambos segmentos VL y VH de las cadenas ligera y pesada. Contiene 6 regiones hipervariables, 3 en la cadena ligera y 3 en la cadena pesada. A nivel genético, 3 exones son responsables de especificar VH, incluyendo su estructura y regiones hipervariables; 2 exones especifican VL. Las dos primera regiones hipervariables de VL y de VH son especificadas por los exones del gen V de las cadenas ligera y pesada respectivamente. La tercera región hipervariable de la cadena ligera es especificada por dos exones, VL y JL. La tercera región hipervariable de la cadena pesada es especificada por tres exones VH, D y JH. La expresión del gen de inmunoglobulina ocurre a través de la unión del gen V con el gen C mediante recombinación somática en los linfocitos B. Estos genes se unen para formar la inmunoglobulina completa. Los segmentos genéticos unidos, transpuestos, codifican entonces la inmunoglobulina completa o dominios de ligación de antı́geno de las cadenas variables ligera y pesada. Existen 5 clases principales de cadenas pesadas, caracterizadas por propiedades quı́micas e isotı́picas. Estas clases de cadenas pesadas son referidas como mu, gamma, delta, alfa y epsilon. Existen también dos clases principales de cadenas ligeras: kappa y lambda. En esta invención, un anticuerpo especı́fico por fibrina es clonado como parte de la molécula hı́brida de inmunoglobulina. Preferentemente, únicamente se clona la región variable del anticuerpo de fibrina. La cadena ligera variable o la cadena pesada variable, o bien ambas, comprenden parte de la molécula hı́brida. Además, la región de bisagra del anticuerpo especı́fico por fibrina puede ser clonada. El dominio constante de la porción Fab del anticuerpo especifico por fibrina unida a la región variable, puede ser también clonada. Las regiones variable y constante del anticuerpo especı́fico por fibrina clonadas y utilizadas en la molécula hı́brida de inmunoglobulina pueden ser de origen mamı́fero, prefiriéndose aquellas derivadas de humanos. Alternativamente, la región variable puede ser de origen mamı́fero, siendo la región constante de origen humano. Los activadores de plasminógeno que pueden 5 10 15 20 25 30 35 40 45 50 55 60 65 8 ser usados en esta invención incluyen uroquinasa, prouroquinasa, activador de plasminógeno de tipo tisular y estreptoquinasa. Cuando el plasminógeno se convierte, mediante un activador, en plasmina, el enzima fibrinolı́tico activo del plasma, desarrolla una notable afinidad por su substrato, fibrina. El término “activador de plasminógeno” es por tanto un agente trombolı́tico y debe apreciarse que en esta des - crip - ción se incluye cualquier agente utilizado. Se conocen otros términos en la técnica para la lisis de un trombo, incluyendo fibrinolisis. Aunque los activadores de plasminógeno más comunes son estreptoquinasa, uroquinasa, prouroquinasa y activador de plasminógeno de tipo tisular, en esta invención se puede emplear cualquier otro activador de plasminógeno o agente trombolı́tico. En la preparación de las moléculas hı́bridas de inmunoglobulina de esta invención, todo el activador de plasminógeno puede ser clonado y expresado como parte de la molécula hı́brida. Preferentemente, solo se clona la porción activa del activador de plasminógeno. Este punto activo o punto catalı́tico puede ser determinado mediante una experimentación de rutina, como se describe en.los ejemplos. El proceso para la obtención de una molécula hı́brida de inmunoglobulina según la presente invención requiere la clonación del anticuerpo especı́fico a fibrina y del activador de plasminógeno y la expresión de sus secuencias de ADN a una sola molécula hı́brida. Las secuencias de ADN del anticuerpo especı́fico a fibrina y del activador de plasminógeno empleados para la preparación de la molécula hı́brida de inmunoglobulina, puede derivarse de diversas fuentes. Estas fuentes incluyen ADN genómico, cADN, ADN sintético y combinaciones de los mismos. El ADN genómico puede o no incluir intrones de origen natural. El ADN obtenido a partir de ADN genómico o cADN puede obtenerse de varias formas. Pueden aislarse células codificadoras de la secuencia deseada, el ADN genómico Se fragmenta, convenientemente mediante una o más endonucleasas de restricción, y los fragmentos resultantes son clonados y evaluados con una sonda respecto a la presencia de la secuencia de ADN codificadora de especificidad a fibrina o con respecto al activador de plasminógeno. Para la región variable del anticuerpo especı́fico a fibrina, el ADN codificador de la cadena pesada transpuesta puede incluir regiones V, D y J. El ADN codificador de la cadena ligera de la lı́nea germinal transpuesta puede incluir las regiones V y J. Una vez que el fragmento clonado ha sido identificado como conteniendo el punto de ligación deseado de la secuencia de ADN especifica a fibrina, este fragmento puede ser manipulado adicionalmente para separar el ADN superfluo, para modificar uno o ambos terminales y para separar la totalidad o una porción de secuencias intervinientes (intrones) o similares. La unión de los diversos fragmentos se efectúa según técnicas convencionales, empleando terminales de extremos romos o de extremos escalonados para la ligación, digestión con enzimas de 5 9 2 054 688 restricción para proporcionar terminales adecuados, relleno de extremo cohesivos en la forma adecuada, tratamiento con fosfatasa alcalina para evitar una unión indeseable y ligación con las ligasas adecuadas. Para cADN, el cADN puede ser clonado y el clon resultante es evaluado con una sonda adecuada respecto al cADN que codifica la región variable o constante deseada. Una vez aislado el clon deseado, el cADN puede ser manipulado prácticamente del mismo modo que el ADN genómico. Sin embargo, con cADN no existirán intrones o secuencias intervinientes. Por otro lado, los genes del anticuerpo especı́fico a fibrina y los genes del activador de plasminógeno pueden ser sintetizados de acuerdo con medios bien conocidos y clonados para utilizarse en la preparación de la molécula hı́brida de inmunoglobulina. Para expresar la molécula hı́brida de inmunoglobulina, son necesarias señales de transcripción y traducción reconocidas por un huésped adecuado. Los huéspedes eucarióticos serán células de mamı́feros capaces de cultivarse in vitro, particularmente leucocitos, más especialmente células de mieloma, u otros linfocitos transformados u oncogénicos, por ejemplo, células transformadas EBV. Alternativamente, se pueden emplear células que no son de mamı́feros, tales como bacterias, hongos, por ejemplo, levadura, hongos filamentosos y similares. La secuencia de ADN que codifica la región variable especı́fica a fibrina puede obtenerse en asociación con la región promotora del ADN genómico. En la medida que las células huésped reconocen las señales reguladoras de transcripción e iniciadoras de la traducción asociadas con la región variable, la región 5’ de la secuencia codificadora de la región variable puede entonces retenerse y emplearse para regular el inicio de la transcripción y de la traducción. La región 5’ no codificadora contigua a la región variable incluirá normalmente aquellas secuencias implicadas con la iniciación de la transcripción y de la traducción, tal como la caja TATA, la secuencia terminadora, la secuencia CAAT y similares. Normalmente, la secuencia 5’ - no codificadora será de por lo menos 150 pb, más normalmente de por lo menos 200 pb, en general sin exceder de 2 kpb, más normalmente sin exceder de 1 knb aproximadamente. La región no codificadora 3’ respecto a la región constante especı́fica a fibrina puede retenerse por sus secuencias reguladoras de la terminación de la transcripción, tales como terminación y poliadenilación. Además, la región no codificadora 3’ respecto a la región codificadora contiene también un estimulador importante en genes de inmunoglobulina. Ası́, mediante la retención de la región 3’ contigua de forma natural a la secuencia de ADN que codifica la región constante, pueden proporcionarse las señales de terminación de la transcripción. Cuando las señales de terminación de la transcripción no son satisfactoriamente funcionales en la células huésped de expresión, entonces puede emplearse una región 3’ funcional en la célula huésped. Las construcciones para el anticuerpo es6 5 10 15 20 25 30 35 40 45 50 55 60 65 10 pecı́fico a fibrina y activador de plasminógeno pueden unirse entre sı́ para formar un solo segmento de ADN, o bien pueden mantenerse como segmentos separados, bien por sı́ mismos o bien en combinación con vectores. La construcción o construcciones pueden introducirse en una célula mediante transformación en combinación con un gen que permita la selección en donde la construcción llegará a integrarse en el genoma del huésped. Normalmente, la construcción será parte de un vector que tiene un sistema de replicación reconocido por la célula huésped. Los vehı́culos de expresión para la producción de las moléculas de la invención incluyen plasmidos u otros vectores. En general, en conexión con el huésped, se utilizan aquellos vectores que contienen secuencias de replicones y de control derivadas de especies compatibles con una célula huésped. El vector lleva normalmente un punto de replicón, ası́ como genes especı́ficos que son capaces de proporcionar una selección fenotı́pica en células transformadas. Por ejemplo, E. coli se transforma fácilmente usando pBR322, un plasmido derivado de una especie de E. coli. El pBR322 contiene genes para resistencia a ampicilina y tetraciclina y, de este modo, proporciona un medio sencillo para identificar células transformadas. El plasmido pBR322 u otros plasmados microbiales deben contener también, o han de modificarse para que contengan, promotores que pueden ser usados por el organismo microbial para la expresión de sus propias proteı́nas. Aquellos promotores más normalmente usados en la construcción de ADN recombinante incluyen beta lactamasa, sistemas promotores de lactosa, promotores de fagos lambda y los sistemas promotores de triptofano. Aunque estos son los más generalmente usados, han sido descubiertos otros promotores microbiales que pueden ser utilizados. Por ejemplo, una construcción genética para la molécula hı́brida de inmunoglobulina puede colocarse bajo el control del promotor de la izquierda de bacteriofago lambda. El control es ejercido por el represor lambda y se conocen puntos de restricción adyacentes. La expresión de la molécula hı́brida de inmunoglobulina puede colocarse también bajo control de otras secuencias reguladoras que pueden ser homólogas al organismo en su estado no transformado. Por ejemplo, el ADN cromosómico de E. coli dependiente de lactosa comprende un operón lactosa o lac que mediatiza la utilización de lactosa mediante la elaboración del enzima beta galactosidasa. Los elementos de control lac pueden obtenerse a partir del bacteriofago lambda plac5, el cual es ineficaz para e. coli. El sistema promotor - operador lac puede ser inducido por IPTG. Igualmente, pueden emplearse otros sistemas promotores/operadores o porciones de los mismos. Por ejemplo, se pueden emplear colicina El, galactosa, fosfatasa alcalina, triptofano, xilosa, tax y similares. Los huéspedes preferidos son células de mamı́feros, desarrolladas in vitro en cultivo de tejidos o in vivo en animales. Las células de mamı́feros proporcionan modificaciones posterio- 11 2 054 688 res a la traducción a moléculas proteı́nicas de inmunoglobulina que incluyen el doblado o glicosilación correctos en los puntos igualmente correctos. Células de mamı́feros que pueden ser útiles como anfitriones incluyen células de origen fibroblástico tales como VERO o CHO - K1, o células de origen linfoide, tales como el hibridoma SP210 - AG14 o el mieloma P3x63Sg8, y sus derivados. Las células huéspedes de mamı́feros preferidas incluyen SP210 y J55BL. Varias lı́neas celulares segregan uroquinasa y pueden ser empleadas para la transfección, tales como células cultivadas de carcinoma de riñón (Ferraivolo, et al., J. Cell. Phusiol., 121:363 (1984)) y células (Belin et al., EMBO J., 3:190 (1984)). Para un huésped mamı́fero, se disponen de varios sistemas de vectores posibles para la expresión de la molécula hı́brida de inmunoglobulina. Una clase de vectores utiliza elementos de ADN que proporcionan plasmidos extra - cromosómicos de replicación autónoma, derivados de virus animales tales como virus de pa - pi - lo ma bovino, virus de polioma, adenovirus o virus SV40. Una segunda clase de vectores está basada en la integración de las secuencias del gen deseado en el cromosoma de la célula huésped. Pueden seleccionarse células que han integrado de forma estable el ADN introducido en sus cromosomas introduciendo también uno o más marcadores que permiten la selección de células huésped que contienen el vector de expresión. El marcador puede proporcionar prototrofia a un huésped auxotrófico, resistencia biocida, por ejemplo antibióticos, o metales pesados. tal como cobre, o similares. El gen marcador seleccionable puede enlazarse directamente a las secuencias genéticas de ADN a expresar, o bien puede introducirse en la misma célula mediante co - transfección. Pueden necesitarse también otros elementos para la sı́ntesis óptima de mARN de proteı́na de ligación de una sola cadena. Estos elementos pueden incluir señales de unión, ası́ como promotores de la transcripción, estimuladores y señales de terminación. Los vectores de expresión de cADN que incorporan tales elementos incluyen aquellos descritos por Okayama, H., Mol. Cel. Biol., 3:280 (1983) y otros. Puede emplearse una amplia variedad de secuencias reguladoras de la transcripción y de la traducción, en función de la naturaleza del huésped. Las señalesreguladoras de la transcripción y de la traducción pueden derivarse de fuentes virales, tales como adenovirus, virus de pa - pi - lo - ma bovino, virus Simian y similares, en donde las señales reguladoras se asocian con un gen particular que tiene un alto nivel de expresión. Alternativamente, pueden emplearse promotores derivados de productos de expresión de mamı́feros, tales como actina, colágeno, miosina, etc. Se pueden seleccionar señales reguladoras del inicio de la transcripción que permitan la represión o activación, de manera que pueda modularse la expresión de los genes. De interés son las señales reguladoras sensibles a la temperatura, de modo que variando la temperatura, la expresión puede ser reprimida o iniciada, o bien señales reguladoras que están sujetas a regulación 5 10 15 20 25 30 35 40 45 50 55 60 65 12 quı́mica, por ejemplo, metabolitos. Otro huésped preferido es levadura. La levadura proporciona ventajas sustanciales ya que puede llevar a cabo también modificaciones péptidas posteriores a la traducción, incluyendo glicosilación. Existen varias estrategias de ADN recombinante que utilizan secuencias promotoras fuertes y un alto número de copia de plasmidos que pueden ser utilizados para la producción de las proteı́nas deseadas en levadura. La levadura reconoce secuencias de guı́a en productos genéticos de mamı́feros clonados y segrega péptidos portadores de las secuencias de guı́a (es decir, pre - péptidos). Puede emplearse cualquiera de una serie de sistemas de expresión de genes de levadura que incorporan elementos promotores y de terminación a partir de los genes expresados de forma activa y que codifican enzimas glicolı́ticos producidos en grandes cantidades cuando la levadura se hace crecer en medios ricos en glucosa. Los genes glicolı́ticos conocidos pueden proporcionar también señales de control de la transcripción muy eficientes. Por ejemplo, puede utilizarse las señales promotoras y terminadoras del gen de fosfoglicerato quinasa. Una vez que el vector o secuencia de ADN que contiene la construcción o construcciones ha sido preparado para la expresión, la construcción o construcciones de ADN pueden introducirse en un huésped adecuado. Pueden emplearse varias técnicas, tales como fusión de protoplastos, precipitación de fosfato cálcico, electroporación u otras técnicas convencionales. Después de la fusión, las células se hacen crecer en un medio selectivo, en donde las células no transformadas son destruidas, dejando únicamente células transformadas con la construcción de ADN. La expresión del gen o genes se traduce en un conjunto para formar la molécula hı́brida de inmunoglobulina. Las células huésped serán en su mayor parte células inmortalizadas, particularmente células de mieloma o linfoma. Estas células se pueden hacer crecer en un medio nutriente adecuado en matraces de cultivo o puede inyectarse en un huésped sinérgico, por ejemplo, ratón o rata, o en un huésped o punto de un huésped inmunodeficiente, por ejemplo, en la bolsa de un ratón o hámster. En particular, las células pueden introducirse en la cavidad abdominal para la producción de fluido ascı́tico y posterior recogida del receptor quimérico. Alternativamente, las células pueden ser inyectadas subcutáneamente y los anticuerpos pueden recogerse de la sangre del huésped. Las células se pueden emplear del mismo modo que las células hibridomas. Véase Diamond et al., N. Eng. J. Med. (1981) 304:1344 y Kennatt, McKearn y Bechtol (eds.), Monoclonal Antibodies: Hubridomas - - A New Dimension in Biologic Analysis, Plenum, 1980, cuya información se incorpora aquı́ solo con fines de referencia. La molécula hı́brida de inmunoglobulina puede aislarse y purificarse según técnicas convencionales, tales como extracción, precipitación, cromatografı́a, cromatografı́a de afinidad, electrofóresis y similares. El método preferido es la cromatografı́a de afinidad con el heptapéptido 7 13 2 054 688 amino - terminal de la cadena beta de fibrina (se liga al punto de antifibrina) o con benzamidina (se liga al punto catalı́tico de activador de plasminógeno) para aislar selectivamente la molécula hı́brida. La presente invención proporciona también métodos de inmunoterapia e inmunodiagnosis que utilizan las moléculas hı́bridas de inmunoglobulina. En aplicaciones inmunoterapéuticas y de inmunodiagnóstico, la molécula hı́brida de inmunoglobulina se administra a un paciente, llegando a localizarse en el punto de un trombo a través del punto de ligación especı́fico a fibrina de la molécula hı́brida. El trombo es lisado por la actividad enzimática de la porción del activador de plasminógeno de la molécula hı́brida. Como podrá ser apreciado por el experto en la materia, la especificidad de la molécula hı́brida de activador de plasminógeno especı́fico a fibrina permite la selectividad de unión al trombo y la lisis de este último, lo cual reduce el riesgo de efectos secundarios serios, tales como hemorragias. Las moléculas hı́bridas de inmunoglobulina de esta invención se pueden emplear también en aplicaciones de inmunodiagnóstico, incluyendo inmunodiagnosis in vivo. En esta aplicación, la molécula hı́brida es marcada de forma detectable usando un radionúclido. El radionúclido debe ser del tipo de decadencia, el cual es detectable por un cierto tipo de instrumento. Además, el radionúclido para la diagnosis in vivo deberá tener una vida media suficientemente larga para que todavı́a sea detectable en el momento de la máxima absorción, pero suficientemente corta para que, después de la diagnosis, no permanezca radiación indeseable en el paciente. El acoplamiento de los radionúclidos a la proteı́na de este modo a la molécula hı́brida, ya se conoce por el estado de la técnica y suele efectuarse bien directamente o bien indirectamente usando un grupo funcional intermediario. Ejemplos de radioisótopos que pueden ser utilizados para la diagnosis in vivo son 99 Tc, 123 I, 131 I, 111 In, 97 Ru, 67 Cu, 67 Ga, 72 As, 89 Zr y 201 Tl. Según los métodos de esta invención, pueden emplearse también isótopos paramagnéticos para diagnosis in vivo. Ejemplos de elementos que son particularmente útiles para utilizarse en técnicas de energı́a de resonancia magnética incluyen 157Gd, 55 Mn, 162 Dy, 52 Cr y 56 Fe. La molécula hı́brida de inmunoglobulina puede constituir además una composición farmacéutica junto con un vehı́culo farmacéuticamente aceptable. Estos vehı́culos son bien conocidos en la técnica y pueden incluir emulsiones o suspensiones acuosas o en disolventes, incluyendo salina y medios tamponados. Véase, por ejemplo, la técnica farmacéutica recogida en Remington’s Pharmaceutical Sciences (16a ¯ Edición, 1980). Las proporciones de dosificación para la administración de la molécula hı́brida de inmunoglobulina son aquellas que resultan suficientemente grandes para detectar la presencia de trombos. La dosis no deberá ser tan grande que cause efectos secundarios adversos, tales como reacciones de hipersensibilidad, por ejemplo, salpullido o shock anafiláctico. En general, la dosis variará 8 5 10 15 20 25 30 35 40 45 50 55 60 65 14 en función de la edad, estado, sexo y grado de enfermedad del paciente. Las contraindicaciones pueden incluir hipersensibilidad y otras variables y pueden ser ajustadas por el médico. La dosis puede oscilar desde 0,01 a 500 mg/kg de peso corporal, preferentemente de 0,01 a 200 mg/kg. La molécula o moléculas hı́bridas de inmunoglobulina pueden administrarse parenteralmente por inyección o mediante perfusión gradual en el tiempo. También pueden administrarse por vı́a intravenosa, intraperitoneal, intramuscular o subcutánea. Una vez descrita la invención en términos generales, la misma llegará a ser más fácilmente evidente por referencia a los siguientes ejemplos especı́ficos los cuales se incluyen únicamente con fines ilustrativos y de ningún modo intentan ser limitativos, salvo que se indique lo contrario. Ejemplos Ejemplo 1 Materiales Se adquirieron 3 - (2 - piridilditio)propionato de N - succinimidilo (SPDP) y 2 - iminotiolano en Pierce y se adquirió Sepharose 4B - CL en Pharmacia. El 125 I fibrinógeno (IBRIN) se adquirió en Amersham. El plasma se obtuvo a partir del banco de sangre local. Helena Labs. suministró el substrato cromogénico para proteasas, dihidrocloruro de H - D - isoleucil - L - propil - L arginina - p - nitroanalida (S - 2288). Todos los otros productos quı́micos fueron suministrados por Sigma o Fisher. El anticuerpo 64C5 especı́fico a fibrina ha sido descrito en Hui et al., supra y en solicitud de patente USA copendiente n◦ de serie 824.228, incorporada aquı́ solo con fines de referencia. El anticuerpo 59D8 especı́fico a fibrina ha sido descrito en la solicitud de patente USA copendiente n◦ de serie 851.514, incorporada también solo con fines de referencia. Electrofóresis u autorradioarafı́a Se llevó a cabo SDS - PAGE de acuerdo con el método de Laemmli, Nature (London), 277:681 (1970). Las proteı́nas fueron visualizadas utilizando Coomassie Brilliant Blue R o, cuando fueron radiomarcadas, usando autorradiografı́a durante 24 - 72 horas a - 70◦C. Clonación del gen de uroquinasa Un clon de ADN complementario (PHUK8) que contiene la secuencia codificadora de cadena B catalı́tica fue aportado de forma desinteresada por el Dr. F. Blasi (Verde et al., Proc. Nat’l. Acad. Sci. USA, 81:4727 (1984)). Este clon se hizo crecer y se aisló en cantidad en pBR322. Un segmento de este clon de ADN se utilizó en construcciones con genes de anticuerpos anti fibrina, empleándose para aislar la secuencia de ADN genómico. Clonación del gen de tPA El Dr. Sandra Degen aportó de forma desinteresada un clon de ADN complementario de longitud completa del gen de tPA humano (PPA34’F). La secuencia codificadora de la cadena B catalı́tica de tPA fue extractada del clon y, en el extremo 5’ de esta secuencia se colocó un segmento corto único de ADN sintético (adaptador) codificador de dos puntos comunes de disociación 15 2 054 688 con enzimas de restricción. Este adaptador permite que el gen se una convenientemente “en el marco de lectura” a otros segmentos de ADN. Este clon ası́ construido se utiliza en construcciones con genes de anticuerpos anti - fibrina. Se utiliza también para aislar la secuencia genómica codificadora del cadena B de tPA y la secuencia genómica se utiliza posteriormente en construcciones con los genes 59D8. Clonación de los genes de cadenas ligera y pesada variables del anticuerpo 64C5 especı́fico a fibrina. Usando un oligonucleótido redundante 17 mer, que fue sintetizado para corresponderse con el terminal amino de la cadena ligera de 64C5 y una sonda kappa/J disponible, la transposición de cadena ligera de 64C5 productiva fue clonada a partir de una biblioteca subgenómica construida en pBR322. La cadena ligera entera fue reconstruida por ligación del fragmento transpuesto clonado en un plásmido pBR322 que contiene un fragmento EcoR1/BamH1 de 5,8 Kb, el cual codifica la región constante kappa de ratón y segmentos de unión (Max, et al, J. Biol, Chem., 256:5116 - 20 (1981)). La transposición Vi se colocó 5’ de la región constante en la orientación correcta. El ADN genómico derivado del hibridoma 64C5 fue digerido con enzima de restricción EcoR1, fraccionado por tamaños en un gel de agarosa preparativo y posteriormente ligado en un vector de clonación lambda para producir una biblioteca subgenómica. Usando una sonda de la región de unión de cadena pesada, se clonó un fragmento transpuesto. Se determinó que era la transposición de cadena pesada usada en el hibridoma 64C5 por hibridación a un oligonucleótido basado en la secuencia amino - terminal del anticuerpo. Clonación del gen de cadena pesada variable del anticuerpo 59D8 especifico a fibrina. El ADN genómico del hibridoma 59D8 fue fraccionado por tamaños, ligado en un vector de clonación lambda y evaluado con la sonda de la región de unión de cadena pesada anteriormente indicada. Ambas transposiciones de cadena pesada fueron clonadas y se seleccionó la productiva mediante hibridación a un oligonucleótido 20 - mer basado en la secuencia de ARN de la cadena pesada de 59D8. Construcciones genéticas de anticuerpo especı́fico a fibrina/activador de plasminógeno. El fragmento de restricción clonado, que contiene regiones variable y de unión ası́ como secuencias estimuladoras del gen 59D8 o 64C5, se introduce en la orientación correcta en un plásmido 5’ de la secuencia de región constante de cadena pesada 2B gamma de ratón. Este plásmido que contiene la secuencia de región constante (PSV GPT/gamma 2B) contiene también el gen de resistencia a ampicilina de pBR322, y el gen de guanina fosforribosil transferasa (GPT) bajo control del promotor viral SV40. Fue una aportación gratuita del Dr. Richard Neer. Esta construcción es propagada en E. coli MC1061 por vı́a del gen de resistencia a ampicilina y pudo seleccionarse la expresión del gen de GPT en eucariotos respecto a la presencia de xantina, hipoxantina y ácido micofenólico. Posteriormente se separó el grueso de la secuencia codificadora 5 10 15 20 25 30 35 40 45 50 55 60 65 16 del terminal carboxi de la región constante de cadena pesada. Se reemplazó con un fragmento de ADN complementario que codifica la cadena carboxi “B” catalı́tica o uroquinasa o activador de plasminógeno de tejido. El tercer exon de cualquiera de los genes de región constante de cadena pesada se une en el mismo marco a uno de los genes de activador de plasminógeno, de manera que se produzca la secuencia usual de aminoácidos y se obtenga una proteı́na compuesta. Esta construcción final es transfectada por electroporación en la variante hibridoma 59D8 o 64C5 adecuada que ha sido detenida produciendo la cadena pesada usual. Estos transfectantes producen una molécula de anticuerpo con especificidad a fibrina, con la mitad activador de plasminógeno en el extremo de cola de la cadena pesada truncada. Purificación de moléculas hı́bridas uroquinasa - 64C5 de inmunoglobulina. La molécula hı́brida se aı́sla utilizando cromatografı́a de afinidad sucesiva sobre benzamidina Sepharose y beta - péptido - Sepharose, con el fin de obtener moléculas hı́bridas que contienen un punto de combinación de anticuerpo y secuencia de uroquinasa o de tPA. La columna de afinidad es construida acoplando un péptido de fibrina de cadena beta amino - terminal sintético (Gly His - Arg - Pro - Leu - Asp - LyS - Cys (beta péptido)) Hui, et al., Science, 222:1129 (1983) a maleimidobenzoil lisina - Sepharose C1 - 4B Kitagawa, et al., J. Biochem, (Japon), 79233 (1976). El eluado de esta columna (0,2 m glicina.HCl, pH 2,8) se recupera y se analiza para determinar las propiedades de ligación de fibrina y la actividad fibrinolitica. Purificación de moléculas hı́bridas tPA - 59D8 de inmunoalobulina. Las moléculas hı́bridas de inmunoglobulina son purificadas a partir de las células huésped mediante cromatografı́a de afinidad secuencial en dos etapas. Las moléculas se aplican en primer lugar a Sepharose CL - 4B que contiene benzamidina inmovilizada y se retienen las moléculas hı́bridas de tPA - anticuerpo las cuales son posteriormente eluidas con 0,1 M acetato, 0,4 M NaCl (pH 4,0). Después de la neutralización, el eluado se aplica a la columna de péptido - Sepharose. El eluado de la columna de beta péptido (0,2 M glicina, pH 2,8), se dializa contra tampón NaPi que incluye 1 M arginina y 0,1% de Tween 80 y se guarda en este tampón a 4◦C. Caracterización de moléculas hı́bridas de inmunoalobulina. Las moléculas hı́bridas se someten a SDS PAGE en condiciones tanto reductoras como no reductoras. Los geles son teñidos con azul Coomassie o sometidos a autorradiografı́a (en el caso de que tPA o UK se marque con 125 I antes del acoplamiento). Ensayo con substrato cromogénico para determinar la actividad peptidasa. Para determinar las propiedades funcionales de la molécula hı́brida, se examinan en primer lugar sus propiedades peptidolı́ticas con respecto a un substrato no selectivo, dihidrocloruro de H D - isoleucil - L - propil - L - arginina - p - nitroanalida (S - 2288). El ensayo con S - 2288 se efectúa con un volumen total de 1 ml en 0,05 m 9 17 2 054 688 Tris - HCI, 0,10 M NaCl (pH 8,5) con una concentración de substrato de 3 x 104 M. La absorbancia a 405 nm se mide cada 10 segundos a 20◦ C. Ensayos con fibrinógeno El contenido en fibrinógeno de muestras de plasma humano citratado o plasma de conejo citratado se determinó mediante dos métodos. El fibrinógeno coagulable fue medido mediante el método de Clauss, Acta Chir. Scand., 90:419 (1957) y el fibrinógeno total se determinó mediante precipitación con sulfito sódico. Ensayo con coágulo de plasma Se utiliza el método de Lijnen et al., Thromb. Haemostas, 52:308 (1984) con las siguientes modificaciones. Plasma humano congelado obtenido de donantes se reune, se distribuye en partes alı́cuotas y se vuelve a congelar. Inmediatamente antes de cada experimento, se calibran las actividades de tPA, UK y de sus moléculas hı́bridas de inmunoglobulina empleando el ensayo con S - 2288 (es decir, se determinan las actividades peptidasa de los activadores de plasminógeno naturales y de sus moléculas hı́bridas y se efectúan diluciones adecuadas para que al actividad peptidasa (en unidades/ml) sea idéntica en cada una de las muestras). Se preparan coágulos de plasma añadiendo a plasma congelado reciente cada uno de los siguientes materiales: trombina, 8 unidades NIH/ml; 0,5 M CaCl2 , 100 µ/ml; y fibrinógeno humano marcado con 125 I (IBRIN), 40.000 cpm/ml. La solución se pasa inmediatamente a tubos Silastic (diámetro interno: 4 mm) y se incuba a 37◦ C durante 30 minutos. El tubo Silastic que contiene plasma congelado reciente coagulado se corta en secciones de 1,5 cm, para obtener coágulos de 0,2 ml. Estos se lavan entonces en 0,15 M NaCl antes de su uso. Cada coágulo se coloca en un tubo de plástico, se efectúa un conteo y se suspende en 1 ml de plasma congelado reciente (procedente del mismo depósito). Los experimentos se inician por adición de un activador de plasminógeno (o molécula hı́brida de activador de plasminógeno y anticuerpo). A intervalos de 30 minutos, se separa de cada tubo, para proceder a su conteo, una parte alı́cuota del plasma congelado reciente. Se conservan muestras al final del experimento para la determinación de los niveles de fibrinógeno. Trombolisis in vivo Se utiliza el modelo de la vena yugular de conejo de Collen et al, J. Clin. Invest., 71:368 (1983). Después de sedar el conejo con acetopromazina y cetamina, se practica una incisión paramedial desde la mandı́bula derecha hasta por encima de la clavı́cula derecha. La vena yugular externa se aı́sla por disección y las ramificaciones se ligan y se separan. Se introduce un hilo de lana para sujetar el coágulo. Después de cesar la sangrı́a, se colocan pinzas vasculares con el fin de aislar este segmento de la vena yugular externa y los componentes del coágulo se introducen en el segmento venoso aislado. Estos componentes consisten en - aproximadamente 500. 000 cpm de fibrinógeno humano marcado con 125I (cada muestra es sometida a conteo antes de su uso), 100 µl de glóbulos rojos sanguı́neos humanos, 100 µl de plasma congelado reciente humano, 10 µl 10 5 10 15 20 25 30 35 40 45 50 55 60 65 18 de 0,5 m CaCl2 Y 10 µl de trombina bovina (8 unidades NIH). Después de 30 minutos, se retiran las pinzas vasculares y se restablece el flujo sanguı́neo. Se toma una muestra de sangre inmediatamente después de soltar las pinzas, para determinar la radioactividad no incorporada en el trombo. Se diluyen cantidades medidas de activador de plasminógeno a un volumen de 25 ml y se suministran por vı́a de la vena marginal de la oreja contralateral durante 4 horas mediante una bomba de infusión. Se determinan los recuentos mediante jeringas de recuento, esponjas de gasas y tubos. Seis horas después del inicio de la infusión, el segmento venoso entero es aislado, separado y sometido a recuento. El porcentaje de lisis se determina como la relación de los recuentos que permanecen al término del experimento con respecto a los recuentos netos al comienzo. Ensayo fibrinolı́tico El ensayo fibrinolı́tico cuantitativo consiste en ligar monómero de fibrina en Sepharose. El fibrinógeno se purifica de plasmina contaminante mediante paso sobre lisina - Sepharose y luego se mezcla con trazas de fibrinógeno marcado con 125 I. A continuación se acopla a Sepharose Cl 4B activado con bromuro de cianógeno. El fibrinógeno inmovilizado se convierte a fibrina por adición de trombina humana en presencia de 100 mM CaCl2 . Para evaluar su actividad fibrinolı́tica relativa, se incuban cantidades cada vez mayores de molécula hı́brida 125 I - UK - 64C5 y de uroquinasa (o molécula hı́brida 125 I - tPA - 59D8 y tPA) con 125 I - fibrina - Sepharose durante 4 horas. A continuación, la resina se incuba con plasminógeno purificado. Después de intervalos de 2,5 y 15 horas, la mezcla se centrifuga y se determina la radioactividad del sobrenadante. Este procedimiento se repite con el conjugado de control, (125 I - UK) SS - (3H3). Ejemplo 2 Materiales y métodos Clonación del gen de cadena negada 59D8 Se preparó ADN genómico de alto peso molecular a partir de las células hibridomas 59D8 en la forma ya descrita en Quertermous et al., J. Immunol., 128:2687 - 2690 (1987). Para identificar genes de inmunoglobulina de cadena pesada transpuesta, especı́ficos a la lı́nea hibridoma 59D8, se lleva a cabo el análisis de transferencia Southern, como ya ha sido descrito, con ADN genómico digerido con Eco R1 y con una sonda de región de unión genómica Eco R1/Pst1 de 1,7 kilobases (kb). (Southern, E.M., J. Mol. Biol., 98:503 - 517; Sakano et al., Nature, 286:676 - 683 (1980)). Se identificaron dos transposiciones que no se encontraban en ninguna de las células originalmente fusionadas para producir el hibridoma 59D8 (SP210 y Balb/c). A continuación se digirió 1 mg de ADN genómico con Eco R1 y se fraccionó por tamaños en un gel de agarosa preparativo. Southern, E. in Methods in Enzymology, et. Wu. R. (Academic Press. NY) vol. 68, pp. 152 176. Las fracciones que contenı́an cada uno de los dos fragmentos transpuestos fueron identificadas por hibridación a la sonda de la región de unión. Estas fracciones fueron concentradas y ligadas en 19 2 054 688 λgt10. Las dos bibliotecas subgenómicas ası́ construidas fueron evaluadas con la sonda de región de unión y se aislaron varios clonos potenciales a partir de cada biblioteca. (Maniatis et al., Molecular Cloning. 1982) (Cold Spring Harbor, NY). La selección del clon que contiene el fragmento transpuesto codificador del punto de combinación de antigeno 59D8 se llevó a cabo mediante hibridación a un oligonucleótido de 20 pares de bases que habı́a sido construido en base a la secuencia del mARN de cadena pesada de 59D8. El aislamiento y secuenciación de ARN, el marcado con 32 p del oligonucleótido con T4 polinucleótido quinasa y la hibridación se llevaron a cabo según técnicas ya descritas. (Maniatis et al., Molecular Cloning, supra: Clarke et al., J. Ex - V. Med. 161:687 - 704 (1985); Suggs et al., Proc. Nat’l Acad. Sci. USA, 78:6613 - 6617 (1981). Construcción del vector de expresión La secuencia de t - PA se derivó de un clon de cADN (pPA34’F) que habı́a sido construido a partir de mARN de células HELA. Fisher et al., J. Biol. Chem., 260: 11223 - 11230 (1985). El ADN codificador del punto SacI de cadena beta al punto Eco R1 de pBR322 fue aislado y ligado en pGEm3. A continuación, se aisló un fragmento 5’ contiguo por digestión con SfaN1 y Sac1. Al extremo 5’ del segundo fragmento se añadió un oligonucleótido sintético que contiene un extremo Bam H1, un punto Xho1 y dos bases reconstituyentes de un codon para glicina. El fragmento modificado fue ligado entonces en un plásmido que contiene ya el fragmento 3’, reconstituyendo ası́ la secuencia de cadena beta. La cadena beta fue cortada con Xho1 y Sca1, siendo aportado el punto Sca1 por la secuencia de oBR322. La construcción final fue montada en el vector pSV2gpt que habı́a sido modificado por la inserción de un poli - enlazador que contiene un fragmento de restricción Xba1 de 6 kb codificador de la región constante de cadena pesada γ2b murinica. Mulligan et al., Proc. Nat’l Acad. Sci. USA. 78:2072 - 2076 (1981); Tucker et al., Science, 206:1303 - 1306 (1979). El gen transpuesto productivo de cadena pesada de 59D8 que habla sido clonado en un fragmento Eco R1 de 2,6 kb, se insertó en la orientación correcta en un punto Eco R1 del polienlazador 5’ de la región constante γ2b. La secuencia de la región constante entre el punto Xhol único en CH2 y un punto Sall en el polienlazador fue cortada, el punto Sall se hizo romo y la cadena beta de t - PA se ligó en su sitio. El análisis de la secuencia de nucleótidos confirmó que la unión entre la cadena pesada y los segmentos de t - PA se encontraba en el mismo marco. Sanger et al., Proc. Nat’l. Acad. Sci. USA, 74: 5463 - 5467 (1977). Anticuerpos monoclonales y selección de variantes de pérdida El anticuerpo monoclonal 59D8 especı́fico a fibrina fue promovido por inmunización con un heptapéptido sintético basado en la secuencia amino - terminal de la cadena beta de fibrina, como ya ha sido descrito en Hui et al., Science 222:1129 - 1132 (1983). Las células hibridomas y las variantes de pérdidas se mantuvieron en medio completo: DMEM con 4,5 mg/ml de glucosa, 12% 5 10 15 20 25 30 35 40 45 50 55 60 65 20 de suero vacuno fetal (FCS), 50 g/ml de sulfato de gentamicina y 0,6 mg/ml de L - glutamina. Para la selección de las variantes de pérdida de cadena pesada, las células se hiciéron crecer en agarosa blanda. A los platos de cultivo tisular (60 mm) se añadieron 5 ml de medio completo más 0,2% de agarosa y 8% más de FCS y se dejó solidificar a temperatura ambiente durante 3 - 5 minutos. Las células (1 a 2 x 103 ) a seleccionar respecto a la pérdida de cadenas fueron depositadas en capas sobre la agarosa. Los platos se incubaron a 37◦C en 6% de dióxido de carbono hasta que se formaron racimos de células (2 - 4 dı́as). Para detectar variantes de pérdida de cadena pesada, los racimos de células fueron cubiertos con una solución de antisuero (1 ml) conteniendo medio completo con 0,2% de agarosa y 5 - 10% de cadena pesada anti - ratón de conejo o cabra. Los racimos de células que segregan cadena pesada desarrollaron un halo de precipitina. Los racimos que no tenı́an un halo de precipitina fueron recogidos de la agarosa blanda mediante una pipeta capilar y se suministraron posteriormente a platos de 96 pocillos que contenı́an medio completo con 8% más de FCS. Los subclonos individuales fueron ensayados mediante el ensayo con inmunoabsorbente enlazado a enzimas (ELISA) o mediante transferencia Western respecto a la presencia de cadena pesada y cadena ligera. Transfección u selección La construcción pD8SVtβ fue transfectada en células variantes de pérdida por electroporación, usando una fuente de alimentación eléctrica Isco, en la forma descrita por Potter et al., Proc. Nat’l Acad. Sci. USA. 81:7161 - 7165 (1984). Las condiciones óptimas de la transfección fueron una descarga de 2.000 voltios en 0,8 ml de salina tamponada con fosfato. Los transformantes fueron seleccionados mediante crecimiento en ácido micofenólico, xantina e hipoxantina. La confirmación de la transfección y expresión se obtuvo mediante análisis de transferencia Northern usando una sonda de CADN de 2 kb codificadora de la porción 3’ de la cadena beta de t - PA humano. Maniatis et al., Molecular Cloning supra. Las lı́neas de células transfectadas fueron subclonadas de acuerdo con técnicas convencionales. Purificación de proteı́na La proteı́na fue purificada a partir de los sobrenadantes celulares y a partir del fluido ascı́tico mediante cromatografı́a de doble afinidad secuencial en dos columnas. Una de las columnas se construyó enlazando el péptido sintético usado para la generación de 59D8 con Sepharose. La otra columna consistı́a en un anticuerpo monoclonal de t - PA anti - humano enlazado a Sepharose. Se utilizó una tercera columna, compuesta de benzamidina enlazada a Sepharose, en los intentos iniciales de purificación. Sin embargo, incluso aunque la benzamidina se liga bien al punto activo de t - PA y se puede utilizar benzamidina - Sepharose para purificar la molécula intacta, la columna no retuvo la proteı́na recombinante. La purificación de la proteı́na recombinante se controló mediante dos inmunoanálisis en fase sólida. Para detectar actividad de anticuerpo anti - fibrina, se revistieron placas de microvaloración 11 21 2 054 688 de 96 pocillos con monómero de fibrina y se bloquearon con 10% de suero de caballo. Se incubaron entonces con muestras, tras lo cual se lavaron y se sondaron con Fab anti - ratón de cabra marcado con 125 I. El segundo ensayo o análisis fue para detectar el antigeno de t - PA asociado con la actividad del anticuerpo anti - fibrina. En este ensayo, las placas revestidas con monómero de fibrina se incubaron con sobrenadante de cultivo o fluido ascitico y se sondaron con t - PA anti - humano marcado con 125I. Debido a que la cadena de t - PA no posee actividad de ligación de fibrina, únicamente se detecta proteı́na recombinante que contiene ambos dominios funcionales. Análisis de transferencia Western Se efectuaron transferencias Western a partir de ambas muestras reducida y sin reducir separadas en geles de poliacrilamida y NaDodSO4 , usando técnicas ya establecidas. Burnette, W.N., Anal. Biochem., 112:195 - 203 (1981). Como sonda se utilizó Fab anti - ratón o un anticuerpo monoclonal de tiPA anti - humano marcado con 125 I. Ensayo de ligación de antigeno El anticuerpo original (59D8) y la molécula recombinante se ensayaron en primer lugar respecto a la presencia de antigeno de Fab de ligación de fibrina. Esto se efectuó con el inmunoanálisis en fase sólida descrito anteriormente usando, como sonda, Fab anti - ratón de cabra marcado con 125 I. Se generaron curvas de titulación para 59D8 y para la proteı́na recombinante variando sus concentraciones en el ensayo. Aquella concentración que proporcionó la misma cantidad de anticuerpo ligado marcado con 125 I se seleccionó entonces entre la parte lineal de cada una de las curvas. A esta concentración de 59D8 o de proteı́na de fusión, se llevó a cabo un ensayo de competición en pocillos que habı́an sido revestidos con fibrina y llenados con varias cantidades de fibrina soluble. La proteı́na que se ligó a la fibrina soluble en lugar de hacerlo a la fibrina insoluble, se separó mediante lavado antes de la aplicación del anticuerpo marcado. Ensayos de la función enzimática Para comparar la función enzimática de la proteı́na recombinante con la de t - PA natural, se examinaron en primer lugar sus propiedades peptidolı́ticas en un ensayo que mide la disociación o rotura del substrato no selectivo S - 2288 (Helena Labs. Beaumont, TX). El ensayo se llevó a cabo en un volumen de 50 µl de tampón (0,15 M Tris, 0,15 M NaCl) con una concentración final 1 milimolar de substrato cromogénico. Se añadieron varı́as concentraciones de proteı́na recombinante o de t - PA purificado a partir de la lı́nea de células de melanoma Bowes (Bio Response, Hayward, CA) y se midió la absorbancia a 405 nm en una serie de puntos de tiempo. Para determinar sı́ la proteı́na recombinante es capaz de activar plasminógeno, se efectuó un segundo ensayo utilizando el substrato cromogénico S - 2251 (Helena Labs). En primer lugar se determinó, en el ensayo S - 2288, la actividad de t - PA de melanoma, de la proteı́na recombinante y de tripsina bovina, y se ajustaron las concentraciones de manera que cada en12 5 10 15 20 25 30 35 40 45 50 55 60 65 22 zima estuviera presente en 100 unidades/100 µl. Se añadieron entonces µl de t - PA de melanoma, proteı́na recombinante o tripsina bovina en una dilución en serie a 100 µl de plasminógeno humano (0,15 mg/ml) y 800 µl de substrato S - 2251. Las muestras se incubaron durante 60 minutos a 37◦C. La reacción se terminó por la adición de 1 ml de ácido acético al 50% y se determinó la absorbancia a 405 nm. Resultados La electroporación de la construcción pSVD8T (Fig. 1) en las variantes de pérdida de cadena pesada de 59D8 proporcionó numerosos clonos transfectados. Cuando se mezclaron aproximadamente 1 x 108 células hibridomas con 50 µg de ADN plásmido circular en 0,8 ml de salina tamponada con fosfato y la mezcla se sometió a una descarga de 2.000 voltios, aproximadamente 15 de los pocillos de una placa de 96 pocillos contenı́a clonos resistentes a medicamentos. Aproximadamente el 75% de estos clonos segregaron la proteı́na recombinante. Se seleccionaron 5 clonos para su análisis posterior en base a su velocidad de crecimiento y expresión de mARN codificador de la proteı́na de fusión. Se efectuaron análisis de transferencia Western de la proteı́na recombinante purificada por afinidad. Transferencias de geles reducidos sondados con un anticuerpo monoclonal de t - PA anti - humano yodado revelaron en marcado de un péptido de 65 kD. Este es el tamaño esperado de una proteı́na de fusión de t - PA de cadena pesada. La cadena beta de t - PA es de aproximadamente 33 kD y la cadena pesada truncada deberá aportar 30 kD.Varias lı́neas de evidencia indican que el péptido de 65 kD no es una molécula de tipo t - PA aportada por suero vacuno fetal. La banda de 65 kD es observada cuando las lı́neas de células transfectadas son crecidas en un medio libre de suero o en el espacio intraperitoneal del ratón. Igualmente, cuando se purificó t - PA bovino a partir de suero vacuno fetal mediante cromatografı́a de afinidad con benzamidina, incluso aunque fue marcado por el anticuerpo en transferencias Western, el tamaño de la molécula fue de 75 kD. Transferencias Western de muestras reducidas y sondadas con un Fab anti - ratón de cabra derivado de sueros policlonales, revelaron el marcado de una proteı́na de 25 kD, el cual es el tamaño esperado de la cadena ligera K de 59D8. Aunque en dichas transferencias este reactivo marca normalmente también las cadenas pesadas de inmunoglobulina de ratón, la ausencia de marcado del péptido de fusión no es sorprendente puesto que se ha separado la mayor parte de la región constante de cadena pesada. Transferencias producidas con muestras son reducir revelaron el marcado de una sola banda a un peso molecular de 170 - 180 kD mediante ambos anticuerpos yodados. Esto proporciona una fuerte evidencia de que las células hibridomas producen una molécula que contiene ambos péptidos de inmunoglobulina y de t - PA. El valor de 170 - 180 kD sugiere que se han formado los enlaces disulfuro entre las cadenas pesadas para obtener una molécula de tipo Fab que contiene dos puntos de combinación de antı́genos y dos mitades de t - PA. 23 2 054 688 La actividad peptidolı́tica de la porción de t PA de la molécula se evaluó inicialmente midiendo la disociación del substrato no especı́fico S - 2288. La disociación de este tripéptido puede ser controlada con precisión siguiendo la producción de paranitroanilina, la cual absorbe luz a una longitud de onda de 405 nm. La figura 2A muestra un ensayo tı́pico, el cual utiliza directamente la actividad de diferentes concentraciones de t - PA de melanoma puro. La actividad en este ensayo se define como la velocidad de cambia en la densidad óptica. Cuando se efectúa una comparación, sobre una base molar, entre la proteı́na recombinante y t - PA natural, la proteı́na recombinante posee 70% de la actividad de t - PA natural. Para determinar si la subunidad beta catalı́tica mantenı́a actividad contra plasminógeno (su substrato fisiológico), se llevó a cabo un ensayo S - 2251. En este caso, se requiere el activador de plasminógeno para convertir plasminógeno a plasmina y la plasmina libera posteriormente para nitroanilina a partir de un tripéptido sintético. Ni el activador de plasminógeno ni la tripsina pueden convertir directamente el substrato S2251. En primer lugar se determinaron, en el ensayo S2288, las actividades amidolı́ticas de la proteı́na recombinante, de t PA de melanoma y de tripsina y a continuación se determinó la capacidad de cantidades comparables de cada uno de ellos para convertir plasminógeno. La figura 2B revela que la capacidad de la proteı́na recombinante para actuar sobre el substrato fisiológico es muy similar a la de t - PA natural. Aunque una proteasa de serina no especı́fica, tal como tripsina, es capaz de convertir plasminógeno a plasmina, lo hace de un modo mucho menos eficaz que el activador de plasminógeno natural o recombinante. Tanto el esquema de purificación como los ensayos utilizados después de la purificación requerı́an un punto de combinación de antı́geno intacto y funcional. Con el fin de comparar más cuantitativamente la molécula recombinante con el anticuerpo 59D8, se utilizó un ensayo de competición simple. Este ensayo midió la capacidad del monómero de fibrina soluble para competir por los puntos de ligación de anticuerpo contra fibrina ligada al fondo de una placa de 96 pocillos. Aunque el ensayo indica que el anticuerpo natural liga monómero de fibrina mejor que lo hace la proteı́na recombinante, la diferencia en sus afinidades de ligación es inferior a 10 veces (Figura 3). Es evidente que la ligación del anticuerpo no se deteriora de manera importante en la proteı́na de fusión. Discusión El análisis extensivo de la proteı́na segregada indica que una proteı́na de fusión de t - PA de cadena pesada de 59D8 está siendo expresada y segregada en asociación con la cadena ligera y ello del modo previsto. Sin embargo, la cantidad de proteı́na recombinante presente en los sobrenadantes de los cultivos de células aparece solo como del 10% de la cantidad esperada para los anticuerpos monoclonales. mediante purificación por afinidad, se han obtenido de forma rutinaria solo 0,1 µg de proteı́na purificada por ml de sobrenadante de cultivo celular o 10 µg por ml en fluido ascı́tico. 5 10 15 20 25 30 35 40 45 50 55 60 65 24 Se controló la purificación con inmunoanálisis en fase sólida como se ha descrito anteriormente y las recuperaciones obtenidas a partir de las columnas de afinidad estaban dentro de la gama esperada. Existen varias razones posibles de la producción limitada de proteı́na recombinante. Una de ellas es que la proteı́na recombinante se degrada durante el crecimiento de las células o purificación de la proteı́na. En un intento de limitar la degradación proteolı́tica, se añadieron inhibidores de proteasa a los cultivos celulares. Aunque no se observó ninguna mejora en el rendimiento, la degradación proteolı́tica siguió siendo un problema. Otros problemas más fundamentales pudieron ser la causa de los bajos rendimientos de proteı́na. Aunque puede apreciarse ARN mensajero del tamaño adecuado en la transferencia Northern, la transcripción de la construcción puede ocurrir a un bajo nivel. La transcripción es impulsada por el promotor y estimulador de cadena pesada natural, pero de esta construcción han sido excluidas las secuencias 3’, las cuales han demostrado ser importantes en la regulación de la expresión de inmunoglobulina. Gregor et al., Mol. Cell. Biol., 6:1903 - 1916 (1986); Kobrin et al., Mol. Cell. Biol., 6:1687 - 1697 (1986). En adición, la región 3’ no traducida del gen quimérico es de t - PA, una proteı́na que se produce a un bajo nivel bajo condiciones normales, y se guarda posteriormente en las células en donde se produce. Es posible que la región 3’ no traducida del gen de t - PA conduzca a bajos niveles de transcripción o traducción, o bien que interfiera con la secreción de la proteı́na recombinante a partir de la célula. Experimentos dirigidos a la cuantificación de la sı́ntesis de m ARN, sı́ntesis de proteı́na y estabilidad del péptido recombinante deberán permitir la resolución de este problema. Las variantes de pérdida de cadena pesada proporcionan un medio conveniente para la reconstitución del punto de combinación del anticuerpo. Su disponibilidad hace innecesario clonar y transfectar la transposición de cadena ligera productiva. Este enfoque, como es lógico, depende de la posibilidad de poder transfectar estas lı́neas celulares variantes. Las dos lı́neas usadas en estos experimentos fueron transfectadas fácilmente usando técnicas convencionales, pero no está todavı́a claro si las otras lı́neas derivadas de SP210 se comportarı́an de manera similar. La cantidad de cadena ligera que segregan las variantes de pérdida de cadena pesada varı́a. Sin embargo, algunas variantes de pérdida que segregan pequeñas cantidades de cadena ligera pueden ser capaces de segregar cantidades normales de esta misma cadena ligera cuando se reanuda la sı́ntesis de la cadena pesada. Wilde et al., Eur. J. Immunol., 10:462 - 467 (1980). Se sabe poco acerca de la base biológica de la pérdida de producción de cadena de inmunoglobulina en estas células y es posible que pueda deteriorarse la capacidad de algunas variantes de pérdida para producir cadena ligera ası́ como cadena pesada. El bajo nivel de producción de la presente proteı́na recombinante podrı́a ser el resultado de una expresión deprimida de la cadena ligera. La cadena beta de t - PA recombinante tiene un alto nivel de actividad catalı́tica y retiene la 13 25 2 054 688 capacidad especı́fica de convertir plasminógeno a plasmina. Los primeros estudios, que enlazaron nucleasa estafilococal y funciones de ADN polimerasa de E. coli a la cadena pesada de inmunoglobulina, proporcionaron una actividad de función efectora considerablemente menor del 70%, medida en el ensayo S - 2288. Neuberger et al, Nature, 312:604 - 608 (1984); Williams et al., Gene, 43:319 - 324 (1986). Esta retención de actividad enzimática y especificidad por el substrato indica que para formar proteı́nas recombinantes hı́bridas pueden utilizarse incluso moléculas complejas que requieren un doblado y formación estrictos de múltiples enlaces disulfuro entre las cadenas. Otros han demostrado que la cadena beta de t - PA es capaz de doblar correctamente y mantener la actividad en ausencia de la cadena alfa. macDonald et al., Gene, 42:59 - 67 (1986); von Zonneveld et al., Proc. Nat’l. Acad. Sci. USA, 83:4670 - 4674 (1986). Los resultados aquı́ obtenidos confirman la actividad de la cadena cata- 5 10 15 20 25 30 35 40 45 50 55 60 65 14 26 lı́tica únicamente e indican que la cadena puede doblarse correctamente en el contexto de una secuencia aminoterminal diferente. En conjunto, estas observaciones proporcionan evidencia del doblado independiente de diferentes dominios de proteı́na. En resumen, según esta invención se ha clonado el gen de cadena pesada codificador del punto de combinación de antı́geno de un anticuerpo antifibrina y se ha producido una construcción que codifica un péptido de fusión de subunidad beta de t - PA de cadena pesada truncada. La construcción fue transfectada posteriormente en variantes de pérdida de cadena pesada del hibridoma antifibrina. El análisis de transferencia Western indica que la proteı́na de fusión tiene actividad de anticuerpo antifibrina y retiene un nivel de activación de plasminógeno suficientemente alto para considerarlo similar a la de t PA natural. 27 2 054 688 REIVINDICACIONES 1. Un proceso para la producción de una molécula hı́brida recombinante de inmunoglobulina que comprende un anticuerpo, o una porción del mismo, especı́fico por fibrina y un activador de plasminógeno, o una porción del mismo, capaz de convertir plasminógeno a plasmina, caracterizado porqué comprende acoplar sucesivos aminoácidos mediante la formación de enlaces péptidos. 2. Un proceso según la reivindicación 1, caracterizado porque el activador de plasminógeno es activador de plasminógeno de tipo tisular, estreptoquinasa, uroquinasa o prouroquinasa. 3. Un proceso según la reivindicación 1 o 2, caracterizado porque se prepara el anticuerpo 64c5 (ATCC HB 8545) o 59D8 (ATCC HB 8546). 4. Un proceso según cualquiera de las reivindicaciones anteriores, caracterizado porque la porción del activador de plasminógeno es la región catalı́tica. 5. Un proceso según la reivindicación 4, caracterizado porque la región catalı́tica es la cadena B de tPA o uroquinasa. 5 10 15 20 28 6. Un proceso según cualquiera de las reivindicaciones 1 a 5, caracterizado porque comprende además la etapa de marcar de forma detectable la molécula. 7. Un proceso según la reivindicación 6, caracterizado porque comprende radiomarcar la molécula. 8. Un proceso para la preparación de una composición farmacéutica administrable para su aplicación en diagnosis in vivo, caracterizado porque comprende mezclar una molécula hı́brida recombinante de inmunoglobulina, preparada según el proceso de cualquiera de las reivindicaciones 1 a 5, con un vehı́culo farmacéutica o veterinariamente aceptable para la misma. 9. El uso de una molécula hı́brida recombinante de inmunoglobulina preparada por un proceso según cualquiera de las reivindicaciones 1 a 5, en la preparación de un agente trombolı́tico. 10. El uso de una molécula hı́brida recombinante de inmunoglobulina, marcada de forma detectable, preparada por un proceso según la reivindicación 6 o 7, en la preparación de un agente detector de trombos. 25 30 35 40 45 50 55 60 NOTA INFORMATIVA: Conforme a la reserva del art. 167.2 del Convenio de Patentes Europeas (CPE) y a la Disposición Transitoria del RD 2424/1986, de 10 de octubre, relativo a la aplicación del Convenio de Patente Europea, las patentes europeas que designen a España y solicitadas antes del 7-10-1992, no producirán ningún efecto en España en la medida en que confieran protección a productos quı́micos y farmacéuticos como tales. 65 Esta información no prejuzga que la patente esté o no incluı́da en la mencionada reserva. 15 2 054 688 16 2 054 688 17 2 054 688 18 2 054 688 19