LEY DE BOYLE TEMPERATURA CONSTANTE LEYES DE LOS
Anuncio
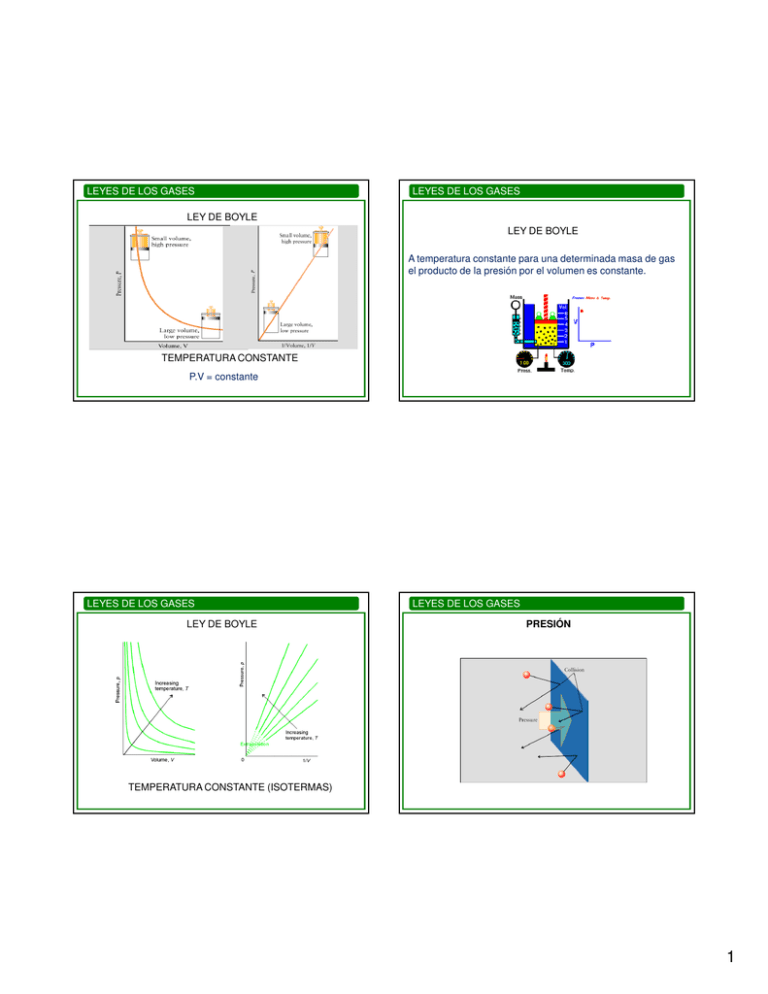
LEYES DE LOS GASES LEYES DE LOS GASES LEY DE BOYLE LEY DE BOYLE A temperatura constante para una determinada masa de gas el producto de la presión por el volumen es constante. TEMPERATURA CONSTANTE P.V = constante LEYES DE LOS GASES LEY DE BOYLE LEYES DE LOS GASES PRESIÓN TEMPERATURA CONSTANTE (ISOTERMAS) 1 LEYES DE LOS GASES LEYES DE LOS GASES Ejemplo: Una masa dada de gas ocupa un volumen de 240 mL a 1,25 atm, ¿cuál sería el cambio de volumen si la presión se llevara a 0,75 atm a la misma T? LEY DE BOYLE SI DISMINUYO EL VOLUMEN: V2 = P1 × V1 = 400mL P2 ∆V = V2 – V1 = 400mL - 240 mL = 160 mL LEYES DE LOS GASES LEYES DE LOS GASES LEY DE CHARLES (PRESIÓN CONSTANTE) 0 OC Patm Termómetro LEY DE CHARLES PRESIÓN CONSTANTE Patm 100 OC Coeficiente de dilatación a presión constante: Aumento relativo del volumen de una masa de gas por cada grado de aumento de temperatura a presión constante. αV = aire Vo (Vt − Vo ) Vo t V100 Vt= volumen a temperatura t 2 LEYES DE LOS GASES LEYES DE LOS GASES LEY DE CHARLES PRESIÓN CONSTANTE LEY DE CHARLES PRESIÓN CONSTANTE (ISOBARAS) A presión constante el volumen de una masa determinada de cualquier gas aumenta en la misma cantidad relativa por grado de aumento de temperatura. Temperatura en oC Vt = Vo + (αv Vo) t = Vo (1 + αv t) A bajas presiones y altas temperaturas: Coeficiente de dilatación a presión constante Vt = Vo + (αv Vo) t αv = 1/273 oC-1 pendientes LEYES DE LOS GASES Vt = Vo + (αv Vo) t = Vo (1 + αv t) LEYES DE LOS GASES LEY DE CHARLES (PRESIÓN CONSTANTE) (I) αv = 1/273 oC-1 V1 V2 = T1 T2 t Vt = Vo 1 + o 273( C ) A presión constante el volumen de una determinada masa de gas es directamente proporcional a su temperatura absoluta. A dos temperaturas: t1 V1 = Vo 1 + o 273( C ) t2 V2 = Vo 1 + o 273( C ) V1 (273 + t1 ) T1 = = V2 (273 + t2 ) T2 (II) 3 LEYES DE LOS GASES LEYES DE LOS GASES LEY DE GAY-LUSSAC (VOLUMEN CONSTANTE) LEY DE GAY LUSSAC VOLUMEN CONSTANTE Coeficiente de compresibilidad a volumen constante: Aumento relativo de la presión de una masa de gas por cada grado de aumento de temperatura a volumen constante. P αP = t(oC) αp = αV = 1/273 oC-1 LEYES DE LOS GASES LEYES DE LOS GASES LEY DE GAY-LUSSAC (VOLUMEN CONSTANTE) coeficiente de variación de presión Pt = Po + (αp Po) t = Po (1 + αp t) Po Pt = To Tt (Pt − Po ) Po t ⇒ Tt Pt = To Po αp = 1/273 oC-1 LEY DE GAY-LUSSAC VOLUMEN CONSTANTE A volumen constante la presión de una determinada masa de gas es directamente proporcional a su temperatura absoluta. P = T constante 4 LEYES DE LOS GASES ISOCORAS LEY DE GAY-LUSSAC LEYES DE LOS GASES VOLÚMENES MOLARES A 0OC Y 1 ATM VOLUMEN CONSTANTE LEYES DE LOS GASES LEYES DE LOS GASES LEY DE AVOGADRO A PRESIÓN Y TEMPERATURA CONSTANTES EL VOLUMEN DE GAS ES DIRECTAMENTE PROPORCIONAL AL NÚMERO DE MOLÉCULAS PV PV 0 0 = = constante T0 T Para 1 mol de gas en CNTP: PV 1atm × 22, 4l / mol = T 273, 2 K PV l × atm = 0,082 T K × mol Presión ECUACIÓN DE ESTADO DEL GAS IDEAL 2 P´ 3 P T 1 P0 0 0 To V0 V Volumen R Para n moles de gas : pV = nR T 5 LEYES DE LOS GASES T = cte. LEYES DE LOS GASES P = cte. V = cte. DENSIDAD DE LOS GASES ¿Cómo se modifican los gráficos cuando cambia la masa de gas? LEYES DE LOS GASES LEYES DE LOS GASES DENSIDAD DE LOS GASES IDEALES δ= m V DENSIDAD DE LOS GASES pV = nR T δ= M ×P RT 6 LEYES DE LOS GASES LEYES DE LOS GASES LEY DE DALTON LEY DE DALTON La presión total en una mezcla de gases es la suma de las presiones parciales de sus componentes. PTOTAL = PA + PB La presión parcial de un componente de la mezcla es la presión que este ejercería si estuviera solo a la temperatura de la mezcla, ocupando todo el volumen de la mezcla. LEYES DE LOS GASES LEYES DE LOS GASES LEY DE DALTON n RT PA = A V PB = nB RT V P = ( nA + nB ) P = nA PA n A = = xA P n PRESIONES PARCIALES RT RT =n V V RT RT + nB = PA + PB V V DIFUSIÓN (LEY DE GRAHAM) Movimiento de un gas a través de otro. M2 vd1 = vd 2 M1 PB nB = = xB P n x A + xB = 1 Cociente de las velocidades de difusión 7 LEYES DE LOS GASES EFUSIÓN Escape de gas a través de un pequeño orificio hacia un espacio evacuado. vef ∝ 1 M 8











