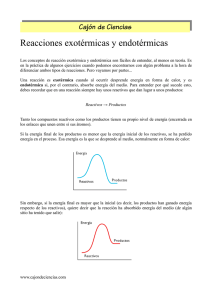
DIAGRAMAS DE ENERGÍA Y ESTADOS DE TRANSICIÓN. La
Anuncio

DIAGRAMAS DE ENERGÍA Y ESTADOS DE TRANSICIÓN. La diferencia de energía entre los reactivos y el Estado de Transición(ET), denominado Energía del Complejo Activado, ΔG≠, determina que tan rápida ocurre la reacción. Una ΔG≠ alta, que implica una diferencia grande entre la Energía de los Reactivos y la Energía del ET, da por resultado una Reacción LENTA, debido a que hay pocas moléculas del reactivo que tengan la suficiente energía para escalar la Barrera Energética. Una ΔG≠ pequeña da por resultado una Reacción Rápida, debido a que casi todas las moléculas reaccionantes son suficientemente Energéticas para escalar la Barrera Energética. La mayoría de las reacciones orgánicas tienen una ΔG≠ en el intervalo de 10 a 35 kCal/mol. Un cambio en las condiciones de reacción afecta a ΔG≠ de dos formas: a) Modificar el nivel de Energía de los reactivos: Reduciendo el nivel de energía, de manera que ΔG≠ se incrementa y R se reduce. Aumentando el nivel de Energía, de manera que ΔG≠ se reduce y R aumenta. b) La Estabilización del Estado de Transición reduce ΔG≠ y aumenta R La Desestabilización del Estado de Transición incrementa ΔG≠ y reduce R. Se acostumbra utilizar los términos Exotérmico y Endotérmico para referirse a las reacciones en las cuales la ΔG• es negativo y positivo respectivamente, aunque termodinámicamente esto no es correcto, ya que los términos se refieren al cambio entálpico, y hay muchas sustancias que no se adaptan a esta simplificación. En las siguientes Figuras se presentan Diagramas de Energía de Reacción Hipotéticos para diferentes situaciones: a) Reacción Exotérmica Rápida (ΔG≠ bajo y ΔG• negativo ) b) Reacción Exotérmica lenta (ΔG≠ alto y ΔG• negativo ) c) Reacción Endotérmica Rápida (ΔG≠ bajo y ΔG• Positivo bajo ) d) Reacción Endotérmica lenta (ΔG≠ Alto y ΔG• positivo ) En las figuras (e),(f) y (g) se muestran los Diagramas de Energía Global para diferentes tipos de reacciones. En la Fig.( e ) se muestra el Diagrama para la reacción del Etileno con el HBr. El producto del paso 1( el Carbocatión ), actúa como reactivo para el paso 2. El intermediario de la Reacción se encuentra en un mínimo de la energía entre los pasos 1 y 2. Primer Estado de Transición ↓ Carbocatión Intermediario ↓ Fig ( e ) En la Fig ( f ), se muestra el Diagrama de Energía Hipotético para una Reacción en dos pasos Exotérmica: Fig ( f ) En la Figura ( g ), se tiene el Diagrama de Energía Hipotético para una Reacción en dos pasos Endotérmica . Fig ( g )