TERMOQUÍMICA A MICROESCALA
Anuncio

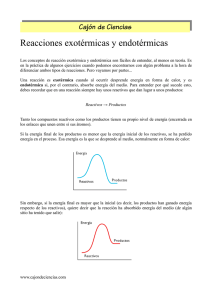
TERMOQUÍMICA A MICROESCALA Estefanía Piles Selma Verónica Piles Selma I.E.S. Enric Soler i Godes Agradecimientos: Esta práctica la realizamos por primera vez en un curso del Cefire titulado: “Química a microescala” impartido por Maria Teresa Climent, a quien tenemos que agradecer su aprobación para poderla reproducir con alumnos, así como su colaboración. En referencia al desarrollo de la práctica con alumnos de 1º de Bachiller del IES Enric Soler i Godes, tenemos que agradecer en primer lugar la participación y colaboración del profesor Joan Beferull por facilitarnos los recursos para llevarla a cabo, así como la colaboración de los alumnos. 1 Introducción: La termoquímica estudia los cambios de energía asociados a las transformaciones químicas. Cuando en una reacción química los reactivos (R) y los productos (P) se encuentran a la misma presión (frecuentemente la presión atmosférica), el calor puesto en juego durante el proceso (R → P) se denomina variación de entalpía (∆H = Qp). A partir de ello, se distinguen: 1) Procesos químicos exotérmicos, donde se desprende calor y ∆H<0. 2) Procesos químicos endotérmicos, donde se absorbe calor y ∆H>0. La variación de entalpía (∆H) puede determinarse experimentalmente por medida del calor involucrado en los procesos químicos, con un equipamiento relativamente sencillo y eficaz como es un CALORÍMETRO. A nivel cualitativo, en la presente práctica, estudiaremos la variación de entalpía mediante la observación experimental de variaciones de temperatura durante el proceso químico. De manera que distinguiremos: 1) Procesos químicos exotérmicos, cuando se observe un aumento de temperatura. 2) Procesos químicos endotérmicos, cuando se observe una disminución de temperatura. A este estudio cualitativo, añadiremos un procedimiento de trabajo a nivel de microescala, que a diferencia de la forma habitual en el laboratorio, utiliza pequeñas cantidades de sustancias y material más pequeño, con el fin de utilizar cantidades mínimas de reactivos y generar las mínimas cantidades de residuos. Objetivo: Distinguir cualitativamente un proceso exotérmico de uno endotérmico, mediante un procedimiento a microescala, incluyendo la construcción casera del calorímetro y del imán agitador. Relación del tema propuesto con el curriculo del curso: Está relacionado con el concepto de calor de la asignatura de Física y Química de 1º de Bachiller. 2 Material y recursos necesarios: • • • • • • • • • • • Vaso de precipitados de 50 mL. Termómetro. Material poroso. Pipeta Pasteur. Clip. Mechero Bunsen. Pinzas. Cúter. Papel de aluminio. Probeta de 10 mL. Agitador magnético. Reactivos: • • • • Disolución de NaOH 1M. Disolución de HCl 1.2M. Agua destilada. Nitrato potásico. Normas de seguridad: • • En la construcción del imán agitador, el material que ha estado en contacto con llama (pipeta Pasteur) está extremadamente caliente y puede provocar quemaduras. Conviene manipularlo con pinzas y dejar enfriar antes de cogerlo con los dedos. Deben utilizarse gafas protectoras, guantes y campana de ventilación durante la preparación de las disoluciones. Procedimiento: Construcción del calorímetro: 1. Cortar con el cúter un cuadrado del material poroso de manera que en el centro se pueda vaciar un cilindro, hueco, en el que se introduzca el vaso de precipitados de 50 mL. El material vaciado servirá de tapa del vaso de precipitados. Tanto el soporte como la tapa se envuelven con papel de aluminio para evitar que el material poroso se vaya deshaciendo al manipularlo. 2. Introducir el termómetro a través de la tapa, de manera que quede a una altura aproximadamente la mitad del vaso. 3 Construcción del imán agitador: 1. Cortar un trocito de clip de aproximadamente 0.5 cm. 2. A partir de una pipeta Pasteur, a la llama de un mechero Bunsen, se sella el capilar de la pipeta. 3. Colocar el trocito de clip dentro de la pipeta hasta llegar al capilar. Calentar el vidrio por el otro extremo del capilar para derretir y separar la parte que envuelve el clip del resto de pipeta. 4. Sellar a la llama el extremo recién cortado. 4 A) DETERMINACIÓN DE LA VARIACIÓN DE ENTALPÍA ASOCIADA A LA NEUTRALIZACIÓN ENTRE UN ÁCIDO FUERTE Y UNA BASE FUERTE. HCl (ac) + NaOH (ac) → NaCl (ac) + H2O (l) 1. Introducir 10 mL de una disolución NaOH 1M en el calorímetro casero (con el imán agitador), taparlo y medir la temperatura (Tb). 2. Tomar 10 mL de HCl 1.2M, medir su temperatura (Ta), con el termómetro limpio, y añadirlos al calorímetro. 3. Conectar el agitador magnético y observar atentamente la evolución de la temperatura de la mezcla. 4. Anotar el valor máximo alcanzado por la mezcla (Te). B) DETERMINACIÓN DE LA VARIACIÓN DE ENTALPÍA ASOCIADA A LA DISOLUCIÓN DE UN SÓLIDO IÓNICO. 1. Introducir 9 mL de agua destilada junto con el imán agitador y anotar la temperatura (Td). 2. Se pesan, con la máxima precisión, 1g de KNO3, se introduce en el calorímetro y se observa la variación de temperatura, anotando el valor de ésta una vez se haya estabilizado (Te). 5 Tiempo necesario para desarrollar esta práctica: Preparación de reactivos y organización del material: 30 minutos. Realización de la práctica: 1 sesión Cuestiones para los alumnos y recopilación de resultados: • • • ¿Cuál es la temperatura inicial de cada reactivo? ¿Cuál es la temperatura de equilibrio de la mezcla? ¿Es un proceso exotérmico o endotérmico? 6 Recopilación de los resultados: EXPERIENCIA 1 GRUPOS Tb(ºC) 1 2 3 4 5 20 21 22 19 22 Ta(ºC) 19 19 20 20 20 Exotérmica/ Te(ºC) Endotérmica 22 22 24 24 25 Exotérmica Exotérmica Exotérmica Exotérmica Exotérmica EXPERIENCIA 2 Td(ºC) Te(ºC) Exotérmica/ Endotérmica 18 19 18 18 19 14 13 13 12.5 14 Endotérmica Endotérmica Endotérmica Endotérmica Endotérmica Análisis de las respuestas de los alumnos: Los alumnos quedaron muy sorprendidos en la construcción casera del calorímetro y del imán agitador, así como en su aplicación respecto al calorímetro habitual en laboratorio. Además, la mayor parte de los alumnos entendieron el concepto de microescala, la importancia de su aplicación y el objetivo de la práctica. Las respuestas de los alumnos se consiguieron mediante la siguiente tabla: EN DE MUY DE MUY EN DESACUERDO DESACUERDO ACUERDO ACUERDO ¿Te ha parecido interesante la práctica? ¿Se han cumplido los objetivos previstos? ¿Has entendido la diferencia entre reacción endotérmica y exotérmica? ¿Has entendido el concepto de microescala? ¿Has entendido la función del calorímetro? ¿Recomendarías la realización de esta práctica en cursos posteriores? Las condiciones propuestas para el desarrollo de la práctica han sido adecuadas y muy interesantes para los alumnos. 7