PRÁCTICA N° 3
Anuncio

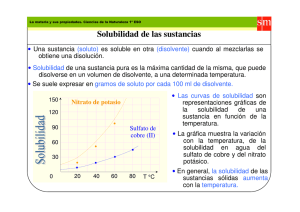
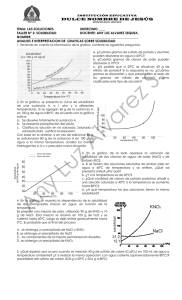
PRÁCTICA N° 3 SOLUBILIDAD (CURVA DE SOLUBILIDAD Y CRISTALIZACIÓN FRACCIONADA) I. OBJETIVO GENERAL Establecer de forma experimental, la dependencia de la solubilidad con la temperatura. Utilizar la variación de esta dependencia, para obtener sustancias puras por cristalización fraccionada. II. OBJETIVOS ESPECÍFICOS Al finalizar la práctica el alumno será capaz de: 1. Definir solución y solubilidad. 2. Distinguir los tipos de soluciones según el estado físico y de acuerdo a la cantidad relativa de sus componentes. 3. Determinar el efecto de la temperatura en la solubilidad del nitrato de potasio (KNO3) y cloruro de sodio (NaCl). 4. Construir una curva de solubilidad para cada compuesto (KNO3 y NaCl). 5. Utilizar la técnica de cristalización fraccionada, para purificar una muestra de KNO3 contaminada con NaCl. 6. Calcular el porcentaje de sustancia pura que se obtiene por cristalización fraccionada. MARCO TEÓRICO Una solución es una mezcla homogénea de composición variable pero limitada por la solubilidad. Se dice que es una mezcla porque tiene más de un componente (soluto y solvente) que no reaccionan entre sí. La homogeneidad se debe a la uniformidad en el sistema, es decir que presenta una sola fase, por ejemplo: un volumen de aire representa un sistema de una sola fase que contiene más de un componente (H2, N2,O2, Ar, Xe, etc). 41 Tipos de soluciones. Según el estado físico: Soluciones Sólidas Gas en sólido Líquido en sólido Sólido en sólido Soluciones Gaseosas Gas en gas Sólido en gas Líquido en gas Soluciones Líquidas Gas en líquido Sólido en líquido Líquido en líquido Ejemplo H2 gaseoso en paladio Empastes dentales (mercurio en plata) Bronce (zin/cobre) Ejemplo Aire Polvo en aire Vapor de agua en aire Ejemplo CO2 en soluciones (Coca-Cola) Azúcar en agua Alcohol en agua Según la cantidad relativa de sus componentes: a) Diluída b) Concentrada No Saturada c) Saturada d) Sobresaturada a) Solución diluída es la que contiene una cantidad relativamente pequeña de soluto. b) Solución concentrada es la que contiene una cantidad relativamente grande de soluto, pero sin llegar a la saturación. De acuerdo a lo anteriormente expuesto puede deducirse que una solución no saturada contiene menor cantidad de soluto que la que es capaz de disolverse. c) Solución saturada contiene la máxima cantidad de soluto que se disuelve en un disolvente en particular, a una temperatura específica. d) Solución sobresaturada, es la que contiene más soluto que la contenida en una solución saturada del mismo soluto a la misma temperatura. Estas soluciones no son muy estables, una parte del soluto se separa de la disolución sobresaturada en forma de cristales, dando lugar, el proceso inverso de disolución (la cristalización). 42 Como diferencias estas soluciones: • • • Si el soluto se disuelve todo o parte de él, la solución es no saturada. Si el soluto no se disuelve ni produce precipitación de lo que estaba disuelto, es una solución saturada. Si el soluto añadido produce la cristalización de una parte del soluto que estaba disuelto, es una solución sobresaturada. Solubilidad y factores que afectan la solubilidad. El término solubilidad, se define como la máxima cantidad de un soluto que se puede disolver en una cantidad determinada de disolvente, a una temperatura especifica, se expresa ordinariamente como los gramos de soluto contenidos en 100 gramos de disolvente. No todas las sustancias son solubles en las demás sustancias. Algunos solutos son más difíciles de disolver que otros, esto dependerá de algunos factores como: 1. Las propiedades del soluto y del disolvente. Cuando una sustancia se disuelve en otra, las partículas del soluto se dispersan en el disolvente. Con frecuencia hemos escuchado la frase “lo semejante disuelve a lo semejante”, lo que es de gran ayuda para predecir la solubilidad de una sustancia en un determinado disolvente. Esta expresión significa que es probable que dos sustancias cuyas fuerzas intermoleculares son del mismo tipo y magnitud sean solubles entre sí. Por lo tanto, los compuestos iónicos (polares) casi siempre son solubles en disolventes polares (sal en agua), y los compuestos covalentes (no polares o débilmente polares) se disuelven en disolventes no polares (tetracloruro de carbono en benceno). 2. La temperatura. Según la definición de solubilidad se puede inferir que la temperatura afecta la solubilidad de la mayoría de las sustancias, este efecto debe determinarse en forma experimental. Por lo general, la solubilidad de los sólidos aumenta con el incremento de la temperatura. Sin embargo, hay algunas excepciones, como lo indica el siguiente cuadro: TABLA 14. Dependencia de la solubilidad con la temperatura. Compuesto Gramos de soluto en 100 gr de agua Nombre Fórmula a 0°C a 50°C a 100°C Hidróxido de potasio Nitrato de potasio Clorato de potasio Cloruro de sodio Cromato de calcio Hidróxido de calcio Sulfato de zinc KOH KNO3 KClO3 NaCl CaCrO4 Ca(OH)2 ZnSO4 97,00 13,30 3,30 35,63 4,50 0,14 41,9 144,00 85,50 19,30 36,67 1,12 0,10 76,80 178,00 246,00 57,00 39,12 0,42 0.06 80,80 43 3. La presión. Las soluciones formadas sólo por líquidos y sólidos no se ven afectadas en forma apreciable por la presión. Sin embargo, las soluciones de gases en líquidos o gas en gas tienen una influencia directa de la presión. Curvas de solubilidad. La dependencia de la solubilidad con la temperatura puede expresarse gráficamente mediante curvas de solubilidad (Figura 15), donde en el eje de las ábsidas se marca la temperatura y en el eje de las ordenadas, la solubilidad. Es el mejor procedimiento para observar inmediatamente no sólo el valor de solubilidad sino su variación con la temperatura. Solubilidad g/100 g de agua Variación de la solubilidad del Nitrato de Plomo con la Temperatura 120 100 A B 40 60 N 80 60 40 20 0 0 20 80 100 Temperatura °C Fig. 15 Curva de solubilidad del nitrato de plomo en agua. En el gráfico superior el punto B indica que a 60°C una solución saturada de nitrato de plomo contiene 95 gramos de soluto en 100 gramos de agua. La línea ABN indica que al aumentar la temperatura se produce una solución no saturada (punto N) y que, en cambio, por cuidadoso enfriamiento, para evitar que se deposite parte del soluto, la solución originalmente saturada se convertirá en sobresaturada (punto A). El punto N indica que la solución está a 80°C, a esa temperatura podría contener 114 gramos de soluto en cada 100 gramos de agua, y sólo contiene 95 gramos , por lo tanto se trata de una solución no saturada. El punto A muestra que la solución, a 40 °C, contiene 95 gramos, según el gráfico, a esa temperatura sólo debería tener 75 gramos, de lo que se deduce que se trata de una solución sobresaturada. Por medio de la curva de solubilidad se puede determinar gráficamente la solubilidad de las sustancias a diferentes temperaturas, realizar cálculos necesarios para llevar a cabo una cristalización fraccionada, empleada para la purificación de las sustancias sólidas. 44 Ejemplo: Se necesita recristalizar 1 Kg de CuSO4. Calcular en qué cantidad de agua debe ser disuelto y cuál será el rendimiento de la sal recristalizada, si la disolución se verifica a 100°C enfriándola después hasta 15°C. La solubilidad a 100°C, en 100 g de agua es de 73,6 g; y a 15°C, es de 20,5 g. Si 73, 6 gramos de sal se disuelven en 100 gramos de agua, ¿cuánto se necesita de agua para disolver 1 Kg de sal? 1000 g sal * 100 g de agua = 1359 g de agua 73,6 g sal Al enfriar la solución saturada desde 100°C a 15°C, la cantidad de sal que se cristaliza es igual a la diferencia de solubilidades a estas temperaturas, ya que a 15°C sólo quedará disuelto 20, 5 g de sal. 73,6 g – 20, 5 g = 53,1 g Si al enfriar una solución preparada a partir de 73,6 g de sal se cristaliza 53,1 g de sal, ¿Cuánto se cristalizará a partir de 1000 g de sal? 53,1 g de sal * 1000g de sal = 722 g de sal 73,6 g de sal El rendimiento teórico debe ser: % Rendimiento = sal cristalizada * 100% (3) cantidad inicial de la sal De manera, que el rendimiento de CuSO4 recristalizado constituye 72,2%. Cristalización fraccionada. La cristalización fraccionada es la separación de una mezcla de sustancias en sus componentes puros con base a sus diferentes solubilidades. Como ya se había mencionado la mayor parte de las sustancias sólidas, especialmente las sales, aumentan su solubilidad con la temperatura. Este aumento puede ser: a) Rápido; Pb(NO3)2, KNO3, K2Cr2O7. b) Lento, KCl. c) Muy pequeño, NaCl. Sin embargo, existen compuestos, para los cuales su solubilidad disminuye con la temperatura. Esto ocurre con algunos compuestos como el hidróxido de calcio, el cromato de calcio, el acetato de calcio, el carbonato de litio , el acetato de estroncio y el sulfato de cerio. Estas marcadas diferencias de la solubilidad con respecto a la temperatura pueden utilizarse para llevar a cabo la cristalización fraccionada. La cristalización de las sustancias cuya solubilidad disminuye en función de la temperatura puede lograrse bajando la temperatura de la solución saturada (recristalización). Si la temperatura 45 disminuye lentamente, las sustancia cristaliza en forma de cristales grandes, si el enfriamiento es rápido, se forman cristales pequeños. Los cristales pequeños son más puros, mientras que el crecimiento de cristales grandes va acompañado de captura de cantidades pequeñas de la solución madre que contiene impurezas provenientes de otras sustancias. Para las sustancias cuya solubilidad aumenta con el descenso de la temperatura, la recristalización se lleva a cabo en orden inverso: la solución se satura con la sustancia dada a una temperatura lo más baja posible y después se calienta hasta ebullición. A veces hay que filtrar la solución saturada a 100°C para eliminar diferentes impurezas (polvo, lodo, etc). La sustancia recristalizada se separa de la solución madre por filtración al vacío (succión). Esto es necesario porque en la filtración ordinaria queda una gran parte de la solución madre sobre la superficie de los cristales (lo que contamina el producto) y hace falta secar por mucho tiempo los cristales. PARTE EXPERIMENTAL Solubilidad del KNO3. • • • • Pesar en un vaso de 10 mL 1,0000 g de KNO3 y por separado en papel, 4 porciones de 1g exactamente pesados. Agregar al vaso con KNO3 4 mL de agua, agitar hasta disolver y tomar la temperatura a la que se disuelve. Cuando toda la sustancia este disuelta, añadir una nueva porción (1g) y colocar en la plancha de calentamiento, agitar hasta que se disuelva y tomar la temperatura. Repetir el procedimiento hasta agregar las cuatro porciones de KNO3. Solubilidad del NaCl. • • • • • Pesar en un vaso de 50 mL 6,0000 g de NaCl y por separado pesar en papel, 2 porciones de 0,5000 g y 2 porciones de 0,1000 g (exactamente pesados). Agregar al vaso con NaCl 20 mL de agua, agitar hasta disolver y tomar la temperatura a la que se disuelve. Cuando toda la sustancia este disuelta, añadir una nueva porción (0,500 g) y colocar en la plancha de calentamiento, agitar hasta que se disuelva y tomar la temperatura. Repetir el procedimiento hasta agregar las cuatro porciones de NaCl (0,5000; 0,5000; 0,1000 y 0,1000). Construya en una misma gráfica, las curvas para las dos sales. Purificación de KNO3 contaminado con NaCl.(Figura 16) • • Pesar en un vaso de 10 mL , 5 g de muestra contaminada. Agregar 6 mL de agua en el vaso con la muestra. 46 • • • • • • Calentar a 80°C hasta completa dilución. Enfriar con baño de hielo (0°C). Pesar un papel de filtro. Filtrar al vacío para separar la solución de los cristales. Secar los cristales en estufa a 100°C. Pesar los cristales y calcular el porcentaje de KNO3 en la muestra. Fig. 16 Dibujo esquemático para la purificación de KNO3 contaminado con NaCl. 47 DATOS EXPERIMENTALES TABLA 15 . Solubilidad y Temperatura de disolución del KNO3 y NaCl Compuesto Cantidad pesada Solubilidad Temperatura de (g) g de soluto/100g de solvente disolución (°C) 1,0000 2,0000 KNO3 3,0000 4,0000 5,0000 6,0000 6,5000 NaCl 7,0000 7,1000 7,2000 Volumen de agua para la solubilidad del KNO3 ________________________ Volumen de agua para la solubilidad del NaCl ________________________ Masa de la muestra contaminada___________________________________ Masa del papel de filtro ___________________________________________ Masa de vidrio de reloj _____________________________ Masa de vidrio de reloj + papel de filtro + cristales secos _____________________________ RESULTADOS Masa de los cristales ____________________________ Porcentaje de KNO3 en la muestra ______________________________ CUESTIONARIO 1. ¿ Por qué el sulfato de calcio se incluye en el grupo de las sustancias con solubilidad anómala? 2. Tres frascos contienen soluciones saturada, sobresaturada y no saturada de la misma sustancia. ¿Cómo determinar qué solución hay en cada frasco? 3. A partir de los siguientes datos trazar la curva de solubilidad del Pb(NO3)2 y determinar su solubilidad a 37°C Temperatura °C 10 Solubilidad, g/100g de agua 44,5 20 52,2 30 60,8 50 78,6 60 88,0 70 97,6 4. La solubilidad de una sal es igual a 64,7 y 13,8 g/ 100g de agua a 80°C y 17°C, respectivamente. ¿Qué cantidad de sal sólida y agua hace falta tomar para obtener 1Kg de la sal recristalizada? La solución se calienta a 80°C y se enfría hasta 17°C. 48 BIBLIOGRAFIA 1. CHANG, R y COLLEGE, W. Química. Séptima edición. McGraw-Hill, México, 2002. 2. DAUB, W y SEESE, W. Química. Séptima edición. Prentice Hall, México, 1996. 3. BRICEÑO, C y CÁCERES, L. Química. Primera edición. Editorial Educativa, BogotáColombia, 1994. 4. PRETRUCCI, HARWOOD, y HERRING, G. Química General. Octava edición. Prentice Hall, Madrid, 2003. 5. MOORE, KOTZ, STANITSKI, JOESTEN y WOOD. El Mundo de la Química. Segunda edición, Addison Wesley Longman, México, 2000. 6. MARTÍN, D. Química, Disoluciones. Segunda edición. Caracas,1981. 49