TALLER DESESCOLARIZACIÓN NOVENO (4º PERIODO)
Anuncio

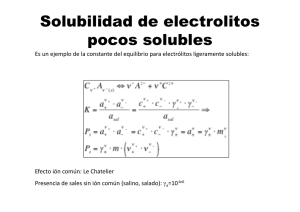
TALLER DESESCOLARIZACIÓN NOVENO (4º PERIODO) Tema: SOLUCIONES Actividades: 1. MOL (3%) Investigar El significado de los siguientes conceptos: mol, peso atómico, peso molecular (masa molar). Cómo se determina cada uno de ellos (5%) Resolver los siguientes ejercicios: ¿Cuál es el peso atómico del Hierro (Fe)? ¿Cuántas moles de hierro (Fe) hay en 350 g.? ¿Cuál es la masa molar del azúcar (sacarosa: C12H22O11)? ¿Cuántas moles de azúcar hay en los 20 g. de azúcar que le agrego a un tinto? 2. DENSIDAD (5%) Investigar El significado de los siguientes conceptos: densidad, la fórmula que relaciona densidad con masa y volumen. Una tabla con la densidad de las siguientes sustancias: agua, alcohol metílico, gasolina, hierro, plomo. La equivalencia de litros a m3, de litros a ml, de mililitros a cm3, La equivalencia de kilogramos a gramos., de kilogramos a libras, de kilogramos a toneladas. (5%) Resolver los siguientes ejercicios: A cuantos gramos corresponden a) 1.7 kg; b) 2.3 lb. ¿ 1.5 L de agua equivale a cuanto a) g.; b) kg 3. SOLUCIONES (10%) Investigar las siguientes unidades de concentración con su fórmula Molaridad Molalidad Fracción molar Porcentaje volumen/volumen Porcentaje masa/volumen Partes por millón Por cada unidad de concentración escribir dos ejemplos que expliquen cómo se usan (en internet se encuentran fácilmente ejemplos de cada tipo). (22%) Resolver los siguientes ejercicios: (3%) A 100 g de sal de cocina (NaCl) se agregan 300 ml de agua. Indique a) la Molaridad. de la solución. (asuma que el soluto no afecta el volumen de la solución); b) la molalidad. (4%) Una botella de 2L de ácido sulfúrico (H2SO4) con tiene en el rótulo la información 1 M. ¿Cuántas moles y gramos de H2SO4 hay en esta botella? (5%) Se disuelven 450 g de KNO3 en 2 kg de agua. Determine a) la Molalidad; b) la fracción molar; c) el porcentaje masa/masa; porcentaje masa/volumen. (5%) Se prepara una solución agregando 200 g. de azúcar y luego adicionando 600 ml agua. Indique cual es la a) Molaridad; b) Molalidad (Ten en cuenta que debes cambiar las unidades del agua de ml a kg); c) Fracción molar; d) Porcentaje masa/vol. (asuma que el soluto no afecta el volumen de la solución). (4%) En una ciudad muy contaminada se determina que la concentración de CO2 en el aire es de500 ppm. ¿Cuántos g de CO2 hay en una oficina de 32m3? 4. FACTORES QUE AFECTAN LA SOLUBILIDAD (10%) Investigar Que es la solubilidad De qué manera la presión, la temperatura y la naturaleza del soluto y el solvente afectan la solubilidad y elabora un trabajo escrito con lo investigado. (20%) Realizar el taller adjunto: “Factores que afectan la solubilidad” 4. CURVAS DE SOLUBILIDAD (25%) Realiza el siguiente taller utilizando las gráficas de solubilidad del Taller “Factores que afectan la solubilidad” A. (10%)Responde Falso O Verdadero y explica tu respuesta: o Todas las soluciones saturadas tienen a la misma temperatura la misma cantidad de soluto en 100 ml de agua. o Siempre que se calienta una solución saturada esta queda insaturada B. (15%)Resuelve el siguiente problema o Si se prepara una solución de 25 g. de KCl en 100 ml de agua a 20°C ¿Cómo se encuentra la solución? o Si agrego 20 g más de KCl ¿cómo queda la solución? ¿Aparece precipitado? ¿Cuantos gramos? o ¿A qué temperatura mínima tengo que calentar la solución anterior para que quede insaturada? o Si por último agrego 30º ml de agua a la temperatura hallada en el punto anterior, ¿Cuántos gramos de KCl tengo que adicionar para que la solución quede saturada?