FUERZAS INTERMOLECULARES
Anuncio

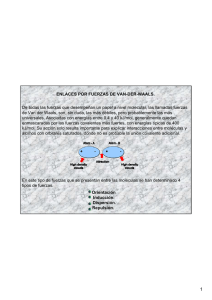
FUERZAS INTERMOLECULARES Fuerzas: intramoleculares vs. intermoleculares Fuerzas intramoleculares: • Mantienen unidos a los átomos dentro de una molécula. • Son el origen de los enlaces químicos. • Determinan las propiedades químicas de un compuesto. Fuerzas intermoleculares: • Se dan entre moléculas y no involucran la formación de enlaces químicos. • Las fuerzas atractivas son de origen electrostático. • Determinan las propiedades físicas de un compuesto. 1 Fuerzas: intramoleculares vs. intermoleculares Enlace covalente (fuerte) Interacción intermolecular (débil) HCl (g) → H (g) + Cl (g) ΔH = 431 kJ/ mol (relac. con F. intramolec.) HCl (l) → HCl (g) ΔH = 16 kJ/ mol (relac. con F. intermolec.) ⇒ F. intramoleculares >> F. intermoleculares Energía de Interacción Radio de van der Waals Energía de repulsión (VR) Energía de interacción total (V) Energía de atracción (VA) Distancia entre centros de partículas (r) Distancia de mínima energía (r0) Distancia de mayor aproximación (ra) 2 Estado de agregación y F. intermoleculares enfriar o comprimir gas calentar o reducir la presión enfriar calentar líquido sólido El estado de agregación de una sustancia depende del balance entre la energía cinética (Ec) y la energía potencial de interacción entre moléculas (V) (relacionada con las fuerzas intermoleculares) GAS: energía cinética >> energía pot. intermolecular LÍQUIDO: energía cinética ≈ energía pot. intermolecular SÓLIDO: energía cinética << energía pot. intermolecular Algunas propiedades que están afectadas por las fuerzas intermoleculares • Punto de fusión y ΔHfus • Punto de ebullición y ΔHvap • Presión de vapor • Solubilidad • Densidad • Viscosidad Factores que influyen en las fuerzas intermoleculares: - Distribución de densidades electrónicas - Electronegatividad de los elementos cuyos átomos forman las moléculas - Momento dipolar - Forma de la molécula - Tamaño de la molécula 3 Las moléculas interaccionan entre sí a través de fuerzas de origen electrostático y mecanocuántico d A B FAB FBA FAB = -FBA = F Interacciones intermoleculares: se aproximan suponiendo interacción entre 2 cuerpos y promediando sobre todas las orientaciones posibles V es la suma de las energías de interacción Vij(rij) entre los pares de moléculas i y j. N V ≈ ∑ ∑ v ij (rij ) i=1 j> i Se considera que una molécula es un dipolo con una determinada polarizabilidad 4 Fuerzas intermoleculares atractivas • Fuerzas ión- dipolo: intervienen especies cargadas - ión- dipolo permanente - ión- dipolo inducido • Fuerzas entre moléculas covalentes: - dipolo- dipolo - dipolo- dipolo inducido - de dispersión, o fuerzas de London - puentes de hidrógeno Cuanto más intensas sean las fuerzas intermoleculares mayor energía se necesita para vencerlas. Entonces el P. Ebullic. y el P. Fusión del compuesto serán mayores… Interacciones ión- dipolo -Se dan entre cationes o aniones y moléculas polares (dipolos; μ ≠ 0) δμ=q×d μ δ+ - No ocurren en sustancias puras, sino que son adecuadas para explicar procesos como la solubilidad de sólidos iónicos en solventes polares q- q+ Ej: hidratación de iones Na+ y Cl- - La energía potencial de interacción es de la forma: Vi−d (r ) ∝ − qμ r2 5 Interacciones ión- dipolo inducido -Se dan entre cationes o aniones y moléculas no polares (μ = 0) + + + - - + Ej: K+ y SF6 - En general son más débiles que las fuerzas ión-dipolo permanente. Por eso los iones son muy solubles en solventes polares y poco solubles en solventes no polares. - La energía potencial de interacción es de la forma: Vi−di (r ) ∝ − qα r4 Interacciones dipolo- dipolo - Se dan entre moléculas polares - Dependen de la orientación relativa de las moléculas Si las rotaciones de las moléculas están impedidas, la energía potencial de interacción es de la forma: V (r ) ∝ − d− d ,c μμ r 1 2 3 μ: momento dipolar r: dist. entre moléculas (para hallar la fuerza se hace la derivada del potencial en fc de la dist r) sólido líquido 6 Interacciones dipolo- dipolo Si las rotaciones de las moléculas son libres (en gases o líquidos): La energía potencial de interacción es de la forma: V (r ) ∝ − d− d μμ r 2 1 2 2 6 μ: momento dipolar r: dist. entre moléculas Interacciones dipolo- dipolo Influyen en la solubilidad y en los puntos de fusión y ebullición Ej: ¿Cuál de estos dos compuestos tendrá mayor PE? Este tiene mayor punto de ebullición debido a que la molécula tiene mayor μ y por lo tanto las interacciones son mayores ¿Y el 1,1 – dicloroeteno? 7 Interacciones dipolo- dipolo PMR μ (D) PE (K) > polaridad > fuerzas de atracción > punto de ebullición Interacciones dipolo- dipolo inducido - Se da entre moléculas polares y no polares. - Las moléculas polares (μ ≠ 0) pueden inducir momentos dipolares en moléculas no polares. + - + - + - - + + - - + La polarizabilidad (α) de una molécula indica la facilidad con que la nube electrónica de ésta puede deformarse debido a la presencia de otra molécula. Depende del PMR y de la forma de la molécula. 8 Interacciones dipolo- dipolo inducido La energía potencial de interacción es de la forma: V (r ) ∝ − d − di μα r 2 1 2 6 μ: momento dipolar α: polarizabilidad r: dist. entre moléculas Estas interacciones son las que permiten que compuestos no polares como el O2 o el CO2 puedan disolverse en agua H2O O2 Interacción atractiva Interacciones de dispersión (London) Se dan entre moléculas no polares. En las moléculas no polares en promedio la distribución de la nube electrónica es homogénea, pero debido a que los electrones están en continuo movimiento en un momento se produce una distribución asimétrica de cargas y se produce un dipolo instantáneo. Los dipolos instantáneos inducen dipolos en moléculas vecinas (llamados dipolos inducidos). atracción dipolo instantáneo dipolos inducidos Esto da lugar a las fuerzas de dispersión, también llamadas fuerzas de London. F. London 9 Interacciones de dispersión (London) La energía potencial de interacción es de la forma: V (r ) ∝ − disp αα r 1 6 2 α: polarizabilidad r: dist. entre moléculas Estas interacciones están presentes en todas las sustancias, pero en general son predominantes en los casos en que μ = 0. La existencia de estas interacciones explica por qué los gases nobles pueden existir en estado líquido, o por qué es posible licuar al N2 y el O2. Interacciones de dispersión (London) > PM > fuerzas de atracción > puntos de fusión y de ebullición 10 Interacciones de dispersión (London) Los hidrocarburos presentan estas interacciones: CH4 C2H6 C6H14 PMR creciente Interacc. de dispersión crecientes ⇒ Puntos de ebullición y fusión crecientes! Temperatura de ebullición (ºC) Interacciones de dispersión (London) C18H38 C5H12 C15H32 Nº de electrones (∝ PMR) Puntos de ebullición y de fusión: aumentan con el PM 11 Interacciones de dispersión (London) Dependen de la forma de las moléculas no polares C5H12 n-pentano PE = 36,1 °C dimetilpropano PE = 9,5 °C La forma alargada del n- pentano favorece la interacción y el desarrollo de dipolos inducidos. Las interacciones de dispersión son mayores en el n- pentano Interacciones de van der Waals J. van der Waals La energía potencial atractiva para dos moléculas neutras es la suma de tres términos: Energía neta de atracción = V d-d + V d-di + Vdisp Cada uno de estos términos es proporcional a 1/ r6. La fuerza atractiva que surge de estos tres efectos es proporcional a 1/ r7 y se llama fuerza de van der Waals. 12 Importancia relativa de las interacciones de van der Waals en diferentes sustancias Puentes de hidrógeno Se forman entre un átomo de H que forma un enlace covalente polar con un átomo muy electronegativo (F, O, N) y un par de electrones libres de un átomo muy electronegativo cercano (F, O, N) F δ- δ+ F—H δδ+ F—H H - Son más débiles que un enlace químico - Son más fuertes que las interacciones dipolo-dipolo y de dispersión - Tienen una dependencia complicada con la distancia (la dist de los puentes de H es de aprox 200 pm) - A veces se incluyen con las fuerzas de van der Waals. 13 Puentes de hidrógeno en el agua Puente de H Cada molécula de H2O puede estar rodeada como máximo por 4 moléculas de H2O vecinas (formando así 4 puentes de H) Puntos de ebullición En general, los PE de hidruros de no metales de un mismo grupo aumentan con el PM. Pero: hay algunas excepciones. La anomalía en los PE de H2O, NH3 y HF se debe a que éstos forman puentes de H… 14 ¿Por qué flota el hielo en agua líquida? Rta: porque la densidad del hielo es menor que la del H2O líquida Pero… ¿Por qué el H2O presenta este comportamiento anómalo? Debido a los puentes de H Puentes de hidrógeno en el agua AGUA LÍQUIDA HIELO En el hielo hay más espacio vacío entre moléculas, por eso tiene menor densidad que el H2O (l) 15 Puentes de hidrógeno en otras especies Puentes de H entre moléculas de ácido acético Puentes de H entre moléculas de etanol Puente de H entre una molécula de H2O y una de metanol Estructura del ADN Posee una estructura de doble hélice Hay interacciones de tipo de puente de H entre las bases nitrogenadas del ADN! 16 Estructura de las proteínas Los puentes de hidrógeno juegan un rol fundamental: Estructura de hoja β Estructura de hélice α Interacciones intermoleculares No son excluyentes entre sí. ⇒ Si una sustancia presenta interacciones de tipo de puente de hidrógeno, también puede presentar interacciones de tipo dipolo- dipolo (si es polar) y presentará interacciones de dispersión (London) Si tiene interacciones tipo dipolo- dipolo, presentará también interacciones de dispersión (London) Las fuerzas de dispersión (o de London) están actuando siempre entre las moléculas En moléculas con μ ≠ 0, pueden ser más intensas que las dipolo- dipolo si el PM es medio o alto, o si la forma de las moléculas favorece la interacción 17 18 Resumen de las interacciones Aumenta la interacción • Ión- dipolo (1/r2) ∗ (400- 600 kJ / mol) • Puente de H (distancia fija ~200 pm) (10- 40 kJ / mol) ∗ • Dipolo- dipolo (1/r3 ó 1/r6) ∗ (5- 25 kJ / mol) Funciones inversas de la distancia a varias potencias • Ión- dipolo inducido (1/r4) ∗ (3- 15 kJ / mol) • Dipolo- dipolo inducido (1/r6) ∗ (2- 10 kJ / mol) • Dipolo inducido- dipolo inducido (1/r6) ∗ (0,05 – 40 kJ / mol) ¿La molécula está formada por iones? Ión-dipolo Sí No No ¿Hay enlaces N-H, O-H o F-H? No ¿La molécula es polar? Sí Sí Puentes de H Dispersión Dipolo-dipolo 19 Ejercicio integrador: ¿Qué sustancia de cada par es la de mayor punto de ebullición? Indique todas las interacciones intermoleculares que presenta cada una de las moléculas. a) ICl - Br2 b) XeF4 - XeF2 d) CO2 - NO2 e) O2 - O3 c) HCl - HBr f) H2O - HF (μ(H2O) > μ(HF)) Energía de Interacción Radio de van der Waals Energía de repulsión (VR) Energía de interacción total (V) Energía de atracción (VA) Distancia entre centros de partículas (r) Distancia de mínima energía (r0) Distancia de mayor aproximación (ra) 20 Interacciones repulsivas Vrep ≈ A rn Son de muy corto alcance Potenciales intermoleculares Potencial de esferas rígidas 0 para r ≥ d V= ∞ para r ≤ d Potenciales intermoleculares V = Vatr + Vrep V= A B − rn r6 Potencial de Lennard- Jones ⎡⎛ σ ⎞12 ⎛ σ ⎞ 6 ⎤ V = 4ε ⎢⎜ ⎟ − ⎜ ⎟ ⎥ ⎝r⎠ ⎦ ⎣⎝ r ⎠ 21 GASES REALES N2: desviaciones de la idealidad 22 Factor de compresibilidad (Z) Z(P, T ) ≡ PV RT Gas ideal: P V = RT V= V n Z=1 A una P y T dadas: Z = A un V y T dados: V V id Z= P Pid Para un gas real: PV = Z(P, T )nRT 23 Z ≠ 1 ⇒ desviación de la idealidad Modelo más “sofisticado” para describir el gas real: ecuación de estado del virial PV B(T ) C( T ) D(T ) = 1+ + 2 + 3 + ... RT V V V ¿Por qué el gas real se comporta en forma diferente al gas ideal? • Fuerzas intermoleculares • Volumen finito de las moléculas Pared del recipiente 24 Energía de Interacción Radio de van der Waals Energía de repulsión (VR) Energía de interacción total (V) Energía de atracción (VA) Distancia entre centros de partículas (r) Distancia de mínima energía (r0) Distancia de mayor aproximación (ra) Temperatura de Boyle Es la temperatura a la cual las fuerzas atractivas y repulsivas se balancean exactamente para P→ 0 (más correctamente, temperatura para la que el 2do coeficiente del virial (B) se hace cero) 25 Z > 1: predominan las repulsiones Z < 1: predominan las atracciones H2: hay desviaciones para altas presiones (interacc. repulsivas) En otros casos (p. ej. para el NH3) hay desviaciones a presiones más bajas (interacc. atractivas) Ecuación de estado más sencilla para el gas real Ecuación de van der Waals van der Waals (P + an2 )(V − nb ) = nRT ; V2 Pid (P + a )(V − b ) = RT 2 V Vid (vol disponible a las moléc.) Tiene 2 constantes: a: relacionada con las fuerzas intermoleculares b: relacionada con el tamaño de las moléculas de gas a y b son propias de cada gas 26 (P + a )(V − b ) = RT 2 V Pb a ab PV = 1+ − + RT VRT RTV 2 RT Para bajas presiones: a (P + 2 )V = RT V PV a = 1− RT VRT Para altas presiones: P(V − b ) = RT Pb PV = 1+ RT RT Pb a ab PV = 1+ − + RT VRT RTV 2 RT Para altas temperaturas: PV = RT PV =1 RT 27 Constantes de van der Waals para varios gases Compuesto a (L2- 2 atm/mol ) b (L/mol) He 0.03412 0.02370 Ne 0.2107 0.01709 H2 0.2444 0.02661 Ar 1.345 0.03219 O2 1.360 0.03803 N2 1.390 0.03913 CO 1.485 0.03985 CH4 2.253 0.04278 CO2 3.592 0.04267 NH3 4.170 0.03707 1 mol de CO2 a 273 K a = 3.592(L2-atm/mol2) b = 0.04267 (L/mol) V (L) Gas ideal P(atm) Gas de van der Waals PV ⎛ latm ⎞ ⎟ ⎜ RT ⎝ Kmol ⎠ P(atm) PV ⎛ latm ⎞ ⎟ ⎜ RT ⎝ Kmol ⎠ 22,4 1 1 0,995 0,996 0,2 112 1 52,6 0,470 0,05 448 1 1620 3,618 28 Isotermas de Andrews H2O Punto crítico (variables críticas:Tc, Vc, Pc) X Temperatura crítica (Tc): temperatura máxima a la que se puede licuar un gas A B C D E F 29 (P + a )(V − b ) = RT 2 V 30 Ecuación de van der Waals y estado crítico (P + En el punto crítico: a 2 )(V − b ) = RT V ⎛ ∂P ⎞ ⎜ ⎟ =0 ⎝ ∂V ⎠ T RT 2a ⎛ ∂P ⎞ + ⎜ ⎟ =− ( V − b )2 V 3 ⎝ ∂V ⎠ T − Pc = ⎛ ∂ 2P ⎞ ⎜ 2⎟ =0 ⎝ ∂V ⎠ T 2RT 6a ⎛ ∂ 2P ⎞ − ⎜ 2⎟ =− ( V − b )3 V 4 ⎝ ∂V ⎠ T RT 2a + 3 =0 2 ( Vc − b) Vc Vc = 3b; y a ; 27b 2 − 2RT 6a − 4 =0 3 ( Vb − b) Vc Tc = 8a 27Rb Se pueden hallar experim. los valores de a y b 31