dermatofilosis
Anuncio

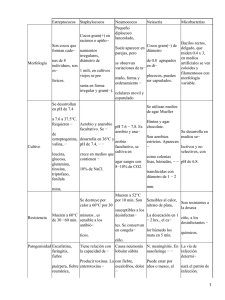
CAPÍTULO 2.3.10. DERMATOFILOSIS RESUMEN La dermatofilosis (también conocida como estreptotricosis) es una dermatitis exudativa y pustular que afecta principalmente al ganado vacuno, ovejas y caballos, pero también a cabras, perros y gatos, muchos mamíferos salvajes, reptiles y, en ocasiones, al hombre. La enfermedad, grave en los rumiantes, se debe a efectos inmunomoduladores inducidos por infestación con la garrapata Amblyomma variegatum. El diagnóstico de laboratorio de la dermatofilosis depende de la demostración de la bacteria Dermatophilus congolensis en material clínico procedente de la piel o de otros órganos. Raramente se ven afectados otros lugares distintos a la piel. En los cocodrilos se puede encontrar Dermatophilus cheloniae. Identificación del agente: Dermatophilus congolensis afecta generalmente a la epidermis produciendo la formación de costras. Puede demostrarse en frotis procedentes de costras emulsionadas o maceradas en agua o en frotis de impresión de la base de las costras adherentes recién extraídas. El microorganismo es Gram positivo, pero su morfología es más fácil de observar en frotis teñidos con Giemsa. En frotis teñidos, el microorganismo se presenta como filamentos ramificados con múltiples cadenas de cocos. Esta apariencia característica posee valor diagnóstico. En costras secas o con infección secundaria, pueden presentarse sólo cocos libres, de modo que se requiere tinción por inmunofluorescencia. Se puede demostrar Dermatophilus congolensis en secciones histopatológicas por tinción con Giemsa o por inmunofluorescencia. En los cocodrilos se puede encontrar Dermatophilus cheloniae. El aislamiento de D. congolensis a partir de costras recién extraídas es directo, pero el microorganismo se enmascara fácilmente por el crecimiento excesivo de otras bacterias. Cuando se cultiva a partir de zonas contaminadas, resultan necesarias técnicas especiales que incluyen filtración, quimiotaxis o medios selectivos. La demostración e identificación de D. congolensis mediante inmunofluorescencia es un método de diagnóstico fiable y muy sensible, pero requiere que los laboratorios dispongan de sus propios antisueros de diagnóstico ya que no están disponibles comercialmente. Aunque se han descrito reacciones antigénicas cruzadas con especies de Nocardia, ésta proporciona solamente una fluorescencia débil. En teoría, se debería utilizar un anticuerpo monoclonal específico para D. congolensis. Pruebas serológicas: Se han utilizado varias pruebas serológicas en estudios de la epidemiología y patogénesis de la dermatofilosis. Los anticuerpos se pueden demostrar en todos los casos excepto en la sangre fetal de rumiantes sanos, pero se pueden utilizar los elevados niveles asociados con la infección clínica para identificar los animales que han sido infectados con la enfermedad. Requisitos para las vacunas y los materiales de diagnóstico: En la actualidad, no hay vacunas disponibles. Manual de la OIE sobre animales terrestres 2004 561 Capítulo 2.3.10. − Dermatofilosis A. INTRODUCCIÓN La dermatofilosis (también conocida como estreptotricosis, o, en el caso de las ovejas, como "enfermedad nodular de la lana") es una dermatitis exudativa y pustular que afecta principalmente al ganado vacuno, ovejas y caballos, pero también a cabras, perros y gatos a muchos mamíferos salvajes, reptiles y, en ocasiones, al hombre. Es la enfermedad cutánea más común de los cocodrilos en Australia y tiene impacto en las granjas de esta especie (2). La dermatofilosis está causada por la bacteria Dermatophilus congolensis, la especie tipo del género Dermatophilus, que es un miembro de los Actinomicetos (Dermatophilus cheloniae se ha aislado de los cocodrilos). Típicamente, la infección origina la formación de costras densas en la piel pero en ciertas áreas, como en el perineo de los rumiantes y en las articulaciones de los caballos, se pueden presentar lesiones húmedas con piel engrosada y plegada. En tales lesiones se encuentran costras relativamente finas. Donde las lesiones se exponen a la humedad prolongada, con infección secundaria o sin ella, se pueden presentar lesiones exudativas. La enfermedad, grave en rumiantes, se debe a los efectos inmunomoduladores inducidos por la infestación con individuos adultos de la garrapata Amblyomma variegatum (1). Debe recordarse que tanto las costras como los cultivos pueden originar infecciones en el hombre. B. TÉCNICAS DE DIAGNÓSTICO 1. Identificación del agente Normalmente el diagnóstico se basa en la demostración del microorganismo causante de las lesiones en las costras o en el exudado que se encuentra debajo de las costras. El microorganismo presenta un aspecto microscópico característico -sus filamentos septados y ramificados se dividen longitudinal y transversalmente formando cadenas de cocos esféricos u ovoides, cada uno de 0,5 µm de diámetro, en varias filas. Esta morfología posee valor diagnóstico, siempre que los cocos se dispongan en filas transversales de cuatro o más, y es fácilmente visible en preparaciones teñidas. Sin embargo, esta disposición peculiar puede alterarse durante la preparación de los frotis para examen si el material se extiende de modo demasiado vigoroso sobre el portaobjeto. Se pueden preparar frotis por impresión en las superficies húmedas y cóncavas de costras recién eliminadas. También se preparan frotis densos a partir de costras emulsionadas en agua destilada estéril. Alternativamente, las costras se pueden remojar durante la noche en agua destilada o en solución salina para humedecerlas y utilizar la superficie inferior para frotis de impresión, presionando firmemente esta superficie sobre un porta para microscopía. Los frotis se secan luego al aire, se fijan con calor o por inmersión en metanol durante 5 minutos, y se tiñen. El microorganismo se tiñe bien con fucsina fenicada diluida o con azul de metileno, pero la mejor diferenciación en frotis densos se logra con la tinción de Gram o, preferiblemente, con una dilución 1/10 de Giemsa durante 30 minutos, mediante las cuales aparece D. congolensis teñido de oscuro y contrastando con el fondo más pálido o rosado de la tinción de contraste tomada por los queratinocitos y los neutrófilos. La tinción de Gram no da tan buenos resultados como la de Giemsa debido a que puede sobrecolorear el fondo y no mostrar claramente la disposición escalonada de las formas cocoides. Con frecuencia las costras húmedas o con infección secundaria contienen muy pocos filamentos intactos, y el microorganismo puede no teñirse como Gram positivo. En tales muestras, los cocos no se pueden distinguir morfológicamente de otros cocos bacterianos, de modo que se necesita tinción por inmunofluorescencia. Sin embargo, los antisueros específicos para inmunofluorescencia no están disponibles comercialmente. Se utilizan frotis finos, fijados por calor. En casos difíciles y cuando se sospecha la infección de órganos distintos de la piel, se aconseja el examen histopatológico deL material de las biopsias o necropsias. Se emplea la tinción de Giemsa o la inmunofluorescencia. En la mayoría de los casos, el aspecto característico de las lesiones y del microorganismo en los frotis de dermatofilosis bovina típica hace innecesario el cultivo. Sin embargo, en los casos raros en los que un frotis teñido con Giemsa no suministre un resultado definitivo, se puede confirmar el diagnóstico aislando la bacteria. Los cultivos se llevan a cabo en agar-sangre y se incuban a 37°C. El crecimiento se acelera en condiciones de microaerofilia; a las 24 horas se observan colonias de color grisáceo amarillento, normalmente hemolíticas, de alrededor de 1 mm de diámetro, formando hoyos en el medio. La incubación aerobia produce a las 24 horas colonias puntiformes similares que crecen hasta 1 mm a las 48 horas. Las colonias de aspecto rugoso se forman por los filamentos ramificados, pero el crecimiento continuo aeróbico estimula la producción de cocos, que por lo general son de color amarillo. Las colonias toman un aspecto liso, frecuentemente amarillento. Normalmente los cocos son muy móviles cuando proceden de cultivos jóvenes. Las colonias deben diferenciarse de las de especies de Nocardia y Streptomyces, ninguna de las cuales produce filamentos que se fragmentan para dar lugar a múltiples cadenas de cocos móviles. 562 Manual de la OIE sobre animales terrestres 2004 Capítulo 2.3.10. − Dermatofilosis Para el aislamiento, el material se puede extender directamente a partir de las superficies internas de las costras no contaminadas y recién extraídas o de emulsiones de costras, pero el crecimiento relativamente lento de D. congolensis resulta fácilmente enmascarado por el excesivo crecimiento de otras bacterias. Por tanto se requieren técnicas especiales para el estudio de muestras contaminadas. En la mayoría de las muestras de emulsiones de material se presentan cocos libres, bien sean móviles o no. Normalmente es suficiente una filtración de la emulsión por un filtro de membrana de 0,45 µm para reducir o eliminar los contaminantes y permitir el aislamiento del filtrado, como se describe arriba. Alternativamente, se puede usar el método de Haalstra (3). Se colocan pequeños trozos de costra en una botella con 1 ml de agua destilada estéril y se mantiene durante 3-4 horas a temperatura ambiente. La botella abierta se coloca luego durante 15 minutos en una jarra de anaerobios. Se extraen muestras de la superficie del líquido con un asa bacteriológica y se cultivan. El método depende de la liberación de la costra de cocos móviles de D. congolensis y su atracción quimiotrópica hacia la atmósfera rica en dióxido de carbono de la jarra de anaerobios. También se puede utilizar un medio selectivo que incluye 1000 unidades/ml de polimixina B en agar-sangre, que resulta efectivo cuando el contaminante es susceptible a este antibiótico. Para la identificación de antígenos de D. congolensis y para el diagnóstico de la dermatofilosis, la tinción de frotis o tejidos por inmunofluorescencia es la técnica inmunológica más fiable y sensible. Se pueden preparar con facilidad, por métodos estándar, anticuerpos policlonales de animales inoculados con D. congolensis, pero existe el riesgo de posible reacción cruzada con especies de Nocardia. Es preferible la utilización de anticuerpos monoclonales contra antígenos específicos de especie (4). Se tiñen frotis finos de emulsiones de costras que se fijan por calor o frotis de impresión. Siempre deben incluirse muestras conocidas como control positivo y control negativo. 2. Pruebas serológicas El diagnóstico clínico se lleva a cabo mejor utilizando los métodos descritos anteriormente que mediante los métodos serológicos. Los anticuerpos se pueden demostrar en todos los casos, excepto en la sangre fetal de rumiantes sanos, pero los niveles aumentan con la infección clínica. El enzimoinmunoensayo (ELISA) constituye un método sensible y cómodo, y la elevación de los títulos por encima de los valores basales puede utilizarse en estudios epidemiológicos para identificar animales que han padecido la enfermedad (5). En la actualidad, el ELISA solo es adecuado como un método de investigación; no se utiliza en el diagnóstico habitual. C. REQUISITOS PARA LAS VACUNAS Y LOS MATERIALES DE DIAGNÓSTICO Las vacunas están en fase de desarrollo, pero aún no están disponibles en el mercado. REFERENCIAS 1. AMBROSE N., LLOYD D.H. & MAILLARD J.C. (1999). Immune responses to Dermatophilus congolensis infections. Parasitol. Today, 15, 295–300. 2. BUENVIAJE G.N., LADDS P.W. & MARTIN Y. (1998). Pathology of skin disease in crocodiles. Aust. Vet. J., 76, 357–363. 3. HAALSTRA R.T. (1965). Isolation of Dermatophilus congolensis from skin lesions in the diagnosis of streptothricosis. Vet. Rec., 77, 824–825. 4. HOW S.J., LLOYD D.H. & LIDA J. (1988). Use of a monoclonal antibody in the diagnosis of infection by Dermatophilus congolensis. Res. Vet. Sci., 45, 416–417. 5. MARTINEZ D., AUMONT G., MOUTOUSSAMY M., GABRIEL D., TATAREAU J.C., BARRE N., VALLEE F. & MARI B. (1993). Epidemiological studies on dermatophilosis in the Caribbean. Rev. Elev. Med. Vet. Pays Trop., 46, 323–327. * * * Manual de la OIE sobre animales terrestres 2004 563