Práctico 6
Anuncio

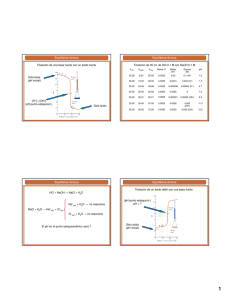
Práctico 6 Parte 2. Equilibrio de solubilidad 6.- ¿Cuál es el pH de una solución saturada de hidróxido de cinc? Para calcular el pH de esta solución, al tratarse de una base, debemos calcular la concentración de OH- en el equilibrio. La reacción de disociación para el hidróxido de cinc es: Zn(OH ) 2 Zn 2 2 (OH ) Como la disolución está saturada (en equilibrio), el producto iónico es igual al KpS Kps [ Zn 2 ] [OH ]2 En el equilibrio, las concentraciones de Zn2+ y de OH- serán iguales a la solubilidad molar multiplicada por el coeficiente estequiométrico. Zn(OH ) 2 Zn 2 2 (OH ) [Zn2+] = S [OH-] = 2 S Kps [ Zn 2 ] [OH ]2 S (2S ) 2 Por tabla sabemos que el Kps para el hidróxido de cinc a 25 ºC es igual a 2 x 10-17 Kps S (2S ) 2 2 x10 17 Kps S 4S 2 4S 3 2 x10 17 Despejamos S: 17 S 3 2 x10 4 1.7 x10 6 M Sabemos que [OH-] = 2 S, entonces: [OH-] = S = 2 x 1.7x10-6 M = 3.4 x 10-6 M Conociendo la concentración de OH- podemos calcular el pOH pOH = - log [OH-] = - log (3.4 x 10-6 M) = 5.47 Finalmente, pH + pOH = 14; entonces: pH = 14 – pOH = 14 – 5.47 = 8.53 7.- El pH de una solución saturada de un hidróxido metálico MOH es 9,68. Calcular la Kps del compuesto. Como se trata de un hidróxido, para calcular la Kps debemos conocer, primero, la concentración de OH- en el equilibrio. pH = 9.68 pOH = 14 – pH = 14 – 9.68 = 4.32 pOH = - log [OH-] = 4.32 [OH-] = 10-4.32 = 4.79 x 10-5 M Como la solución es saturada (en equilibrio), el producto iónico es igual al Kps Kps [ M 1 ] [OH ] En el equilibrio, las concentraciones de M+ y de OH- serán iguales a la solubilidad molar multiplicada por el coeficiente estequiométrico (igual a 1 para ambos) M (OH ) M (OH ) [M+] = S [OH-] = S Kps [ M 1 ] [OH ] S x S = S2 = (4.79 x 10-5 )2 = 2.3 x 10-9