La trombosis constituye la principal causa de morbi
Anuncio

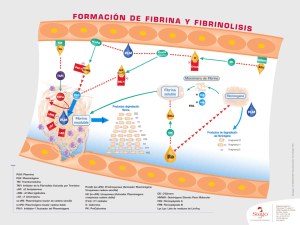
PLAN DE TRABAJO PROPUESTO Materia: Laboratorio de Química Biológica Tema: Acción del dermatán sulfato sobre la formación y lisis de la fibrina. Docente Responsable: Dra. Ana María Lauricella INTRODUCCIÓN La trombosis constituye la principal causa de morbi-mortalidad en el mundo occidental, lo que estimula la búsqueda de una estrategia antitrombótica óptima. Recientemente se ha demostrado que el dermatán sulfato (DS), un glicosaminoglicano que se encuentra en la pared del vaso sanguineo, previene la trombosis venosa sin producir eventos hemorrágicos. Aunque la función más conocida del DS es su acción antitrombótica, algunos investigadores han sugerido que también tendría actividad profibrinolítica. Cuando se produce una injuria en los tejidos, la pérdida de sangre se detiene con la formación de un tapón hemostático. Para formarlo, el Fibrinógeno (la proteína más abundante del sistema) se polimeriza por activación de la cascada de coagulación, formando una matriz denominada fibrina. Las proteínas que constituyen el sistema de coagulación se llaman factores y generalmente se encuentran en circulación en forma de precursores enzimáticos inactivos o zimógenos. Mac Farlane y Davie propusieron un sistema de reacciones secuenciales, donde una enzima activa a un sustrato (por una proteólisis específica), el cual se convierte a su vez en una enzima activa para el próximo sustrato, desencadenando un sistema de activación en cascada. La trombina es la enzima clave del proceso hemostático, cuya principal función es polimerizar al fibrinógeno. Mientras se produce la reconstrucción de la pared vascular afectada, la fibrina se disuelve por acción de la plasmina, principal enzima del sistema fibrinolítico, cuyo precursor inactivo es el plasminógeno. Ambos sistemas, el de coagulación y el fibrinolítico están regulados por inhibidores específicos. El objetivo de este plan es investigar el efecto del DS de alto y bajo peso molecular sobre la red de fibrina, evaluando la cinética de formación, carácterísticas estructurales y lisabilidad. Además se propone estudiar posibles interacciones entre el DS y el plasminógeno. OBJETIVOS ESPECÍFICOS Y METODOLOGÍA A UTILIZAR Impartir a los alumnos conocimientos acerca de la secuencia de reacciones involucradas en la formación de la fibrina y su lisis. Evaluar el efecto del DS de alto y bajo peso molecular sobre: - la cinética de formación de la fibrina por un método espectrofotométrico. - la estructura de redes de fibrina formadas a partir de plasma y de la fracción euglobulínica del plasma (formada principalmente por plasminógeno, fibrinógeno y los activadores del plasminógeno) utilizando microscopía electrónica de barrido. - la compresibilidad o compactación de los coágulos de fibrina plasmática y de la fracción euglobulínica pesando en balanza analítica el líquido exudado como resultado de fuerzas centrífugas controladas. - la lisabilidad por el método de lisis de euglobulinas. - la lisabilidad con uroquinasa (UK) de fibrina plasmática y euglobulínica por seguimiento espectrofotométrico en función del tiempo. - posibles interacciones con el plasminógeno mediante inmunoelectroforesis bidimensional en placas de acetato de celulosa (Titán III). En todos los ensayos se emplean controles realizados con buffer fosfato salino (PBS). Bioseguridad El material biológico a utilizar será sometido previamente a los controles previstos en las Normas de Higiene y Seguridad impartidas por la FCEyN, UBA. Del mismo modo, los procedimientos involucrados en la realización del presente proyecto cumplirán con las normas adecuadas. MATERIALES Y MÉTODOS Obtención de la Fracción euglobulínica La técnica consiste en precipitar en medio ácido la fracción de euglobulinas del plasma (formada principalmente por plasminógeno, fibrinógeno y los activadores del plasminógeno) y luego redisolverla en medio alcalino. Lisis de euglobulinas La fracción euglobulínica se coagula por agregado de cloruro de calcio o trombina. Se cuantifica el tiempo de lisis del coágulo formado desde el agregado de trombina hasta su disolución completa. Reactivos: 1. Citrato de sodio 3,8% p/v 2. Ácido acético 1% 3. Cloruro de calcio 0,025 M 4. Buffer borato: NaCl 0,15 M, borato de sodio 2,6 µM, pH 9. Técnica: 1. En un tubo cónico de vidrio agregar: 9 ml de agua destilada, 0,5 ml de plasma citratado y 0,1 ml de ácido acético 1%. Dejar 30 minutos a 4 °C. 2. Centrifugar a 3000 rpm durante 5 minutos. Descartar el sobrenadante y dejar el tubo invertido sobre papel de filtro durante 2 minutos. 3. Agregar 0,5 ml de buffer borato y disolver el precipitado a 37°C ayudándose con una varilla de vidrio. 4. Agregar 0,5 ml de cloruro de calcio 0,025 M (o 5 Unidades de trombina) y poner en marcha un cronómetro. 5. Investigar la lisis del coágulo formado a intervalos de 10 minutos. En el momento de su lisis completa detener el cronómetro, tomar la lectura correspondiente y asignar como tiempo de lisis de euglobulinas. Formación y lisis de redes de fibrina El fibrinógeno forma redes de fibrina por efecto de la trombina en presencia de calcio. A este sistema de coagulación se le agrega además uroquinasa, con el objeto de generar plasmina en el interior del coágulo y degradar las redes de fibrina formadas. Reactivos 1 Pool de plasma humano normal, citratado, pobre en plaquetas o su fracción euglobulínica. 2 Trombina bovina (International Laboratories, USA) 100 U/ml. 3 Cloruro de Calcio 1M. 4 Uroquinasa: Ukidan (Serono Argentina S.A.) 50.000 U/ml. 5 Buffer Tris - HCl 50 mM, en una solución 15mM de NaCl (pH 8) Técnica 1 En una policubeta de fondo plano se colocan volúmenes de trombina, cloruro de calcio, uroquinasa, DS y buffer en las concentraciones adecuadas para alcanzar las concentraciones finales deseadas en cada ensayo. 2 Los ensayos de fibrinoformación se logran reemplazando la uroquinasa por igual volumen de buffer, de modo de no activar el plasminógeno. 3 Se colocan las policubetas en un lector de ELISA y se agregan con fuerza 100 µl de plasma, de modo de homogeneizar los reactivos colocados en la policubeta. 4 Se registra la densidad óptica a 405 nm a intervalos regulares de tiempo. Estructura de redes de fibrina Se realizarán coágulos plasmáticos y de fracciones euglobulínicas sobre soportes de vidrio. Las muestras serán procesadas y observadas en un microscopio electrónico de barrido (MEB). Reactivos 1 Pool de plasma humano normal, citratado, pobre en plaquetas o su fracción euglobulínica. 2 Trombina bovina (International Laboratories, USA) 35 U/ml. 3 Cloruro de Calcio 1M. 4 Glutaraldehído 30% (p/v). 5 paraformaldehído 2,5% (p/v) 6 tetróxido de osmio 1%. 7 Acetona Técnica 1 Sobre soportes de vidrio de 7mm de lado se forman coágulos a partir de plasma (o su fracción euglobulínica) con trombina (concentración final 0,1U/ml) y cloruro de calcio (concentración final 33 mM). 2 Los coágulos formados se dejan estabilizar en cámara húmeda durante 18 horas a 4°C. Los pasos subsiguientes se realizan a temperatura ambiente. 3 Las muestras se fijan con glutaraldehído-paraformaldehído durante 2 horas. 4 Lavar con buffer cacodilato. Postfijar con tetróxido de osmio. 5 Deshidratar con soluciones de acetona en agua en concentraciones crecientes (50, 70, 85 y 100 %). 6 Las muestras se secan por punto crítico y son metalizadas para ser observadas en un microscopio electrónico de barrido a 5 kV, donde se obtienen las fotografías correspondientes. 7 Se realizan mediciones sobre las fotografías de las observaciones microscópicas con el programa Imaje J. Se evalúan al menos 10 campos de igual área, aleatoriamente seleccionados y se caracteriza cada red midiendo: número de fibras por campo, % de red (relación porcentual entre la superficie ocupadas por las fibras respecto al área total del campo), ancho y largo de las fibras. Compactación de fibrina plasmática. Se prepararon geles de fibrina por triplicado en microtubos plásticos a partir de plasma o su fracción euglobulínica con Trb-Ca2+. Luego de centrifugar los tubos en condiciones controladas se determina el peso de la solución exudada. Reactivos 1 Pool de plasma humano normal, citratado, pobre en plaquetas o su fracción euglobulínica. 2 Trombina bovina (International Laboratories, USA) 35 U/ml. 3 Cloruro de Calcio 1M. Técnica 1 Se prepararon geles de fibrina con 650 µl de cada muestra diluida y 50 µl de Trb-Ca2+ (c.f. Trb = 0,1 U/ml; c.f. Ca = 33 mM). Se deja gelificar a 37 ºC durante 2 hs; luego los tubos se centrifugaron a 2000 rpm durante 2 minutos, y se determina el peso de la solución exudada en balanza analítica. Los resultados se expresan en porcentaje de compactación, calculado como la relación porcentual entre el volumen exudado y el volumen original del gel de fibrina. Interacción entre plasminógeno y DS. Para estudiar posibles interacciones entre el plasminógeno y el DS se utilizará la técnica de inmunoelectroforesis bidimensional en placas de acetato de celulosa deshidratado (Titán III). En un extremo de la placa se siembra plasminógeno purificado y se realiza la electroforesis en una dimensión donde se esparce DS. Luego se esparce sobre el resto de la placa el anticuerpo anti-plasminógeno y se realiza otra electroforesis en la segunda dimensión. El perfil correspondiente al complejo inmune puede poner de manifiesto diferencias debidas a interacciones moleculares. Reactivos 1 Plasminógeno purificado. 2 Placas de acetato de celulosa deshidratado (Titán III). 3 Buffer de desarrollo electroforético: Tris 0,05 M-Glicina 0,1 M, pH 8,3. 4 Colorante: Azul Brillante de Coomassie R-250, 0,5% en solución decolorante (p/v). 5 Solución decolorante: Metanol: Acético: Agua (45:10:45) Técnica 1 2 3 4 5 Se aplica 50 µl de DS en buffer (o buffer sin DS como control) sobre la porción de la placa donde se desarrollará la primer corrida electroforética. Se siembra el plasminógeno en un extremo y se efectúa la electroforesis en la primera dimensión a 350 V, 2,5 mA/placa durante 30 minutos. Se esparcen 60 µl del antisuero diluido sobre el resto de la placa. Se realiza la segunda electroforesis a 300 V, 25 mA/placa durante 2 horas. Se lava la placa para eliminar el anticuerpo remanente. Se colorea la placa y se lava el excedente de colorante, para poner en evidencia el complejo inmune.