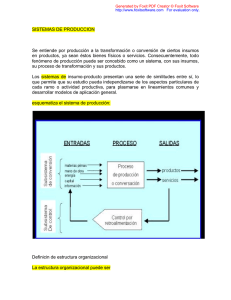
NOMENCLATURA INORGÁNICA
Anuncio

Generated by Foxit PDF Creator © Foxit Software http://www.foxitsoftware.com For evaluation only. CURSO DE QUÍMICA GENERAL AÑO 2011. NOMENCLATURA INORGÁNICA Prof. Leonardo Gaete G. Introducción El amor por la ciencia CIENCIA. Es la observación y ordenamiento de hechos reproducibles para un conocimiento ordenado de ellos Método científico Es el que se basa en la observación Observación de los hechos, deducción, predicción e inducción de nuevos hechos Hipótesis Suposición que sirve de guía en una investigación. Experimentación Creación de hechos que sirven para probar la hipótesis Leyes. Enunciados matemáticos que generalizan, en ciertas condiciones, la conducta de la Naturaleza. Generated by Foxit PDF Creator © Foxit Software http://www.foxitsoftware.com For evaluation only. Teorías. Conjunto de leyes, hipótesis y observaciones que ayudan a explicar un fenómeno La química es una ciencia experimental de la Naturaleza DEFINICIÓN DE LA QUÍMICA. “Ciencia de la Naturaleza que estudia la materia, las diferente formas en que esta se presenta, los cambios que afectan su naturaleza íntima y la energía involucrada en dichos cambios”. MATERIA. “Todo lo que ocupa un lugar en el espacio”. Se mide en gramos, libras, moles y equivalentes gramos. FORMAS EN QUE SE PRESENTA LA MATERIA. COMPOSICIÓN : sustancias puras: elementos, compuestos mezclas: soluciones o mezclas homogéneas mezclas heterogéneas Generated by Foxit PDF Creator © Foxit Software http://www.foxitsoftware.com For evaluation only. “cambio que afectan la naturaleza íntima de la materia” REACCIÓN QUÍMICA. Se expresa como una ecuación matemática regida por la ley de Lavoisier o de conservación de la materia. Tipos de reacciones: ácido base; oxido-reducción, sustitución, desplazamiento, eliminación, etcétera. ENERGÍA. “Todo aquello capaz de transformarse en trabajo”. Se mide en ergios, joules, litro-atmóferas y calorías. La unidad más usada en química es la Kcal. Una calorá es igual a 4,18 joules. Un joule son 107 erg. Ejemplo: el calor de combustión del etanol es de 326 Kcal/mol. ELEMENTOS. “sustancias puras constituidas por un solo componente, o sea, por átomos de una sola clase”. Se clasifican en metálicos, metálicos, ánfidos e inértidos. no Generated by Foxit PDF Creator © Foxit Software http://www.foxitsoftware.com For evaluation only. CLASIFICACIÓN DE LOS ELEMENTOS 1.- metálicos: ns1, ns2, ns2np1. Ejemplos: Li, Na, K, Be, Mg, Ca, Ba, Al. 2 2–5 2.-no metálicos: ns np Ejemplos: Cl, Br, S, O, N, P. 3.- ánfidos: 3.1.- de transición: ns2np6nd1 – 9 (n +1)s1, ns2np6nd1 – 9 2 2 6 1–9 2 2 1-5 1–9 (n +1)s ns np nd , (n +1)s ns np nd Ejemplos: Fe, Cu, Cr, Co, Ni. 3.2.- de transición interna: ns2np6nd10 f1-13. Ejemplos: Th, U, Pu, Ra. 2 6 4.- inértidos ns np . Ejemplos: He, Ne, Ar, Kr, Xe. CLASIFICACIÓN PERIODICA DE LOS ELEMENTOS. LEY PERIODICA. Ley Periódica: “Las propiedades de los elementos varían sistemáticamente con el número atómico” Tabla Periódica: Sistema de clasificación de los elementos basado en la ley periódica. VALENCIA QUÍMICA: “Es el número de átomos de Hidrógeno (o sus equivalentes) con el cual un átomo de un elemento electronegativo se puede combinar, o bien, el número de átomos de Hidrógenos que se pueden desplazar en una reacción química por un elemento electropositivo. En otras palabras es un número que indica la capacidad de combinación de un elemento. Esta capacidad puede ser una o varias. Generated by Foxit PDF Creator © Foxit Software http://www.foxitsoftware.com For evaluation only. CONFIGURACIÓN ELECTRÓNICA. ESTRUCTURAS DE LEWIS. “es la representación de los electrones de un átomo en sus orbitales, indicando capas: 1 o K, 2 o L, 3 o M, 4 o N, 5 u O, 6 o P y 7 o Q, y subcapas: 2 en s, 6 en p, 10 en d, 14 en f”. “Las estructuras Lewis representan la configuración electrónica de la capa de valencia o de esta y la capa inmediatamente inferior en los elementos de transición”. IONES: “especie química con carga eléctrica, puede ser elemental o formada por 2 o más elementos”. Cationes, especies químicas con carga positiva; Aniones, especies químicas con carga negativa. PESO ATÓMICO Peso relativo y promedio de los átomos de un elemento. Es relativo respecto al Carbono, isótopo 12 al cual se le asigno por convención el valor de 12,0000 unidades de masa atómica, y, es promedio de los isótopos existentes en la Naturaleza. Generated by Foxit PDF Creator © Foxit Software http://www.foxitsoftware.com For evaluation only. COMPUESTOS. “Substancia química pura formada por dos o más átomos diferentes”. Iónicos, covalentes. Orgánicos e inorgánicos. CLASIFICACIÓN: Binarios: óxidos, Fe O, Cu2O, Fe2O3, CuO. compuestos hidrogenados, HCl, H2S. sales, Na Cl, K2S, CaCl2. Terciarios: bases o hidróxidos: NaOH, Ba(OH)2. Oxácidos, H2SO4, HClO4, H3PO4 Sales, Fe SO4, CaCO3. NOMENCLATURA: Acido Hídrico Oso Ico sal uro ito ato Valencia muy menor prefijo HIPO; valencia menor terminación OSO; valencia mayor terminación ICO; valencia muy mayor prefijo PER Ejemplo: Acidos: hipocloroso, HClO; cloroso, HClO2; clórico, HClO3 y perclórico, HClO4. OXIDOS óxidos metálicos, Na2O óxidos no metálicos o anhídridos; CO, CO2 , NO. COMPUESTOS HIDROGENADOS. Hidruros, NaH, LiAlH4, CaH2 Hidrácidos, HCl, HF, H2S. PH3, NH3, CH4. Compuestos hidrogenados covalentes: alcanos, alcenos, alcinos; etcétera Generated by Foxit PDF Creator © Foxit Software http://www.foxitsoftware.com For evaluation only. SALES BINARIAS: NaCl HIDRÓXIDOS. NaOH, KOH OXÁCIDOS. H2 SO4 SALES TERCIARIAS Sales terciarias neutras: Fe SO4, CaCO3 Sales terciarias básicas: NaHS, Sales cuaternarias básicas, Na2HPO4, KH2PO4, NaHCO3 MACROMOLECULAS. Proteínas, ácidos nucleicos, polisacaridos, etc.. IONES O RADICALES Aniones: Cl-, PO4-3, HCO3Cationes: Na+, K+, NH4+ IONES COMPLEJOS. Un átomo central y ligandos unidos a orbitales d. Ion Hexacianoferrato II Fe (CN)6-4 HIDRATOS BaCl2 (H2O)2 Cloruro de Bario II dihidratado CrBr3(H2O)6 Bromuro de Cromo III hexahidratado PESO MOLECULAR “masa relativa que representa la sumatoria de los pesos atómicos de los elementos que forman parte de un compuesto, en relación a la referencia que es el isótopo Carbono 12. El Peso molecular más pequeño corresponde al de la molécula de hidrógeno y es igual a 2. La albúmina, proteína de la sangre, tiene un peso molecular de 60.000