Examen Fisica y Quimica
Anuncio

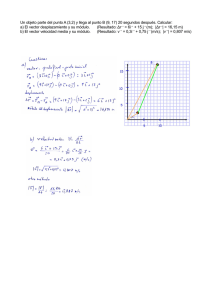
Nombre: Fecha: Física y Química 1ºBachillerato 1ªEvaluación Pregunta 1.– (1 punto) Un cuerpo tiene respecto a un sistema de referencia el siguiente vector posición: ⃗r =5t2 ⃗i −(10t + 2) ⃗j en metros . a) Calcular su velocidad y aceleración a los 2 segundos de iniciar su movimiento. b) Calcula la distancia recorrida por el cuerpo en dicho tiempo. Pregunta 2.- (1 punto) Un paracaidista se deja caer desde un avión que vuela a una altitud de 900 m. Permanece en caída libre durante 10 segundos hasta que despliega su paracaídas, instante a partir del cual desciende con una velocidad constante de 2 m/s. Considerando que no existe rozamiento con el aire, calcula: a) El tiempo que tarda en llegar al suelo desde que se lanza del avión y la velocidad con la que llegará. c) La altura a la que desplegó el paracaídas. Datos: g = 9,8 m/s2 Pregunta 3.– (1 punto) Un electrón que se mueve con una velocidad v = 0,1c (donde c es la velocidad de la luz) entra en una región del espacio donde existe un campo magnético, como consecuencia de la acción de dicho campo el electrón describe una trayectoria circular de radio R=3x10-6 m. Calcular la aceleración experimentada por dicho electrón. Datos: velocidad de la luz en el vacío c = 3x108 m/s Pregunta 4.– (1 punto) Un móvil se encuentra en el instante t = 0 s en la posición de coordenadas (1, 1) y se mueve con una velocidad de 3 m /s en la dirección y sentido del eje X positivo y con una velocidad de 4 m /s en la dirección y sentido del eje Y positivo. Calcula: a) El vector velocidad resultante del móvil y su velocidad a los 2 segundos. b) El vector posición en función del tiempo y su posición después de 2 s. Las coordenadas están expresadas en metros. Pregunta 5.– (1 punto) Un avión que vuela a una velocidad de 720 Km/h y a una altitud de 3500 m deja caer un proyectil con la intención de que impacte en un blanco situado en la cima de una montaña de 1500 m de altitud. Calcular a que distancia del blanco deberá lanzar el proyectil dicho avión. Datos: g = 9,8 m/s2 Pregunta 6.(1 punto )– Calcula cuántos átomos de Hidrógeno hay en un frasco de 250 g de ácido clorhídrico al 90%. Datos: Masas atómicas: H = 1 u Cl = 35,5 u N Avogadro=6,022x1023 Pregunta 7. (1 puntos)– Un hidrocarburo gaseoso contiene 85,63% de carbono y 14,37% de hidrógeno. La densidad de este gas, en condiciones normales, es 1,258 g/l. Hallar la fórmula molecular del compuesto. Datos: Masas atómicas: H = 1 u C = 12 u Constante R = 0,082 atm l / K mol Pregunta 8.– (1 puntos) Disolvemos Bromuro de Potasio en 200 ml de agua a 30 ºC hasta la saturación. Calcula: a) Cantidad de dicha sal que podemos disolver en 1 L de agua, a esa temperatura. b) Si dejamos enfriar el agua hasta los 20 ºC ¿Cuánta sal se cristalizará? Datos: Solubilidad del Bromuro de Potasio en 1 g de agua a 30ºC=0,125 g; a 20ºC= 0,075 g Pesos atómicos Br=80 u; K=39 u Pregunta 9.– (1 puntos) Diluimos 20 mL de ácido sulfúrico del 90 % en masa y densidad 1,18 g/cm3 en un recipiente con 100 ml de agua. Calcular la concentración molar de la nueva disolución. Pesos atómicos S=32 u; O=16 u H=1 u Pregunta 10.– (1 puntos) Un recipiente de 2 dm3 de volumen contiene 6g de Dióxido de azufre gaseoso a 25ºC. ¿Cuál es la presión del recipiente?¿Cuántos moles de dióxido de azufre contiene?. Datos Masa Atómica S=32 u; O=16 u; R = 0,082 atm · L/mol · K.


![• (1JJ [b [M]](http://s2.studylib.es/store/data/001660247_1-1b1ec3f2af6ce5b36615782edea2e40e-300x300.png)





