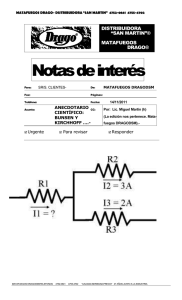
Bunsen y Kirchhoff Los nombres de Robert Wilhem Bunsen (1811
Anuncio

Bunsen y Kirchhoff Los nombres de Robert Wilhem Bunsen (1811-1899) y Gustav Robert Kirchhoff (1824- 1887) solo recuerdan actualmente a mucha gente un mechero (utilizado todavía en los laboratorios de química) y unas reglas referidas a los circuitos eléctricos. Sin embargo, la colaboración de estos dos científicos alemanes en Heidelberg fue fundamental para el desarrollo de la espectroscopia. La espectroscopia se basa en que al calentar ciertas substancias, por ejemplo mediante una llama, emiten luz. Si la luz emitida se hace pasar a través de un prisma, se descompone en un conjunto de radiaciones denominado espectro. Bunsen y Kirchhoff desarrollaron un aparato denominado espectroscopio que permite observar espectros de diversas substancias. En cierta ocasión mientras observaban, desde unos 80 km de distancia, un incendio en el puerto de Hamburgo, se les ocurrió hacer pasar por un prisma la luz que venía del incendio. Vieron una luz amarilla intensa como la que habían observado al quemar sodio. Pronto encontraron la explicación. Lo que estaba ardiendo era un almacén de salazones. Si era posible deducir la presencia de sodio a distancia observando la luz de las llamas, también sería posible deducir la composición del Sol y de las estrellas analizando la luz que recibimos de ellas. Después de varias semanas de intenso trabajo dieron a conocer sus resultados: el Sol está formado por substancias como las que hay en la Tierra. En la figura1 se representan el espectro de la luz solar (I) y el de los elementos potasio (II), sodio (III), cesio (IV) y rubidio (V). Estos dos últimos elementos fueron descubiertos por Bunsen y Kirchhoff mediante el análisis de sus espectros. ¿Es una casualidad que la línea amarilla del espectro del sodio corresponda a una de las líneas negras que se ven en el espectro solar? No, cuando la luz del Sol atraviesa su atmósfera, el sodio presente en ella absorbe precisamente la luz de color amarillo que vemos en su espectro (III). 1 La imagen pertenece al libro Ganot, A. 1870. Tratado de física. (Librería de Rosa y Bouret: Paris) --------------- 0 --------------Cesio (IV) Descubridor: Robert Wilhem Bunsen (18111899) (Alemán) y Gustav Robert Kirchhoff (18241887) (Alemán) en: 1860 Etimología: del latín caesius (azul del cielo) • Poco después de haber inventado el espectroscopio, Bunsen y Kirchhoff lo utilizaron para observar el espectro producido por la lepidolita. La presencia de dos líneas azules no conocidas era la señal de haber descubierto un nuevo elemento. El nombre que le asignaron hace referencia a este hecho. • Arde de forma espontánea en el aire y como otros metales alcalinos reacciona explosivamente con agua produciendo hidrógeno. • Es el más reactivo y blando de los metales. Su punto de fusión de 28,5 ºC hace que sea líquido en una habitación caliente. • Cuando incide sobre él la luz pierde electrones con mucha facilidad. Por esta razón se utiliza en la células fotoeléctricas. • El reloj atómico de cesio se basa en propiedades cuánticas de su núcleo. Dada su precisión se utiliza para establecer el tiempo estándar. --------------- 0 --------------Potasio (II). Descubridor: Humpry Davy (1778-1829) (Inglés) en 1807 Etimología (nombre): del inglés pot ashes (cenizas de vasija) Etimología (símbolo): del alemán kali (álcali) • Durante mucho tiempo al carbonato sódico (Na2CO3) obtenido de cenizas de plantas marinas y al carbonato potásico (K2CO3) obtenido de cenizas de plantas terrestres se les denominaba con la palabra álcali procedente del árabe al-qali (ceniza de plantas barrilleras). Cuando se descubrió la diferencia entre ambos, en inglés se denominó potash (en español potasa) al K2CO3 y natrón al Na2CO3. El símbolo del potasio proviene del nombre alemán de la potasa: kali. • Fue el primer elemento aislado mediante electrolisis. Davy descompuso hidróxido de potasio (KOH) mediante una batería voltaica. • Al igual que el sodio, reacciona violentamente con el agua dando hidrógeno. • Los cationes potasio (K+) junto con los cationes sodio juegan un papel importante en los mecanismos de transporte a través de las membranas celulares así como en la transmisión de impulsos electroquímicos en las fibras nerviosas y musculares. --------------- 0 --------------Sodio (III) Descubridor: Humphrey Davy (Inglés) en 1807 Etimología (nombre): del latín sodanum (sosa) Etimología (símbolo): del latín natrium (nitrato de sodio) • Aunque es un metal con apariencia similar a la plata algunas de sus propiedades son muy distintas de las que normalmente asociamos a los metales. • Es tan blando que se corta fácilmente con una navaja. • Su punto de fusión es de sólo 98 ºC. • Su baja densidad hace que flote en agua aunque no debemos intentar comprobarlo ya que reacciona violentamente con ella. • Es el sexto elemento más abundante en la Tierra. • Su gran reactividad hace que sea necesario almacenarlo en una atmósfera inerte o sumergida en benceno u otro líquido con el que no reaccione. En el aire se oxida rápidamente debido a la presencia de vapor de agua. • Con frecuencia en las iluminaciones públicas se utilizan lámparas de vapor de sodio fácilmente reconocible por su luz de color amarillento. • La sal común o cloruro de sodio (NaCl), en uno de sus compuestos más familiares, se emplea desde la antigüedad como potenciador del sabor de los alimento y en la conservación de los mismos. --------------- 0 --------------- Rubidio (V). Descubridor: Robert Wilhem Bunsen (1811-1899) (Alemán) y Gustav Robert Kirchhoff (1824- 1887) (Alemán) en 1861 Etimología: del latín rubidus (rojo obscuro) • Poco después de haber inventado el espectroscopio, Bunsen y Kirchhoff lo utilizaron para observar el espectro producido por la lepidolita. La presencia de dos líneas rojas no conocidas era la señal de haber descubierto un nuevo elemento. El nombre que le asignaron hace referencia a este hecho. • Arde de forma espontánea en el aire y como otros metales alcalinos reacciona violentamente con agua produciendo hidrógeno. • Por su capacidad de emitir electrones cuando se expone a la luz visible, se utiliza en la fabricación de células fotoeléctricas. • Es líquido a partir de 38,9 ºC. f. Conservación de carnes y pescados en sal: la salazón permitía el comercio entre puntos distantes. Conjunto de carnes o pescados salados: sirvieron entremeses de salazón de pescados variados.