3 1. Interpretación gráfica de la ley de Boyle
Anuncio

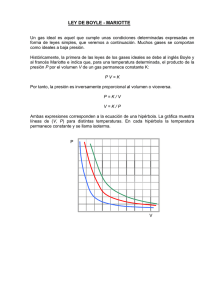
0S3FQCRefuerzo07.03 06/08/07 9:14 Página 10 M AT E R I A Y PA R T Í C U L A S MATERIAL FOTOCOPIABLE / © Oxford University Press España, S. A. 3 1. Interpretación gráfica de la ley de Boyle Hemos visto que R. Boyle basó su investigación sobre la compresibilidad de los gases, es decir, estudió el efecto de la presión sobre los volúmenes de los gases. Llegó a la conclusión de que el volumen de una masa dada de cualquier gas a temperatura constante varía de forma inversamente proporcional a la presión a la que se somete. Vamos a llegar aquí a las mismas conclusiones que extrajo el científico irlandés estudiando diferentes representaciones gráficas. Análisis de resultados En la tabla se recogen los resultados experimentales cuando 4 g de helio se someten a diferentes presiones a la temperatura de 0 °C. Observa cómo varían las magnitudes. Como era de esperar el volumen varía al modificarse la presión. p (atm) V (L) No olvides 1,000 22,4 Para hacer una representación gráfica ten en cuenta que: 쮿 La variable dependiente se suele situar sobre el eje Y. 쮿 La variable independiente se suele situar sobre el eje X. 쮿 Localizamos la pareja de puntos (x, y) y los unimos. 쮿 La línea resultante constituye la gráfica y representa la variación de una magnitud en función de otra. 0,809 27,7 0,685 32,7 0,539 41,6 0,355 63,1 Si se representa gráficamente la relación entre la presión y el volumen de este gas, se obtiene la siguiente gráfica. p ⴢV La gráfica corresponde a una hipérbola y recibe el nombre de isoterma, ya que los datos se han obtenido a temperatura constante. La relación matemática que representa una hipérbola es del tipo: k k y ⫽ ; en nuestro caso: V ⫽ 씮 p ⭈ V ⫽ k x p 1. Vamos a constatar que, con los datos de la tabla se cumple realmente la relación anterior. Física y Química 10 22,4 p (atm) 22,4 1,000 22,4 0,900 22,4 0,800 0,700 Efectuamos todos los productos p ⭈ V. 0,600 Comprobamos, en efecto, que el producto de la presión por el volumen correspondiente es constante. 0,500 2. Consideramos al helio en dos condiciones diferentes de presión. Utiliza la gráfica para obtener, los valores de volumen que corresponden a dos condiciones distintas de presión, por ejemplo 0,2 atm y 0,5 atm. 0,300 Comprueba que se verifica esta relación: p1 ⭈ V1 ⫽ p2 ⭈ V2 22,4 0,400 0,200 0,100 0 0 20 40 Interpolar Para intrapolar, sitúa los valores de presión en el eje Y y llévalos hasta la gráfica. De aquí, llévalos hasta el eje X; así obtienes los valores de los volúmenes que corresponden a los valores determinados de la presión. 60 V (L) 06/08/07 9:14 Página 11 M AT E R I A Y PA R T Í C U L A S 3 1. Interpretación gráfica de la ley de Boyle Conclusiones 쮿 La representación de una hipérbola muestra que la variable dependiente se modifica de forma inversa a la variable independiente; es decir, cuando una aumenta, la otra disminuye, y viceversa. 쮿 A temperatura constante, el volumen de una masa fija de un gas varía de manera inversamente proporcional a la presión; es decir, cuando aumenta el volumen, disminuye la presión, y viceversa. 쮿 A cada valor de una magnitud (presión) le corresponde un único valor de la otra magnitud (volumen). Se cumple la relación: p1 ⭈ V1 ⫽ p2 ⭈ V2 1 ¿Qué ocurre si representamos p frente a V? 1/p (atmⴚ1) V (L) 1,000 22,4 1,236 27,7 1,460 32,7 2,800 1,855 41,6 2,600 2,817 63,1 Análisis de resultados En este caso, cada isoterma es una línea recta, cuya relación matemática es y ⫽ ax ⫹ b. En el 1 ejemplo que nos ocupa, V ⫽ k ⭈ , donde k es p la pendiente de la recta y debe ser una constante. Conclusiones 쮿 La representación de una línea recta indica una relación proporcional y directa entre las variables; es decir, cuando una aumenta, la otra también lo hace. 쮿 A temperatura constante, el volumen de una masa fija de un gas es directamente proporcional al inverso de la presión; es decir, cuando se incrementa el volumen, aumenta el inverso de la presión, o lo que es lo mismo disminuye la presión. 1/p (atmⴚ1) 3,000 MATERIAL FOTOCOPIABLE / © Oxford University Press España, S. A. 0S3FQCRefuerzo07.03 2,400 2,200 2,000 1,800 1,600 1,400 1,200 1,000 0 0 20 40 60 V (L) 1 Respecto a los datos de la tabla p-V. ¿Qué gráficas obtendríamos si representásemos p ⭈ V frente a V o p ⭈ V frente a p? Saca las conclusiones oportunas. 2 En la tabla se detallan los valores de volumen obtenidos al someter 4 g de helio a distintas presiones y a 25 °C: a) Comprueba que se cumple la ley de Boyle. b) Representa gráficamente p frente a V. ¿Cómo es la isoterma a 25 °C? c) Representa gráficamente 1/p frente a V. Compara esta isoterma con la isoterma a 0 °C. d) Representa gráficamente p ⭈ V frente a p. ¿Qué se puede deducir de esta gráfica? p (atm) V (L) 1,000 24,4 0,809 30,2 0,685 35,7 0,539 45,3 0,355 68,7 Física y Química Actividades 11