PRÁCTICA 2. CONSTRUCCIÓN DE ESCALAS DE POTENCIAL Y
Anuncio

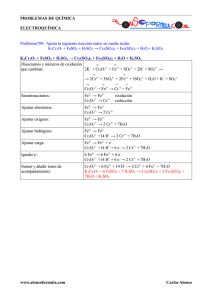
PRÁCTICA 2. CONSTRUCCIÓN DE ESCALAS DE POTENCIAL Y SU UTILIZACIÓN PARA LA PREDICCIÓN DE REACCIONES. PROBLEMAS. Entrega 25 Febrero 2015 I. Problemas de Reacciones Redox 1. Balancea las siguientes reacciones por ión-electrón, indicando cual especie es la oxidante y cual el reductor, así como su ecuación de Nernst. a) Cu° + NO3- Cu2+ + NO2 + H2O b) Fe(CrO2)2 + O2 + KOH Fe2O3 + K2CrO4 + H2O c) SO2 + O2 SO3 II. Celdas Galvánicas 2. Se forma una celda galvánica con un electrodo de zinc metálico sumergido en 100 mL de una disolución de Zn (2+) [0.01 M] y un electrodo de platino sumergido en 100 mL de una disolución de Tl (3+) [0.01 M] y Tl(+) [0.01 M]. Se cierra el circuito tanto eléctrica como iónicamente. a) Dibuja el diagrama de la pila como si fueran dos semiceldas (de manera similar a como se indica en la práctica), indicando cual es el cátodo, cual es el ánodo y el flujo de electrones. b) Escribe también la notación de pila c) Escribe la ecuación de Nernst para cada una de las semireacciones. Da el valor de potencial para cada semicelda d) Indica el valor de FEM para esta pila e) Expresa la constante de equilibrio para esta reacción. f) Indica las concentraciones de las especies al equilibrio. ¿Cuánta energía (en coulomb) será capaz de generar antes de que la celda se agote por completo? (Cte. de Faraday = 96,485,339 900 Coulomb / mol) Zn° (s) → Zn2+ (aq) + 2e− E0 = -0.76 V Tl+ (aq) → Tl3+ (aq) + 2e− E0 = 1.25 V III. Predicción de Reacciones. 3. Identifica los siguientes pares redox en una escala de potencial, indica las especies que están participando en la reacción, y si las siguientes reacciones pueden ocurrir cuantitativamente escribe las reacciones balanceadas (debes buscar los potenciales adecuados): a) A una disolución de Hierro (III) se le agrega otra conteniendo Cr(II) b) Agregando permanganato de potasio en una disolución de yodato de potasio. c) Se agrega permanganato de potasio a una disolución de dicromato de potasio d) Se agrega óxido de plomo a una disolución de sulfato de manganeso e) Se agrega tiosulfato de sodio a una disolución de yodo 4. Se lleva a cabo un experimento en el cual se hacen 2 semiceldas de la siguiente manera: Fe2+ (aq) → Fe3+ (aq) + e− Tl° (s) → Tl+ (aq) + e− E° = 0.77 V E° = -0.34 V a) Calcula el potencial de celda (ecuación de Nernst) para una solución 0.5 M de Fe2+ y 0.1 M de Fe3+ b) Calcula el potencial de celda (ecuación de Nernst) para una solución 0.27 M de Fe2+ y 0.34 M de Fe3+ c) Calcula el potencial de celda (ecuación de Nernst) para una solución 0.15 M de Tl+ en contacto con alambre de Talio d) Indica la FEM de las siguientes celdas: 1. Fe3+ [0.5 M], Fe2+ [0.1 M], Tl+ [0.15 M] 2. Fe3+ [0.1 M], Fe2+ [0.5 M], Tl+ [0.5 M] 3. Fe3+ [0.5 M], Fe2+ [0.5 M], Tl+ [0.5 M] e) ¿Cuál es el potencial de ambas semiceldas cuando la celda está totalmente descargada (E=0)? f) ¿Cuál es la constante de equilibrio para la reacción presentada?