Fuerzas Intermoleculares y Líquidos
Anuncio
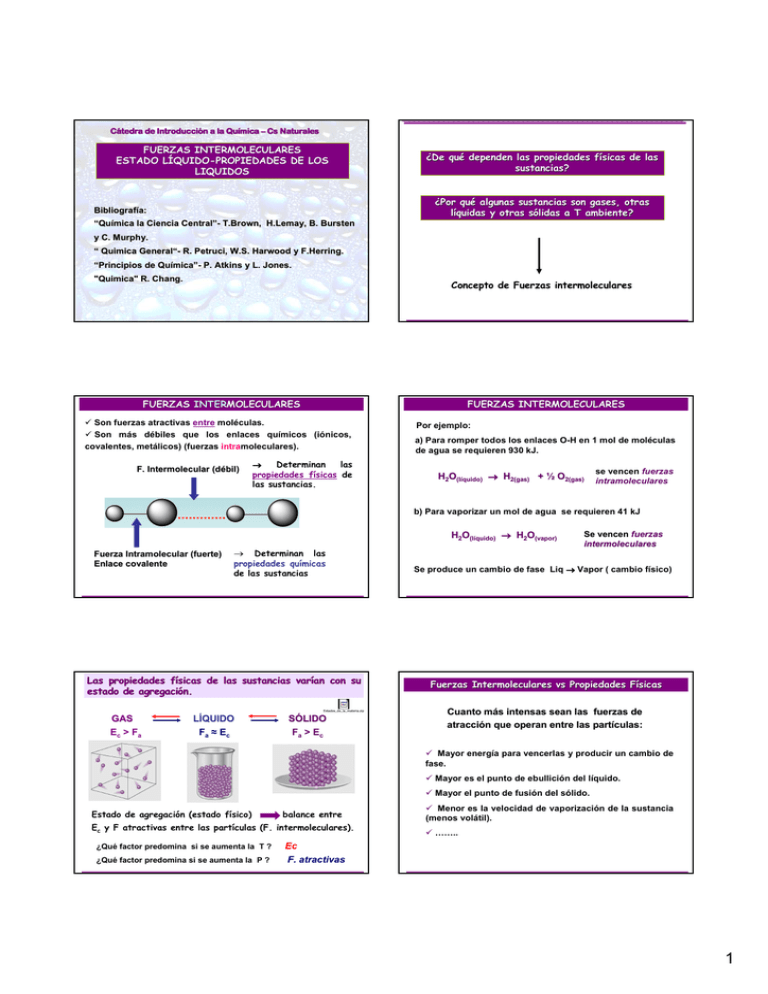
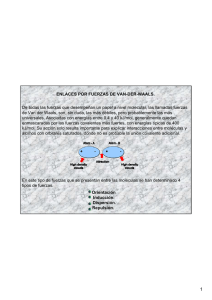
Cátedra de Introducció Introducción a la Quí Química – Cs Naturales FUERZAS INTERMOLECULARES ESTADO LÍ LÍQUIDOQUIDO-PROPIEDADES DE LOS LIQUIDOS ¿De qué qué dependen las propiedades fí físicas de las sustancias? ¿Por qué qué algunas sustancias son gases, otras líquidas y otras só sólidas a T ambiente? Bibliografí Bibliografía: “Quí Química la Ciencia Central” Central”- T.Brown, T.Brown, H.Lemay, H.Lemay, B. Bursten y C. Murphy. Murphy. “ Quimica General“ General“- R. Petruci, Petruci, W.S. W.S. Harwood y F.Herring. F.Herring. “Principios de Quí Química” mica”- P. Atkins y L. Jones. Jones. "Quimica" Quimica" R. Chang. Concepto de Fuerzas intermoleculares FUERZAS INTERMOLECULARES INTERMOLECULARES FUERZAS INTERMOLECULARES Son fuerzas atractivas entre moléculas. Son más débiles que los enlaces químicos (iónicos, covalentes, metálicos) (fuerzas intramoleculares). F. Intermolecular (dé (débil) → Determinan las propiedades físicas de las sustancias. Por ejemplo: a) Para romper todos los enlaces O-H en 1 mol de moléculas de agua se requieren 930 kJ. H2O(lí (líquido) → H2(gas) + ½ O2(gas) se vencen fuerzas intramoleculares b) Para vaporizar un mol de agua se requieren 41 kJ H2O(lí (líquido) → H2O(vapor) Fuerza Intramolecular (fuerte) Enlace covalente → Determinan las propiedades químicas de las sustancias Las propiedades fí físicas de las sustancias varí varían con su estado de agregació agregación. Estados_de_la_materia.zip GAS Ec > Fa LÍQUIDO Fa ≈ Ec SÓLIDO Fa > Ec Se vencen fuerzas intermoleculares Se produce un cambio de fase Liq → Vapor ( cambio físico) Fuerzas Intermoleculares vs Propiedades Fí Físicas Cuanto má más intensas sean las fuerzas de atracció atracción que operan entre las partí partículas: Mayor energía para vencerlas y producir un cambio de fase. Mayor es el punto de ebullición del líquido. Mayor el punto de fusión del sólido. Estado de agregación (estado físico) balance entre Ec y F atractivas entre las partículas (F. intermoleculares). ¿Qué factor predomina si se aumenta la T ? ¿Qué factor predomina si se aumenta la P ? Menor es la velocidad de vaporización de la sustancia (menos volátil). …….. Ec F. atractivas 1 TIPOS DE FUERZAS INTERMOLECULARES Fuerzas ionion-dipolo FUERZAS IÓ IÓN- DIPOLO PERMANENTE ion - dipolo permanente µ≠0 Catión ion - dipolo inducido Fuerzas de Van der Waals: Waals: fuerzas atractivas entre Anión molé moléculas neutras µ≠0 Fuerzas dipolo-dipolo Fuerzas dipolo-dipolo inducido Fuerzas de dispersión de London (F. dipolo La fuerza de atracción es mayor cuando: Menor la distancia entre ambos. Mayor es la carga del ion (Q+ o Q-), Mayor es el µ de la molécula neutra instantáneo- dipolo inducido) Puentes de Hidrógeno FUERZAS IÓ IÓN- DIPOLO INDUCIDO FUERZAS IÓ IÓN- DIPOLO PERMANENTE Un ión puede inducir un dipolo en una molécula no polar Disolución de NaCl en agua Ion Molécula no polar Ion Dipolo inducido + + δ- - - δ+ µ=0 Importantes en disoluciones de sólidos ió iónicos en lí líquidos polares Fuerzas ió ión-dipolo δ- δ+ Más débil que la anterior Dependen de la magnitud del momento dipolar µ. Cuanto mayor es su intensidad mayor energía para vencerlas δ- Extremo positivo de un dipolo es atraído por el extremo negativo del otro. F. ión-dipolo inducido FUERZAS DIPOLODIPOLO-DIPOLO Son fuerzas de atracció atracción entre molé moléculas neutras polares δ+ δ- µ≠0 Distribución simétrica de carga FUERZAS DIPOLODIPOLO-DIPOLO δ+ Ejemplo: Atracción SO2 µ≠0 Repulsión Sustancia PM(uma) µ(D) Peb (K) CH3CH2CH3 44,10 0,1 231 CH3OCH3 46,07 1,3 248 CH3CN 41,05 3,9 355 Atracción neta de dipolos permanentes 2 FUERZAS DIPOLODIPOLO-DIPOLO INDUCIDO Los dipolos pueden inducir dipolos en molec. no polares δ- δ+ FUERZAS DE DISPERSIÓ DISPERSIÓN DE LONDON Fuerzas de atracción entre un dipolo instantáneo y un dipolo inducido. δ- δ+ µ=0 µ≠0 Distribución de carga simétrica en molécula no polar µ=0 Dipolo instantáneo: distribución temporal no uniforme de los eδ- δ+ dipolo permanente δ+ induce un dipolo en una molécula vecina . δSon má más dé débiles que las fuerzas dipolodipolo-dipolo dipolo inducido Dipolo instá instántaneo FUERZAS DE DISPERSIÓ DISPERSIÓN DE LONDON Dipolo inducido Atracción electrostática δ- δ+ FUERZAS DE DISPERSIÓ DISPERSIÓN DE LONDON Dipolo instantá instantáneo δ- Dipolo inducido Operan en todas las moléculas (polares o no polares) δ+ Único tipo de fuerzas que opera en moléculas no polares. At He (2) At He (1) At He (2) At He (1) Dependen de la polarizabilidad de las especies. Interacción entre dos moléculas de CH4 Polarizabilidad de un átomo o molécula: Dipolo inducido Dipolo instantáneo Polarizabilidad y Fuerzas de London ¿ Como influye la forma de las moléculas? Neopentano: Neopentano: A mayor PM > Polarizabilidad > F.London F2 Del Nº de electrones ( PM, tamaño) De la forma de la molécula Depende Polarizabilidad y Fuerzas de London La polarizabilidad aumenta con el Nº de electrones y estos con la masa molar. mide la facilidad con que la densidad electrónica puede distorsionarse por efecto de un campo eléctrico. Peb: 9,5ºC C5H12 F2 PM = 38 uma Menor contacto, menor interacción, F. London más débiles µ = 0; Peb = -189ºC Interacción débil n-pentano: I2 Peb: 36,5ºC I2 PM = 254 uma µ = 0; Peb= 184ºC Interacción fuerte C5H12 Mayor contacto, mayor interacción, F. London más intensas 3 Consideraciones a tener en cuenta, ejemplos: A) Moléculas que difieren bastante en su PM: Consideraciones a tener en cuenta, ejemplos: B) Moléculas con forma y PM semejante→ → F. de London similares -Explique la tendencia en los Peb de: µ1 µ2 H Cl µ3 H Br F. Dipolo -dipolo: HCl > HBr> HI F. London: Pebullición: H I HI > HBr> HCl HI > HBr> HCl µ Especie i) HCl (188K), HBr(206K), HI (237K) µ1 > µ2> µ3 N° e-: HI > HBr> HBr> HCl Tendencia opuesta, entonces ???? PM PE(K) N2 0 28 77 CO ≠0 28 81 PE(K) µ PM CH3OCH3 1,3 46 248 CH3CN 3,9 41 355 Especie PE(CO) > PE(N2) PE(CH3CN) > PE(CH3OCH3) Fuerzas de London decisivas. Fuerzas dipolodipolo-dipolo decisivas. decisivas ii) HCl (188K) y Cl2(239K) PUENTES DE HIDRÓ HIDRÓGENO (enlace de hidró hidrógeno) PUENTES DE HIDRÓ HIDRÓGENO Punto de ebullición (ºC) Interacción atractiva entre un átomo de H que forma un enlace covalente polar con un átomo X muy electronegativo y un par de electrones no compartidos de un átomo Z electronegativo y pequeño. N, O, F δ(-) δ(+) X – H ……:Z- N, O, F Período H2O, HF, NH3 presentan Peb altos. Tendencia contraria a la que se espera por sus PM. Lleva a postular el concepto de enlace o puentes de hidrógeno. FUERZAS POR PUENTES DE HIDRÓ HIDRÓGENO (enlace de H) Ejemplos: Son más fuertes que las fuerzas de dispersión de London y que las fuerzas dipolo-dipolo. Son más débiles que un enlace químico Puentes hidró hidrógeno - Estructura del ADN: la doble hé hélice HF sólido HF en fase gaseosa Los puentes hidró hidrógeno A-T y CC-G entre las bases púricas y pirimí pirimídicas son el eje de la doble hé hélice del modelo de Watson y Crick para el ADN (1953). Adenina (A) Timina (T) Citosina (C) Guanina (G) 4 EL ENLACE DE HIDRÓGENO EN El AGUA Puentes de hidró hidrógenogeno- Replicació Replicación del ADN Replicación del ADN Puente hidró hidrógeno entre 2 molé moléculas de agua H2O 2δ(-) Enlace de H 0,177 nm δ(+) Enlace covalente δ(+) 0,0965 nm Ordenamiento tetraé tetraédrico Puentes de hidró hidrógeno responsables de las propiedades extraordinarias del agua Entorno alrededor de una molécula de agua Explican: Por qué el agua es líquida a T ambiente. Por qué su Peb es 100°C a P= 1 atm. En el sólido En el líquido Punto de ebullición (ºC) Por qué la δH2O(s) < δH2O(l) δH2O(s) < δH2O(l) Período Estructura abierta del agua sólida (hielo). δ Máxima H2O(l) = 4°C δH2O(s) < δH2O(l) Agua Densidad (g/ml) Hielo flota Forma hexagonal característica de los copos de nieve Hielo Consecuencia: Una dada masa de H2O(s) ocupa mayor volumen que la misma masa de H2O(l). Temperatura (°C) Permite la vida acuática en climas fríos. 5 FUERZAS INTERMOLECULARES Y ALGUNAS PROPIEDADES DE LOS LÍ LÍQUIDOS Ejercicios: 1. Identifique el tipo de F. Intermoleculares presentes en las siguientes sustancias: H2S; SF6; NH3; Ar; HF; HCl VISCOSIDAD (η): Resistencia de un líquido a fluir. En igual tiempo Forma de medirla 2. a) Cuál de los siguientes átomos es más polarizable: O, S, Se. b) Ordene en orden creciente de polarizabilidad: SiCl4; CH4, SiH4 3. Explique la diferencia en los Peb de las siguientes sustancias: a) CH3F ( -142°C); CCl 4(-23°C); b) F 2 ( 85K); HCl (188K). 4. a) Cuál de los siguientes moléculas puede formar puentes de hidrógeno con otras moléculas del mismo compuesto: i) CH3OH; ii) PH3, iii) CH3NH2, iv) CH3OCH3, v) H3PO4: Más viscoso Menos viscoso Ejemplo: comparar agua, alcohol etílico, miel y aceites pesados para motores. Tensió Tensión Superficial F. intermoleculares más intensas Cuando T aumenta aumenta la Ec de las partículas Mayor Viscosidad Los líquidos tienden a mantener un área superficial mínima. Tienden a formar gotas. Menor Viscosidad Se resisten a aumentar su superficie Las características estructurales influyen en su valor. En una familia de compuestos aumenta al aumentar el PM Sustancia Las fuerzas de atracción en el interior son diferentes a las de la superficie. Hexano Heptano Octano Nonano Decano La energía que se requiere para aumentar la superficie de un líquido en una unidad de área se denomina tensió tensión superficial. Unidades: J/m2. Tensió Tensión Superficial La superficie del líquido se comporta como una membrana o barrera. Tensió Tensión Superficial Fuerzas de cohesió cohesión Fuerzas de adhesió adhesión Opone una gran resistencia a ser traspasada y origina una “película superficial” que permite: Fuerzas intermoleculares entre moléculas semejantes. (Ej: agua-agua) Fuerzas intermoleculares entre moléculas diferentes. (Ejemplo agua-vidrio) Superficie Limpia El líquido moja la superficie F.adhesión> F.cohesión Superficie encerada El líquido conserva su forma esférica F.cohesión > F.adhesión 6 FUERZAS INTERMOLECULARES F.cohesión > F.adhesión No asciende F.adhesión> F.cohesión El liquido moja el vidrio. Menisco cóncavo El Hg no moja el vidrio Menisco convexo F.cohesión > F.adhesión Capilaridad: fuerzas de adhesión El proceso se detiene cuando la presión que ejerce la columna de agua , se equilibra con la presión capilar. La altura de la columna depende del diámetro del tubo. Fenómeno responsable, en parte, de la ascensión de la savia desde las raíces hasta las hojas, a través de los vasos leñosos. 7