Geometría molecular
Anuncio
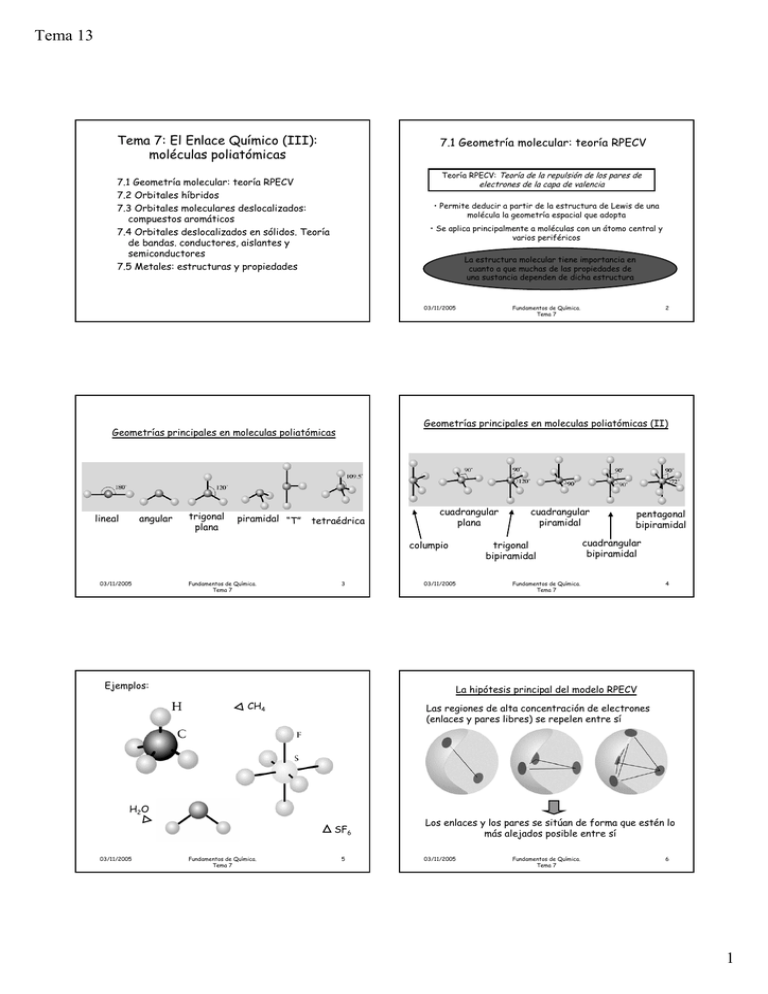
Tema 13 Tema 7: El Enlace Químico (III): moléculas poliatómicas 7.1 Geometría molecular: teoría RPECV Teoría RPECV: Teoría de la repulsión de los pares de electrones de la capa de valencia 7.1 Geometría molecular: teoría RPECV 7.2 Orbitales híbridos 7.3 Orbitales moleculares deslocalizados: compuestos aromáticos 7.4 Orbitales deslocalizados en sólidos. Teoría de bandas. conductores, aislantes y semiconductores 7.5 Metales: estructuras y propiedades • Permite deducir a partir de la estructura de Lewis de una molécula la geometría espacial que adopta • Se aplica principalmente a moléculas con un átomo central y varios periféricos La estructura molecular tiene importancia en cuanto a que muchas de las propiedades de una sustancia dependen de dicha estructura 03/11/2005 angular trigonal plana piramidal “T” tetraédrica cuadrangular plana columpio 03/11/2005 Fundamentos de Química. Tema 7 3 Ejemplos: cuadrangular piramidal trigonal bipiramidal 03/11/2005 pentagonal bipiramidal cuadrangular bipiramidal Fundamentos de Química. Tema 7 4 La hipótesis principal del modelo RPECV CH4 Las regiones de alta concentración de electrones (enlaces y pares libres) se repelen entre sí H2O SF6 03/11/2005 2 Geometrías principales en moleculas poliatómicas (II) Geometrías principales en moleculas poliatómicas lineal Fundamentos de Química. Tema 7 Fundamentos de Química. Tema 7 5 Los enlaces y los pares se sitúan de forma que estén lo más alejados posible entre sí 03/11/2005 Fundamentos de Química. Tema 7 6 1 Tema 13 Prelación de Fuerzas de repulsión: par libre-par libre > par libre-par de enlace > par de enlace-par de enlace Uso de la teoría RPECV ESCRIBIR LA ESTRUCTURA DE LEWIS DE LA MOLÉCULA DETERMINAR CUANTOS PARES DE ELECTRONES ENLAZANTES Y CUANTOS PARES SOLITARIOS EXISTEN ALREDEDOR DEL ÁTOMO CENTRAL Y CUANTOS EN TOTAL ESTABLECER LA GEOMETRÍA BÁSICA DE LOS PARES DE ELECTRONES ALREDEDOR DEL ÁTOMO CENTRAL APLICAR LA PRELACIÓN DE FUERZAS DE REPULSIÓN PARA PROPONER LA ESTRUCTURA FINAL DE LA MOLÉCULA 03/11/2005 Fundamentos de Química. Tema 7 7 03/11/2005 Fundamentos de Química. Tema 7 Moléculas sin pares libres en el átomo central 8 AX3 → plana trigonal AXn AX2 → lineal BF3 BeCl2 03/11/2005 Fundamentos de Química. Tema 7 9 03/11/2005 AX4 → tetraédrica Fundamentos de Química. Tema 7 10 AX5 → bipirámide trigonal PCl5 03/11/2005 Fundamentos de Química. Tema 7 11 03/11/2005 Fundamentos de Química. Tema 7 12 2 Tema 13 AX6 → octaédrica Los enlaces múltiples se tratan como los sencillos en RPECV CO2 03/11/2005 Fundamentos de Química. Tema 7 13 03/11/2005 Fundamentos de Química. Tema 7 14 Geometría de iones poliatómicos H H C C H H Eteno (etileno) Ejercicio 7.1: ¿qué geometría tendría la molécula de acetileno? 03/11/2005 Fundamentos de Química. Tema 7 Ión sulfato SO42- 15 03/11/2005 Fundamentos de Química. Tema 7 16 Moléculas con pares libres en el átomo central AX3E → pirámide trigonal Si una molécula tiene pares libres en el átomo central, éstos modifican la forma de la molécula debido a la repulsión Pares solitarios Par solitario Ión sulfito SO32H2O 03/11/2005 NH3 Fundamentos de Química. Tema 7 17 03/11/2005 Fundamentos de Química. Tema 7 18 3 Tema 13 AX4E2 Moléculas AX4E Menos favorable 03/11/2005 Más favorable Fundamentos de Química. Tema 7 19 03/11/2005 Fundamentos de Química. Tema 7 20 7.2 Orbitales híbridos Otro ejemplos: Orbitales próximos en energía pueden combinarse entre sí para formar enlaces Hibridación Estado fundamental Ejemplo: el átomo de carbono SF4 Ejercicio 7.2: Conforme al modelo RPECV, predecir la geometría del ozono, el dióxido de azufre y el ión nitrito 03/11/2005 Fundamentos de Química. Tema 7 21 03/11/2005 Fundamentos de Química. Tema 7 22 Geometría de la hibridación sp3 Orbital sp3 aún a costa de un incremento de energía se incrementa el número de electrones desapareados (Regla de Hund) HIBRIDACIÓN C: 2sp3 03/11/2005 Tetrahedro Fundamentos de Química. Tema 7 23 03/11/2005 Fundamentos de Química. Tema 7 24 4 Tema 13 La molécula de metano La molécula de etano CH3- CH3 CH4 03/11/2005 Fundamentos de Química. Tema 7 25 Combinación del orbital s y de 1 orbital p CH3= CH3 Geometría lineal Combinación del orbital s y de 26 La molécula de etileno 2 orbitales sp BH3 Fundamentos de Química. Tema 7 Enlaces múltiples carbono-carbono: hibridación sp2 y sp Hibridación sp y sp2 BeH2 03/11/2005 2 orbitales p 3 orbitales sp2 Geometría trigonal plana 03/11/2005 Fundamentos de Química. Tema 7 B 27 03/11/2005 Fundamentos de Química. Tema 7 28 7.3 Orbitales moleculares deslocalizados: compuestos aromáticos La molécula de acetileno La Teoría de Orbitales moleculares permite construir orbitales que no están asociados a un par de átomos en concreto, sino que pertenecen al conjunto de la molécula Un electrón situado en un orbital molecular deslocalizado puede encontrarse con una apreciable probabilidad en la cercanía de cualquiera de los átomos que han intervenido en la formación del orbital deslocalizado 03/11/2005 Fundamentos de Química. Tema 7 29 03/11/2005 Fundamentos de Química. Tema 7 30 5 Tema 13 El ejemplo más típico de orbitales deslocalizados es el que se presenta en el benceno: Friedrich Kekulé propuso en 1865 una estructura cíclica con enlaces dobles y sencillos alternados: C6H6 03/11/2005 Fundamentos de Química. Tema 7 31 03/11/2005 Fundamentos de Química. Tema 7 32 Sin embargo se comprueba que todos los enlaces del benceno son La estructura resonante del benceno se representa de forma más equivalentes. El benceno se comporta como si su estructura fuera adecuada así: consecuencia de la resonancia entre dos estructuras equivalentes El anillo de 6 átomos de carbono del benceno es una estructura muy estable que da a esta sustancia y sus derivados propiedades características. A las sustancias que contienen en su estructura anillos bencénicos se las denomina compuestos aromáticas 03/11/2005 Fundamentos de Química. Tema 7 33 03/11/2005 Fundamentos de Química. Tema 7 34 “densidad” electrónica en un compuesto aromático La molécula de benceno El aminoácido tirosina “visto” por difracción de rayos-X 03/11/2005 Fundamentos de Química. Tema 7 35 03/11/2005 Fundamentos de Química. Tema 7 36 6 Tema 13 7.4 Orbitales deslocalizados en sólidos: Teoría de bandas Formación de una banda O. atómico. O.Molecular. 2 Muchos sólidos (metales, sólidos iónicos y covalentes) pueden considerarse como una gran molécula en la que todos sus átomos se encuentran unidos por fuerzas de enlace químico 3 4 La Teoría de Bandas es la extensión de la teoría de orbitales moleculares al caso de los sólidos 03/11/2005 Fundamentos de Química. Tema 7 .. . ∞ 37 03/11/2005 Formación de una banda (II) + p - + - + - + - + + - + - + - + + + + - + 03/11/2005 + T>0 Nivel de Fermi Niveles ocupados Conductor Aislantes y semiconductores Enlazante Fundamentos de Química. Tema 7 Semiconductor tipo p T=0 Antienlazante Banda s + E Niveles vacíos + Separación entre bandas + - s 38 Conductores, aislantes y semiconductores Banda p Separación entre orbitales atómicos Fundamentos de Química. Tema 7 39 03/11/2005 Semiconductor tipo n Fundamentos de Química. Tema 7 40 7.5 Metales: estructuras y propiedades PROPIEDADES PRINCIPALES La mayoría de los metales son sólidos cristalinos a temperatura ambiente Banda dadora Banda aceptora 03/11/2005 Son dúctiles y maleables aunque resistentes a la rotura Brillantes Conductores del calor y la electricidad Fundamentos de Química. Tema 7 41 03/11/2005 Fundamentos de Química. Tema 7 42 7 Tema 13 Conductividad y estructura electrónica Niveles vacíos Niveles ocupados La conductividad es una consecuencia de la estructura electrónica de los metales Los niveles vacíos corresponden a orbitales próximos en energía y débilmente atraídos por los núcleos. Los electrones de los metales se comportan como electrones libres que pueden responden a un campo eléctrico o un gradiente de temperatura. Ejercicio 7.3: Explica a partir de su estructura electrónica porqué el He sólido no conduce la electricidad y el Li sí. 03/11/2005 Fundamentos de Química. Tema 7 43 8




